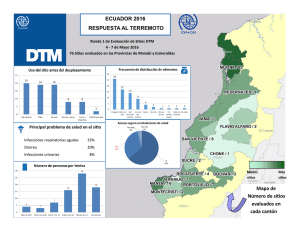
Primer Curso Argentino de Prevención y Control de
Anuncio

Primer Curso Argentino de Prevención y Control de Infecciones Hospitalarias Por Internet AUTORES • Dr. Guillermo R Lossa Médico Especialista Jerarquizado en Infectología Master en Microbiología Clínica y Sanitaria Director del Instituto Nacional de Epidemiología Jefe del Programa de Prevención y Control de Infecciones Hospitalarias • Dra. Diana Gómez Bacterióloga Jefa de la Sección Bacteriología del INE. • Dra. Juana Vairetti Médica Especialista en Neonatología Programa de Prevención y Control de IH del INE • Lic. Norma Peralta Lic. en Enfermería Docente Universitaria Programa de Prevención y Control de IH del INE • Enf. Ilda Telo Enfermera del INE. Programa de Prevención y Control de IH del INE COLABORADORES Mabel Clemente Marcelo Córdoba PRO G RA M A N A C IO N A L D E PREVEN C IO N Y C O N TRO L D E IN FEC C IO N ES H O SPITA LA RIA S I.N .E. [email protected] INSTITUTO NACIONAL DE EPIDEMILOGÍA “Dr. Juan H. Jara” Ministerio de Salud Secretaría de Políticas, Regulación y Relaciones Sanitarias ADMINISTRACION NACIONAL DE LABORATORIOS E INSTITUTOS DE SALUD "Dr. CARLOS G. MALBRAN" Ministerio de Salud Secretaría de Políticas, Regulación y Relaciones Sanitarias Administración Nacional de Laboratorios en Institutos de Salud Instituto Nacional de Epidemiología "Dr. Juan H. Jara" Programa de Prevención y Control de Infecciones Hospitalarias Indice ♦ Factores a considerar en la Epidemiología de las Infecciones Hospitalarias ............................................................................................... - 1. Procedimientos Generales…….. ....................................................... - 2. Procedimientos Clínicos……………………………........................ - 3.Situaciones Especiales ....................................................................... - 4. Conclusiones ………………………………………………………. ♦ Infección según localización ......................................................................... - Infección de la piel y de los tejidos blandos ................................................ Infecciones Estreptocócicas y Estafilocóccicas de la Piel ……….………... Síndrome Estafilocóccico de Piel Escaldada ……………………………… Infecciones de Piel y Tejidos Blandos en Pacientes Diabéticos…………… Infecciones en Quemados………………………………………………… Escaras por Presión (Úlceras por Decúbito)……………………………… Bacteriemia Nosocomial por Infección de la Piel o de los Tejidos Blandos… - Infección del torrente sanguíneo .................................................................. - Infección nosocomial de las vías urinarias ................................................... - Neumonías nosocomiales ............................................................................. - Neumonías Nosocomiales Asociadas a Asistencia Respiratoria Mecánica - Infecciones relacionadas con infusiones y vías intravenosas…………… - Infecciones relacionadas con transfusiones sanguíneas y líquidos - intravenosos .................................................................................................. - Infecciones relacionadas con la preparación del paciente para cirugía …… - Infecciones relacionadas con el quirófano ................................................... - Control de infecciones en obstetricia ........................................................... - Sepsis abdominal .......................................................................................... ♦ Bibliografía ................................................................................................. 3 3 3 5 9 11 11 11 12 12 13 13 14 15 16 19 22 24 25 28 31 33 35 51 2 Ministerio de Salud Secretaría de Políticas, Regulación y Relaciones Sanitarias Administración Nacional de Laboratorios en Institutos de Salud Instituto Nacional de Epidemiología "Dr. Juan H. Jara" Programa de Prevención y Control de Infecciones Hospitalarias Factores de Riesgo en Infecciones Institucionales Los factores de riesgo de infecciones están relacionados con los agentes causales, los reservorios ambientales, los huéspedes portadores y los susceptibles de adquirir dichas infecciones, como fruto de la interrelación constante entre todos ellos en las instituciones asistenciales. Internacionalmente se acepta que las infecciones institucionales más frecuentes son las urinarias, post-quirúrgicas, respiratorias, cutáneas, bacterianas, etc. Por supuesto, éstas varían en frecuencia de acuerdo al tipo de pacientes y las patologías que lo llevan a la internación. Por otra parte, el riesgo de infecciones es diferente para pacientes internados en Unidad de Cuidados Intensivos (UCI) que en Cirugía, Clínica Médica, Ginecología u Obstetricia, así como de acuerdo a su condición individual. A tal efecto debemos considerar factores de riesgo en: 1. PROCEDIMIENTOS GENERALES 1.1. Tendido de cama: Gran número de microorganismos, principalmente flora de piel, se dispersan mientras se tiende la cama, por lo cual esta tarea se debe realizar con una técnica que incluya un mínimo movimiento y una separación de la ropa limpia y la sucia que debe transportarse embolsada y rotulada al lavadero. 1.2. Líquidos corporales derramados: Deben ser limpiados tan rápido como sea posible, con toalla descartable que se coloca en bolsa plástica de residuos. Luego se repasa con desinfectante fenólico o agua lavandina. 1.3. Jeringas, agujas y objetos punzantes varios: Se deben colocar las jeringas y agujas en solución de hipoclorito de sodio. Si son descartables ambas pueden colocarse en un mismo recipiente a prueba de pinchazos. Si no son descartables deben colocarse por separado. También los objetos punzantes que deben tratarse con cuidado para evitar accidentes. 2. PROCEDIMIENTOS CLÍNICOS 2.1. Técnicas Invasivas: Equipos endovenosos: (Ver Figura Nº 1) La inserción se debe hacer con una correcta técnica de asepsia y debe revisarse por lo menos una vez por turno para detectar si hay signos de flebitis, inflamación, infiltración o purulencia. En cualquiera de estos casos se debe retirar de inmediato e insertar un nuevo equipo en otro lugar. 3 Ministerio de Salud Secretaría de Políticas, Regulación y Relaciones Sanitarias Administración Nacional de Laboratorios en Institutos de Salud Instituto Nacional de Epidemiología "Dr. Juan H. Jara" Programa de Prevención y Control de Infecciones Hospitalarias Figura Nº 1 MECANISMOS POTENCIALES DE CONTAMINACIÓN DE SISTEMAS DE INFUSION IV INTRÍNSECOS EXTRÍNSECOS (Presentes antes del uso) (Introducidos con el uso) Grietas (botella de vidrio) Pinchazos (envases de plástico) Líquido de infusión o aditivos Aditivos Cambio de envases Unión del aparato de administración Aire contaminado Sistema de cierre (botella) Inyecciones, lavados, etc. Todos los componentes de los aparatos de administración Mediciones de PVC Antisépticos, pomadas, etc Membrana del filtro Cánula Inserción y manipulación de la cánula Sondas vesicales: Los puntos principales de entrada de bacterias se muestran en la Figura Nº 2. Los catéteres vesicales deben ser colocados con estricto cumplimiento de la técnica aséptica. El sistema de drenaje debe ser cerrado, la unión meato-catéter debe limpiarse con un antiséptico por lo menos una vez al día. La bolsa no debe ser colocada a un nivel superior al de la vejiga ni debe tocar el piso. Se debe usar guantes para el vaciado de la bolsa recolectora así como para la higiene de la unión meato-catéter. Respiradores y nebulizadores: Pueden ser una fuente importante de bacterias, fundamentalmente las que sobreviven bien en medios húmedos como por ej.: pseudomonas, Klebsiella, Serratia, Enterobacter, etc. Por eso el equipo debe ser higienizado y secado luego de cada uso. Los humidificadores de los respiradores y las tubuladuras deben limpiarse cada 24 horas. No debemos olvidar que los nebulizadores están diseñados para proyectar gotas fijas de agua a las vías respiratorias bajas y que si éstas tienen bacterias pueden ser de gran riesgo. Aspiración de secreciones endotraqueales: Esta técnica significa romper el círculo cerrado del respirador. Consiste en una técnica aséptica para la que debe usarse cánula estéril, agua estéril para su enjuagado, guantes y, de ser posible, delantal o camisolín. El equipo de aspiración debe ser desconectado después de su uso. De tener que aspirar secreciones bucales, deben hacerse con otro catéter estéril. 4 Ministerio de Salud Secretaría de Políticas, Regulación y Relaciones Sanitarias Administración Nacional de Laboratorios en Institutos de Salud Instituto Nacional de Epidemiología "Dr. Juan H. Jara" Programa de Prevención y Control de Infecciones Hospitalarias FIGURA N° 2 INSERCIÓN DE UN CATETER URINARIO Puntos de entrada de las bacterias CORRIENTE SANGUÍNEA Meato uretral Conexión Toma de muestra de orina Cierre 2.2 Técnicas no invasivas: Higiene oral: Es un factor importante en la prevención de infecciones de la boca, como por ej.: aftas o muguet en pacientes inconscientes o con tubos endotraqueales. La frecuencia de la misma depende de cada paciente, pudiendo ser necesario realizarlo cada 2 horas en algunos casos. Higiene corporal: En el paciente que no se moviliza es fundamental, lo mismo que la movilización para prevenir escaras. Vendaje y protección de heridas: Debe hacerse con un estricto cumplimiento de la técnica aséptica, desechando el material usado en envase cerrado. 3. SITUACIONES ESPECIALES 3.1. Paciente quirúrgico: Una intervención quirúrgica rompe los mecanismos naturales de defensa y expone los tejidos profundos al riesgo de contaminación con bacterias endógenas y exógenas. La fuente de microorganismos puede ser la piel, el tracto respiratorio o gastrointestinal del paciente, o la piel o tracto respiratorio superior del personal de la sala de operaciones. La infección puede ser diseminada por contacto, por aire o -menos frecuentemente - a través de equipos contaminados. 5 Ministerio de Salud Secretaría de Políticas, Regulación y Relaciones Sanitarias Administración Nacional de Laboratorios en Institutos de Salud Instituto Nacional de Epidemiología "Dr. Juan H. Jara" Programa de Prevención y Control de Infecciones Hospitalarias Entre los factores generales de los pacientes se deben destacar: - Edad: Los niños y los ancianos son más susceptibles a adquirir infecciones. - Sexo: Es menos probable que una mujer desarrolle una infección operatoria que un hombre de la misma edad. - Tipo de herida: Las grandes incisiones y operaciones largas están asociadas a mayor incidencia de sepsis. - Tipo de operación: Las operaciones limpias producen menos lesiones infectadas que los tipos de cirugía limpia contaminada. - Drenajes: Aumentan el riesgo de infección sobre todo los abiertos. - Condiciones pre-existentes: La obesidad, diabetes, mal nutrición y enfermedades respiratorias crónicas aumentan el riesgo de infección. En lo que respecta al acto operatorio se deben considerar los factores relacionados con: - El ambiente: El diseño del área quirúrgica debe permitir: 1) un ingreso restringido a través del área de vestuarios para el personal y de camilla de transferencia para el paciente; 2) una zona de circulación intermedia donde se efectúe la preparación anestésica, la recuperación y el depósito de materiales y equipos de uso. 3) un sector de circulación restringida donde estén los lavabos y los quirófanos. Debe ser adecuadamente climatizada y tener una ventilación apropiada de 1.000 a 1.500 pies cúbicos por minuto (20 cambios por hora), con presión positivas en los quirófanos a fin de remover las bacterias liberadas al aire e impedir la entrada de otros gérmenes. La limpieza del área se debe hacer diariamente con técnica de doble trapo y doble balde. No es necesario usar desinfectantes. Una vez cada tres meses se debe realizar una limpieza profunda de paredes y techos y un reordenamiento del área. Entre paciente y paciente los derrames se deben limpiar con desinfectante (Hipoclorito de Sodio al 1%). La camilla de operaciones se lavará con una solución de detergente. - El personal del área quirúrgica: Debe ser el mínimo indispensable. Debe cambiarse al ingresar colocándose la ropa del área (ambo y suecos). Se ingresa al sector de circulación restringida estricta (quirófano), deberá usar gorro, barbijo, camisolín y botas. Es fundamental que el personal no padezca infecciones en la piel ni en vías respiratorias o gastrointestinales a efectos de evitar contagio a los pacientes. Asimismo, es imprescindible un correcto lavado de manos. - El paciente: Es fundamental que llegue a Cirugía con su superficie corporal limpia por lo que es imprescindible el baño con agua y jabón como mínimo los días previos a la intervención. Existen trabajos que demuestran que el baño con agua y jabón como mínimo los días previos a la intervención. Existen trabajos que demuestran que el baño previo repetido durante varios días con una solución antiséptica, disminuye el riesgo de infección post-operatoria. El rasurado es un tema discutido, existiendo diversos métodos: afeitado con hoja, con máquina eléctrica o con crema depilatoria, corte de pelo al ras con tijera, etc. Por lo general 6 Ministerio de Salud Secretaría de Políticas, Regulación y Relaciones Sanitarias Administración Nacional de Laboratorios en Institutos de Salud Instituto Nacional de Epidemiología "Dr. Juan H. Jara" Programa de Prevención y Control de Infecciones Hospitalarias se considera que sólo debe realizarse si realmente es necesario, abarcando la zona mínima indispensable y lo más próxima posible al acto operatorio. El traslado del paciente al Quirófano debe realizarse con ropa de cama recién cambiada y adecuadamente vestido. - La técnica quirúrgica: Esta depende de la habilidad de los cirujanos y ayudantes, siendo indispensable realizar una buena hemostasia; no dejar espacios muertos ni tejidos necróticos; efectuar suturas lo menos traumáticas posible y en los tiempos operatorios mínimos, ya que en las cirugías prolongadas aumenta el riesgo de infección. - El cuidado post-operatorio: Los riesgos del mismo son los que se mencionan en los Puntos 1 y 2. 3.2. Recién nacidos Los recién nacidos pueden adquirir infecciones antes, durante y después del nacimiento. Los bebés con bajo peso al nacer, aquellos con defectos congénitos y otros que requieren cuidados especiales tienen menos resistencia a las infecciones que los bebés sanos normales. Ellos pueden necesitar apoyo o controles adicionales con una serie de equipos invasores reales como catéteres, tubo nasogástrico, infusiones endovenosas, tubos endotraquiales, etc. que quiebran la barrera natural de defensa. A todo esto se agregan factores ambientales; defectos de construcción en las salas de cuidados especiales para recién nacidos; usos de respiradores y humidificadores; preparación de alimentos especiales; presencia de personal y visitantes con infecciones desconocidas; exceso de trabajo; inadecuados niveles de formación del personal. Teóricamente, cada bebé colocado en una incubadora está aislado, pero las manos del personal y visitantes frecuentemente atraviesan estas barreras, factor que se agrava si consideramos que durante los primeros días de vida el recién nacido comienza a adquirir su flora bacteriana normal y es particularmente vulnerable a las bacterias patógenas por lo que el riesgo de infección es muy alto. Entre los procedimientos generales se debe destacar la importancia de la higiene de la incubadora. Si se usan humidificadores, éstos deben estar limpios y secos hasta el momento de utilizarse en que se coloca agua estéril. La higiene del bebé es un factor importante en la prevención. Se debe hacer una limpieza de boca, dado que las infecciones orales pueden transformarse en sistémicas en los recién nacidos de bajo peso, fundamentalmente en los bebés ventilados o con sondas nasogástricas. Las erupciones en el área del pañal son frecuentes y generalmente triviales. Sin embargo, deben ser tratadas rápidamente, ya que la erupción puede ser colonizada por patógenos oportunistas; incluyendo Cándida Albicans. 7 Ministerio de Salud Secretaría de Políticas, Regulación y Relaciones Sanitarias Administración Nacional de Laboratorios en Institutos de Salud Instituto Nacional de Epidemiología "Dr. Juan H. Jara" Programa de Prevención y Control de Infecciones Hospitalarias Es fundamental una cuidadosa higiene de manos del personal después de manipular el bebé, pañales o instrumental en contacto con el mismo para prevenir la diseminación de infecciones. La alimentación del recién nacido es otro factor de suma importancia a considerar. Si se le da leche materna, la madre debe cambiarse adecuadamente, lavarse las manos e higienizarse el pezón. Si se le da leche materna en biberón, la madre debe proceder al lavado de manos, higiene del pezón y usar sacaleche y biberón estériles con técnica aséptica, para lo cual hay que capacitarla. Si se le administra leche artificial, ésta debe ser preparada por personal entrenado en la cocina de leche. En cuanto a las técnicas invasivas de riesgo son las mismas explicadas en el punto 2, agravadas por las características de susceptibilidad del recién nacido. Premisa: “Las manos son la fuente de diseminación de infecciones más importante en las salas de cuidados especiales neonatales, por lo que es fundamental su correcto lavado” 3.3. Unidad de quemados: Una quemadura rompe la barrera vital a la infección –la piel- y deja al cuerpo vulnerable a la invasión bacteriana. Si bien la quemadura está inicialmente libre de microorganismos, pronto es colonizada por bacterias endógenas y exógenas. Los microorganismos más frecuentemente encontrados son Pseudomonas y otras bacterias Gram (-) y estafilococcus aureus, raramente estreptococcus piojenes. Los riesgos de la infección pueden ser minimizados por un especial cuidado con técnica aséptica de la herida y una buena higiene general. No obstante, después del shock hipovolémico, la infección es la causa más común de muerte en pacientes extensamente quemados. Los pacientes con quemaduras extensas requieren terapia endovenosa y sonda vesical por lo que se agregan a los riesgos del quemado los propios de estas prácticas. Los pacientes quemados requieren aislamiento protector, con habitación individual, sistema especial de ventilación para evitar la contaminación ambiental y con equipamiento específico para el paciente. Las personas que entren en la misma deben llevar camisolín y lavarse muy bien las manos con solución antiséptica. Se deben tomar muestras para controles microbiológicos frecuentemente a fin de poder tratar de inmediato al paciente. Si se realiza balneoterapia, es muy importante prevenir la contaminación por lo que se debe higienizar y desinfectar la bañera con cada paciente. 8 Ministerio de Salud Secretaría de Políticas, Regulación y Relaciones Sanitarias Administración Nacional de Laboratorios en Institutos de Salud Instituto Nacional de Epidemiología "Dr. Juan H. Jara" Programa de Prevención y Control de Infecciones Hospitalarias Si se practica baño en cama, debe realizarse con técnica aséptica. En especial se debe cuidar la higiene de ojos y de boca. Asimismo debe tenerse especial cuidado en el cambio de la ropa de cama que se realizará según técnica. 3.4. Pacientes inmuno-comprometidos: El problema principal de control de infecciones asociado a los pacientes inmunocomprometidos es la baja resistencia a las infecciones. Por lo tanto es imprescindible recordar en todo momento que cualquier contacto o procedimiento en tales pacientes los expone a un riesgo aumentado de adquirir una infección. El compromiso inmunológico puede variar de leve a severo, por lo que las medidas de control a aplicar depende de cada caso en particular, existiendo pacientes que pueden ser internados con controles generales y otros muy comprometidos que requieren aislamiento estricto. Los patógenos más comunes son en general los que constituyen la flora normal del mismo o de otros individuos, tanto del tracto gastrointestinal como de la piel. Algunas bacterias contaminantes del medio ambiente, como las Pseudomonas aureoginosas, actúan como patógenos oportunistas. Otras infecciones en general leves como por ejemplo, las eruptivas en los niños, así como la ingesta de alimentos contaminados pueden ser muy graves en inmuno-comprometidos. Al respecto debemos recordar que las comidas no son estériles y cuando están crudas pueden tener una amplia variedad de microorganismos contaminantes. Los recuentos de microorganismos contaminantes. Los recuentos de microorganismos en vegetales crudos indican que puede haber más de un millón de ellos por gramo. Por tal motivo, estos pacientes deben ingerir comidas cocinadas y manipuladas con estrictas medidas higiénicas. La habitación del paciente debe permitir controlar los contaminantes ambientales y tener presión positiva de aire a efectos de evitar la entrada de microorganismos por las aberturas. Las personas que entran en la habitación deben vestirse adecuadamente, estar instruidas respecto a los factores de riesgo; y lavarse las manos para evitar ser una fuente de transmisión de infección; los demás controles generales son similares a los expresados en los puntos anteriores. 4. CONCLUSION: Es imprescindible identificar los distintos factores de riesgo en cada área, categorizarlos e implementar las medidas de prevención y control específicas a fin de optimizar el recurso evitando medidas costosas o poco factibles de cumplir. 9 Ministerio de Salud Secretaría de Políticas, Regulación y Relaciones Sanitarias Administración Nacional de Laboratorios en Institutos de Salud Instituto Nacional de Epidemiología "Dr. Juan H. Jara" Programa de Prevención y Control de Infecciones Hospitalarias Es asimismo fundamental recordar que existen una serie de procedimientos generales y clínicos que deben aplicarse rutinariamente con la técnica aséptica que requiere la práctica hospitalaria. Finalmente se deben implementar sistemas de capacitación, supervisión y evaluación a fin de lograr un permanente cumplimiento de las medidas de prevención y control mediante el uso de los conocimientos de la epidemiología como una herramienta indispensable para organizar las actividades del programa de control de las infecciones hospitalarias. 10 Ministerio de Salud Secretaría de Políticas, Regulación y Relaciones Sanitarias Administración Nacional de Laboratorios en Institutos de Salud Instituto Nacional de Epidemiología "Dr. Juan H. Jara" Programa de Prevención y Control de Infecciones Hospitalarias I nfecciones según Localización Infecciones de la Piel y de los Tejidos Blandos Las infecciones de la piel y de los tejidos blandos son comunes en el medio hospitalario. Además de complicaciones localizadas, las infecciones de la piel y de los tejidos blandos pueden producir bacteremias que conducen a sepsis o que ponen en peligro la vida. El agente etiológico más común es el Staphylococcus aureus, seguido del Streptococcus pyogenes y los bacilos Gram negativos anaerobios. En poblaciones especiales (pacientes diabéticos o con quemaduras) también se deben tomar en cuenta los bacilos Gram negativos aerobios, incluyendo a la Psedomonas aeruginosa. El Staphylococcus aureus se encuentra sobre la piel normal, como un organismo transitorio, y a menudo está presente en las fosas nasales anteriores. Las condiciones preexistentes, tales como lesiones de tejidos (heridas quirúrgicas, trauma, escaras por presión) o inflamación de la piel (dermatitis) y otras enfermedades sistémicas (diabetes insulino – dependiente, cáncer, insuficiencia renal crónica con hemodiálisis, abuso de drogas intravenosas e infección por VIH) son factores de riesgo bien conocidos para la colonización de la piel y/o la infección secundaria por Staphylococcus aureus. Infecciones Estreptocócicas y Estafilocóccicas de la Piel El impétigo es la infección cutánea más común. Se trata de una infección superficial primaria de la piel, causada con mayor frecuencia por infección por Streptococcus pyogenes (90%) o Staphylococcus aureus (10%). El impétigo puede aparecer como complicación de otras alteraciones cutáneas, tales como el eczema, la varicela o la escabiosis. El impétigo, visto a menudo en niños, se transmite con facilidad en el hogar y en los hospitales. Cuando se esté considerando el diagnóstico de impétigo, se debe recordar la incidencia cada vez más frecuente de alteraciones de la piel en pacientes infectados por VIH. Se sugiere usar las medidas estándar de higiene y aislamiento de contacto para los pacientes con impétigo. Esta práctica es especialmente importante en las unidades de cuidado intensivo neonatales y pediátricas, así como para pacientes con erupciones o con VIH. Estudios clínicos han demostrado que el uso de diversos antibióticos (mupirocina, ácido fusídico, eritromicina, tetraciclina) para el tratamiento tópico del impétigo tiene aproximadamente 90% de eficacia. El uso de antibióticos locales disminuye la colonización bacteriana y promueve la cicatrización rápida de las heridas. El tratamiento oral con antibióticos (eritromicina, penicilina antiestafilocóccica, amoxicilina + ácido clavulánico) también ha sido similarmente exitoso. No obstante, la aparición de Staphylococcus aureus multiresistente, incluyendo el meticilino – resistente (SAMR) y cepas resistentes a la mupirocina, es motivo de preocupación y debe ser monitorizada cuidadosamente cuando se 11 Ministerio de Salud Secretaría de Políticas, Regulación y Relaciones Sanitarias Administración Nacional de Laboratorios en Institutos de Salud Instituto Nacional de Epidemiología "Dr. Juan H. Jara" Programa de Prevención y Control de Infecciones Hospitalarias administren tratamientos tópicos con agentes especiales como la mupirocina durante períodos prolongados. Síndrome Estafilocóccico de Piel Escaldada Este síndrome representa una infección severa por Staphylococcus aureus, con formación de bullas y exfoliación extensas. Ocurre usualmente en niños y rara vez en adultos, pudiendo observarse en paciente VIH. Se han reportado numerosas epidemias en guarderías y unidades de cuidado intensivo neonatal. El cuadro clínico está relacionado con la producción de un poderosa exotoxina por cepas de Staphylococcus aureus. La mayoría de los casos se presentan con un cuadro de fiebre aguda y erupción cutánea escarlatiniforme, seguido de formación de bullas de gran tamaño y posteriormente exfoliación. Conocido también como necrolisis epidérmica tóxica, este síndrome puede ser causado por otras infecciones o como reacción a un medicamento. La penicilina es el tratamiento antibiótico inicial de preferencia. El tratamiento tópico consiste en la aplicación de compresas frías de solución salina. No se recomienda el uso exclusivo de corticoesteroides para este síndrome. Infecciones de Piel y Tejidos Blandos en Pacientes Diabéticos Los estados hiperglucémicos están asociados con una mayor presencia de cepas de Staphylococcus aureus en la nariz y sobre la piel. También constituye un factor importante la alteración de la inmunidad mediada por células en estos pacientes. Los pacientes diabéticos pueden presentar una variedad de síndromes clínicos debido a infecciones de la piel y de los tejidos blandos. Una condición severa es el síndrome de gangrena dérmica aguda, relacionado con infección de tejidos más profundos y necrosis dérmica y a menudo asociado con un trauma anterior o cirugía. Incluye dos condiciones diferentes: 1. Aponeuritis (fascitis) necrotizante; afecta la fascia y produce necrosis completa del tejido subcutáneo. Este síndrome se asocia frecuentemente con fiebres altas, sepsis, shock séptico y una tasa de mortalidad alta (30%). 2. Gangrena bacteriana progresiva: es una infección de progresión más lenta que afecta el tercio superior de la hipodermis y usualmente está relacionada con heridas quirúrgicas, puntos de ileostomía y puntos de salida de drenajes (intraabdominales o torácicos por empiema). El paciente usualmente está afebril o ligeramente febril y los signos de infección localizada son predominantes. 3. Otros síndromes incluyen la gangrena de Meleney, en la que el cuadro clínico progresa lentamente y sin compromiso de la fascia profunda; gangrena de Fournier, si la zona del periné es afectada; gangrena estreptocóccica, si es causada por Streptococcus pyogenes; o mionecrosis sinergística anaeróbica no clostridial, en la que además hay compromiso 12 Ministerio de Salud Secretaría de Políticas, Regulación y Relaciones Sanitarias Administración Nacional de Laboratorios en Institutos de Salud Instituto Nacional de Epidemiología "Dr. Juan H. Jara" Programa de Prevención y Control de Infecciones Hospitalarias muscular. Estas afecciones de la piel y de los tejidos blandos casi siempre se deben a infecciones polimicrobianas con aislamiento frecuente de Streptococcus pyogenes y de Staphylococcus aureus. Siempre es necesario y debe empezarse lo antes posible el tratamiento antimicrobiano sistémico basado en los patógenos probables (incluyendo penicilina, amoxicilina + ácido clavulánico, cefalosporinas de primera o segunda generación) acompañado por debridamiento quirúrgico extenso y repetido. Infecciones en Quemados Los pacientes con quemaduras y las unidades de quemados son puertas de entradas potenciales para brotes nosocomiales de Staphylococcus aureus meticilino – resistente y de Pseudomonas aeruginosa. El Staphylococcus aureus es responsable de 25% de todas las infecciones en quemaduras, seguido por la Pseudomonas aeruginosa. Los reservorios más probables para estas infecciones son las manos y las fosas nasales de los trabajadores de la salud (Staphylococcus aureus, SAMR), la quemadura en sí y el tracto gastrointestinal de pacientes quemados (Staphylococcus aureus, Pseudomonas aeruginosa) y el medio inanimado de la unidad de quemados, incluyendo las superficies y/o el equipo (Staphylococcus aureus, SAMR, Pseudomonas aeruginosa). Se sugiere las precauciones estándar comunes de aislamiento junto con precauciones de aislamiento de contacto que son importantes para prevenir las infecciones nosocomiales en las unidades de quemados y en los pacientes. Se debe reservar el tratamiento tópico con acetato de sulfadiazina de plata, bacitracina/neomicina/polimixina o mupirocina al 2%, además de antibióticos sistémicos antiestafilocóccicos y anti Pseudomonas para infecciones documentadas o clínicas. Escaras por Presión (Úlceras por Decúbito) Las escaras por presión se producen en 6% de los pacientes admitidos en instituciones de atención de la salud (rango de 3% a 17%) y son la causa principal de infección en las unidades de atención a largo plazo (rehabilitación, asilos). La prevención de estas úlceras incluye el control de factores locales, tales como presión no aliviada, fricción y humedad o factores sistémicos, tales como niveles bajos de albúmina sérica, incontinencia fecal y medidas pobres de higiene. La infección es polimicrobiana e incluye bacilos Gram negativos. Staphylococcus aureus, especie Enterococcus y anaerobios. El número promedio de aislados en estas lesiones es cuatro, incluyendo tres bacterias aeróbicas y una anaeróbica. En algunas ocasiones las escaras por presión están asociadas con complicaciones sistémicas severas, incluyendo bacteriemia, tromboflebitis séptica, celulitis, necrosis del tejido profundo y de la fascia y osteomielitis. El desarrollo de tétanos clínico es poco probable, aunque posible. En la mitad de los pacientes con bacteriemia y úlceras por decúbito se consideró que las escaras fueron la fuente de la bacteriemia. La mortalidad global fue del 55% con aproximadamente 25% de las muertes atribuibles a la infección. Por 13 Ministerio de Salud Secretaría de Políticas, Regulación y Relaciones Sanitarias Administración Nacional de Laboratorios en Institutos de Salud Instituto Nacional de Epidemiología "Dr. Juan H. Jara" Programa de Prevención y Control de Infecciones Hospitalarias lo tanto, se debe considerar que las escaras por presión son fuentes potenciales de bacteriemia nosocomial. Se sugiere el tratamiento antibiótico y el debridamiento quirúrgico de las escaras. Tomando en cuenta los microorganismos más probables, una de las drogas de preferencia es una cefalosporina de segunda generación. La combinación de un antibiótico beta-lactámico con un aminoglucósido, clindamicina y aminoglucósido o cefalosporina y metronidazol constituyen buenas opciones terapéuticas. Bacteriemia Nosocomial por Infección de la Piel o de los Tejidos Blandos La tasa de frecuencia de bacteriemia nosocomial secundaria a infecciones de la piel o de los tejidos blandos es baja. Según informes del NNIS (Vigilancia Nacional de Infecciones Nosocomiales) de EEUU, solo un 5% a un 8% de todos los episodios bacteriémicos fue secundario a infecciones de este tipo. En España, diferentes encuestas seriadas de prevalencia mostraron que la tasa nacional de bacteriemia nosocomial relacionada con infecciones de la piel y de los tejidos blandos era 5.3% a 6.6%. Los pacientes con diabetes mal controlada o con cáncer constituyen grupos de alto riesgo para el desarrollo de esta infección. En una serie numerosa del Instituto Nacional de Cáncer en Estados Unidos, 12% de todos los episodios bacteriémicos en pacientes con cáncer fue secundario a infecciones de piel y de tejidos blandos. Sin embargo, solo 6% de estos casos estuvo asociado con neutropenia severa. En pacientes neutropénicos, siempre se debe considerar la posibilidad de ectima gangrenosa por infección de la piel y de los tejidos blandos por P. aeruginosa. El abuso de drogas intravenosas, incluyendo el uso de heroína, heroína más cocaína o heroína más otras drogas, es un problema mundial. Las infecciones de la piel y de los tejidos blandos son comunes en este grupo como lo demostró un extenso estudio español, en el que un rango de 6% a 8% de todas las infecciones fue de este tipo. El S. aureus es el microorganismo más común (un tercio de los casos). Los abscesos subcutáneos, la celulitis y la linfangitis con mayor frecuencia (60%) en las extremidades superiores son presentaciones clínicas comunes. La bacteriemia es una de las complicaciones más severas y más comunes del abuso de drogas intravenosas con un 40% de los episodios producido por S. aureus. Si se desarrolla bacteriemia en un adicto a drogas intravenosas, es importante considerar la posibilidad de tromboflebitis séptica o de endocarditis y se debe iniciar el tratamiento antibiótico lo más pronto posible. Infecciones del Torrente Sanguíneo La mayoría de las infecciones nosocomiales del torrente sanguíneo están relacionadas con el uso de un dispositivo intravascular. Las tasas de infección del torrente 14 Ministerio de Salud Secretaría de Políticas, Regulación y Relaciones Sanitarias Administración Nacional de Laboratorios en Institutos de Salud Instituto Nacional de Epidemiología "Dr. Juan H. Jara" Programa de Prevención y Control de Infecciones Hospitalarias sanguíneo son sustancialmente mayores en pacientes con dispositivos intravasculares que en aquellos que no los tienen. El cuidado apropiado de los dispositivos intravasculares previene la infección. La mortalidad cruda por infecciones circulatorias nosocomiales es alta (25% a 60%) y la mortalidad atribuible es, en promedio, 25%. En Estados Unidos las infecciones circulatorias nosocomiales causan hasta 3.5 millones de días adicionales de hospitalización por año, siendo responsables de 3.500 millones de dólares en costos relacionados con la estadía adicional. Las infecciones nosocomiales del torrente sanguíneo están divididas en dos categorías: • Infecciones circulatorias primarias. Ocurren en ausencia de un foco reconocible de infección y son producidas por el mismo organismo presente en otra localización anatómica en el momento en que el cultivo resulta positivo. Episodios de infecciones circulatorias nosocomiales secundarios a líneas intravenosas o arteriales son típicamente clasificados como infecciones circulatorias primarias (según definiciones del CDC). • Infecciones circulatorias secundarias. Se desarrollan subsecuentemente a una infección por el mismo organismo documentada en otra localización. Los dispositivos intravasculares son responsables de por lo menos un tercio de todas las infecciones primarias del torrente sanguíneo y de una variedad de complicaciones infecciosas locales o sistémicas. Las especies de microorganismos que causan estas infecciones han cambiado en las últimas dos décadas. La proporción de bacteriemias primarias causadas por estafilococos coagulasa – negativos y enterococos se hizo más de dos veces mayor y la especie Cándida apareció entre los diez primeros patógenos. En tanto que la Escherichia coli y la Klebsiella pneumoniae, junto con el Staphylococcus aureus eran los tres primeros patógenos a mediados de la década de 1970, los dos primeros causaron solamente un 10% de todos los episodios de bacteriemia nosocomial tanto en 1983, como en el período entre 1986 y 1989. Los estafilococos coagulasa – negativos son responsables, en la actualidad, de una cuarta parte de las infecciones del torrente sanguíneo. En el pasado, frecuentemente se consideraba a los estafilococos coagulasa – negativos como contaminantes. Sin embargo, estudios recientes han mostrado que un solo hemocultivo positivo para estafilococos coagulasa – negativos ocasionalmente está asociado con episodios clínicos relevantes de infección circulatoria. Por esta razón, cada episodio de bacteremia por estafilococos coagulasa – negativos requiere consideración cuidadosa. Las siguientes son prácticas sobre cuya eficacia no existen evidencia o consenso suficientes: • Uso de catéteres intravasculares impregnados o recubiertos, o de dispositivos intravasculares sin aguja. • Frecuencia de cambio de tubos intravenosos utilizados para infusiones intermitentes y frecuencia de cambio rutinario de los vendajes que cubren el punto el punto de acceso del catéter. 15 Ministerio de Salud Secretaría de Políticas, Regulación y Relaciones Sanitarias Administración Nacional de Laboratorios en Institutos de Salud Instituto Nacional de Epidemiología "Dr. Juan H. Jara" Programa de Prevención y Control de Infecciones Hospitalarias • Uso rutinario de heparina o cortisona en las soluciones parenterales para reducir el riesgo de flebitis. La prevención de infecciones circulatorias asociadas con dispositivos intravasculares incluye las siguientes prácticas recomendadas: • Educación y entrenamiento de los trabajadores de la salud. • Vigilancia de infecciones circulatorias asociadas con catéteres. • Lavado de manos. • Precauciones de barrera (batas y guantes estériles) durante la inserción del catéter y precauciones máximas de barrera (guantes, batas, mascarillas, y campo quirúrgico de buen tamaño, estériles) en los pacientes neutropénicos y de alto riesgo. • Cuidado del punto de inserción del catéter (antisepsia cutánea, evitar la acumulación de humedad, vendaje estéril). • Remoción del catéter tan pronto como sea indicado clínicamente. • Reemplazo inmediato de tubos utilizados para la administración de sangre, productos sanguíneos o emulsiones lipídicas. • Limpieza con alcohol al 70% antes de la utilización de los puntos destinados para la inyección de medicamentos. • Control de calidad de las mezclas intravenosas. • No uso rutinario de filtros para el control de infecciones. • Personal entrenado y asignado exclusivamente para procedimientos intravenosos. • Uso de la vía subclavia, en vez de la vía yugular, para catéteres venosos centrales. • Evitar el reemplazo no rutinario de catéteres venosos centrales durante un período de tiempo regular. • No usar guía de alambre para cambiar catéteres en caso de infección. • Tunelización subcutánea de catéteres para uso prolongado en pacientes de alto riesgo. El riesgo de infección ha disminuido gracias al uso de barreras estériles máximas (guantes, batas, mascarilla, campo quirúrgico) para la inserción de catéteres, al uso de preparaciones de clorhexidina con alcohol para desinfectar la piel en el punto de inserción y a la tunelización subcutánea de catéteres venosos centrales. El uso de catéteres recubiertos se ha asociado con tasas de infección más bajas y pueden ser recomendado, en un futuro cercano, para ciertos tipos de pacientes. Infecciones Nosocomiales de las Vías Urinarias Las infecciones hospitalarias de las vías urinarias son las infecciones nosocomiales más comunes y son responsables de aproximadamente 40% del total de infecciones hospitalarias. Aproximadamente 80% del total de estas infecciones está asociado con catéteres urinarios; en segundo lugar están otros tipos de instrumentación urogenital. Es posible reducir significativamente su incidencia mediante el cumplimiento de recomendaciones para la prevención de infecciones de las vías urinarias asociadas con el uso de catéteres. El cateterismo urinario constituye una condición propicia para la aparición de la mayoría de las infecciones nosocomiales de las vías urinarias. Se considera que las infecciones urinarias asociadas con catéteres son de carácter benigno y en algunos casos la 16 Ministerio de Salud Secretaría de Políticas, Regulación y Relaciones Sanitarias Administración Nacional de Laboratorios en Institutos de Salud Instituto Nacional de Epidemiología "Dr. Juan H. Jara" Programa de Prevención y Control de Infecciones Hospitalarias infección desaparece al remover el catéter. Sin embargo, estas infecciones pueden conducir a bacteriemia. Se ha calculado que 18% a 25% de las bacteriemias hospitalarias están relacionadas con infecciones nosocomiales de las vías urinarias. Las infecciones urinarias nosocomiales no sólo pueden ocurrir esporádicamente sino también constituir epidemias de pequeñas o grandes proporciones y ocasionadas con mayor frecuencia por patógenos multiresistentes. La piedra angular del control de infecciones es un sistema de drenaje continuamente cerrado. En presencia de un sistema abierto la infección urinaria a menudo ocurre después de 3 o 4 días. Los pacientes también están predispuestos a infecciones cuando no se mantiene correctamente la esterilidad del drenaje cerrado. Con el uso de sistemas cerrados se puede reducir el riesgo de infección introduciendo el catéter adecuadamente y evitando su manipulación innecesaria una vez introducido. Usualmente la infección ocurre cuando los microorganismos se adhieren a las células epiteliales de la uretra y proliferan alrededor del meato uretral con entrada retrógrada a la vejiga. Es importante mantener limpia la zona periuretral para prevenir la colonización y sus consecuencias. Otras medidas preventivas para bloquear la entrada de bacteria al espacio entre la superficie externa del catéter y la uretra han fracasado. No obstante, el mejor para prevenir las infecciones urinarias hospitalarias es evitar, siempre que sea posible, el uso de un catéter interno. Se puede afirmar que: • Las infecciones hospitalarias de las vías urinarias son causadas por una variedad de patógenos de los cuales muchos, como la Escherichia coli, las especies Klebsiella, Proteus y Enterococcus, son parte de la flora intestinal endógena del paciente. • El aislamiento de patógenos como la Serratia marcescens y la Pseudomonas cepacia tiene una importancia epidemiológica especial e indica, en la mayoría de los casos, la existencia de una fuente de infección exógena. • Numerosos estudios han demostrado que un aumento en las tasas de infección está asociado con el uso no justificado de catéteres a largo plazo. Para minimizar el riesgo de infección, el período de cateterismo debe ser tan corto como sea posible médicamente. • Las razones más comunes para la entrada de bacterias a la vejiga durante la cateterización son: 1. Preparación aséptica inadecuada en el momento de inserción del catéter; 2. Desconexión del catéter y del tubo de drenaje; 3. Contaminación durante la irrigación; 4. Colonización de la bolsa de drenaje y flujo retrógrado de orina contaminada hacia la vejiga. Aspectos Controvertidos: En grupos selectos de pacientes el uso de sistemas de drenaje con catéter tipo condón disminuye el riesgo de infección de las vías urinarias; sin embargo, en algunos pacientes, un aumento en el riesgo de infección se ha asociado con el uso de estos sistemas. El uso de un catéter suprapúblico disminuye el riesgo de infecciones de las vías urinarias. La eficacia de esta práctica no ha sido comprobada por estudios clínicos controlados. 17 Ministerio de Salud Secretaría de Políticas, Regulación y Relaciones Sanitarias Administración Nacional de Laboratorios en Institutos de Salud Instituto Nacional de Epidemiología "Dr. Juan H. Jara" Programa de Prevención y Control de Infecciones Hospitalarias No se ha investigado adecuadamente el beneficio potencial del monitoreo bacteriológico de rutina de los pacientes cateterizados para detectar nuevas infecciones de las vías urinarias. El hallazgo de bacteriemia transitoria pueden conducir al uso innecesario de antibióticos. La eficacia de los antibióticos sistémicos profalácticos para prevenir las infecciones de las vías urinarias es transitoria y su uso está asociado con la selección de microorganismos resistentes a los antibióticos. Se sugiere: • • • • • • • Educar al personal sobre las técnicas correctas de inserción y cuidado del catéter. Cateterizar sólo cuando sea necesario. Hacer énfasis en el lavado de las manos. Insertar el catéter bajo condiciones de asepsia y utilizando equipo estéril. Asegurar el catéter adecuadamente. Mantener continuamente cerrado el drenaje estéril. Mantener el flujo de orina sin obstrucciones. Evitar la irrigación a menos que se requiera para prevenir o corregir una obstrucción. Métodos para Evitar el Uso de Catéteres Internos Población Métodos Paciente postoperatorio No sobrehidratar Evitar el uso de drogas anticolinérgicas Mantener un orinal al lado de la cama Permitir suficiente tiempo para orinar en privado Aplicar compresa tibia suprapública Considerar el uso de drogas que estimulen el músculo detrusor y relajen el esfínter Considerar un cateterismo aislado si no hay micción en 4 a 6 horas. Paciente en cuidado intensivo Retirar el catéter interno cuando el paciente se estabilice Practicar cateterismo intermitente según sea necesario Utilizar catéteres tipo condón en hombres Paciente renal oligúrico Evitar la cateterización; considerar practicar un ultrasonido al paciente en su cama Paciente anciano incontinente Estimular la micción Usar toallas perineales absorbentes Usar catéteres tipo condón con prótesis de pene, si es necesario Paciente con vejiga neurogénica Practicar cateterismo intermitentes Practicar esfiterotomía y usar catéter tipo condón, si es necesario epididimitis Utilizar catéteres suprapúblicos para evitar una Cuando el cateterismo es necesario el tiempo de permanencia debe reducirse al mínimo. La manipulación del catéter debe ser hecha únicamente por el personal hospitalario. 18 Ministerio de Salud Secretaría de Políticas, Regulación y Relaciones Sanitarias Administración Nacional de Laboratorios en Institutos de Salud Instituto Nacional de Epidemiología "Dr. Juan H. Jara" Programa de Prevención y Control de Infecciones Hospitalarias (en caso de catéteres permanentes los familiares y el paciente mismo deben ser instruidos en la técnica correcta para la inserción y mantenimiento asépticos del catéter). Medidas adicionales que pueden resultar útiles en la reducción de las infecciones hospitalarias de las vías urinarias incluyen educar periódicamente al personal involucrado en el cuidado del catéter, elegir un catéter con el diámetro más pequeño posible, abstenerse de limpiar diariamente el meato urinario con solución de povidona yodada o con agua y jabón ya que no se ha demostrado que ninguna de las dos prácticas disminuya el número de infecciones urinarias hospitalarias, y no cambiar los catéteres a intervalos fijados arbitrariamente. Pueden ser útil reemplazar un sistema de drenaje cerrado cuya esterilidad haya sido comprometida así como también separar a los pacientes cateterizados infectados de los que no lo están, pero la eficacia de estas medidas no ha sido comprobada mediante estudios controlados. La irrigación continua de la vejiga con una solución antimicrobiana o con una solución de ácido acético al 0.25% no resulta más efectiva que el uso de un sistema de drenaje cerrado y no es recomendable. Es importante enfatizar que el uso profiláctico de antibióticos tarde o temprano conduce a la aparición de cepas resistentes y, por tanto, debe evitarse. Neumonías Nosocomiales La neumonía nosocomial es una de las principales infecciones adquiridas en el hospital tanto en los países en vías de desarrollo como en los industrializados y está asociada con hospitalización prolongada y morbimortalidad sustancial. La obtención de datos precisos sobre la epidemiología de la neumonía nosocomial está limitada por la carencia de una “regla de oro” para su diagnóstico. La intubación y la ventilación mecánica aumentan en gran medida el riesgo de neumonía nosocomial. Es posible prevenir un número considerable de estas infecciones mediante medidas simples de control de infecciones y la desinfección adecuada del equipo de terapia respiratoria para los pacientes que requieren ventilación mecánica. Está demostrado que: Los patógenos causales de la neumonía nosocomial de aparición temprana (la que ocurre durante los primeros 3 días de hospitalización) más comunes son Streptococcus pneumoniae, Haemophilus influenzae y Moraxelia (Branhamella) catarrhalis. La neumonía nosocomial de aparición tardía (la que ocurre después de los primeros 3 días de hospitalización) usualmente es de origen polimicrobiano y es causada principalmente por Stahylococcus aureus y bacilos Gram negativos aerobios como Pseudomonas aeruginosa, Enterobacter cloacae, Klebsiella pneumoniae, Serratia marcescens y Acinetobacter baumannii. La neumonía nosocomial causada por Legionella pneumophila puede ocurrir en hospitales cuyo abastecimiento de agua está contaminado. 19 Ministerio de Salud Secretaría de Políticas, Regulación y Relaciones Sanitarias Administración Nacional de Laboratorios en Institutos de Salud Instituto Nacional de Epidemiología "Dr. Juan H. Jara" Programa de Prevención y Control de Infecciones Hospitalarias El diagnóstico de neumonía nosocomial es difícil y en gran medida se basa en hallazgos clínicos como fiebre, tos y aparición de esputo purulento, en combinación con evidencia radiológica de infiltrado pulmonar nuevo o progresivo y cultivos de esputo, aspirado traqueal, líquido pleural y sangre. Las herramientas diagnósticas avanzadas, incluyendo las técnicas broncoscópicas, como por ejemplo, el cultivo cuantitativo de lavado broncoalveolar y el espécimen protegido de cepillado bronquial, se usan principalmente en estudios de investigación clínica y rara vez están disponibles en la mayoría de los hospitales. La neumonía nosocomial es la primera causa de muerte por infección hospitalaria y se ha asociado con una mortalidad cruda de 30% y con una mortalidad atribuible de 10% (un tercio de la mortalidad total). Los pacientes críticamente enfermos e intubados corren un riesgo especial de adquirir neumonía nosocomial. La colonización cruzada juega un papel muy importante en la diseminación de patógenos nosocomiales. La ruta más común de infección es la aspiración de bacterias de la orofaringe y del tracto gastrointestinal superior al árbol traqueobronquial. La colonización del estómago y del tracto gastrointestinal es mayor en pacientes de edad avanzada, en presencia de aclorhidria, desnutrición y el uso de antiácidos y bloqueadores H2 que elevan el pH gástrico. La colonización traqueal en el paciente ventilado puede resultar de la filtración de bacterias que se encuentran alrededor del balón inflable del tubo endotraqueal. Con el tiempo las bacterias se pueden acumular sobre la superficie del tubo endotraqueal y formar un “biofilm” que las protege de la acción de los agentes antimicrobianos o de las defensas del huésped. Los factores del huésped que predisponen a neumonía nosocomial incluyen edad avanzada, enfermedad subyacente severa aguda o crónica –en particular enfermedad pulmonar crónica o cirugía previa (procedimientos toracoabdominales)inmunosupresión, depresión de la conciencia, obesidad, desnutrición y tabaquismo. Las factores que aumentan el riesgo de neumonía nosocomial, que favorecen la colonización y que son esencialmente prevenibles, incluyen la infección bacteriana cruzada entre personal y pacientes colonizados, la desinfección inadecuada del equipo de terapia respiratoria, las bolsas de resucitación, los espirómetros, los analizadores de oxígeno y los broncoscopios, el uso no restringido de antibióticos que puede resultar en colonización por organismos multiresistentes, los medicamentos que elevan el pH gástrico, el uso de instrumentos invasivos y el uso de sedantes. Una estrategia para prevenir la colonización bacteriana y la infección del tracto respiratorio inferior en pacientes ventilados mecánicamente, es la descontaminación selectiva del tracto digestivo mediante la administración tópica de agentes antibióticos no absorbibles, tales como la polimixina, un aminoglucósido, o una quinolona unida a una agente antimicótico. La mayoría de los ensayos clínicos han demostrado una disminución en las tasas de neumonía nosocomial asociada con ventilación mecánica, pero no han demostrado tener efecto sobre la mortalidad. Aún más, existen inquietudes con respecto al desarrollo de resistencia a los antimicrobianos y a la superinfección por bacterias Gram positivas. 20 Ministerio de Salud Secretaría de Políticas, Regulación y Relaciones Sanitarias Administración Nacional de Laboratorios en Institutos de Salud Instituto Nacional de Epidemiología "Dr. Juan H. Jara" Programa de Prevención y Control de Infecciones Hospitalarias No se ha determinado el valor de la profilaxis antimicrobiana sistémica para la neumonía nosocomial, y la superinfección potencial por organismos resistentes constituye un problema. El uso de una sonda nasogástrica puede aumentar la colonización de la nasofaringe y ocasionar reflujo del contenido gástrico. Se desconoce si el riesgo de neumonía cambia si la alimentación enteral se administra continua o intermitentemente. No se ha determinado el tiempo máximo durante el cual es seguro mantener sin cambiar el circuito de ventilación de un paciente. Se sugiere: El lavado adecuado de las manos entre el contacto con cada paciente y el uso apropiado de guantes para evitar la contaminación cruzada, continúan siendo las medidas de control de infecciones más importantes en los pacientes ventilados mecánicamente. Limpiar a fondo todo el equipo e instrumental que vaya a ser esterilizado o desinfectado. La desinfección o esterilización apropiadas del equipo de terapia respiratoria, incluyendo las bolsas de resucitación, es importante para prevenir la neumonía nosocomial. No utilizar humidificadores ambientales de vapor frío que no hayan sido esterilizados o desinfectados adecuadamente. Utilizar únicamente productos estériles para nebulizaciones y prevenir la contaminación de los nebulizadores para medicamentos y de los humidificadores. Prevenir el flujo retrógrado de condensación proveniente de tubos contaminados hacia el árbol traqueobronquial en pacientes ventilados mecánicamente. No cambiar rutinariamente el circuito de ventilación con una frecuencia mayor de cada 48 horas, Asegurar una técnica de succión adecuada y utilizar soluciones estériles para lavar el catéter de succión traqueal. Evitar la transferencia de cualquier tipo de equipo entre pacientes. Mantener al paciente en posición semi-decúbito, con la cabecera de la cama elevada 30 grados. Limitar la profilaxis para el sangrado por estrés. Durante el período postoperatorio inmediato controlar el dolor que interfiere con la tos y con la respiración profunda mediante el uso de analgesia sistémica. No utilizar rutinariamente agentes antimicrobianos sistémicos para prevenir la neumonía nosocomial. Considerar el aislamiento o agrupación de pacientes con organismos altamente resistentes como el Staphylococcus aureus meticilino-resistentes (SAMR). 21 Ministerio de Salud Secretaría de Políticas, Regulación y Relaciones Sanitarias Administración Nacional de Laboratorios en Institutos de Salud Instituto Nacional de Epidemiología "Dr. Juan H. Jara" Programa de Prevención y Control de Infecciones Hospitalarias Neumonías Nosocomiales Asociadas a Asistencia Respiratoria Mecánica La ventilación mecánica constituye el principal factor de riesgo de neumonía nosocomial en los pacientes críticamente enfermos. La infección nosocomial más común en las unidades de cuidado intensivo es la neumonía asociada con ventilación mecánica; en general es responsable del 30% al 50% de todas las infecciones adquiridas en estas unidades y se ha asociado con tasas de mortalidad cruda y una mortalidad atribuible de aproximadamente 10% en los pacientes críticamente enfermos. En los pacientes que sobreviven, causa mortalidad sustancial, prolonga la estancia en el hospital y, por lo tanto, aumenta considerablemente la utilización de recursos. El diagnóstico de neumonía asociada con ventilación mecánica es uno de los aspectos más controvertidos. La presencia de fiebre, leucocitosis y consolidación pulmonar, signos característicos de neumonía en pacientes por lo demás sanos, pueden ser el resultado de otros mecanismos patogénicos en pacientes intubados, tales como edema pulmonar, contusión, atelectasia, derrames pleurales y síndrome de dificultad respiratoria aguda (SDRA). Las técnicas diagnósticas invasivas para el diagnóstico de neumonía asociada con el uso de respiradores incluyen el lavado broncoalveolar (BAL) protegido, el BAL no broncoscópico (“ciego”) y el cepillado bronquial protegido “ciego”. Debería recomendarse seriamente el uso de cualquiera de estas técnicas para aumentar la precisión del difícil diagnóstico de la neumonía asociada con respiradores. La descontaminación selectiva digestiva (DSD) se ha estudiado durante muchos años y comprende el uso de antibióticos orales, tópicos e intestinales, frecuentemente acompañados de un antibiótico sistémico que se administra durante los primeros días del régimen, y cuyo objetivo es la eliminación de todos los patógenos posibles del tracto gastrointestinal. Es posible que se evite la infección al esterilizar las fuentes bacterianas endógenas. A pesar de los datos obtenidos en varios estudios clínicos, es difícil recomendar con certeza si en las unidades de cuidado intensivo se debe o no usar de rutina la DSD. Sin embargo, puede ser prematuro ignorar los beneficios potenciales de la DSD ya que los resultados de la mayoría de estudios clínicos han sido alentadores respecto de la reducción de las tasas de infección. Otros aspectos no resueltos de la prevención de este tipo de neumonía incluyen el empleo de filtros en el circuito respiratorio para recolectar la condensación: el empleo de filtros bacterianos en el sistema de respiración: la frecuencia con que se deben cambiar los diferentes dispositivos mientras se utilizan en el mismo paciente y el uso de guantes estériles a cambio de los no estériles para succionar secreciones. Varias estrategias preventivas se han implementado y se recomiendan firmemente para todos los hospitales: 22 Ministerio de Salud Secretaría de Políticas, Regulación y Relaciones Sanitarias Administración Nacional de Laboratorios en Institutos de Salud Instituto Nacional de Epidemiología "Dr. Juan H. Jara" Programa de Prevención y Control de Infecciones Hospitalarias Educación y entrenamiento de los trabajadores de la salud. Vigilancia de los pacientes de alto riesgo para determinar las tendencias y los brotes de neumonía asociada con respiradores en las unidades de cuidado intensivo. Aplicación de medidas para interrumpir la transmisión exógena de microorganismos (desinfección y mantenimiento apropiados del equipo, uso de agua estéril para el lavado de equipo reusable, cambio de los circuitos respiratorios con frecuencia no mayor que una vez cada 48 horas, drenaje periódico de la condensación en los tubos de un circuito respiratorio, precauciones de barrera para el manejo de secreciones respiratorias y lavado de manos). Se debe favorecer el uso de técnicas apropiadas para el diagnóstico de esta neumonía con el propósito de reducir el uso excesivo de agentes antimicrobianos, el cual puede incrementar la resistencia a los antibióticos. Probablemente las circunstancias más importantes que conducen al desarrollo de neumonía asociada con ventilación mecánica son la colonización bacteriana de la orofaringe por bacilos aeróbicos Gram negativos y la microaspiración de este contenido orofaríngeo colonizado hasta las vías aéreas inferiores. Se recomiendan diversas estrategias para prevenir la aspiración asociada con alimentación enteral: elevar la cabeza a un ángulo de 30º a 45º, descontinuar la alimentación enteral y retirar la sonda lo antes posible, verificar rutinariamente la posición correcta de la sonda y la motilidad intestinal del paciente e instalar un sistema efectivo de drenaje de las secreciones subglóticas. Para prevenir la colonización gástrica y orofaríngea, diversos estudios prospectivos han demostrado tasas menores de neumonía asociada con ventilación mecánica en pacientes seleccionados al azar para recibir sucralfato para la profilaxis de úlceras por estrés comparadas con las tasas de los pacientes que recibieron antiácidos o antagonistas de receptor H2 de histamina. En resumen podemos decir que las medidas tradicionales para la prevención de la neumonía asociada con ventilación mecánica incluyen la disminución del riesgo de aspiración, la prevención de la contaminación cruzada y de la colonización a través de las manos del personal, la desinfección o esterilización apropiadas del instrumental respiratorio y la educación del personal hospitalario. Las medidas nuevas que se están investigando involucran la reducción de la colonización orofaríngea y gástrica por microorganismos patogénicos. Sin embargo, el beneficio de esta estrategia continúa siendo controvertido y puede facilitar la aparición de microorganismos resistentes. Por contraste, los métodos no farmacológicos diseñados para reducir el reflujo gastroesofágico, la aspiración tranqueal y la inoculación directa de microorganismos al tracto respiratorio inferior, pueden ser aplicados de manera rutinaria a pacientes ventilados mecánicamente y son efectivos en la reducción de la incidencia de neumonía asociada con el uso de respiradores. El drenaje efectivo de las secreciones subglóticas, la elevación de la cabecera de la cama y el manejo cuidadoso de la vía aérea artificial, tal como el monitoreo periódico de la presión del balón intratraqueal, son medidas poco costosas y efectivas para la prevención de la neumonía asociada con ventilación mecánica. 23 Ministerio de Salud Secretaría de Políticas, Regulación y Relaciones Sanitarias Administración Nacional de Laboratorios en Institutos de Salud Instituto Nacional de Epidemiología "Dr. Juan H. Jara" Programa de Prevención y Control de Infecciones Hospitalarias Infecciones relacionadas con Infusiones y Vías Intravenosas El manejo de líneas intravenosas implica grandes riesgos de bacteriemia cuando se realiza sin el cuidado imprescindible. El problema es muy grave y se ha calculado que, si se reconociera su magnitud, ocuparía una de las primeras causas de muerte en países en desarrollo. Muchas bacteriemias pudieran prevenirse con relativa facilidad, con sólo eliminar vicios en el manejo de la terapia parenteral. Se acepta que los catéteres intravasculares contaminados son, por mucho, el origen más frecuente de las bacteriemias hospitalarias. La mayor parte de las bacteriemias hospitalarias se relacionan con la contaminación del catéter o de los líquidos intravenosos. Existen inconvenientes en el manejo de la terapia parenteral, como la mezcla de soluciones en las áreas de hospitalización, lo que las contaminan fácilmente por gérmenes como Klebsiella-Enterobacter. El hecho de que las bacteriemias sean causadas principalmente por estos gérmenes sugiere que la contaminación extrínseca de los líquidos de infusión puede ser una causa común. En muchos hospitales existen los siguientes vicios en el manejo de la terapia parenteral: Los médicos indican mezclas de soluciones parenterales. Las enfermeras mezclan las soluciones en áreas de hospitalización. Se comparten jeringas para aplicar medicamentos en los sistemas endovenosos. En pediatría se utiliza la misma botella para cargar sistemas de diferentes pacientes. Se efectúan múltiples conexiones en “y” en los sistemas, con el uso de agujas. Muchos hospitales no cuentan con la toma rutinaria de hemocultivos y otros estudios de microbiología. Si bien las soluciones parenterales vienen estériles del fabricante, estos vicios las contaminan fácilmente (contaminación extrínseca) por gérmenes de la tribu Klebsiellae (Klebsiella, Enterobacter, Serratia), donde una contaminación de éstos desarrollan como en medio de cultivo. En general se debe tener en cuenta que: Existen pocos datos de las tasas y causas de bacteriemia, pero pudiera suponerse que es un grave problema si los informes de hospitales aislados se aplican a aquellos que no publican sus resultados. El hecho de que las bacteriemias sean causadas principalmente por gérmenes de la tribu Klebsiellae sugiere que la contaminación extrínseca de los líquidos de infusión es un factor importante. Es posible que el problema de la contaminación extrínseca esté difundido en cualquier hospital en donde se manejan las soluciones parenterales con estándares deficientes de enfermería. La deficiente cloración del agua corriente en los hospitales pudiera ser un factor de riesgo para la contaminación extrínseca, pues se ha establecido una asociación con bacteriemias en servicios pediátricos, al parecer por contaminación de las manos del personal y de la piel de los pacientes, esto se agrava por la colonización de los grifos. 24 Ministerio de Salud Secretaría de Políticas, Regulación y Relaciones Sanitarias Administración Nacional de Laboratorios en Institutos de Salud Instituto Nacional de Epidemiología "Dr. Juan H. Jara" Programa de Prevención y Control de Infecciones Hospitalarias La infusión intravenosa de un pequeño número de bacterias pudiera conducir a reacciones o síntomas leves que pasarían inadvertidos. Sin embargo, dada la entrada directa al torrente sanguíneo, la infusión masiva de bacilos Gram negativos pudiera ser una equivalente de bacteriemia primaria, al menos para los pacientes pediátricos, pues se han informado tendencias semejantes entre las bacteriemias pediátricas y la tasa de contaminación de infusiones. Se sugiere: La toma de hemocultivos para los pacientes con sospecha de bacteriemia. Si en las estadísticas del hospital predominan dos gérmenes de la tribu Klebsiellae, deberá solicitarse, además del hemocultivo, el cultivo de la solución parenteral en uso, aspirando con jeringa del sistema de infusión. Debe hacerse una campaña de educación continua para el manejo de las soluciones parenterales y reducir así la mortalidad asociada con la hospitalización. Deberá preferirse siempre el uso de soluciones premezcladas por el fabricante. En todos los hospitales deberán existir normas escritas para la prevención de bacteriemias. Los programas de educación de médicos y enfermeras deben hacer énfasis en el riesgo de las soluciones parenterales y, sobre todo, en el enorme riesgo microbiológico de indicar mezclas de soluciones en las áreas de hospitalización. Los programas de control de infecciones deberán incluir en sus rutinas la vigilancia el estado de conservación de los depósitos de agua, el nivel de cloración del agua corriente del hospital, y el control de contaminación de los grifos. INFECCIONES RELACIONADAS CON TRANSFUSIONES SANGUINEAS Y LIQUIDOS INTRAVENOSOS Las transfusiones de sangre y la restitución de líquidos intravenosos, cuando están indicados pueden ser procedimientos que salvan la vida. Las transfusiones de sangre pueden ser muy seguras gracias al advenimiento de la tecnología moderna de los bancos de sangre y a la introducción de pruebas para detectar enfermedades infecciosas. Un agente infeccioso adquirido por transfusión muy común es el virus de la hepatitis C (VHC). El riesgo de VCH postransfusión ha disminuido a menos del 1% con el uso de inmunoensayos enzimáticos de segunda y tercera generación para VHC. Por contraste, el riesgo del virus de inmunodeficiencia humana tipo I (VIH-I) puede ser tan bajo como 1 en 450.000 a 600.000 unidades en países como Estados Unidos. En los países en desarrollo las transfusiones de sangre continúan siendo una fuente significativa de transmisión de VIH-I. Según una encuesta de la Organización Mundial de la Salud, en 1992 menos de la mitad (46%) de los países menos desarrollados practicaban estudios para VIH-I a todas las donaciones de sangre. 25 Ministerio de Salud Secretaría de Políticas, Regulación y Relaciones Sanitarias Administración Nacional de Laboratorios en Institutos de Salud Instituto Nacional de Epidemiología "Dr. Juan H. Jara" Programa de Prevención y Control de Infecciones Hospitalarias Otros patógenos transmitidos por transfusión sanguínea incluyen VHC, VHB, virus linfotrópicos humanos de células T tipos I y II (VLHT-I y II), citomegalovirus, virus de Epstein-Barr. Hepatitis delta, malaria, brucelosis, toxoplasmosis, leishmaniasis, sífilis y una variedad de contaminantes bacterianos. Cuando los familiares del paciente donan sangre para reemplazar las unidades que le son suministradas, se debe considerar que las donaciones de reemplazo probablemente transmiten más infecciones que las obtenidas de donadores voluntarios habituales, si no se es muy estricto en los controles. El examen riguroso de donadores debería disminuir el riesgo de transfundir unidades de sangre infectadas. Las soluciones a largo plazo incluyen la creación de una reserva de donantes voluntarios de bajo riesgo para mejorar el abastecimiento de sangre y la puesta en práctica de tecnología de banco de sangre y de análisis de laboratorio menos costosas. Los fluidos intravenosos tienen mucha menor probabilidad de transmitir infecciones que las transfusiones de sangre y, se deben usar en lugar de ellas en los casos en que se requiere expansión de volumen de urgencia. La deshidratación severa en pacientes incapaces de recibir hidratación oral y la pérdida de volumen por hemorragia son situaciones en las que se podrían usar fluidos intravenosos. La complicación infecciosa más común de la terapia intravenosa es la relacionada con los catéteres. La sepsis por Gram negativos, resultante de la infusión de fluidos contaminados, aunque poco común, puede ser una complicación fatal. Se sugiere como fundamental considerar que: El empleo de donantes voluntarios habituales, en lugar de donadores remunerados o de reemplazo, reduce el riesgo de infecciones por transfusión sanguínea. Cuando se realizan adecuadamente, la determinación de compatibilidad de grupo sanguíneo y los análisis adicionales para VIH, virus de hepatitis B y C (VHB. VHC) y otros patógenos reducen el riesgo de muerte por transfusión sanguínea a menos de 1 por cada 100.000 pacientes. La infección más común asociada con la administración de líquidos intravenosos se debe a la entrada de flora cutánea (estafilococos coagulasa-negativos, difteroides o Staphylococcus aureus) y su colonización del catéter. El riesgo de infección aumenta cuanto más tiempo se mantenga el catéter en el paciente. Los fluidos intravenosos contaminados, a menudo por bacilos Gram negativos, están asociados con altas tasas de bacteriemia en los pacientes. Cuando se administran fluidos intravenosos se sugiere: Siempre lavar las manos a fondo (15 a 20 segundos) antes de insertar catéteres intravenosos, antes de preparar líquidos para infusión incluyendo la adición de medicamentos, o antes de cambiar vendajes. Desinfectar la piel con povidona yodada alcohólica al 10% o alcohol isopropílico al 70% antes de insertar el catéter. No se debe tocar la piel una vez preparada para el procedimiento (técnica de “no tocar”). 26 Ministerio de Salud Secretaría de Políticas, Regulación y Relaciones Sanitarias Administración Nacional de Laboratorios en Institutos de Salud Instituto Nacional de Epidemiología "Dr. Juan H. Jara" Programa de Prevención y Control de Infecciones Hospitalarias Seleccionar una zona de la extremidad superior que minimice la incomodidad del paciente y la restricción del movimiento. Evita la región inguinal, las extremidades inferiores y las prominencias óseas ya que estas localizaciones presentan tasas más altas de infección y/o molestias para el paciente. Es preferible utilizar guantes estériles al insertar líneas periféricas. Para toda administración intravenosa de líquidos se deben usar agujas y tubos de venoclisis estériles. Siempre que sea posible se deben usar agujas y tubos desechables. Examinar los envases de líquidos intravenosos para detectar rupturas, escapes o turbidez en el fluido. Administrar intravenosamente únicamente líquidos y medicamentos estériles. Sólo personal entrenado debe añadir medicamentos a los fluidos intravenosos y debe hacerlo, preferiblemente en la farmacia y en condiciones de asepsia. Asegurar el catéter para evitar su movimiento y cubrir el punto de inserción con un vendaje estéril. Examinar diariamente el punto de inserción y cambiar el vendaje únicamente cuando sea necesario. Dentro de lo posible remover o cambiar a otra localización los catéteres intravenosos periféricos cada 72 horas. En caso de Transfusiones sanguíneas se sugiere: Utilizar las mismas técnicas generales recomendadas para los fluidos intravenosos. Siempre que sea posible, utilizar fluidos intravenosos en lugar de sangre para el restablecimiento de volumen. Hacer pruebas de detección tanto a los donadores como a la sangre donada para reducir el riesgo de transmisión de infección . Se debe suponer que todos los productos derivados de la sangre son infecciosos y, por lo tanto, se deben manejar con guantes. No se debe añadir ningún medicamento a las transfusiones de sangre. No se deben reutilizar los tubos de venoclisis empleados para transfusiones ya que existe el riesgo de que hayan sido esterilizados inadecuadamente. Controlar la temperatura y la tensión arterial del paciente durante la transfusión. Descontinuar inmediatamente la transfusión si ocurren fiebre o hipotensión ya que estas pueden ser signos de una reacción inmunológica no infecciosa. Pruebas recomendadas para detectar Enfermedades Infecciosas Trasmitidas por sangre o por productos derivados de la sangre Anticuerpo VIH-1 (IEE) AgsHB (RIE o IEE) Anti-VHC (IEE) Anticuerpo VIH-1/2 (IEE) Anticuerpo VLHT-I/II (IEE) Prueba no treponémica (RPR, etc.) Antígeno VIH-I p24 El orden exacto depende de la prevalancia de las enfermedades relativas en la comunidad y de la eficacia del sistema de aplazamiento de donaciones IEE = Inmunoensayo enzimático; RIE = Radioinmunoensayo; RPR = Reagina Plasmática Rápida 27 Ministerio de Salud Secretaría de Políticas, Regulación y Relaciones Sanitarias Administración Nacional de Laboratorios en Institutos de Salud Instituto Nacional de Epidemiología "Dr. Juan H. Jara" Programa de Prevención y Control de Infecciones Hospitalarias INFECCIONES RELACIONADAS CON LA PREPARACIÓN DEL PACIENTE PARA CIRUGÍA La preparación adecuada de la piel junto con la profilaxis antimicrobiana puede disminuir la incidencia de infecciones de las heridas tanto superficiales como profundas después de ciertos procedimientos quirúrgicos. Una ducha antes de la cirugía, la preparación de la piel con antisépticos en el quirófano y una dosis única prequirúrgica de una cefalosporina de primera o segunda generación son de gran importancia para disminuir significativamente las tasas de infección de la herida. Desgraciadamente en algunos centros médicos generalmente se administran varias dosis profilácticas postquirúrgicas lo que resulta en costos excesivos y la aparición de bacterias multiresistentes. La preparación de los pacientes para cirugía, destinada a prevenir la infección postquirúrgica de la herida, se basa en la preparación de la piel y la profilaxis antibiótica adecuadas. El gluconato de clorthexidina resultó significativamente superior que los jabones medicados con povidona yodada. Se debe abandonar la práctica de rasurar el área quirúrgica, especialmente la noche anterior, ya que al rasurar se pueden producir lesiones cutáneas significativas que posteriormente son colonizadas y se convierten en foco de contaminación bacterianas de la herida quirúrgica. Se ha visto que el riesgo de infección de la herida quirúrgica es más bajo al remover el pelo con tijeras o con una crema depilatoria que al rasurar el área. Es interesante que los pacientes a quienes no se les ha removido el pelo pueden tener tasas de infección de la herida aún más bajas. Sólo el personal entrenado debe realizar la preparación de la piel en el quirófano. Inicialmente, se lava el área quirúrgica cuidadosamente con un detergente (con o sin agente desengrasante). El antiséptico, usualmente gluconato de clorhexidina o un producto yodoforado, se aplica en círculos concéntricos empezando en el punto donde se va a realizar la incisión. Se ha definido como infección de la herida quirúrgica la secreción purulenta de la incisión, ya sea que se cultiven organismos o no. En 1992, el CDC redefinió el término como “infecciones del área quirúrgica” y las dividió en superficiales y profundas. Las infecciones superficiales comprometen únicamente la piel y el tejido subcutáneo mientras que las infecciones profundas comprometen, por lo menos, el músculo y la fascia. Las incisiones pueden ser contaminadas por flora propia del paciente o por flora ambiental, incluyendo al personal del quirófano. La vigilancia apropiada de infecciones de heridas se extiende hasta 30 días después del procedimiento y hasta 1 año en el caso de implantes. El sistema tradicional de clasificación de las heridas quirúrgicas fue establecido con base en la exposición de la incisión a la contaminación bacteriana . En el Estudio de la Eficacia del Control de Infecciones Nosocomiales (SENIC) se desarrolló una nueva clasificación basada en la evaluación de riesgo del paciente en lugar del tipo de herida. Los factores de riesgo incluyen cirugía abdominal, cirugías de más de 2 horas de duración y la existencia de tres o más diagnósticos asociados cuando el paciente es dado de alta. Según algunas experiencias, los pacientes sin factores de riesgo tenían un riesgo de infección bajo (1%) aquellos con un 28 Ministerio de Salud Secretaría de Políticas, Regulación y Relaciones Sanitarias Administración Nacional de Laboratorios en Institutos de Salud Instituto Nacional de Epidemiología "Dr. Juan H. Jara" Programa de Prevención y Control de Infecciones Hospitalarias factor de riesgo, tenían un riesgo de infección moderado (3.6%) y aquellos con dos o más factores de riesgo tenían un riesgo de infección alto (8.9% a 27%). En 1991 el sistema de Vigilancia Nacional de Infecciones Nosocomiales (NNIS) trató de redefinir los factores de riesgo. Los siguientes factores de riesgo proporcionaron una mayor discriminación de los pacientes con riesgo de infección de la herida: 1) Clasificación de la herida como contaminada o sucia. 2) Alto riesgo prequirúrgico: valoración prequirúrgica de 3 o más, según la definición de la Sociedad Estadounidense de Anestesiología (ASA). 3) Duración mayor del percentil 75 establecido para el procedimiento que se va a realizar. Las cirugías de larga duración generalmente incluyen mayor pérdida de sangre, mayor complejidad y violaciones de la asepsia. 4) También constituyen factores de riesgo para la infección de la herida la desnutrición, la edad avanzada, la obesidad, la diabetes mellitus, el cáncer y el uso de esteroides o drogas inmunosupresoras. Se debe considerar que: Todavía se discute la necesidad de remover el pelo del área donde se va a realizar el procedimiento, y el método adecuado para hacerlo. La duración de la profilaxis en el paciente traumatizado no está bien definida. Es necesario realizar estudios adicionales de valoración de los factores de riesgo para las cirugías limpias. El objetivo de la profilaxis antimicrobiana en cirugía es prevenir la infección tanto superficial como profunda del área quirúrgica. En varios estudios clínicos aleatorios se ha demostrado que la profilaxis antimicrobiana quirúrgica reduce significativamente la incidencia de infecciones postquirúrgicas de la herida. Se sugiere aplicar los siguientes principios de profilaxis: Se debe administrar por vía intravenosa una sola dosis terapéutica completa inmediatamente antes de la incisión de la piel y simultáneamente con la inducción de la anestesia, esto es, antes de la contaminación de los tejidos para asegurar concentraciones tisulares efectivas durante el período operatorio. Los antibióticos son más efectivos cuando son administrados antes de la inoculación de bacterias y resultan ineficaces si se administran 3 o 4 horas después de ella. En la mayoría de las cirugías limpias y limpias-contaminadas incluyendo aquellos que involucran la implantación quirúrgica de cuerpo extraño, se debe administrar únicamente cefazolina en el momento de inducción de la anestesia e incisión de la piel. En las cirugías contaminadas se debe administrar cefazolina junto con un agente antianaeróbico. La selección del medicamento apropiado debe hacerse con base en las bacterias que más probablemente causen infección en cada situación. Dentro de lo posible debe administrarse una droga única. Las cefalosporinas y en particular la cefazolina son ideales para la profilaxis gracias a su amplio espectro de actividad, su vida media sérica moderadamente larga, su baja toxicidad, su fácil administración y su bajo costo. Las cefalosporinas de tercera generación son más costosas y promueven la aparición de cepas resistentes. En general, no deben usarse para profilaxis de rutina. La cefoxitina se puede recomendar como agente único para cirugía colorectal, el trauma penetrante 29 Ministerio de Salud Secretaría de Políticas, Regulación y Relaciones Sanitarias Administración Nacional de Laboratorios en Institutos de Salud Instituto Nacional de Epidemiología "Dr. Juan H. Jara" Programa de Prevención y Control de Infecciones Hospitalarias abdominal o la apendicetomía primaria, ya que en estos casos es necesaria la cobertura contra organismos aeróbicos y anaeróbicos Gram negativos. El metronidazol y la gentamicina se pueden utilizar para los pacientes alérgicos a los agentes beta-lactámicos. La profilaxis no debe prolongarse más de 24 horas después de la cirugía. Siempre y cuando se mantengan niveles séricos adecuados de la droga durante la cirugía, una dosis única es tan efectiva como las dosis múltiples. En el caso de hemorragia masiva o cuando la duración de la cirugía es mayor de tres horas, se debe administrar una dosis adicional. Los antibióticos profilácticos están indicados en casos de implante de materiales protésicos (por Ej. válvulas cardíacas, injertos vasculares, piezas ortopédicas) o cuando factores de riesgo en el huésped sugieren la necesidad de administrar profilaxis. Dado que los estafilococos constituyen la mayor amenaza en las prótesis infectadas, en las instituciones con alta prevalencia comprobada de cepas meticilino-resistentes se debe utilizar la vancomicina. La profilaxis antibiótica apropiada previene la infección del área quirúrgica reduciendo así la morbilidad y los costos. Sin embargo, se debe enfatiza que el abuso y el uso equivocado de antibióticos para la profilaxis quirúrgica son responsables de hasta la mitad del costo total de los antibióticos prescritos en los hospitales de Estados Unidos y contribuyen a la aparición de microorganismos multi-resistentes. Clasificación de las Heridas Quirúrgicas Limpias No penetración los tractos gastrointestinal respiratorio o genitourinario No signos de inflamación o infección agudas No traumática No violaciones de la técnica aséptica Limpias-Contaminadas Penetración de los tractos gastrointestinal o respiratoria, sin contaminación significativa Penetración del tracto biliar en ausencia de bilis infectada Entrada en la orofaringe o la varina Penetración del tracto genitourinario en ausencia de orina infectada Violación menor de la técnica aséptica Contaminadas Contaminación importante después de la entrada a los tractos gastrointestinal o respiratorio Penetración de los tractos genitourinario o biliar en presencia de infección aguda Heridas traumáticas recientes Violación importante de la técnica aséptica Sucias Presencia de inflamación bacteriana aguda o pus Hallazgo de víscera hueca perforada Herida traumática con presencia de tejido desvitalizado, cuerpo extraño, contaminación fecal y/o tratamiento tardío 30 Ministerio de Salud Secretaría de Políticas, Regulación y Relaciones Sanitarias Administración Nacional de Laboratorios en Institutos de Salud Instituto Nacional de Epidemiología "Dr. Juan H. Jara" Programa de Prevención y Control de Infecciones Hospitalarias INFECCIONES RELACIONADAS CON EL QUIRÓFANO El objetivo de mantener buenas prácticas de control de infecciones en el quirófano es disminuir la infección del área quirúrgica, la cual representa una fracción importante de las infecciones hospitalarias, con la morbilidad y el aumento en los costos asociado. La modificación de factores ambientales asociados con las infecciones quirúrgicas es un área importante de las prácticas de control de infecciones. Se debe considerar que: La mayoría de las infecciones quirúrgicas ocurren durante el procedimiento mismo. Después de la cirugía se producen pocas infecciones si ha habido cierre primario de la herida. Por lo tanto, la corta estancia en el hospital o la cirugía ambulatorio no disminuyen significativamente la incidencia de infecciones del área quirúrgica. La mayor parte de las infecciones del área quirúrgica surgen de la flora endógena del paciente, la cual contamina la herida por contacto directo. Por esto, la preparación del paciente para cirugía debe ser meticulosa con el objeto de disminuir su carga microbiológica en el intestino, la piel, el tracto respiratorio, el trato genital, etc., según el procedimiento que se le vaya a hacer. También es determinante la contaminación exógena de heridas, especialmente en lo que se refiere a procedimientos quirúrgicos limpios. Por lo tanto, merece hacer énfasis en las prácticas de control de infecciones en el quirófano. El personal de cirugía constituye la fuente primaria de patógenos aéreos en el quirófano. Esto se debe a la difusión de una gran cantidad de microorganismo de la piel, especialmente estafilococos. A fin de minimizar el riesgo de Infección en el quirófano se sugiere: Ventilación y calidad del aire en el quirófano En condiciones óptimas las salas de cirugía deben estar equipadas con sistemas de presión positiva para asegurar que el aire fluya de los quirófanos (zona aséptica) hacia las áreas adyacentes (zona limpia y protectora) Para asegurar la eliminación de contaminantes aéreos generados por el paciente o por el personal durante la cirugía es necesario que el sistema de ventilación, como mínimo filtre el aire a razón de 20 cambios/hora de los cuales por lo menos 4 sean con aire fresco. Mantener la temperatura en el quirófano entre 18ºC y 24ºC y la humedad entre 50% y 55%. Si debido a la escasez de recursos el quirófano no está equipado según estas recomendaciones, es necesario centrar la atención en estrategias menos costosas para mantener el aire lo más limpio posible: minimizar el número de personas en el quirófano durante el procedimiento, evitar hablar excesivamente, mantener las puertas y ventanas cerradas y minimizar las entradas al quirófano durante la cirugía. Preparación del paciente para cirugía Evitar rasurar el área quirúrgica a menos que el pelo sea tan abundante que interfiera con el procedimiento. 31 Ministerio de Salud Secretaría de Políticas, Regulación y Relaciones Sanitarias Administración Nacional de Laboratorios en Institutos de Salud Instituto Nacional de Epidemiología "Dr. Juan H. Jara" Programa de Prevención y Control de Infecciones Hospitalarias Si es necesario rasurar el área, usar tijeras o un depilador en lugar de máquinas de afeitar. Las tasas de infección aumentan por un factor de 10 con el uso de hojas de afeitar comparado con no rasurar o con el uso de tijeras o depiladores. El área quirúrgica debe ser rasurada inmediatamente antes de que el cirujano haga la incisión y no la noche antes. Limpiar a fondo con detergente el área quirúrgica y luego aplicar jabón antiséptico partiendo del lugar de la incisión hacia fuera. Como antisépticos se recomiendan la clorhexidina, los productos yodoforados y el yodo. Después de la asepsia adecuada se debe cubrir el área donde se va hacer el procedimiento con campos quirúrgicos estériles. Si se ha prescripto un antibiótico profiláctico, éste debe ser administrado menos de 2 horas antes de que el cirujano haga la incisión o, idealmente, inmediatamente antes de comenzar el procedimiento. El riesgo de infección del área quirúrgica aumenta por un factor de 2 a 3 si se administra el antibiótico después de haber hecho la incisión y por un factor de más de 6 si se administra con demasiada anticipación (p.ej. más de 2 horas antes de la in cisión). Por lo tanto, es preferible administrar el antimicrobiano cuando el paciente se encuentre en el quirófano. Si se va aplicar un torniquete a una extremidad, como en casos de cirugía ortopédica, administrar el antibiótico por lo menos 60 minutos antes de la incisión. Preparación del personal de cirugía Usar mascarilla, gorro (que cubra todo el cabello) y vestimenta apropiada para el quirófano. Las botas para cubrir los zapatos se pueden reemplazar por zapatos normales cuyo uso esté restringido al quirófano, ya que no hay diferencia en la contaminación del suelo si se usan unas u otros (es claro que las botas resultan más costosas para el hospital) En caso de usarla lo adecuado sería utilizarla únicamente en la sala de operaciones propiamente dicha. Utilizar un uniforme quirúrgico que cubra la mayor parte de la piel para disminuir el desprendimiento de microorganismos de la piel expuesta. Hasta 109 células epiteliales por día se desprenden de la piel de cada persona y la mayoría de estas células contienen bacterial. Todo el personal que trabaje en el quirófano debe llevar uniforme de cirugía, no sólo quienes trabajan en o cerca del campo operatorio. Antes del primer procedimiento del día, lavar a fondo los brazos y las manos con clorhexidina, o yodoforados durante por lo menos 5 minutos y durante 2 a 5 minutos entre procedimientos subsiguientes. Los guantes estériles deben ser de buena calidad, ya que aproximadamente 10% de los guantes se perforan desapercibidamente durante la cirugía. Para cirugía ortopédica (en la que hasta 48% de los guantes se perforan) y para otros procedimientos en los que haya el riesgo de perforación por fractura de hueso (p.ej. esternotomías) se debe usar doble guante. Las buenas técnicas quirúrgicas claramente reducen el riesgo de infección del área quirúrgica. Asegurar que todo el equipo e instrumentos quirúrgicos para el procedimiento se encuentren en el quirófano antes del comienzo de la cirugía para así reducir el tráfico y la necesidad de abrir puertas. 32 Ministerio de Salud Secretaría de Políticas, Regulación y Relaciones Sanitarias Administración Nacional de Laboratorios en Institutos de Salud Instituto Nacional de Epidemiología "Dr. Juan H. Jara" Programa de Prevención y Control de Infecciones Hospitalarias Algunas prácticas como las siguientes continúan siendo discutidas: Los pacientes deben bañarse o ducharse con un antiséptico antes de la cirugía. Aún cuando esta práctica reduce la colonización por bacterias de la piel del paciente, no se ha probado que reduzca la colonización de las fosas nasales por Staphylococcus aureus o que reduzca las tasas de infección del área quirúrgica. El uso de cepillos o esponjas para la asepsia preoperatoria de las manos y los brazos de cirujanos y enfermeras se puede reemplazar por jabón solamente, ya que algunos estudios han demostrado que el número de bacterias después del cepillado es mayor que después del simple lavado con jabón. Hay ahorro significativo al no ser necesario el uso de esponjas. A pesar de que el algodón no es efectivo para reducir la transferencia de bacterias de la piel que se encuentra debajo del uniforme quirúrgico a la superficie de éste, ningún otro material que permita la comodidad del personal ha probado reducir lo contaminantes aéreos del quirófano. No se ha demostrado el valor de la erradicación de staphylococcus aureus de la nariz del paciente con mupirocina prequirúrgica. Las siguientes prácticas no reducen la infección del área quirúrgica y no deben ser usadas: La existencia de un área de transferencia en la que el paciente se traspasa de la camilla del pabellón a una del pabellón a una del quirófano resulta costosa, y la reducción en la contaminación del suelo no justifica este gasto, si se usan las medidas de vestimenta y calzado adecuadas. No son necesarios lo cultivos rutinarios del personal de quirófano a menos que, durante un brote, el personal esté claramente ligado a la infección del área quirúrgica. En esta situación y si la causa del brote es staphylococcus aureus sólo se hacer el cultivo de muestra del personal implicado ya que esta localización tiene una sensibilidad del 93%. También es innecesario el cultivo rutinario del medio quirúrgico puesto que los objetos inanimados y las superficies rara vez son la causa de infecciones del área quirúrgica. Por la misma razón no son útiles las placas de asentamiento para evaluación de contaminantes aéreos. Usar alfombras pegajosas. Programar la cirugía de casos contaminados para el final del día. CONTROL DE INFECCIONES EN OBSTETRICIA La sepsis neonatal y la endometritis postoperatoria pueden ser prevenibles, en gran medida, mediante simples medidas de control de infecciones. La mayoría de las infecciones son causadas por microorganismos del la flora vaginal de la madre. Sin embargo en muchos lugares estas todavía son causan morbimortalidad sustanciales. La importancia del control de las infecciones en obstetricia fue establecida cuando Semmelweis hizo sus observaciones históricas durante la segunda mitad del siglo XIX. La ruptura de membranas, el trabajo de parto, una condición socioeconómica baja, y los exámenes vaginales frecuentes son factores de riesgo bien documentados para las endometritis posparto después de las cesáreas. Así como para la endometritis post parto 33 Ministerio de Salud Secretaría de Políticas, Regulación y Relaciones Sanitarias Administración Nacional de Laboratorios en Institutos de Salud Instituto Nacional de Epidemiología "Dr. Juan H. Jara" Programa de Prevención y Control de Infecciones Hospitalarias vaginal lo son la ruptura prolongada de membranas, el parto con fórceps medio, la anemia, el trauma de tejidos blandos materno y la vaginosis bacteriana. Es importante tener en cuenta que simples medidas como el lavado del canal del parto con clorexidina al 0,25% cada vez que se haga un examen vaginal antes del parto, combinado con una limpieza del recién nacido, resultan significativas en la disminución de las infecciones neonatales y maternas y de la mortalidad neonatal con un costo muy bajo. Aunque es motivo de discusión se considera que las infecciones del recién nacido adquiridas durante su paso por el canal del parto en el hospital se consideran hospitalarias. Existen algunos aspectos que deben considerarse importantes: Los microorganismos causales de sepsis neonatales más importantes son los estreptococos grupo B (EGB) y la E. Coli. El lavado del canal del parto con un antiséptico reduce la tasa de infección neonatal, lo mismo que el lavado antiséptico durante los exámenes vaginales reducen el riesgo de Endometritis puerperal. La prevención de infecciones por EGB se puede lograr mediante las pruebas de detección y el tratamiento de la colonización vaginal durante el embarazo. La rentabilidad de estas estrategias depende del medio hospitalario en cuestión. El parto por cesárea está asociado con tasas más altas de Endometritis posparto (10 a 20%) que el parto vaginal. Una dosis única de profilaxis antibiótica reduce el riesgo de Endometritis postcesárea en pacientes de alto riesgo. Se consideran como tales las mujeres que son portadoras de EGB mediante pruebas de cultivos a las 35 y 37 semanas de gestación, o las mujeres con trabajo de parto prematuro o ruptura de membranas antes de la semana 37 de gestación, así como las mujeres que presentan uno o más de los siguientes factores de riesgo durante el trabajo de parto: nacimiento a menos de 37 semanas de gestación, ruptura de membranas de más de 18 hs. o temperatura mayor de 38ºC. Se debe considerar la administración de profilaxis a mujeres que en partos anteriores dieron a luz a niños con sepsis por EGB y a mujeres que presentaron bacteriemias por EGB durante el embarazo. Aunque poco frecuentes, los brotes de fiebre puerperal clásica causada por estreptococos hemolíticos del grupo A ocurren y justifican la investigación inmediata de la fuente de infección. Esto incluye la identificación de portadores del microorganismo. Durante el trabajo de parto puede haber contacto frecuente e incontrolado con sangre y otros fluidos corporales por lo que es necesario tomar medidas preventivas para evitar la transmisión de patógenos de la sangre.(usar bata, mascarilla, anteojos protectores y guantes en todo momento) No está claro el valor de la profilaxis antibiótica para la cesárea en mujeres que no se encuentran en trabajo de parto y cuyas membranas están íntegras. En casos en que la madre está infectada por el virus de hepatitis B, el recién nacido debe ser inmunizado después del parto. Las madres con infección genital activa por el virus del herpes simples deben ser manejadas tomando precauciones de barrera. Se sugieren las siguientes recomendaciones: 34 Ministerio de Salud Secretaría de Políticas, Regulación y Relaciones Sanitarias Administración Nacional de Laboratorios en Institutos de Salud Instituto Nacional de Epidemiología "Dr. Juan H. Jara" Programa de Prevención y Control de Infecciones Hospitalarias Se deben tomar medidas generales de control de infecciones antes, durante y después del trabajo de parto. Durante el trabajo de parto se deben usar guantes estériles en todo momento, y es aconsejable llevar bata, mascarilla y anteojos. Se debe limpiar el canal del parto con un desinfectante durante los exámenes vaginales. En las pacientes de alto riesgo se debe administrar una dosis única de antibiótico profiláctica cuando se vaya a practicar una cesárea. Los antibióticos se deben administrar directamente una vez pinzado el cordón umbilical. SEPSIS ABDOMINAL Modificado de Julio Alberto Nieto Silva MD. La sepsis de origen abdominal ha constituido un reto permanente para el médico en sus aspectos diagnósticos y terapéuticos, pues el diagnóstico erróneo o tardío, o la conducta inadecuada o diferida, ponen en grave peligro la vida del paciente. La cavidad abdominal, de manera fisiológica, pone en funcionamiento una serie de medidas tendientes a localizar la infección, al igual que el mecanismo de depuración de bacterias de la cavidad abdominal pero que llevan a éstas a entrar en contacto con los mecanismos de defensa sistémicas, originando una respuesta a nivel generalizado que en muchas ocasiones pone en riesgo la vida del paciente. El abdomen ha sido denominado con mucha razón como la caja de sorpresas de la anatomía humana y la patología inflamatoria intraabdominal constantemente obliga a tomar decisiones de primordial importancia que, en el caso de ser ellas erróneas o inoportunamente resueltas, ponen en grave peligro la integridad anatómica y funcional del paciente. A principios de siglo la mortalidad oscilaba alrededor del 90%, en la década de los 20 y gracias a los principios definidos por el Dr. Kirschner de eliminar la fuente de infección y eliminar el pus y los detritus tóxicos, la mortalidad baja desciende al 50 por ciento. Entre 1930 y 1960, luego del advenimiento de la penicilina, la mortalidad presenta muy poca variación, se atribuye esto a la gran confianza de los cirujanos en el efecto antibiótico pero motivó el descuido de los principios quirúrgicos definidos por Kirschner. No fue sino hasta el advenimiento de las penicilinas de amplio espectro y las cefalosporinas y la aparición de la terapia antianaeróbica que se observó una nueva disminución en la mortalidad por sepsis abdominal. El advenimiento de las unidades de cuidado intensivo, el soporte nutricional y nuevos conceptos en el tratamiento quirúrgico de la sepsis de origen abdominal, marcan un nuevo descenso en la mortalidad, que todavía hoy, sigue cobrando tasas prohibitivas de mortalidad. Una clasificación amplia de la patología inflamatoria intraabdominal se podría establecer agrupando aquellas entidades que en algún momento de su desarrollo pueden evolucionar hacia un síndrome de asa cerrada, presentándose con posterioridad el 35 Ministerio de Salud Secretaría de Políticas, Regulación y Relaciones Sanitarias Administración Nacional de Laboratorios en Institutos de Salud Instituto Nacional de Epidemiología "Dr. Juan H. Jara" Programa de Prevención y Control de Infecciones Hospitalarias fenómeno de la perforación intraabdominal con lo que se genera un cuadro de peritonitis focal o generalizada. El otro grupo de patología lo constituyen aquellos problemas intraabdominales que dentro de su historia natural no presentan como eventualidad predominante el riesgo de perforación inminente y en donde, a la luz del conocimiento actual, la translocación bacteriana como foco de infección desempeña un papel predominante. La posibilidad de perforación se establece en las denominadas vísceras huecas, sea por una situación que determine fenómenos obstructivos que impidan la adecuada propulsión de sus secreciones o por lesiones que en algún momento de su evolución llegan a alterar la integridad anatómica y funcional de la pared. Cuando esto ocurre, se establece una situación altamente peligrosa para el paciente y, en este caso, la intervención quirúrgica no se discute. La cavidad abdominal, como se verá más adelante, puede resolver un episodio simple de contaminación y esto se ve en muchas perforaciones de úlcera gástrica e incluso duodenales que pueden evolucionar satisfactoriamente sin la intervención del cirujano. Los mecanismos defensa abdominal están en condiciones de controlarlo; sin embargo, si la contaminación es continua, origina secuestro importante de líquidos, déficit plasmático e hipovolemia, absorción de toxinas, liberación de mediadores inflamatorios, fenómenos de sepsis y formación de abscesos y por último, falla orgánica múltiple. La intervención quirúrgica en esta situación no se discute; por el contrario, es la conducta indicada; la demora en el procedimiento está determinada por el tiempo requerido en la recuperación hemodinámica del enfermo, la compensación parcial del desequilibrio hidroelectrolítico y ácidobásico que presenta y la estabilización de las funciones cardiovascular, pulmonar y renal, si ellas se encontraran alteradas. Las lesiones de tipo inflamatorio intraabdominal que no presentan riesgo de perforación, en muchas ocasiones también requieren del tratamiento quirúrgico para su corrección; gran cantidad de ellas, mejoran con procedimientos médicos no invasivos de tipo quirúrgico, con radiología intervencionista y el tratamiento operatorio sólo estaría indicado si el plan médico inicialmente establecido fracasa. En tanto que el diagnóstico diferencial del factor etiológico que determinó un cuadro de obstrucción intestinal o de perforación de víscera hueca en la mayoría de los casos es eminentemente académico; en las lesiones inflamatorias intraabdominales no perforantes es fundamental y sólo se llega a él mediante un análisis minucioso de la historia clínica, de la evolución de la enfermedad y de los hallazgos realizados durante la exploración física. El lugar de la perforación es fundamental en la evolución del cuadro séptico, la flora bacteriana va cambiando con la altura del tubo digestivo, al nivel de estómago, la densidad es mínima en condiciones normales de acidez, y con predominio de gérmenes Grampositivos, la densidad bacteriana aumenta al nivel del duodeno y el yeyuno y continúa dominado la flora gram positiva con ocasional colonización de enterobacter y bacteroides. A la altura del íleon y en la medida en que se acerca a la válvula ileocecal, la densidad bacteriana aumenta, continúa aún predominando la flora Gram-positiva a expensas de 36 Ministerio de Salud Secretaría de Políticas, Regulación y Relaciones Sanitarias Administración Nacional de Laboratorios en Institutos de Salud Instituto Nacional de Epidemiología "Dr. Juan H. Jara" Programa de Prevención y Control de Infecciones Hospitalarias estreptococo y lactobacilo, pero también se incrementa el espectro Gram-negativo y de anaerobios. Por último, en el colon, la densidad bacteriana es tan grande que el 60% del peso de la materia fecal seca se encuentra constituido por microorganismos y la relación aerobios/anaerobios es de 1: 10.000. El problema La situación de contaminación continua de la cavidad abdominal es el principal problema de índole infecciosa que afrontan los médicos y a pesar de los avances existentes en los agentes antimicrobianos y en las medidas de cuidado intensivo y soporte del paciente, la mortalidad por causa de peritonitis supurativa aguda es extremadamente alta. El líquido peritoneal, al igual que todos los demás líquidos contenidos en las cavidades serosas, es estéril y su contaminación, como se anotó, lleva a situaciones catastróficas. La cavidad peritoneal es el mayor espacio extravascular del organismo; tiene una superficie de 1.72 m2, equivalentes a la superficie cutánea corporal de un adulto. En condiciones de normalidad solo contiene aproximadamente 50 cc de un líquido amarillento citrino con una densidad aproximada de 1.016, su contenido proteico es inferior a los 3 g%, dentro de los que predomina la albúmina. No contiene fibrinógeno y su capacidad para coagular en forma espontánea es nula; su actividad antibacteriana es mínima y se encuentra mediada fundamentalmente por el sistema del complemento. La concentración de sus solutos es sensiblemente igual a la del plasma sanguíneo, su celularidad es baja: contiene alrededor de 3.000 células por cc de las cuales el 50% se encuentra representado por macrófagos, el 40% por linfocitos, algunos eosinófilos, mastocitos y células mesoteliales. La serosa peritoneal se comporta como una barrera pasiva, semipermeable al paso de agua y sustancias de bajo peso molecular, lo que ha permitido su empleo en la diálisis peritoneal en casos de insuficiencia renal crónica; y, precisamente, estudios realizadas en este tipo de pacientes, han permitido establecer que la superficie de intercambio eficaz es de aproximadamente 1 m2, y que la eficiencia del peritoneo para el intercambio de agua y solutos puede ser incrementada por agentes farmacológicos que aumenten el flujo o la permeabilidad vascular es plácnica. Durante el proceso de diálisis peritoneal, 1as soluciones hiperosmolares aplicadas pueden ocasionar un flujo de agua entre los 300 y 500 cc por hora al espacio peritoneal. El proceso inflamatorio de la peritonitis tiene un efecto similar de manera tal que el shock hipovolémico que presentan estos enfermos puede resultar rápidamente mortal en el paciente no tratado. Los elementos químicos como la bilis, las enzima pancreáticas y el jugo gástrico potencian esta exudación. Se ha considerado que la pérdida de líquidos durante una peritonitis es equivalente a la que se produce durante una quemadura de 60% de la superficie cutánea. 37 Ministerio de Salud Secretaría de Políticas, Regulación y Relaciones Sanitarias Administración Nacional de Laboratorios en Institutos de Salud Instituto Nacional de Epidemiología "Dr. Juan H. Jara" Programa de Prevención y Control de Infecciones Hospitalarias Aunque toda la superficie peritoneal participa en el intercambio de líquido y solutos de bajo peso molecular, las partículas sólo pueden se absorbidas a través de los vasos linfáticos diafragmáticos, debido a las especiales características de su mesotelio y de los linfáticos de la zona. En la mayor parte de la cavidad peritoneal las células mesoteliales forma un tapiz aplanado y compacto cubierto de numerosas microvellosidades cuyos límites intercelulares no se aprecian. Sin embargo, en la cara inferior del diafragma existen unos vasos linfáticos especiales inmediatamente por debajo de la membrana basal mesotelial. Estos estomas, que fueron descritos inicialmente por von Recklinhausen en 1963, sirven para el drenaje linfático de la cavidad peritoneal. La relajación pasiva del diafragma durante la expiración provoca un rápido reflujo de líquido peritoneal hacia ellos; su contracción produce el vaciamiento de los linfáticos hacia los canales eferentes, situación que se ve favorecida con el aumento de la presión intratorácica durante la inspiración. El flujo retrógrado es impedido por la existencia de válvulas unidireccionales en estos vasos linfáticos. Si bien es cierto que en el hombre la vía exacta de drenaje de los linfáticos diafragmáticos no se conoce, también lo es el hecho que durante la necropsia de pacientes fallecidos de peritonitis se han encontrado repletos de bacterias los linfáticos mediastinales anteriores, en tanto que el resto de la cavidad torácica se encuentra completamente estéril. El tamaño de estos estomas es de 8 a 12 micras y determina el tamaño de las partículas que por ellos se absorben; las bacterias con un diámetro entre 0,5 y 2 micras son rápidamente eliminadas de la cavidad abdominal. Se ha demostrado experimentalmente en perros que luego de la inyección intraperitoneal de bacterias, éstas son aisladas a los 6 minutos en el canal torácico derecho y en sangre periférica a los 12 minutos. La salida del líquido peritoneal determina la creación de una presión negativa relativa dentro del abdomen superior lo que da lugar al flujo del líquido peritoneal en dirección cefálica; a esta circulación se opone el efecto normal de la gravedad. El Dr. Autio describió, en 1964, que al inyectar medio de contraste en la región ileocecal durante una apendicectomía o colecistectomías rutinarias, éste migraba rápidamente hacia la pelvis y en menor grado hacia las áreas subhepáticas y paracólica derecha, cantidades menores se acumulaban en la gotera cólica izquierda hasta el espacio subfrénico izquierdo. Cuando el medio de contraste se inyectaba en las vecindades del duodeno, éste migraba hacia los espacios suprahepático derecho, paracólico derecho, infrahepático izquierdo y pelviperitoneal. Estos estudios que determinaron las vías de diseminación del material contaminado a partir de vísceras rotas, coinciden con la localización de los abscesos que habitualmente se encuentran en los casos de peritonitis que intervinimos. Ya en 1900 el Dr. Fowler había observado que los pacientes afectados de peritonitis que se mantenían permanentemente en posición horizontal, fallecían rápidamente a causa de lo que él denominó absorción de toxinas; propuso entonces la posición semierecta que lleva su nombre con el fin de retardar la absorción de estas toxinas a partir de la cavidad 38 Ministerio de Salud Secretaría de Políticas, Regulación y Relaciones Sanitarias Administración Nacional de Laboratorios en Institutos de Salud Instituto Nacional de Epidemiología "Dr. Juan H. Jara" Programa de Prevención y Control de Infecciones Hospitalarias abdominal. Posteriormente, en 1944, el Dr. Steimberg comprobó que la absorción de bacterias a partir de la cavidad abdominal se retardaba con la posición erguida y se aceleraba en la posición contraria. Otra serie de situaciones intervienen en favor o en contra de la rápida depuración de bacterias de la cavidad abdominal, el íleo adinámico provocado por la manipulación de las vísceras, al igual que la depresión respiratoria ocasionada por los agentes anestésicos generales la disminuyen en forma proporcional a la reducción de la frecuencia respiratoria; por el contrario, es incrementada por el aumento en la presión intraabdominal. Interacción de la contaminación y el peritoneo ¿Cómo responde el peritoneo a la agresión que determina la contaminación de la cavidad peritoneal? Su gran sensibilidad resulta importante en la formación de adherencias fibrinosas que impiden la diseminación de la infección. La lesión de las células mesoteliales provoca una degranulación de los mastocitos peritoneales, ocasionando la liberación de cantidades importantes de histamina, serotonina y péptidos vasoactivos que determinan un aumento importante en la permeabilidad vascular esplácnica; esto facilita la exudación de plasma rico en proteínas a la cavidad, con una alta cantidad de fibrinógeno. Por otra parte, estas mismas células mesoteliales, al ser agredidas, liberan tromboplastina que convierte la protrombina en trombina y esta última transforma el fibrinógeno en fibrina, que se adhiere a las superficies adyacentes. Un activador del plasminógeno que se encuentra en las células mesoteliales y que en condiciones de normalidad activa las enzimas fibrinolíticas impidiendo la formación de adherencias de fibrina, disminuye su actividad en presencia de lesión peritoneal y la peritonitis bacteriana la paraliza por completo. Al no actuar este activador del plasminógeno, las adherencias de fibrina permanecen hasta que la producción de colágeno las convierte en adherencias fibrosas . La sangre dentro de la cavidad abdominal potencia la formación de adherencias ya que también produce depósitos de fibrina. En las peritonitis no tratadas este mecanismo de formación de adherencias, al taponar la víscera perforada y aislar las bacterias, puede salvar la vida del paciente. Simultáneamente con estas acciones de localización de la infección, la lesión de las células mesoteliales, activa el complemento iniciando el fenómeno de quimiotaxis y liberación de opsoninas; esto determina, gracias al aumento de permeabilidad del endotelio vascular, la llegada de granulositos y el inicio de la fagocitosis bacteriana. Desde el punto de vista mecánico, la movilidad diafragmática inicia a través de sus linfáticos la depuración de bacterias para enfrentarlas a las defensas sistémicas. Si todos estos mecanismos de defensa peritoneal tienen éxito, se produce la muerte bacteriana, de lo contrario, se establecen fenómenos de sepsis, falta multisistémica y muerte del paciente. 39 Ministerio de Salud Secretaría de Políticas, Regulación y Relaciones Sanitarias Administración Nacional de Laboratorios en Institutos de Salud Instituto Nacional de Epidemiología "Dr. Juan H. Jara" Programa de Prevención y Control de Infecciones Hospitalarias Mientras esta cadena de eventos ocurre dentro de la cavidad peritoneal, sistémicamente y en forma simultánea entran en acción otra serie de mecanismos, encaminados también a controlar el proceso infeccioso. Al presentarse la contaminación peritoneal el primer mecanismo que entra en función, como ya se ha mencionado, es la depuración de bacterias a través de los linfáticos diafragmáticos, facilitando la absorción de bacterias a partir de la cavidad abdominal y llevándolos a la circulación sistémica. Por otra parte, la lesión de células mesoteliales en respuesta a la agresión inflamatoria provoca la degranulación de los mastocitos peritoneales, que liberan sustancias vasoactivas que aumentan la permeabilidad vascular facilitando la llegada de plasma rico en complemento y opsoninas séricas que, a su vez, se unen a las bacterias y facilitan su destrucción por los fagocitos. Los depósitos de fibrina, localizan la infección, aislando y en ocasiones sellando la perforación, retardando la absorción bacteriana, que podría dar lugar a un shock endotóxico (La rápida llegada de los neutrófilos, unas 4 horas aproximadamente, seguida de los macrófagos, constituye probablemente la principal defensa de la cavidad abdominal frente a la contaminación masiva. Desafortunadamente, toda esta serie de mecanismos de defensa que pone en juego la cavidad peritoneal, además de los efectos benéficos que poseen, también causan situaciones desfavorables para el huésped, en el área sistémica. La depuración bacteriana a través de los linfáticos diafragmáticos determina bacteriemia, la acción de la endotoxina bacteriana y la liberación de citoquinas por los neutrófilos y macrófagos alteran la captación de oxígeno por la célula, lo que altera el gasto cardíaco y la oxigenación. Hay hipovolemia por pérdida de líquidos al espacio extravascular, aparece shock hipovolémico con alteración de la perfusión renal y de la microcirculación y alteraciones metabólicas que finalmente pueden llevar a disfunción orgánica múltiple. Se establecen fenómenos de sepsis sistémica con un cuadro de respuesta inflamatorio, caracterizado por fiebre, leucocitosis, hipermetabolismo, hipoperfusión, hipotensión e hipoxia celular. Por otra parte, este gran flujo de líquidos ocasiona otra serie de problemas; la gran distancia existente dentro de la cavidad abdominal distendida por líquido, la pobre solubilidad del oxígeno en este medio y el consumo que de él hacen las bacterias aerobias llevan a una disminución del potencial de oxígeno, lo cual facilita la proliferación de gérmenes anaerobios. Además, estas grandes cantidades de líquido exceden la capacidad de depuración de los linfáticos del diafragma y el alto consumo de opsoninas que se produce en los líquidos inflamatorios permite que los gérmenes supervivientes y no depurados proliferen y no sean fagocitados. La formación de adherencias de fibrina que hace unos momentos parecía un excelente mecanismo de defensa, también ocluye los estomas diafragmáticos y al aislar los gérmenes impide la acción de los agentes antimicrobianos. 40 Ministerio de Salud Secretaría de Políticas, Regulación y Relaciones Sanitarias Administración Nacional de Laboratorios en Institutos de Salud Instituto Nacional de Epidemiología "Dr. Juan H. Jara" Programa de Prevención y Control de Infecciones Hospitalarias Influencia de sustancias extrañas en la respuesta peritoneal La virulencia de la peritonitis es influenciada en forma importante por la presencia de sustancias ajenas a la cavidad abdominal como lo son el moco, la sangre, la fibrina, las sales biliares y el mismo líquido peritoneal, lo que coadyuvan al mantenimiento de la infección pues una gran cantidad de leucocitos son destinados a fagocitar estos materiales extraños. Se ha demostrado en forma experimental que estas sustancias proteínicas incrementan la virulencia de la contaminación. El moco recubre las bacterias e impide su fagocitosis; adicionalmente, los polisacáridos existentes en el moco interfieren con las reacciones de quimiotaxis y opsonización. La hemoglobina no sólo retrasa la depuración bacteriana sino que además ejerce efecto tóxico directo, posiblemente por la acción de los pigmentos de hierro que se liberan cuando la hemoglobina es degradada; también se ha demostrado que la hemoglobina inhibe la respuesta quimiotáctica de los neutrófilos polimorfonucleares disminuyendo su migración dentro de la cavidad peritoneal. La acción coadyuvante de los pigmentos biliares probablemente se encuentra relacionada a sus propiedades detergentes, que disminuyen la tensión superficial e interfieren con los mecanismos de defensa del peritoneo mediados por la fibrina, en su intento de sellar la perforación y aislar el foco de contaminación. Gérmenes en la sepsis abdominal Como fuente de patógenos, el tracto gastrointestinal contiene más de 400 especies de bacterias con una concentración que varía desde 1.000 bacterias por cc en el esófago y estómago normales, hasta 3,8 10-12-14 por mg de materia fecal seca en el colon; su distribución depende del estado funcional del órgano y, en muchas ocasiones, de la terapéutica de base. La flora gástrica puede cambiar en presencia de Ca. gástrico o con el empleo prolongado de antiácidos, y la densidad de gérmenes anaerobios se incrementó en los casos de obstrucción intestinal. De esta gran masa bacteriana, son pocos los gérmenes patógenos que sobreviven en la cavidad abdominal luego de una perforación y, dentro de éstos, los más afectados son los gérmenes aerobios obligados que mueren en la medida en que la concentración de oxígeno dentro de la cavidad peritoneal disminuye durante el proceso de la peritonitis. De acuerdo a la vía de infección, la peritonitis puede clasificarse: Peritonitis primaria. El término peritonitis primaria se refiere a una contaminación del peritoneo de fuente extraabdorninal en la gran mayoría de los casos por vía hematógena. Ella aparece tanto en niños como adultos y es más frecuente en las mujeres que en los hombres por la comunicación existente entre la cavidad peritoneal y la vagina a través de las trompas de Falopio. Los patógenos mas comúnmente encontrados son de tipo Grampositivo: meningococo, gonococo, estafilococo y estreptococo hemolíticos. Ejemplos de este tipo de peritonitis son la peritonitis espontánea de la infancia, generalmente ocasionada por el estreptococo hemolítico y el neumococo; el foco primario 41 Ministerio de Salud Secretaría de Políticas, Regulación y Relaciones Sanitarias Administración Nacional de Laboratorios en Institutos de Salud Instituto Nacional de Epidemiología "Dr. Juan H. Jara" Programa de Prevención y Control de Infecciones Hospitalarias puede ser una otitis, pero también se ha descrito en infantes con síndrome nefrótico y lupus eritematoso. Otro ejemplo de este tipo de peritonitis es la peritonitis espontánea del adulto, apreciada con frecuencia en pacientes con ascitis secundaria a cirrosis hepática; el espectro bacteriano ha cambiado con relación a la década de los 80; el espectro habitual en la actualidad momento se encuentra representado por gérmenes conformes. Otros ejemplos de este tipo de peritonitis, son la peritonitis secundaria a la diálisis peritoneal ambulatoria continua (CAPD), ocasionada a menudo por gérmenes Grampositivos y ocasionalmente por Pseudomonas aeruginosa; el otro ejemplo es el de la peritonitis tuberculosa cuya incidencia se ha incrementado últimamente en relación con el aumento del síndrome de inmunodeficiencia adquirida (SIDA), por infección con el virus de inmunodeficiencia humana (VIH). Peritonitis secundaria: Es la forma de peritonitis que con mayor frecuencia se encuentra en pacientes con sepsis intraabdominal. Aproximadamente el 80% de los casos se originan en una gran variedad de procesos necróticos del tracto gastrointestinal y de otros órganos intraabdominales; un 10 a un 20% se derivan de cirugías abdominales (peritonitis postoperatorias). Peritonitis terciaria: Por lo general aparece en pacientes inmunosuprimidos por diferentes causas, en quienes los mecanismos de defensa son incapaces de controlar una infección sobreagregada, desarrollando una peritonitis difusa que de acuerdo a Rotstein y Meakins, debe ser denominada peritonitis terciaria. Su cuadro clínico es el de una sepsis oculta, manifestada por estado cardiovascular hiperdinámico, fiebre de bajo grado y estado hipermetabólico. Se efectúan numerosas exploraciones abdominales con el fin de drenar colecciones líquidas infectadas. Estas colecciones se diferencian de los abscesos por el hecho de no ser localizadas sino difusas, las bacterias aisladas son de bajo grado de patogenicidad y seleccionadas por múltiples tratamiento antibióticos, se aíslan estafilococos coagulase negativa, pseudomonas y hongos. Estos pacientes desarrollan casi siempre un cuadro de falla múltiple de órganos y, por lo general, fallecen. El cuadro de sepsis abdominal es de tipo polimicrobiano y bifásico. En una primera fase, que se extiende del primero al séptimo día predominan los fenómenos de sepsis producidos en gran medida por las endotoxinas bacterianas de los gérmenes Gramnegativos, específicamente Escherichia coli, en la medida en que los mecanismos de defensa del peritoneo consumen oxígeno durante su lucha contra los gérmenes; la concentración de este gas dentro de la cavidad disminuye y permite la proliferación de gérmenes anaerobios, estableciéndose la fase de formación de abscesos intraabdominales a partir del quinto día. Experimentalmente se realizaron inóculos peritoneales en perros de modo experimental con diferentes gérmenes- el inóculo de E. coli, reprodujo la fase séptica con una mortalidad del 30%; monocultivos de Bacteroides o Fusobacterias no produjeron ni sepsis ni abscesos con 0% de mortalidad. Igual ocurrió con monocultivos de gérmenes Gram-positivos aerobios tipo Enterococo; los cultivos de Enterococos y Bacteroides produjeron abscesos y el inóculo bacteriano de E. coli y Bacteroides reprodujo las fases de sepsis y de formación de abscesos, con mortalidad en la fase séptica del 43 por ciento. 42 Ministerio de Salud Secretaría de Políticas, Regulación y Relaciones Sanitarias Administración Nacional de Laboratorios en Institutos de Salud Instituto Nacional de Epidemiología "Dr. Juan H. Jara" Programa de Prevención y Control de Infecciones Hospitalarias Sinergismo bacteriano En la evolución de un cuadro de contaminación peritoneal hay que tener en cuenta que esta entidad suele ser una infección polimicrobiana y que ciertos datos inducen a creer que algunas bacterias interactúan con el huésped con el fin de sobrevivir en la cavidad peritoneal, mas aún cuando se ha demostrado que la combinación de gérmenes aeróbios y anaeróbios lleva con facilidad a la formación de abscesos intraabdominales. Son numerosos los mecanismos propuestos para el sinergismo bacteriano; se especula con la producción de un factor de crecimiento o medio nutritivo producido por una bacteria que permitiría el crecimiento de otra más virulenta. También se ha mencionado la producción de secreciones bacterianas que protegen a otras bacterias de los mecanismos de defensa del huésped y de la formación de un medio adecuado para el crecimiento de un germen patógeno; con anterioridad se mencionó que el consumo de oxígeno por parte de las bacterias aerobias, favorecía el crecimiento de gérmenes anaerobios. Se ha demostrado en forma experimental, que el tratamiento antibiótico dirigido contra un germen sinérgico en las etapas iniciales de contaminación impide la formación de abscesos. Sin embargo, una vez estabilizado el cuadro de contaminación peritoneal, la eliminación de uno de los microorganismos no acaba con la infección, posiblemente porque el absceso es un proceso inflamatorio autosuficiente, o en razón de que el crecimiento bacteriano se encuentra retardado en su interior y facilita la aparición de mutantes, resistentes a la acción de los antimicrobianos. Cuadro clínico En los libros de texto la descripción de la peritonitis se equipara con la del abdomen agudo pero no es posible generalizar este término; de hecho, las manifestaciones varían según la enfermedad específica que la originó, su localización, relación con otras vísceras, con las superficies serosas y con factores específicos del huésped como la inmunosupresión o las intervenciones quirúrgicas recientes. El dolor es de aparición rápida y puede ser súbito como en la úlcera perforada o instaurarse a lo largo de varias horas como en la apendicitis. Aunque en el momento del inicio es localizado, se generaliza con rapidez; los movimientos e incluso la respiración lo agravan y en la medida que progresa en el tiempo aparece rigidez abdominal. Desde un principio se hacen presentes la anorexia y, de modo predominante las náuseas y los vómitos; aparece deshidratación manifestada por sed y oliguria; hay distensión y silencio abdominal como expresiones del íleo paralítico y casi siempre, con excepción de pacientes inmunosuprimidos, hay estado febril y taquicardia. Inicialmente el paciente permanece alerta e irritable pero si no se establece rápidamente el tratamiento, se torna obnubilado en forma paulatina. Si no se controla adecuadamente, puede detectarse la aparición de shock hiperdinámico, incremento progresivo de los niveles de glucosa como manifestación de 43 Ministerio de Salud Secretaría de Políticas, Regulación y Relaciones Sanitarias Administración Nacional de Laboratorios en Institutos de Salud Instituto Nacional de Epidemiología "Dr. Juan H. Jara" Programa de Prevención y Control de Infecciones Hospitalarias gluconeogénesis, disminución en la captación arteriovenosa de oxígeno y acidosis metabólica mucho antes que aparezca cualquier otro signo. Tratamiento El tratamiento de la sepsis de origen abdominal se asienta sobre tres pilares: un tratamiento antibiótico adecuado y oportuno, una buena técnica operatoria que cumpla los principios de Kirschner y el soporte metabólico y hemodinámico del paciente, que evite la aparición de la segunda agresión. Tratamiento antibiótico De modo ideal, de acuerdo a Wittman, Rotstein y Meakins, no debe ser iniciado en el preoperatorio y de manera ciega hasta no haber eliminado el foco de infección; es una situación diferente al empleo antibiótico para prevenir la infección de la herida quirúrgica en donde se deben obtener niveles tisulares antes de la incisión de la piel. La sepsis abdominal puede agravar el cuadro de respuesta sistémica a la infección por la absorción de gran cantidad de toxinas a partir de los gérmenes muertos por la terapia antibiótico, por otra parte impide el análisis bacteriológico adecuado, debido a la acción antibiótica en la muestra cultivada. La terapia antibiótica debe ser un tratamiento planificado, dirigido contra el espectro típico de patógenos aeróbios y anaerobios que con más frecuencia se aíslan en la peritonitis secundarias, debe contemplar el sinergismo bacteriano y es necesario administrarla en dosis adecuadas y de acuerdo al estado hemodinámico del paciente para obtener altas concentraciones en el sitio de infección y dentro de lo posible, no presentar efectos colaterales. La antibioticoterapia debe dirigirse contra los principales gérmenes aerobios hallados en la peritonitis secundaria, específicamente contra Escherichia coli, enterococos y Proteus y con menos frecuencia, Pseudomonas y Estreptococo; adicionalmente debe cubrir los gérmenes anaerobios encontrados con más frecuencia, es decir: Bacteroides y Clostridios. Es necesario considerar la patogenicidad del germen, relacionando su concentración intraluminal con la frecuencia con la que se aísla de focos de sepsis abdominal. La patogenicidad de un germen es tanto mayor cuanto su concentración en el tubo digestivo sea menor, con una alta frecuencia en las infecciones intraabdominales. Se ha observado cómo Escherichia coli tiene un factor de patogenicidad muchísimo mayor que el del Bacteroides. Algunos prefieren la terapia empírica y recomiendan iniciarla una vez establecido el diagnóstico de sepsis intraabdominal. Este tipo de terapia, al analizarla, no es tan empírica pues considera y tiene en cuenta la flora más frecuente por regiones, analizando la sensibilidad a un tipo de antibiótico determinado; es necesario tener en cuenta, además, que aproximadamente del 60% al 70% de las infecciones intraabdominales son de carácter polimicrobiano. Otro aspecto que se debe tener en cuenta en la selección antibiótico, es la patología subyacente y la terapia asociada. 44 Ministerio de Salud Secretaría de Políticas, Regulación y Relaciones Sanitarias Administración Nacional de Laboratorios en Institutos de Salud Instituto Nacional de Epidemiología "Dr. Juan H. Jara" Programa de Prevención y Control de Infecciones Hospitalarias Varios esquemas antibióticos cumplen las normas generales para el tratamiento de la peritonitis. La Sociedad de Infección Quirúrgica (Surgical Infection Society) ha recomendado los siguientes esquemas: Infecciones moderadas: Se puede usar Monoterapia con: Cefoxitina, Cefotetan, Cefmetazole, Ticarcilina-Acido clavulánico. Infecciones Severas: Antianaeróbios más aminoglucócidos, Antianaeróbios más cefalosporinas de tercera , (Clindamicina más Aztreonan, Imipenem – Cilastin.) Quienes recomiendan la monoterapia sin incluir aminoglucósidos como parte del tratamiento en pacientes ancianos, con déficit en la función renal o en estado de shock, analizan estos aspectos: 1. 2. 3. Que la toxicidad aumenta en los ancianos. Que la acción antibacteriana efectiva no se obtiene hasta después de 4 días de iniciado el aminoglucósido y que esta actividad se demora aun más en presencia de gran cantidad de líquido intraabdominal Que este tipo de antibiótico es poco eficiente en medios ácidos e hipóxicos como el que se encuentra en las peritonitis. No emplear un aminoglucósido en el manejo de la sepsis abdominal debe ser analizado cuidadosamente, sopesando el alto costo de los esquemas monoterapéuticos que no los emplean; la combinación de anaerobicida asociado a aminoglucósido es notablemente menos costosa al compararla con cualquiera de los esquemas de monoterapia anotados previamente. Tanto el metronidazol como la clindamicina son efectivos, no tóxicos, de bajo costo y con una excelente cobertura anaerobicida. En cuanto al tiempo de mantenimiento de la terapia antibiótico muchos autores, entre otros Nathens y Rotstein, recomiendan únicamente antibioticoterapia de tipo profiláctico en la apendicitis aguda temprana, apendicitis aguda supurada no perforada, colecistitis aguda no complicada, perforación gastroduodenal de corta evolución y perforación intestinal traumática; en todos los demás casos de peritonitis secundaria el tratamiento debe establecerse con criterio terapéutico. Manejo quirúrgico El otro pilar del tratamiento se asienta en el manejo quirúrgico, que debe guardar tres principios básicos: 1. Eliminar la fuente de contaminación mediante el cierre del defecto, su resección o exclusión de la cavidad abdominal 2. Eliminar la mayor parte de detritus y toxinas. 3. Evitar la reacumulación. 45 Ministerio de Salud Secretaría de Políticas, Regulación y Relaciones Sanitarias Administración Nacional de Laboratorios en Institutos de Salud Instituto Nacional de Epidemiología "Dr. Juan H. Jara" Programa de Prevención y Control de Infecciones Hospitalarias Los principios del tratamiento quirúrgico se han venido definiendo desde 1905. Price postuló el debridamiento y el lavado. En 1920, Kirschner definió los principios que bajaron la mortalidad en la década de los 20, de drenaje del foco, debridamiento y el de evitar la reacumulación de detritus. En 1960, McKena postuló el lavado peritoneal continuo y, por último, en 1978, Moffat describió la técnica del abdomen abierto que fue popularizada por Meakins. La técnica quirúrgica empleada para el manejo quirúrgico de la peritonitis depende de la localización y naturaleza de la patología que determinó la contaminación peritoneal. De manera tradicional, el acceso al abdomen en presencia de una peritonitis difusa se realiza mediante una laparotomía mediana, que permite localizar, tratar el proceso y lavar adecuadamente la cavidad abdominal. En general, la contaminación peritoneal originada en una perforación de víscera hueca, se controla adecuadamente mediante el cierre, la exclusión o la resección del foco contaminante; cuando técnicamente es factible, la extirpación del órgano comprometido es la mejor opción. Una excepción importante a este principio se presenta cuando la perforación vísceral tiene como causa un traumatismo; en esta situación, si el paciente se encuentra hemodinámicamente estable, la contaminación es mínima y el número de lesiones asociadas es limitado, el cierre primario de la víscera es el tratamiento adecuado. Disminución de la contaminación bacteriana La reducción del inóculo bacteriano en la cavidad abdominal se obtiene mediante la aspiración del material purulento, la exploración de los fondos de saco y goteras parietocólicas así como también de los espacios subfrénicos y subbepáticos. El lavado transoperatorio con solución salina tibia es un procedimiento que se realiza por lo general durante la laparotomía por peritonitis difusa; la adición de antibióticos al lavado no parece influir en la evolución del cuadro de contaminación intraabdominal. Hay que tener en cuenta que el lavado peritoneal altera los mecanismos locales de defensa de la cavidad abdominal; la solución salina actúa como coadyuvante para alterar la fagocitosis y la migración de leucocitos hacia la cavidad abdominal; la adición de antibióticos o antisépticos al líquido de lavado, altera la quimiotaxis de los neutrófilos, inhibe su actividad microbicida y aumenta la formación de adherencias. Luego del lavado es importante un secado estricto de la cavidad abdominal pues la solución salina residual diluye las opsoninas bacterianas, deja a las bacterias en suspensión en un medio liquido, reduce la fagocitosis y permite la proliferación bacteriana. El drenaje completo y absoluto de la cavidad abdominal es imposible, la inflamación secundaria alrededor del cuerpo extraño termina por ocluirlo y aislarlo, el cuidado de los mismos, por lo general es inadecuado y facilita la entrada de gérmenes desde el exterior. Esto ha llevado a dos enfoques quirúrgicos en el manejo de la infección intraabdominal recurrente o persistente; la técnica del abdomen abierto y la relaparotomía planeada a intervalos fijos o Etappenlavage de la literatura alemana. 46 Ministerio de Salud Secretaría de Políticas, Regulación y Relaciones Sanitarias Administración Nacional de Laboratorios en Institutos de Salud Instituto Nacional de Epidemiología "Dr. Juan H. Jara" Programa de Prevención y Control de Infecciones Hospitalarias La técnica del abdomen abierto tiene gran cantidad de defensores y detractores, según los resultados que con ella se han obtenido; cuando la comparamos en cuanto a costos, estadías y sobrevivencia, con la técnica de la laparotomía programada. De todas maneras, si se decide a emplear la técnica del abdomen abierto, se deben tener en cuenta sus indicaciones universalmente reconocidas: 1. 2. Una predicción de Mortalidad mayor del 50%, de acuerdo a la clasificación del Apache II mayor de 21. Un foco séptico intraabdominal no controlado. 3. Necrosectomías incompletas en caso de pancreatitis. 4. En casos de isquemia intestinal. 5. Cuando el paciente ha sido sometido a múltiples procedimientos. 6. Cuando el excesivo edema peritoneal impide el cierre adecuado de la pared. 7. Cuando una hemorragia en capa incontrolable exige el empaquetamiento Tratamiento sistémico Por último, todo paciente con una infección intraperitoneal está al menos en potencia, gravemente enfermo y exige una vigilancia adecuada de sus funciones vitales en los períodos preoperatorio, intraoperatorio y postoperatorio; la terapia de cuidado intensivo es primordial, ella se orienta fundamentalmente a: 1. 2. 3. Regenerar la fisiología del paciente. Disminuir las lesiones a todos los sistemas orgánicos. Regular la exagerada respuesta de defensa a la sepsis. Debe establecerse control estricto de sus signos vitales, diuresis, estado de hidratación, signos del tercer espacio y análisis de laboratorio como el cuadro hemático, nitrógeno úrico, creatinina, glicemia, electrólitos y gases arteriales que, dentro de lo posible, son mandatarios. Como la hipovolemia precoz es una característica de los pacientes con peritonitis, es necesario establecer una rápida recuperación con cristaloides hasta obtener volúmenes urinarios de por los menos 1,5 cc kilo hora, teniendo obviamente en cuenta para esta reposición de líquidos los antecedentes cardiovasculares del enfermo y las mediciones periódicas de la PVC. o del monitoreo invasivo, si es necesario establecerlo. Con frecuencia se encuentran fenómenos de hipoxia y acidosis; el aumento de la permeabilidad vascular provoca la exudación de líquido a los alvéolos pulmonares con lo 47 Ministerio de Salud Secretaría de Políticas, Regulación y Relaciones Sanitarias Administración Nacional de Laboratorios en Institutos de Salud Instituto Nacional de Epidemiología "Dr. Juan H. Jara" Programa de Prevención y Control de Infecciones Hospitalarias cual el intercambio de oxígeno se reduce. La contractura abdominal y el espasmo diafragmático contribuyen a la hipoventilación; se trata aumentando el oxígeno inspirado a concentraciones del 40% mediante cánula nasal o preferiblemente máscara. La intubación y asistencia mecánica estarían indicadas si la hipoxemia no se corrige con las medidas anotadas anteriormente. Cierre de la pared La relaparotomía planeada o la laparostomía (abdomen abierto), se encuentran reservadas para aquellos pacientes con severas infecciones intraabdominales; la gran mayoría de los pacientes pueden cerrarse en el primera acto quirúrgico, la aponeurosis debe cerrarse con puntos separados de monofilamento y en ocasiones se requiere la colocación de puntos antitensión para prevenir la dehiscencia de la sutura. Un aspecto técnico importante es la precaución de incluir segmentos amplios de los bordes de la herida para prevenir la dehiscencia de las suturas. No debe aproximarse el tejido celular subcutáneo y la piel se aproxima con suturas para cierre primario diferido, una vez que se ha obtenido la esterilización mediante curaciones periódicas de la pared abdominal contaminada. 48 Ministerio de Salud Secretaría de Políticas, Regulación y Relaciones Sanitarias Administración Nacional de Laboratorios en Institutos de Salud Instituto Nacional de Epidemiología "Dr. Juan H. Jara" Programa de Prevención y Control de Infecciones Hospitalarias FIGURA 1 DIAGRAMA DE LOS POSIBLES MECANISMOS QUE SE SUPONE LLEVA A LA FORMACION DE ADHERENCIAS DE FIBRINA PARA LA LOCALIZACION DE LA INFECCION Lesión Peritoneal Células Mesoteliales (mastocitos) Libert. Histam Erot, etc Permeabil. Bloqueo Células mesoteliales Tromboplastina Trombina Células mesoteliales Protrombina Plasmina Exudac. rico en Proteinas y Fibrinógeno Fibrina Activadores Plasminogeno Product. de degradac. Fibrina Adherencias Fibrinosas Adherencias Fibrosas De Hau T Payne W.D y Simmons R.L. Surg Gynecol.Obstet. 148, 415, 1979 49 Ministerio de Salud Secretaría de Políticas, Regulación y Relaciones Sanitarias Administración Nacional de Laboratorios en Institutos de Salud Instituto Nacional de Epidemiología "Dr. Juan H. Jara" Programa de Prevención y Control de Infecciones Hospitalarias FIGURA 2 DIAGRAMA DE LA RESPUESTA PERITONEAL A LA INFECCION Contaminación Peritoneal Movimientos Diafragmáticos Activación del complemento Lesión célula peritoneal Lesión mesotelial Degranulación mastocito Quimiotaxis Absorción por linfat. Diafrag. Liber. Histam. Serot. Sust. Vasoact. Permeabil. vascular Exudac. rico en Proteinas y fibrinógeno Circulación Sistémica Localización (abceso) Llegada de PMN Opsonización Fagocitosis Muerte de las bacterias De Hau, T; Ahrenholz D. Y Simmons R.L Curr.prob.Surg., 16,1,1979 Modificado De Hau, T; Ahrenholz D. Y Simmons R.L Secundari bacterial Peritonitis: The biologic basis of treatment in: Current Problems in Sugery. Vol. 14(1). Year Book Medical Publishers, Chicago, p.5 - 65, 197 50 Ministerio de Salud Secretaría de Políticas, Regulación y Relaciones Sanitarias Administración Nacional de Laboratorios en Institutos de Salud Instituto Nacional de Epidemiología "Dr. Juan H. Jara" Programa de Prevención y Control de Infecciones Hospitalarias Bibliografía • ALMEIDA FILHO, Naomar. Epidemiología sin números. Washington: OPS Serie Paltex Nº 2; 1992. • BANTA, David. Aplicaciones de la epidemiología en la evaluación de la tecnología médica, Documento del Seminario Usos y Perspectivas de la Epidemiología, Publicación Nº PNSP 84-47. Buenos Aires: OPS. p, 199-208. • BEAGLEHOLE, R., BONITA, R. KYELLSTRÖM. Epidemiología Básica. Washington: OPS, Serie Paltex; 1994. • CASTELLANOS, P.L. Sobre el concepto de salud y enfermedad - Descripción y explicación de la situación de salud. Vol. 10, Nº 4. Washington: OPS, Boletín Epidemiológico; 1990.p. 1-74 • CASTILLO, M.. Método Epidemiológico. La Habana: Ed. Pueblo y Educación; 1984. p, 10-24 • DEVER, Alan. Epidemiología y Administración de Servicios de Salud. Washington: OPS; 1991. p. 4-7 • GONZALEZ OCHOA, E.; OCHOA SOTO, R.; ARMAS PEREZ, L. Fundamentos de la Epidemiología en Atención Primaria de Salud. La Habana; 1996. • JENICEK, Milos. Epidemiología. Principios, técnicas y aplicaciones. Barcelona: Ed. Masson .1994. p. 810 • JENICEK, Milos. Epidemiología. La Lógica de la medicina moderna. Barcelona: Ed. Masson; 1996.p. 1227-139 • KELMEDI DE UESTARAN, Joseba. Epidemiología. 1ra. Edición. Buenos Aires: Ed. Eudeba; 1992.p. 35-39 • LILIENFELD, A.; LILIENFELD, D. Colección Ciencias de la Salud.Capítulo XII. Ed. Fondo Educativo Interamericano, edición en español; 1983.p. 260-287 • LITVAK, J.; RUIZ, L.; RESTHEPO, H.; MC ALISTER, A. El problema creciente de las enfermedades no transmisibles en desafío para los países de las Américas. Vol. 103 Nº 5. Washington: Boletín OPS; 1987 • LOSSA, Guillermo - Infecciones Institucionales: Concepto y Magnitud de Infecciones - Boletín Informativo Nº 16, FECLIBA, Buenos Aires, 1989 • LOSSA, Guillermo - Limitaciones en la Prevención y Control de Infecciones Institucionales - Boletín Informativo FECLIBA, Buenos Aires, 1990 • MAZZAFERO, Vicente Enrique. Medicina en salud pública. 2da. Edición. Buenos Aires: Ed. El Ateneo; 1994. • OPS. Promoción de la Salud: una antología. Publicación científica Nro. 557. Ottawa: Ed. Organización Mundial de la Salud/ Canadian Public Health Association, Chapter for Health Promotion; 1986. • ROSE, G. Individuos enfermos y poblaciones enfermas, en: Breck C., Llopis A., Nájera E., Terris M., “El desafío de la epidemiología”. Washington: OPS; 1988.p. 900-909 51 Ministerio de Salud Secretaría de Políticas, Regulación y Relaciones Sanitarias Administración Nacional de Laboratorios en Institutos de Salud Instituto Nacional de Epidemiología "Dr. Juan H. Jara" Programa de Prevención y Control de Infecciones Hospitalarias • ROTHMAN, K. Epidemiología Moderna. Ed. Díaz Santos; 1988. • SAN MARTIN, Hernán. La Crisis Mundial de la Salud. 2da. Edición. Madrid: Ed. Ciencia 3; 1985.p. 491-493 • SUAREZ OJEDA, Elbio Néstor. El concepto resiliencia comunitaria desde la perspectiva de la Promoción de la salud, Medicina y Sociedad, Vol. 19 Nº 1 Enero/Marzo; 1996.p. 18-27 • TERRIS, M. Promoción de la salud: una antología. Conceptos de la promoción de la salud: dualidades de la teoría de salud. Pub. Científica Nro. 557. Washington: OPS; 1996.p. 37 • TERRIS, M. La Epidemiología y el liderazgo en Salud Pública. Vol. 10, Nº 1. Washington: OPS, Boletín Epidemiológico; 1989. 52 Ministerio de Salud Secretaría de Políticas, Regulación y Relaciones Sanitarias Administración Nacional de Laboratorios en Institutos de Salud Instituto Nacional de Epidemiología "Dr. Juan H. Jara" Programa de Prevención y Control de Infecciones Hospitalarias Bibliografía ▪ AHRENHOLZ D., SINIMORIS R.L,, Peritonitis y otras infecciones intraabdominales. En. Simmons R. L., Howard, R. J.: Infecciones Quirúrgicas, 1º Ed. Barcelona. Salvat Editores S.A. 817 - 863. 1984 ▪ ALTEMIER WA., CULTBERSON, WR.,FULIEN, WD., SHOOK, C.D.: Intraabdomial Abcesses Am.J.Surg.,125:70,1973 ▪ AUTIO V. : The spread of intraperitoenal infection). Studie swith roentgen contrast medium. Acta Chir Scand 123 [Suppl 32): 5, 196.4 ▪ Antimicrobial prophylaxis in surgery. Med Lett Drugs Ther 1993:35:91-4 ▪ BANG NU. Diagnosis and management of bleedig disorders. En:Shoemaker WC, Ayres S, Grenvik A, et al. Textbook of Critical Care. 2a Ed. WB Saunders Company, Filadelfia: 869 - 886, 1989 ▪ BRYAN CS, DEW CE, REYNOLDS KL, Bacteremia associated with decubitus ulcers, Arch Intern Med 1983; 143:2093-5. ▪ BONE RC, FISHER CJ, CLEMMER TP Sepsis Syndrome: A valid clinical syndrome. Cri Care Med 17; 390: - 393, 1989. ▪ BONE RC, et al. ACCP/SCCIN/Consensus Conference. Chest 101 (6): 1644 -1658, 1992. ▪ BROWN J, GROSSO M, HARKEN A. Cytokines, Sepsis and the surgeon. Surg Gynecol Obstet 169: 568 572, 1989. ▪ CAREY LC, CLOUTIER CT, LOWERY BD. Gromwth hormona and adrenal cortical response to shock and trauma in humans. Ann Surg 174: 451-458, 1971. ▪ CLASSEN DC, EVANS RS, RESTOMIK SL. ET AL. The timing of prophylactic administration of antibiotics and the risk of surgical wound infection. N Engl J. Med 1992:326:281-6 ▪ CRAVEN DE. STEGER KA. DUNCAN RA. Prevention and control of nosocomial pneumonia. In: Wenzel RP. Editor. Prevention and control of nosocomial infections. 3rd ed. Baltimore. MD: Williams and Wilkins; 1997. ▪ CARRICO CJ, MEAKINS J, MARSHALL JC. Multiple organ failure syndrome. Arch Surg 21: 196 - 208, 1986. ▪ CERRA FB, Hypermetabolism, organ failure and metabolic support. Surgery 10 1 (1): 1 - 14, 1987. ▪ CERRA FB, UPSON D, ANGELICO R, ET AL. - Branched chains support postoperative synthesis. Surgery 02: 192 - 199, 1982. ▪ CLOWES GHA, O'DONNELL TF, BLACKBURN G. Energy metabolism and proteolysis in traumatized and septic man. Surg Clin North Am 56: 1169 - 1172, 1976. ▪ Centers for Disease Control and Prevention. Guideline for prevention of nosocomial pneumonia. Infect Control Hosp Epidemiol 1994:15:587-627. ▪ DE LA HOZ J. Síndrome de Múltiples Fallas de Organos. Cirugía y Hospital. Schering Plough S.A. 2: 7 - 9, 1993. 53 Ministerio de Salud Secretaría de Políticas, Regulación y Relaciones Sanitarias Administración Nacional de Laboratorios en Institutos de Salud Instituto Nacional de Epidemiología "Dr. Juan H. Jara" Programa de Prevención y Control de Infecciones Hospitalarias ▪ DEMLING RH, LALONDE C, IKEGAMI K. Physiologic support of the septic patient. Surg Clin North Am. 74 (3) 637 - 658, 1994. ▪ EDMOND MB, WENZEL RP, PASCULLE AW, Vancomycin-resistant Staphylococcus aureus: perspectives on measures needed for control, Ann Intern Med 1996; 124: 329-34. ▪ FLETCHER JR, RAMWEEL WR. Prostaglandins in shock. To give or to block. Adv Shock Res 3:57 - 63, 1980. ▪ GREENBERG R S, DANIELS S.R, FLANDERS W.D., ELEY J.W., BORING J.R. Epidemiología Médica - Ed. Manual Moderno - Capítulo 12 pág. 199-209 ▪ GIROIR BP Mediators of septic shock: New approaches for interrupting the endogenous inflamatory cascade. Crit Care Med 21(5): 780 - 789, 1993. ▪ GIBBS WN, CORCORAN P. Blood safety in developing countries. Vox Sang 1994:67:377-81. ▪ GROENWELD AB, BRONSVELD W, Thijs LG. Hemodinamyc determinants of septic shock. Stirgery 99: 240 - 252, 1986. mortality in human ▪ GOLDMAN DA, WEINSTEIN RA, WENZEL RP, TABLAN OC, DUMA RJ., GAYNES RP, ET AL. Strategies to prevent and control antimicrobial – resistant microorganisms in hospitals: a challenge to hospital leadership, JAMA 1996; 275: 234-40. ▪ Guidelines for Prevention of Nosocomial Pneumonia. CDC/MMWR recommendations and reports. 1997. Vol 46 RR-1. ▪ HAWKER FH, STEWART PM, BAXTER RC. Relationship of somatomiedin C/insulin - like growth factor - I levels to conventional nutritional índices in críticas ill patients. Crit Care Med 15: 732 - 739, 1987 ▪ HARALD SEIFERT, MD. Neumonias Nosocomiales. Guia para el control de infecciones en el hospital. ISID 2000. ▪ HENDERSON WR JR. Eicosanoids and Jung inflamation. Am Rev Resp Dis 135: 1176 - 1186, 1987. HELEN GIAMARELLOU, MD, Preparación Prequirúrgica del Paciente, Guía para el Control de las Infecciones Hospitalarias. ISID.2000. ▪ HERSKOWIIZ K, SOUBA WW. Intestinal glutamine metabolism during critical illnes: a surgical perspective. Nutrition 6: 199 - 206,1990. ▪ Hospital infection control practices advisory committee (HIPAC), Recommendations for preventing the spread of vancomycin resistance, Infect Control Hosp Epidemiol 1995; 16 (2): 105-113. ▪ Hospital-acquired pneumonia in adults: diagnosis, assessment of severity, initial antimicrobial therapy and preventive strategies. A consensus statement by the American Thoracic Society Am J Respir Crit Care Med 1995:153:1711-5 ▪ HUME DM, EGDAHL RH. The importance of the brain in the endocrine response to injury. Aun Surg 150: 697 - 705, 1959. ▪ JARVIS WR. COOKSON ST. ROBLES B. Prevention of nosocomial bloodstream infections: a national and international priority. Infect Control Hosp Epidemiol 1996:17:272-275. ▪ JOHNSTON C. Diabetic skin and soft tissue infections, Curr Opin Infect Dis 1994; 7:214-8. 54 Ministerio de Salud Secretaría de Políticas, Regulación y Relaciones Sanitarias Administración Nacional de Laboratorios en Institutos de Salud Instituto Nacional de Epidemiología "Dr. Juan H. Jara" Programa de Prevención y Control de Infecciones Hospitalarias ▪ KADOWITZ PJ, CHAPNIC BM, FEIGEN LP, ET AL. Pulmonary and sistemic vasodilator effects of the newly discovered prostaglandin, PGI2. J Appl Physiol 45: 953 - 962, 1977. ▪ KAHN CR. Insulin resistance, insulin insensivity, and insulin unresponsiveness: a Metabolism 27: 1893 - 1895, 1978. necesary distinction. ▪ KUNIN CM, MCCORMACK RC, Prevention of catheter-induced uninary tract infections by sterile closed drainage, N Engl Jmed 1966; 274:1155-61. ▪ LINDQUIST B. Propulsive gastrointestinal motility related to tetroperitoneal irritation. Acta Chir Scand. Suppl 384: 1 7, 1968. ▪ LONG C, BIRKAN R, GEIGER J. Contribution of skeletal muscle protein in elevated rates of whole-body protein catabolism in trauma patients Am J Clin Nut 34:1087, 1981. ▪ LUCAS CE, SUGAWA C, RIDDLE J, ET AL. Natural history and surgical dilemma of stress gastric bleeding. Arch Surg 102: 266 - 272, 1971. ▪ MACÍAS ALEJANDRO E -Infusiones y líneas intravenosas en países en desarrollo Guía para el control de Infecciones en el Hospital ISID 2000. ▪ MACIAS-HERNANDEZ AE. HERNÁNDEZ RAMOS I. MUÑOZ BARRET JM. ET AL. Pediatric primary Gram-negative nosocomial bacteremia: a posible relationship with infusate contamination. Infect Control Hosp Epidemiol 1996:17:276-280. ▪ MACÍAS AE. MUÑOZ JM. BRUCKNER DA. ET AL. Parental infusions bacterial contamination in a multiinstitutional survey in México: Considerations for nosocomial mortality, Am J Infect Control 1999:27:285290. ▪ MAKI DG. Infeccions due to infusion therapy. In: Bennett JV, Brachman PS. Sanford JP. eds. Hospital Infections. Boston: Little. Brown and Company: 1992 p. 849-892. ▪ MACHIEDO GW, POWEIL RJ, RUSH BF, ET AL. The incidence of decrease red blood cell deformability in sepsis and the association with oxygen free radical damage and multiple system organ failure. Arch Surg 124:1386 - 1389, 1989. ▪ MAKI DG, ALVARADO CJ, HASSEMER CA AND ZILZ MA- Relation of the inanimate hospital environment to endemic nosocomial infection - N. Engl J.Med 1982; 307:1562-6 ▪ MAKI DG, MERMEL LA, Infections due to infusion therapy, In; Bennett J, Brachman P, editors, Nosocomial infections, 4th ed. 1998, p. 689-739. ▪ MALANGONI MA. EDITOR. Critical issues in operating room management. Philadelphia. PA: LippincottRaven: 1997. ▪ MALAGON-LONDOÑO, G, MD - HERNANDEZ ESQUIVEL L., -Infecciones Hospitalarias - Ed. Médica Panamericana, 1995 ▪ MEAD PB. HESS SM, PAGE SD, Prevention and control of nosocomial infections in obstetrics and gynecology, IN: Wenzel RP editor. Prevention and Control of nosocomial intectious, 3º Ed. Philadelphia, PA. Williams and Wilkins. 19997 p 995-1016. ▪ MICHIE HR, MNJZOUB JA, O'DWIER ST, ET AL. Both Cyclooxigenase-dependent and cyclooxigenaseindependent pathways, mediate neuroendocrine response in human. Surgery 108:254 - 262, 1990. 55 Ministerio de Salud Secretaría de Políticas, Regulación y Relaciones Sanitarias Administración Nacional de Laboratorios en Institutos de Salud Instituto Nacional de Epidemiología "Dr. Juan H. Jara" Programa de Prevención y Control de Infecciones Hospitalarias ▪ MILESKI W, WINN R, POHLMAN T, ET AL. Inhibition of neutrophits (PMN) adherence with the monoclonal antibody (MAb) 60,3 during resuscitation from hemorrage shock in primates. surgery 108: 206 212, 1990. ▪ MORGAN RJ, MARTYN JA, PHILBIN DM, ET AL. Water metabolism and antidiuretic hormone response following thermal injury. J. trauma 20: 468 - 472, 1980. ▪ MONNET DL, ARCHIBALD LK, PHILLIPS L, TENOVER FC, MCGOWAN PE, GAYNES RP, Antimicrobial use and resistance in eight US hospitals: complexities of analysis and modeling. Infect Control Hosp Epidemiol 1998; 19 (6): 388-94. ▪ NELSOII LD. Application of venous saturationmonitoring. En: Civetta JM, Taylor RW, Kirby RR. Critica Care la. Ed. B. Lippincott Company, London 327- 334, 1988. ▪ NIETO SILVA Julio A . - MD, MSCC, FACS - Sección III - Capítulo V - Fisiopatología de la infección pág 761-772 ▪ NIETO SILVA Julio A . - MD, MSCC, FACS - Sección VIII - Capítulo XXX - Sepsis abdominal - pág 5-67 ▪ NATHENS AB, ROTSTEIN OD. Therapeutic options in peritonitis. Surg. Clin. N A. 74(3). 677 -692.1994. ▪ O'DONNELL TF JR, CLOWES GHA, TAHINO RC, ET AL. Kinins activation in the blood of patients with sepsis. Sur Gynecol Obstet 143: 539 - 566, 1976 ▪ O' KEEFE SJ, SENDER PM, JAMES WP. Catabolic loss of nitrogen in response to surgery. Lancet 2:1035 - 1042, 1974. ▪ ONDERDONK AB, WEINSTEIN WM, SULLIVAN NM, ET AL. Experimental intraabdoninal abscesses in rats: Quantitative bacieriology of infected animals. Infect Inrnun 10-. 1256,1974. ▪ PARKER MM, Shelhammer JH, Bacharach SL, et al. Profound but reversible myocardial depression in patients with septic shock. Ann Intem Med 100: 483 - 502, 1984. ▪ PEARSON ML and the Hospital Infection Control Practices Advisory Committee, Guideline for prevention of intravascular device-related infections, Infect Control Hosp Epidemiol 1996; 17: 438-73. ▪ PEGUES DA. ARATHOON EG. SAMAYOA B. ET.AL. Epidemic gram-negative bacteremia in a neonatal unit in Guatemala. Am J Infect Control 1994:22:163-171. ▪ PRINCE AM. Control of hepatitis B virus infection in third-world countries. Transfus Med Rev 1990:4:18790. ▪ PITTET D, Nosocomialbloodstream infections, In: Wenzel RP, editor, Prevention and control of nosocomial infections, 3rd ed. Baltimore, MD: Williams and Wilkins; 1997, p. 712-69. ▪ PITTET D. HARBARTH S. The intensive care unit In: Bennett J. Brachman P. editors. Nosocomial Infections. 4th ed. 1998 p. 381-402. ▪ PINSKY MR, MATSCHACK GM. Multiple sistems organ failure: Failure oh host defense homeostasis. Crit Care Clin 5(2): 199 - 220, 1989. ▪ RYAN NT Metabolic adaptations for energy production during trauma and sepsis. Surg Clin Noith Am 56: 1073 184, 1978 56 Ministerio de Salud Secretaría de Políticas, Regulación y Relaciones Sanitarias Administración Nacional de Laboratorios en Institutos de Salud Instituto Nacional de Epidemiología "Dr. Juan H. Jara" Programa de Prevención y Control de Infecciones Hospitalarias ▪ RAPPAPORT WD, HOLCOMB M, VALENTE J. Antibiotic irrigation and the formation of intraabdominal adhesions. Am J Surg 158:435, 1989 ▪ RAY MARIE-CLAUDE, MD, MSC. -Guía para el control de Infecciones en el Hospital - Publicación Oficial de la Sociedad Internacional de Enfermedades Infecciosas (ISID) - Capítulo 17, El Quirófano, - pág. 81-85 ▪ RENVALL, S., NIINIKOSKI, J.: Intraperitoneal oxygen and dioxide tensions in experimental adhesions disease and peritonitis. Am. J. Stirg.13 : 296, 1986. ▪ ROTSTEIN OD, MEAKINS JL. Diagnostic and T'herapeutic challenges of intraabdominal infections. World J Surg 14:159 - 166, 1990. ▪ ROTSTEIN OD, PRUET TL, SIMMONS RL. Microbiologic features and treatment of persistent peritonitis in patients in the intensive care unit. Can J Surg 29: 247 - 250, 1986. ▪ SIMMONS, RL., Howard, RJ.: Infecciones Quirúrgicas. 1º Ed. Barcelona Salvat Editores S.A. 817 - 963. 1984. ▪ SHAW JHF, KOEA JB. Metabolic basis for management of the septic surgical patient. World J Surg 17: 154 - 164, 1993. ▪ SCHLAES DM, GERDING DN, JOHN JF JR., CRAIG WA, BORNSTEIN DL, DUNCAN RA, ET AL, Society for Healthcare Epidemiology of America and Infectious Disease Society of America Joint Committee on the Prevention of Antimicrobial Resistance: guidelines for the prevention of antimicrobial resistance in hospitals, Infect Control Hosp Epidemiol 1997; 18 (4): 275-91. ▪ SHENCI JI, MOGAN KA, Kineties of endotoxin release during antibiotic therapy for experimental gram negative bacteria] sepsis. J Infect Dis 150: 280 - 388, 1984. ▪ SHENEP JI, FLYNN PM, BARRET FE Serial quantiation of endotoxemia and bacteremia during therapy for gram negative bacteria] sepsis. J Infect Dis 157: 565 - 568, 1988. Stein H, Hinder R, Oosthuizen M. Gastric mucosal injury caused by hemoffagic shock and reperfusion: Protective role of the antioxidant glutathione. Surgery 108: 467 472, 1990. ▪ SCHLEUPNER CS. Protecting recipients of blood and blood products, In: Wenzel RP. Editor. Prevention and control of nosocomial infections. 3 rd. ed. Baltimore. MD: Williams and Wilkins: 1997. p. 1187-214. ▪ STEPHAN HARBARTH, MD Y DIDIER PITTET, MD, infecciones nosocomiales asociadas a asistencia respiratoria mecánica. Guia para el control de Infecciones en el Hospital.ISID.2000. ▪ SOLOMKIN JS, DELLINGER EP, CHRISTOU NY Results of multicenter trial comparing imipenem/cilastin to tobramicyn/ clindarnicyn for intraabdorninal infections. Ann Surg 212: 581, 1990. ▪ TANAKA H, SUGIMOTO H, YOSMOKA T, ET AL. Ole of granulocyte elastase in tissue injury in patients with septich shock complicated by multiple organ failure. Ann Surg 213: 81-90,1991. ▪ TAHA TE, BIGGAR RJ, BROADHEHEAD RL, ET AL, Effect of cleansing the birth canal with antiseptic solution on maternal and newborn morbidity and mortality in Malawi. Clinical trial.BMJ 1997: 315: 216-20. ▪ The American Thoracic Society. Hospital-acquired pneumonia in adults: diagnosis, assessment of severity, inicial antimicrobial therapy, and preventive strategies. Am J Respir Crit Care Med 1995: 153: 1711-25. ▪ TRILLA A, MIRÓ JM, Identifying high – risk patients for Staphylococcus aureus infections; skin and soft tissue infections, J Chemother 1995; 7:27-33. ▪ TIMOTHY F. BREWER, MD, MPH, Transfusiones de Sangre y Líquidos Intravenosos en Países en Desarrollo. Guia para el Control de Infecciones Hospitalarias ISID 2000. 57 Ministerio de Salud Secretaría de Políticas, Regulación y Relaciones Sanitarias Administración Nacional de Laboratorios en Institutos de Salud Instituto Nacional de Epidemiología "Dr. Juan H. Jara" Programa de Prevención y Control de Infecciones Hospitalarias ▪ VAQUE J, ROSSELL UJ, TRILLA A ET AL, Nososcomial infections in Spain; results of five serial prevalence surveys, Infect Control Hosp Epidemiol 1996; 17:293-7. ▪ VINDENES H, BJERKNES R. Activation of polimorphonuclear neutrophilic granulocytes following by injury: Alteration of FC receptor and complement - receptor expression and of opsonophagocytocis. The J of trauma 30 (2): 61 - 67, 1994. ▪ VISNER MC, CERRA FB, ANDERSON RW. Respuestas hemodinámicas y metabólicas. En: Simmons, RL., Howard, RJ.: Infecciones Quirúrgicas. 11 Ed. Salvat Editores S.A., Barcelona, 342, 1984. ▪ WARDEL EN. Kupffer cells and their function. Liver 7: 63 - 75, 1987. ▪ WEBER DJ AND RUTALA WA - Environmental issues and nosocomial infections. In: Wenzel RP, editor Prevention and control of nosocomial infection .3rd ed. Baltimore. MD: Williams and Wilkins; 1997: 491-514. ▪ WAREN JW. Urinary tract infections, In: Wenzel RP, editor Prevention and control of nosocomial infections, 3rd ed. Baltimore, MD; Williams and Wilkins; 1997, p. 821-40. ▪ WEISS S. Tissue destruction by neutrophils. N Eng J Med 320: 365 - 376, 1989. ▪WENZEL RP, Preoperative antibiotic prophylaxis. N Engl’J Med 1992; 236: 337-9. ▪WENDT CONSTANZE, MD, M Guía para el control de Infecciones en el Hospital - Publicación Oficial de la Sociedad Internacional de Enfermedades Infecciosas (ISID) - Capítulo 12, Areas de Atención de Pacientes, pág. 59-64 ▪WENZEL R, NETTLEMAN M, JONES R, PFALLER M, Methicillin-resistant Staphylococcus aureus: implications for the 1990s and affective control measures, Am J Med 1991; 91:221S-7S. ▪ WILMORE D, LINDSEY CA,. MOYLAN JA, ET AL. Hyperglucagonemia after bums. Lancet 1: 73 - 81, 1974. ▪ WITTMAN DE.: Intraabdominal Infections. Pathophysiology and treatment, Hoechts Aktiengesellschaft, Frankfurt, West Germany. 1991. ▪ WONG ES, guideline for prevnetion of catheter-associated urinary tract infections, Am J Med 1983; 11: 2836. ▪ YATRS RR, New intervention strategies for reducing antibiotic resistance, Chest, 1999; 115 (3 Suppl.): 24S27S. ▪ ZAIDI M. SIFUENTES J. BOBADILLA M. ET AL. Epidemic Serratía marcescens bacteremia and meningitis in a neonatal unit of México city, Infect Control Hosp. Epidemiol 1989:10:14-20. ▪ ZALOGA GP, WASHBUM D, BLACK KW, ET AL. Human sepsis increase lymphocite intracelular calcium. Crit Care Med 21(2): 196 - 202, 1993. 58