Dispo_0189-10
Anuncio

t
"2010 ~ Afio del bicentenario de la revolución de Mayo"
Ministerio de Salud
Secretaría de Políticas,
Regulación e Institutos
A.N.M.A.T.
BUENOSAIRESPr5
ENE 2010
VISTO e\ Expediente N° \-0047-0000-004\85-03-0 del Registro de esta
Administración Nacional de Medicamentos, Alimentos y Tecnologla Médica (ANMAT), y
CONSIDERANDO:
Que por las presentes actuaciones SAV ANT PHARM S.A. solicita se autorice
la inscripción en el Registro de Especialidades Medicinales (REM) de esta Administración
Nacional, de una nueva especialidad medicinal, la que será elaborada en la República
Argentina.
Que de la misma existe por lo menos un producto similar registrado y
comercializado en la República Argentina.
Que las actividades de elaboración y comercialización de especialidades
medicinales se encuentran contempladas por la Ley 16.463 y los Decretos 9.763/64, 1.890/92,
y 150/92 (T.O. Decreto 177/93), y normas complementarias.
Que la solicitud presentada encuadra en el Artículo 30 del Decreto 150/92 (T.O.
Decreto 177/93).
Que consta la evaluación técnica producida por el Departamento de Registro.
Que consta la evaluación técnica producida por el Instituto Nacional de
\\
Medicamentos, en la que informa que el producto estudiado reúne los requisitos técnicos que
"2010 - Afto del bicentenario de la revolución de Mayo"
I
Ministerio de Salud
Secretaria de PoIlticas,
Regulación e Institutos
A.N.M.A.T.
contempla la norma legal vigente, y que los establecimientos declarados demuestran aptitud
para la elaboración y el control de calidad del producto cuya inscripción en el Registro se
solicita.
Que consta la evaluación técnica producida por la Dirección de Evaluación de
Medicamentos, en la que informa que la indicación, posología, vía de administración,
condición de venta, y los proyectos de rótulos y de prospectos se consideran aceptables y
reúnen los requisitos que contempla la nonna legal vigente.
Que los datos identificatorios característicos a ser transcriptos en los proyectos
de la Disposición Autorizante y del Certificado correspondiente, han sido convalidados por
las áreas técnicas precedentemente citadas.
Que la Dirección de Asuntos Jurídicos de esta Administración Nacional,
dictamina que se ha dado cumplimiento a los requisitos legales y formales que contempla la
normativa vigente en la materia.
Que corresponde autorizar la inscripción en el REM de la especialidad
medicinal objeto de la solicitud.
Que se actúa en virtud de las facultades conferidas por los Decretos 1490/92 y
253/08.
Por ello;
EL INTERVENTOR DE LA ADMINISTRACIÓN NACIONAL DE
MEDICAMENTOS, ALIMENTOS Y TECNOLOGÍA MÉDICA
DISPONE:
"2010· Año del bicentenario de la revolución de Mayo"
ro 1 8 9
[")í,'::-P:'I':-;V'l('I'\!
~,]n
",",.' ,
"
Ministerio de Salud
,
Secretaría de Políticas,
Regulación e Institutos
A.N.M.A.T.
ARTICULO 1°· Autorizase la inscripción en el Registro Nacional de Especialidades
,",
Medicinales (REM) de la Administración Nacional de Medicamentos, Alimentos y
Tecnologla Médica de la especialidad medicinal de nombre comercial NORFLOXACINA
SAVANT PHARM Y nombre/s genérico/s NORFLOXACINA, la que será elaborada en la
República Argentina, de acuerdo a lo solicitado, en el tipo de Trámite N° 1.2.1, por SAVANT
PHARM S.A. con los Datos Identificatorios Caracteristicos que figuran como Anexo 1 de la
presente Disposición y que forma parte integrante de la misma.
ARTICULO 2°
M
Autorizanse los textos de los proyectos de rótulo/s y de prospectols
figurando como Anexo II de la presente Disposición y que forma parte integrante de la
misma.
ARTICULO 3
D
-
Extiéndese, sobre la base de lo dispuesto en los Articulos precedente!>, el
Certificado de Inscripción en el REM, figurando como Anexo III de la presente Disposición y
que forma parte integrante de la misma.
ARTICULO 4° • En los rótulos y prospectos autorizados deberá figurar la leyenda:
ESPECIALIDAD MEDICINAL AUTORIZADA POR EL MINISTERIO DE SALUD
CERTIFICADO N°
, con exclusión de toda otra leyenda no contemplada en la
norma legal vigente.
ARTICULO 5°· Con carácter previo a la comercialización del producto cuya inscripción se
autoriza por la presente disposición, el titular del mismo deberá notificar a esta
Administración Nacional la fecha d~ inicio de la elaboración o importación del primer lote a
•
comercializar a'los fines de realizar la verificación técnica consistente en la constatación de la
capacidad de producción y de control correspondiente.
,
"2010 - Año del bicentenario de la revolución de Mayo"
Ministerio de Salud
Secretaría de Políticas,
Regulación e Institutos
lO 1 8 9
A.N.M.A.T.
ARTICULO 6° - La vigencia del Certificado mencionado en el Artículo 3° será por cinco (5)
años, a partir de la fecha impresa en el mismo.
ARTICULO 7° - Regístrese. Inscríbase en el Registro Nacional de Especialidades
Medicinales al nuevo producto. Por Mesa de Entradas notiflquese al interesado, haciéndole
entrega de la copia autenticada de la presente Disposición, conjuntamente con sus Anexos 1, II
Y 1Il. Gírese al Departamento de Registro a los fines de confeccionar el legajo
correspondiente; cumplido archivese.
EXPEDIENTE N": 1-0047-0000-004185-03-0
DISPOSICIÓN N°:
OIB 9
"2010 - Afio del bicentenario de la revolución de Mayo"
6
Ministerio de Salud
Secretaría de Políticas,
Regulación e Institutos
A.N.M.A.T.
ANEXO 1
DATOS IDEmIFICATORIOS CARACTERÍSTICOS DE LA ESPECIALIDAD
MEDICINAL INSCRIPTA EN EL REM MEDIANTE DISPOSICiÓN ANMAT W:
lO 1 8 9
Nombre comercial: NORFLOXACINA SA VANT PHARM.
Nombre/s genérico/s: NORFLOXACINA.
Industria: ARGENTINA.
Lugar/es de elaboración: RUTA NACIONAL 19 KM. 204, EL TIO, PROVINCIA DE
CORDOBA.
Los siguientes datos identificatorios autorizados por la presente disposición se detallan a
continuación:
Forma fannacéutica: COMPRlMIDO RECUBIERTO.
Nombre Comercial: NORFLOXACINA SAVANT PHARM.
Clasificación ATe: JOIMA06.
Indicación/es autorizada/s: INFECCIONES AGUDASY CRÓNICAS, COMPLICADAS Y
SENCILLAS, DEL TRACTO URINARIO SUPERIOR E INFERIOR: CISTITIS, PIELITIS,
CISTOPIELITIS, PIELONEFRITIS, INFECCIONES DEL TRACTO URINARIO DEPUES
DE
LAS
INTERVENCIONES
UROLÓGICAS,
VEJIGA
NEUROGENA
y
NEFROLlTlASIS CAUSADAS POR GERMENES SENSIBLES A LA NORFLOXACINA.
) t
"2010 - Año del bicentenario de la revolución de Mayo"
16
Ministerio de Salud
Secretaría de Polfticas,
Regulación e Institutos
A.N.M.A.T.
GASTRO ENTERITIS BACTERIANA
AGUDA
A
GERMENES
SENSIBLES.
GONOCOCCIA URETRAL. DE CUELLO DE UTERO O ANO RECTAL CAUSADAS
POR
CEPAS
DE
NEISSERIA
GONORRHOEAE
QUE
PRODUCEN
O
NO
PENICILINASA. PARA LA PROFILAXIS DE: SEPSIS, EN GRANULOCITOPENIA
MARCADA (DEFINIDOS EN LOS ESTUDIOS CLINICOS SOBRE LA BASE DE UNA
CONCENTRACION DE 100 GRANULOCITOS / MM3 DURANTE UNA SEMANA O
MAS).
Concentración/es: 400 rng. de NORFLOXACINA.
Fórmula completa por unidad de forma farmacéutica ó porcentual:
Genérico/s: NORFLOXACINA 400 mg.
Excipientes: ESTEARATO DE MAGNESIO 5.00 mg, DlOXIDO DE TITANIO 4.3 rug,
HIDROXIPROPILMETILCELULOSA 28.8 mg, GLICERINA 4.00 mg, AC-Dl-SOL 10.00
mg, CELULOSA MICROCRISTALINA 105.00 rug, TARTRAZINA 0.2 rug.
Origen del producto: SINTÉTICO O SEMISINTÉTICO.
VíaJs de administración: ORAL.
Envase/s Primario/s: BLISTER DE AUPVC.
Presentación: BLISTER CONTENIENDO 8, 16, 24, 32, lOO, 250,
500 Y 1000
COMPRIMIDOS, SIENDO LAS ULTIMAS CUATRO DE USO HOSPITALARIO.
Contenido por unidad de venta: BLISTER CONTENIENDO 8, 16,24, 32, 100,250, 500 Y
1000 COMPRIMIDOS, SIENDO LAS ULTIMAS CUATRO DE USO HOSPITALARIO.
Período de vida útil: 24 MESES.
Forma de conservación: TEMPERATURA AMBIENTE - PROTEGER DE LA LUZ Y LA
"2010 - Afio del bicentenario de la revolución de Mayo"
i
Ministerio de Salud
Secretaría de Políticas,
Regulación e Institutos
A.N.M.A.T.
HUMEDAD; hasta: 30 oc.
Condición de expendio: BAJO RECETA ARCHIVADA.
DISPOSICIÓN N°:
~\
18 9
"20tO - Afio del bicentenario de la revolución de Mayo"
6
Ministerio de Salud
Secretaría de Políticas,
Regulación e Institutos
A.N.M.A.T.
ANEXO 1I
TEXTO DEULOS RÓTULO/S y PROSPECTO/S AUTORIZADO/S
DE LA ESPECIALIDAD MEDICINAL INSCRIPTA EN EL REM MEDIANTE
DISPOSICIÓN ANMAT W
E!RQYECTO DE pROSPECTO Y/O INFORMACiÓN PARA EL PACIENTE
•
I
NO FLO
AV
101 8 9
PHARM
CNA
Comprimidos .-.cubiertos 400 mg
Venta bajo receta archivada
Industria Argentina
Fórmula cuall-cuantltatlva:
Cada comprimido recubierto contiene:
Norfloxacina ....................................... 400 mg
Excipientes: estearato de magnesio 5 mg; ac-di-soI10 m'g; celulosa microcrlstalina 105
mg; hidroxipropllmetilcelulosa 28.8 mg; glicerina 4 mg; dióxido de titanio 4,3 mg;
tartrazina 0,2 mg.
i'
terapéutica:
J ~clón
~ntibacterlano qulno16nico de amplio aspe t.
1;
'r. tndleaclone.:
'
,
' 1
Infecciones agudas y crónicas, complicadas y sencillas. del tracto urinario superior e
inferior: cistitis, pialitis, clstopielltis, pielonefrltis, infecciones del tracto urinario después
de las intervenciones urológicas. vejiga neurógena y nefrolitlasis causadas por
gérmenes sensibles a la norfloxacina.
Gastro-enterltis bacteriana aguda a gérmenes sensibles.
Gonococcla uretra~ de cuello del útero o ano-rectal causada por cepas de Nelsseria
gonorrhoeae que producen o no penlcllinasa.
Para la profilaXis de:
Sepsls, en granulocitopenla marcada (definidos en los estudios cllnlcos sobre la base
de una concentración de 100 granuI6c1tos/mm~ durante una semana o más) en estos
pacientes, la notiloxaclna InhIbe la flora intestinal endógena aeróbica y puede inducir la
sepsis (por ejemplo, en leucemia tratada con quimioterapia).
;:l:=~~~:~.
acción
1:
i
:- La norfloxacina 8S un derivado del ácido q lnoleocarboxilico, a~tibacterlano sustancia
.)
administrada por vla oral.
El espectro antibacterlano In vltro de norfloxacina cubre aeróbltos gram-posltlvos y
gram-negativos.
Norfloxacina Inhibe la sfntesis bacteriana del ácido desoxinibonucleico, que es la acción
bactericida. A nivel molecular, que se atribuyó a tres procesos norfloxacina especlflcos
para Escherichia coli:
Desarrollo de la resistencia (la frecuencia y el mecanismo)
12
Resistencia a la mutación espontánea 8S rara norfloxaclna (rango 10. a 10"9).
Por su estructura especifica, norfloxacina actOa en determinados microorganismos
resistentes a otros ácidos orgánicos, como el ácido nalidixlco, el ácido oxálico y ácido
pipémidico y la cinoxacina y f1umequina. Resistencia In vitro con respecto a la media
norfloxaclna también expresó su resistencia a los ácidos orgánicos. Los estudios
,,
'"1'I" ,
_1"
r"
,
/Y.c I
O"'N~T08~
MA~O
nIRFrT~~~O
preliminares que sugieren que las bacterias resistentes a la norfloxacina son tambi
los pefloxaclna, ofloxaclna, ciprofloxaclna y enoxacin.
Norfloxacina carece de resistencia cruzada con sustancias estructuralmente no
relaclonados, tales como penicilinas, cefalosporinas, tetraciclinas, macrólldos,
amlnociclitols, sulfamldas, 2-4-DIAMINOPYRIMIDINA o sus asociaciones (por ejemplo,
cotrimoxazol).
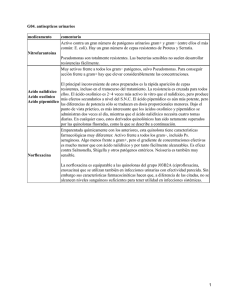
Espectro de actividad antimicrobiana in vitro de norfloxacina
Todos los ensayos clínicos han encontrado una correlación fiable entre las pruebas de
sensibilidad in vitro y la eficacia clínica y bacteriológica.
Algunas cepas de Nelsseria gonorrhoeae han demostrado resistencia a norfloxacina,
.. ~8peclalmente los de Asia sudorlental y el Raclfico.
Con la excepción de Clostrldlum perfrlngens, norfloxacina carece de actividad sobre los
tipos de enaeróblca Actlnomyces spp. Fusobacterium spp., Becteroldes spp. y
Clostridum spp.
Evaluación de la sensIbilidad. Le recomendamos que ut\1ice el esténdar de disco
aprobado por la FDA (antes Kirby-Bauer) para el estudio de la sensibilidad a los
antibióticos; seleccione los discos de 10 ¡Jg, con un diámetro de 6 mm.
Sensibilidad de estos criterios se han definido a partir de microorganismos aislados en
muestras de heces y orina.
En general, los valores límite para probar la sensibilidad para distinguir entre los
patógenos susceptibles (5) y resistentes (R) son:
5 s 4 ¡Jg I mi, R il:: 16 ¡Jg Iml.
No se establece limite alguno para Neisserla gonorroeae.
Fannacoclnétlca
.. Absorción
.
Norfloxacina administrado por vía oral se absorbe rápidamente. Se estableció que en
voluntarios sanos de una dosis oral de norfloxaclna se absorbe a un ritmo de 30 a 40%,
como mlnimo. El suero obtenido una hora despun de una dosis de 400 mg es de 1,5
g/mI.
~'. ,
DistribucIón
.....
La media de las concentraciones señaladas en cHversos tejidos y Ifquldos de 1 a 4 horas
después de la administración de 2 dosis de 400 mg fueron los siguientes:
Tejido renal 7,3 ¡Jglg.
Próstata 2,5 ¡Jg/g.
•
Fluido seminal 2,7 !JgJg.
Testlculos 1 ,6 !Jg/g.
Útero I cérvix 3,0 IJglg.
Vagina 4,3 !Jg/g.
Trompas 1,9 IJg/g.
Vesícula billar 1,8 j.lg/g. (medido 4--6 horas después de una dosis única de 400 mg).
Bilis 6,9lJg/g. (después de la administración de 2 )( 200 mg).
La concentración biliar puede llegar a un nivel hasta 10 veces superior a la
correspondiente concentración sérica.
'
Unión a proteinas de norfloxacina es de 10 a 15%.
Metabolismo/Eliminación
La vida media sMca promedio es de 3 ó 4 horas y es independiente de la dosis.
Norfloxacina se metabollza y excreta por la bilis y la orina. La actividad antlmicroblene
mide un promedio de112, 24 y 48 horas después de una dosis de 400 mg de
norfloxacina correspondió respectivamente a 278. 773 Y 82 9 de norfloxaclna por gramo
,
10 1 8 9
....ltM-A.)'
~~
de heces. La excreción renal se produce por filtración glomerular y secreción tubular, lo ~/
que resulta en un mayor clearance renal (275 ml/mln aprox.).
!~ ~ 6 3 horas después de una dosis de 400 ~a voluntarios sano,s, la concentración
li tM"inarla alcanzó 200 ~g/g.
o más y supera
s de 30 IJg/ml du'rante 12
'f¡ ~ntldad de sustancia que se encuentra en
:' 33848%.
horas. la
a! orina durante las primeras 24 horas es de
¡
Norfloxacina se pone de relieve en la orina de forma Inalterada y seis metabolltos
activos de la eficacia antimicrobiana pero menos marcada, la proporción de la misma
sustancia que representan más del 70% del importe total de excreta. La actividad
bactericida de norfloxacina no es influenciada por el pH urinario.
Cinética en situaciones cllnlcas especificas
En voluntarios sanos de 65 a 75 aFios con fundón renal normal, pero fisiOlógicamente
afectado por razón de edad, la eliminación de la norfloxaclna es ligeramente más lento,
pero la absorción de norfloxacina no parece que se influye. La semlvida eficaz de
norfloxacina en ancianos es de 4 horas.
La farmacoclnétlca de la norfloxaclna evaluados después de una dosis de 400 mg de
norfloxacina era prácticamente idéntica en pacientes con clearance de creatlnlna
superior a 30 mVmin y en voluntarios sanos. La eliminación renal fue significa1ivamente
reducida cuando el clearance de creattnlna inferior a 30 mI/m in. En estos pacientes. el
~"lWero de vida media puede llegar a 8 horaslq más. La insuficienpia renal no parece
n: afectar la absorción de la norfloxacina. ' '
•"
•
. t"
1:
Poaologla:
Dosis habitual
Tratamiento
La sensibilidad a la norfloxaclna de los gérmenes en cuestión deben someterae a
prueba. El tratamiento puede ser aplicado antes de la obtención de resultados.
En las infecciones del tracto urinario, la dosis normal para adultos es de 400 mg de
norfloxacina 2 veces/dla, en 1 hora antes ó 2 horas daspués de una comida.
Un tratamiento de 3 dlas fue eficaz en la clstltis aguda no complicada en las mujeres.
En Infecciones urinarias crónicas a repetición, administrar 400 mg de norfloxacina 2
veces por dla durante un máximo de 12 semanas. Si se observa un resultado
bacteriológico favorable durante las primeras 4 semanas, la dosis de norfloxacina podrá
reducirse a 400 mg/dia.
1: La dosis habitual en la gastroenteritis bacte~na aguda es de 4QO mg de norfloxac1na 2
::~ yeces por día durante 5 dlas.
:
I
.
't En uretritis gonocóclca aguda, ano-rectal y
icltls admlnlstrar,800 mg de norfloxacma
como una dosIs única.
Esta dosis puede ser insuficiente para elimihar la infección concomItante con Clamydia
o Mycoplasma o para el tratamiento de uretritis post-gonoc6cica.
i:
Profilaxis
En caso de neutropenia severa, la dosis recomendada para prevenir la sepsis es de 400
mg tres veces al dla hasta una tasa de reaparición de los granulocltos neutrófilos
satisfactoria. Sin embargo, todavla no hay información para asesorar a la continuación
del tratamiento durante más de 8 semanas.
Oasis especiales:
Insuficiencia Renal:
Estudios en pacientes con clearance de creatinina inferior a 30 ml/min/1, 73 m~ y sin
hemodiálisis han demostrado que la vida media en plasma fue de aproximadamente 8
horas. Los estudios cl[nicos han sido capaces de poner de relieve las diferencias entre
~¡:. ,
.
;.
,
",
,/V~:
~~
MAY\Co
DJRECTO~~~~~
O1 8 9
('
la vida media de norfloxaclna si el clearance de creatinina es Inferior a 10 ml/min/1,73
m2 y la vida media en el caso de clearance de creatinina de 10 a 30 ml/min/1, 73 m 2 .
~
~8...,
...~oS'.. Df.J...:~.¡t.
, 1: ~or consiguiente, se recomiend~ en estos ~~Ie.ntes la administración de 1 comprimido
11. de 400 mg por dla. En esta dOSIS, la conee tr.ación de norfloxacina en los principales
r; ~jidos o fluidos del cuerpo excede la CIM la mayorla de las bacterias sensibles al
." principio actlvo.,~
No hay suficiente Información para el tratamiento de pacientes con clearance de
creatlnina Inferior a 10 ml/min/1 ,73 m2 ,
La experiencia también es insuficiente para recomendar una dosis en el caso de la
gonorrea en clearance de creatinina de 30 ml/mln/1, 73 m2 o menos.
Las posibilidades de empleo en la fiebre tifoidea si el clearance de creatlnina es Inferior
a 30 ml/minl1, 73 m" no están documentadas.
Forma d. administración
La norfloxacina debe tomarse al menos una hora antes ó 2 horas después de comer o
beber leche. En caso de preparados multivltaminicos o de otras preparaciones que
contengan hierro y/o zinc, antiácidos con hidróxido de magnesio y/o aluminio o
sucralfato como dldanosina (Vldex), deben ser administrados al menos 2 horas antes o
después de tomar norfloxaclna.
'¡ ~ntralndlcaclon.s:
ti
.j¡ Pacientes sensibles a la droga o a antibact
rlanos quino lógicas.
,seientes hipersenslbles a los colorantes
azoicos, ácido acetilsallcilico y antirreumáticos y analgésicos (los Inhibldores de la
prostaglandlna) no deben usar norfloxaclna.
Nor11oxacina está contraindicada en caso de anuria.
Nlf'los:
No utilice norfloxacina en niños durante el crecimiento, ya que los ensayos con
animales han puesto de manifiesto un riesgo potencial de daM a los cartllagos
articulares durante el crecimiento. La seguridad y eficacia de norfloX8cina en los niños
no han sido establecidas,
l! Norfloxaclna contiene un colorante azoico.
Advertencias y Precauciones:
Pacientes con antecedentes de convulsiones. No se ha demostrado aún seguridad y
eficacia en niños prepuberes, ni en el embarazo, donde su administración debe evaluar
riesgo-beneficio.
~n lactancia, se observó niveles muy baJostf nor11oxaclna en leche matema, no
Jl obstante, debe administrase con precaucló .:
~ Se debe monltorear los niveles de teofilina ncaso de administlflción simultánea.
En pacientes que recibían quino lonas. entre ellas ciprofloxacinaj levofloxaclna,
ofloxacina y moxifloxaclna, se han detectado casos de rupturas de tendón a nivel del
hombro, de la mano y especialmente Tendón de Aquiles u otros que requirieron cirugla
o trajeron aparejado como resultado una Incapacidad prolongada. Los infonnes de
Fannacovlgltancia post-marketing Indican que este riesgo se incrementa en pacientes
que reciben o hayan recibido tratamiento con corticosteroides. especialmente en los
mayores de 65 años. Debe dlscontlnuarse la adminIstración del producto si el paciente
presenta slntomas sugestivos de tendlnltls (dolor, inflamación) o ruptura de tendÓn. Los
pacientes deben descansar y abstenerse de hacer ejerCicios hasta ha~rse descartado
el diagnóstico de tendlnltls o de ruptura de tendón. La ruptura puede ocurrir desde las
48 ha de iniciado el tratamiento con cualquiera de las drogas referidas, hasta luego de
haber finatizado el mismo .
e
.
l~
,
"
,
.~,
j,
,n
W
j
t>
Uso genátnco
"; Facientss mayores de 65 años tienen ma~ riesgo de de8arron~r alteraciones severas
~ ~ los tendones, Incluyendo ruptura, con el r~tamiento con cualquiera de las
1: Rulnolonas referidas.
1I '
i' Este riesgo es mayor en pacientes que reciben o hayan estado en tratamiento con
corticosteroides.
Usualmente la ruptura se observa en el tendón de Aquiles o tendones de mano u
hombro y pueden ocurrir durante o varios meses después de completar la terapia
~'"
'D 1 8 9
antibiótica. Los pacientes deben ser Informados de dicho efecto adverso,
aconsejándose la suspensión de la ¡ngesta si se presenta alguno de los srntomas
mencionados e Informando de Inmediato a su médico.
Interacciones:
La administración simultánea de probenecld no influyó en las concentraciones séricas
de noñloxacina, pero redujo la excreción urinaria.
Al igual que con otros ácidos orgánicos antibacterianos, se comprobó In vitro
antagonismo entre la norfloxacina y nitrofurantolna. Es el mismo para el cloranfenlcol y
tetraciclina .
.. ii ~e ha demostrado in vltro que las qUinolon,~ Incluyendo norfIQ~aclna, inhiben el CYP
r:. ~A2. La administración simultánea de fánn1cps metabollzados *"r CYP 1A2 (por
~,ejemplo, clozaplna. imipramlna, olanzapina~ roplnirol. tacrine, t9ffillna, tizanidine) puede
resultar en el aumento de las concentraciones del sustrato de lai droga cuando se
administra en dosis nonnales. Los pacientes que toman alguno de estos medicamentos
Junto con norfloxaclna debe ser estrechamente vIgilados.
Un aumento en teofillnemia se observó durante la administraciÓn simultánea de teofilina
y qulnolonas. Los efectos secundarlos causados por la teofllina se han notificado en
raras ocasiones cuando el uso de norfloxaclna. De ahlla necesidad de vigilar la
teoflllnemla y, si procede. en consecuencia ajustar la dosis de teofilina.
Un aumento en suero de la clclosporlna. se observó al utilizar este agente en los
pacientes tratados con norfloxacina. SI estas dos sustancias se utilizan Juntos, vigilar el
suero de ciclosporlna y ajustar la dosis en consecuencia.
Como cualquier qu!nolona norftoxacina puede JXl1:enclar la acción de los
anticoagulantes orales, incluida la warfarina y sus derivados, as! como la f1uindfona o
sustancias similares. La administración simultánea de estos agentes y norfloxaclna
~~~~::~::::::
::~:~::::~
:~:eJo:::~:::b~~i::J:
;~:::::~::~ade
~:
ra~¡,
I!
sulfonilurea) fue el resultado, en casos
una hipoglucemia grave. Por lo tanto, se
recomienda vigilar los niveles de azúcar en la sangre cuando estos fánnacos se
administran simultáneamente.
Norfloxacina y preparados multlvitamlnicos. hierro o zinc, así como los antiácidos o el
sucralfato no deben utilizarse simultáneamente, y gestionar con una brecha de al
menos 2 horas para evitar ta interferencia de est06 agentes con la absorción de
noñloxacina, cuyo suero y orina se puede reducir.
Didanosina no deben tomarse al mismo tIempo o dentro de dos horas después de tomar
norftoxaclna porque podr[a interferir con la absorción y conducir a suero y orina menor.
Norfloxaclna puede interferir con el metabolIsmo de la cafelna. Esto puede resultar en
una reducción en la excreción de la cafeína Y. por tanto. una extensión de su vida
media.
El uso simultáneo de fánn3cos antiinflamatorios (AINE) y las quinolonas, incluyendo
'11' .
"'l: "
""
~
norfloxaeino, pueden aumentar el riesgo de estimulaclón del SNC y convUlsiones. Po
tanto, el uso de norfloxacina en pacientes qUe toman AINE mismo tiempo requiere
._ especial precaución.
~~
~
.,
.ü ha experimentación con animales ha demo~t(ado que la administración concomitante de
1: quinolonas y fenbufeno podrla inducir convqlslones. Por lo tanto, la administración
.. simultanea de quinolonas y fenbufeno debe!,evltarse.
EmbarazolLactancla:
No utilice norfloxacina durante el embarazo.
Los experimentos con animales han puesto de manifiesto un riesgo de daf"lo en el
cartllago articular a los jóvenes cada vez mayor. Los efectos secundarlos de este tipo
no se pueden excluir en los seres humanos.
Norfloxacina se encontró en la sangre del cordón umbilical y ell1quklo amniótico,
La presencia de norfloxacina en la leche materna no se ha encontrado después de una
dosis de 200 mg. Esta dosis es baja y otras quinolonss pueden circular en la leche
humana, la administración de norfloxacina durante la lactancia, sólo se tendrá en cuenta
cuando sea absolutamente necesario.
Efecto sobre la capacidad para conducir y utilizar máquinas:
;; puede causar mareos en algunos paCiente; .Los pacientes de~n saber cómo
Feaccionan a la norfloxaclna y tener precau ~n con la conducción, el uso de maquinaria
I~.. O realizar otras actividades que requieren uI a atención considerable y gran
coordinación.
'ji
Reacciona. "dvers8s:
Se observaron en un 5% de los pacientes, son generalmente tolerados, transitorios y
reversibles.
Se presentaron principalmente en el tracto gastrointestinal, náuseas, vómitos, diarrea,
dolor abdominal, anorexia.
También se observó, pero en menor grado, cefalea, mareos, reacciones cutáneas
menores.
En muy raras ocasiones, se reportaron reacciones de hipersensibilidad o artralgla.
Pueden aparecer valores del hepatograma anormales.
Los efectos secundarios a continuación se han observado en estudios cllnlcos o de los
Informes de post..comercializacl6n:
Frecuentes (2:: 1/100, <1/10), ocasionales (2:: 1/1000, <1/100), raras (2:: 1110'000,
~1/1000), muy raros «1/10'000) y alslada~i .
ji I"fecciones e Infestaciones
1: Casuales: candldiasis vaginal.
I!
Trastomos de la sangre y del sistema linfático
Ocasionales: eosinofilia, leucopenia, neutropenia, disminución del hematocrito,
trombocitopenia.
Raras: anemia hemolftlca, a veces asociados con la deficiencia de glucosa-6-fosfato
deshldrogenasa.
Muy raras: agranulocitosls.
Trastornos del sistema inmunológico
Raras: angioedema, reacción de hipersensibilidad, vasculltls, anafilaxis, dificultad para
respirar.
Trastomos del metabolismo y nutrición
Ocasional: anorexia
i
I'
"
11 .
-11 '
1\ "
"
o,.,N~
~'I'O~
"
.
Mental
Ocasional: depresión, trastornos del sueño, nerviosismo, ansiedad,
,. ~ros: desorientación, irritabilidad, euforia,
¡ polcóllca.
rluCinac,ones. confusión mental, reaCCiórtlO
:
~
i
",;'Trastomos
del sistema nervioso
,
:
l .
" Ocasional: dolor de cabeza, mareos, pares~slaSt trastornos de la sensibilidad,
dlsgeusia. sabor amargo, convulsiones.
Poco frecuentes: temblor, polineuropatla incluyendo slndrome de Guillaln-Barre.
mioclonus incluyendo exacerbaciones de mlastenla gravis~·
Trastornos oculares
Raras: epifora, visión borrosa.
Trastomos funcionales de la oreja y el oldo interno
Raras: tinnitus,
Muy raros: pérdida de la audición.
Trastornos gastrointestinales
Frecuentes: náuseas.
Ocasionalmente diarrea, dolor abdominal/espasmos abdominales, ardor de estómago,
vómitos, sequedad de boca, flatulencia, dispepsia, disfagia, estref'llmlento, trastornos
digestivos, dolor en la parte inferior del abdomen.
. :i_ ~aras: pancreatitis, colitis pseudomembra~~8 .
~rastomos funcionales del hígado y de ves ~Ia biliar
f; Frecuentes: aumento de ALT (SGPT), AST, SGOT).
,. Raras: ictericia, hepatitis, hepatitis colestásiba.
Trastornos funcionales de la piel y tejido subcutaneo
Ocasionales: erupción cutánea, prurito, urticaria.
Raras: fotosensibllldad, eritema muJtifonne, slndrome de Stevens-Johnson, dennatltls
exfoliatlva, necrólisls epidérmica tóxica (slndrome de Lyell).
Trastomos funcionales del sistema músculo-esquelético, tejido conjuntivo y huesos
Raras: artralgia, mialgia, artritis.
Muy raras: tendinltls, rotura de tendones.
Trastornos funcionales de los riñones y tracto urinario eferente
Frecuentes: aumento de la creatinina sérlca.
Raras: nefritis Intersticial. insuficiencia renal.
Pruebas de laboratorio
Frecuentes: aumento de la fosfatasa alcalina y LDH.
Muy raras: aumento de la creatlnlna cinasa ,(CK).
.h
'1'
"!: Sobredoslflcacl6n:
No hay información sobre la sobredosis de norfloxaclna.
En caso de sobredosis. inducir el vómito o realizar lavado gástrico. mantener al paciente
bajo estricta supervisión y aplicar un tratamiento sintomático.
En los últimos casos de sobredosis aguda, debemos darle al paciente para beber
soluciones que contengan calcio, para transformar el comple.lO norfloxaclna en calcio
que se absorbe en el tracto gastroIntestinal en un grado limitado.
Mantener el equilibrio hidrico.
Los pacientes que han sido tratados con altas dosis de norfloxacina presentaron
cristalurla. en tales casos, el paciente debe beber lo suficiente para mantener la
hidratación.
Ante la eventualidad de una sobredoslficaclón, concurrir al Hospital más cercano o
comunicarse con los Centros de Toxicologla:
,
¡,
·,.1,
"1:':-
1: _
,
MAU~
DlRECTOi~~g
18 9
Unidad Toxicológica del Hospital de NU'os Dr. Ricardo Gutlérrez
Tel.: (011) 4962 6866/2247
;<
Centro Nacional de Intoxicaciones POIIClll1¡CO Prol. A. Posa4as
~,'.I.: (011) 4654 6648
i
;
TCentro Toxicológico de la Facultad d. M dlclna (UBA) Tel.: (011) 4981 8447
I
Conservación:
Conservar a una temperatura entre 15"C y 30~C, lejos de la luz directa y el calor.
Presentacl6n:
Envases conteniendo 8,16,24,32,100,250,500 Y 1000 comprimidos recubiertos,
siendo las 4 últimas presentaciones de Uso Hospitalario Exclusivo.
MANTENER ÉSTE Y TODOS LOS MEDICAMENTOS ALEJADOS DEL ALCANCE DE
LOS NIÑOS.
r ,Este medicamento debe ser usado eXcluSi~mente bajo prescripción y vigilancIa medica
~: ~ no puede repetirse sin nueva receta médi .
i
1\·'
.
h
,
1 1 ;
5AVANT riHARM S.A.
I
Ruta Nacional N° 19, Km 204 - Córdoba - CP. X2432XAB
Director Técnico: Mauro G. Bono, Farmacéutico
Especialidad Medicinal autorizada por el Ministerio de Salud.
Certificado N°;
ReviSión:
Lote:
vencimiento:
MAU~
DlRECTOi~~g
i' '
9. PROYECTO DE RÓTULO
Comprimido. recubiertos 400 mg
Venta Bajo Receta Archivada
Industria Argentina
: :l'enidO: 8 comprimidos recubiertos
I
"
Formula cuall-cuantltaliva:
Cada comprimido recubierto contiene:
Norfloxacina ....................................... 400 mg
Exclpientes: estearato de magnesio; ac-dIMsol; celulosa mlcrocristallna;
hidroxipropUmetllcelulosa; glicerina; dióxido de titanio: tartrazina.
POlologia: Ver prospecto Interno.
Cons.rvaclón: Conservar a una temperatura entre 15°C y 30'C, lejos de la luz directa y el
calor.
MANTENER ÉSTE Y TODOS LOS MEDICAMENTOS ALEJADOS DEL ALCANCE DE LOS
NIÑOS.
, :li&~ medlca,mento debe ser usado eX~luSlva"IT' te bajo prescrlpc,~n y vi~ilancia médica y no
~e repetirse sin nueva receta médica.
.,.
•
"
i,
I
I
SAVANT ~HARM S.A.
Ruta Nacional NCl 19, Km 204- Córdoba - CP, X2432XAB
Director Técnico: Mauro G. Bono, Farmacéutico
Especialidad Medicinal autorizada por el Ministerio de Salud.
Certificado N°:
Revisión:
Loto;
Nota: El mismo texto acompañará la
recubiertos.
:1: ;
.tI r
-¡,'
\.
vencimiento:
presentacl6~
conteniendo 16, 24 Y 32 comprimidos
Comprimidos recubiertos 400 mg
V.nta
aaJo Rec.ta Archivada
Industria Argentina
Contenido: 100 comprimidos recubiertos, siendo da Uso Hospitalario Exclusivo
~ula cuall-cuantltatlva:
=o::~=~ido~~Ubiertoconti~~.
~ :
..400
';
~g
I
Excipientes: esteerato de magnesio; ac-dl-sol;'celulosa microcrlstalina;
hldroxipropilmetilcelulosa; glicerina; dióxido de titanio; tartrazina.
Poaologia: Ver prospecto Interno.
Con.ervaclón: ConselVar a una temperatura entre 15'C y 30'C, leJos de la luz directa y el
calor.
MANTENER ÉSTE Y TODOS LOS MEDiCAMENTOS ALEJADOS DEL ALCANCE DE LOS
NIÑOS.
Este medicamento debe ser usado exclusivamente bajo prescripción y vigilancia médica y no
puede repetirse sin nueva receta médica.
"
"" ,,
!!
SAVANTlHARM S.A.
Ruta Nacional N° 19, Km 2
Director Técnico: Mau
~ Córdoba - CP. X2432XAB
G. Bono, Fannacéutlco
Especialidad Medicinal autorizada por el Ministerio de Salud.
Certificado N°:
Revisión:
vencimiento:
Lote:
Nota: El mismo texto acompai'lará la presentación conteniendo 250, 500 Y 1000 comprimidos
recubiertos, siendo de Uso Hospitalario Exclusivo.
n
","
I:
1
"2010 - Año del bicentenario de la revolución de Mayo"
Ministerio de Salud
Secretaria de Polfticas,
Regulación e Institutos
A.N.M.A.T.
ANEXO 1II
CERTIFICADO
Expediente N°: 1-0047-0000-004185-03-0
El Interventor de la Administración Nacional de Medicamentos, Alimentos y Tecnologla
Médica (ANMAn certifica que, mediante la Disposición
N'~_O 1 8 S.y de acuerdo a
lo solicitado en el tipo de Trámite N° 1.2.1, por SAVANT PHARM S.A., se autorizó la
inscripción en el Registro de Especialidades Medicinales (REM), de un nuevo producto con
los siguientes datos identificatorios caracteristicos:
Nombre comercial: NORFLOXACINA SA VANT PHARM.
Nombre/s genérico/s: NORFLOXACrNA.
Industria: ARGENTINA.
Lugar/es de elaboración: RUTA NACIONAL 19 KM, 204, EL TI0, PROVINCIA DE
CORDOBA.
Los siguientes datos identificatorios autorizados por la presente disposición se detallan a
continuación:
Forma farmacéutica: COMPRIMIDO RECUBIERTO.
Nombre Comercial: NORFLOXACINA SAVANT PHARM.
Clasificación ATC: JOIMA06.
"Indicación/es autorizada/s: INFECCIONES AGUDASY CRÓNICAS, COMPLICADAS Y
SENCILLAS, DEL TRACTO URINARIO SUPERIOR E INFERIOR: CISTITIS, PIELITlS,
"2010 - Afto del bicentenario de la revolución de Mayo"
6
Ministerio de Salud
Secretaria de Politicas,
Regulación e Institutos
A.N.M.A.T.
RIO DEPUES
CISTOPIELITIS, PIELONEFRITIS, INFECCIONES DEL TRACTO URINA
DE
LAS
INTERVENCIONES
UROLÓGICAS,
VEJIGA
NEUROGENA
y
NORFLOXACINA.
NEFROLlTIASIS CAUSADAS POR GERMENES SENSIBLES A LA
GASTRO
ENTERITIS
BACTERIANA
AGUDA
A GERMENES
SENSIBLES.
L CAUSADAS
GONOCOCCIA URETRAL, DE CUELLO DE UTERO O ANO RECTA
POR
CEPAS
DE
NEISSERIA
GONORRHOEAE
QUE
PRODUCEN
O
NO
ULOCITOPENIA
PENIClLINASA. PARA LA PROFILAXIS DE: SEPSIS, EN GRAN
LA BASE DE UNA
MARCADA (DEFINIDOS EN LOS ESTUDIOS CLlNICOS SOBRE
UNA SEMANA O
CONCENTRACION DE lOO GRANULOCITOS / MM3 DURANTE
MAS).
Concentración/es: 400 mg. de NORfLOXACINA.
Fórmula completa por unidad de forma farmacéutica ó porcentual:
Genérico/s: NORFLOXACINA 400 mg.
TITANIO 4.3 rng,
Excipientes: ESTEARATO DE MAGNESIO 5.00 rng, DIOXIDO DE
AC-DI-SOL 10.00
HIDROXIPROPILMETILCELULOSA 28.8 IUg, GLICERINA 4.00 rng,
mg.
rng, CELULOSA MICROCRISTALlNA 105.00 rng, TARTRAZINA 0.2
Origen del producto: SINTÉTICO O SEMISINTÉTICO.
Víals de administración: ORAL.
Envase/s Primario/s: BLISTER DE AUPV C.
250,
Presentación: BLISTER CONTENIENDO 8, 16, 24, 32, lOO,
500 Y 1000
TALARIO.
COMPRIMIDOS, SIENDO LAS ULTIMAS CUATRO DE USO HOSPI
,32,10 0,250 , 500 Y
Contenido por unidad de venta: BLISTER CONTENIENDO 8, 16,24
"2010 - Afio del bicentenario de la revolución de Mayo"
t
•
Ministerio de Salud
Secretaria de Políticas,
Regulación e Institutos
A.N.M.A.T.
OS, SIENDO LAS ULTIMAS CUATRO DE USO HOSPITALARIO.
RIMID
COMP
1000
Período de vida útil: 24 MESES.
DE LA LUZ Y LA
Forma de conservación: TEJvlPERATURA AMBIENTE - PROTEGER
HUMEDAD; hasta: 30 oC.
Condición de expendio: BAJO RECETA ARCHIVADA.
rs 5 3 3 7,
Se extiende a SAVANT PHARM SA el Certifica;o N
Buenos Aires, a los
días del mes dJ-l
5 ENE 2O1Ocle
por cinco (5) años a partir de la fecha impresa en el mismo.
r
DISPOSICIÓN (ANMAT) N°:
en la Ciudad de
, siendo su vigencia