Tema de muestra
Anuncio

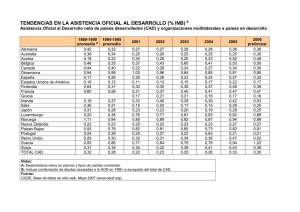
81 TEMA 8. HIPERGLUCEMIA. J. Mª. Garrido Miranda. 1. CONCEPTO. La hiperglucemia es un trastorno metabólico frecuente en los niños en las salas de urgencia y en unidades de cuidados intensivos. Además, puede ser un marcador biológico de mal pronóstico. En primer lugar nos ocuparemos de la hiperglucemia en el contexto de una cetoacidosis diabética, y, a continuación, trataremos el coma hiperglucémico no cetósico y otras hiperglucemias. 2. CETOACIDOSIS DIABÉTICA. La cetoacidosis diabética (CAD) es un cuadro clínico caracterizado por hiperglucemia, generalmente mayor de 250 mg./dl. (13,9 mmol./l.), acompañada de un pH sanguíneo menor de 7.30 y/o bicarbonato menor de 15 mEq./l., junto con deshidratación y presencia de cetonemia y cetonuria. Es la principal causa de mortalidad en niños y adolescentes con diabetes mellitus tipo 1. 2.1. Fisiopatología. La hiperglucemia se produce por el descenso de la utilización periférica de glucosa y por el incremento de la neoglucogénesis y la glucogenolisis hepática (la glucogenolisis en mucha menor medida, pues las reservas de glucógeno son mínimas en la hipoinsulinemia crónica). El descenso de la utilización periférica de glucosa se debe al décit de insulina. La insulina es una hormona polipeptídica secretada por las células beta del páncreas, bajo estímulos beta-adrenérgicos y parasimpáticos. La regulación de su secreción está mediada por la hiperglucemia vía elevación del AMPc. La acción de la insulina es anabolizante y actúa básicamente en tres tejidos: 82 - En el hígado aumenta la captación de glucosa de la sangre, estimula la síntesis de glucógeno, inhibe la neoglucogénesis y la glucogenolisis. - En el músculo aumenta la captación de glucosa, promueve la síntesis de glucógeno, estimula la síntesis proteica e inhibe la proteolisis. - En el tejido graso ayuda a la captación de glucosa y lipoproteínas, estimula la lipogénesis e inhibe la lipolisis. La gura 1 permite entender las alteraciones que se producen en el metabolismo hidrocarbonado como consecuencia del décit de insulina y de la disminución del índice insulina/glucagón. El décit de insulina activa a la enzima glucoquinasa, que activa la glucogenolisis. Figura 1. Metabolismo hidrocarbonado. FFK: fosfofructoquinasa. FdP: fructosa difosfatasa. GS: glucógenosintetasa. GP: glucogenofosforilasa. PK: piruvatoquinasa. 83 Se produce una disminución de la piruvatoquinasa que bloquea la glucólisis. Se produce también un aumento de la proteolisis para la producción de sustratos para la neoglucogénesis. Y se favorece la lipolisis a partir de los ácidos grasos libres, sustrato adecuado para la cetogénesis (gura 2). Pero la hiperglucemia en la CAD también se debe a la acción de hormonas contrarreguladoras, tales como el glucagón, que activa la neoglucogénesis y la Fig. 2. Metabolismo graso y cetogénesis. CAT: carnitin-acil-transferasa I. Ac-co-A: Acetil coenzima A. M-co-A: malonil coenzima A. Ac-co-A-C: acetil coenzima A cocarboxilasa. GPTA: glicerolfosfato aciltransferasa. TG: triglicéridos. AG: ácidos GPTA glucogenolisis y aumenta la producción de cuerpos cetónicos. En el hígado aumenta la síntesis hepática de carnitina y disminuye el malonyl-Co-A, que normalmente inhibe la estericación de los AGL con carnitina, a través de la regulación de la enzima responsable, la carnitina-acil-transferasa (CAT). Al disminuir el M-Co-A se facilita el paso de AG y carnitina al interior de la mitocondria, iniciando la beta-oxidación. Otras hormonas contrarreguladoras, como la epinefrina, activan la lipolisis, neoglucogénesis y glucogenolisis, contribuyendo a la hiperglucemia. El cortisol inhibe 84 la utilización periférica de glucosa. Cuando la cifra de glucemia supera el dintel de reabsorción renal (180-200 mg./dl. ó 10-11 mmol./l.) se produce glucosuria y poliuria osmótica con depleción de electrolitos (sodio, potasio, cloro, calcio, magnesio y fosfato). La hiperglucemia produce hiperosmolaridad en el espacio intra y extravascular, generando un gradiente osmótico, con salida de agua del espacio intracelular al extracelular. Por ello, desde el punto de vista clínico, la deshidratación de la CAD puede ser subestimada, debido al relativo mantenimiento del espacio extracelular. Es una deshidratación mixta: intra y extracelular. Los cetoácidos acetoacético y beta-hidroxibutírico actúan como aniones no reabsorbibles en el túbulo distal y son excretados en la orina como sales de sodio y potasio, contribuyendo a la depleción electrolítica. — Alteraciones del sodio: En la CAD además de existir una deciencia real e importante de sodio, la natremia suele encontrarse articialmente baja. Por una parte, la hiperglucemia incrementa la osmolalidad plasmática e induce la salida de agua intracelular, reduciendo la natremia (hiponatremia dilucional); por otra, la hipertrigliceridemia, con suero lipémico, frecuente en la CAD, también puede, al disminuir la fracción acuosa del suero, reducir la concentración de sodio por volumen de suero, contribuyendo así a la hiponatremia facticia. Por tanto, este parámetro es un mal indicador del tipo y grado de deshidratación, y debe ser corregido (Na+ corr.): Na+corr.= Na+medido (mEq/l) + 1,6 x (glucemia en mg/dl / 100). Una natremia corregida elevada indica una mayor deciencia de agua libre y, por lo tanto, una deshidratación intracelular mayor. — Alteraciones del potasio. Existe un décit global de potasio, debido a las pérdidas urinarias, ya que los cuerpos cetónicos se eliminan también en forma de sales de potasio. Pero el potasio sérico puede ser normal o elevado, por salida de K+ intracelular debido a la acidosis e hiperosmolaridad. Además, el décit de insulina también disminuye la entrada de potasio a la célula. Por último, la disminución del ltrado glomerular puede condicionar una menor eliminación de potasio. — Alteraciones del fósforo. La depleción de fósforo debida a pérdida urinaria por diuresis osmótica y menor reabsorción de fosfatos por la acidosis, puede condicionar una disminución en el 2,3-diPG intraeritrocitario, y desviación de la curva de disociación de la hemoglobina a la izquierda, lo que se ve compensado por la acidosis, que la desvía a la derecha. — Alteraciones del calcio. 85 La acidosis condiciona una elevación del calcio iónico, y una mayor eliminación de calcio por orina. — Alteraciones del magnesio. Puede aparecer hipomagnesemia debida a las pérdidas urinarias por glucosuria y acidosis. Las alteraciones del calcio y del magnesio generalmente no producen clínica relevante. — Acidosis. Se debe al incremento en la producción de cetoácidos (acetoacético y betahidroxibutírico), que son responsables también del incremento del anión gap. De los tres cuerpos cetónicos que se producen en la cetoacidosis: beta-hidroxibutirato, acetoacético y acetona, sólo los dos primeros son ácidos y sólo los dos últimos son cetonas. Los métodos comerciales para determinar la cetonuria se basan en la reacción del nitroprusiato, en la que el acetoacético, y, en menor medida, la acetona, pero no el beta-hidroxibutírico, producen un color púrpura, cuya intensidad es una estimación cualitativa del grado de cetosis. En condiciones normales, la proporción beta-hidroxibutírico/acetoacético es de 3-4/1, pero durante la CAD grave la proporción puede ser de 15 ó incluso mayor, sobre todo si hay hipoxemia tisular; de forma que, si no se determinan especícamente los niveles de beta-hidroxibutírico, el grado de cetosis puede ser subestimado. Cuando el tratamiento reestablece el metabolismo oxidativo, se incrementan los niveles de acetoacético y de acetona, de forma que puede, en ocasiones, detectarse una mayor presencia de cuerpos cetónicos, pese a que, en realidad, estén disminuyendo. La cetona es eliminada por la orina y la respiración (fetor cetonémico). La acidosis en la CAD se debe también a la acidosis láctica producida por la glicólisis anaerobia secundaria a hipoperfusión y/o hipovolemia. Mucho menos frecuente es la aparición de acidosis hiperclorémica, debida a aportes excesivos de cloro al rehidratar, con eliminación excesiva de bicarbonato por orina, incrementándose la reabsorción de cloro para mantener la electroneutralidad. 2.2. Clínica. El niño con CAD suele estar deshidratado, ojeroso, hipotérmico, y con vasoconstricción por la hipovolemia, aunque es poco frecuente que presente hipotensión arterial. Las manifestaciones clínicas de la cetosis y la acidosis son: dolor abdominal, fetor cetonémico, vómitos y respiración de Kussmaul. La afectación neurológica produce obnubilación progresiva y coma. El edema cerebral es una complicación poco frecuente, pero con elevada mortalidad. Puede aparecer al inicio de la CAD, aunque es más frecuente en las primeras 24-48 horas de tratamiento. Se caracteriza por obnubilación, cefalea progresiva y periodos de agitación. Evoluciona a coma profundo con signos de descerebración. El 86 edema cerebral subclínico, según la mayoría de los autores, es frecuente, y se puede evidenciar por disminución del tamaño ventricular en el scanner. A veces aparece cianosis y dicultad respiratoria, debido a edema pulmonar, que es una complicación poco frecuente y que aparece de forma precoz. 2.3. Monitorización. La monitorización de un paciente con CAD incluye: constantes vitales continuas (FC, FR, ECG y pulsioximetría). Se debe determinar periódicamente la TA no invasiva e, inicialmente, la diuresis. Al ingreso se precisan los valores de: glucemia, EAB, Na+, K+, Cl-, Ca++, urea, creatinina, osmolaridad, anión Gap, Na+ corregido y hemograma. La monitorización de la glucemia debe ser horaria durante todo el manejo de la CAD, y los controles gasométricos y de iones también horarios durante las primeras 4-5 horas. El resto de parámetros bioquímicos ya mencionados deben controlarse con una periodicidad de aproximadamente 4 horas, y según la evolución de cada caso. Es interesante el control seriado de los niveles de beta-hidroxibutirato capilar con tiras reactivas, cuyos niveles se correlacionan bien con la situación ácido-base del paciente. 2.4. Tratamiento. El tratamiento hospitalario de un niño con CAD comienza ya en la sala de urgencias. La ubicación ideal para el tratamiento y monitorización de estos pacientes es una unidad de cuidados intensivos pediátricos. En cualquier caso, se hace obligado el ingreso en UCIP si: paciente menor de 2 años, shock, alteración del nivel de consciencia, acidosis intensa (pH < 7,1 y/o EB d 7) y en el caso de pacientes con CAD que, estando en tratamiento fuera de la UCIP, presentan complicaciones evolutivas graves (clínicas o metabólicas). Es necesario la canalización de dos vías venosas periféricas: una para sueros de perfusión de insulina y sueros de rehidratación (conectados en Y con llave de tres pasos); y otra, si es posible, para controles analíticos, evitando punciones múltiples, manteniéndola permeable con suero heparinizado y lavados múltiples. Insulinoterapia: añadir en 100 ml., de suero siológico tantas unidades de insulina regular como kg., pesa el paciente. Se purga el sistema con los primeros 50 ml., de esta solución. La equivalencia en unidades/kg./hora de insulina (U./kg./h.) según microgotas/minuto (mcg./mto.) es la siguiente: U./kg./h. de insulina mcg./mto. 0,1 10 0,09 9 87 0,08 8 0,07 7 y así sucesivamente. Desde el inicio del tratamiento se pone dicha perfusión por una vía diferente de la del suero de rehidratación o por esa misma vía en Y. Se comienza la perfusión a un ritmo de 10 mcg./mto., las modicaciones posteriores se harán en relación a los controles de glucemia, para mantener la glucemia en torno a 200 mg./dl. Las modicaciones se suelen hacer de 2 en 2 mcgotas. Si en 1-2 horas la glucemia no desciende más del 10% se incrementará la perfusión de 2 en 2 mcgotas./mto. si se precisa. La glucemia no debe descender más de 100 mg./dl., por hora. La insulina IV debe mantenerse hasta alcanzar la corrección metabólica, después continuar con insulina subcutánea. No parar la perfusión IV de insulina hasta 30 minutos después de la primera dosis de insulina regular subcutánea. Fluidoterapia: — 1ª Fase (1ª-2ª hora): si shock: suero salino siológico hasta 40 cc./kg., o más si se precisa en 1-2 horas hasta lograr la estabilidad hemodinámica. Si no shock: suero salino siológico a 10 cc./kg., en 1 hora. Asociar bicarbonato 1 molar en el suero siológico si existe acidosis metabólica grave: 1 mEq./kg. si pH < 7 ó 2 mEq./kg. si pH < 6,9. Añadir en la 2ª hora en el suero potasio: 40 mEq./l. (20 mEq. como ClK y 20 como PO4K) excepto si: hipercaliemia inicial (K > 5 mEq./l.), insuciencia renal, shock (poner sólo 20 mEq./l.). Gluconato cálcico al 10%: 34 cc./m2/24 horas administrados de forma intravenosa lenta intermitente, cada 4-6 horas desde el inicio. — 2ª Fase: hasta pH de 7,3 y/o EB > 15, corrección de la deshidratación grave y estabilización de la glucemia. El total de líquidos a administrar en esta fase son las necesidades de mantenimiento más el décit, calculando un décit de un 5 a un 10% según el grado de deshidratación. El décit, según algunos autores, se repone en 24 horas, el 50% en las 8 primeras horas y la otra mitad en las restantes. Para otros, debe corregirse en 36 horas, especialmente en las deshidrataciones graves, reponiendo la mitad en 12 horas y la otra mitad en las 24 horas siguientes. Las necesidades de mantenimiento se calculan multiplicando las necesidades basales por un factor de corrección (F) que varía según el grado de deshidratación: en deshidrataciones moderadamente graves F=1,5 y en deshidrataciones muy graves F=2. La composición del líquido a administrar será: Por cada 1.000 cc., de suero glucosado al 5-10% (según las necesidades): — Na: 70 mEq./l. (35 cc. de NaCl 2 M.). Aumentar hasta 125 mEq./l., de Na si: 88 hiponatremia importante o si no aumenta el sodio al descender la glucemia. — K: 40 mEq./l. 20 mEq./l., en forma de ClK 2M y 20 mEq./l., como PO4H. Aumentar los aportes de K si caliemia < 3,5 mEq./l., (siempre PO4H 20 mEq./l., y el resto como ClK). — Mg: 1-5 mEq./l. También se administrará gluconato cálcico al 10 %: 34 ml./m2/24 horas de forma intravenosa lenta intermitente, cada 4-6 horas desde el inicio (dosis individual máxima 30 ml.). 2.5. Complicaciones. El edema cerebral es la causa más frecuente de muerte en niños diabéticos durante el tratamiento de una CAD, si bien es una situación rara, la muerte por este motivo ocurre en menos del 1% de los casos. Considerando el potencial mortal del edema cerebral y su relación con el tratamiento, el manitol (0,25-1 g./kg. en 30 mtos.) debe estar disponible en cuanto se inicia la pauta de tratamiento, además de otras medidas antiedema cerebral. El edema de pulmón es una complicación poco frecuente en niños. La existencia de dicultad respiratoria, cianosis y quejido son signos de alarma. Precisa ventilación mecánica, y, tratado precozmente, su pronóstico es favorable. La hipoglucemia es la complicación más frecuente, y debe ser tratada precozmente con disminución de la perfusión de insulina y administración de glucosa hipertónica. Las complicaciones cardiovasculares son muy raras en los niños. 3. COMA HIPERGLUCÉMICO NO CETÓSICO Y OTRAS HIPERGLUCEMIAS. El coma hiperglucémico no cetósico (CHNC) forma parte de un síndrome denominado coma hiperosmolar, caracterizado por una situación de hiperosmolaridad extracelular causante de disminución del nivel de consciencia por deshidratación de las células neuronales. 3.1. Fisiopatología. La fórmula de la POsmE es: POsmE= 2 Na+ (mEq./l.) + Glucosa (mg./dl.) / 18 = mOsm./kg., de agua. De lo que se deduce que el ascenso de los dos componentes de la fórmula provoque hipertonicidad plasmática y, como consecuencia, deshidratación intracelular por el 89 paso de agua al espacio extracelular. La hiperglucemia provoca diuresis osmótica, lo que condiciona, nalmente, una gran deshidratación hipertónica y colapso vascular. El fallo prerrenal secundario intensica la hiperglucemia al limitar la eliminación urinaria de glucosa. Puede existir acidosis metabólica, pero menos intensa que en la CAD, y es debida a la acidosis láctica por el shock hipovolémico y a la retención de ácidos orgánicos por la insuciencia renal aguda. La ausencia de cetonuria y cetonemia puede deberse a: - Existe suciente insulina para inhibir la lipolisis pero no para estimular la captación periférica de glucosa. - Aunque existe aumento de la lipolisis el hígado se encuentra insulinizado de forma adecuada y es capaz de metabolizar los ácidos grasos por vía anabólica. - La propia hiperosmolaridad podría inhibir la lipolisis. 3.2. Etiología. El CHNC suele ocurrir en pacientes diabéticos, generalmente con dependencia para la ingesta de agua o incapacidad para la percepción de la sed; pero también puede ocurrir en niños no diabéticos. Sobre la enfermedad de base incide una causa precipitante, como una enfermedad aguda, un procedimiento (diálisis, cirugía, ...) o la toma de ciertos fármacos. También se pueden incluir las deshidrataciones hipertónicas del lactante pequeño. 3.3. Clínica. Se presenta como alteración del nivel de conciencia que suele ir precedido de poliuria, polidipsia y vómitos en los días previos. Existen signos de shock y deshidratación, además de polipnea. Son poco frecuentes las alteraciones neurológicas focales. El término CHNC no es del todo correcto, porque sólo existe coma en el 10-20% de los casos. También pueden producirse trombosis vasculares y coagulación intravascular diseminada. La complicación más temida del tratamiento es el edema cerebral. 3.4. Diagnóstico. Son fundamentales la exploración física y el conocimiento de los antecedentes personales. Al ingreso se determinará: hemograma, bioquímica sanguínea, equilibrio ácido-base, presión osmótica, sedimento y bioquímica urinaria. El CHNC se caracteriza por hiperglucemia mayor de 600 mg./dl., hiperosmolaridad plasmática con valores 90 superiores a 350 mOsm./kg., glucosuria intensa y cetonuria mínima o inexistente. Suelen estar elevadas la urea y la creatinina. También suele existir hipernatremia y normo o hipocaliemia. Puede haber signos de hemoconcentración con elevación del hematocrito. La bioquímica de orina mostrará datos de insuciencia renal prerrenal. Se debe monitorizar al paciente y realizar controles de glucemia y de equilibrio ácido-base horarios y de bioquímica cada 3 ó 4 horas. 3.5. Tratamiento Se deben establecer medidas de soporte generales. La restitución de líquidos es semejante a la que se realiza en la CAD. Si el paciente está hipotenso se realizará una expansión inicial de volumen. Una vez normalizada la tensión se puede corregir la mitad del décit en las primeras 12 horas y el resto en las 24-36 horas siguientes. Se puede utilizar inicialmente suero salino siológico para evitar un descenso de la osmolaridad sanguínea superior a 2 mOsm./kg./hora. Cuando la glucemia sea inferior a 250 se puede pasar a glucosado al 5%. No debe añadirse potasio a los líquidos intravenosos hasta que se conozca el estado de la función renal y la diuresis sea suciente. La depleción de magnesio también debe corregirse una vez normalizada la función renal. Sólo se administrará bicarbonato en caso de acidosis grave (pH<7), y se administrará como bicarbonato 1/6 molar. La administración de insulina debe retrasarse hasta que se asegure un buen volumen extravascular. Se recomienda una dosis inicial de 0,05 unidades/kg./hora y se aumentará o disminuirá el ritmo de infusión según evolucionen los controles de glucemia. BIBLIOGRAFÍA. Calvo Macías C, López-Siguero JP, Durán Hidalgo I. Cetoacdosis diabética. En: Calvo Macías C, Ibarra de la Rosa I, Pérez Navero JL, Tovaruela Santos A, eds. Emergencias pediátricas. Madrid: 127-133. Dorao Martínez-Romillo P. Patología pancreática y del metabolismo hidrocarbonado. En: Ruza F., ed. Tratado de cuidados intensivos pediátricos. Madrid: Norma Capitel; 1399-1431. Ellis EN. Conceptos del tratamiento con líquidos en cetoacidosis diabética y coma hiperosmolar hiperglucémico no cetósico. Pediatr Clin North Am; 2: 319-328. Hale PM, Rezvani I, Braunstein AW. Factors predicting cerebral edema in young children with diabetes ketoacidosis and new onset type 1 diabetes. Acta Pediatr. ; 86: 626-631. 91 López MJ, Oyarzabal M, Rodríguez Rigual M. Tratamiento de la diabetes mellitus en la infancia y la adolescencia. En: Pombo M, Audí L, Bregada C, Bueno M, Clazada R, Diéguez C, Ferrández A, Molina JA, Moya M, Sáez JM, Sandrini R,Tojo R, eds. Tratado de endocrinología pediátrica. Madrid: McGraw-Hill Interamericana: 1131-1149. Nicolino M, Chatelain P. Diabetes mellitus infantil: clasicación, diagnóstico, epidemiología y etiología. En: Pombo M, Audí L., Bregada C, Bueno M, Clazada R, Diéguez C, Ferrández A, Molina JA, Moya M, Sáez JM, Sandrini R,Tojo R, eds. Tratado de endocrinología pediátrica. Madrid: McGraw-Hill Interamericana: 1122-1130. Pozo Román J. Hiperglucemia y acidosis (cetoacidosis diabética). En: Casado Flores J, Serrano A, eds. Urgencias y tratamiento del niño grave. Síntomas, guía, técnicas y procedimientos. Madrid: Ergon: 727-744. Sperling MA. Diabetes Mellitus. En: Behrman, Kliegman, Jenson, eds. Nelson. Tratado de pediatría. Madrid: McGraw-Hill Interamericana; 1927-1952. Sperling MA. Diabetes mellitus. En: Sperling, ed. Pediatric endocrinology. Philadelphia: Saunders; 323-366. 92