(M).
Anuncio

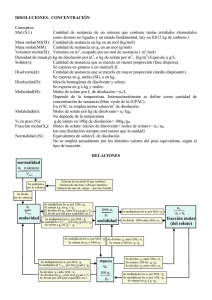
Unidad IV: Introducción a las Disoluciones • Preparando una solución – Molaridad – Iones en solución – Dilución • Estequiometría de solución • Titulaciones – Titulaciones ácido-base 1.Concentración de Soluciones • Al preparar soluciones es importante indicarconcentración de la misma, es decir, cuanto soluto y solvente componen la solución. • Una medida de concentración muy utilizada es Molaridad (M). Molaridad = moles de soluto Litros de solución • El volumen medido es el de la solución completa (soluto + solvente) y debe estar siempre en unidades de litros. Ejemplo: Determine la concentración de una solución de KMnO4 (masa molar 158.03 g/mol) que se obtiene al disolver 3.95 gramos del compuesto en un matraz volumétrico de 25.00 mL. Estrategia: 1. Calcule los moles de soluto utilizando los gramos y la masa molar del soluto. 3.95 gKMnO4x 1mol KMnO4 = 2.50x10-2mol KMnO4 158.03 gKMnO4 2. Cambie el volumen a unidades de litros. 25.00 mL 10-2L = 2.500x10-2L 1mL 3. Calcule la Molaridad. M= 2.500x10-2mol KMnO4 = 1.00M 2.500x10-2L Preparando una Solución Ejemplo: ¿Cuántos gramos de Na2CO3 debe usar para preparar 25.00 mL a partir de una solución 0.103 M de Na2CO3? (Masa molar Na2CO3 = 106.0 g/mol) Estrategia: 1. Para calcular gramos, primero debes calcular los moles de soluto. Despeje la expresión de molaridad por moles. M= moles moles = Mx Vol.(L) Vol.(L) 2. Calcule los moles de Na2CO3 que necesitas. Recuerde usar el volumen en L. moles = 0.02500Lx0.103M = 2.58x10-3moles Ejemplo: ¿Cuántos gramos de Na2CO3 debe usar para preparar 25.00 mL a partir de una solución 0.103 M de Na2CO3? (Masa molar Na2CO3 = 106.0 g/mol) Estrategia: Use los moles de soluto y la masa molar para determinar los gramos. 2.58x10-3mol Na2CO3 x 106.0g Na2CO3 = 0.273g Na2CO3 1mol Na2CO3 Utilizando una Solución Ejemplo: Una reacción requiere que se añadan 1.25 10-2 moles de NaOH y tienes disponible una solución 1.48 M de NaOH. ¿Cuánto volumen (mL) de la solución debe usar? Estrategia: 1. Despeje por volumen. M= moles Vol.(L) = moles Vol.(L) M 2. Calcule el volumen y pase a unidades demL. Vol.(L) = 1.25x10-2mol = 8.45x10-3L 1.48M 8.45x10-3L x 1mL= 8.45mL 10-3L Concentración de Iones en una Solución Ejemplo: Calcule la concentración de iones de cloro en una solución 0.533 M de CaCl2. Estrategia: Desglose las unidades de molaridad en moles/L de CaCl2 y multiplique por la razón de Cl- en CaCl2. . 0.533M CaCl2 = 0.533molCaCl2 x 2molCl- = 1.07M Cl1Lsolución 1mol CaCl2 Diluciones En los laboratorios se utilizan con frecuencia soluciones concentradas para preparar una soluciones de menor concentración. • Para preparar soluciones a partir de una solución concentrada, – se toma una porción de la solución concentrada – se coloca en un matraz volumétrico – se añade agua hasta el nivel. . ¿Cuál es la concentración de la solución diluida? Diluciones • El total de moles de sustancia en la solución diluida son la misma cantidad de moles que se transfirieron de la solución concentrada. Recuerde que moles = MxV Entonces, Moles transferidos del concentrado = Moles en diluido McVc = MdVd • Con esta relación puede hacer cálculos para determinar como hacer una dilución. Diluciones Ejemplo: Determina el volumen de una solución concentrada de 5.0 M CuCl2 que se necesita para preparar 25.0 mL de solución 1.5 M. Estrategia: Utilice la fórmula de dilución, despeje por volumen del concentrado y calcule. McVc = MdVd Vc = MdVd Mc Vc = 1.5Mx25.0mL = 7.5mL 5.0M Estequiometría de Solución Ejemplo: La siguiente reacción ocurre con reactivos en solución acuosa y genera gas. Na2S(ac) + 2 HCl(ac) → 2 NaCl(ac) + H2S(g) Si se utilizan 25.0 mL de HCl 3.0 M para hacer reaccionar todo el Na2S en solución, ¿cuántos gramos de gas se generan? • Para hacer estos cálculos es necesario combinar las relaciones entre concentración, moles y volumen de solución con cálculos estequiométricos. • La clave es llevar los datos a unidades de mol. Estequiometría de Solución A B Gramos B Gramos A Masa Molar B Masa Molar A moles A Moles A = M x V Coeficiente estequiométrico moles B Moles B = M x V Estequiometría de Solución Ejemplo: La siguiente reacción ocurre con reactivos en solución acuosa y genera gas. Na2S(ac) + 2 HCl(ac) -> 2 NaCl(ac) + H2S(g) Si se utilizan 25.0 mL de HCl 3.0 M para hacer reaccionar todo el Na2S en solución, ¿cuántos gramos de gas se generan? Estrategia: 1. Calcule los moles de la solución que conoce. molesHCl = MHCl x VHCl molesHCl = 3.0M x 0.0250L = 0.075molesHCl 2. Por estequiometría, pase de moles de reactivo a gramos de producto. 0.075molesHCl x 1molH2S x 34.09gH2S = 1.28g 2molHCl 1molH2S Estequiometría de Solución Ejemplo: Determinar el volumen (mL) de HCl 1.50 M necesario para consumir por completo 0.830g deMg. Mg(s) + 2 HCl(ac) -> MgCl2(ac) + H2(g) Estrategia: 1. Determine los moles de HCl que se necesitan para consumir Mg. 0.830g Mg x 1mol Mg x 2mol HCl = 0.0683 mol HCl 24.31g Mg 1molMg 2. Calcule volumen de HCl. V=moles/M V= 0.0683 moles HCl = 0.0455L 1.50M 0.0455L x 1mL = 45.5 mL 10-3 L Titulaciones Titulación es un método para determinar las concentración de un compuesto en una muestra. Se añade una solución acuosa de concentración conocida para que reaccione con el compuesto de interés en la muestra. Esta solución se conoce como solución estándar. Dependiendo de la cantidad de solución estándar utilizada y conociendo la ecuación química balanceada se puede determinar la concentración del compuesto en la muestra. Titulaciones Ácido-Base • El momento que la solución estándar consume todo el compuesto de interés en la muestra se conoce como el punto de equivalencia. • Durante titulaciones ácido- base se utilizan indicadores para el punto de equivalencia. – Indicadores son tintes que cambian de color dependiendo de la concentración de H+. – Ejemplo: fenolftaleína es incoloro en soluciones ácidas y de color rosa en soluciones básicas. Titulaciones Ácido-Base •Ejemplo: Se necesitan 15.00 mL de HNO3 2.25 M para llegar al punto de equivalencia durante la titulación de 20.00 mL de Ca(OH)2. Determine la concentración de Ca(OH)2 Estrategia: 1. Escriba la ecuación química balanceada. 2 HNO3 + Ca(OH)2 -> Ca(NO3)2 + 2 H2O 2. Usando el volumen y la concentración de HNO3 determine la cantidad de moles de solución estándar utilizados. Moles HNO3 = M x V = 2.25M x 0.01500L = 0.0338moles Titulaciones Ácido-Base Estrategia: 3. Por estequiometría, determine la cantidad de moles de Ca(OH)2 que reaccionaron con los moles de HNO3 añadidos. 0.0338moles HNO3 x 1molCa(OH)2 = 0,0169 mol Ca(OH)2 2moles HNO3 4. Utilice la cantidad de moles de Ca(OH)2 y el volumen para calcular la concentración de la base. M = moles V M= 0.0169 mol Ca(OH)2 = 0.845M 0.02000L • Otras formas de expresar la concentración de una disolución: – Densidad – % en peso y Volumen – Molalidad – Fracción Molar Concentración es la proporción entre soluto y disolvente, donde su expresión mas básica es la densidad: Densidad (r) m soluto ( g ) r V disolución ( L ) A 5 g de NaCl (sal común) se añaden 250 mL de agua. ¿Cuál será su densidad en g/L de la disolución preparada? Solución: El volumen de la disolución 250 mL = 0,25 L. r g 250 L (L) 0 ,1 L m soluto ( g ) V disolución La densidad será 250 g/L. 25 g Porcentaje en Peso y en Volumen Porcentaje en Peso : indica los gramos contenidos en 100 g de disolución (soluto+disolvente) m soluto % masa ( de soluto ) * 100 m disolución Porcentaje en Volumen: indica los gramos contenidos en 100 mL de disolución (soluto+disolvente) % volumen ( de soluto ) m soluto V disolución * 100 Porcentaje en Peso Calcular el % en masa de una disolución de 25 g de sulfato de cobre en 300 g de agua. m disolución m soluto m disolvente 25 g + 300 g = 325 g de disolución Entonces: % peso m soluto V disolución * 100 25 g 325 g * 100 7, 7 % El % en masa de la disolución preparada es de 7,7% en sulfato de cobre (soluto) Porcentaje en Volumen Calcular el % en volumen (grado) que tendrá una disolución de 80 mL de metanol (alcohol de quemar) en 800 mL de agua. Suponer que los volúmenes son aditivos. v soluto v disolvente v disolución 80 mL + 800 mL = 880 mL de disolución Entonces: % volumen V soluto V disolución * 100 80 mL 880 mL * 100 9,1 % El % en volumen de la disolución preparada es de 9,1% o también 9,1° Molalidad (m) Se define como la cantidad de soluto (en moles) disuelto en 1 Kg de disolvente molalidad (m) n soluto m disolvente Ordenando se tiene: molalidad (m) m soluto m disolvente M soluto Se disuelven 5,61 g de KOH (MM=56,1 g/mol) en 500 mL de agua ¿Cuál es su molalidad, sabiendo que la densidad del agua es 1 g/mL a la temperatura de trabajo? Respuesta: 500mL*1g/mL= 500g de agua Entonces: molalidad (m) 5,61g 0,50Kg * 56,1g/mol molalidad (m) 0 , 2 ( mol / Kg ) 0 , 2 m Fracción Molar Se define como la relación entre la cantidad de un componente de la disolución, en mol y la cantidad total de las especies presentes en el sistema. Xi ni n totales Xi= Fracción molar del constituyente “i” ni= cantidad (en moles) del constituyente “i” Fracción Molar Determine la fracción molar del agua y del etanol cuando se disuelven 2,0 mol de agua en 8,0 mol de etanol. Respuesta: n totales n agua n etanol 2,0mol + 8,0mol = 10,0mol Entonces la fracción molar: del agua: del etanol: X X H2O EtOH 2,0mol 0 , 20 10,0mol 8,0mol 10,0mol 0 ,80 Ejercicios Propuestos 1. Una disolución está formada por 8 g de soluto y 250 g de agua. Sabiendo que la densidad de la disolución es de 1,08 g/mL. Calcule la concentración de la disolución en g/L, %pp, %pv. Sol: 33,47 g/L; 3,10%pp; 3,35%pv 2. Calcule la molalidad de una disolución de ácido sufúrico que contiene 24,4 g de ácido sufúrico en 198 g de agua. La masa molar de H2SO4 es 98,08 g/mol Sol: 1.26 molal Ejercicios propuestos Libro Chang. 10 edición A.Pag. 163. 4.60, 4.62, 4.64, 4.66 B.Pag. 546 12.16, 12.18, 12.22, 12.24