DISOLUCIONES. CONCENTRACIÓN Conceptos: Mol (S.I.
Anuncio
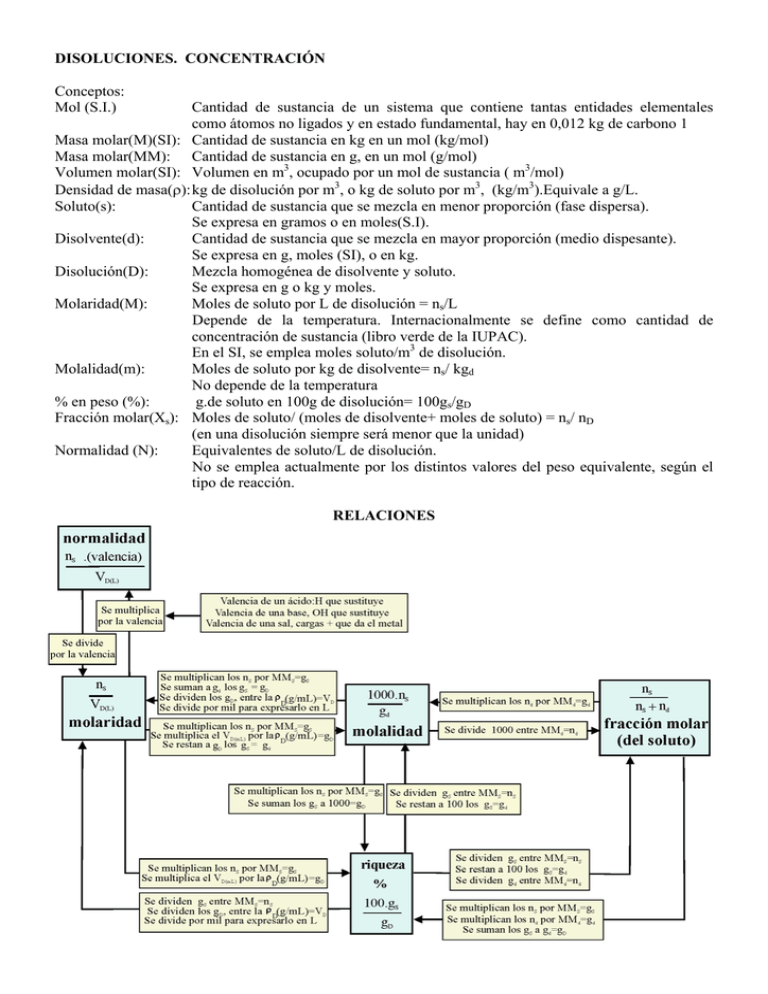
DISOLUCIONES. CONCENTRACIÓN Conceptos: Mol (S.I.) Cantidad de sustancia de un sistema que contiene tantas entidades elementales como átomos no ligados y en estado fundamental, hay en 0,012 kg de carbono 1 Masa molar(M)(SI): Cantidad de sustancia en kg en un mol (kg/mol) Masa molar(MM): Cantidad de sustancia en g, en un mol (g/mol) Volumen molar(SI): Volumen en m3, ocupado por un mol de sustancia ( m3/mol) Densidad de masa(ρ): kg de disolución por m3, o kg de soluto por m3, (kg/m3).Equivale a g/L. Soluto(s): Cantidad de sustancia que se mezcla en menor proporción (fase dispersa). Se expresa en gramos o en moles(S.I). Disolvente(d): Cantidad de sustancia que se mezcla en mayor proporción (medio dispesante). Se expresa en g, moles (SI), o en kg. Disolución(D): Mezcla homogénea de disolvente y soluto. Se expresa en g o kg y moles. Molaridad(M): Moles de soluto por L de disolución = ns/L Depende de la temperatura. Internacionalmente se define como cantidad de concentración de sustancia (libro verde de la IUPAC). En el SI, se emplea moles soluto/m3 de disolución. Molalidad(m): Moles de soluto por kg de disolvente= ns/ kgd No depende de la temperatura % en peso (%): g.de soluto en 100g de disolución= 100gs/gD Fracción molar(Xs): Moles de soluto/ (moles de disolvente+ moles de soluto) = ns/ nD (en una disolución siempre será menor que la unidad) Normalidad (N): Equivalentes de soluto/L de disolución. No se emplea actualmente por los distintos valores del peso equivalente, según el tipo de reacción. RELACIONES