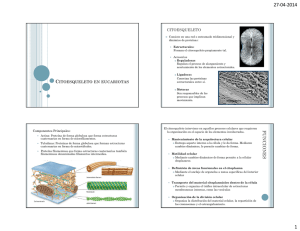
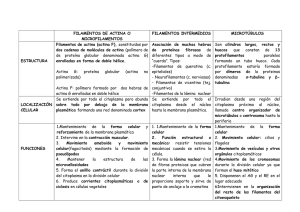
Descargar
Anuncio

1 M Á Q U I N A S V I V I E N T E S ¿ C Ó M O M U E V E N L A S C É L U L A S ? S E Autores: ISAURA MEZA / EUGENIO FRIXIONE http://bibliotecadigital.ilce.edu.mx/sites/ciencia/menu.htm COMITÉ DE SELECCIÓN EDICIONES DEDICATORIA PREFACIO I. INSTRUCCIONES PARA LA FABRICACIÓN DE ....PARTES: LA MOLÉCULA DEL ADN II. FABRICACIÓN DE LAS PARTES: DEL ADN ....A LAS PROTEÍNAS III. ENSAMBLE DE LAS PARTES: DE LAS ....PROTEÍNAS A LA ORGANIZACIÓN ....SUPRAMOLECULAR IV. COMBUSTIBLE PARA EL MOVIMIENTO: ....BOENERGÉTICA V. MOTORES Y MÁQUINAS SIMPLES: ....MECANOENZIMAS Y POLÍMEROS DE SOPORTE VI. APARATOS DE PRECISIÓN: MOTILIDAD COORDINADA VII. SISTEMAS MIXTOS: MOVIMIENTO GENERADO POR MICROTÚBULOS ....POLÍMEROS Y MICROFILAMENTOS VIII. OPERACIÓN DE LA MAQUINARIA: REGULACIÓN CELULAR CONTRAPORTADA 2 C O M I T É D E Dr. Antonio Alonso Dr. Juan Ramón de la Fuente Dr. Jorge Flores Dr. Leopoldo García-Colín Dr. Tomás Garza Dr. Gonzalo Halffter Dr. Guillermo Haro † Dr. Jaime Martuscelli Dr. Héctor Nava Jaimes Dr. Manuel Peimbert Dr. Juan José Rivaud Dr. Emilio Rosenblueth † Dr. José Sarukhán Dr. Guillermo Soberón Coordinadora Fundadora: Física Alejandra Jaidar † Coordinadora: María del Carmen Farías S E L E C C I Ó N 3 E D I C I O N E S Primera edición 1996. La Ciencia para todos es proyecto y propiedad del Fondo de Cultura Económica, al que pertenecen también sus derechos. Se publica con los auspicios de la Secretaría de Educación Pública y del Consejo Nacional de Ciencia y Tecnología. D. R. © 1996, FONDO DE CULTURA ECONÓMICA Carretera Picacho-Ajusco 227; 14200 México, D.F. ISBN 968-l 6-4988-5 Impreso en México 4 D E D I C A T O R I A A la memoria del doctor DANIEL MAZIA 5 P R E F A C I O La vida es movimiento. La íntima relación entre estos dos conceptos ha sido cincelada en la imaginación humana de manera estremecedora, con la repetida observación de que el fin de la vida—la muerte— tiene como señal inequívoca la cesación irreversible del movimiento. El vínculo ha parecido tan claro para todas las culturas que, casi sin excepción, se le ha supuesto de validez bidireccional: el movimiento es signo de vida. Las personificaciones del viento, el océano y los astros como individualidades dotadas de conductas voluntarias en las mitologías de todas las épocas, derivan precisamente de la asociación intuitiva entre movimiento y vitalidad. En nuestros días la biología ha podido confirmar que, si bien no todo lo que se mueve está vivo, el movimiento organizado caracteriza a lo viviente prácticamente en todas sus manifestaciones. Hoy está claro que al menos a escala microscópica todos los organismos muestran algún tipo de actividad — crecimiento, división, cambio de forma, locomoción— que implica redistribuciones ordenadas de su propia sustancia en el espacio. Esta singular capacidad de la materia viviente, con sus innumerables variantes, ha constituido uno de los más pertinaces enigmas de la biología. Desde los asombrosos hallazgos de Leeuwenhoek, dados a conocer por primera vez en 1673, se han acumulado pruebas de que la aptitud de moverse por fuerza propia se encuentra incluso en los organismos más diminutos. Pero sólo hasta las dos últimas décadas, gracias al desarrollo de poderosos recursos en el campo de la microscopía y la biología molecular, se ha logrado integrar un cuerpo de teoría en el que la profusa diversidad de fenómenos de movimiento biológico halla su explicación en un conjunto limitado de componentes y mecanismos básicos del citoplasma. Las páginas que siguen intentan ofrecer, en términos accesibles al público general, una visión panorámica de los elementos operativos esenciales que hacen posible la motilidad celular. El libro ha sido escrito con un enfoque inédito hasta ahora. En lugar de la clásica introducción general seguida por un catálogo de ejemplos acompañados de sus explicaciones particulares, se hace una exposición progresiva de las piezas que conforman la maquinaria motriz intracelular, desde su origen común a partir de la información genética hasta su integración en tipos cada vez más complejos de máquinas y aparatos alimentados por energía metabólica. El texto cubre, pues, aspectos de la biología molecular; la biología celular y la fisiología, teniendo a la vez en mente a un ingeniero curioso por saber cómo se las arregla la materia viva para fabricar y montar dispositivos capaces de efectuar movimientos autónomos, desde el simple tránsito de partículas intracelulares en una alga primitiva hasta las espectaculares piruetas de un acróbata consumado. Enmarcar un espectro de esta amplitud en el formato de un volumen de divulgación ha exigido restringir o incluso eliminar por 6 completo algunos asuntos. Las decisiones en este sentido, aunque arbitrarias, han obedecido a los criterios siguientes: 1) Nos hemos circunscrito a revisar el tema a partir de la célula individual como unidad fundamental de los seres vivientes. Se excluye por consiguiente el interesante y complejo material relativo a la interacción entre células en los organismos multicelulares. Así, por ejemplo, el capítulo que trata sobre la contracción de los músculos concluye sin incursionar en el control nervioso del trabajo muscular. 2) Se tratan únicamente los principales sistemas de motilidad, es decir; aquellos que han sido muy conservados por la evolución y dan cuenta de la inmensa mayoría de los movimientos biológicos. No se encuentran, en consecuencia, casos especiales —como los flagelos de los procariontes, los espasmonemas de los vorticélidos, el curioso mecanismo de invasión de los microsporidios, o las respuestas motoras por cambios de turgencia en algunas plantas—, cuya operación es independiente o paralela a la del citoesqueleto típico. 3) Se menciona sólo brevemente todo cuanto toca a la regulación del movimiento celular; dado que constituye un campo en el que — aparte de la intervención casi universal de los iones de calcio— no existe un esquema teórico de validez general equivalente a los que han logrado establecerse en relación con los aspectos propiamente mecánicos de la motilidad, o con la síntesis de las proteínas que desempeñan un papel central en tales procesos. Esperamos que, no obstante estas limitaciones inescapables, los lectores encontrarán en este libro una ventana abierta hacia la información disponible hoy en día sobre ese atributo fundamental y fascinante de la vida, el movimiento. Deseamos hacer constar nuestro agradecimiento a los miembros de los grupos de investigación que, de una manera u otra, colaboraron con nosotros en la obtención de algunas de las imágenes micrográficas que nos sirvieron para ilustrar las células o componentes del citoesqueleto que aparecen en este libro. En particular a Lourdes Ruiz Zamarripa, Roberto Lagunes Torres y Alejandro Trejo Carmona. México, D.F, diciembre de 1993. 7 I . I N S T R U C C I O N E S P A R A L A F A B R I C A C I Ó N D E P A R T E S : L A M O L É C U L A D E L A D N EL MOVIMIENTO de las células, igual que sus demás funciones, es como el de una maquinaria integrada por muchas piezas que deben funcionar con precisión. A diferencia de las máquinas construidas por el hombre, la célula tiene que fabricar todas y cada una de sus partes y ensamblarlas después en un conjunto funcional. En gran medida el ensamblaje de las partes procede de manera automática gracias a que las piezas tienen formas definidas y complementarias que encajan unas con otras como en un rompecabezas. Por consiguiente, la funcionalidad del conjunto depende de la precisión en la fabricación de las partes, lo cual asegura el engranaje perfecto. La célula cuenta con los planos o instrucciones para fabricar estas piezas en un código almacenado en las moléculas de ácido desoxirribonucleico (ADN), el cual se encuentra contenido dentro del núcleo en la mayoría de las células. Estas instrucciones son muy importantes y necesarias para el correcto funcionamiento de cada ser vivo, por lo que deben preservarse cuidadosamente y ser transmitidas de generación en generación, ya que constituyen el material genético. Una molécula de ADN tiene una estructura helicoidal, parecida a una escalera de caracol que gira hacia la derecha y en la que los escalones están formados por un par de moléculas planas unidas entre si por puentes angostos, llamados puentes de hidrógeno, unidas a la vez, como los eslabones de una cadena, a las moléculas que forman los escalones contiguos a través de uniones químicas covalentes denominadas enlaces fosfodiester. Las moléculas planas de los escalones son bases nitrogenadas de cuatro variedades, adenina, guanina, citosina y timina y se representan como A, G, C y T. Debido a sus formas y dimensiones particulares cada base del par, o sea un medio escalón, sólo puede hacer pareja con otra base especial para completar el escalón. Así tenemos que A se aparea solamente con T, y G solamente con C, lo que da como resultado que las bases de un escalón sean siempre complementarias. Los escalones son distintos entre sí y pueden estar ordenados en una gran diversidad de secuencias, tantas como las combinaciones posibles en el alfabeto que maneja la célula, que es de cuatro letras, A, T, G, C. La conexión, entre las bases de una misma cadena se hace por enlaces que se establecen entre las moléculas del azúcar des oxirribosa que acompaña cada una de las bases y grupos fosfato asociados a los oxidrilos de las desoxirribosas (Figura I.1). 8 Figura I.1. Organización de las bases en las cadenas de la doble hélice del ADN. A = adenina, T = timina, G = guanina, C = citosina, D = azúcar desoxirribosa, P = enlace fosfodiéster. Al conjunto que forman una base, su azúcar y uno o más fosfatos se le llama un nucleótido. Será un nucleótido monofosfato si tiene un fosfato, nucleótido difosfato si tiene dos, etc. En la molécula del ADN un fosfato une a dos nucleótidos formando el enlace fosfodiester (Figura I.2). Una secuencia definida de pares de bases constituye lo que se llama un gen, la variabilidad en la secuencia de bases forma el código genético. En los genes de un organismo está la información precisa, que al ser descifrada permite construir las piezas necesarias para que funcionen las diferentes máquinas que en su conjunto forman una célula. El núcleo de pares de bases y de genes en un organismo puede ser muy variable. El ADN de un virus tiene alrededor de 5 000 pares de bases, mientras que el ADN humano 4 500 millones. 9 Figura I.2. Fórmula y representación esquematica de los nucleótidos trifosfato. En 1953, James Watson y Francis Crick, trabajando juntos en Inglaterra; y basándose en estudios de otros investigadores, como Linus Pauling, Rosalind Franklin y Maurice Wilkins, concibieron un modelo de la estructura del ADN que reunía todos los requisitos de una molécula autorreplicable. Este modelo es conocido como el modelo de la doble hélice y corresponde a la forma como se ha comprobado experimentalmente que se arreglan estas moléculas (Figura I.3). Este modelo tuvo gran repercusión sobre todo el pensamiento biológico del momento, ya que la estructura propuesta contiene dentro de sí misma todos los elementos que le permiten, por un lado, almacenar la información genética y transmitirla y, por el otro, duplicarla, asegurando que la información almacenada pase a otras generaciones, con lo cual cumple con los requisitos para ser un almacén de información tan importante. 10 Figura I.3. Imagen tridimensional de la doble hélice. Una mólécula de ADN que contiene miles de pares de bases puede tener longitudes macroscópicas, es decir, que se podrían medir con una regla y hasta con un metro. El ADN de la bacteria Escherichia coli por ejemplo, tendría 1 mm de longitud, o sea 1 000 veces más largo que la longitud total de la bacteria. Para caber dentro de esta célula el ADN tiene que ser compactado, como sucedería al rehacerse un ovillo de estambre que se ha desmadejado. En los organismos eucariontes, llamados así porque sus células contienen un núcleo, el ADN no está en el citoplasma, como en las bacterias, sino dentro del núcleo, el cual a su vez está contenido dentro de la célula y por consiguiente es muy pequeño. En este caso la molécula de ADN, cuya longitud es mayor que el ADN de las bacterias, tiene que compactarse muchísimo y esto se logra enredándose sobre otras moléculas, que son las proteínas llamadas histonas. Se forma así la unidad básica de las estructuras conocidas como cromosomas y de las cuales todos los organismos mantienen un número constante. La longitud del ADN cuando se empaca en un núcleo se reduce de 1.5 m para formar cromosomas cuya longitud promedio es de 1 x 10-6m (Figura I.4). 11 Figura I.4. Los estados de comparación de la cromatina para formar un cromosoma. Independientemente de la forma en que el ADN se compacte, la información genética está siempre contenida en la estructura primaria de la doble hélice. Al ser complementarios todos los pares de bases, la clave escrita en la secuencia de bases en una de las cadenas de la hélice, correspondiente a la mitad de los escalones, será el molde de la otra mitad. Una analogía a esta situación sería lo que es el positivo y el negativo en una película fotográfica, que tienen la misma imagen pero complementaria. La clave se puede ir descifrando en cualquiera de las dos cadenas pero leyéndola en sentidos opuestos, como puede verse en la Figura I.1. Por esta razón se dice que una molécula de ADN tiene polaridad. Cada cadena 12 tiene entonces un extremo 5´ y uno 3´ en lados opuestos. Por la polaridad y complementaridad del arreglo de las bases siempre se puede reconstruir un medio escalón, ya que se sabe qué base se necesita para completarlo, y si se daña una de las cadenas, ya sea en su totalidad o solamente en un fragmento, este daño podrá repararse copiando de la cadena intacta (que será el molde) la secuencia dañada. Esta reparación restituye así la información completa. Ya que la información genética tiene que transmitirse de generación en generación, las moléculas del ADN deben duplicarse muchas veces, tantas como una célula se divida para formar dos nuevas células y debe hacerlo con alta fidelidad. ¿Cómo puede entonces duplicarse una molécula tan grande y compleja? La replicación del ADN requiere a su vez de la duplicación de cada una de las cadenas por separado, lo cual se puede hacer si en principio las dos cadenas de la hélice se separan (Figura I.5). Abrir todos los puentes que unen a los pares de bases de cada escalón requiere gran cantidad de energía, esto y la formación o síntesis de las nuevas cadenas necesita la participación de otras moléculas que proporcionen la energía, y que como ayudantes mantengan abiertas a las cadenas maternas para que los nucleótidos puedan ser adicionados a las cadenas nuevas. Estas moléculas ayudantes son las proteínas llamadas enzimas, las cuales pueden actuar como catalizadores de reacciones químicas. Se unen a las moléculas que participan en la reacción, llamadas substrato, aumentando su concentración local en el sitio en donde se llevará a cabo la reacción y manteniendo la orientación correcta de los grupos químicos reaccionantes. Además, al unirse al substrato, la energía derivada de esta unión contribuye a la catálisis. Al final de la reacción la enzima se desprende del substrato ya modificado, quedando lista para actuar de nuevo. El proceso de replicación de una molécula del ADN demanda alta fidelidad y podría dividirse en tres grandes etapas. La primera es la selección del nucleótido que se va a incorporar a la molécula nueva y el desenrollamiento de las cadenas en el sitio en donde va a empezar la replicación y se incorporan los nucleótidos seleccionados. 13 Figura I.5. Replicación del ADN. El crecimiento en la dirección 5´- 3´ es el que sucede en forma continua. No se ha encontrado ninguna polimerasa que pueda agregar nucleótidos en la dirección 3´- 5´. Una vez incorporado un nucleótido a la nueva cadena, hay que asegurarse que es el correcto, es decir, el complementario a la base o letra que se está leyendo en la cadena que sirve de molde. Un error en esta parte implica que el nucleótido tendrá que ser eliminado, pues de lo contrario el código se altera y al descifrarlo se tendrá una palabra incorrecta y una instrucción errónea. Finalmente, una vez terminado el ensamble de los nuevos nucleótidos en una cadena hay que asegurarse de la fidelidad de la copia y hacer las correcciones necesarias, como un editor al revisar un texto recién escrito o impreso. La enzima llamada polimerasa del ADN es la que se encarga de seleccionar el nucleótido adecuado y meterlo a la cadena que se está construyendo. Los nucleótidos se incorporan al ADN como nucleótidos trifosfato, se pegan entre sí formando el enlace químico llamado fosfodiéster, perdiendo dos grupos fosfato. El apareamiento correcto ya mencionado, y que solamente se da entre bases complementarias, A con T y C con G, es aparentemente la forma más estable desde el punto de vista energético. Sin embargo, se ha calculado que se introduce un nucleótido que no corresponde por cada 10 millones de pares de bases; este 14 nucleótido es sacado de la cadena al romperse fosfodiéster por otra enzima llamada exonucleasa. su enlace En algunos casos se pasa por alto el error y esto puede resultar en un beneficio para el organismo, ya que el futuro de una población depende en parte de su habilidad para cambiar y adaptarse fabricando piezas de máquinaria con ciertas ventajas para una nueva situación. Estos cambios o mutaciones suceden frecuentemente cuando las condiciones del medio ambiente se hacen más difíciles. Tal posibilidad de cambio y adaptación, iniciada en las secuencias de las bases del ADN, constituye la base molecular del proceso evolutivo de las especies conocido como selección natural. La polimerasa únicamente puede incorporar los nucleótidos en una de las dos cadenas a la vez, pues lo hace leyendo el mensaje que está en la cadena que tiene la orientación 3´-5´s. ¿Cómo se hace entonces la síntesis de la otra cadena que tiene la polaridad invertida? El proceso es un poco diferente y la copia de esta cadena se hace ensamblando pequeños fragmentos sobre las bases que llevan la orientación correcta 3´-5´, aunque por esta razón la incorporación de nucleótidos no puede ser continua. Estos fragmentos son sintetizados después de un iniciador formado por ribonucleótidos del ácido ribonucleico (ARN) y se denominan fragmentos de Okazaki (su descubridor), y están unidos o ligados por una enzima llamada ligasa, previo desprendimiento del ARN iniciador. La fabricación o sin tesis de esta cadena es más lenta, ya que implica la participación de varias enzimas y un mecanismo más complejo (Figura I.6). 15 Figura I.6. Ilustración de un punto de replicación en la doble hélice. Se muestran las varias enzimas que participan. La síntesis de nuevas cadenas del ADN también requiere del desenrollamiento de la doble hélice en el punto de replicación para que puedan; llevarse a cabo todas las acciones de incorporación de nuevos: nucleótidos. Esto se realiza mediante enzimas específicas que facilitan el proceso, como las llamadas topoisomerasas, B helicasa, etc., que ayudan a desenrollar la doble hélice y a mantener las dos cadenas separadas mientras se incorporan los nucleotidos. Estos procesos necesitan de la energía que es provista por el ATP. En el caso de que el ADN se asocie a proteínas, como sucede en los organismos nucleados, la replicación del ADN va acompañada por la síntesis de estas proteínas, ya que la nueva molécula del ADN debe enrollarse nuevamente sobre ellas para formar los cromosomas. Entendiendo la estructura de la doble hélice, ¿podremos conocer la secuencia en que se ordenan las bases para formar genes en una determinada molécula de ADN? Cada célula humana, por ejemplo, contiene aproximadamente 100 000 genes, cuya información, al ser descifrada, permite formar un ser humano funcional. Esta información contenida en el ADN de cada organismo constituye su genoma. Descifrar la estructura de los genes de: un genoma, 16 aunque éste corresponda a un organismo primitivo o tan complejo como un ser humano, es una tarea de grandes proporciones, ya que hablamos de millones de pares de bases. Sin embargo, las nuevas técnicas desarrolladas para el estudio del ADN hacen posible pensar que en un futuro próximo se podrá tener descifrado el genoma humano. Ya se han localizado 1 500 de los genes humanos en varios de los 23 pares de cromosomas que forman el mapa cromosómico humano. Una de las técnicas más promisorias en la tarea de identificar genes es la posibilidad de introducir y multiplicar, dentro de las bacterias, fragmentos del ADN de cualquier organismo. Esta multiplicación de fragmentos específicos, llamada donación, permite que el ADN introducido (extraño) se replique y amplifique en las bacterias, las cuales al crecer y multiplicarse producen cantidades grandes de los fragmentos del ADN extraño. Si se logra obtener un número grande de bacterias recombinantes (aquellas que han integrado fragmentos del ADN extraño) , la posibilidad de tener donados a la mayoría de los genes contenidos en el ADN de cualquier organismo es también muy alta. Se tiene así lo que se llama una biblioteca genómica, ya que de ésta podrá sacarse en cualquier momento la información guardada junto con el ADN de las bacterias. Los diferentes genes presentes en una biblioteca de este tipo pueden identificarse; por varias metodologías que se han desarrollado en los últimos años y que por su importancia en la investigación biológica les ha merecido a sus inventores el codiciado premio Nobel. Una vez identificado el gen, su secuencia de nucleótidos se establece caracterizando a las bases que la forman por sus propiedades químicas y físicas. En este punto ha sido muy importante el descubrimiento de enzimas que pueden romper las cadenas del ADN en sitios en donde hay una secuencia particular de bases, como sería por ejemplo AGTC. Al usar la enzima que solamente rompe a esta secuencia sabemos de antemano que si se rompe el ADN que estamos estudiando es porque existe esta secuencia en el gen. El uso de una combinación de este tipo de enzimas facilita no sólo la identificación de las bases sino que nos permite conocer su arreglo lineal en una molécula de ADN. Con estas metodologías se ha podido conocer la secuencia de varios genes y establecer que no todos sus nucleótidos contienen la información utilizable para construir las partes de la maquinaria. Estas secuencias, sin información, tienen una función regulatoria, necesaria para que pueda descifrarse la clave de un gen, asegurando, a través de programas bien establecidos, cuándo y como se va a transmitir la información contenida en el gen. Hay también algunas secuencias en el ADN que no contienen ningún mensaje pero cuyo papel regulatorio se ejerce cuando la molécula del ADN se va a duplicar, cuando se desenrolla y vuelve a enrollarse para formar los cromosomas o también cuando se desenreda un poco mientras se pasa la información del código a otras moléculas encargadas de llevar las instrucciones a los sitios donde se fabrican piezas para las máquinas celulares. 17 I I . F A B R I C A C I Ó N D E L A S P A R T E S : D E L A D N A L A S P R O T E Í N A S COMO vimos anteriormente, la escalera que forma a la molécula del ADN puede abrirse longitudinalmente al separarse las mitades de los escalones temporalmente por rompimiento de los puentes de hidrógeno que mantienen unidas a las bases complementarias. Cada mitad de escalón, desconectada, puede entonces asociarse a una contraparte provisional, formando así un nuevo par de bases. La cadena de bases sintetizada sobre el molde del ADN es necesariamente complementaria al segmento abierto de la escalera. A medida que la molécula del ADN se abre y la información se transmite, se va formando una nueva molécula complementaria. La cadena sintetizada será de ADN cuando el ADN se duplica, mientras que cuando la información del ADN se pasa a una molécula de ácido ribonucleico (ARN) decimos que el código ha sido transcrito. SÍNTESIS DE LOS INTERMEDIARIAS ARNs: FABRICACIÓN DE MOLÉCULAS Los ARNs fueron hallados primeramente en las células formando las estructuras llamadas ribosomas que participan en la síntesis de proteínas. Años después se descubrieron los ARNs de transferencia (ARNt) y los ARNs mensajeros (ARNm). En los últimos años se ha identificado un gran número de ARNs pequeños dentro del núcleo de las células (ARNsn). A diferencia del ADN, cada molécula del ARN está formada por una sola cadena de bases, esto es, como si fuera sólo media escalera y por lo tanto no tiene estructura de doble hélice. Tres de las bases son idénticas a las del ADN (A, G, C,), y el uracilo (U) sustituye a la timina apareándose perfectamente con la adenina. Las bases en las moléculas de los ARNs contienen además un azúcar diferente al que se encuentra en el ADN. Los nucleótidos se asocian al azúcar llamado ribosa, mientras que en el ADN se asocian a la desoxirribosa, cuyas uniones entre los átomos de carbono son mas estables. Por esta característica los ARNs son más lábiles, es decir, se rompen con facilidad. Los diferentes tipos de ARNs varían de tamaño. Hay ARNs muy grandes, como los ribosomales, que pueden tener miles de nucleótidos y ARNs pequeños con solamente 25-30 nucleótidos. Cada uno de ellos tiene una función diferente en las células, aunque todas ellas están relacionadas con la transmisión de la información genética. Participan en la edición de los mensajes, ya sea que ellos mismos lleven el mensaje, o se encarguen de dirigir el ensamblaje de las proteínas seleccionando a los componentes de éstas y llevándolos a la línea de ensamble. Tenemos así que las moléculas de ARN mensajero (Figura II.1) llevan las instrucciones del ADN a ribosomas que son la línea de ensamble. Ahí, el mensaje se descifra para. tener las instrucciones y acomodar las partes que forman urna proteína específica. En este nivel se requiere la ayuda de los" ARN de transferencia (Figura. II.2), cuyo papel es llevar los aminoacidos, que son los componentes de una proteína, al sitio de ensamble. 18 Figura II.1. Estructura del ARN mensajero. Figura II.2. Asas y regiones de doble cadena en los ARN de transferencia (ARNt). La región variable en los diferentes ARNt corresponde al anticodón, donde se une al codón correspondiente en el ARN mensajero. El extremo 3´ es al que se unen los aminoácidos. Los ribosomas mismos están constituidos por ARN ribosomales (Figura II.3). Cada ribosoma está formado por tres moléculas de ARN, que en este caso tienen un papel estructural. Los ARNs que son de tamaño muy pequeño (ARNsn) tienen una participación importante en la edición de los mensajes, es decir, participan en la modificación del ADN mensajero, para asegurar que cuando éste llegue a los ribosomas lleve un mensaje correcto. 19 Figura III.3. El complejo arreglo de asas y regiones de doble cadena que muestran las ARN ribosomales en procariontes (16S) y en eucariontes (18S). Se nota una cierta similitud estructural entre los ARN, la cual se mantiene en toda la escala evolutiva. El tener un material primario o precursor que puede ser arreglado en diferentes formas por corte y reunión de fragmentos de las moléculas de ARN, ofrece un gran número de posibilidades para hacer: 1) diferentes mensajes a partir de una información limitada, y 2) corrección de errores que no se hubieran detectado en la transcripción primaria. Por otro lado, al estudiarse estos procesos quedó claro para los investigadores que estas modificaciones de los ARNs, que implican actividades enzimáticas inherentes a las mismas moléculas, podrían explicar cómo se originó la clave de la información genética y los mecanismos para preservarla y transmitirla. Si consideramos al ARN como el primer biopolímero, o sea, la primera macromolécula biológica que se formó en la tierra primitiva, sus características de enzima le habrían permitido romper y reunir diferentes fragmentos de sí misma, proceso llamado autocatálisis, hasta formar fragmentos con información coherente y por lo tanto utilizable. Una vez formados los fragmentos podrían dar instrucciones para fabricar proteínas. Más tarde, a partir de estos mismos ARNs, se originarían moléculas del ADN, ya que las bases de los dos tipos de moléculas son siempre complementarias. Este paso habría requerido de la reacción inversa a la reacción conocida como transcripción y de la cual ya hemos hablado. De hecho se ha probado que se presenta esta reacción y es mediada por la enzima transcriptasa reversa, que ya ha sido identificada por varios investigadores en todas las células. El ADN como tal, por sus características de estabilidad y capacidad de autorreplicación, sería seleccionado como el almacén de la información genética primeramente organizada al azar por las moléculas primitivas de ARN. Desde ese momento el flujo de información sería de ADN a ARN y se origina la fabricación de proteínas. La transcripción del ADN para formar una molécula de ARN se hace por las enzimas llamadas polimerasas del ARN, que incorporan 20 ribonucleótidos en una cadena leyendo siempre la información que está en el ADN en la dirección 3´-5´ (Figura II.4). Las diferentes polimerasas se encargan de sintetizar los distintos tipos de ARNs por un mecanismo idéntico. Cada polimerasa empieza a leer un mensaje en el ADN cuando encuentra una señal que le indica dónde y qué tan rápido debe leerlo. Esta señal puede ser una secuencia especial de bases o la presencia de proteínas reguladoras en el sitio en donde se inicia la lectura. Una vez iniciada la lectura la polimerasa continúa incorporando ribonucleótidos a la cadena nueva hasta que se encuentra una señal en el ADN que le indica que ahí acaba la lectura de ese mensaje. Este mensaje o transcrito primario se desprende del ADN y de la polimerasa, y queda libre para ser modificado o llevado directamente a los ribosomas. El ADN puede volver a cerrar sus medios escalones en la región de la molécula que fue transcrita. Si el transcrito tiene información para hacer proteínas es un precursor de ARN mensajero. El transcrito puede ser también precursor de ARNs ribosomales, de ARNs de transferencia o de ARNs pequeños. 21 Figura II.4. Esquema de la transcripción: A) Llegada de la ARN- polimerasa a su promotor; B) desdoblamiento de la doble hélice para que se inicie la síntesis de ARN; C) iniciación de la síntesis de ARN; D) alargamiento del ARN a medida que se desplaza la polimerasa; E) el ARN transcrito se desprende ya completo, al igual que la polimerasa. El primer nivel de control de la traducción de un mensaje viene desde la modificación adecuada del mensaje que va a salir del núcleo a través del proceso de edición, en un segundo paso ese mensaje se traducirá siempre y cuando tenga las características esenciales. Por ejemplo, para el primer nivel un ARNm se puede transcribir en todas las células de un organismo; sin embargo, sólo es editado adecuadamente en algunas de ellas, permitiendo que la proteína correspondiente se sintetice solamente en algunas células. Para el segundo nivel de control se puede usar como ejemplo la presencia y longitud de una secuencia localizada en el extremo 3´ de la mayoría de los ARNm, como se ve en la figura II.1. Esta secuencia de alrededor de 200 bases está formada exclusivamente de adeninas, por lo que se le conoce como el extremo poli A. La longitud de este poli A determina la velocidad y frecuencia de traducción de un ARNm, de modo que ARNs mensajeros con un poli A muy pequeño ya no se asocian con ribosomas para sintetizar proteínas, de donde se ha propuesto que la célula no utiliza mensajeros viejos que podrían estar alterados o dañados. El precursor de un ARNm tiene además bloqueado su extremo 5´ por una guanina que se coloca en posición invertida en la cadena de 22 ribonucleótidos, formando un tapón (Figura II.5), por lo cual no puede ser desprendida por las enzimas que romperían, un enlace fosfodiéster típico. Este bloqueo se conserva para proteger a la molécula de ARNm durante el proceso de edición, al igual que la secuencia poli A mencionada anteriormente. Otras secuencias que se conservan en el ARNm modificado, esto es, aquellas que codifican a la proteína respectiva, se llaman exones. Las secuencias que se eliminan durante la modificación se llaman intrones. Figura II.5. Bases metiladas en el tapón o casquete del extremo 5´de los ARN mensajeros. Un transcrito primario puede entonces tener varios exones y varios intrones. Por ejemplo; el gen de ovalbumina, una proteína formada por aproximadaniente 4 300 aminoácidos, contiene las secuencias de siete intrones que se transcriben al ARNm y se eliminan cuando el ARNm se modifica. El ARNm que se encuentra en los ribosomas sólo tiene las secuencias que codifican 4 300 aminoácidos que forman la proteína. Se ha especulado que los intrones, al no tener un mensaje, son los sitios en que pueden introducirse; alteraciones (en donde la frecuencia de mutación es muy alta) y aun preservar sin cambio aquellas secuencias que tienen mensajes que no pueden alterarse para el funcionamiento normal de las células. La modificación de los ARNm por remoción de intrones se conoce como splicing que en español correspondería a edición (Figura II.6). En este proceso participan los ARNsn formando partículas ribonucleoproteicas sobre las que se hace la edición. La edición del mensaje se hace eliminando partes que no se necesitarán para entender las instrucciones y construir una determinada pieza o proteína o reuniendo fragmentos de mensajes provenientes de diferentes regiones del ADN y que al unirse adquieren sentido. Este último proceso de edición seria el equivalente a formar un párrafo recortando y pegando palabras de varios artículos diferentes de una revista. Los ARNs ribosomales y los ARNs de transferencia se sintetizan también de precursores que se transcriben de regiones 23 especiales del ADN utilizando polimerasas que reconocen las señales específicas para que estas moléculasfpuedan sintetizarse. Se transcriben como precursores y deben ser modificados mediante edición de los transcritos primarios para que puedan convertirse en moléculas funcionales. Estos ARNs así como los ARNs pequeños no tienen información para hacer proteínas y participan en los diferentes mecanismos que resultan en la transcripción de la información de un gen y en la síntesis de las proteínas. Figura II.6. Proceso de edición (splicing) de un ARN mensajero snrp = partículas ribonucleoproteicas. Los números 1 a 6 se refieren a diferentes tipos de partículas: A) mensajero que se va a editar; B) eliminación del intrón; C) formación de la estructura de lazada (lariat); D) mensajero editado. PRODUCCIÓN DE LAS PARTES: SÍNTESIS DE PROTEÍNAS Las proteínas corresponden a las partes de las diferentes maquinarias celulares que ejecutan las instrucciones almacenadas en el ADN. Las instrucciones no se limitan a cómo unir a los aminoácidos sino que también indican cuándo se traduce el mensaje del cual se construye una proteína y el orden en que ésta debe construirse. Las instrucciones también permiten que se puedan hacer muchas copias de una proteína cuando así se requiera. Cada secuencia de tres nucleótidos en un ARNm forma un codón, es decir, la unidad mínima en la clave que, al descifrarse, indica qué aminoácido se selecciona para ponerlo en la línea de ensamble. Un ARNm debe ser por lo tanto tres veces más largo en nucleótidos que la proteína que codifica. Cuando un ARNm especifica su información se dice que esta siendo traducido, pues ése es el momento en que la información contenida 24 originalmente en el ADN se interpreta y se puede sintetizar una proteína. Los ARNs de transferencia son los encargados de seleccionar cada uno de los aminoácidos, lo reconoce y se une a él a través de su extremo 5´. Los ARNt cargados llegan a los ribosomas, en donde el ARNm está siendo traducido y translocan al ribosoma el aminoácido necesario para que la proteína se vaya formando. Cada molécula de ARNt se une solamente a un tipo de los 20 aminoácidos que se encuentran en el citoplasma de las células y de cuya combinación resultan las proteínas. En el extremo opuesto, en donde se une el aminoácido a la molécula de ARNt, hay una estructura en forma de asa y en ella está la secuencia de tres bases llamada anticodón, la cual encaja perfectamente con el codón del ARNm ya que le es complementaria (figura II.3) Al engancharse estas secuencias se asegura que el aminoácido seleccionado se incorpore en el orden preciso en la secuencia de la proteína que se está sintetizando. Todo este ensamble coordinado entre codones, anticodones y formación de enlaces químicos entre aminoácidos para fabricar una proteína se lleva a cabo sobre los ribosomas (Figura II.7). Las dos partículas de ribosomas contienen moléculas de ARN combinadas con proteínas. El ARNr de mayor tamaño (llamado de 26 ó 28S) y uno llamado 5S forman la partícula más grande y el de menor tamaño (16 ó 18S) forma la partícula pequeña. El arreglo estructural de los ribosomas permite que sobre ellos se acomoden todos los elementos que participan en la construcción de una proteína. En esta compleja línea de ensamble existen también diferentes enzimas y factores que inician y terminan la traducción del mensaje, permiten formar la unión entre los aminoácidos y desprender a la proteína completamente terminada. Un mensaje puede ser usado muchas veces si la célula requiere de una gran cantidad de una proteína determinada o puede ser descartado si sólo requiere que se traduzca una sola vez. Estos pasos son controlados por las necesidades de producción de las células y de acuerdo con programas bien establecidos, lo que lleva al buen funcionamiento de un organismo. Las proteínas constituyen más de la mitad del peso seco de una célula, tienen gran diversidad de tamaños, arreglos tridimensionales y muy variadas funciones. En el humano hay más de 100 000 proteínas diferentes. Algunas son enzimas o catalizadores de reacciones químicas dentro de las células, otras tienen actividad lítica para destruir blancos específicos y componentes extraños a la célula, y otras más forman diversas estructuras celulares. Los aminoácidos que las forman (20 diferentes) son moléculas con una estructura básica común, formada por un carbono denominado alfa, al que se une un grupo carboxilo (COOH), un grupo amino (NH2) y un residuo de varios carbonos y otros átomos que le dan a cada aminoácido su propia personalidad química y carga eléctrica. 25 Figura II.7. Traducción de un ARN mensajero y síntesis de la proteína para la cual lleva la información. De esta manera se producen aminoácidos básicos, ácidos y neutros, cuya combinación, al fabricarse una proteína, también le confiere a ésta características químicas propias. La posibilidad de combinar varios aminoácidos permite también gran versatilidad en la fabricación de proteínas y por consiguiente en las funciones que desempeñan. Los diferentes aminoácidos se unen entre sí originándose un enlace peptídico que se forma entre el grupo carboxilo de un aminoácido y el grupo amino del aminoácido que se inserta en la cadena. Una cadena o polipéptido formado de varios aminoácidos tiene entonces un extremo amino terminal y un extremo carboxilo terminal (Figura II.8). De la secuencia en que se ordenan los aminoacidos o la estructura primaria de la proteína dependerá la estructura de ésta a niveles secundarios. Por ejemplo, las interacciones entre ciertos aminoácidos pueden formar puentes de hidrógeno o puentes disulfuro y dar origen a regiones en la proteína con forma de espiral o de hojas planas. Las combinaciones que se dan en estas regiones constituyen lo que se denomina un dominio. Una proteína pequeña tiene por lo general un dominio, una grande tendrá varios. Algunas proteínas están constituidas por la asociación de varios polipéptidos idénticos, otras están formadas por polipéptidos que pueden tener diferente secuencia de aminoácidos y distinto tamaño. Las proteínas tienen que sintetizarse con mucha precisión, ya que un solo cambio en un aminoácido es suficiente para alterar su estructura y función, a veces con resultados fatales. Por ejemplo, en la proteína hemoglobina, componente principal de los glóbulos rojos de la 26 sangre, el cambio de glutámico por valina es suficiente para que esta proteína funcione inadecuadamente y se produzca en el organismo el padecimiento llamado anemia falciforme. Figura II.8. Formación de la unión peptídica entre aminoácidos para formar un polipéptido o proteína. Algunas proteínas están formadas por varios polipéptidos que una vez sintetizados interaccionan entre sí a través de enlaces diversos. Las proteínas formadas por un solo polipéptido se llaman monoméricas, a diferencia de las que tienen dos, que son diméricas, tres las triméricas, etc., hasta poliméricas. En el caso que nos interesa en este libro, que es el de las proteínas que participan en movimiento, éstas se encuentran en el citoplasma de las células formando la matriz fibrosa que constituye el citoesqueleto. Este nombre se deriva de las características estructurales de sus elementos que dan un soporte rígido alrededor del cual se organiza el resto del citoplasma y del cual depende también la forma que adopta la célula y los movimientos que puede realizar. Las primeras observaciones del citoesqueleto en el citoplasma se hicieron desde el siglo XIX. Hay descripciones detalladas de estructuras fibrosas en neuronas, realizadas por Sigmund Freud y Santiago Ramón y Cajal. Este último, usando técnicas de tinción de plata, pudo describir una matriz organizada en células de glia. No fue sino hasta los años cincuenta y sesenta que el uso del microscopio electrónico y del glutaraldehído, como fijador de células, permitieron la identificación de estructuras individuales y morfológicamente distintas dentro de la matriz citoplásmica. Sin embargo, la verdadera y diversa identidad proteica de los componentes del citoesqueleto se pudo establecer años más tarde, utilizando metodología bioquímica e inmunológica. Analizaremos los componentes proteicos más abundantes del citoesqueleto: Actina. Ésta es una proteína globular con un peso molecular de 42 700 daltones, es decir, que tiene aproximadamente 427 aminoácidos formando una cadena lineal o polipéptido. Su nombre deriva del griego y significa rayo. Es una proteína acídica, pues contiene un elevado porcentaje de aminoácidos ácidos y una carga eléctrica negativa. Tiene una molécula de Ca2+ asociada que utiliza la conformación globular y una molécula de ATP, cuyo fosfato terminal se hidroliza cuando varias moléculas se asocian y polimerizan para formar la actina filamentosa. Al enredarse dos de estos filamentos se forma un microfilamento de actina que; se ve al 27 microscopio electrónico como una fibrilla de 7- 9nm en el citoplasma de las células (Figura II.9). Figura II.9. Estructura de un monómero de actina con sus sitios de unión a Ca2+ y ATP (A) y de un polímero o microfilamento de actina (B) formado de muchos monómeros ensamblados en una doble espiral. Hay varias formas de la actina en los diferentes tipos de células de un organismo y en ocasiones dentro de una misma célula. Las diferencias se deben principalmente a sustituciones de uno o varios aminoácidos que no alteran las propiedades funcionales de la proteína. Así tenemos que la actina alfa es característica del músculo esquelético, mientras que las formas beta y gamma existen en músculo liso y estriado y en células no musculares. Esto significa que en un mismo organismo pueden existir diferentes isoformas de la actina, lo que llevó a considerar que debe haber genes diferentes para codificar a las diferentes actinas. Se ha encontrado que ciertamente existen en una célula varias copias de los genes de la actina, algunas de las cuales se expresan solamente en un tipo celular, por lo que ciertas células sólo fabrican una isoforma de esta proteína —como sería el caso del músculo esquelético—, aunque tienen la información para hacerlas todas. Algunas veces, como en el actinomiceto Dictyostelium discoideum, se expresa una sola forma de la actina, aunque hay 17 copias del gen de ésta. Una gran variedad de proteínas se asocia a la actina y gobierna de diferentes formas la configuración y función de la proteína y de los microfilamentos. Algunas de estas proteínas regulan, por ejemplo, la viscosidad de la actina purificada formando puentes entre los filamentos, otras forman haces de éstos, provocando rigidez en filamentos en paralelo, algunas forman conexiones a distancia entre las fibras aisladas, y otras mas se unen a filamentos aislados y regulan su polimerización rompiendo el filamento o estabilizándolo. Entre estas proteínas asociadas a la actina se puede citar a la gelsolina, la tropomiosina, la severina, la fimbrina, la vellosina, etc. y, desde luego, la miosina, que junto con la actina puede convertir 28 la energía química del ATP en movimiento contráctil en muchos tipos de células. Hace tiempo se pensaba que la actina y la miosina eran proteínas exclusivas de las células musculares. Ahora se sabe que también son proteínas estructurales en las células no musculares. Miosina. Es una proteína de gran tamaño. Su nombre se deriva de la voz músculo ya que es en los tejidos musculares donde se encuentra en gran abundancia. La etimología de músculo proviene del griego mus (ratón), al parecer porque los médicos hipocráticos encontraron una analogía entre estos roedores y las masas de carne que parecen deslizarse rápidamente por debajo de la piel. La miosina existe en varias formas. La miosina I tiene una cadena de aminoácidos llamada pesada, porque está formada por 1 200 a 1 400 aminoácidos y una o dos cadenas ligeras con 130 a 150 aminoácidos. Este tipo de miosinas se encuentra en células no musculares. La miosina II forma los filamentos gruesos en los sarcómeros de los músculos y también se encuentra en células no musculares que requieren la contracción de las estructuras formadas por la actina, como puede ser el anillo de constricción en una célula en división (Figura II.10). Está formada por una combinación de seis polipéptidos, dos con cadenas de 2 000 aminoácidos y dos pares de cadenas ligeras formadas por 160 a 200 aminoácidos. Por su gran tamaño esta molécula es soluble solamente a altas concentraciones de sal. Cuando se agregan estos seis polipétidos forman fibras con extremos globulares o cabezas en donde se acomodan las cadenas ligeras. La combinación de varias de estas fibras produce un filamento grueso que, visto en el microscopio electrónico, tiene un diámetro de aproximadamente 30 nm. A diferencia de la actina, las miosinas varían mucho en su evolución, pero la secuencia de aminoácidos, aunque algo similar, sí es diferente en los distintos tipos de células. Hay varios genes para las diferentes miosinas y, como en el caso de la actina, no todos se expresan en las mismas células. H. Huxley encontró que la parte de la molécula de miosina que interacciona con la actina se puede desprender del resto de la molécula, y ya separada puede seguir interaccionando con los filamentos de actina para formar complejos que, observados al microscopio electrónico, tienen la apariencia de puntas de flecha. Esta metodología fue utilizada en células no musculares por H. Ishikawa y sus colaboradores en la Universidad de Pensilvania, quienes demostraron que los fragmentos de miosina se unían a estructuras específicas en las células que correspondían en apariencia a los microfilamentos observados por varios microscopistas en los sarcómeros del músculo. Esta unión es completamente específica para la actina, lo que permitió no sólo observar en una célula no muscular a los filamentos de la actina, sino distinguirlos de otros tipos de estructuras fibrosas en el citoplasma. La interacción de la actina con la miosina y otras proteínas regula en las células no musculares los movimientos como la citocinesis y la locomoción, migración de partículas y organillos, contracción de vacuolas y cambios de forma. 29 Figura II.10. Diagrama de las moleculas de miosina II (A) y I (B) en el que se muestra la cabeza globular asociada a las cadenas ligeras. Tubulina. Esta proteína es también mayoritaria en el citoesqueleto de las células. Está organizada como un dímero con un peso molecular de 115 000 daltones, en el que participan las proteínas llamadas tubulina alfa y tubulina beta en la misma proporción (Figura II.11). Cada una de estas proteínas está formada por aproximadamente 550 aminoácidos, con una buena proporción de residuos acídicos, por lo que también son proteínas acídicas. Los dos tipos de tubulina, aunque son similares, no son idénticos y de hecho se transcriben de genes diferentes. La tubulina alfa puede también estar acetilada, es decir; tener un grupo acetilo unido a uno de sus aminoácidos. La acetilación ocurre una vez que la proteína se desprende de los ribosomas. Esta tubulina se comporta en forma diferente y se asocia en forma particular a estructuras celulares como los flagelos. Se ha encontrado también tubulina destirosinada, y esto significa que la tubulina perdió el aminoácido tirosina de su extremo amino terminal, y en esta forma se le asocia al aparato de Golgi. Las tubulinas son, como la actina, proteínas conservadas, por lo que su secuencia de aminoácidos no varía mucho en diferentes células, sean animales o vegetales, y de hecho, si se observan al microscopio los microtúbulos aislados y las estructuras formadas por microtúbulos, se encuentra siempre la misma organización básica. 30 Figura II.11. A) estructura del heterodímero de tubulina con sus sitios de unión a GTP y a colchicina; B) microtúbulo formado por la polimeración de los heterodímeros. Un microtúbulo en corte transversal muestra 13 unidades alrededor de la luz. Los microtúbulos se ensamblan por la polimerización de los dímeros de tubulina dejando un espacio central o luz de 10 nm de diámetro, de manera que al cortar transversalmente un microtúbulo se observan 13 unidades estructurales alrededor de la luz, correspondientes a los dímeros ordenados para formar el tubo. Recientemente se ha identificado una tubulina gamma que se encuentra asociada a los centrómeros de los cromosomas. Hay proteínas asociadas a la tubulina y su papel es facilitar la polimerización de la proteína en microtúbulos. Estas proteínas forman grupos llamados MAPS y TAU. Proteínas de filamentos intermedios. Las proteínas que forman los filamentos intermedios constituyen el grupo más diverso de proteínas del citoesqueleto; tienen diferentes propiedades bioquímicas y diferentes tamaños, y contienen desde 400 hasta 2 000 aminoácidos aunque son codificadas por una familia de genes similares que se expresan diferencialmente en distintos tipos de células o en diferentes estadios funcionales. Reciben diferentes nombres, según el tipo de célula de donde se han aislado. Hay por lo menos 20 subtipos de queratinas que se han identificado en epitelios, desmina en el músculo, filamentos gliales en células glia, neurofilamentos en muchos tipos de neurona y vimentina en células de origen mesenquimatoso. La proteína lámina que forma la membrana de los núcleos es un miembro de esta familia. Todas estas moléculas tienen una región central de longitud constante en la que de 30 a 70% de los aminoácidos son idénticos (Figura II.12). A través de esta región se hace la unión de varias moléculas para formar el arreglo que finalmente constituye un filamento intermedio. Estos filamentos son muy estables, por lo que estas proteínas, a diferencia de las ya mencionadas, no se polimerizan y despolimerizan continuamente. Es frecuente encontrar fosforiladas a las proteínas de filamentos intermedios, modificación que es 31 reversible y llevada a cabo por cinasas específicas que responden a señales celulares relacionadas con niveles iónicos en el citoplasma o con fenómenos membranales. Se conocen por lo menos dos tipos de proteínas asociadas a filamentos intermedios: filagrina y sinemina. No obstante, su función específica es poco clara. En algunas enfermedades, como la de Alzheimer, se ha demostrado que las proteínas de los filamentos intermedios están alteradas, por lo que muchos investigadores estudian estas proteínas tratando de establecer una correlación entre esta enfermedad y la alteración de los filamentos intermedios. Figura II.12. Interacción de los dímeros de proteínas de filamentos intermedios (A) para formar los tetrámeros (B) que al polimerizar forman la unidad estructural de los filamentos intermedios (C). 32 I I I . E N S A M B L E D E L A S P A R T E S : D E L A S P R O T E Í N A S A L A O R G A N I Z A C I Ó N S U P R A M O L E C U L A R UNA vez formada una cadena de aminoácidos o polipéptidos ésta puede adquirir diversas conformaciones tridimensionales. Un péptido puede asociarse también a otras proteínas de la misma o diferente secuencia de aminoácidos y adoptar diferentes configuraciones. Igualmente, a nivel tridimensional las proteínas tienen que ordenarse con precisión. La interacción entre sus diferentes dominios resulta en asociaciones específicas tanto con moléculas diferentes como con moléculas del mismo tipo. Cuando esto último sucede, la interacción no covalente de subunidades trae como resultado la formación de una estructura polimérica. Este fenómeno de ensamble o polimerización tiene las siguientes ventajas: 1) se construye una estructura a partir de subunidades iguales de modo que la información para hacer una sola de ellas es suficiente, 2) se puede controlar tanto el ensamble como el desensamble, y para esto se requiere relativamente poca energía, y 3) el ensamble permite corregir más fácilmente errores que se darían si cada vez se tuviera que sintetizar toda la estructura. Para que se realice el ensamble se requiere solamente que una proteína tenga un sitio de unión que sea complementario a otra región de su propia superficie. Así se pueden formar dímeros, que es el caso más simple, trímeros y hasta polímeros, en los cuales hay miles de subunidades o monómeros asociados. En el caso del citoesqueleto las estructuras subcelulares que lo componen, tanto los diferentes tipos de filamentos como los microtúbulos, se forman por polimerización de sus subunidades proteicas (Figura III.1). La forma alargada de estas estructuras les da las características esenciales para formar las partes de una maquinaria de la que se requiere fuerza mecánica. 33 Figura III.1. Curva de polimerización de una proteína del citoesqueleto. Se puede apreciar que el polímero que se esta formando crece mas rápidamente en el extremo (+). La concentración crítica (Cc) es aquella por debajo de la cual no hay polimerización. Tr = treadmilling, se refiere al rango de concentración en el polímero se polimeriza en el extremo (+) y se despolimeriza en el (-). MICROFILAMENTOS Los monómeros de actina pueden ser polimerizados aumentando la concentración de sales a nivel fisiológico (Figura III.2). Figura III.2. Micrografía de filamentos de actina polimerizados in vitro. La actina se extrajo de músculo esquelético de conejo y se introdujo a polimerizar en presencia de Mg2+. Durante la polimerización el fosfato terminal de una molécula de ATP, que está regularmente asociada con los monómeros, se hidroliza proveyendo la energía necesaria para el ensamble. La actina despolimerizada, llamada también soluble, forma una solución poco viscosa, pero al polimerizarse hay un rápido aumento de viscosidad que al medirse nos dará una indicación de la velocidad con que se asocian los monómeros de actina para formar un filamento (Figura II.9). Cada microfilamento tiene dos cadenas de monómeros de actina enrollados en espiral, la cual crece siempre en un extremo (extremo +), puesto que sus extremos son estructuralmente diferentes por la molécula deATP o ADP que se halla asociada a los monómeros ensamblados. Esta polaridad de la molécula es muy importante en la asociación de los filamentos con otras proteínas y en la forma como se desensambla un filamento. Este desensamble se puede producir aumentando los niveles de Ca2+ y también por la acción de algunas drogas, como la citocalasina. El desensamble siempre ocurre a partir del extremo (-) de los filamentos. Los filamentos de actina interaccionan con otras moléculas para poder funcionar. Su interacción va a depender del tipo de célula en la que se encuentren y de las funciones que ésta lleve a cabo. En los diferentes tipos de músculos la actina interacciona con la miosina para producir la contracción muscular. En otros tipos de 34 células los filamentos de actina forman redes y haces (Figura III.3) que dan más resistencia al citoplasma y permiten desplazamiento de las células. Las proteínas que facilitan la formación de haces se llaman, en forma genérica, hacinadoras, aunque dos de ellas se han caracterizado mejor y se conocen como fascina y fimbrina. Otras proteínas favorecen el entrecruzamiento de los filamentos para formar redes y entre ellas están la ABP, la filamina y la alfa-actinina. Otras rompen los filamentos, como la gelsolina y la severina, facilitando la despolimerización y la repolimerización. En los sitios de contacto de filamentos con la membrana celular se encuentran proteínas como la ankirina, la espectrina y la fodrina. En áreas de contacto de las células con el substrato se encuentran los filamentos de actina asociados a proteínas como vinculina y talina. Asimismo, proteínas como la profilina se asocian a los monómeros de atina inhibiendo su polimerización y manteniendo la actina en la célula en forma soluble. Toda esta gama de proteínas regula de manera precisa la forma en que la actina participa en los movimientos celulares y determina cuándo y cómo se debe inducir la polimerización, así como la despolimerización de los microfilamentos (Figura III.4). Figura III.3. Red de filamentos de actina vistos por microscopía de inmunofluoresencia dentro de una célula en cultivo. Los filamentos de actina se decoraron con un anticuerpo específico contra la actina que, una vez unido a está, se revela con un segundo anticuerpo acoplado a un reactivo fluoresente. 35 Figura III. 4. Representación de algunas de las proteínas que se unen específicamente a filamentos y monómeros de actina para darles diferentes organizaciones dentro de la célula. Las moléculas de miosina también se polimerizan en forma espontánea para formar filamentos gruesos (Figura III.5). El número de cadenas que se ensamblan para formar una fibra depende del tipo de la miosina, pero básicamente la estructura es similar. Las cadenas pesadas se enredan una sobre la otra formando una espiral, manteniendo la misma dirección y dejando libre una parte de la molécula en donde se asocian las cadenas ligeras, constituyendo con ello una especie de cabeza. 36 Figura III. 5. Micrografía de filamentos de miosina obtenidos de una célula no muscular. (Foto cortesia de J. Kendrick Jones.) Para formar un filamento grueso las colas de moléculas individuales se asocian por uniones hidrofóbicas y así se dejan las cabezas sueltas. Esta asociación se va haciendo fuera de fase, de modo que un filamento tendrá cabezas a todo lo largo con ciertos intervalos (Figura V.1). En el músculo esquelético se asocian cientos de cabezas para formar un filamento grueso. En otras células los filamentos de miosina pueden estar formados por fibras individuales. Las cabezas de las fibras son la parte de la molécula de miosina que interacciona con la actina. Estas moléculas tienen una actividad enzimática de ATPasa, es decir, son capaces de hidrolizar ATP, con lo que se deriva la energía necesaria para la interacción con la actina y los movimientos que se llevan a cabo con esta interacción. Además de la actina hay varias proteínas que se asocian a la miosina, y las mejor definidas hasta ahora son aquellas que se asocian a los filamentos en el músculo y regulan el deslizamiento. La tropomiosina se une como una varilla a lo largo del filamento de la actina, la troponina se une a intervalos regulares a los filamentos de la actina y regula los niveles de Ca2+, y la alfa actinina ayuda a unir los filamentos de actina a la línea Z del sarcómero. Cuando una de las dos cadenas ligeras de la miosina se fosforila o uno de sus aminoácidos (serina) adquiere un grupo fosfato, la cabeza de la miosina puede interaccionar con la actina y entonces el filamento se desplaza sobre la actina. Esta fosforilación, así como la activación subsecuente de otras moléculas, depende de los niveles de Ca2+ en la célula. En células no musculares la miosina forma filamentos menos organizados que los del músculo y para ensamblarse debe ser fosforilada, si esto no sucede, la molécula se agrega sobre sí misma y no forma filamentos. La asociación de la miosina y la actina en células no musculares forma estructuras contráctiles o pequeñas maquinarias para llevar a cabo ciertos movimientos. Un ejemplo es el anillo contráctil que divide el citoplasma de una célula para formar dos células hijas (véase figura 7.VII). Otro ejemplo son las fibras de tensión que se forman en células en movimiento y que se insertan en la membrana celular en los puntos de contacto con el substrato sobre el que se desplazan. En algunas células, como las de los epitelios, la interacción forma redes permanentes que les permite mantener su forma y sus contactos con otras células (Figura III.5). Cuando las estructuras no son permanentes se establece un equilibrio dinámico entre las proteínas solubles y las polimerizadas, lo cual le permite a la célula regular el ensamble o desensamble de estas maquinarias, según lo necesite, manteniendo todas las partes en equilibrio y listas para su reutilización. Los filamentos de actina pueden despolimerizarse por interrupción del equilibrio entre monómeros y polímero. Hace algunos años se encontró que las drogas llamadas citocalasinas se unen a los microfilamentos en el extremo (-) causando su polimerización por el extremo (+). En esta condición los filamentos no se pueden repolimerizar, lo cual da como resultado su desensamble total y la inhibición defunciones celulares en las que éstos participan. MICROTÚBULOS 37 La unidad básica de los microtúbulos es el dímero, formado por tubulinas alfa y beta en iguales proporciones. El ensamble de estos dímeros para formar un microtúbulo requiere de la hidrólisis de GTP, un nucleótido trifosfato que contiene la base guanina en lugar de adenina, como en el ATP, y que se encuentra asociado a cada dímero. La energía provista por la hidrólisis del GTP favorece la polimerización en el extremo del túbulo, que aumenta de tamaño. El otro extremo, al no crecer, se empieza a despolimerizar. Por esta razón los microtúbulos son muy inestables y pueden polimerizarse y despolimerizarse con gran rapidez. Los dímeros, al polimerizar, forman filamentos alargados (Figura III.6) que posteriormente se asocian en grupos de 13 y dejan una luz central que le da a la estructura el carácter de túbulo en el citoplasma. Los microtúbulos, de aproximadamente 240 nm, se forman de manera espontánea partiendo de centros de nucleación llamados organizadores de microtúbulos (MTOC), en donde se concentran las subunidades de tubulina. Con base en estas estructuras se organizan los microtúbulos que radian hacia el citoplasma (Figura III.7). Los centros organizadores de microtúbulos forman los ásteres en la mitosis y también los cuerpos basales de los cilios y flagelos en muchas células. Figura III. 6. Micrografía de microtúbulos polimerizados in vitro. La tubulina se obtuvo de cerebro de rata y se hizo polimerizar en presencia de GTP. Algunos dímeros de tubulina se modifican una vez ensamblados en un microtúbulo, para participar en funciones definidas. Así vemos cómo algunas tubulinas se acetilan y otras pierden el aminoácido tirosina. También, al asociarse a algunas proteínas los microtúbulos, se estabilizan. 38 Figura III. 7. Centros organizadores de microtúbulos (MTOC). Los microtúbulos se observan por microscopía de inmunofluoresencia dentro de las células, ya que se decoraron con un anticuerpo contra la tubulina. La región más brillante alrededor de los núcleos corresponde al MTOC, de donde irradian los microtúbulos a todo el citoplasma. Entre las proteínas que estabilizan a los microtúbulos se encuentran las llamadas MAPs, que son de peso molecular elevado y que están formadas por aproximadamente 2 000 a 3 000 aminoácidos, y las llamadas TAU, con 400 a 600 aminoácidos. Ambas se asocian a todo lo largo de los microtúbulos y contienen dos dominios, uno que une a varios dímeros y ayuda a polimerizarlos y otro que permite que los microtúbulos se unan a otras proteínas. La estructura microtubular más organizada es tal vez el axonema de cilios y flagelos, en el cual nueve pares exteriores de microtúbulos se arreglan alrededor de un par central, todos ellos conectados entre sí por un gran número de proteínas diversas que ayudan a que este axonema lleve a cabo el movimiento de deslizamiento que resulta en el movimiento batiente de los cilios y de látigo o tirabuzón de algunos flagelos (Figura III.8). En el caso de cilios y flagelos los microtúbulos son muy estables y no se despolimerizan con facilidad. Cada par exterior tiene asociada una proteína con actividad de ATPasa, que se conoce como dinaina, y que al hidrolizar el ATP genera la energía necesaria para permitir el deslizamiento de los túbulos y, por consiguiente, de los flagelos o cilios. 39 Figura III. 8. A) Videomicrografía del protozoario parásito Giardia con sus dos flagelos en movimiento. B) Representación esquemática del axonema de túbulos arreglados en nueve pares exteriores y un par central. El movimiento de los microtubulos causa la flexión de los flagelos y esto permite a la célula desplazarse en su medio ambiente. La polimerización de los microtúbulos puede inhibirse por temperatura, presión, falta de cationes como Ca2+ y Mg2+ y por drogas, como la colchicina, que al interaccionar con los dímeros de tubulina impide que éstos se integren al microtúbulo que esta créciendo en un extremo, causando la despolimerización del otro extremo. Ya que un microtúbulo está en un equilibrio dinámico entre dímeros y polímeros, cualquier factor que interrumpa este equilibrio interferirá con su funcionamiento. Es por esto que la colchicina es un inhibidor de la mitosis, del transporte axonal y de otras funciones que requieren la participación de microtúbulos. La droga llamada taxol actúa en forma contraria a la colchicina, esto es, estabiliza al polímero de modo que los microtúbulos no pueden despolimerizarse, con la consecuente inhibición del equilibrio dinámico y de los procesos ya mencionados, en los que participan los microtúbulos. FlLAMENTOS INTERMEDIOS Los filamentos intermedios se forman al ensamblarse cuatro elementos fibrosos, compuesto cada uno de subunidades correspondientes a un mismo tipo de polipéptido. Las cuatro cadenas pueden agruparse en diversas combinaciones, dependiendo de las proteínas de esta familia que existan en la célula (como se vio en la figura II.12). Se asocian lateralmente en algunas zonas, dejando espacios libres en donde las subunidades proteicas adquieren diferentes configuraciones. Los filamentos intermedios son de longitud variable y posiblemente se extienden hasta el citoplasma de la célula para interaccionar con otras estructuras, como los llamados desmosomas en las membranas, dándoles rigidez y ayudando a su función de mantener a las células unidas entre sí (Figura III.9). Generalmente se piensa que tienen una función mecánica dentro de las células, puesto que existen siempre 40 en forma polimerizada. La presencia de clases específicas de filamentos intermedios, en diferentes tipos celulares, ha permitido tipificar a una célula e identificar de dónde proviene, lo cual ha resultado muy útil en los casos de cánceres en que el origen de las células en una metástasis puede determinarse por el tipo de proteínas que constituyen a los filamentos intermedios que contiene, y así localizar el punto de origen de la metástasis. Figura III. 9. Micrografía por inmunofluoresencia de células en cultivo que han sido decoradas con un anticuerpo contra filamentos intermedios (en este caso vimetina). La intrincada red de estos filamentos se extiende por toda la célula hasta su periferia. Hay también proteínas asociadas a filamentos intermedios; dos bien conocidas son la filagrina y la sinemina. Sin embargo, su función específica es poco clara todavía, ya que los filamentos intermedios son muy estables. En algunas enfermedades, como la de Alzheímer, se ha demostrado que las proteínas de los filamentos intermedios están alteradas. La fosforilación de las proteínas que forman a los filamentos intermedios está relacionada con algunas de sus funciones, es reversible y se observa cuando las células cambian de forma o se reestructura un componente celular, como sucede con la envoltura nuclear. No se conocen drogas que los despolimericen, aunque en células tratadas con colchicina estos filamentos se colapsan sobre el núcleo sin desensamblarse, por lo que se ha observado que la organización de los microtúbulos controla la organización de los filamentos intermedios y entonces la colchicina, al desensamblar los microtúbulos, produce un colapso de la red de filamentos intermedios. Este proceso es reversible y tanto los filamentos como los microtúbulos se reorganizan al quitarse la colchicina. Sin embargo, no se han hallado los cofactores que participan en la reorganización de filamentos intermedios. 41 I V . C O M B U S T I B L E P A R A E L M O V I M I E N T O : B I O E N E R G É T I C A HASTA aquí hemos descrito cómo las células fabrican, siguiendo las instrucciones contenidas en su código genético, los elementos necesarios para construir largas estructuras lineales que pueden entrecruzarse o hacinarse en extensas redes y fuertes armazones internos. La gran resistencia mecánica de tales complejos estructurales permite a la mayoría de las células mantener una forma definida y característica, a la vez que brinda puntos de apoyo para que se ejerza y transmita el movimiento. Es por esta razón, como hemos dicho, que al conjunto organizado de microtúbulos, filamentos de actina y filamentos intermedios se le ha dado el nombre de citoesqueleto. Pero, salvo en los cuentos de terror, los esqueletos no se mueven por sí mismos, y el esqueleto de la célula no es la excepción de la regla. Por tanto, la siguiente etapa de nuestro análisis la destinamos a considerar qué es lo que mueve al citoesqueleto, actividad de la cual depende la generalidad de los movimientos de las células. Por supuesto, cualquier cambio en la organización del citoesqueleto, sea por la adición de una nueva red estructural, sea por la ampliación, conversión o desmantelamiento de otra ya existente, o por una combinación de todas estas causas, puede dar como resultado una alteración en la forma de la célula. Esta clase de reacomodo es sin duda un tipo de movimiento, en la medida en que lo son también el hundimiento de la carpa de un circo cuando se elimina uno de sus postes de sostén, o las dramáticas metamorfosis que experimenta un paragüas cuando cambian de posición sus varillas. Más adelante veremos cómo algunas células —como las amibas y los glóbulos blancos de la sangre, que de continuo cambian de forma, o los espermatozoides de ciertos invertebrados marinos, en los que una súbita polimerización de la actina produce un largo tentáculo que les permite anclarse al óvulo— muestran ejemplos notables de esta suerte de movimiento. Sin embargo, la sola transformación de estructura no es suficiente para explicar la vasta diversidad de movimientos que se observan en la materia viviente. La contracción activa del cuerpo celular, la agitación de apéndices en su superficie, y el transporte de materiales por el interior de las células, que en general depende estrictamente de los microtúbulos o de filamentos de actina, requieren además de otros componentes indispensables. El movimiento celular es producto de la actividad de una complicada maquinaria compuesta a su vez por diferentes tipos de máquinas individuales, distribuidas y arregladas conforme a distintos diseños, según el tipo de célula y de movimiento de que se trate. Ahora bien, toda máquina consta de algunas partes fijas que sirven de soporte y de las partes móviles que ejecutan la función. Pero, si nos enfocamos a examinar las máquinas que son capaces de movimiento propio, es decir; que no son accionadas por el esfuerzo corporal del hombre o de algún animal, es fácil percatarse de que por lo común las piezas móviles comprenden dos categorías: 42 aquellas que únicamente son jaladas o empujadas, y las que se encargan de originar el movimiento. Estas últimas son los motores, que convierten alguna forma de energía —térmica, química, hidrodinámica, eléctrica, nuclear, etc.— en energía mecánica. La maquinaria que produce el movimiento celular tiene también sus motores. Al igual que todo esqueleto, el citoesqueleto depende de elementos generadores de fuerza para efectuar los cambios de posición que determinan el movimiento. Hace no muchos años se acuñó el nombre de citomusculatura para referirse al conjunto de tales factores clave para el cinetismo biológico. En la actualidad el término ha caído en desuso, pero el concepto gana validez día con día, a medida que se descubren nuevas proteínas especializadas en convertir energía metabólica en fuerza mecánica. Son estos potentes motores moleculares los que, con apoyo en el citoesqueleto, impulsan a los seres vivos. El movimiento de las células es por tanto activo, producto de los componentes del propio citoplasma y se denomina motilidad para distinguirlo de movilidad, es decir, de movimientos debidos a causas externas. Antes de describir sus mecanismos de operación, conviene mencionar brevemente de dónde obtienen la energía que utilizan. FUENTES DE ENERGÍA La energía que mueve al mundo viviente proviene del Sol. La energía solar es capturada por algunos organismos —ciertos microbios y las plantas verdes— que la aprovechan directamente para construir, a partir de materiales inorgánicos simples que absorben del medio, las complejas moléculas orgánicas que los constituyen (Figura lV.1) El resto de los seres vivientes, que no tienen la facultad de utilizar directamente la energía solar de esta manera, dependen de un proceso inverso para funcionar. Ingieren las moléculas orgánicas creadas por el proceso anterior y las desarman hasta convertirlas otra vez en sustancias simples, con lo que se libera la energía invertida para la construcción de las primeras. Los motores que mueven a las células, al igual que el resto de los mecanismos fisiológicos, consumen la energía derivada del Sol, tanto por la vía directa como por la indirecta. Por cualquiera de ambas vías dicha energía queda almacenada temporalmente en un combustible de uso general llamado trifosfato de adenosina, al que los biólogos acostumbran referirse por sus siglas en inglés: ATP. 43 Figura IV. 1. Utilización de la energía solar por los seres vivos. El ATP es un nucleótido idéntico a uno de los cuatro eslabones que componen cada una de las cadenas del ADN, excepto que en lugar de un solo grupo fosfato tiene tres, los dos últimos conectados en serie con el primero (Figura IV.2). Su propiedad de servir como intermediario en el flujo de energía en las células estriba en que el tercer grupo fosfato se encuentra, por así decir, acomodado a presión en la molécula. Un ejemplo mecánico puede ayudar a explicar de qué manera el ATP guarda energía que es capaz de transferir a otras moléculas para promover una reacción bioquímica. Figura IV. 2. Fórmula del ATP, la fuente principal de energía dentro de la célula. 44 Imaginemos una caja de madera en la que se empacan tres balones de hule, aunque únicamente caben dos sin dificultad; el tercero alcanza a entrar sólo parcialmente, por lo que para cerrar la caja es necesario oprimir la tapa y asegurarla con un broche. La elasticidad de los balones les permite deformarse para ser encajonados si se les fuerza a ello, pero estarán listos para tomar su forma original a la primera oportunidad. Para construir este sistema se ha requerido invertir la energía en varios momentos: en primer lugar, hay que considerar la energía que tomó la producción de los materiales básicos (digamos, el crecimiento de los árboles que proveyeron la madera para la caja y el caucho para los balones); se tiene además la energía gastada para la confección de cada uno de los elementos del sistema (fabricar la caja y los tres balones); por último, está la energía aplicada para integrar el sistema con base en los elementos (colocar en la caja los tres balones y cerrarla venciendo la resistencia que resulta de la presencia del tercer balón). (Figura IV.3). Figura IV. 3. Modelo mecánico para ilustrar la formación del enlace de alta energía en el ATP durante su fosforilación y la liberación de esta energía por la hidrólisis del enlace. La liberación de energía se aprovecha para realizar un trabajo T. Gran parte del trabajo en una célula se expresa como movimiento. La energía invertida en este sistema no es recuperable por completo, pero sí una buena parte de ella. Por ejemplo, un método para extraer del sistema el máximo de energía recuperable es prenderle fuego, lo que produce una generación de calor que se puede aprovechar para realizar trabajo si la combustión ayuda a vaporizar agua en una caldera y la presión del vapor se emplea para poner en movimiento una máquina. Sin embargo, a pesar de que este procedimiento es muy efectivo, implica la destrucción total del sistema, lo que no siempre es deseable. Una manera menos drástica de recuperar parte de la energía contenida en el sistema consiste simplemente en desabrochar la tapa de la caja; los tres balones volverán a su forma original y uno de ellos saldrá disparado, empujando la tapa tan pronto como desaparezca la barrera que los mantenía aprisionados en el interior. La fuerza desarrollada espontáneamente por el sistema, cuando se relaja, 45 también podrá realizar un trabajo; por ejemplo, impulsar hacia arriba un objeto relativamente ligero colocado encima de la tapa. Parte de la energía almacenada habrá sido transferida al objeto, que gracias a ella efectúa un movimiento ascendente a pesar de la atracción gravitacional. Esta energía fácilmente liberable es una consecuencia exclusiva de la presencia del tercer balón, porque sin él la energía restante del sistema no realizaría el trabajo de manera espontánea. Por otra parte, el sistema puede ser puesto en servicio en múltiples ocasiones, pues para ello basta con introducir nuevamente el tercer balón en la caja, oprimir la tapa y abrocharla. Una situación equivalente existe en el ATP. Al igual que cualquier otra molécula, contiene energía —la invertida en la creación y el ensamble de sus componentes. La descomposición total de la molécula liberaría el máximo de energía recuperable, pero las células prefieren aprovechar sobre todo su capacidad de guardar energía fácilmente liberable por la presencia del tercer grupo fosfato, que se encuentra agregado de manera forzada en la estructura. Desde luego, en este caso no se trata de una compresión mecánica, sino de una posición desfavorable a la estabilidad de la molécula, debida principalmente a repulsiones eléctricas entre átomos vecinos. Sin embargo, el sistema opera de manera semejante al modelo descrito. Tan pronto como se abre la posibilidad, el tercer grupo fosfato se desprende del conjunto y la energía liberada es aprovechable para efectuar una alteración que no ocurriría de manera espontánea en moléculas cercanas. De esta manera el ATP queda convertido en ADP (difosfato de adenosina), que puede ser "recargado" nuevamente si, a expensas de una fuente extra de energía, se le añade otra vez un tercer grupo fosfato (Figura IV.4). Figura IV. 4. Formación del ATP y su hidrólisis. A diferencia de los balones del ejemplo mecánico anterior; la división del ATP implica la ruptura de un enlace químico entre el segundo grupo fosfato y el tercero. Los dos cabos sueltos de este enlace tienen cargas eléctricas de signos contrarios y tienden a asociarse de manera natural con algo que las neutralice; para ello 46 utilizan los dos fragmentos en que puede partirse una molécula de agua (H+ y OH-). A este fenómeno se le denomina hidrólisis (del griego hydros agua y lysis, descomponer), por lo que se dice que el ATP es hidrolizado cuando se divide en ADP y fosfato libre. En la célula, la hidrólisis del ATP es promovida por enzimas llamadas ATPasas, que al mismo tiempo capturan la energía liberada para aplicarla a un fin particular. Cuando, como veremos, la aplicación consiste en que la ATPasa modifica transitoriamente su propia conformación para realizar un trabajo mecánico, se le da el nombre de mecanoenzima. Otras ATPasas utilizan la energía derivada de la hidrólisis del ATP para distribuir solutos de manera asimétrica entre ambos lados de las membranas celulares, por lo que constituyen un verdadero sistema de bombeo. Muchas otras ATPasas aplican la energía para vincular moléculas durante la construcción de cómpuestos orgánicos mayores. La adición de un grupo fosfato a una molécula de ADP para regenerar ATP se conoce como fosforilación. Como mencionamos en un párrafo anterior, en el comienzo del flujo energético a través de los sistemas vivientes la energía necesaria para incorporar el tercer fosfato proviene del Sol. La luz es energía radiante capaz de actuar sobre la materia, como lo atestiguan todos los recursos que ofrece la fotografía, el cambio de tono de la piel después de asolearse, y la posibilidad de incendiar una hoja seca mediante una lente que concentre en un punto los rayos solares. Las plantas verdes y algunos microorganismos tienen la facultad de capturar esta energía y aprovecharla para producir ATP. Este fenómeno, llamado fotofosforilación, tiene lugar gracias a la existencia de sustancias que son excitadas por la luz, como la clorofila (Figura IV.5). Figura IV. 5. Fotosíntesis. 47 En las plantas dichas sustancias se encuentran enclavadas en las membranas internas de numerosos corpúsculos citoplásmicos llamados cloroplastos. Cuando éstos reciben la radiación, la incidencia de la energía lumínica ocasiona que algunos electrones de los átomos de la clorofila sean dislocados de su posición habitual y se desplacen hacia moléculas contiguas de otro tipo, que a su vez los descargan en otras moléculas, y éstas los hacen pasar a otras más, a lo largo de una compleja cadena dentro de la propia membrana de que forman parte. La energía de este flujo de electrones es empleada para acumular iones de hidrógeno en uno de los dos espacios separados por la membrana. Al verse más concentrados en uno de los compartimientos, los iones de hidrógeno tienden naturalmente a difundirse hacia el lado contrario buscando alcanzar el equilibrio. Y sucede que el único camino para el regreso a través de la membrana es una enzima que saca provecho del empuje de los iones de hidrógeno en su retorno para unir un grupo fosfato al ATP. Estas enzimas se denominan ATPsintetasas. Una fracción de los electrones que la luz desprende de la cloroflia regresa a ésta por una ruta molecular alterna, pero el resto termina por abandonar la membrana, uniéndose a compuestos solubles que los aceptan. Esta segunda parte tiene que reponerse de algún modo, puesto que de no ser así el proceso se interrumpiría rápidamente al agotarse los electrones que pueden ser dislocados de la clorofila. La fuente inagotable de electrones que mantiene en marcha el mecanismo es el agua, que los cede a la clorofila. El resultado total es la descomposición de la molécula de agua en dos protones y un átomo de oxígeno. La inmediata asociación de dos de estos átomos produce oxígeno molecular; que puede difundirse a través de las membranas del cloroplasto hacia otras regiones de la célula e incluso más allá, fuera de la planta, hacia la atmósfera. Por su parte, los electrones que emergen de la membrana, asociándose con aceptores solubles, proveen la energía necesaria para la fabricación de carbohidratos o azúcares a partir de bióxido de carbono, que los vegetales absorben de la atmósfera. A través de estos dos procesos paralelos, que en conjunto reciben el nombre de fotosíntésis, la energía solar queda atrapada en forma de ATP y compuestos orgánicos, con lo que ingresa en el mundo viviente, donde es distribuida por medio de las cadenas alimentarias. La nutrición de unos seres vivos a expensas de otros implica no sólo la obtención de materias primas para crecer y resarcir el desgaste natural de los componentes corporales, sino también —y de manera capital— la apropiación de la energía indispensable para dicho mantenimiento y para la reproducción. La degradación de los materiales orgánicos ingeridos, en particular de los carbohidratos, constituye el principal recurso energético con que cuentan los animales y otros organismos incapaces de efectuar la fotosíntesis. Dicha degradación se lleva a cabo con la participación de numerosas enzimas que conducen paso a paso el proceso, y puede seguir dos vías principales. La más sencilla y antigua, aunque menos eficiente, consiste en fragmentar moléculas de algunos azúcares como la glucosa, y se denomina por tanto glucólisis (Figura IV.6). La división de una molécula de glucosa 48 libera energía suficiente para la generación de dos moléculas de ATP, a partir de ATP y de fosfato inorgánico. Si bien esta clase de reacción se encuentra representada de manera casi universal en los organismos, su rendimiento energético es bajo en comparación con la cantidad total de energía recuperable que existe en la glucosa. No sorprende, por tanto, que la evolución haya favorecido el desarrollo y la expansión de la segunda vía de degradación de carbohidratos, en general subsecuente a la primera, que permite una explotación más completa de su potencial energético. Figura IV. 6 Glucólisis. En este último proceso la glucosa es descompuesta a través de una completa serie de reacciones enzimáticas hasta revertir a sus ingredientes originales, es decir, el bióxido de carbono y el agua que las células vegetales utilizaron durante la fotosíntesis. Buena parte de la energía solar que hizo posible dicha transformación es retenida mediante la fosforilación de 36 moléculas de ADP por cada molécula de glucosa degradada totalmente. Este método de reconstitución del ATP requiere de oxígeno, cuya combinación con el carbono de la glucosa para dar como resultado terminal el bióxido de carbono constituye una oxidación, por lo que se ha dado el nombre de fosforilación oxidativa. Es indispensable un continuo abastecimiento de oxígeno para mantener en operación este 49 eficiente proceso de extracción de energía metabólica. Los animales superiores cuentan con un aparato respiratorio y un sistema circulatorio que colaboran en la tarea de ingresar y distribuir el oxígeno en sus cuerpos. Sin embargo, la respiración es un fenómeno mucho más general, que ocurre en la gran mayoría de las especies animales y vegetales. El sitio donde tiene lugar la respiración esta en el interior de las células, en las membranas de pequeños corpúsculos funcionalmente similares a los cloroplastos: las mitocondrias. El paralelismo inverso evidente entre la fotosíntesis y la respiración se refleja en una clara similitud de sus mecanismos. La degradación metabólica de carbohidratos y otros compuestos orgánicos aporta electrones que son conducidos a lo largo de una cadena de moléculas enclavada en la membrana mitocondrial, que termina por cederlos al oxígeno con la consiguiente producción de agua. El movimiento de los electrones brinda la energía para un bombeo de iones de hidrógeno a través de la membrana, y el empuje de dichos iones para redistribuirse de manera uniforme a ambos lados de la misma impulsa la operación de una ATP-sintetasa. La energía del ATP es aprovechada después por diversos tipos de ATPasas, entre las que se encuentran las mecanoenzimas o motores moleculares, cuyo funcionamiento examinaremos a continuación. 50 V . M O T O R E S Y M Á Q U I N A S S I M P L E S : M E C A N O E N Z I M A S Y P O L Í M E R O S D E S O P O R T E PARA proceder en el orden cronológico de sus respectivos descubrimientos, entre los motores celulares debe mencionarse, en primer lugar, a la miosina, la cual se describió e ilustró en capítulos anteriores. MIOSINA La miosina, con sus dos cabezas en uno de sus extremos, tiende espontáneamente a formar fascículos con un arreglo peculiar. Cada molécula se une a otra con orientación opuesta, empalmando las colas, y cada una de estas parejas se asocia lateralmente con otras parejas hasta constituir fibras en donde las cabezas quedan asomando escalonadamente en la periferia del fascículo. Constituida de esta manera, la apariencia de la fibra es similar a la que presentaría un ramo doble de rosas en botón, en el que las varas sin hojas estarían empalmadas en sentido contrario, y los botones quedarían expuestos alternada y simétricamente a lo largo de los extremos. Las cabezas de miosina son enzimas capaces de hidrolizar ATP y aprovechar la energía liberada (Figura V. 1). La miosina utiliza esta energía para modificar de manera transitoria su propia conformación, y puesto que este cambio produce trabajo mecánico, como veremos a continuación, se trata de una mecanoenzima. Figura V. 1. Filamento de miosina II y su interacción con microfilamentos de actina. A) Múltiples moléculas de miosina asociadas para formar un filamento bipolar. B) La interacción de filamentos de miosina con filamentos de actina produce el deslizamiento de estos últimos. Cuando una de estas fibras se encuentra con un microfilamento alineado en paralelo, las cabezas de miosina propenden a acoplarse con las moléculas de actina, favoreciendo una firme asociación entre ambas estructuras. Es entonces cuando, en presencia de ATP, 51 se expresan las propiedades motoras de la miosina y sus cabezas literalmente caminan a lo largo del filamento. Al igual que el movimiento de un pie, este notable fenómeno ocurre en varias etapas: 1) separación del punto de contacto inicial; 2) avance hacia una nueva posición; 3) afianzamiento en el nuevo punto de contacto, y 4) efecto de arrastre sobre el resto de la estructura en esa dirección. Las moléculas de ATP participan en las dos primeras etapas a través dos acciones. Por una parte, tienen la virtud de desprender las cabezas de miosina del filamento de actina; por la otra, ceden su energía para permitir que las cabezas ya liberadas se enderecen de su condición retraída normal y puedan alcanzar el siguiente punto de anclaje. Así, cada molécula de ATP, de éste toma energía para enderezarse, y se ancla nuevamente en un punto vecino al filamento. Al concluir este último paso, la cabeza de miosina se vuelve a retraer y, puesto que se halla unida al filamento de actina, la retracción se refleja en el arrastre de su cola (Figura V.2). El ciclo se repite una y otra vez, siempre que haya ATP disponible. Una cabeza de miosina consume la energía que aportan entre 5 y 10 moléculas de ATP cada segundo para desarrollar este trabajo. Dado que otras cabezas de miosina en esa misma fibra efectúan un proceso equivalente, la fibra se desplaza longitudinalmente sobre el filamento. Figura V. 2. Interacción de una molécula de miosina II con un filamento de actina. A) En estado de reposo la cabeza de miosina se encuentra firmemente asociada al filamento. B) La unión con una molécula de ATP le permite desprenderse del filamento. C) Una vez suelta, la cabeza de miosina hidroliza el ATP y aprovecha la energía liberada para cambiar de conformación y alcanzar un sitio algo más distante sobre el filamento. D) Al ser eliminado el ATP la cabeza de miosina vuelve a asociarse al filamento en el nuevo sitio alcanzado. A la vez recupera automáticamente su conformación original y tira del resto de la molécula en la dirección del avance. Nuevas moléculas ATP permiten la repetición sucesiva del ciclo y el avance lento sobre el filamento. Esta descripción del funcionamiento de un motor molecular no es producto de la imaginación. Aunque no es posible ver directamente la interacción dinámica entre las moléculas de actina y miosina, existen numerosos indicios de que así es como opera, hace algunos años se obtuvo una prueba contundente de ello. Los investigadores 52 purificaron moléculas de miosina a partir de músculo de conejo, y las fijaron por métodos químicos sobre esférulas de un material sintético visible al microscopio. Cuando estas esférulas se pusieron en contacto con los filamentos de actina que existen en ciertas algas verdes, de inmediato se observó que migraban a lo largo de los filamentos, y el movimiento sólo ocurrió si existía ATP en el medio. Además de corroborar la teoría formulada previamente acerca del mecanismo de deslizamiento de fibras de miosina sobre filamentos de actina, este ingenioso experimento puso en evidencia que dicho mecanismo es común en células tan distintas y distantes entre sí, desde el punto de vista evolutivo, como son las del músculo de un animal superior y las de una planta primitiva. Se trata, por consiguiente, de un recurso tan eficaz que la evolución lo ha conservado y distribuido entre una gran variedad de organismos para desempeñar múltiples funciones. Un filamento de actina se convierte así en una pista para que la miosina camine sobre él, y esto impone una orientación definida al movimiento en el espacio tridimensional. Además, tal como sucede con la mayoría de las pistas, aparte de que el desplazamiento debe efectuarse a lo largo del filamento, la dirección está también determinada: las cabezas de miosina pueden caminar únicamente en un sentido. Esto es consecuencia de la polaridad estructural de los filamentos de actina, que acepta la asociación entre ambas clases de moléculas exclusivamente en una posición específica, de manera análoga o como los asientos de un avión determinan una posición regular y orientada de los pasajeros. Esta propiedad puede demostrarse luego de exponer filamentos desnudos ante una multitud de cabezas de miosina dispersas en una solución carente de ATP. En tales condiciones, por lo explicado antes, la miosina se adhiere con firmeza a los filamentos, y el microscopio electrónico revela que la adhesión ocurre de acuerdo con un arreglo preciso. Las cabezas aparecen recubriendo por completo cada filamento, ordenadas una junto a otra como pequeñas salientes inclinadas que dan al conjunto el aspecto de una apretada serie de puntas de flecha, similar al de una espiga de trigo (Figura V.3). Se dice entonces que el filamento fue decorado con las cabezas de miosina, y ello constituye una prueba contundente de que se trata de un filamento de actina. Cuando las cabezas forman parte de una fibra de miosina en la condición natural, el desplazamiento de la fibra es en dirección contraria a aquella en la que señalan las puntas de una flecha. En términos de la polaridad del filamento de la actina, esta dirección es la que ve hacia el extremo (+), o aquél en donde ocurre preferentemente la adición de moléculas de actina durante la polimerización. Figura V. 3. Filamento de actina decorado con miosina II. 53 La explicación de los mecanismos que median la interacción motora de la miosina con los filamentos de actina ha sido un camino arduo en el que han participado muchos brillantes investigadores, y dista aún de completarse en todos sus detalles. Sin embargo, por compleja que pueda parecer la descripción dada en los párrafos anteriores, el principio de operación es, en última instancia, el de una de las máquinas más simples inventadas por el hombre; corresponde a lo que en mecánica se llama un trinquete, es decir, un dispositivo en el que una uñeta avanza a lo largo de un poste, clavándose sucesivamente en ranuras hendidas de manera periódica sobre la superficie del mismo. En cada paso, la uñeta se separa de la ranura que ocupa y alcanza la ranura siguiente, donde se engancha para iniciar un nuevo ciclo. La forma de la uñeta y las ranuras es complementaria y oblicua con respecto al eje del poste, de tal modo que el avance sólo puede efectuarse en una dirección; el mecanismo se atranca en la dirección contraria. De manera análoga, la miosina avanza unidireccionalmente como una uñeta sobre el filamento de la actina. La única diferencia fundamental es que la uñeta del trinquete mecánico responde pasivamente a una fuerza externa —aplicada por la mano de un operador; por ejemplo— , mientras que la miosina consume energía directamente para realizar ella misma todo el trabajo. La energía obtenida del ATP es utilizada por la miosina de manera específica para enderezar la cabeza y ponerla en posición de alcanzar un nuevo sitio de anclaje. Es por esta razón que la miosina, a diferencia del trinquete, es un motor. Dado que las cabezas de miosina deben tener una orientación particular para asociarse funcionalmente con los filamentos de actina, una fibra de miosina, organizada simétricamente con cabezas caminantes apuntando en direcciones opuestas, sólo puede interaccionar con filamentos orientados de manera adecuada en cada uno de sus dos extremos. Sin embargo, el extremo opuesto puede interaccionar con filamentos de actina colocados en posición antiparalela, es decir, cuya polaridad esté invertida con respecto a los primeros. La actividad motora de la miosina en ambos extremos de la fibra resultará entonces en una aproximación de los dos conjuntos de filamentos de actina, si éstos se encuentran libres. Pero si, como es habitual, los filamentos se encuentran unidos en sus cabos distantes con membranas u otros componentes celulares, tales componentes experimentarán una fuerza de tracción hacia la zona en que se halla la miosina. Puesto que las fibras de miosina tienen cabezas caminantes proyectadas en diversos ángulos en torno a su eje, cada fibra puede interaccionar a la vez con varios filamentos de actina en cada extremo. Se multiplica así el trabajo realizado por la fibra y aumenta la fuerza que es capaz de generar. Este es, esencialmente, el fenómeno que ocurre durante la contracción muscular aunque, como veremos en capítulos posteriores, las células aprovechan este mecanismo para diversos fines. La combinación de este motor molecular—la miosina— con filamentos que transmiten la fuerza constituye una (de las máquinas biológicas más ubicuas y, por consiguiente, más estudiadas y mejor comprendidas. Veamos ahora otros ejemplos. DINAÍNA, CINESINA Y DINAMINA 54 El funcionamiento del complejo actina-miosina hace patente que las estructuras del citoesqueleto resultan ideales como puntos de apoyo, guías y líneas de transmisión de las fuerzas desarrolladas por los motores moleculares en las células. No sorprende, por tanto, que los microtúbulos, algo más rígidos y resistentes que los filamentos de actina, constituyan el soporte para la operación de otros motores moleculares. Y en retrospectiva, tampoco causa mucho asombro que tales motores estén diseñados conforme al mismo principio que la miosina. De hecho, al menos en el primer caso que abordaremos a continuación, existe una gran similitud (Tabla 1) . Tabla 1. Motores moleculares Miosina I Miosina II Dinamina Cinesina Dinaína 400-500 Peso 110-140 Kda.. 200 Kda. 100 Kda. 120 Kda. Kda. molecular Número de 1 2 1 2 2ó3 cabezas Proteínas y y/o microtúbulos organelos actina miosina II microtúbulos vesículas o vesículas con los vesículas que se une ATPasa microfilamentos microfilamentos microtúbulos microtúbulos microtúbulos activada de actina de actina por La dinaína —la proteína de la fuerza— es otra mecanoenzima que utiliza energía derivada de la hidrólisis del ATP para cambiar transitoriamente su conformación. Se trata también de una molécula de grandes dimensiones integrada por varias subunidades, las mayores de las cuales son dos cabezas globulares con un peso de 410 000 daltones cada una, en las que reside la actividad de ATPasa. Esta actividad aumenta sustancialmente en presencia de microtúbulos. La dinaína fue inicialmente identificada como el motor que genera el movimiento de apéndices vibrátiles llamados cilios y flagelos que ciertas células poseen. En fechas más recientes ha podido comprobarse que hay otras formas de dinaína distribuidas en el citoplasma de una vasta variedad de organismos. La característica distintiva de las dinaínas es su capacidad para avanzar sobre los microtúbulos, de manera análoga a como lo hace la miosina sobre los filamentos de actina (Figura V.4). Cabe aclarar que esta interacción es por el exterior y no por la estrecha luz de los microtúbulos, como justificadamente alguien pudiera pensar. Todo indica que las cabezas de la dinaína se afianzan a un sitio en la pared de los microtúbulos, en seguida cambian bruscamente de forma, y luego se desprenden para enderezarse y afianzarse en un nuevo sitio, repitiendo el ciclo sin cesar mientras dispongan de ATP. 55 Figura V. 4. Interacción de la cinesina con microtúbulos. A) Mecanismo básico propuesto para la acción de la cinesina; B) desplazamiento de microtúbulos, uno con respecto a otro, a través de la cinesina; C) movimiento mediado por cinesina de una partícula sobre un microtúbulo. Puesto que normalmente las moléculas de dinaína están unidas a estructuras celulares por el extremo opuesto al de las cabezas motrices, dichas estructuras responden al esfuerzo de arrastre que se ejerce sobre ellas. Cuando la dinaína se halla asociada con una vesícula o algún otro tipo de partícula en libertad para desplazarse, ésta migra a lo largo del microtúbulo. Pero si la dinaína se encuentra anclada en otro microtúbulo, se produce un deslizamiento de un microtúbulo sobre el otro y cada uno de ellos actúa como elemento de transmisión de la fuerza generada hacia las partes de la célula con las que esté conectado mecánicamente. El fenómeno puede reproducirse experimentalmente colocando microtubulos purificados sobre una laminilla de vidrio recubierta con moléculas de dinaína; se observa entonces que los microtúbulos se deslizan paralelamente a la superficie si el medio está provisto de ATP. Al igual que en la máquina constituida por actina y miosina, la polaridad de los microtúbulos determina la dirección del avance de la dinaína sobre ellos. Una diferencia importante, sin embargo, es que en este caso el sentido del movimiento apunta hacia el extremo (-) del microtúbulo, es decir; el menos propicio para la adición de moléculas de tubulina durante su polimerización. Por fortuna, en los últimos diez años han aparecido otros dos tipos de mecanoenzimas —las cinesinas o proteínas del movimiento (120 000 daltones) y la dinamina o proteína de la potencia (100 000 daltones)— con propiedades y funciones semejantes a las de las dinaínas, pero que se trasladan en sentido contrario al de éstas sobre los microtúbulos (figura .V.5). En consecuencia, un mismo microtúbulo puede servir como soporte y guía para movimientos de otros componentes celulares en ambas direcciones. 56 Figura V. 5. Desplazamiento de microtúbulos mediado por la dinaína. Hemos completado así un inventario mínimo de partes e ingredientes indispensables para la integración y el funcionamiento de la maquinaria que mueve a las células, y a través de estas últimas a la mayoría de los seres vivientes. La lista incluye los tres principales componentes del citoesqueleto —encargados de mantener la forma de las células y la distribución de estructuras en su interior —, una familia de cuatro tipos de motores moleculares capaces de generar fuerzas sobre algunos polímeros del citoesqueleto, y el combustible necesario para alimentar estos motores. Vimos también que las máquinas simples constituidas por la combinación de motores y polímeros del citoesqueleto pueden desarrollar tensión entre puntos específicos de una célula o acarrear estructuras a través de su citoplasma. Pasaremos ahora a examinar cómo estas máquinas simples se reúnen en conjuntos armónicos para integrar aparatos que desempeñan muy variadas funciones. SISTEMAS DE TRANSPORTE COLECTIVO Ya hemos dicho que cuando las moléculas de miosina, dinaína, cinesina y dinamina disponen de energía suministrada por el ATP tienen la capacidad de caminar en sentido unidireccional sobre los microfilamentos de actina o a lo largo de los microtúbulos, respectivamente, y que en cada caso el sentido del avance está determinado por la polaridad del polímero lineal correspondiente. En consecuencia, un arreglo en paralelo de múltiples polímeros del mismo tipo constituye una verdadera pista para el tráfico de los motores moleculares respectivos. Esta clase de arreglo es aprovechada por muchas células para realizar un acarreo dirigido de materiales por su interior. Corrientes citoplásmicas Un ejemplo típico de este fenómeno se encuentra en numerosas células vegetales. En presencia de luz —es decir, cuando hay producción de ATP gracias a la fotosíntesis— el contenido celular es circulado ininterrumpidamente a velocidades de hasta 100 micras 57 por segundo, dentro de pasadizos internos que a menudo atraviesan o circunvalan un enorme espacio libre o vacuola central (Figura V.6). Mediante este proceso la célula asegura una distribución homogénea de nutrientes y otras sustancias en su interior. El espectáculo de estas corrientes intracelulares ha cautivado a los microscopistas por más de 200 años, desde que en 1774 Corti lo describió por primera vez; pero no fue sino hasta la década pasada que logró aclararse el principio general que explica el fenómeno. Figura V. 6. Varios tipos de corrientes citoplásmicas en células vegetales. Por lo regular; el movimiento se origina en la cercanía de largas fibras que pueden estar dispuestas de diversas maneras en el interior de las células. El deslizamiento del citoplasma siempre es paralelo a estas fibras y con una velocidad máxima en la vecindad inmediata a las mismas. Las fibras que dirigen el movimiento tienen un diámetro aproximado de 0.2 micras, pero cuando son examinadas con un microscopio electrónico aparecen corno cables integrados por múltiples filamentos con un calibre individual de entre cinco y siete nanómetros. Estos filamentos pueden ser decorados artificialmente con cabezas de miosina, como se explicó en el capítulo anterior, por lo que no hay duda de que son polímeros de actina. Es más, como también se mencionó antes, se ha demostrado que en presencia de ATP y en condiciones propicias los cables compuestos por estos filamentos pueden servir como base y guía para la migración de cabezas de miosina obtenidas de músculo de conejo. El tratamiento de las células vegetales con citocalasinas —que como se recordará inducen la despolimerización de los filamentos de actina o con inhibidores metabólicos que disminuyen la producción de ATP, interrumpe de manera drástica el flujo intracelular. Puesto que también se sabe que las células vegetales —al igual que las de origen animal— tienen una dotación de moléculas de miosina, está claro que las corrientes cito plásmicas en las plantas se generan porque estas moléculas se impulsan sobre filamentos de actina mediante un proceso dependiente de ATP (Figura V.7). 58 Figura V. 7. Corrientes citoplásmicas en una célula vegetal. Secuencias videomicroscopicas del movimiento de los cloroplastos dentro de una célula de la planta acuática Vallisneria. Los cloroplastos se mueven en círculos alrededor de la célula utilizando la interacción de actina y miosina. Las flechas señalan un mismo grupo de cloroplastos en 3 posiciones sucesivas. De manera análoga a lo que sucede con las calles y avenidas de una ciudad, los cables de filamentos de actina pueden ser transitados por las moléculas de miosina en doble sentido o en una sola dirección. Puesto que cada filamento permite el avance únicamente en un sentido, el tránsito en uno o en dos sentidos depende de la orientación de los filamentos que componen el cable. Si todos los filamentos tienen su polaridad orientada en el mismo sentido, el movimiento será necesariamente unidireccional; pero si el cable está formado por filamentos dispuestos de modo antiparalelo, es decir, con sus polaridades orientadas en sentidos opuestos, constituye una pista sobre la que las moléculas de miosina podrán migrar en ambas direcciones. Las moléculas de miosina recorren los cables de filamentos de actina como unidades libres, o bien como vehículos de carga si están asociadas con vesículas y otras pequeñas estructuras. El desplazamiento activo de estos componentes ocasiona un efecto de arrastre pasivo sobre el fluido circundante, por lo que si el movimiento es unidireccional se produce un flujo continuo en la capa de citoplasma contigua al cable. Cuando existe un conjunto de cables paralelos, los flujos respectivos se suman y afectan regiones de citoplasma más distantes, generándose así una verdadera corriente que pone en circulación prácticamente la totalidad del contenido celular (Figura V.8). 59 Figura V. 8. Mecanismo propuesto de corriente citoplasmica: a =actina, c = cloroplasto, m = miosina, me = membrana, p = pared celular. Transporte axoplásmicosmico Al igual que los filamentos de actina, los microtúbulos también pueden constituir pistas para la migración de motores moleculares. El caso más notable de esto es el llamado transporte axoplásmico que tiene lugar en el interior de las prolongaciones cilíndricas o axones de las células nerviosas o neuronas. Estas prolongaciones, tradicionalmente conocidas como fibras nerviosas, son las que permiten la transmisión de señales entre puntos específicos del sistema nervioso, y pueden alcanzar longitudes de decenas de centímetros e incluso metros en animales de gran tamaño. Si bien las señales conducidas son en su mayoría de naturaleza eléctrica y se propagan por la membrana que limita cada axón, existe además un atareado acarreo de materiales por dentro de la fibra, es decir, a través del axoplasma. Proteínas, gránulos, mitocondrias, y vesículas de diversos tamaños emplean este sistema de transporte colectivo para viajar de un extremo a otro de las células nerviosas. El proceso ocurre de manera continua en ambos sentidos de la fibra, simultáneamente, con velocidades de hasta cinco micras o algo más por segundo (casi medio metro en 24 horas) que, convertidas proporcionalmente a una escala más familiar; serían comparables a la de un automóvil compacto corriendo a unos 120 km por hora. El transporte por el interior del axón permite a la neurona suministrar a sus prolongaciones y a sus remotas terminales los componentes que requieren para su mantenimiento y funcionalidad, así como recibir mensajes de tipo químico acerca de las células con que está directamente conectada (Figura V.9). 60 Figura V. 9. Transporte axoplásmico. A) Representación del axón en una neurona; B) amplificación mostrando vesículas transportadas a lo largo del axón por el citoesqueleto: mt = microtúbulos interconectados con la matriz citoplasmica, mit = motocondrias, nf = neurofilamentos, me = membrana celular, v = vesículas. Las prolongaciones, en ocasiones muy ramificadas, que otorgan a las neuronas su apariencia singular, no serían posibles sin un armazón interno que les ayude a mantener una forma tan asimétrica. Dicho armazón está constituido desde luego por el citoesqueleto; de hecho, las células nerviosas son quizás el ejemplo más destacado de hasta qué punto el citoesqueleto puede obligar a que las células embrionarias, originalmente globulares, adopten morfologías adecuadas a funciones particulares. El microscopio electrónico revela que la estructura más prominente de toda fibra nerviosa es una columna de microtúbulos asociados lateralmente entre sí por medio de numerosos brazos transversales. En muchos casos se encuentran también filamentos longitudinales de 10 nanómetros de grueso, llamados neurofilamentos, que por sus características pertenecen a la familia de los filamentos intermedios. Además de proporcionar estabilidad estructural a la fibra, los microtúbulos desempeñan un papel central en el mecanismo del transporte axoplásmico. La colchicina, la vinblastina y otras drogas que despolimerizan los microtúbulos, imposibilitan la continuidad del transporte. Por otra parte, cualquier condición que dificulte la producción de ATP —falta de oxígeno, sustancias tóxicas para las mitocondrias, etc.— detiene el proceso en poco tiempo. Como hemos visto, estas propiedades —interrupción del movimiento por trastorno del citoesqueleto o por carencia de energía metabólica— son características de los fenómenos mediados por motores moleculares. Sin embargo, sólo hasta en fechas muy recientes consiguió establecerse la identidad de tales motores. En 1985, mediante laboriosos procedimientos bioquímicos, se logró aislar del axoplasma un complejo de proteínas que tiene la habilidad de efectuar muy curiosos malabares. Al ser agregado, junto con ATP, a una suspensión de microtúbulos sueltos, hace que éstos repten sobre el vidrio de la cámara de observación o que se deslicen unos contra otros. Si los microtúbulos se sujetan 61 artificialmente al vidrio con un adhesivo y se añaden luego vesículas obtenidas también del axoplasma, además de ATP; la proteína hace que las vesículas marchen a lo largo de los microtúbulos. Se trata, pues, de un translocador que actúa en concierto con los microtúbulos; sí éstos están libres puede moverlos con respecto a una superficie de sostén, pero si están fijos su acción se refleja en el movimiento de pequeñas partículas sobre los mismos microtúbulos. Como conviene a un sistema de transporte colectivo, el translocador resultó no ser específico, ya que mueve toda clase de carga dadas las dimensiones apropiadas. En esta misma serie de experimentos se constato que la proteína es capaz de transportar perlitas microscópicas de látex. Ésta es en resumen la historia del descubrimiento de la cinesina, uno de los motores moleculares que opera en asociación con los microtúbulos. La investigación posterior ha comprobado que la cinesina es el vehículo del transporte axoplásmico, y que la columna de microtúbulos en el axoplasma ofrece guía y soporte para el traslado de componentes a lo largo del axón. Sin embargo, a diferencia de los cables de filamentos de actina en las células vegetales, los microtúbulos que se encuentran en el axoplasma tienen su polaridad orientada casi exclusivamente en un solo sentido. La cinesina, que al igual que los demás motores moleculares sólo transita en una dirección sobre su polímero correspondiente, migra en los axones alejándose del cuerpo celular. Como ya explicamos, el transporte axoplásmico es bidireccional, y por ello el flujo en sentido opuesto requiere de alguna explicación. La respuesta para este enigma parece residir en la dinaína, un translocador que avanza sobre los microtúbulos en dirección inversa llevarse a cabo a la cinesina. El ir y venir simultáneo de diferentes materiales a lo largo del axón puede mediante un sistema compuesto únicamente por una sola columna de microtúbulos orientados de idéntica manera, y dos tipos de transiocadores que marchan en direcciones opuestas. El transporte axoplásmico ha sido de gran utilidad para determinar con precisión la conectividad en el sistema nervioso, ya que, para indagar con qué otras células está conectada una neurona, basta inyectar en ella una sustancia reconocible, y examinar al cabo de algún tiempo el paradero de dicha sustancia en las regiones donde se sospecha que llegan sus prolongaciones. Desafortunadamente esta misma capacidad de transporte indiscriminado es aprovechada por ciertos virus para invadir las neuronas. La rabia, la polio y un tipo de herpes se propagan por las vías nerviosas a través de este mecanismo. Movimiento amiboideo Además del movimiento interno en las células generado por las diferentes máquinas que forman el citoesqueleto, muchas células necesitan desplazarse a diferentes partes de su hábitat, y en los organismos multicelulares algunas se mueven de un órgano a otro. Este sería el caso de los glóbulos blancos que se desplazan al sitio de una infección, de las células embrionarias que se reorganizan para formar órganos, y de las células invasoras o cancerosas. Los leucocitos, macrófagos, y las células embrionarias y cancerosas se 62 desplazan proyectando pseudópodos o pies falsos, que mueven sobre diferentes tipos de soporte o en un medio líquido. En este tipo de células los pseudópodos se forman y se retraen en forma constante para permitir el desplazamiento (figura V.10). La célula se proyecta hacia adelante cuando se forma un pseudópodo en esa dirección y una fuerza motora jala al resto de la célula también hacia adelante. A este tipo de movimiento se le llama amiboideo, por haberse observado inicialmente en organismos unicelulares de la clase Amoebina o amibas, que por cierto han sido objeto de gran interés para los usuarios de microscopios ópticos. Figura V.10. Secuencia videomicroscópica de una amiba en movimiento. La dirección del movimiento es señalada por la proyección del pseudópodo anterior (flecha), en donde el citoplasma carece de organelos. Para que una célula se mueva utilizando sus "pies" necesitará, como en el caso de un ser humano, de algo análogo a lo que son los huesos y los músculos que permiten el sostén y la propulsión del cuerpo. En el caso de una célula, el citoplasma se proyecta hacia la dirección en que se quiere hacer el desplazamiento. Debe estar lista toda la maquinaria necesaria para hacer el movimiento y arrancar en cuanto éste empieza, como sucede con un corredor de carreras, que está completamente listo en la línea de salida para arrancar en cuanto le den la señal. Así pasa con un músculo, una célula no muscular, cuya maquinaria está presta para moverse. Desde el siglo XVIII, los biólogos que habían observado el movimiento de las amibas también habían descrito transiciones en la consistencia del citoplasma, que denominaron gel-sol, ya que correspondía al estado más rígido (gel) o líquido (sol) que éste presentaba, particularmente en los pseudópodos. En algún momento se pensó que la formación de los pseudópodos y el desplazamiento de la célula en una dirección se podría deber a los mismos fenómenos de interacción de filamentos de actina y miosina que hacen que se contraiga un sarcómero. Sin embargo, por lo que se conoce en la actualidad, parecería que el mecanismo del movimiento amiboideo reside principalmente en la organización de 63 la actina en el citoplasma cortical o ectoplasma (Figura V.11). Esta banda de citoplasma periférico, localizado justamente debajo de la membrana celular, es particularmente transparente y sufre cambios notorios en su consistencia precisamente cuando se forma un pseudópodo. Cuando se encuentra en un estado gelatinoso rígido es capaz de soportar grandes presiones. Al cambiar a la condición líquida, este citoplasma cortical se expande hacia donde se está desplazando la célula. Figura V. 11. Localización de actina en el pseudópodo anterior de dos amibas en movimiento. Se pudo observar la actina en el citoplasma al decorarla con anticuerpos preparados contra la proteína y, después, viendo la célula con un microscopio de fluorescencia. En 1976 se descubrió que tanto la actina como la miosina se localizan en el ectoplasma de las células amiboides. La actina de esta región puede ensamblarse en filamentos largos concomitantemente con un aumento en la viscosidad del citoplasma. La viscosidad disminuye silos filamentos de actina se rompen en sus componentes, es decir, si se despolimerizan. Unos años después se pudieron hacer experimentos de gelificación de extractos citoplásmicos en un tubo de ensayo. Estos extractos tomados de varios tipos de células se transforman en gel al quitar del medio iones de Ca2+ y son particularmente ricos en actina, la cual polimerizarse, forma una red que le da cohesión al gel a pesar de que su masa mayoritaria es fluida. Si uno toma filamentos de actina y los polimeriza en un tubo de ensayo, los filamentos tienden a agruparse en haces, por lo que se pensó que el arreglo reticular observado en los geles citoplásmicos podría resultar de la interacción de la actina con otras proteínas en el gel, ya que por experimentos de tipo bioquímico se sabía que los componentes proteicos en estos geles eran de varios tipos. La primera proteína que se identificó como promotora de la gelación de actina se aisló de macrófagos y se llamo ABP (por actin-binding protein). La ABP se une en ángulo recto a los filamentos de actina, como si fuera una bisagra o un gozne que une dos filamentos en forma más o menos perpendicular para formar una red octagonal. La presencia de esta red en el citoplasma cortical impide el libre paso de organelos subcelulares a esa región, regulando a la vez la comunicación con la membrana celular. La consistencia del ectoplasma dependerá de la concentración y número del filamentos de actina y de la concentración de las proteínas que, al unirse a los filamentos, causan su interacción para formar la red. La miosina que se encuentra en esta región podría estar interaccionando con los filamentos de actina, lo cual sería responsable de la locomoción. Sin embargo, hay evidencia 64 experimental reciente de que, por un lado, la concentración de miosina en células no musculares es muy baja para formar una estructura tipo sarcómero, que tampoco se ha visto en el citoplasma de este tipo de células, y por el otro, éstas se mueven normalmente. Por este tipo de resultados, y con el descubrimiento de otras proteínas que se unen a la actina, se ha pensado que la locomoción de las células es un fenómeno causado por cambios en la conformación de la actina, más que una contracción causada por su deslizamiento sobre filamentos de miosina. Sin embargo, ésta puede participar en la restricción del ectoplasma a una zona, contrayendo la región inmediatamente por detrás de donde se forma el pseudópodo. En el modelo de movimiento amiboideo, causado por expansión cortical, el desensamble de filamentos de actina en el ectoplasma causaría un aumento local en la concentración de partículas que generaría el movimiento de fluidos hacia esta zona y, por lo tanto, cambios en la presión osmótica. De esta presión se podría derivar la fuerza para formar un pseudópodo que se proyectaría hacia el exterior en aquella zona más fluida del ectoplasma que perdió rigidez al desensamblarse los filamentos de actina. La formación del pseudópodo y la fuerza del líquido en la misma dirección moverían a la célula ayudados por la polimerización de la actina en el pseudópodo para darle rigidez. La repetición de ciclos de polimerización-despolimerización de la actina en la región cortical le permite a la célula formar pseudópodos y moverse (Figura V.12). Para la iniciación de cada uno de los ciclos se requiere de ayuda adicional —otras proteínas— que facilite la polimerización y despolimerización de la actina en los momentos necesarios. Una proteína con estas características y que se encuentra tanto en macrófagos como en muchas otras células es la llamada gelsolina. Esta proteína se pega a los filamentos de actina y los corta en pequeños fragmentos y monómeros de la proteína que quedan listos para polimerizarse de nuevo. Sin embargo, como se requiere que permanezcan despolimerizados durante el estado del sol del citoplasma, la gelsolina bloquea la polimerización pues permanece pegada al extremo de los fragmentos, que es por donde podría reiniciarse. Mientras tanto, los monómeros también son bloqueados al unírseles la proteína llamada profilina. El material para rehacer la red queda en reserva e inactivo. Cuando se recibe una señal para polimerizar la actina, el material se activa y se inicia la gelificación. 65 Figura V. 12. Diagrama del movimiento amiboideo. Los filamentos de actina (a) y miosina (m) interaccionan para permitir el desplazamiento de la célula sobre el sustrato y la formación y retracción de los pseudópodos. En S- G se da la transición sol a gel y en G- S a la inversa; e = región del endoplasma; X región del ectoplasma. La coordinación de todos estos procesos está bajo el control de señales que llegan a la membrana de la célula. Al pasar la señal al interior de la célula se producen varios efectos; uno de los más frecuentes es la salida de iones de Ca2+ del interior de las vesículas en donde está almacenado. El Ca2+ es un activador de la gelsolina, a la cual se une. La gelsolina activada se pega a 1os filamentos de actina y, al fragmentarlos, inicia el ciclo. Los fragmentos de filamentos unidos a la gelsolina, así como los monómeros unidos a la profilina, se difunden hacia la membrana celular, en donde se ha encontrado que se ponen en contacto con lípidos de la clase del fosfoinositol. Estos fosfolípidos liberan la unión que existe entre la gelsolina y los filamentos de actina, por un lado, y la asociación de la profilina con monómeros de actina, por el otro, de modo que estos últimos ya libres, pueden volverse a reunir para formar núcleos de polimerización y nuevos filamentos de actina. Con ello se recupera el arreglo reticular que estabiliza al pseudópodo y a la franja cortical gelificada del ectoplasma (Figura V.13). Aunque éste sólo es un modelo, hay mucha evidencia experimental que nos hace pensar que es el mecanismo responsable de ellas transiciones gelsol del citoplasma y de la locomoción celular. Nuevamente, en este modelo la miosina podría participar asociada a la actina en algún tipo de contracción que actúe en concierto con los cambios de consistencia descritos. 66 Figura V. 13. Diagrama del proceso de polimerización y despolimerización de la actina en la región cortical de una célula en movimiento. Este proceso ayuda a la expansión del citoplasma para formar un pseudópodo. Las proteínas que interaccionan con la actina y su unión a fosfolípidos en la membrana regulan la polimerización y despolimerización de la actina en conjunto con el Ca2+ en el citoplasma. 67 V I . A P A R A T O S M O T I L I D A D D E P R E C I S I Ó N : C O O R D I N A D A APARATOS DE ACCION INTERNA Cromatóforos HEMOS mencionado que el transporte intracelular cumple con funciones muy diversas y ayuda para la adecuada distribución de metabolitos en distintas zonas del citoplasma, para el mantenimiento de regiones muy distantes del cuerpo celular y para el intercambio de mensajes químicos entre células relacionadas. Todos estos procesos son desde luego invisibles; sólo pueden observarse con la ayuda de un microscopio o de técnicas especiales y, en general, ocurren en la profundidad de los tejidos dentro de los organismos. Existe, sin embargo, un famoso ejemplo de transporte intracelular con efectos macroscópicos, que se manifiesta en la parte externa de algunos animales, por lo que es fácilmente observable, aunque en ocasiones persigue precisamente lo opuesto, es decir; conferir al individuo que lo posee el preciado don de la invisibilidad. La evolución ha perfeccionado este dispositivo como un eficaz medio de comunicación silenciosa entre congéneres, o como un recurso de seguridad para la oportuna desaparición ante los ojos de los enemigos naturales o de los distraídos prospectos para un buen almuerzo. Dicho dispositivo se encuentra en diversos grupos zoológicos, desde los insectos hasta los vertebrados, pero sus beneficiarios mejor conocidos son los peces y, por antonomasia, el camaleón. Mediante modificaciones del color que exhiben en diversas partes de sus cuerpos, muchos de estos animales pueden declarar su pasión por un determinado ejemplar del sexo opuesto, mostrar su ira ante un rival en amores o en dominio de territorio, o tan sólo remedar el patrón cromático del fondo hasta fundirse ópticamente con el ambiente. Todos estos cambios de apariencia son posibles gracias a células superficiales llamadas cromatóforos, es decir, que transportan pigmentos. Un cromatóforo típico consiste en una célula discoidal o en forma de estrella aplanada con puntas ramificadas, que contiene en su interior —aparte del núcleo, mitocondrias y demás organelos citoplásmicos— cientos e incluso miles de gránulos de alguna sustancia colorida (Figura VI.1). Los cromatóforos reciben el nombre específico de melanóforos si la sustancia es negra, eritróforos si es rojiza, iridóforos si es iridiscente, etc. En respuesta a ciertos estímulos nerviosos u hormonales, el cromatóforo acumula las partículas de pigmento en su región central o las dispersa hasta que quedan distribuidas uniformemente por todo el volumen celular. Como resultado de estas movilizaciones radiales en masa, el citoplasma varía sus propiedades de absorción y reflexión de luz; la mayor parte de su extensión palidece cuando las partículas están agregadas, y adquiere la coloración respectiva cuando el pigmento se dispersa. Dada que en cada escama o porción de piel ellos responden de igual manera a los estímulos, ese sector modificará la intensidad del color correspondiente; la activación síncrona de 68 series de sectores contiguos cambiará así el aspecto de vastas zonas corporales. En ocasiones un mismo sector puede contener cromatóforos de diferentes colores —melanóforos intercalados con eritróforos y con iridóforos— y cada tipo es controlado por estímulos distintos; el matiz cromático se verá entonces alterado en función de la estimulación relativa de cada tipo, según las circunstancias. La multiplicidad de combinaciones puede llegar a mimetizar el entorno inmediato con una fidelidad sorprendente. Figura VI.1. Esquema ilustrativo del movimiento de los gránulos de pigmento dentro de un cromatóforo. A) Célula vista desde arriba; B) vista lateral; C) sección amplificada de la célula en B), donde se ve la asociación de los gránulos con elementos del citoesqueleto (microtúbulos mt y matriz cotoplasmica). Como en el caso de las neuronas, la morfología peculiar de los cromatóforos se debe a una organización especial del citoesqueleto. Hay numerosos microtúbulos orientados con la misma polaridad desde un sitio central hacia todos los rincones de la periferia, como los rayos de una rueda de bicicleta. Esta disposición radial es apta para dirigir y brindar soporte a los desplazamientos de los gránulos de pigmento, cuya migración centrífuga durante la dispersión es mediada por la cinesina, al menos en los melanóforos. Al igual que otras manifestaciones de transporte intracelular basado en microtúbulos, los cambios de posición del pigmento son muy sensibles a drogas como la colchicina y la vinblastina, y dependen estrictamente de un generoso aporte de ATP. Es evidente, por tanto, que el mecanismo de los cromatóforos es similar al del transporte axoplásmico, pero adaptado para funcionar en un arreglo radial más que longitudinal (Figura VI.2). 69 Figura VI. 2. Micrografía que muestra tres estados de distribución de gránulos de pigmento en cromatóforos del cangrejo de río. De izq. a der. Dispersión máxima, dispersión media y agregación máxima del pigmento.(Fotografía cortesía de L. Rodríguez Sosa). Pero en los cromatóforos interviene además otro elemento del citoesqueleto, que desempeña un papel clave para aumentar en mucho la eficiencia y la coordinación del sistema. Tanto en el transporte axoplásmico como en las corrientes citoplásmicas de las células vegetales, los motores moleculares corren sueltos o asociados con partículas libres; cada componente desplazado obedece al trabajo de motores particulares con los que está directamente uncido, o al flujo general provocado por la continua marcha unidireccional de una. multitud de motores sueltos. En ambos casos se observa que las estructuras se trasladan de manera más o menos simultánea, pero independiente. En contraste, los cromatóforos muestran un movimiento concertado de los gránulos de pigmento (Figura Vl.2). Ya sea durante la agregación o durante la dispersión, cada gránulo mantiene su posición relativa con respecto al resto de la población; se dice que el movimiento es coherente. El secreto de esta uniformidad estriba en que los gránulos son transportados en un vehículo común. Las partículas de pigmento se encuentran engarzadas en un material fibroso llamado red microtrabecular. La actividad de las moléculas de cinesina, alejándose del centro del cromatóforo cuando migran sobre los microtúbulos obliga a que esta red se extienda por el citoplasma y distribuya así el pigmento en todo el volumen celular; y cuando, ante un cambio de condiciones, los motores cesan de actuar, la red se contrae por su propia elasticidad arrastrando con ella los gránulos hacia el centro de la célula. Esto provoca una mayor eficiencia de transporte, en comparación con otros sistemas, porque la acción motriz de las moléculas de cinesina es cooperativa y se transmite por medio de la red microtrabecular a muchas particulas a la vez, aun cuando no todas estén en proximidad inmediata de los microtúbulos. Al mismo tiempo se consigue una buena coordinación en los movimientos de una vasta multitud, lo que es especialmente conveniente para la función del cromatóforo. La incorporación de la red microtrabecular como un medio de transmisión de fuerzas representa así un incremento favorable en el nivel de complejidad sobre la máquina básica constituida por la cinesina y los microtubulos. La operación sinérgica de máquinas individuales como 70 parte de un complejo estructural que funciona como una unidad y para un mismo propósito, nos permite hablar ya de un aparato. Mecanismos de control Aparte de la organización radial y de la movilización coherente, existen otras dos importantes diferencias entre los cromatóforos y los demás sistemas de transporte intracelular examinados hasta ahora: 1) en todos los ejemplos anteriores el movimiento sobre los rieles del citoesqueleto es unidireccional o va en ambas direcciones, simultáneamente, pero no se alternan migraciones en un sentido y luego en otro; 2) el movimiento es continuo y no se presenta como respuesta ante factores extrínsecos a la propia célula. En los cromatóforos, por lo contrario, el pigmento tiene un comportamiento de ida y vuelta— se agrega o se dispersa en masa en un momento dado—, y la acción es inducida por hormonas o por impulsos nerviosos. En otras palabras, en los cromatóforos aparece un mecanismo de control. Esta particularidad es también propia de los aparatos. Las evidencias acumuladas por la investigación de diversos aparatos de motilidad celular indican que la activación o inactivación de los mismos depende casi siempre de cambios en la abundancia de iones de calcio libres en el citoplasma. La mayoría de las células cuida celosamente que el calcio libre en su fluido interno se mantenga en un bajo nivel, al grado de que la concentración del mismo en el citoplasma es por lo regular 10 000 veces menor que en el medio extracelular. No obstante, ciertos estímulos pueden ocasionar que en algunas células la membrana plasmática permita la entrada de calcio, o que éste se escape de compartimientos internos donde es normalmente secuestrado con objeto de disminuir su presencia en libertad. Así, el aumento transitorio de calcio libre en el citoplasma tiene el efecto de apagar o encender el funcionamiento de las máquinas moleculares, o incluso de modificar la organización misma del citoesqueleto. En los cromatóforos la elevación del calcio libre en el citoplasma —a consecuencia de que hacen contacto con la membrana plasmática hormonas vertidas a la sangre del animal o sustancias secretadas por terminales nerviosas cercanas— parece obstaculizar la tracción centrífuga de la cinesina, ya que causa agregación del pigmento. Todavía no está esclarecida la secuencia de movimientos que determina esta respuesta. Sin embargo, es muy probable que tenga lugar una serie de procesos análogos a los que explican el control de la contracción de los músculos esqueléticos, y que tendremos oportunidad de revisar con detalle más adelante. Migraciones de pigmentos retinales Las migraciones masivas y reversibles de gránulos de pigmento no son exclusivas de los cromatóforos. También existen en células de la retina de algunos animales, donde cumplen con la función de regular la luz que llega a las células sensibles o fotorreceptoras. Incluso se puede ver que en ciertos casos los fotorreceptores cuentan con su dotación de pigmento transportable. Un buen ejemplo se encuentra en los ojos de las moscas, mariposas y muchos otros insectos, y de crustáceos, como los camarones y los 71 cangrejos (Figura VI.3). Las partes propiamente fotosensibles de las células fotorreceptoras pueden verse tapizadas por una densa cortina de gránulos oscuros que evitan la iluminación excesiva de las mismas durante las horas diurnas. Al anochecer, se retira el pigmento de esta posición y se sitúa de tal manera que no impide el máximo aprovechamiento de la escasa luz disponible. Figura VI. 3. Esquema ilustrativo de la distribución de los gránulos de pigmento en los fotorreceptores retinales del cangrejo de río. A) En presencia de la luz los gránulos se mueven hacia la parte superior para proteger las membranas fotosensibles (zona alargada, gris oscuro); B) en la oscuridad los gránulos se desplazan a la parte inferior, dejando descubiertas las membranas fotosensibles. En los fotorreceptores del cangrejo de río este movimiento se efectúa por un aparato de translocación en masa, integrado por un grueso haz de microtúbulos, por una malla fibrosa equivalente a la red microtrabecular de los cromatóforos y muy probablemente, por moléculas de cinesina. La estimulación lumínica origina un aumento de calcio libre en el citoplasma de los fotorreceptores y dispara el retorno de la población de gránulos de pigmento a la posición de adaptación a la luz. Cuando entre los mecanismos que controlan el ingreso de la luz a la retina se encuentran células pigmentarias — que no son fotosensibles —, como en los peces y las ranas, el transporte se efectúa también por un citoesqueleto especialmente organizado (Figura VI.4). 72 Figura VI. 4. Microscopía de barrido de alta resolución de un fotorreceptor del cangrejo de río. Se pueden observar los gránulos de pigmento asociados a haces de microtúbulos. APARATOS DE ACCIÓN EXTERNA Hasta aquí hemos considerado movimientos celulares en donde los motores moleculares recorren grandes distancias sobre los rieles que proporciona el citoesqueleto. Cada motor está en libertad de desplazarse de uno a otro extremo del polímero respectivo. Tal vez la única excepción relativa en este sentido serían las migraciones pigmentarias en los cromatóforos y en las células retinales porque, a medida que alcanza su máxima extensión en cada región de la célula, la red microtrabecular del aparato de translocación impone probablemente cierta restricción a que continúe el avance de las moléculas de cinesina. En otros sistemas de motilidad, sin embargo, el recorrido de los motores sobre los rieles del citoesqueleto está limitado a distancias mucho menores. Paradójicamente, gracias a esta sujeción parcial se consiguen los más notables y poderosos movimientos biológicos. La actividad de los motores moleculares en el interior de las células es capaz, entonces, de realizar trabajo fuera de ellas, ya sea para acarrear materiales en el medio extracelular, o para transportar la célula completa de un lugar a otro, e incluso para movilizar al organismo entero del que forman parte. Todas estas proezas implican, por supuesto, aparatos muy complejos. Cilios y flagelos Cuando revisamos el caso del transporte axoplásmico se mencionó que el desplazamiento en dirección al cuerpo celular parece estar mediado por la dinaína, un translocador que migra sobre los 73 microtúbulos en sentido opuesto al de la cinesina. Sin embargo, la dinaína fue inicialmente conocida como el motor responsable del movimiento de los cilios y los flagelos, unos apéndices filiformes de aproximadamente 0.2 micras de diámetro que emergen de la superficie de algunas células, y cuya agitación al ritmo de entre 5 y 10 ciclos por segundo tiene una acción mecánica sobre el líquido circundante. Cuando la célula se encuentra fija —como integrante de un epitelio, por ejemplo— el batir de los cilios tiene un efecto de empuje sobre el líquido externo, que es barrido sobre la superficie del tejido porque muchas otras células idénticas realizan la misma operación. Un caso ilustrativo de esto último es el epitelio que reviste las vías respiratorias, donde la función de los cilios es encaminar al exterior el mucus que retiene las particulas de polvo que penetran con el aire. Los óvulos de muchas especies también son conducidos a través del oviducto, por medio de la actividad ciliar de células epiteliales. Ahora bien, si se trata de una célula libre —como un protozoario o un espermatozoide—, el trabajo de los cilios o los flagelos (Figura VI.5 y VI.7) se traduce en un desplazamiento de la propia célula a través del liquido en que se encuentre, y constituye entonces un recurso de locomoción. Figura VI. 5. Aspecto de los cilios alrededor de un paramecio vistos por videomicroscopía de contraste, acentuada electrónicamente. Para que los cilios y los flagelos puedan desempeñar su función con eficacia necesariamente deben actuar con direccionalidad. Los cilios consiguen esto mediante un movimiento análogo a las brázadas de un nadador: se extienden y empujan el líquido como remos durante la fase activa del ciclo, y se repliegan hacia el cuerpo de la célula en su retorno a la posición inicial (Figura VI .6) . 74 Figura VI. 6. Etapas del movimiento ciliar. A, B, C) Etapas de empuje; D, E, F) etapas de retorno; G) cilios en etapas consecutivas del ciclo. Las flechas indican magnitudes relativas y dirección de esfuerzos contra el medio. Figura VI. 7. Espermatozoides de cobayo en donde se ven claramente los flagelos en diferentes etapas de reflexión. (Fotografía cortesía de A. Mújica). Los flagelos —que son mucho más largos y generalmente menos numerosos que los cilios— emplean un principio de propulsión similar al de una anguila: ondulaciones continuas que recorren toda su longitud. Si el flagelo está inserto en el polo posterior de la célula, como en los espermatozoides, la ondulación dirigida hacia atrás representa un empuje hacia adelante. Cuando el flagelo está situado en el polo anterior, como en muchos protozoarios y algas unicelulares, el desarrollo de fuerzas es algo más complejo. El flagelo se curva hacia un lado al enfrentar la resistencia del medio acuoso y realiza ondulaciones helicoidales que obligan a la célula a girar con cierta inclinación en torno al eje de avance; dicha rotación convierte al cuerpo celular en una especie de aspa que impulsa el fluido hacia atrás y, en consecuencia, repercute en un desplazamiento del organismo hacia adelante (Figura VI.8). Por increíble que parezca, esta diversidad de movimientos es producto de un interdeslizamiento restringido de microtúbulos. 75 Figura VI.8. Representación esquematica de dos tipos de movimiento flagelar. A) característica de algunos protozoarios y algas flageladas; B) característica de espermatozoides. Las flechas grandes señalan la dirección de desplazamiento del organismo. La estructura básica de los cilios y los flagelos consiste en un aparato longitudinal al que los microscopistas llamaron axonema (filamento axial), recubierto por membrana plasmática como el resto del cuerpo celular (Figura III.9). Al igual que otros aparatos, el axonema está integrado por múltiples máquinas que trabajan de manera coordinada, y cada máquina consta de un motor y sus respectivos elementos de soporte. Estos últimos son provistos por un arreglo de microtúbulos paralelos y dispuestos de tal manera que un par central aparece circundado por nueve microtúbulos dobles. Los microtúbulos dobles periféricos no son simplemente parejas, como las que constituyen los dos centrales, sino unidades peculiares que resultan de una forma distinta de polimerización de la tubulina. Cada unidad está integrada por un microtúbulo incompleto, lo cual indica que no se cierra sobre sí mismo, adosado longitudinalmente a uno completo, de modo que la fracción faltante del primero queda sellada por la pared del segundo. Cada microtúbulo doble tiene su raíz en la corteza del cuerpo celular, donde se origina a partir de una estructura triple formada por la anexión lateral de un segmento más de microtúbulo incompleto; el conjunto resultante de nueve tripletes acomodados en formación anular recibe el nombre de cuerpo basal. Los dos microtúbulos centrales del axonema no llegan hasta el cuerpo basal ni presentan una inserción especial, pero se encuentran rodeados por una capa de material fibrilar llamada vaina interna. Los microtúbulos dobles periféricos aparecen vinculados entre sí y con la vaina interna por medio de varios tipos de enlaces perpendiculares al eje del axonema, todos ellos colocados con exacta periodicidad a intervalos particulares. Desde cada microtúbulo periférico se extienden puentes radiales hacia el centro del axonema, y tenues bandas hacia uno de los dos microtúbulos dobles adyacentes. Además, cada microtúbulo doble presenta dos hileras de brazos cortos que llegan a tener contacto con el otro de los microtúbulos dobles vecinos. Estos brazos son, las moléculas de dinaína o motores que, en combinación con los elementos de apoyo 76 estructural, constituyen las máquinas que mueven el axonema. El principio del mecanismo no es difícil de comprender (Figura VI.9). Cuando dispone de ATP, la dinaína propende a caminar sobre los microtúbulos en dirección al cuerpo celular, arrastrando con ella cualquier carga unida, que en este caso es también un mícrotúbulo doble con el que está permanentemente asociada. Sin embargo, éste no puede migrar porque está anclado en el cuerpo basal y porque se lo impiden además los múltiples vínculos con el centro del axonema y con el microtúbulo doble anexo por el otro lado. En consecuencia, el esfuerzo produce tan sólo un breve deslizamiento entre los dos microtúbulos conectados por la dinaína. Dado que cada microtúbulo doble está sometido a un esfuerzo similar, el resultado general es un efecto de torsión o flexión del axonema en su conjunto. Figura VI.9. Mecanismo del axonema. Los pares exteriores están conectados entre sí a través de otras proteínas y, al añadirse ATP y Ca2+, el primero se hidroliza por la actividad de la dinaína para ceder la energía necesaria para el movimiento. Las moléculas de dinaína asociadas a un par de microtúbulos periféricos actúan sobre el par adyacente (A) y producen un esfuerzo de deslizamiento en presencia de ATP y calcio (B). El esfuerzo conjunto de todos los pares exteriores obliga a la flexión del cilio o flagelo (C); m = membrana. Por supuesto, nadie ha podido observar los vertiginosos fenómenos que ocurren en el minúsculo interior de un cilio o un flagelo en movimiento. Pero existen datos experimentales que sustenta la explicación resumida en el párrafo anterior. No hay duda de que el mecanismo se encuentra en los cilios o flagelos mismos porque, cuando son aislados de sus células— "rasurando'" protozoarios mediante vibraciones de alta frecuencia o con ayuda de un fino rayo láser —, continúan agitándose en una solución salina que contenga 77 ATP. Es más, el aparato motriz reside en el axonema porque la eliminación de la membrana plasmática por métodos químicos no afecta la motilidad de cilios o flagelos aislados. Está también claro que los motores son las moléculas de dinaína porque la exposición del axonema a tratamientos capaces de retirarlas selectivamente causa un enlentecimiento progresivo del movimiento, hasta llegar a la parálisis total, y la motilidad se recupera al agregar dinaína purificada. Por otra parte, la aplicación de enzimas que destruyen las conexiones pasivas entre los microtúbulos dobles sin dañar mayormente los brazos de dinaína, seguida de adición de ATP, da como resultado un rápido deslizamiento de dichos microtúbulos entre sí, hasta que el axonema llega a medir nueve veces su longitud inicial (la suma de las longitudes de los microtúbulos dobles individuales). Este fenómeno es una clara indicación de que el movimiento ondulatorio de cilios y flagelos es consecuencia de restricciones estructurales para que las moléculas de dinaína corran libremente a lo largo de los microtúbulos con que hacen contacto funcional en el axonema. Por último, el microscopio electrónico ha mostrado que los extremos de los microtúbulos dobles en las puntas de los cilios, así como las diversas conexiones transversales en la estructura del axonema, aparecen acomodados en posiciones que varían con la curvatura del eje longitudinal, como se puede esperar según el modelo que hemos descrito. Sarcómero El axonema es una pequeña obra maestra de la ingeniería natural. Gracias a él los procesos internos del citoplasma logran influir mecánicamente sobre el medio exterior. Sin embargo, en este terreno los aparatos construidos con microtúbulos no pueden competir con aquellos que se basan en filamentos de actina. La potencia, velocidad y precisión de control que han alcanzado estos últimos les hacen acreedores al título de la maquinaria más perfecta y poderosa que ha creado la evolución. Es esta maquinaria molecular la que produce el brutal coletazo de una ballena, el raudo aleteo de un mosquito, el salto exacto de un trapecista y el arrebatador manejo del teclado de un virtuoso del piano. Su capacidad de transformación material del mundo ha quedado de manifiesto, con proporciones monumentales, en las pirámides de Egipto y Mesoamérica, las catedrales góticas de Europa y la Gran Muralla China. En cada uno de estos casos el movimiento implícito en la ejecución es o sido producto del trabajo muscular, y éste es la expresión macroscópica de la actividad de múltiples máquinas compuestas por moléculas de miosina y por filamentos de actína. Estas máquinas, en principio idénticas a las que generan las corrientes citoplásmicas en las plantas, conforman la unidad fundamental del músculo esquelético, un aparato contráctil conocido como sarcómero (del griego sarcos, carne, y meros, parte). Los músculos esqueléticos —así llamados porque su trabajo ejerce fuerza sobre los huesos en los vertebrados— están constituidos por muchas fibras paralelas, cada una de las cuales se origina por la fusión de varias células alargadas (Figura VI.1O(a). Puesto que al fundirse entre sí las células originales eliminan las fronteras entre sus respectivos citoplasmas, pero conservan sus núcleos 78 individuales, las fibras musculares son en realidad grandes células multinucleadas. Además, las fibras musculares presentan la singularidad de que su citoplasma está surcado por numerosas fibrillas longitudinales formadas por haces muy compactos de filamentos de actina y miosina. La cantidad de estas proteínas en la fibra muscular es tan enorme que la mayor parte de su volumen se encuentra ocupada por los polímeros correspondientes. Si bien las fibras y las fibrillas pueden medir varios milimetros, y hasta centímetros de largo, por lo común los filamentos individuales apenas exceden una micra de longitud. Cada fibrilla está integrada por muchos segmentos de filamentos de actina y miosina. El secreto del diseño del músculo esquelético, la clave de su gran éxito evolutivo y de sus asombrosas capacidades radica en la perfecta regularidad con que estos filamentos están distribuidos en el espacio (Figura Vl.10(b). Figura VI.10. Organización de un músculo esquelético. A) El músculo está formado por varias fibras; B) cada fibra muscular está formada por fibrillas, constituidas, a su vez, por series de sarcómeros; C) el sarcómero esta formado por filamentos de actina (delgados) y miosina (gruesos), que se interdigitan. Los extremos de los filamentos de la actina se encuentran anclados en estructuras terminales llamados discos Z; D) amplificación de la interacción que muestra la colocación de las cabezas de la miosina en relación con los filamentos de actina. Cada fibrilla es una serie de miles de unidades discretas, y cada unidad está compuesta por un conjunto de filamentos de actina en cada extremo y un conjunto de filamentos de miosina en la región central. Los filamentos de actina de cada conjunto tienen la misma polaridad pero son antiparalelos con los del conjunto opuesto — tienen polaridad contraria—, y penetran parcialmente entre los filamentos de miosina. La polaridad de cada conjunto de filamentos 79 de actina es tal que las moléculas de miosina caminan sobre ellos en el sentido de dirigirse hacia los extremos del sarcómero. Por su parte, los filamentos de miosina muestran la configuración bipolar que describimos en el capítulo anterior: las moléculas de miosina aparecen asociadas por sus colas, con las cabezas motoras colocadas de manera escalonada en dirección a los extremos. La unidad formada por estos tres conjuntos de filamentos es un sarcómero, y cada sarcómero está separado del que le sigue en la fibrilla por una placa circular llamada disco Z, en la que se anclan los filamentos de actina de ambos sarcómeros contiguos (Figura VI.10(c). Con este tipo de ordenamiento la actividad motriz de las cabezas de miosina tiene el efecto de tirar de ambos conjuntos de filamentos de actina y aproximarlos entre sí. Esto es precisamente lo que sucede durante la contracción muscular; los filamentos de actina son jalados por las cabezas de miosina. Como ocurre con el deslizamiento de los microtúbulos dobles contiguos del axonema, la interacción entre un filamento de miosina y un filamento de actina es mediada por múltiples motores que operan de manera desfasada, por lo que en todo momento hay un cierto número de ellos en la fase activa del ciclo mientras otros se hallan en las etapas de reacomodo, quedando garantizada con ello una tracción sin interrupciones. A diferencia del axonema, sin embargo, la organización del sarcómero brinda la posibilidad de que la tracción sea aplicada de manera uniforme de cada filamento y no sólo sobre uno de sus lados, como en los microtúbulos dobles de los cilios y los flagelos. Esta uniformidad deriva de que los filamentos de miosina presentan las cabezas motoras orientadas en varias direcciones en torno a su eje, por lo que cada uno de ellos puede interaccionar con varios filamentos de actina a la vez (Figura VI.10(d). Por su parte, cada filamento de actina hace contacto con las cabezas motoras de todos los filamentos de miosina que lo circundan. Puesto que dichas interacciones tienen lugar en ambos extremos de cada filamento de miosina, los dos conjuntos de filamentos de actina experimentan un arrastre uniforme y el sarcómero desarrolla una fuerza homogénea que tiende a disminuir su longitud. Cada sarcómero tira entonces de los dos adyacentes y, dado que todos los sarcómeros de una fibrilla y todas las fibrillas de una fibra se activan prácticamente al mismo tiempo, el músculo entero se contrae (Figura VI. 11). 80 Figura VI.11. Micrografía electrónica mostrando el arreglo de los filamentos de miosina y actina en los sarcómeros de músculo esquelético. El grado de tensión y la amplitud del movimiento efectivo desarrollados por los sarcómeros dependen de algunos factores. El más obvio es la carga que enfrenta el músculo, porque si ésta es superior a la que puede vencerse con el empleo de toda la potencia de los motores, la longitud de los sarcómeros no variará. Esto es, lo que le sucede al novato que sin entrenamiento pretende levantar una pesa de 140 kilos. El trabajo de las cabezas de miosina sobre los filamentos de actina se realiza con un gran gasto de energía, pero la pesa permanece inmóvil porque los músculos encuentran imposible acortarse ante una resistencia de tal magnitud. El término que se emplea para designar este esfuerzo estático es contracción isométrica —contracción sin cambio en las dimensiones del músculo —, que puede parecer un contrasentido, pero en el fondo es válido, porque en realidad algunos sarcómeros sí alcanzan a contraerse en cierta medida a expensas del estiramiento de otros, y gracias a cierta elasticidad del tejido (Figura VI.12). Ahora bien, no todas las contracciones isométricas son tan inútiles como la del ejemplo anterior. Los músculos que mantienen a los animales de pie, contra la fuerza gravitacional, cumplen con su función mediante contracciones isotérmicas sostenidas. Cuando el animal se levanta a partir de una posición yacente, estos músculos se contraen hasta que los huesos del esqueleto se encuentran con las relaciones espaciales específicas que determinan la posición erguida para dicha especie; una vez alcanzado este objetivo su actividad no puede ya expresarse como cambio de longitud, el trabajo que desarrollan permite guardar dichas relaciones y conservar la posición. Otro tanto ocurre al mantener un brazo alzado, al detener una puerta que alguien empuja por el otro lado, y en cualquier otra situación en la que oponerse a un movimiento debido a causas externas requiere de un esfuierzo corporal continuo, aunque sea aparentemente estático. 81 Figura VI. 12. Relación entre la longitud inicial de un sarcómero y la tensión que puede desarrollar. La tensión es máxima en B cuando existe una interpenetración media de los filamentos. Por supuesto, mas que oponerse al cambio, la función principal del músculo es generar movimiento. Cuando se enfrenta con cargas proporcionales a su potencia particular, todo músculo activo se contrae efectivamente, es decir, reduce su longitud como resultado del acortamiento de sus sarcómeros. Sin embargo, debido a la construcción de estos últimos, la fuerza que pueden desarrollar al contraerse depende de su longitud inicial. Para comprender esta relación consideremos situaciones extremas. En un sarcómero excesivamente distendido antes de la contracción, la yuxtaposición de filamentos de actina y de miosina es mínima, puesto que el estiramiento aleja simétricamente a los primeros de la región media, donde se encuentran los segundos. En esta condición los dos grupos de filamentos se tocan entre sí sólo en sus porciones terminales y, por consiguiente, el número de cabezas de miosina que pueden interactuar con los filamentos de actina es reducido, y la fuerza total generada es también baja. Por lo contrario, en un sarcómero cuya longitud inicial sea demasiado corta, el traslapamiento de filamentos será máximo. En este caso, prácticamente la totalidad de las cabezas de miosina podrá ejercer tracción sobre los filamentos de actina pero, puesto que los filamentos de miosina se encontrarán en el tope de sus respectivos carriles —muy próximos a los discos Z—, el sarcómero se verá casi imposibilitado de contraerse más. De aquí que la posición más favorable para que un músculo desarrolle su máxima potencia es cuando sus sarcómeros tienen una longitud inicial intermedia, en forma tal que permita el contacto de numerosas cabezas de miosina con los filamentos de actina, y que a la vez ofrezca a los filamentos de miosina un buen trecho para desplazarse. Esta relación entre el grado de estiramiento inicial y la potencia desarrollada por el músculo esquelético no se presenta en otra gran clase de tejido contráctil: el tipo de músculo que forma parte (de los vasos sanguíneos y de vísceras como el estómago y los intestinos, la vejiga urinaria y el útero. Las paredes de estos órganos pueden distenderse de manera considerable sin que disminuya su capacidad de contracción, de la que depende su función de promover o regular la transportación de los contenidos respectivos. Se dice, por lo tanto, que esta clase de músculos tiene la propiedad de plasticidad , y la razón de esta cualidad es estructural. Los filamentos de actina y miosina en las células de este tejido no se encuentran dispuestos de manera especialmente ordenada, como en el músculo esquelético. No hay en ellas series de aparatos unitarios equivalentes a los sarcómeros, y por consiguiente no muestran las estiraciones periódicas que caracterizan al músculo liso (Figura VI.13). La ventaja que significa la plasticidad del músculo liso se ha conseguido, sin embargo, a costa de la rapidez y precisión de trabajo que distinguen al músculo esquelético, pues los órganos de que forma parte, no obstante que en ocasiones son muy poderosos, como es el caso del útero, accionan con lentitud y sin una exacta coordinación espacio-temporal. 82 Figura VI. 13. Esquema de la organización de la miosina (m) y la actina (a) en una célula de músculo liso. En estas células los filamentos no se arreglan en forma de sarcómeros, sino que se distribuyen irregularmente en el citoplasma; n = nucleo. Una tercera categoría de músculo es la que constituye el corazón de los vertebrados. Este órgano excepcional, diseñado para funcionar sin interrupción durante toda la vida, posee atributos fisiológicos muy singulares. No obstante, desde el punto de vista de la organización de la máquinaria molecular que lo anima, es muy similar al músculo esquelético. Sus células son estriadas, puesto que los filamentos de actina y de miosina se encuentran dispuestos en forma de sarcómeros que se contraen de manera concertada y alternada entre diferentes regiones. Hasta aquí hemos revisado las principales maquinarias moleculares y los aparatos que integran para efectuar la gran mayoría de los movimientos que presenta la materia viviente. Estos mecanismos comprenden a las máquinas constituidas por actina y miosina, o bien a las que tienen como base la tubulina y sus motores asociados. Estos dos sistemas operan simultáneamente en muchas células, cada uno encargado de su propia función. Pero al menos en la mayoría de las células animales llega un momento crucial en el que ambos conjuntos deben de actuar de manera perfectamente coordinada. Esta acción, una de las más asombrosas que haya producido la evolución, es la que consigue reproducir la vida misma —la división celular. La descripción de los aparatos que intervienen en este fenómeno fundamental es el tema del siguiente capítulo. 83 V I I . S I S T E M A S M I X T O S : M O V I M I E N T O G E N E R A D O P O R M I C R O T Ú B U L O S Y M I C R O F I L A M E N T O S LA DIVISIÓN CELULAR LA DIVISIÓN celular se inicia con el proceso llamado mitosis, en el cual los cromosomas, duplicados, se separan y reparten en dos nuevos núcleos. La separación de los cromosomas es seguida por la división del resto del citoplasma o citocinesis. Cada célula hija tendrá entonces la información suficiente para crecer y dividirse, a fin de continuar el proceso de proliferación. Por muchos años los biólogos han estudiado la mitosis, describiendo desde hace más de 100 años las diferentes figuras producidas al interaccionar los cromosomas con estructuras fibrosas y formar lo que se llama el huso acromático o aparato mitótico (Figura VII. 1). Este huso, llamado así por su parecido a un huso de hilandera, cambia de longitud, grosor, etc., durante la mitosis, y es sobre sus fibras en donde los cromosomas parecen moverse para iniciar su segregación a lo que más tarde serán las células hijas. Aunque la descripción detallada de la mitosis se hizo hace muchos años, estas observaciones se limitaron a células fijadas, de modo que reflejaban momentos de lo que realmente es un proceso dinámico y continuo. Por otro lado, la caracterización bioquímica de las diversas estructuras participantes en el proceso se logró apenas recientemente, de modo que hasta la fecha todavía hay muchas incógnitas en relación con la mitosis. Figura VII. 1. Fotografía de los primeros aparatos mitóticos aislados por D. Mazia y K. Dan. Los ásteres, el huso y los cromosomas en la placa ecuatorial son claramente distinguibles. (Fotografía cortesía de D. Mazia). Si consideramos el huso acromático como una máquina que mueve a los cromosomas debemos estudiar cómo está la máquina ensamblada para entender su funcionamiento. Empezaremos por analizar esta estructura. El huso no es algo permanente en las 84 células. Se observa solamente durante la mitosis y se ensambla a partir de microtúbulos que a su vez, como vimos en capítulos anteriores, son polimerizados de las subunidades de tubulina. Una vez realizada la mitosis, los microtúbulos desaparecen para volverse a estructurar cuando la célula está lista para dividirse de nuevo. En algunas células, como las de un embrión, puede haber una división celular cada 10 ó 15 minutos. En otras, como las neuronas y los reticulocitos, que han llegado a un estado completamente diferenciado, no hay divisiones celulares (por lo menos en situaciones regulares, aunque experimentalmente éstas se logran inducir). En células en crecimiento activo la división celular se efectúa, aproximadamente, cada 24-48 horas y el proceso dura como una hora y media. Como se vio en capítulos previos, los microtúbulos están formados por las tubulinas (α y β) que al polimerizarse forman una estructura con polaridad, esto es, con extremos asimétricos en donde el ensamble y desensamble de subunidades procede con diferente cinética. Podríamos imaginar que un microtúbulo es una flecha formada a su vez por flechas pequeñas, todas alineadas con la punta orientada en la misma dirección y que por estas características muestra propiedades diferentes en las puntas de la flecha o en las colas. Se sabe actualmente que los microtúbulos del huso están orientados con el extremo que crece más aprisa, llamado positivo, hacia el lado contrario de donde está la estructura del huso llamada centrosoma (Figura VII. 2). Estas propiedades facilitan la interacción diferencial con otras moléculas que se asocian a los microtúbulos durante la mitosis, y que son capaces de transformar energía química en movimiento, así como facilitar tanto la polimerización-despolimerización de los microtúbulos como la unión de éstos a los cromosomas. 85 Figura VII. 2. Esquema del aparato mitótico. Las cabezas de flecha indican la dirección en la que crecen los microtúbulos, que tienen como centros organizadores a los ásteres. Los centrosomas son otro elemento importante del huso. Estos se forman al inicio de la mitosis a partir de un organelo formado por microtúbulos que existe permanentemente en la célula, que es el centriolo. Cuando una célula va a dividirse este centriolo se duplica, acción que se da, generalmente, cuando los cromosomas se están replicando (Figura. VII. 3), y cada uno de ellos se mueve en el citoplasma para colocarse en extremos opuestos, entre los cuales se formará el eje del huso acromático. Alrededor de los centriolos, que realmente son centros organizadores de microtúbulos, radian los microtúbulos del huso y aquellos que forman el centrosoma (Figura I.1). Figura VII. 3. Micrografía que muestra la organización de los microtúbulos en los centriolos en una célula del oviducto de rata. En el corte transversal (flecha) se puede apreciar el arreglo de éstos como nueve pares de tripletes. (Fotografía cortesía de E. Dirksen). Aunque los cromosomas no son propiamente parte del huso, cada cromátida (una de las dos partes que forma a un cromosoma mitótico) tiene una región enriquecida en proteínas que se conoce como el cinetocoro (Figura VII. 4). Esta región es el punto de contacto entre los microtúbulos del huso y los cromosomas, y lo que permite que cada cromátida se mueva por separado y se distribuya adecuadamente a los nuevos núcleos. 86 Figura VII.4. Micrografía que muestra los microtúbulos del huso cuando hacen contacto con la región del cinetocoro (cabezas de flecha) en los cromosomas.(Fotografía cortesía de J. Pickett-Heaps). Típicamente hay entre 15 y 35 microtúbulos uniendo a un cinetocoro con el centrosoma, aunque no todos los microtúbulos del huso llegan a los cinetocoros. Hay microtúbulos que se extienden de un centrosoma al otro y de los cuales depende la longitud del huso y otros más cortos que están interdigitados entre los microtúbulos más largos. Hace algunos años B. Nicklas, en la Universidad de Carolina del Norte, demostró que si se rompe la unión entre los microtúbulos y los cinetocoros, las cromátidas no pueden moverse, produciéndose una distribución anormal de los cromosomas. Estos experimentos hechos con un rayo láser, que rompe la unión microtúbulo- cinetocoro, demostraron también que el cinetocoro tiene polaridad y que su interacción con los microtúbulos de uno u otro centrosoma dependerá de su orientación. Esta especificidad garantiza que solamente una de las cromátidas se mueva hacia cada lado del huso, asegurando la distribución adecuada del material genético. ¿Cómo es entonces que estas estructuras logran el movimiento de los cromosomas? Tratemos de integrar datos nuevos en la descripción clásica de la mitosis (figuras VII. 5 y VII.6). Una vez que los cromosomas se han duplicado, cada uno de ellos se mantiene unido, formado por dos cromátidas. El centriolo se ha duplicado también al organizarse como centrosoma y dirige la polimerización de microtúbulos a su alrededor. Algunos de estos microtúbulos interaccionan con las cromátidas a través del 87 cintocoro. A esta etapa se le llama prometafase. El cromosoma que aun consiste de dos cromátidas, unido a uno o varios micrótúbulos, empieza a moverse hacia el centrosoma del cual provienen los microtúbulos con los que ha interaccionado. Esto se puede deber al acortamiento de los microtúbulos en la base o a la interacción de una proteína específica en el cinetocoro con el microtúbulo, que estaría inerte. El desplazamiento de un cromosoma duplicado hacia un extremo se interrumpe cuando microtúbulos provenientes del centrosoma situado en el extremo opuesto interaccionan con la otra cromátida y hay entonces una fuerza que tira en el otro sentido. Este tirar en direcciones opuestas mueve a los cromosomas a la zona ecuatorial del huso, dando por resultado la figura llamada metafase. Es determinante la colocación de los cromosomas en el ecuador, mediante su conexión con microtúbulos provenientes de los dos centrosomas, y la mitosis prosigue sólo hasta que esto se ha logrado. En este momento las cromátidas todavía están unidas entre sí y se desplazan hacia el centrosoma de donde provienen los microtúbulos, con los cuales interaccionan. Se ha propuesto que el desplazamiento de una cromátida hacia el centrosoma se hace por despolimerización de los microtúbulos en sitio de unión con el cinetocoro, el cual practicamente se iría deteniendo del extremo del túbulo que es cada vez más corto por la despolimerización progresiva en ese polo. La cromátida se acercaría al centrosoma dando como resultado el movimiento descrito en la anafase A. Figura VII. 5. Esquema de la mitosis. Por otro lado podría haber un componente con características elásticas, no descrito todavía, que se uniera al cinetocoro y moviera 88 a la cromátida, utilizando a los microtúbulos como las vías de un tren. Este movimiento se haría junto con la despolimerización los microtúbulos al nivel del cinetocoro. De hecho se ha demostrado la presencia de actina y miosina en el huso acromático, mediante el empleo de anticuerpos fluorescentes para visualizar a estas proteínas. Sin embargo, aún no es posible concluir si estas proteínas podrían ser los elementos elásticos en el movimiento de cromosomas. Figura VII. 6. Fotografías por microscopia de inmunofluorescencia en donde se aprecian las fases de la mitosis esquematizadas en la figura VII. 5. Los microtúbulos se ven decorados por un anticuerpo específico para tubulina, y los cromosomas se muestran marcados con un indicador también fluorescente que se une especificamente al ADN. a) Profase; b) placa ecuatorial en la metafase: c) anafase; d) telofase, en donde pueden verse los restos del cuerpo medio. (Fotografía cortesía de B. Brinkley). En la anafase B los microtúbulos del huso que no están unidos a cinetocoros crecen en su extremo positivo e interdigitan entre sí y se establecen puentes laterales que forman otras proteínas asociadas a ellos. A través de estos puentes los microtúbulos se repelen y se deslizan en direcciones contrarias, haciendo que el huso en su conjunto se alargue, coadyuvando a la separación de las cromátidas. Una de las proteínas identificadas como formadoras de puentes entre microtúbulos es la cinesina. Este movimiento de microtúbulos que resulta del alargamiento del huso puede hacerse en el laboratorio con husos aislados de varios tipos de células. A mediados de los ochenta W. Zacheus Cande y sus colegas de la Universidad de California, en Berkeley, aislaron husos acromáticos de células de algas diatomeas, en presencia de ATP (el generador de energía), e investigaron el movimiento de cromosomas en anafase. 89 Encontraron que el movimiento dependía de la fosforilación de proteínas unidas al huso y de la polimerización de los micrcotúbulos en su extremo positivo. Esta elongación de microtúbulos ocurre al mismo tiempo que el acortamiento de aquellos que directamente interaccionan con los cinetocoros. ¿Cómo es posible entonces tener procesos diferentes y antagónicos al mismo tiempo? Una posible explicación es que los dos tipos de microtúbulos están inmersos en diferentes microambientes. Los que interdigitan están realmente inmersos en la matriz citoplásmica, en donde pueden interaccionar con otras moléculas y estabilizarse, de modo que pueden crecer cuando esto sea necesario. Aquellos que interaccionan con los cinetocoros están, a su vez, interaccionando con otro ambiente y dependen de otros mecanismos de control. Se sabe que el calcio y las proteínas reguladoras de los niveles de Ca2+, como la calmodulina, tienen un papel importante en el proceso de mitosis. Se ha encontrado que las vesículas que almacenan calcio se concentran en las inmediaciones del huso acromático y que hay, asimismo, por lo menos dos enzimas con actividad hidrolítica sobre el ATP que son estimuladas por calcio. Finalmente, una vez que las cromátidas llegan al extremo en que está el centrosoma, durante la telofase, los microtúbulos que formaban el huso empiezan a despolimerizarse, quedando un remanente de túbulos en la parte central de la célula que conecta a los dos núcleos que ya han empezado a reestructurarse. La división del citoplasma o citocinesis, que dará como resultado dos células hijas, empieza en la telofase y se lleva a cabo por la estructuración de un anillo de constricción formado por filamentos de actina y miosina en la parte media de la célula en mitosis. Este anillo se forma a 90° del eje del huso acromático por polimerización de monómeros de actina. La acción contráctil de los filamentos de actina y miosina que se asocia a ellos constriñe al citoplasma y acaba por dividirlo (Figura VII. 7). El anillo contráctil es una pequeña máquina que requiere de ATP para hacer trabajo y puede estabilizarse y aislarse de las células. La formación y contracción del anillo puede impedirse con drogas, como las citocalasinas, que impiden la polimerización de la actina. 90 Figura VII.7. Células en citocinesis. A) Microscopia de contraste de fases; B) diagrama del anillo de constricción. M = microtúbulos, c = cromosomas, m= miosina, a= actina. La membrana nuclear, que en la mayoría de las células se desestructura en la prometafase, se reorganiza en la etapa final de la telofase, alrededor de los cromosomas, para formar el nuevo núcleo. En los eucariones inferiores es común que la mitosis se lleve a cabo sin que la membrana nuclear se altere y que el huso acromático se organice con los ásteres en el citoplasma y las fibras del huso atravesando la membrana nuclear. En estos casos la mitosis no es muy típica y las fases no están bien definidas, pero básicamente el proceso debe depender de factores similares a aquellos que se presentan en una mitosis típica. Se han podido contestar varias preguntas acerca de la mitosis, estudiando qué sucede cuando se altera el movimiento o la posición o formación de los centrosomas. En relación al primer caso se han utilizado drogas, como la colchicina, vinblastina y la griseofulvina. Estos alcaloides, al unirse al dímero de tubulina, impiden que se añada al extremo de los microtúbulos que están creciendo, de modo que se interrumpe el equilibrio dinámico de polimerización de los microtúbulos. Al añadir este tipo de drogas a células en proliferación se detiene el proceso de la mitosis en metafase, de modo que los cromosomas quedan colocados en la placa ecuatorial, de donde no pueden proseguir a la separación de las cromátidas. Otras drogas, como el taxol, estabilizan a los microtúbulos ya formados y éstos no pueden despolimerizarse de nuevo, rompiendo el equilibrio dinámico entre polímero- dímero y teniendo como resultado la detención del proceso de mitosis. La inestabilidad de los microtúbulos del aparato mitótico, requisito indispensable para el movimiento por otro lado, impidió por mucho tiempo que esta maquinita y sus componentes pudieran ser aislados y caracterizados. Fue en 1953 que D. Mazia y K. Dan aislaron los primeros aparatos mitóticos de huevos de erizos de mar que habían sido fertilizados in vitro. En estas células las mitosis son sincrónicas una vez que empieza la división celular que da origen al embrión. Estos investigadores pudieron aislar, en condiciones de estabilización de los microtúbulos, un gran número de aparatos mitóticos y hacer su caracterización bioquímica. Más tarde se estableció que los microtúbulos del aparato mitótico, como otros microtúbulos citoplásmicos, están formados por las tubulinas α y β. En el grupo de investigación del doctor Mazia se caracterizaron inicialmente a las tubulinas que forman a éstos y otros tipos de microtúbulos y se hicieron los experimentos que mostraron que el centriolo es el organizador de los centrosomas y de los microtúbulos que radian a partir de estas estructuras. Experimentalmente se pudo inducir la formación de múltiples ásteres, fertilizando a los huevos de erizo de mar con varios espermatozoides, cada uno de los cuales penetra al huevo con un centriolo, capaz de organizar un áster y producir así un gran número de aparatos mitóticos (Figura VII.8). Estas células no pueden continuar la mitosis por el caos que se produce al haber tantos centros directrices del mismo proceso. 91 Figura VII.8. Múltiples ásteres en un huevo de erizo de mar producidos por la fertilización con varios espermatozoides (polisperma). Los microtúbulos que se originan de cada áster se identificaron al ser decorados por un anticuerpo específico para tubulina. (Fotografía cortesía de G. y H. Schatten). Recientemente se han identificado varias proteínas que podrían actuar como motores moviendo a los cromosomas sobre los microtúbulos y que parecerían tener un papel similar a la proteína cinesina mencionada en otro capítulo como un motor celular. Esta proteína permite que los microtúbulos se desplacen unos en relación con otros y muevan gránulos de pigmento o vesículas a lo largo de una célula. El desplazamiento de los microtúbulos en el huso acromático se puede llevar a cabo en formá similar (Figura VII. 9). El arreglo de los microtúbulos en forma de huso, su regreso a microtúbulos dispersos en la interfase, la reorganización de la membrana nuclear durante la mitosis, la condensación y descondensación de los cromosomas y la formación del anillo de constricción, son todos procesos controlados por acciones de fosforilación de varias de las proteínas que forman estas estructuras o que ayudan al movimiento. 92 Figura VII.9. Esquema de la interacción de los microtúbulos con motores moleculares (cinesina) para mover a los cromosomas. Estas fosforilaciones se hacen por enzimas llamadas cinasas, la mayoría de las cuales son reguladas por los niveles de Ca2+ en el citoplasma y los cuales veremos que también regulan el grado de organización del citoesqueleto al asociarse a sus componentes e inducir su polimerización o despolimerización. Sin duda, aunque hay muchos elementos por identificar para entender completamente el proceso de la mitosis, los nuevos avances que pueden hacerse con la técnica de videomicroscopía, que permite observar el proceso dinámico, nos darán pronto una respuesta completa. 93 V I I I . O P E R A C I Ó N D E L A M A Q U I N A R I A : R E G U L A C I Ó N C E L U L A R CUANDO las células llevan a cabo actividades de motilidad, un requisito indispensable es la capacidad de movilizar iones de Ca2+ (Figura VIII.1). Como vimos en otros capítulos, para la contracción muscular se requiere la movilización del Ca2+ de reservorios especiales al citoplasma. La presencia del Ca2+ y su asociación a proteínas, como las troponinas, induce varios cambios en la conformación de las proteínas del sarcómero, favoreciendo la fosforilación de la miosina y su interacción con la actina. En el caso de células no musculares, el Ca2+ sale también de reservorios especiales (vesículas generalmente) hacia el citoplasma, en donde activa a otras proteínas que al unir una o más moléculas de calcio cambian su conformación y pueden interaccionar a su vez con otras proteínas para que éstas funcionen. Este es el caso de la gelsolina, que se analizó en relación con el movimiento amiboideo, y la interacción de calmodulina con microtúbulos y otras proteínas en la mitosis. Muchas proteínas del citoesqueleto son fosforiladas por enzimas llamadas cinasas. Cuando esto sucede su estructura se modifica, al igual que sus relaciones con otras proteínas, dando como resultado la reorganización de los componentes del citoesqueleto, según las necesidades de la célula. La desfosforilación se lleva a cabo por otras proteínas presentes en todas las células, llamadas fosfatasas. Estas enzimas se encargan de remover el o los grupos fosfatos añadidos por las cinasas. Como ejemplos de movimientos celulares en los que la fosforilación y desfosforilación de proteínas es uno de los mecanismos de control tenemos a la fagocitosis, la desorganización de la envoltura nuclear y la condensación de la cromatina que ocurren durante la mitosis, la exocitosis de varios tipos de vesículas, la ciclosis, la formación de contactos focales sobre el sustrato para facilitar el desplazamiento de las células y otros movimientos que describiremos brevemente a continuación. Figura VIII.1. Modificaciones del Ca2+ intracelular durante diferentes tipos de movimiento. Los números denotan unidades de tiempo. 94 El desplazamiento dirigido de una célula puede ser favorecido por la presencia de estímulos químicos que se encuentran solubles en el medio o que forman la parte sólida del sustrato sobre el que se mueve la célula. Este fenómeno se conoce como quimiotaxis y está bien estudiado en las bacterias que se desplazan hacia el atrayente por rotación de su o sus flagelos. Los flagelos bacterianos están constituidos por una proteína diferente de las tubulinas pero que también puede polimerizarse y despolimerizarse. Las bacterias tienen receptores membranales que reciben la señal quimio atrayente y pasan señales al interior de la célula. La señal llega entonces al motor que mueve al o los flagelos y se produce un cambio en la dirección de la rotación que permite a la bacteria dirigirse hacia el estímulo. Un primer paso en la activación de señales es la fosforización de una proteína cinasa que depende de ATP. Esta proteína puede entonces fosforilar a otras que, ya modificadas, intervienen con el motor flagelar y producen la rotación del flagelo. Cabe aclarar que no pueden rotar las mutantes bacterianas que carecen de esta proteína. Al desfosforilarse la proteína se revierte el proceso y el flagelo rota en la dirección contraria, causando un cambio en la dirección del movimiento. Un caso bien estudiado en las células eucariontes es el de los leucocitos que son atraídos hacia un sitio de infección, y que al ser activados modifican su forma y su velocidad de movimiento (Figura VIII.2). Las amibas de Dictyostelium reaccionan en forma similar al estímulo producido por AMP cíclico. Una vez cerca del estímulo las amibas se agregan y empiezan a formar un sincicio, de donde se diferenciarán las células sexuales. En estos casos, como en el de las bacterias, la fosforilación de las proteínas, como respuesta al estímulo, es el efecto inicial a partir del cual se dan los cambios de la motilidad. Figura VIII.2. Quimiotaxis. Un caso particular es la estimulación de la locomoción y la secreción de proteasas, que en varias células son producidas por las proteínas de la matriz extracelular, como la fibronectina, la laminina y la colágena. El reconocimiento del estímulo se hace cuando la célula, a través de una molécula proteica de su superficie (receptor), reconoce a la molécula que es el estimulador (ligando). Cuando esto 95 sucede, el receptor y el ligando unidos causan una cascada de cambios en la organización de la membraña celular que son interpretados como señales para que en el interior de la célula haya cambios a muchos niveles. Tal vez el más notable, en el tema que nos interesa en este libro, es la reorganización del citoesqueleto que tiene consecuencias en la forma de la célula, en su capacidad de desplazarse, en la velocidad con que se desplaza y en actividades metabólicas que le permiten secretar enzimas al exterior, fagocitar e incluso dividirse (Figura VIII.3). Figura VIII.3. Reorganización del citoesqueleto en una célula que corresponde a una señal externa a través de un receptor en la membrana celular. Los fenómenos de motilidad son muy diversos y algunas células presentan una organización especial del citoesqueleto que le permite movimientos a veces espectaculares. Esto es particularmente notable en los organismos unicelulares que se han tenido que adaptar a todos los medios, desarrollando estructuras que les permiten sobrevivir en condiciones adversas e incluso invadir a otras células como parásitos. Como es imposible hacer una revisión completa de todas las modalidades, nos hemos concentrado en ilustrar las bases generales de la organización molecular y estructural del citoesqueleto, en una célula, y considerando el movimiento individual. Desde luego, en muchos casos, el propósito de estos movimientos se hace en el contexto de 96 un órgano o un organismo completo, formado por muchas células y actuando en concierto. El movimiento es, entonces, el resultado de la actividad del citoesqueleto de cada una de las células que forman un organismo, y sus diversas manifestaciones dependerán de la información genética de aquél y de la posibilidad de expresión de ciertos genes. La información genética se transforma, como hemos visto en este libro, en estructuras físicas con capacidad mecánica y fuerza motora de las que dependen todos los movimientos de la maquinaria celular. 97 C O N T R A P O R T A D A El movimiento es uno de los fenómenos que más han llamado la atención de quienes se han dedicado a observar y estudiar la naturaleza. Un atleta es una máquina en movimiento, pero también lo es un organismo unicelular microscópico, por ejemplo una amiba. ¿Cómo, entonces, se organizan una célula o un conjunto de células para producir movimiento? En su interior diminutas máquinas constituidas por motores moleculares funcionan de manera coordinada para actuar sobre otras extructuras y el medio externo. En este libro se describe cómo se fabrican las diferentes partes de dicha maquinaria a partir de instrucciones contenidas en el material genético cómo se ensamblan luego estas partes para formar máquinas individuales alimentadas por energía metabólica y cómo se integran multitudes de estas máquinas en aparatos y sistemas dinámicos bajo el control de señales específicas. El lector encontrará una exposición compacta de las solucies alcanzadas por la evolución para producir numerosas variedades de trabajo mecánico mediante la aplicación de un limitado repertorio de principios operativos de mil maneras por los más antiguos dispositivos para producir movimiento: las máquinas vivientes. Isaura Meza obtuvo su doctorado en la Universidad de California, en Berkeley, bajo la asesoría de Daniel Mazia. Es profesora titular del Departamento de Biología el cual dirigió varios años. Sus trabajos acerca de los aspectos bioquímicos y moleculares del citoesqueleto y de la motilidad celular ha recibido varios reconocimientos. Actualmente es tesorera de la Academia de Investigación Científica. Eugenio Frixione obtuvo su doctorado en neurociencias en el CINVESTAV. Tras de dos años en la Universidad de Pennsylvania regresó al CINVESTAV donde es profesor titular en el Departamento de Biología Celular y en el Departamento de Fisiologia, Biofísica y Neurociencias. Sus numerosos trabajos incluyen enfoques novedosos para el análisis de la motilidad celular. Fue director editorial de la revista Ciencia y Desarrollo que publica el CONACYT, y en la que hasta la fecha cola bora como editor. Diseño: Guillermo Huerta González / Foto: Cortesía de B.R. Brinkley