quimica - Ramonnet
Anuncio
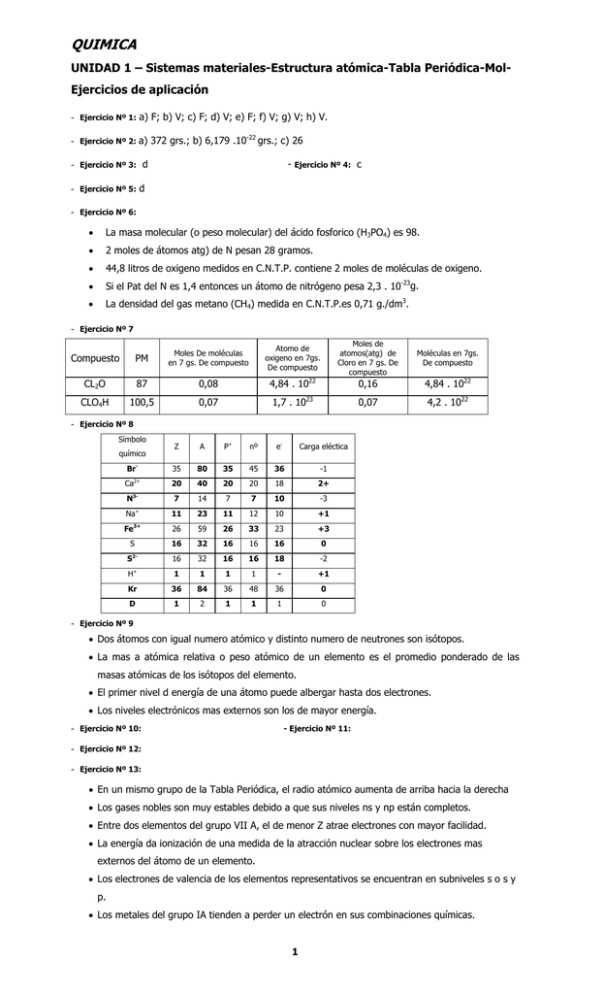
QUIMICA UNIDAD 1 – Sistemas materiales-Estructura atómica-Tabla Periódica-MolEjercicios de aplicación - Ejercicio Nº 1: a) F; b) V; c) F; d) V; e) F; f) V; g) V; h) V. - Ejercicio Nº 2: a) 372 grs.; b) 6,179 .10-22 grs.; c) 26 - Ejercicio Nº 3: - Ejercicio Nº 5: - Ejercicio Nº 6: - d - Ejercicio Nº 4: d • La masa molecular (o peso molecular) del ácido fosforico (H3PO4) es 98. • 2 moles de átomos atg) de N pesan 28 gramos. • 44,8 litros de oxigeno medidos en C.N.T.P. contiene 2 moles de moléculas de oxigeno. • Si el Pat del N es 1,4 entonces un átomo de nitrógeno pesa 2,3 . 10-23g. • La densidad del gas metano (CH4) medida en C.N.T.P.es 0,71 g./dm3. Ejercicio Nº 7 Atomo de oxigeno en 7gs. De compuesto Compuesto PM Moles De moléculas en 7 gs. De compuesto CL2O 87 0,08 4,84 . 1022 CLO4H 100,5 0,07 1,7 . 1023 - Moles de atomos(atg) de Cloro en 7 gs. De compuesto Moléculas en 7gs. De compuesto 0,16 4,84 . 1022 0,07 4,2 . 1022 Ejercicio Nº 8 Símbolo químico BrCa 2+ 3- N Z A P+ nº e- Carga eléctica 35 80 35 45 36 -1 20 40 20 20 18 2+ 7 14 7 7 10 -3 Na+ 11 23 11 12 10 +1 Fe3+ 26 59 26 33 23 +3 S 16 32 16 16 16 0 2- 16 32 16 16 18 -2 + 1 1 1 1 - +1 Kr 36 84 36 48 36 0 D 1 2 1 1 1 0 S H - c Ejercicio Nº 9 • Dos átomos con igual numero atómico y distinto numero de neutrones son isótopos. • La mas a atómica relativa o peso atómico de un elemento es el promedio ponderado de las masas atómicas de los isótopos del elemento. • El primer nivel d energía de una átomo puede albergar hasta dos electrones. • Los niveles electrónicos mas externos son los de mayor energía. - Ejercicio Nº 10: - Ejercicio Nº 12: - Ejercicio Nº 13: - Ejercicio Nº 11: • En un mismo grupo de la Tabla Periódica, el radio atómico aumenta de arriba hacia la derecha • Los gases nobles son muy estables debido a que sus niveles ns y np están completos. • Entre dos elementos del grupo VII A, el de menor Z atrae electrones con mayor facilidad. • La energía da ionización de una medida de la atracción nuclear sobre los electrones mas externos del átomo de un elemento. • Los electrones de valencia de los elementos representativos se encuentran en subniveles s o s y p. • Los metales del grupo IA tienden a perder un electrón en sus combinaciones químicas. 1 • La electronegatividad de un elemento es un valor relacionado con la capacidad de sus átomos para atraer los electrones en sus uniones químicas. - a) 2,2 . 10-3 moles ; 1,3 . 1021 moléculas.; b) 8,8 . 10-3 atg,; 5,3 . 1021 átomos y 0,49 Ejercicio Nº 14: grs. de Fe. Ejercicio Nº 15: Elemento X= S y elemento Y= O Ejercicios de autocomprobación - Ejercicio Nº 1: a) V; b) F; c) V; d) V; e) F; f) F; g) V; h) V; i) F; j) V; k) F; l) F - Ejercicio Nº 2: a) 143; b) 143 grs.; c) 7 átomos de C. - Ejercicio Nº 3: c - Ejercicio Nº 4: e - Ejercicio Nº 5: d - Ejercicio Nº 6: c - Ejercicio Nº 7: c - Ejercicio Nº 8: - - Compuesto PM P2O5 H3PO3 142 82 Moles de moléculas de 16 grs de compuesto 0,11 0,20 Átomos de oxigeno en 16 grs de compuesto 3,39 . 1023 3,52 . 1023 Moles de átomos (atg) de fósforo en 16 grs de compuesto 0,22 0,20 Moléculas en 16 grs de compuesto 6,78 . 1022 1,17 . 1023 Ejercicio Nº 9: II- 18 IV- 40 p+ y 40 e- III- A, G, C IVI- 1s22s22p63s23p64s1 IIII- A y L IVII- IIA, periodo 4 IIV- E IVIII- E Ejercicio Nº 10 a) He.: Helio f) b) Br.: Bromo g) Ej.: Nd Neodimio c) Ba.: Bario h) Ni Niquel d) Ej.: P fósforo i) Fluor Ej.: N, P, As, etc. e) Ej.: Ga Galio; Si Silicio; As Arsenico; etc. - Ejercicio Nº 11: a) Átomo neutro del grupo IVA y Átomo neutro de Z= 16 b) Es un metal; pertenece al grupo IIA; las opciones b) y d) son correctas. - Ejercicio Nº 12: - Ejercicio Nº 14: d Ejercicio Nº 13: a a) O-, Ne y Al3+; Cl- y S; Li+ y He. b) Al y Li metales; O, Cl y S no metales; Ne y He gases nobles. UNIDAD 2 – Uniones químicas Ejercicios de aplicación - Ejercicio Nº 1: VII I IA 1 A 2 B 3 4 5 6 7 III A E IIA C D Z F W III B IVB VB VIB I VII B H VII I IB IIB IVA U Ejercicio Nº 2: Ejercicio Nº 3: - Ejercicio Nº 4: Ejercicio Nº 5: - Ejercicio Nº 6: Ejercicio Nº 7: - Ejercicio Nº 8: Ejercicio Nº 9: 2 c Q K N R G S VIA M Ñ O - J VII A L VA Ejercicios de autocomprobación - Ejercicio Nº 1: - Ejercicio Nº 2: a a) D: grupo VIA; M: Gas noble; T: grupo IA b) Iônico c) Covalente - Ejercicio Nº 3: d Ejercicio Nº 4: I) b)II) a) - Ejercicio Nº 5: d Ejercicio Nº 6: c - Ejercicio Nº 7: a), d), e) y f) iónicos; b),c),g) y h) covalentes - Ejercicio Nº 8: a) I) covalente polar; II) iónico; III) covalente no polar; IV) covalente polar; V) covalente polar; VI) iónico. b) c) I)tetraedrica, no polar; III) lineal, no polar; IV) lineal, polar y V) angular polar. d) I) fuerza de London, II) y VI) cargas elctricas, ferzas de Coulomb, III) fuerzas de London, IV) puente de hidrogeno y V) puente de hidrogeno. - Ejercicio Nº 9: a) Fe: 70%; O: 30% b) Ca: 17,09%; P: 26,50%; O: 54,70%;H: 1,71% c) Al: 8,11%; S: 14,41%; O: 72,07%; H: 5,41% - Ejercicio Nº 10: PtCl4 - Ejercicio Nº 11: Fórmula mínima: C12N2O3H17 Fórmula molecular: C32N4O6H34 - Ejercicio Nº 12: - Ejercicio Nº 13: b I) a) (+6); b) (+4); c) (-2); d) (+6); e) (0) II) a) (0); b) (-2); c) (-1); d) (-2); e) (-1) III)a) (+1); b) (0); c) (-1); d) (+1); e) (+1) - Ejercicio Nº 14: a) CO2 f) Fe(OH)3 b) O2 g) CaCl2 c) NH3 h) Al2S3 d) H3PO4; o HPO3; o H4P2O7 i) NaH e) H3PO3; o HPO2; o H4P2O5 j) KMnO UNIDAD 3 – Nomenclatura-Reacciones químicas-Estequiometría Ejercicios de aplicación - Ejercicio Nº 1: Fórmula Al2O3 Nombre Nombre alternativo Tipo de óxido Oxido cuproso Tritóxido de dihierro Oxido de plomo(IV) K2O SO3 Oxido fosfórico CO2 Oxido de nitrógeno CL2O - Ejercicio Nº 2: - Ejercicio Nº 4: Ejercicio Nº 3: Fórmula NH3 KCLO4 Nombre Números de oxidación Hidruro de calcio Bromato(V) de hidrogeno CuL2 KMnO4 HCN Sulfuro de mercurio(II) 2 b - Ejercicio Nº 5: Ejercicio Nº 6: - Ejercicio Nº 7: c Ejercicio Nº 8: - Ejercicio Nº 9: b Ejercicio Nº 10: - Ejercicio Nº 11: a) a b) c a) NH4Cl(ac) → NH3 + HCl(ac) b) 2 Fe(s) + 6 HCl(ac) → 2 FeCl3(ac)+ 3 H2(g) Reacción de oxido reducción. c) HNO2(ac) + KOH(ac) → KNO2(ac)+ H2O(l) d) Pb(s) + PbO2(ac) + 2 SO4 H2(ac) → 2 PbSO4(ac) + 2 H2O Reacción de oxido reducción. e) 4 Cl2(g) + NH3 (g) + 9 KOH → 8 KCl(ac) + 6 H2O Reacción de oxido reducción. - Ejercicio Nº 12: d III) d II) c IV) a I) - 1 2 3 4 - Ejercicio Nº 13: Reactivos colocados A B 2 moles Exceso 6 moles 5 moles 90 gs. 105 gs. 2,4 moles 2 moles Ejercicio Nº 14: Producto obtenido (moles de C) 0,67 4 0,6 2 moles(80% pureza) Rendimiento de reacción % 50 100 75 100 Reactivo limitante A A B A a Ejercicios de autocomprobación - Ejercicio Nº 1: I) a) Q+3 II) a) T-2 b) Q2O3 ; Q(OH)3 b) TH2 c) S3Q2 ; PO4Q ; Br3Q - c) TO3H2 ; TO4H2 Ejercicio Nº 2: I) CO; Hg2O; N2O3; Cl2O7; Pb(OH)2; SO3H2; (SO4)Fe2; (NO3)2Ca; NaH2PO4; H2O2; CNK; Cu+; (ClO2)-; Li2S. II) Oxido de carbono II; oxido de mercúrio I o monóxido de dimercurio; trióxido de dinitrógeno u oxido de nitrogeno (III); oxido perclórico u óxido de cloro (VII); hidróxido de plomo II; acido sulfuroso; sulfato (VI) de hierro (III); nitrato (III) de cálcio; dihidrógeno fosfato (V) de sódio; água oxigenada (nombre comercial); cianuro de potasio; ión cobre (II); íon clorato (III). - Ejercicio Nº 3: a) Iodato de magnesio. g) Oxido de fosfato III. b) Fluoruro de hidrógeno. h) Dicromato de potasio. c) Fosfato de calico. i) Ión amonio d) Hidruro de calico. j) Ión carbonato e) Acido cloroso k) Ión fosfato ácido. f) l) Hidróxido de plomo IV. Sulfito ferroso. m) Cloruro de aluminio. - Ejercicio Nº 4: a) BaO + H2O → Ba(OH)2 oxido de barrio + agua → Hidróxido de barrio. b) K2o + H2O → 2K(OH) oxido de potasio + água → Hidróxido de potasio c) Fe2O3 + 3 H2O trióxido de dihierro(óxido férrico u óxido de hierro(III) + água → hidróxido férrico o hiróxido de hierro (III) d) CO2 + H2O dioxido de carbono (óxido carbónico) + agua → ácido carbónico (carbonato de hidrogeno) e) Cl2O7 + H2O óxido perclórico (heptóxido de dicloro u óxido de cloro (VII)) + água → ácido perclórico o clorato (VII) de hidrogeno. 2 f) F2 + H2 flúor + hidrógeno → ácido fluorhídrico o fluoruro de hidrógeno g) Na(OH) + NO2H → hidróxido de sodio + ácido nitroso (nitrato (III) de hidrogeno) → nitrito de sódio (nitrato(III)) de sódio + agua h) Mg (OH)2 + H2CO3 → hidróxido de magnesio + ácido carbônico → carbonato de magnésio + agua. i) - - K(OH) + H2SO4 hidróxido d e potasio + ácido sulfúrico (sulfato (IV)de hidrogeno) → sulfato ácido de potasio + agua. Ejercicio Nº 5: • En las sales la unión entre el catión y el anión es de tipo iónico. • La mayoría de los hidróxidos, ácidos y sales se disocian (o ionizan) en solución acuosa. • Todos los oxoácidos son compuestos ternarios. Ejercicio Nº 6: I) c); II) e); III) c); IV) b); V) c); VI) a) - Ejercicio Nº 7: - Ejercicio Nº 8: b) I) a) Aluminio + sulfato cúprico → sulfato de aluminio + cobre. b) ácido clórico + ácido clorhídrico → cloro + água. c) ácido bromhídrico + ácido sulfúrico → bromo + dióxido de azufre + agua. d) bromo + hidóxido de potasio → bromuro de potasio + bromato de potasio + agua II) a) oxidación 2(Al → Al3+ + 3 e-) reduccion 3(Cu+2 + 2e- → Cu) Ec. Iónica balanceada: 2 Al + 3 Cu+2 → 2 Al+3 + 3 Cu Ec. Molecular balanceada: 2 Al(s) + 3 CuSO4 (ac) → Al2(SO4)3 (ac) + 3 Cu Agente oxidante : Cu SO4 b) oxidacion (ac) Agente reductor: Al(s) 2 ClO-3 + 12 H+ + 10+e- → Cl2 + 6 H2O 5 (2 Cl- → Cl2 + 2 e-) reducción Ec. Iónica balanceada 2 ClO3- + 12 H+ + 10 Cl + 6 H2O 2 HClO3 + 10 HCl → 6 Cl2 + 6H2O Ec. Molecular balanceada HClO3 + 5 HCl → 3Cl2 + 3H2O Agente oxidante: HClO3 c) oxidacion Agente reductor: HCl 2 Br- → Br2 + 2 eSO4-2 + 4H+ + 2e- → SO2 + 2H2O reducción Ec. Iónica balanceada 2 Br- + SO4-2 + 4H+ → Br2 + 2H2O Ec. Molecular balanceada 2 HBr(ac) + H2SO4 (ac) → Br2(l) + SO2(g) + Agente oxidante: H2SO4 d) oxidacion 2H2O(l) Agente reductor: HBr(ac) Br2 + 12 (OH)- → 2BrO3- + 6H2O + 10 e5 (Br2 + 2e- → 2Br-) reducción Ec. Iónica balanceada 6 Br2 + 12(OH)- → 2Br2 + 6H2O + 10Br- 6 Br2 + 12 K(OH) → 10 KBr + 2 KBrO3 + 6H2O Ec. Molecular balanceada 3Br2(l) + 6K(OH)(ac) → 5KBr(ac) + KBrO3 + 3H2O(l) Agente oxidante: Br2 - Ejercicio Nº 9: - Ejercicio Nº 10: Agente reductor: Br(2) b) a) 2HCl + Zn → ZnCl2 + H2 c) 0,91 grs. b) 0,54 grs. - Ejercicio Nº 11: a) - Ejercicio Nº 12: 95,2 grs. - Ejercicio Nº 13: 66% - Ejercicio Nº 14: b) - Ejercicio Nº 15: b) - Ejercicio Nº 16: 2 - a) 0,75 moles c) 13 grs. b) 80% d) 0,495 moles Ejercicio Nº 17: a) Cu + 2H2SO4 → CuSO4 + SO2 + 2H2O c) 3 moles b) 28,56 litros d) 0,5 moles, 31,75 grs. UNIDAD 4 – Soluciones Ejercicios de aplicación - Ejercicio Nº 1: • Una solución es una mezcla homogénea fraccionable formada por dos o mas sustancias puras que no reaccionan entre si. • La denominación de los componentes de una solución como solvente y soluto, tienen que ver con la cantidad relativa de dichos componentes en la mezcla. • A determinada temperatura, la solubilidad de un soluto depende de la naturaleza del disolvente. • El estado de agregación de la solución siempre coincide con el estado de agregación del solvente. • Cuando dos sustancias líquidas se mezclan para formar una solución, se dicen que son miscibles. - Ejercicio Nº 2: - Ejercicio Nº 3: I) a) - II) c) Ejercicio Nº 4: I) c) III) a) II) b) - Ejercicio Nº 5: a) • La masa de soluti en I es mayor que en II. • La concentración de la solución I es menor que en la II. b) 1,94 M = 1,94 N d) - Ejercicio Nº 6: - Ejercicio Nº 8: I) c) Ejercicio Nº 9: - Ejercicio Nº 11: b) a) - Ejercicio Nº 10: b) b) Ejercicio Nº 12: a) 39,2 grs. 0,4 moles 0,8 grs b) 39,2 grs. 0,4 moles 0,8 grs c) 2 N 1M II) d) II) c) Ejercicio Nº 13: I) c) - Ejercicio Nº 14: - Ejercicio Nº 15: I) - b) II) b) - - Ejercicio Nº 7: Ejercicio Nº 8: b) b) 125 ml. Sc. 0,6 M Ejercicios de autocomprobación - Ejercicio Nº 1: a) 1 e) 2 b) 2 f) c) 6 g) 2 d) 2 (ioniz.total) o 1 (ioniz. Parcial) h) 3 1 1 - Ejercicio Nº 2: a) 49 grs. b) 98 grs. - Ejercicio Nº 3: - Ejercicio Nº 4: - c) 32,7 grs 6,3 grs. a) 2; 196 d) 1,1; 106,5 b) 3,7; 360,6 e) 0,8; 78,4 c) 2; 196 f) 0,4; 39,2 Ejercicio Nº 5: a) NaCl: 0,06 M, NaHCO3; : 0,03 M; KCl: 0,02 M; glucosa: 0,11 M b) En cada toma: 22,5 meq. Na+, 0,52 g; por dia; 90 meq.Na+, 2,07 g.Na+ c) Se evaporo el solvente, água. Los gramos de Na+no varían; NaCl 0,12 M, Na HCO3 0,06 M., KCl 0,4 M, glucosa 0,22 M. - - Ejercicio Nº 6: I) c) III)a) II) c)p/p IV) b) Ejercicio Nº 7: a) 1,16 grs/ml c) % p/p no varía entonces la densidad b) 17,4% p/p - no varía. Ejercicio Nº 8: a) 0,0456 grs et/ml sangre - Ejercicio Nº 9: - Ejercicio Nº 10: b) Si, concentración etanol > Valor normal 3,46% p/v; 3,35% p/p a) 14,4 ml - Ejercicio Nº 11: - Ejercicio Nº 12: b) 1,92 m 10,5% p/p a) 301,54 gs. c) 44,4 gs b) 40 gs. - Ejercicio Nº 13: 1,7 M; 9,26% p/p - Ejercicio Nº 14: 0,005 M (5 mM); 0,005 N - Ejercicio Nº 15: a) - Ejercicio Nº 17: Ejercicio Nº 16: b) 0,5 litros y 1,5 litros. UNIDAD 5 – Química orgánica Ejercicios de aplicación - Ejercicio Nº 1: • La fórmula general de los alcanos es CnH2n+2. Dos o más compuestos orgánicos diferentes pueden tener la misma fórmula molecular. Los radicales orgánicos alquilo y arilo son agrupaciones atómicas derivadas de hidrocarburos, que poseen un electrón desapareado en su estructura. - Ejercicio Nº 2: - Ejercicio Nº 4: Ejercicio Nº 3: a) 40% C; 4,5% H; 54,6% O c) C3H4O3 b) C6H8O6 d) 10 moles - Ejercicio Nº 5: - Ejercicio Nº 6: b I) II) 1. Los alcanos A y B son isómeros de cadena. 2. Los compuestos D y F presentan isomería geométrica. 1 3. los compuestos C y F son isómeros de posición. 4. Los compuestos D y E son isómeros de cadena. 5. La fórmula estructural del isómero de cadena lineal de a) es hexano. 6. El compuesto G presenta un carbono asimétrico 7. La fórmula mínima de B es C3H7. - Ejercicio Nº 7: - Ejercicio Nº 8: I) b) III)a) II) a) IV) c) - Ejercicio Nº 9: - Ejercicio Nº 10: - Ejercicio Nº 11: - Ejercicio Nº 12: - Ejercicio Nº 13: - Ejercicio Nº 14: - Ejercicio Nº 15: 2 - Ejercicio Nº 16: • Son polihidroxialdehídos o polihidrixicetonas llamados hexonas. • Son óticamente activos porque tienen al menos un carbono asimetrico y no poseen plano de simetría. • En todos, el C3 tiene l grupo oxhidrilo a la izquierda. • A, B y C son aldohexosas y D es una cetohexosa. • La fórmula A corresponde a la glucosa. • A y D son isómeros de función. • La unión glicosídica es la unión entreun grupo oxhidrilo(llamado hemiacetálico) de cualquiera de estos compuestos y un grupo de otro con pérdida de una molécula de agua. • La hidrólisis ácida del polisacáido celulosa origina sólo el monosacárido A. Ejercicios de autocomprobación - Ejercicio Nº 1: a) 3-octeno; alqueno; no saturado o insaturado; de acdena lineal. b) 4-etil-2,4-dimetilheptano;alcano; saturado; de cadena ramificada. c) 3-propilciclopenteno;cicloalqueno (hidrocarbiro alicíclico); no saturado; cíclico. d) 3-cloropropino;alquino; no saturado; cadena lineal. - Ejercicio Nº 2: - Ejercicio Nº 4: - Ejercicio Nº 5: Ejercicio Nº 3: d a) H3CC(CH3)=CHCH3 + H2 b) 16 litros c) 144 gramos - Ejercicio Nº 6: - Ejercicio Nº 7: d catalizador H3CHC(CH3)CH2-CH3 (metilbutano) 1-penteno a) A: 4-metil-2-pentanol, alcohol (secundario), nro. Oxid.= 0 B: metilpropanal, aldheído, nro.oxid.= +1 C: 3-pentanona, vetona, nro. Oxid.= +2 D: ácido metanoico (ác. Fórmico), ácido carboxílico, nro. Oxid.= +2 E: metil-2-propanol, alcohol (terciario), nro. oxid.= +1 F: metoxifenilo, éter G: propanamida, amida H: ac. 2-aminopentanodioico, aminoácido b) CH3-CH= CH(CH3)-CH2-CH3 + H2O adicion Markownikof A 3-metil -1-penteno CH3-(CH3)C= CH2 + H2O adicion Markownikof c) CH3-CH2-CH(OH)-CH2-CH3 + oxidante suave → C 2 E 3-pentanol + oxidante fuerte → D ó H3C-OH d) metanol H3C-OH + oxidante suave → H2COH + oxidante suave → D metanol metanal - HCOOH + NaOH → HCOO + Na+ + H2O e) metanoato de sódio - Ejercicio Nº 8: a) A: NOCH2-CH2-CH(CH3)-CH3 alcohol (primario) -OH B: CH3-CO-CH2-CH(CH3)-CH2-CH3 cetona -CO- C: CH3-C(CH3)2-C(CH3)2-COH aldehido -CHO- D: CH3-CH(OH)HC=CH-CH2-CH3 alcohol (insaturado) –OH- E: (CH3)2CH-NH2 amina -NH2 F: CH3-CH(NH2)-CH2-COOH aminoacido (β-aminoácido) -COOH (grupo funcional principal) y NH2 G: b) CH3-C(CH3)2-C(CH3)2-COH + H2 → CH3-C(CH3)2-C(CH3)2-CH2OH tetrametilbutanol CH3-CO-CH2-CH(CH3)-CH2-CH3 + H2 → CH3-CH-(OH)-CH2-CH(CH3)-CH2-CH3 4-metil-2-hexanol - Ejercicio Nº 9: a) Isómero de cadena: HOCH2-(CH2)3-CH3 1-pentanol Isómero de posición: CH3-HC-(OH)-HC(CH3)-CH3 3-metil-2-butanol b) Isómero de función de B: OHC-(CH2)2-HC-(CH3)-CH2-CH3 Isómero de función de G: (C6H5)-CH2-CH2-COOH ácido 3-fenilpropanoico c) Sólo D d) B: CH3-CO-CH2-CH(CH3)-CH2-CH3 C asimétrico: C3 D: CH3-CH(OH)-HC=CH-CH2-CH3 F: CH3-CH-(NH2)-CH2-COOH - Ejercicio Nº 10: - Ejercicio Nº 11: C asimétrico: C2 C asimétrico: C3 c Dihidroxicetona: CH2(OH)CO-CH2(OH) cetona Gliceraldehído: 2,3-dihidroxipropanal aldehído Fenoló hidroxibenceno Glocerol: CH2(OH)-CH(OH)-CH2(OH) Parabeno: Ácido palmítico: ácido decahexanoico Ácido láctico: CH3-HC(OH)-COOH 3 4-metilhexanal Bensoato de sódio: Éter dietílico: - Ejercicio Nº 12: (1) (+1) a) CH3-CH2-CH2OH + óxido suave → CH3-CH2-CHO + óxido suave → Propanol propanal CH3-CH2-COOH Ácido propanóico b) CH3-HC-(CH3)-COOH + CH3-HC-(OH)-CH3 H + Ác. Metilpropanoico isopropanol CH3-HC(CH3)-COO-CH(CH3)2 + H2O Metilpropanoato de ispropilo (+2) (0) c) CH3CO-CH3 + H2 → CH3HC-(OH)-CH3 Propanona 2-propanol (isopropanol) (+1) (-1) CH3-CH2-CHO + H2 → CH3-CH2-CH2OH Propanal d) HOOC-COOH 1-propanol + ac. Etanodioico Ca(OH2) → (COO-2) Ca+2 + 2H2O hidróxido de cálcio etanodiato de cálcio (oxalato de cálcio) - Ejercicio Nº 13 a) I) NH3 + C6H5-Cl → C6H5 -NH2 + HCl b) 803 grs. - II) CH5-NH2 + CH3-COOH → CH3-COO-NH-C6H5 + H2O Ejercicio Nº 14 I) b) II) H2C(NH2)-CH2-CH2-CH2-(NH2)CH2 1,5 pentildiamina - Ejercicio Nº 15 • Cl3C-CHO + oxidante → Cl3C-COOH Tricloroetanal ác.tricloroacético • Cl3C-COOH → Cl3C-COO- + Na+ → Cl3C-COO-Na+ ác.tricloroacético tricloroacetato tricloroacetato de sodio • Cl3C-CHO + reductor → Cl3C-CH2OH Tricloroetanal tricloroetanol - Ejercicio Nº 16 - Ejercicio Nº 17 - Ejercicio Nº 19 C: 40,00%; O: 53,33%; H: 6,67% a) CH2O b) C6H12O6 c º Ejercicio Nº 18 a) a c) a y e b) d d) d 4 b, f e) a - f) c Ejercicio Nº 20 a) CH3-CH2-HC(CH3)-CH2-CH2-CH3 3-metilhexano b) CH3-COOH ácido etanóico – HCOO-CH3 metanoato de metilo c) C3H-C2H-CH2-CH2-CH2OH 1-pentanol CH2-CH2-CH2-HC(OH)-CH3 2-pentanol CH2-CH2- HC(OH)-CH2- -CH3 3-pentanol 5







