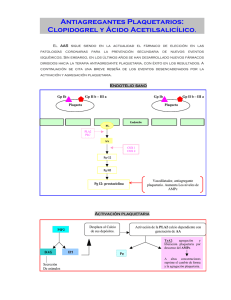
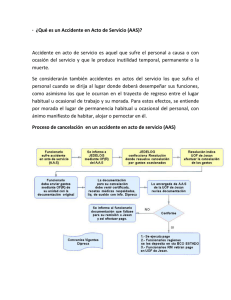
Antiagregación en Atención Primaria
Anuncio

ANTIAGREGACIÓN EN ATENCIÓN PRIMARIA Noviembre 2012 Antiagregación en Atención Primaria Página 1 Grupo de Trabajo en Enfermedad Cardiovascular de la SVMFiC COORDINADOR: Antonio Fornos Garrigós AUTORES: Asunción Ajenjo Navarro Alvaro Bonet Plá Pilar Botija Yagüe Antonio Fornos Garrigós Carlos Fluixá Carrascosa Maria Franch Taix Victoria Gosalbes Soler Antonio Maiques Galán Patricia Montoya Lapuente María del Monte Moreno Jiménez Mercedes Navarro Vicente Carlos Sanchis Domenech Darío Sanmiguel Cervera Manuela Vicente Cañizares Antiagregación en Atención Primaria Página 2 Hace ya más de 15 años que el Grupo de Trabajo en Enfermedad Cardiovascular de la SVMFiC inició su andadura con la misión de trasladar a nuestros compañeros de Atención Primaria la mejor evidencia disponible en el campo de la patología cardiovascular. En este objetivo es donde se enmarca la realización de esta guía de antiagregación orientada especialmente al ámbito de la atención primaria. El importante incremento de pacientes en tratamiento antiagregante en nuestras consultas, el aumento en la prevalencia de patologías como la fibrilación auricular susceptibles de necesitar anticoagulación/antiagregación y la aparición de nuevas evidencias en los últimos años en forma tanto de ensayos clínicos como de revisiones sistemáticas que de alguna manera cambian lo que hasta ese momento era práctica habitual y la modificación en mayor o menor grado de las distintas guías de práctica clínica (GPC) para adecuarse a esas evidencias, nos hizo plantearnos la necesidad de recoger estas novedades en un formato práctico y útil en nuestra actividad clínica diaria. Para ello hemos realizado una búsqueda sistemática de la evidencia publicada en los últimos 5 años, hasta diciembre de 2010, especialmente ensayos clínicos, revisiones sistemáticas y GPC en Medline, Cochrane Library y en National Clearing House. A partir de esas evidencias hemos elaborado una serie de recomendaciones en los diferentes capítulos, que a su vez representan los diferentes escenarios clínicos en los que se utilizan antiagregantes en nuestra práctica habitual. Para graduar dichas recomendaciones hemos utilizado el sistema GRADE. Este sistema establece dos categorías de recomendaciones: -Fuerte: Los beneficios de la intervención sobrepasan claramente (o no) los riesgos, la dimensión de la enfermedad y los costes. Indican que existe suficiente evidencia para aconsejar (o desaconsejar) el uso de la intervención diagnóstica o terapéutica en cuestión. -Débil: Existe menos certeza sobre el balance riesgo/beneficio de la intervención, los costes y la carga de la enfermedad. El respaldo para estas recomendaciones pude provenir de evidencias de alta, moderada o baja calidad, que a su vez se etiquetan como A, B y C respectivamente. Las evidencias de alta calidad (A) provienen de ensayos clínicos aleatorizados sin fallos de diseño o evidencia muy fuerte de estudios observacionales. No es probable que investigaciones adicionales modifiquen la certidumbre con respecto a la magnitud del efecto. Las evidencias de calidad moderada (B) se obtienen de ensayos clínicos aleatorizados con limitaciones importantes o evidencia consistente de estudios observacionales. Probablemente el cálculo del efecto de la intervención puede verse modificado por investigaciones adicionales. Las evidencias de baja calidad (C) derivan de estudios observacionales (cohortes, caso-control, series temporales, antes-después, o series de casos). Muy probablemente las investigaciones adicionales tendrán una repercusión importante en la certidumbre con respecto al cálculo del efecto y es posible que lo modifiquen. Antiagregación en Atención Primaria Página 3 Antiagregación en Atención Primaria Página 4 FARMACOLOGIA DE LA AGREGACIÓN PLAQUETARIA María del Monte Moreno Jiménez*, Mercedes Navarro Vicente† FISIOLOGÍA DE LA AGREGACIÓN PLAQUETARIA Las plaquetas se originan por ruptura de fragmentos citoplasmáticos de los megacariocitos. No presentan, por tanto, núcleo1. Contienen en su interior gránulos de dos tipos: -­‐ Gránulos alfa: contienen proteínas como el fibrinógeno, factor V, factor VIII o de von Willebrand, fibronectina y factor plaquetario de crecimiento de fibroblastos. -­‐ Gránulos beta: contienen calcio, serotonina, ADP y ATP. Las plaquetas, al no presentar núcleo, no pueden renovar el contenido de los gránulos presentes en el momento de la parcelación del fragmento del megacariocito. Permanecen en sangre periférica durante 8-­‐12 días, tras los cuales se destruyen en el bazo y en el hígado por los macrófagos. Cuando existe una lesión en un vaso o en la superficie endotelial causada por la rotura de una placa aterosclerótica, se van a exponer componentes de la matriz vascular a la luz del vaso, entre ellos las fibras de colágeno. Estos elementos inducirán la adhesión, la activación y la agregación de las plaquetas, formando el tapón hemostático. Así, las fibras de colágeno visibles van a unirse con las glicoproteínas (GP) Ia-­‐IIa de la plaqueta, mientas que el factor de von Willebrand se unirá a la GP Ib-­‐IX. Esto dará lugar a un flujo transmembrana calcio-­‐ dependiente que confiere a la GPIIb-­‐IIIa la capacidad de interactuar con el factor de von Willebrand, que hará que las plaquetas se depositen, formen una monocapa en el subendotelio2. * † Médico de Familia. Centro de Salud de Chiva Médico de Familia. Centro de Salud de Cheste Antiagregación en Atención Primaria Página 5 La adhesión plaquetaria dará lugar a la activación de las plaquetas. Esta activación también puede ser generada por diversos compuestos como la adrenalina, 5-­‐HT, vasopresina, angiotensina o ADP3. Mediante la activación, las plaquetas van a liberar el contenido de sus gránulos. Además, van a producir ácido araquidónico a partir de los fosfolípidos, mediante la fosfolipasa A2. La enzima ciclooxigenasa-­‐1 (COX-­‐1) convierte el ácido araquidónico en prostagladinas G2 y H2. A partir de estos precursores se formará, mediante la tromboxano-­‐ sintetasa, el tromboxano A2 (TXA2)¡Error! Marcador no definido., un vasoconstrictor y agonista de la agregación plaquetaria. El TXA2, al igual que el ADP, producirá que la GP IIb-­‐IIIa que se mantiene oculta en las plaquetas inactivadas circulantes en el torrente sanguíneo, salga al exterior de la membrana celular. La GP IIb-­‐IIIa será la encargada de fijar las proteínas de enlace, la principal de las cuales es el fibrinógeno, para formar los puentes de agregación entre las plaquetas, consiguiendo con ello la agregación plaquetaria. Cabe destacar que, aún en el caso de que esté bloqueada la vía del ácido araquidónico, otros agonistas proagregantes, como puede ser el ADP, pueden producir la exposición de la GP IIb-­‐IIIa4. Por otra parte, las células endoteliales también metabolizan el ácido araquidónico, produciendo PG I2, que actúa como vasodilatador y antiagregante. El ADP actúa como agonista de los receptores P2Y. La activación de dichos receptores genera una serie de procesos intracelulares que conducen a movilización del calcio, liberación del contenido de los gránulos, generación de TXA2 y activación del receptor de la GP IIb-­‐IIIa, lo que da lugar a una amplificación de la agregación plaquetaria y la estabilización del agregado plaquetario5. Antiagregación en Atención Primaria Página 6 ANTIAGREGANTES PLAQUETARIOS INHIBIDORES ENZIMÁTICOS Inhibidores de la ciclooxigenasa Ácido acetil salicílico (AAS) Inhibidores de la fosfodiesterasa Dipiridamol INHIBIDORES DE LOS RECEPTORES Inhibidores de receptores de ADP o Ticlopidina o Clopidogrel o Prasugrel o Ticagrelor Antagonistas de GPIIb-­‐IIIa o Abciximab o Tirofibran o Eptifibatide ACIDO ACETIL-­‐SALICÍLICO (AAS) Se trata de un antiinflamatorio no esteroideo, de la familia de los salicilatos, utilizado desde hace más de 100 años, que produce una inhibición irreversible de la COX-­‐1 y 2. En un primer momento, fue utilizado por sus propiedades antiinflamatorias, antipiréticas y analgésicas, aunque posteriormente, en los años 60, se descubrieron también sus propiedades como antiagregante plaquetario. Produce una disminución de la síntesis de TXA2, con lo que se inhibe la agregación plaquetaria, pero también de PGI2, lo que debería contrarrestar los efectos de la inhibición del TXA2. Sin embargo, se ha observado que dosis pequeñas de AAS inhiben en mayor grado la síntesis de TXA2 que de PGI26. Al ser una inhibición irreversible, el efecto permanece hasta la producción de nuevas plaquetas, en torno a 7-­‐10 días. Aproximadamente, se ha calculado que se recupera alrededor de un 10% de la función plaquetaria al día. El AAS comienza a ser absorbido en el estómago y su pico de niveles plasmáticos ocurre de 15 a 20 minutos después de la ingestión de la aspirina. La inhibición de la función plaquetaria se evidencia en la primera hora. Se han realizado numerosos estudios sobre la acción como antiagregante del AAS, comprobándose eficaz en la prevención y tratamiento de fenómenos trombóticos en pacientes con angina estable, infarto agudo de miocardio, isquemia cerebral transitoria, ictus cerebral trombótico y enfermedad arterial periférica7. Habitualmente, la dosis de 100 mg/día es la más Antiagregación en Atención Primaria Página 7 aceptada, ya que se reconoce que es una dosis suficiente para alcanzar el efecto antiagregante minimizando los efectos de toxicidad6. Los principales efectos adversos asociados al uso de AAS han sido reacciones alérgicas y alteraciones gastrointestinales, como náuseas, vómitos, pirosis y dolor epigástrico. En cuanto al aumento de los fenómenos hemorrágicos, se ha observado en los pacientes en tratamiento con AAS un incremento del riesgo absoluto del 0.03% anual en las hemorragias extra craneales graves y del 0.01% en los ictus hemorrágicos8. TRIFLUSAL Su estructura es similar al AAS y, al igual que éste, inhibe de forma reversible la COX, en mayor medida la COX-­‐1. Además, inhibe la síntesis de TXA24. Aunque la tasa de hemorragia parece ser menor en comparación con AAS, también es cierto que su efecto en algunos estudios a nivel de prevención de enfermedad cerebro-­‐vascular ha sido menor que con éste9. DIPIRIDAMOL Presenta un efecto inhibidor de la agregación plaquetaria, al inhibir la fosfodiesterasa, con el consiguiente aumento del AMPc intraplaquetario, ya que inhibe la liberación de ácido araquidónico a partir de los fosfolípidos3. Se absorbe bien por vía oral, pero se elimina con rapidez, por lo que es necesaria su administración en comprimidos de liberación prolongada. No hay evidencia que el dipiridamol reduzca el riesgo de muerte de origen vascular, aunque se ha demostrado que puede reducir el riesgo de eventos vasculares en pacientes con un ictus isquémico previo10, especialmente en combinación con AAS. Es por ello, que su principal indicación unido a AAS es la de prevenir eventos vasculares en pacientes con un accidente isquémico transitorio o en aquellos pacientes que han sufrido un ictus isquémico y en los que clopidogrel está contraindicado. Como tratamiento único, sólo estaría indicado en aquellos pacientes que han sufrido un ictus isquémico y presentan intolerancia o contraindicación al uso de aspirina o clopidogrel11. Su asociación con aspirina no se ha observado que aumente el riesgo de sangrado. El principal efecto adverso es la provocación de dolor anginoso en pacientes con estenosis coronaria. Es Antiagregación en Atención Primaria Página 8 por ello que se utiliza la perfusión de dipiridamol en la gammagrafía cardiaca con Talio 201 como alternativa a la prueba de esfuerzo en aquellos pacientes incapacitados para la realización de ésta. TICLOPIDINA Las tienopiridinas son una familia de fármacos que inhiben los receptores P2Y de ADP de forma irreversible. Así, interfieren en la activación de sitios de fijación para el fibrinógeno, impidiendo la fijación del fibrinógeno a la GP IIb-­‐IIIa y a la membrana plaquetaria3. Además, producen una movilización del calcio intracelular, así como una liberación de los gránulos de las plaquetas, que impedirá la agregación plaquetaria y la estabilización del coágulo. La ticlopidina fue el primer fármaco de este grupo que se utilizó, en 197212. Demostró en diversos estudios su eficacia en la reducción de eventos trombóticos en pacientes con arterioesclerosis (ensayos clínicos CATS13 y TASS14). Entre los principales inconvenientes encontrados en este fármaco destaca el inicio tardío de su efecto; esto ha hecho que no haya podido ser utilizado en el síndrome coronario agudo. Por otra parte, se ha asociado a importante toxicidad en médula ósea, con aparición de trombocitopenia grave, anemia aplásica y púrpura trombótica trombocitopénica. Es por ello que, actualmente, está fuera de uso15. CLOPIDOGREL Al igual que la ticlopidina, se trata también de un profármaco, por lo que debe ser metabolizado por el hígado, a través del citrocomo P450 CYP3A4, para convertirse al fármaco activo. Éste produce una modificación irreversible del receptor P2Y. A diferencia de la ticlopidina, su inicio de acción es más rápido y son más raros los efectos adversos a nivel de toxicidad medular (0.5% de neutropenia frente al 8% de la ticlopidina)4. De todos modos, en comparación con el AAS, su inicio de acción es tardío, por lo que en el contexto de un síndrome coronario agudo (SCA) es necesaria la administración de una dosis de carga (normalmente 300 mg), seguida por una dosis de mantenimiento de 75 mg/día5. Su acción, una vez alcanzada, perdura durante toda la vida de la plaqueta. Antiagregación en Atención Primaria Página 9 Tras la presentación del estudio CAPRIE en 1996, se confirmó la eficacia antiplaquetaria del clopidogrel, al reducir la recurrencia de eventos isquémicos en pacientes con historia de infarto de miocardio y cerebral o enfermedad arterial periférica16. A día de hoy, el clopidogrel es la tienopiridina de elección, tanto en asociación con AAS como en aquellos pacientes en los que el AAS está contraindicado. Hay que tener en cuenta su posible interacción con algunos fármacos, como el omeprazol 17. También se ha visto casos de pacientes no respondedores a clopidogrel relacionados con el tratamiento conjunto con estatinas. En todos estos casos, se trata de fármacos que interactúan con el citocromo P450 3A4. PRASUGREL Se trata de una tienopiridina de tercera generación. A diferencia del clopidogrel, el prasugrel se convierte en su metabolito activo de forma más efectiva, por lo que se obtiene mayor cantidad de metabolitos activos, que son equipotentes con los del clopidogrel. Además, tiene un inicio de acción más rápido y una menor variabilidad interindividual de respuesta4... En diversos estudios, se ha observado una reducción de los episodios isquémicos, incluida la trombosis del stent en comparación con clopidogrel, pero también se ha registrado una mayor tasa de hemorragia, especialmente en personas de 75 años o mayores, que pesan menos de 60 Kg, o que siguen un tratamiento concomitante con medicamentos que pueden incrementar el riesgo de sangrado18. Desde 2010 está comercializado en nuestro país, como una opción terapéutica en pacientes con SCA sometidos a una intervención coronaria percutánea (ICP). TICAGRELOR No se trata de una tienopiridina, aunque su acción es similar a éstas. Bloquea reversiblemente los receptores P2Y12, inhibiendo el efecto protrombótico del ADP. La principal ventaja frente a clopidogrel es que no precisa activación metabólica, por lo que inicia el efecto antes que las tienopiridinas y su pico plasmático se alcanza en 1.5-­‐3 horas. Tiene una vida media sobre 12 horas y tras 48 horas el efecto es mínimo19. Antiagregación en Atención Primaria Página 10 Las dosis utilizadas en distintos ensayos han sido de 100 a 400 mg20,21,22, con las que se ha observado una completa inhibición de la agregación plaquetaria 2 horas después de la dosis. Estas dosis, generalmente, han sido bien toleradas. INHIBIDORES DEL RECEPTOR GPIIb-­‐IIIa El Abciximab es un anticuerpo monoclonal que se une de forma irreversible al receptor GPIIb-­‐ IIIa, impidiendo la unión del fibrinógeno a éste. Su uso es exclusivamente hospitalario. Se ha objetivado como muy eficaz por vía intravenosa en pacientes con SCA que requieren ICP, con y sin posterior implantación de stent23, siendo su eficacia menor en pacientes con angina inestable no programados para ICP. Como efectos secundarios, cabe destacar un importante riesgo hemorrágico por el gran potencial inhibidor, así como la trombocitopenia (1.6-­‐5%)24. También hay que destacar que, al ser un anticuerpo monoclonal, posee capacidad inmunógena. El Tirofibran y el Eptifibatide son, igualmente, fármacos de uso hospitalario. Son compuestos sintéticos que llevan en su estructura la secuencia de aminoácidos Arg-­‐Gly-­‐Asp necesaria para su unión al receptor25. Tienen una vida media corta y menor afinidad que el Abciximab por el receptor4. Sus indicaciones y efectos secundarios han sido similares a los del Abciximab. Antiagregación en Atención Primaria Página 11 PREVENCIÓN PRIMARIA DE LA ENFERMEDAD CARDIOVASCULAR CON ASPIRINA Maria Franch Taix‡, Antonio Maiques Galán § No se recomienda el uso de aspirina como estrategia de prevención primaria de la enfermedad cardiovascular. GRADE: RECOMENDACIÓN DEBIL a favor de su uso, NIVEL DE EVIDENCIA A En el metanálisis de Antithrombotic Trialists (ATT) Collaboration8 se ha demostrado que el tratamiento con aspirina en prevención secundaria, reduce de forma significativa el riesgo de sufrir un episodio cardiovascular grave, que incluye el infarto de miocardio, ictus o muerte por causa cardiovascular, con un RR de 0,81 (IC 95%: 0,75 – 0,87) y una reducción absoluta del riesgo de un 1% por año. Por otro lado, en prevención primaria8, el tratamiento con dosis bajas de aspirina (entre 75 y 500 mg/día) disminuye el riesgo de sufrir un episodio cardiovascular grave (RR = 0,88; IC 95%: 0,82 a 0,94) frente al grupo control, pero la reducción absoluta del riesgo es mucho más baja (0,07% por año) que en prevención secundaria. Si se evalúa el efecto por tipo de enfermedad cardiovascular, la aspirina disminuye de forma significativa el número de episodios coronarios mayores, infarto de miocardio mortal o no, con un RR de 0,82 (IC 95%: 0,75 a 0,90), no significativamente el número de ictus (RR: 0,95; IC 95%: 0,85 a 1,06) o la mortalidad por causa cardiovascular (RR: 0,97; IC 95%: 0,87 a 1,09). Por el contrario, el tratamiento con aspirina tiene como efectos adversos un incremento de los ictus hemorrágicos (RR en prevención primaria: 1,32; IC 95%: 1,00 – 1,75; incremento del riesgo absoluto de un 0,01% anual. RR en prevención secundaria: 1,67; IC 95%: 0,97 a 2,90) y de las hemorragias extra craneales mayores, es decir, las que requieren transfusión o provocan la muerte, con un RR en prevención primaria de 1,54 (IC 95%: 1,30 a 1,82%) y un incremento absoluto del riesgo de un 0,03% por año8 Comparando la reducción absoluta del riesgo, en prevención primaria, de los episodios cardiovasculares mayores (0,07% anual) frente al riesgo incrementado de hemorragia intracraneal (0,01% anual) o de hemorragias extra craneales (0,03% anual) se deduce que los ‡ Medico de familia. Centro de Salud de Trinitat. § Médico de familia. Centro Salud de Manises. Antiagregación en Atención Primaria Página 12 beneficios cardiovasculares no superan de forma clara los riesgos de hemorragia, circunstancia que sí se produce en prevención secundaria. Se ha intentado buscar diversos marcadores para identificar a pacientes en prevención primaria, pero con un riesgo alto de sufrir una enfermedad cardiovascular y compensar con un margen de beneficio mayor el riesgo de hemorragias. Entre estos marcadores se encuentran un riesgo cardiovascular alto estimado mediante tablas que lo calculan, la presencia de diabetes o un índice tobillo brazo inferior a 0,9. Sin embargo, no ha tenido éxito hasta el momento actual. Como se ha confirmado en el metanálisis del Antithrombotic Trialists’ (ATT) Collaboration, al seleccionar pacientes con un riesgo cardiovascular estimado más alto se obtiene un mayor beneficio absoluto cardiovascular, pero también aumenta el riesgo de hemorragia. En ningún ensayo clínico realizado en pacientes diabéticos se obtiene una reducción del riesgo de episodios cardiovasculares26. Tampoco en un metanálisis publicado en 200927. Por último, en un estudio realizado en diabéticos con un índice de tobillo – brazo < 0,9 tampoco se obtienen beneficios significativos28 CONCLUSIÓN: El uso de aspirina en prevención primaria de la enfermedad cardiovascular es incierto, ya que los beneficios obtenidos son similares a los posibles daños (hemorragias mayores). No existe evidencia de que el tratamiento con aspirina ocasione un beneficio en pacientes con un riesgo cardiovascular estimado alto, diabéticos o pacientes asintomáticos con un índice tobillo brazo < a 0,9. Como conclusión general no se recomienda el uso de aspirina en prevención primaria. Antiagregación en Atención Primaria Página 13 ANTIAGREGACIÓN CON ASPIRINA EN PACIENTES DIABÉTICOS Alvaro Bonet Plá** , Asunción Ajenjo Navarro†† En pacientes diabéticos con un riesgo cardiovascular elevado se puede considerar el uso de AAS (75 a 150 mg/ día) como estrategia de prevención primaria GRADE: RECOMENDACIÓN DEBIL, NIVEL DE EVIDENCIA B El ácido acetil salicílico (AAS) ha demostrado su efectividad en la reducción de la morbi-­‐ mortalidad de los pacientes diabéticos (DM) con antecedentes de infarto agudo de miocardio (IAM) o accidente cerebrovascular (ACVA). Sin embargo, el impacto de la anti-­‐agregación en pacientes diabéticos sin eventos cardiovasculares previos es, en el momento actual más dudoso y sujeto a controversia8. De un lado, el beneficio obtenido esta cercano al daño potencial derivado de su uso (aparición de hemorragias digestivas e intracraneales principalmente) y por otra parte, el beneficio neto del AAS es menor en prevención primaria, dado que su objetivo es evitar la aparición de eventos CV en situaciones con un riesgo basal inferior. El metanálisis del ATT8 realizado en 2009, analizó los datos de seis ensayos clínicos (BMD29, PHS30, TPT31, HOT32, PPP33 y WHS34) llevados a cabo en pacientes sin antecedentes de enfermedad cardiovascular. Estos ensayos, realizados en pacientes no exclusivamente diabéticos, incorporaron 4261 personas con DM. El resultado del metanálisis mostró un efecto no significativo del tratamiento con aspirina en la prevención primaria de eventos cardiovasculares en pacientes con diabetes (RR 0.88; 0.67a 1.15), que contrastaba con el efecto significativo que se observó en pacientes no diabéticos (RR 0.87; 0.79 a 0.96). El pequeño tamaño de la muestra y la heterogeneidad que aportaban algunos estudios planteó dudas respecto a la validez de esos resultados. Diversos metanálisis recientes han estudiado el efecto de la aspirina en pacientes con DM, incorporando los datos de los últimos ensayos clínicos realizados exclusivamente en pacientes diabéticos (JPAP35, POPADAD36 y ETDRS37) a los ya valorados en el metanálisis del ATT8. El estudio ETDRS37 analizó el efecto de 650 mgr. de aspirina en 3711 pacientes con DM tipos 1 y 2 (DM1 2) y algún grado de retinopatía y antecedentes de cualquier tipo de enfermedad cardiovascular (ECV). Los pacientes tratados con aspirina, presentaron una disminución del riesgo de IAM del 15% (RR 0.85; 0.73 a 1.00) y una tendencia al aumento del riesgo de ACV del 18% (RR 1.18; 0.88 a 1.58). El beneficio era mayor en hombres (RR 0.74; 0.54 a 1.00) que en ** Médico de familia. Centro de Salud Salvador Pau †† Medico de familia. Centro de Salud de Paterna Antiagregación en Atención Primaria Página 14 mujeres (RR 0.91; 0.65 a 1.28). Por su parte el estudio POPADAD36 llevado a cabo en 1276 pacientes con DM1-­‐2 y enfermedad arterial periférica asintomática (ITB<0.9), valoró si 100 mgr. de aspirina y diversos antioxidantes eran más efectivos que el placebo a la hora de reducir la aparición de eventos cardiovasculares. En los pacientes tratados con aspirina tras 6.7 años de seguimiento, se observó un descenso del riesgo de ECV del 2% (RR 0.98; 0.76 a 1.26). Los resultados no se modificaban si se añadía o no antioxidantes. Finalmente el estudio JPAD35 incluyó a 2536 pacientes con DM2 sin antecedentes de ECV y analizó el efecto de bajas dosis de aspirina (81-­‐100 mgr.) sobre la aparición diversos tipos de ECV. En los pacientes del grupo de tratamiento, disminuyó el riesgo del indicador principal un 20% (RR 0.80; 0.58 a 1.10) y la mortalidad general un 10% (RR 0.90; 0.57 a 1.14) aunque ninguno alcanzó significación estadística. En el análisis pre-­‐establecido del subgrupo de mayores de 65 años el beneficio si fue significativo (RR 0.68; 0.46-­‐0.99). De los metanálisis mencionados anteriormente el más completo es el de Pignone38 que incluye los datos de los tres ensayos mencionados junto a los seis del ATT, incorporando un número de pacientes diabéticos de 11.787 en total. En este estudio el empleo de aspirina se asoció a una disminución del riesgo de cardiopatía isquémica (IAM fatal y no fatal) del 9% (RR 0.91; 0.79 a 1.05) y a un descenso de ACV del 15% (RR 0.85; 0.66 a 1.11). En cuanto al metanálisis de Zhang39 , analiza cuatro estudios además de los tres comentados (no incluye el BMD ni el TPT) y sus resultados son similares a los del anterior metanálisis menor incidencia de IAM (RR 0.85; 0.65 a 1.11), y de ACV (RR 0.83; 0.63 a 1.10). Casi idénticos resultados obtiene el metanálisis de Calvin40 que analiza los mismos siete ensayos que el anterior, descenso del 14% del riesgo de IAM (RR 0.86; 0.67 a 1.11), y del 38% de ACV isquémico (RR 0.62; 0.31 a 1.24) aunque sólo incluye los datos de dos estudios en este apartado. Finalmente el metanálisis de De Berardis41 incorpora seis ensayos (no incluye el HOT, el BMD ni el TPT) y sus resultados son similares a los de todos los anteriores, IAM (RR 0.86; 0.61 a 1.21), y ACV (RR 0.83; 0.60 a 1.14). Los efectos adversos más importantes que se observan en los pacientes tratados con AAS son los ACV hemorrágicos y las hemorragias digestivas, aunque el aumento que se observa no tiene significación estadística (RR 2.5; 0.76 a 8.21)41 CONCLUSION De la revisión de los estudios publicados concluimos que existe una evidencia GRADE 2B , es decir con UNA CALIDAD MODERADA ( B ) respecto a la no efectividad del tratamiento con aspirina en pacientes diabéticos sin ECV, y una fuerza de recomendación DÉBIL (2) para la utilización de aspirina en pacientes diabéticos sin antecedentes de ECV. Antiagregación en Atención Primaria Página 15 TRATAMIENTO ANTIAGREGANTE EN LA ARTERIOPATIA PERIFÉRICA Carlos Sanchis Domenech‡‡ El tratamiento antiagregante no está indicado en la prevención de eventos cardiovasculares en la arteriopatía periférica asintomática GRADE: RECOMENDACIÓN DEBIL a favor de su uso, NIVEL DE EVIDENCIA A INTRODUCCIÓN La arteriopatía periférica (AP) se produce cuando hay un estrechamiento importante en las arterias distales provocando una disminución de la luz arterial, normalmente en las extremidades inferiores. Es más frecuente en personas mayores de 50 años y sobretodo en varones, la prevalencia en población general mayor de 55 años se encuentra alrededor del 15% y su incidencia anual es de 8/1000 en varones y de 4/1000 en mujeres42,43. El síntoma más importante de la AP es la claudicación intermitente, se reconoce como el dolor progresivo, rigidez o calambre en una o ambas extremidades inferiores, que se desencadena al caminar y que se intensifica al seguir deambulando hasta obligar a detenerse, desapareciendo con el reposo sin necesidad de sentarse. La distancia que el enfermo puede caminar sin molestias suele mantenerse constante. Mediante la técnica del índice tobillo brazo (ITB) se puede detectar la AP antes de que aparezcan los síntomas. El ITB es el cociente de la presión arterial sistólica en arteria tibial posterior y la arteria humeral, el punto de corte para el paciente sano en reposo estaría en 0.9. Hablamos de arteriopatía periférica cuando el ITB<0.9. La evolución de la AP es progresiva como el resto de la enfermedad arterioesclerótica. Ésta depende del estado clínico inicial y del grado de exposición a factores de riesgo. Una afectación moderada puede presentar una tasa de amputación 5-­‐7% a los 5 años, mientras si la afectación es grave puede alcanzar 30-­‐50 % a los dos años. También se asocia una mayor morbilidad por afectación del árbol arterial en otros órganos, a los 5 años del diagnostico, el 20% de los enfermos con AP sufren, un infarto de miocardio o un accidente cerebrovascular. La mortalidad también es muy alta entre un 30-­‐75% a los 5 años44. ‡‡ Médico de Familia C.S de Algemesí Antiagregación en Atención Primaria Página 16 TRATAMIENTO DE LA ENFERMEDAD VASCULAR PERIFÉRICA. Debemos de distinguir varios niveles de tratamiento. Por un lado, el control de los factores de riesgo (tabaquismo, hipertensión arterial, dislipemia, diabetes), tanto en prevención primaria como en prevención secundaria. Por otro, el tratamiento médico conservador de la enfermedad crónica y prevención secundaria. En tercer lugar el tratamiento quirúrgico por vía endovascular o por cirugía directa. Y finalmente el tratamiento de la isquemia aguda y tratamiento paliativo o de supervivencia, que sería la amputación de la extremidad. La prevención primaria de la AP, es prácticamente común con las otras manifestaciones orgánicas de la arterioesclerosis, a nivel cardiaco y cerebral. El 69% del riesgo de sufrir una AP es atribuible a los factores de riesgo cardiovascular y sobretodo al tabaquismo y la falta de ejercicio físico. La importancia de la lucha contra el tabaquismo y el resto de factores de riesgo cardiovascular no sólo es útil a nivel de prevención primaria, sino en todos los estadios de la enfermedad, es decir también en la prevención de la progresión de la enfermedad y de sus complicaciones45. En el tratamiento de la enfermedad arterial periférica crónica, uno de los objetivos es mantener la luz de la arterias periféricas libres de trombos y permeables para garantizar la circulación en las zonas más distales. Tenemos evidencias que los agentes antiagregantes (ácido acetilsalicílico, clopidogrel, ticlopidina, y ácido acetilsalicílico más dipiridamol) disminuyen el riesgo de oclusión de la arteria frente a no tratar con antiagregantes en pacientes sintomáticos.46,47 Existen evidencias que nos demuestran los beneficios del tratamiento antiagregante para prevenir eventos cardiovasculares en pacientes con AP sintomática, es decir con claudicación intermitente. Una revisión sistemática del año 1990 se evalúan 39 ensayos clínicos aleatorios con 9000 pacientes sintomáticos, el tratamiento antiagregante versus control previno con mayor eficacia, el infarto de miocardio no fatal, el accidente cerebrovascular no fatal y la muerte de causa cardiovascular.46 Comparando el beneficio obtenido del ácido acetilsalicílico frente al resto de tratamientos antiagregantes (ticlopidina, clopidogrel, y ácido acetilsalicílico más dipiridamol), presentó una reducción absoluta estadísticamente significativa de los eventos cardiovasculares de un 1.8% a favor de los otros antiagregantes. En la prevención de las complicaciones de la AP, el tratamiento antiagregante en pacientes con claudicación intermitente, cirugía de by-­‐pass o angioplastia, se observó una reducción del riesgo de oclusión de las arterias de los MMII durante un periodo superior a 19 meses. Otro estudio observó una reducción en las oclusiones arteriales y de las intervenciones quirúrgicas con by-­‐pass al cabo de tres meses de tratamiento de ácido acetilsalicílico versus control48. Lo mismo demostró la ticlopidina en 2 ensayos clínicos al cabo de 7 años49. Por otra parte el tratamiento post cirugía endoarterial con ácido acetilsalicílico a bajas dosis mas dipiridamol durante 6 meses, no disminuyó el riesgo de oclusión o reestenosis50. Antiagregación en Atención Primaria Página 17 El uso de ácido acetilsalicílico (AAS) está establecido en la enfermedad vascular periférica sintomática sin embargo existe controversia en su utilización en prevención primaria de enfermedades cardiovasculares y en la arteriopatía periférica asintomática (ITB < 0.9)51. Recientemente se han publicado los resultados de un ensayo clínico doble ciego por intención de tratar en 3350 pacientes con ITB< 0.95, en los que se comparaba la administración de 100 mg/día de AAS respecto a placebo, donde no se han encontrado diferencias significativas entre ambos grupos en la reducción de eventos cardiovasculares52. En el estudio POPADAD36 , un ensayo clínico doble ciego, en población diabética de más de 40 años de edad, con enfermedad arterial periférica asintomática (ITB<0.9), en la que se administró 100 mg/día al grupo intervención y se realizó un seguimiento de 8 años, tampoco se observaron diferencias estadísticamente significativas en el riesgo de presentar algún episodio cardiovascular (HR: 0.98 %; IC del 95%, 0,76 a 1,26) en el grupo aspirina frente al placebo. Recientes estudios demuestran que la aspirina no tiene un impacto directo en la evolución de la AP, en pacientes asintomáticos53. En cuanto a los riesgos de hemorragias graves no fatales se han encontrado diferencias significativas entre placebo y los diversos tratamientos antiagregantes mencionados. Así mismo no se han encontrado diferencias en la aparición de hemorragias graves entre el ácido acetilsalicílico y el resto de antiagregantes. El beneficio obtenido en la prevención de eventos cardiovasculares con el tratamiento antiagregante en pacientes con AP, supera al posible riesgo de hemorragia grave fatal o no fatal. CONCLUSIONES: El tratamiento antiagregante no es útil para la prevención de eventos cardiovasculares en la arteriopatía periférica asintomática, según los últimos resultados36. Algunas guías54 en los pacientes con AP asintomáticos con un ITB <0.9, recomiendan que, dosis bajas AAS (75-­‐162 mg diariamente) pueden ser consideradas para aquéllos con riesgo cardiovascular alto, en la ausencia de factores de riesgo de hemorragia (Calidad de la evidencia C. Fuerza de la recomendación: débil). En los pacientes con AP sintomática sin enfermedad cardio o cerebrovascular, se recomienda dosis bajas AAS (75-­‐162 mg diariamente) o clopidogrel 75 si mantiene un riesgo hemorragia bajo (Calidad de la evidencia B. Fuerza de la recomendación 1). La opción del fármaco puede depender de la preferencia paciente y consideraciones de uso racional del medicamento. Para los pacientes alérgico o intolerante a AAS, se sugiere el uso de clopidogrel (Calidad de la evidencia B. Fuerza de la recomendación: fuerte). Antiagregación en Atención Primaria Página 18 Para los pacientes con claudicación intermitente, el uso clopidogrel diariamente 75 mg además de AAS 75-­‐162 mg, no se recomienda a menos que el paciente tenga un riesgo vascular alto junto con un riesgo bajo de sangrado. (Calidad de la evidencia B. Fuerza de la recomendación: débil). Para los pacientes con AP sintomática con enfermedad cardio o cerebrovascular, la terapia antiagregante se recomienda (Calidad de la evidencia A. Fuerza de la recomendación: fuerte). Para los pacientes con AP sintomática sin indicaciones de anticoagulación oral por fibrilación auricular o el tromboembolismo venoso, no debe agregarse anticoagulación oral a la terapia del antiagregante. (Calidad de la evidencia C. Fuerza de la recomendación: fuerte). Para los pacientes con AP sintomática con una indicación para el anticoagulación oral por fibrilación auricular, tromboembolismo venoso, o prótesis valvular cardíaca, la terapia del antiagregante no debe añadirse a la anticoagulación oral (Calidad de la evidencia C. Fuerza de la recomendación fuerte). Terapia del antiagregante a largo plazo con AAS 75-­‐162 mg debe darse a pacientes que tienen una angioplastia de extremidades con o sin STENT por AP sintomática crónica (Calidad de la evidencia C. Fuerza de la recomendación 1). Anticoagulación con heparina o antagonistas de la vitamina K deben de evitarse en este escenario (Calidad de la evidencia C. Fuerza de la recomendación fuerte). Antiagregación en Atención Primaria Página 19 ANTIAGREGACIÓN Y ANTICOAGULACIÓN EN PREVENCIÓN SECUNDARIA DE CARDIOPATÍA ISQUÉMICA Darío Sanmiguel Cervera§§, Antonio Fornos Garrigós*** Todos los pacientes que han sufrido un IM deben recibir de forma rutinaria e indefinidamente AAS a dosis entre 75 y 150 mg/día. (GRADE: RECOMENDACIÓN FUERTE, NIVEL DE EVIDENCIA A) El clopidogrel a dosis de 75 mg/día es una alternativa efectiva y segura en aquellos pacientes que no toleran o está contraindicado el AAS. (GRADE: RECOMENDACIÓN FUERTE, NIVEL DE EVIDENCIA A) La cardiopatía isquémica constituye una de las principales manifestaciones clínicas de la enfermedad arteriosclerótica y es la principal causa de mortalidad en los países desarrollados. En nuestro país la enfermedad coronaria es responsable de un poco más del 30 % de la mortalidad global. Con prevención secundaria hacemos referencia al tratamiento a largo plazo para disminuir la morbi-­‐mortalidad recurrente y mejorar la calidad de vida en personas que ya un sufrido un primer evento coronario. Aproximadamente un 25 % de los varones y un 38 % de las mujeres que han sufrido un infarto de miocardio (IAM) morirán en el primer año. A los 6 años del evento agudo un 18 % de los varones y un 35 de las mujeres tendrán un nuevo IAM, el 22 % de los varones y el 46 % de las mujeres desarrollaran una insuficiencia cardiaca, y entre un 6 y un 7 % del total sufrirá una muerte súbita55. El tratamiento antiagregante constituye una de las piedras angulares en el manejo de los pacientes que han sufrido un evento coronario en sus diversas manifestaciones clínicas. El grupo Anti-­‐Platelet Trialists Collaboration estudió el uso de AAS comparado con placebo en un metanálisis con 140000 pacientes en 300 estudios. Se confirmó el efecto beneficioso profiláctico del AAS tanto en varones como en mujeres con angina, infarto previo o ACV previo, así como tras cirugía de injerto coronario8. En varios estudios efectuados en pacientes con angina crónica estable se ha observado una reducción de la incidencia de infarto y de muerte súbita con la administración de AAS56, 57 §§ Cardiólogo y médico de familia. Hospital General Universitario de Valencia *** Médico de familia, Centro de Salud de Picanya. Antiagregación en Atención Primaria Página 20 La administración de AAS de forma inmediata en la fase aguda del IM y su mantenimiento diario consigue una reducción del número de reinfartos, mortalidad por causas cardiovasculares y mortalidad global; la dosis óptima debe oscilar entre 75 y 150 mg/día58. Se estima que el tratamiento antiagregante previene 18 infartos no fatales, 5 accidentes cerebrovasculares agudos (ACVA) no mortales y 14 muertes vasculares por cada 1000 personas tratadas durante 2 años59. El clopidogrel es una alternativa tan segura y efectiva (a dosis de 75 mg/día) como el AAS para aquellos pacientes que no toleran o está contraindicado el AAS. En el estudio aleatorizado CAPRIE16 se comparó AAS frente a clopidogrel en pacientes con vasculopatía aterosclerótica establecida: La administración de clopidogrel dio lugar a una reducción relativa ligera del 8,7% en el riesgo de fallecimiento por causas vasculares, ACV isquémico o de IM (p= 0,043) a lo largo de 2 años. En estudios posteriores que comentaremos más adelante se ha evaluado la combinación de clopidogrel y AAS en pacientes con síndrome coronario agudo (SCA), observando una reducción más sólida del riesgo en este grupo de pacientes con enfermedad arterial coronaria. Los estudios que se están realizando en esta área van a aclarar la función que desempeña la administración crónica de clopidogrel como prevención secundaria en pacientes con angina crónica estable. Estudios con otros antiagregantes (sulfinpirazona60,61, asociación AAS-­‐dipiridamol62, ticlopidina63, 64, 65) han demostrado beneficio en la prevención secundaria, aunque en ninguno de ellos se supera el del AAS. La anticoagulación oral de baja intensidad; esto es con Razón Internacional Normalizada (INR) < 1,5, añadida al AAS no produce ningún beneficio adicional66. Un metanálisis67 en pacientes con enfermedad coronaria sugiere que la anticoagulación intensa o moderada con warfarina combinado con AAS parece ser superior a AAS en monoterapia pero con un incremento superior al doble en el riesgo de provocar hemorragias clínicamente significativas. Un EC68 con 3630 pacientes concluye que la anticoagulación intensa (INR de 2,8 a 4,2) con warfarina sola o la anticoagulación moderada (INR de 2,0 a 2,5) en combinación con AAS (75 mg/día), fue superior a AAS en monoterapia (160 mg/día) en disminuir de forma significativa la incidencia de reinfarto no fatal y eventos tromboembólicos (no así con la mortalidad total) después de un IAM, pero con un alto riesgo de episodios mayores de sangrado (0,68% y 0,57% respectivamente frente al 0,17%por año del AAS en monoterapia) cuyos resultados no permiten concretar el beneficio de dicha asociación. Sin embargo, en aquellos pacientes con IAM establecido y con alto riego de embolismo sistémico o pulmonar secundario a grandes infartos anteriores, disfunción ventricular severa, insuficiencia cardiaca congestiva, historia de TEP previo o trombofilia, trombo mural demostrado por ecocardiografia, fibrilación auricular persistente, inmovilización prolongada u obesidad marcada deben de ser anticoagulados con heparina a dosis plenas seguida de anticoagulación oral (INR 2.0 a 3.0) durante al menos tres meses69. RIESGOS Antiagregación en Atención Primaria Página 21 El principal riesgo de la terapia con AAS a largo plazo es la hemorragia gastrointestinal, la mayoría de las cuales no son mortales. La odds-­‐ratio (OR) frente a placebo es de 1.68, con un número necesario de pacientes a tratar para presentar un efecto adverso (NNH) de 248 por año. Existe una mayor probabilidad de producir una hemorragia digestiva con dosis superiores a 325 mg/día, pero no existen diferencias por debajo de esta cantidad. No existen evidencias de que las formulaciones de liberación modificada reduzcan la incidencia de hemorragia digestiva70. El efecto adverso mas importante por mortalidad e incapacidad que produce es la hemorragia intracraneal; sin embargo, el exceso de riesgo absoluto es igual o menor de uno por 1000 personas y año. En aquellos pacientes con una historia de hemorragia digestiva inducida por AAS, cuyas úlceras estén ya curadas y con test para la detección de Helicobacter Pilory negativos, deben ser tratados con dosis plenas de un inhibidor de la bomba de protones (IBP) y dosis bajas de AAS. También debe emplearse un IBP junto con AAS en pacientes con historia de dispepsia71 ANTIAGREGACIÓN EN SITUACIONES ESPECIALES DOBLE ANTIAGREGACIÓN EN EL SÍNDROME CORONARIO AGUDO SIN ELEVACIÓN DEL SEGMENTO ST (SCASEST). Todos los pacientes que han sufrido un SCASEST deben recibir 75 mg/ día de clopidogrel durante 12 meses y AAS a dosis bajas (75-­‐162 mg/día). A partir de entonces, se debe continuar con al tratamiento estándar salvo que exista otra indicación para la terapia dual. (GRADE: RECOMENDACIÓN FUERTE, NIVEL DE EVIDENCIA A) En el estudio CURE72, ensayo clínico aleatorizado a doble ciego con 12562 pacientes con SCASEST, la combinación de AAS y clopidogrel comparado con la administración de AAS en monoterapia dio lugar a un descenso estadísticamente significativo de la incidencia en el objetivo primario combinado de mortalidad por causas cardiovasculares, infarto de miocardio no fatal y accidente cerebrovascular de 9.3% y 11.4% respectivamente con la consiguiente reducción del riesgo relativo del 20% (IC 95%,10 a 28, p<0.001) en un seguimiento entre 3 y 12 meses (media de 9 meses). Antiagregación en Atención Primaria Página 22 RIESGOS La incidencia de hemorragias mayores y menores fue mayor en el grupo de clopidogrel en combinación con AAS (3.7 %) comparado con AAS en monoterapia (2.7 %) (RR 1.3; IC 95 %, 1.13 a1.67). No hubo diferencias en cuanto hemorragias fatales, hemorragias que precisaran intervención quirúrgica ni accidentes cerebrovasculares hemorrágicos en ambos grupos comparados. DOBLE ANTIAGREGACIÓN EN EL SÍNDROME CORONARIO AGUDO CON ELEVACIÓN DEL SEGMENTO ST (SCACEST). Todos los pacientes que han sufrido un SCACEST y hayan iniciado la doble terapia en las primeras 24 horas después del SCA, deben continuar la misma al menos durante cuatro semanas. (GRADE: RECOMENDACIÓN FUERTE, NIVEL DE EVIDENCIA A) Se ha establecido que la administración de clopidogrel en la fase aguda del SCACEST y su mantenimiento diario durante 4 semanas en combinación con AAS de forma indefinida, consigue una reducción en la mortalidad por causas cardiovasculares, infarto de miocardio no fatal y accidente cerebrovascular73.En el estudio COMMIT-­‐CCS-­‐274 se incluyeron 45857 pacientes con SCACEST asignándose aleatoriamente a la administración de 75 mg/día de clopidogrel o placebo, además de los 162 mg/día de AAS. El tratamiento farmacológico del estudio debía mantenerse hasta el alta hospitalaria o hasta llegar a las 4 semanas (la duración media del tratamiento fue de 14.9 días). La variable de valoración principal, formada por la combinación de muerte, reinfarto e ictus, se redujo del 10% existente en el grupo placebo al 9,2% en el grupo clopidogrel (OR 0,91 [IC del 95 % 0,86 a 0,97]; p=0.02). En el estudio CLARITY-­‐ TIMI 2875 se incluyeron 3491 pacientes con SCACEST y se les asignó aleatoriamente clopidogrel y placebo. La variable de valoración principal de la eficacia, formada por la combinación de la presencia de una oclusión del la arteria responsable del infarto en la angiografía, muerte e IM recurrente antes de la angiografía, se produjo en un 21.7% de los pacientes del grupo placebo y en el 15.0% de los del grupo de clopidogrel (OR 0,64 [IC del 95% 0,53 a 0,76]; p<0.01). DOBLE ANTIAGREGACIÓN TRAS INTERVENCIONISMO PERCUTÁNEO (ICP) CON IMPLANTE DE STENT Antiagregación en Atención Primaria CORONARIO Página 23 En todos los pacientes sometidos a ICP debe administrarse AAS de manera indefinida a dosis de 75-­‐100 mg./día (GRADE: RECOMENDACIÓN FUERTE, NIVEL DE EVIDENCIA A) En todos los pacientes sometidos a ICP a los que se les inserta un stent no recubierto debe administrarse AAS de manera indefinida a dosis de 75-­‐100 mg./día combinado con clopidogrel a dosis de 75 mg./día durante al menos 1 mes y si es posible durante un año (GRADE: RECOMENDACIÓN FUERTE, NIVEL DE EVIDENCIA A) En todos los pacientes sometidos a ICP con stent recubierto se recomienda la terapia dual durante al menos un año (GRADE: RECOMENDACIÓN FUERTE, NIVEL DE EVIDENCIA A). Si es posible se puede mantener la doble terapia con AAS y clopidogrel de forma indefinida. (GRADE: RECOMENDACIÓN DEBIL, NIVEL DE EVIDENCIA C) Los procedimientos de revascularización coronaria mediante ICP han revolucionado el tratamiento de la cardiopatía isquémica. Actualmente la mayor parte de los procedimientos de ICP se llevan a cabo con la implantación de stents. Uno de los potenciales y graves problemas de los stents es la posibilidad de trombosarse, siendo la causa más importante la discontinuación del tratamiento antiagregante. Todo paciente que ha sido sometido a procedimientos de ICP debe recibir de forma indefinida tratamiento con AAS a dosis antiagregantes. A pesar de ello el tratamiento sólo con AAS no es suficiente para prevenir la trombosis del stent y precisa combinar con clopidogrel. La duración de la doble antiagregación varía en función del tipo de stent implantado. Existen principalmente 2 tipos de stents, los llamados metálicos, convencionales o no recubiertos y los recubiertos de fármacos antiproliferativos o liberadores de fármacos. Se ha establecido que la administración AAS de forma indefinida tras ICP y combinado con clopidogrel durante un periodo determinado en función del tipo de stent utilizado, reduce la tasa de episodios isquémicos cardiovasculares. La recomendación general sigue siendo mantener el clopidogrel durante 1 mes tras la implantación de un stent no recubierto y al menos 12 meses tras la implantación de stent recubierto. Esta última recomendación de prolongar la doble antiagregación está apoyada por Antiagregación en Atención Primaria Página 24 el hecho de que la mayoría de trombosis descritas en los stents recubiertos suceden entre el primer mes tras el implante del stent y el año comparado con los stents no recubiertos. En el estudio M-­‐HEART II76, que comparó AAS con placebo en pacientes con angina estable tratados con ICP, demostró una reducción del 5,7 al 1,2 % en la incidencia de IM tras la ICP, y del 41 al 30 % de eventos cardiovasculares en el seguimiento. En el estudio PCI-­‐CURE77, que incluyó a 2.658 pacientes con SCA sin elevación ST sometidos a intervención coronaria percutánea con colocación de stent, el clopidogrel añadido al tratamiento estándar con AAS antes del tratamiento y continuado 12 meses, mostró una disminución estadísticamente significativa de la variable combinada (muerte de causa cardiovascular, IAM o revascularización), de 12.6% a 8,8%, comparado con aspirina en monoterapia. El estudio CREDO78, que incluyó a 2.116 pacientes que requerían intervención coronaria percutánea, comparó el tratamiento con AAS, desde 2 horas antes de la intervención y mantenida de forma prolongada, combinado con clopidogrel desde 72 horas antes de la intervención y durante 12 meses, frente a AAS en monoterapia. Tras 12 meses de seguimiento se observó una reducción del 27% en la combinación de muerte, IAM o AVC (IC al 95% de 3.9 – 44.4). En un estudio observacional79 con 4.666 pacientes tratados con stent recubierto o con stent convencional, se evaluó el beneficio de prolongar el tratamiento con clopidogrel en ambos tipos de stent. Se observó que en los pacientes en los que se había implantado un stent no recubierto, el prolongar el tratamiento con clopidogrel no ejerció ninguna influencia sobre la incidencia de muerte o infarto entre los 6 y los 24 meses. Por el contrario, la prolongación de la doble antiagregación sí redujo la incidencia de muerte o infarto durante este tiempo en los pacientes tratados con stents recubiertos. No obstante se concluye que para determinar la duración más apropiada serán necesarios ensayos clínicos aleatorizados. NUEVOS ANTIAGREGANTES EN PACIENTES CON SCA SOMETIDOS A ICP: PRASUGREL Se debe iniciar el tratamiento con prasugrel con una dosis única de carga de 60 mg y posteriormente se continúa con 10 mg una vez al día durante 12 meses en combinación con AAS indefinidamente a dosis entre 75-­‐325 mg día en pacientes con SCACEST y SCASEST sometidos a ICP primaria o programada. (GRADE: RECOMENDACIÓN FUERTE, NIVEL DE EVIDENCIA B) Antiagregación en Atención Primaria Página 25 El prasugrel es, como el clopidogrel, una tienopiridina con igual mecanismo de acción, pero con un efecto antiagregante más potente, más consistente y de inicio más rápido. Prasugrel ha sido aprobado por la FDA, la EMEA y AEMPS en 2009 para su administración, junto con AAS, en la prevención de eventos aterotrombóticos en pacientes con SCA sometidos ICP primaria o aplazada80. Se ha establecido que la administración de prasugrel en pacientes con SCA sometidos a ICP primaria o programada, y mantenido durante 12 meses en combinación con AAS de forma indefinida, consigue una reducción significativa del objetivo primario de eficacia compuesto (muerte por causa cardiovascular, infarto de miocardio no fatal o accidente cerebrovascular no fatal. En las Guías de Práctica Clínica del ACC/AHA de 2009 para el manejo de pacientes con SCA ya recomiendan el uso de prasugrel en los pacientes que van a ser sometidos a ICP primaria o programada81 El ensayo clínico en el que se basó la autorización fue el TRITON-­‐TIMI 3882, un estudio multicéntrico randomizado con 13.608 pacientes con SCA de riesgo moderado-­‐alto (10.074 con SCASEST y 3.534 con SCACEST) con intervencionismo coronario programado y asignados a aspirina más una dosis de carga de 60 mg de prasugrel seguida de 10 mg/día (n = 6.813) o 300 mg de clopidogrel seguidos de 75 mg/día (n = 6.795). El objetivo primario de eficacia se compuso de muerte por causa cardiovascular, infarto de miocardio no fatal o accidente cerebrovascular no fatal, y se redujo significativamente con prasugrel (9,9%) con respecto a clopidogrel (12,1%) (OR = 0,81; IC del 95%, 0,73 a 0,9; p < 0,001) tanto en los pacientes con SCASEST como en los SCACEST. La reducción del objetivo compuesto se debió exclusivamente a una reducción de los infartos (el 7,3 frente al 9,5%; OR = 0,76; IC del 95%, 0,67a 0,85; p < 0,001), y la disminución del número de infartos fue una traducción de una menor tasa de trombosis del stent en el grupo de prasugrel (el 1,1 y el 2,4%; OR = 0,48; IC del 95%, 0,36 a 0,64; p < 0,001). RIESGOS Sin embargo, y a pesar de haber excluido los pacientes con alto riesgo de sangrado, prasugrel incrementó en un 50% el riesgo de hemorragia grave y 4 veces el riesgo de hemorragia mortal. Debido a la discordancia hallada entre eficacia clínica (favorable al prasugrel) y eventos hemorrágicos (favorable al clopidogrel), los investigadores realizaron varios análisis post-­‐hoc a fin de identificar subgrupos que no hubieran tenido beneficio clínico neto con prasugrel, o que hubieran mostrado perjuicio83. Se hallaron tres grupos de interés: los pacientes mayores a 75 años y aquellos de menos de 60 kg de peso no obtuvieron beneficio clínico neto con prasugrel; y los pacientes con antecedentes de ACV o ataque cerebral transitorio (TIA) tuvieron perjuicio con esta droga. El mayor beneficio se observó en los pacientes que no mostraban ninguna de las tres características citadas (añosos, de bajo peso ni antecedentes de ACV –AIT), con menores eventos isquémicos y diferencias no significativas de sangrado mayor (HR 0,80, p Antiagregación en Atención Primaria Página 26 <0,001). No obstante, hay una serie de subgrupos de población que podrían beneficiarse: diabéticos, pacientes en tratamiento con clopidogrel que presentan trombosis del stent (con “resistencia” a clopidogrel), y pacientes con SCACEST en los que es necesaria una ICP inmediata, siempre que pesen más de 60 kg y sean menores de 75 años. La guía NICE estableció dichas recomendaciones para el uso de prasugrel.84,85,86, 87 Un artículo ha sido publicado recientemente sobre prasugrel y su posible riesgo aumentado de cáncer88. También en el informe inicial publicado del TRITON-­‐TIMI 38 mencionaba brevemente un incremento estadísticamente significativo de cáncer de colon en los pacientes con prasugrel en comparación con los que recibieron clopidogrel (13 vs 4 pacientes; p= 0,03). Sin embargo, los autores del presente artículo recogen y estudian los datos de un análisis más detallado del TRITON-­‐TIMI 38, realizado posteriormente por la FDA, que reveló un incremento en múltiples tipos de tumores sólidos en los pacientes con prasugrel. Para finalizar, los autores señalan que habrá que esperar a ver los resultados del ensayo TRILOGY-­‐ACS (prasugrel vs clopidogrel en pacientes con síndrome coronario agudo), ensayo al que la FDA le ha encargado que registre los casos de cáncer (previo y durante el estudio). Hasta que esta información esté disponible recomiendan que los médicos consideren el riesgo potencial de cáncer antes de prescribir prasugrel, especialmente para uso prolongado y en pacientes que hayan padecido cáncer. Antiagregación en Atención Primaria Página 27 TRATAMIENTO ANTIAGREGANTE EN LA PREVENCION SECUNDARIA EN EL ACCIDENTE VASCULAR CEREBRAL (ACVA). Manuela de Vicente††† , Carlos Fluixá Carrascosa‡‡‡ Los pacientes que han sufrido un ACVA deben recibir de forma continuada AAS a dosis entre 50 y 325 mg/día en monoterapia (GRADE: RECOMENDACIÓN FUERTE, NIVEL DE EVIDENCIA A) La combinación de AAS (75 mg) y dipiridamol de liberación prolongada (200 mg) dos veces al día (GRADE: RECOMENDACIÓN FUERTE, NIVEL DE EVIDENCIA B), el clopidogrel 75 mg diarios (GRADE: RECOMENDACIÓN FUERTE, NIVEL DE EVIDENCIA B), o el trifusal 600 mg al día (GRADE: RECOMENDACIÓN FUERTE, NIVEL DE EVIDENCIA B) pueden ser otras alternativas al AAS. En pacientes alérgicos al AAS, se recomienda el empleo de clopidogrel. (GRADE: RECOMENDACIÓN FUERTE, NIVEL DE EVIDENCIA C) El ACV (accidente cerebro vascular), supone un importante problema de salud debido a su elevada prevalencia, a la discapacidad y alteración en la calidad de vida que genera y muerte en muchos casos. Lo que hace que su tratamiento y prevención sean una prioridad. El origen es múltiple, pero el proceso patológico subyacente en la mayoría de los casos es la enfermedad aterotrombótica. Se entiende por aterotrombosis la formación de un trombo sobre una ateroesclerosis previa; es bien conocido el papel que desempeñan las plaquetas en la fisiopatología de la trombosis, por lo que los fármacos antiagregantes constituyen una parte esencial en el manejo de las complicaciones cardiovasculares. Al contrario que ocurre en la prevención primaria, en la prevención secundaria la indicación está más establecida. ††† Médico de Familia, Centro de Salud de Paterna ‡‡‡ Médico de Familia, Centro de Salud de Benimaclet Antiagregación en Atención Primaria Página 28 En el análisis de subgrupos de pacientes con ictus del metanálisis ATC, el tratamiento con AAS redujo de forma significativa un 22% la tasa global de eventos cardiovasculares (17,8% contra 21,4%, OR 0.78, IC 95% 0.73 a 0.85 P< 0,002) De tal forma que por cada 1000 personas con un ACVA previo tratados con antiagregantes frente a placebo durante 2 años evitaremos 25 nuevos ACVAs no mortales, 6 Infartos de miocardio (IMA) no mortales y 15 muertes. A cambio se incrementa en casi el doble el riesgo de sufrir una complicación hemorrágica, pero en cualquier caso los beneficios obtenidos con la terapia antiagregante sobrepasan con creces las complicaciones, hemorragia gastrointestinal e ictus hemorrágico89. La evidencia disponible sugiere que la dosificación de AAS debe individualizarse en cada paciente según la indicación del tratamiento. En una revisión reciente de la evidencia, los autores elaboran una tabla con la dosis mínima eficaz en cada una de las situaciones, siendo de 50-­‐325 mg/día para la prevención secundaria y de 325 mg/día para la fase aguda90,91 El ensayo CAPRIE16, que se realizó con más de 19.000 pacientes con enfermedad arterioesclerótica vascular (ictus isquémico reciente, IAM reciente o enfermedad periférica arterial sintomática), concluye que en pacientes con ictus isquémico no hay diferencias entre el tratamiento con clopidogrel a dosis de 75 mg y AAS dosis de 325 mg para reducir el riesgo de ACVA, IMA y muerte vascular. Los efectos adversos fueron parecidos y la tolerancia gastrointestinal mejor para el clopidogrel. Para pacientes con alergia a la aspirina está indicado clopidogrel92 Una revisión sistemática reciente (4 ensayos clínicos, 2.994 pacientes) no mostró diferencias entre el tratamiento con trifusal y AAS (>300 mg/día) para la prevención secundaria del ACVA Y AIT (accidente isquémico transitorio), mostrándose superior al AAS para la recurrencia de episodios fatales; el riesgo de episodios hemorrágicos, incluidos los graves, fue inferior para el trifusal, con una reducción absoluta del 1.7%93 La adición de los resultados del estudio ESPRIT94 al meta análisis95 de estudios previos, concluye que la asociación de AAS 75 mg ( rango 30-­‐325 mg) y dipiridamol de liberación sostenida (200 mg), tiene una eficacia adicional si se compara con la monoterapia de AAS dosis 75 mg (rango 30-­‐325 mg ) en pacientes con antecedentes de de ictus menor de origen arterial o accidente isquémico transitorio en los 6 meses previos, resultando una reducción del riesgo de eventos compuesto de muerte vascular, infarto de miocardio, enfermedad vascular cerebral de 0.82 (I.C, 95% , 95% CI., 0,74a0,91). La combinación de AAS o dipiridamol de acción retardada, no es tan bien tolerada como la AAS sola, así hubo un 31 % de abandonos en el estudio en los que tomaban la terapia combinada frente a la AAS; más del 40% de los pacientes sufrieron cefalea y ocasionaron el abandono en un 10%. Una reducción inicial de la dosis de AAS y dipiridamol de liberación retardada disminuye la severidad de la cefalea y mejora la tolerancia del tratamiento. Antiagregación en Atención Primaria Página 29 La terapia combinada de AAS y clopidogrel no es más eficaz que el tratamiento en monoterapia como se demuestra en el estudio MATCH96 y CARISMA97, pero si aumenta la frecuencia de sangrado moderado o potencialmente letal. Tanto la terapia con AAS más dipiridamol de acción prolongada como con clopidogrel en pacientes con ACVA no cardioembólica, el riesgo de recurrencia en ACVA y el riesgo compuesto de ACVA, infarto de miocardio y muerte por causas vasculares son similares como demuestra el estudio PROGRESS98. Antiagregación en Atención Primaria Página 30 TRATAMIENTO ANTITROMBÓTICO EN LA FIBRILACIÓN AURICULAR Victoria Gosalbes Soler§§§ , Patricia Montoya Lapuente **** Todo paciente con FA y CHA2DS2-­‐VASc ≥ 2, debe recibir tratamiento anticoagulante con antagonistas de la vitamina K con el objetivo de INR de 2,5. (GRADE: RECOMENDACIÓN FUERTE, NIVEL DE EVIDENCIA A) Pacientes con CHA2DS2-­‐VASc ≥ 2, y contraindicación del uso de anticoagulantes la alternativa es el tratamiento con AAS más clopidogrel. (GRADE: RECOMENDACIÓN DEBIL, NIVEL DE EVIDENCIA B) Pacientes con CHA2DS2-­‐VASc ≥ 2, y contraindicación del uso de antagonistas de la vitamina K o dificultad para el control del INR, y en ausencia de Insuficiencia Renal avanzada o hepatopatía, el dabigatran es una alternativa razonable. (GRADE: RECOMENDACIÓN DEBIL, NIVEL DE EVIDENCIA B) La fibrilación auricular (FA) es uno de los factores de riesgo de ictus isquémico más prevalente en los hombres y mujeres mayores de 65 años. Siendo especialmente frecuente entre los pacientes mayores de 80 años (presente en el 46% de los varones y el 52% de las mujeres)99. Dada la alta prevalencia de fibrilación auricular, el manejo adecuado del tratamiento antitrombótico en estos pacientes debería ser objetivo prioritario en la prevención de las enfermedades cerebrovasculares (ACV), especialmente en los pacientes de edad avanzada. ESTRATIFICACION DEL RIESGO Diferentes factores, tales como antecedentes de ictus previo, edad, hipertensión, diabetes, género, enfermedad estructural cardiaca y presencia de disfunción ventricular izquierda100,101 se han asociado con mayor riesgo de ictus isquémico en pacientes con FA no valvular. La identificación de estos factores ha dado lugar a la elaboración de diferentes escalas de riesgo102 siendo, la más utilizada el CHADS2 score (tabla 1). La mayoría de estas escalas clasifican a los pacientes como de bajo, intermedio y alto riesgo, recomendando diferentes estrategias preventivas según el nivel del riesgo. §§§ Médico de familia, Centro de Salud Salvador Pau, **** Médico de familia, Centro de Salud de Teulada-­‐Moraira Antiagregación en Atención Primaria Página 31 Criterios de riesgo CHADS2 Puntuación C: Insuficiencia cardiaca 1 H: Hipertensión 1 A: Edad >75 años 1 D: Diabetes mellitus 1 S: ACV 2 Tabla 1. Escala CHADS2 Sin embargo la última Guía Europea para el manejo de la FA103 resta protagonismo a las escalas basadas en la estratificación del riesgo como bajo, medio o alto, debido al bajo valor predictivo que presentan estas escalas, de forma que reconocen el riesgo como un continuo, recomendando un enfoque basado en la presencia o ausencia de determinados factores de riesgo, como la escala CHA2DS2VASC 104 (tabla 2). El riesgo se calcula sumando 1 punto por cada factor de riesgo, excepto para los antecedentes de ICTUS y edad ≥ 75 años que suman puntos 2. Antiagregación en Atención Primaria Página 32 FACTORES DE RIESGO DE ICTUS Y TROMBOEMBOLISMO EN FA NO VALVULAR FACTORES DE RIESGO MAYORES FACTORES DE RELEVANTES RIESGO CLINICAMENTE • Ictus prévio, accidentes cerebral transitorio • Insuficiencia cardiaca o disfunción ventricular o tromboembolismo sistémico. izquierda moderada a severa (FEV≤ 40%) • Edad ≥ 75 años • Hipertensión • Diabetes mellitus • Género femenino • Edad 65-­‐74 años • Enfermedad vascular (cardiopatía isquémica previa, arteriopatía periférica o estenosis carotidea) Puntuación según factores de riesgo CHA2DS2-­‐VASc Puntuación Congestive heart failure/ LV dysfunction. Insuficiencia cardiaca 1 Hypertension. Hipertensión 1 Age≥75. Edad≥ 75 2 Diabetes mellitus. Diabetes 1 Stroke/TIA/TE. Ictus previo, accidentes cerebrales transitorios o 2 tromboembolismo sistémico. Vascular disease Enfermedad vascular (cardiopatía isquémica previa, 1 arteriopatía periférica o estenosis carotidea) Age 65-­‐74. Edad 65-­‐74 años 1 Sex. Género femenino 1 Tabla 2. Escala CHA2DS2-­‐VASC Antiagregación en Atención Primaria Página 33 En resumen la escala CHADS2 de estratificación de riesgo de ACV podría ser útil como herramienta inicial simple, y fácil de recordar, en la evaluación de riesgo de ACV. La anticoagulación oral estaría indicada en aquellos pacientes con una puntuación ≥ 2. En aquellos pacientes con puntuación de 0 y 1, estaría indicada una evaluación más detallada basándonos en el enfoque de factores de riesgo del CHA2DS2-­‐VASc, estando indicado el tratamiento con anticoagulantes orales si la puntuación en ≥2. En cualquier caso siempre que se considere la anticoagulación oral, es necesario tomar una decisión compartida con el propio paciente, evaluando el riesgo de ACV, de complicaciones hemorrágicas y la posibilidad de mantener de forma segura la anticoagulación. TRATAMIENTO ANTITROMBÓTICO Anticoagulación oral con antagonistas de la vitamina K versus placebo La anticoagulación oral con antagonistas de la vitamina K ha demostrado, en diversos metanálisis, producir unas disminución tanto de los accidentes cerebrovasculares como de todas las causas de mortalidad total (RR 26%)105,106 siendo bajo el riesgo de hemorragia extracraneal. Es por ello que el tratamiento anticoagulante debe considerarse en todo paciente con 1 o más factores de riesgo, si no existen contraindicaciones. El valor recomendado de INR (cociente entre el tiempo de protrombina actual y el obtenido de un suero control estandarizado) óptimo es 2.5, siendo el intervalo terapéutico recomendado entre 2-­‐3. Anticoagulación oral con antagonistas de la vitamina K versus tratamiento antiagregante La comparación entre anticoagulación oral y tratamiento antiagregante con AAS realizada en 9 ensayos clínicos ha demostrado un mayor efecto de la anticoagulación oral (RR 39%)105, 106 Por otra parte el estudio ACTIVE-­‐W107 compara clopidogrel+AAS con anticoagulación oral en la prevención de eventos vasculares en pacientes con FA en pacientes con más de 2 factores de riesgo. Las variables resultado principales fueron ACV, embolismo sistémico, infarto de miocardio o muerte vascular. Siendo mayor el riesgo en el grupo de antiagregantes (RR 1.44, IC95% 1.18 a 1.76). Los efectos secundarios fueron similares en ambos grupos. Tratamiento antiagregante versus placebo Diferentes ensayos clínicos han comparado la eficacia del tratamiento antiagregante, principalmente la AAS, en la prevención de los accidentes cerebrovasculares en pacientes con FA. Los estudios que analizan la utilización de AAS frente placebo105,108 no han demostrado beneficios del tratamiento con AAS frente a placebo en la reducción de ictus isquémicos. Así mismo en el estudio ACTIVE-­‐A109 se comparó el efecto del clopidogrel más AAS frente a AAS sola, en la reducción del riesgo vascular, en pacientes con FA y en los que no era posible la anticoagulación oral. La variable resultado principal fue el combinado de ACV, embolismo Antiagregación en Atención Primaria Página 34 sistémico, infarto de miocardio o muerte vascular. Observándose una reducción del riesgo vascular en los pacientes del grupo de clopidogrel (RR 0.89, IC95% 0.81 a 0.98) principalmente por disminución del ACV (RR 0.72, IC95% 0.62 a 0.83). Así mismo se observo un mayor riesgo de hemorragias. Así pues la AHA en su actualización del 2011110 recomienda el tratamiento con AAS + clopidogrel en aquellos pacientes en los que la anticoagulación no sea posible. Anticoagulación oral con antagonistas de la vitamina K versus anticoagulantes inhibidores de la trombina El estudio RE-­‐LY111 estudia el efecto de la anticoagulación oral con warfarina frente a dosis fijas (110 y 150 mgrs. c/12h) de dabigatran en 18.113 pacientes con FA no valvular y al menos un factor de riesgo de ACV, excluyéndose pacientes con prótesis valvulares o patología valvular hemodinámicamente significativa, ACV reciente, intervención quirúrgica planificada para los 3 próximos meses a la inclusión del estudio o durante el mes anterior, trasstornos hemorrágicos, hipertensión no controlada, necesidad de anticoagulación por otras patologías diferentes, FG <30 ml/min, enfermedad hepática activa o embarazo. Las variables principales fueron ACV o embolismo sistémico y como variables de seguridad se incluyeron hemorragias, alteraciones hepáticas y otros efectos secundarios. La incidencia de ACV con dosis de 110 mg c/12h de dabigatran fueron similares a anticoagulación, pero con una reducción del 20% de hemorragias mayores. A dosis de 150mg c/12h se observó una reducción de los ACV (RR 0.65, IC95% 0.52 a 0.81), presentando similar incidencia de hemorragias a estas dosis. En actualización del 2011 la guía de la AHA112 sobre FA recomienda la utilización del dabigatran en la prevención de AVC y embolismo sistémico en pacientes con FA no valvular y factores de riesgo para ACV o embolismo sistémico, si no presentan Insuficiencia renal severa (FG<15 ml/min) o enfermedad hepática avanzada. Riesgo de hemorragia. Es importante valorar en todo paciente el riesgo de hemorragia tanto en el uso de anticoagulantes orales como el de antiagregantes. Existen varias clasificaciones del riesgo de hemorragia, la Sociedad Europea de Cardiología, recomienda la clasificación HAS-­‐BLED (acrónimo de las iniciales en inglés de: H hipertensión, A función renal o hepática, S de ACV, B sangrado, L INR lábil, E edad avanzada [>65 años], D fármacos o alcohol), dando una puntuación de un punto a cada ítem, y uno o 2 puntos, al A función renal o hepática alterada (si presenta las dos 2) y al D si hay fármacos y alcohol (también 2 puntos, si están presentes ambos). Una puntuación ≥ 3 significa un riesgo elevado de sangrado, en estos pacientes se debe de tener especial precaución y hacer controles regulares una vez iniciado el tratamiento antitrombótico, ya sea con antagonistas de la Vitamina K o AAS. Antiagregación en Atención Primaria Página 35 H A S B L E D Característica Clínica Hipertensión Arterial (Hypertension) Alteración renal/ Hepática (Abnormal renal/ liver function) ACV (Stroke) Historia de Hemorragia (Bleeding) INR lábil (Labil INR) Edad avanzada >65 años (Elderly > 65 años) Fármacos o Alcohol (Drugs or alcohol) Puntuación 1 1 o 2 ( 1 punto por cada uno) 1 1 1 1 1 o 2 (1 punto por cada uno) Máximo 9 puntos Hipertensión Arterial se define como TAS>160 mmHg, Función renal alterada se define como la necesidad de Diálisis o Creatinina sérica ≥ 200 µmol/L, Función hepática alterada se refiere a enfermedad hepática crónica (por ejemplo cirrosis) o a daño hepático demostrable bioquímicamente (Bilirrubina mayor de 2 veces por encima del valor límite de la normalidad, GOT/GPT/FFAA elevadas más de 3 veces por encima del límite superior de normalidad), Hemorragia, hace referencia a historia previa de sangrado y/o predisposición de hemorragia, INR lábil indica INR inestable, elevado o que se encuentra <60% del tiempo en rango terapéutico, Fármacos/alcohol hace referencia al uso 113 concomitante de otros fármacos, alcohol, drogas de abuso,…. . Adaptado de Pisters et al . CONCLUSIONES: Todo paciente con FA y CHA2DS2-­‐VASc ≥ 2, debe recibir tratamiento anticoagulante con antagonistas de la vitamina K con el objetivo de INR de 2,5. (Calidad de la evidencia A; Fuerza de la recomendación: FUERTE). Pacientes con CHA2DS2-­‐VASc ≥ 2, y contraindicación del uso de anticoagulantes la alternativa es el tratamiento con AAS más clopidogrel. (Calidad de la evidencia B; Fuerza de la recomendación: DEBIL) Pacientes con CHA2DS2-­‐VASc ≥ 2, y contraindicación del uso de antagonistas de la vitamina K o dificultad para el control del INR, y en ausencia de Insuficiencia Renal avanzada o hepatopatía se recomienda el empleo el dabigatran. (Calidad de la evidencia A; Fuerza de la recomendación:FUERTE) Antiagregación en Atención Primaria Página 36 ANTIAGREGANTES Y CIRUGIA Antonio Fornos Garrigós†††† , Pilar Botija Yagüe‡‡‡‡ El número de pacientes tratados con antiagregantes se ha incrementado de forma significativa a lo largo de los últimos años. El aumento de las indicaciones de los mismos junto con el crecimiento de las intervenciones coronarias percutáneas, especialmente la implantación de stents, son los principales responsables de este incremento en el número de personas en tratamiento con antiagregantes: aspirina, trifusal, dipiridamol, clopidogrel o ticlopidina . Además estos pacientes pueden estar recibiendo diferentes regímenes de tratamiento: aspirina (AAS) sola, clopidogrel solo, una combinación de ambos, o incluso, aunque en número muy pequeño de pacientes, combinaciones de antiagregantes con anticoagulantes orales. Muchos de estos pacientes deberán someterse a una intervención quirúrgica o a diferentes procedimientos invasivos y deberemos valorar si suspender el tratamiento antiagregante con el incremento del riesgo de trombosis que esto conlleva, o por el contrario aumentar el riesgo de padecer una complicación hemorrágica durante la intervención. Esta decisión deberemos basarla en el balance entre el riesgo de trombosis y riesgo de sangrado durante el procedimiento. Las evidencias disponibles sobre este campo provienen en su gran mayoría de estudios observacionales y han servido para elaborar las recomendaciones del American College of Chest Physicians114 que recogemos en este capítulo. RIESGO DE SANGRADO La aspirina inhibe de forma irreversible la enzima COX1 lo que se traduce en una disminución de la agregación de las plaquetas que se mantiene durante toda la vida de las mismas. De forma similar, el clopidogrel inhibe de forma irreversible la agregación plaquetaria en respuesta al ADP generado por las plaquetas activadas que también se mantiene a lo largo de la vida de las plaquetas. Ensayos en voluntarios sanos115,116 señalan que la actividad plaquetaria se recupera de forma completa a los 5-­‐6 días después de suspender el tratamiento con aspirina. Con el resto de antiagregantes disponemos de menor información. La retirada del tratamiento antiagregante produce un efecto rebote que conlleva un incremento de la agregación plaquetaria, lo que se traduce en un incremento del riesgo de padecer un evento trombótico. La retirada prematura del AAS multiplica por 3 el riesgo de padecer un evento cardiovascular, riesgo que se incrementa hasta 90 veces en los portadores de un stent coronario117. El intervalo que transcurre entre la retirada del fármaco y la aparición de un ictus es de 14,3 + -­‐ 11 días, de 8,5 +-­‐ 3,6 días para los síndromes coronarios agudos, y de 25,8 +-­‐ 18,1 días para los síndromes arteriales periféricos agudos118. †††† Médico de Familia, Centro de Salud de Picanya. ‡‡‡‡ Médico de Familia, Centro de Salud del Barrio del Cristo. Antiagregación en Atención Primaria Página 37 Algo similar ocurre con la retirada prematura del clopidogrel, que es el mejor predictor de trombosis del stent, especialmente en los recubiertos de fármacos. En estos pacientes, la discontinuación del tratamiento con clopidogrel durante el primer mes después de la implantación del mismo se asocia con un incremento de la mortalidad 10 veces superior a aquellos pacientes que continúan tomando el fármaco durante un año (7,5 % frente a 0,7 %, p < 0,0001)119 . La tasa de infartos de miocardio por trombosis del stent en pacientes intervenidos quirúrgicamente durante la fase de endotelización del mismo es del 35%, con una mortalidad entre el 20 y el 45%120, mientras que es inferior al 5% cuando se mantiene la terapia antiagregante dual (TAD) durante el periodo perioperatorio. Los pacientes pueden estratificarse en dos grandes grupos de riesgo: de bajo riesgo en los que la interrupción temporal de la terapia antiagregante no supone un incremento sustancial del riesgo de nuevos eventos cardiovasculares, incluye a los pacientes que toman AAS en prevención primaria, pacientes a los que se les ha implantado un stent no recubierto hace más de 6 semanas y aquellos que han sufrido un síndrome coronario agudo o un ictus hace más de 3 meses. Se consideran como de alto riesgo aquellos en los que se ha implantado un stent recubierto hace menos de 6 meses, los que han sufrido un ictus o un síndrome coronario hace menos de 3 meses o aquellos pacientes en los que concurren factores de riesgo adicionales: diabetes mellitus, fallo renal o estenosis en la bifurcación de las coronarias121. RIESGO DE SANGRADO Mantener el tratamiento con AAS durante la cirugía incrementa el riesgo de complicaciones hemorrágicas una media del 50 %, oscilando entre el 0 % en la escisión de lesiones dérmicas y el 75 % en la biopsia prostática transrectal, sin embargo estas complicaciones no se asocian con un incremento de la morbi-­‐mortalidad perioperatoria con la posible excepción de la cirugía intracraneal y la prostatectomía transuretral122. Aunque las evidencias que disponemos son de menor calidad las conclusiones son similares para la terapia con clopidogrel y la terapia dual. Los diferentes procedimientos quirúrgicos también presentan distintos riesgos de sangrado, ver Tabla 1. Antiagregación en Atención Primaria Página 38 Riesgo bajo • • • • • Riesgo Intermedio Artrocentesis • Procedimientos dentales • Procedimientos oftalmológicos. • R.T.U mediante láser Endoscopias alta y baja , • con o sin biopsia • • • • • • • • Angiografía coronaria con o sin ATPC Endoscopia alta con esfinterectomía Colonoscopia con polipectomía. Broncoscopia Biopsia prostática Cirugía abdominal y hemorroidal Dilatación y curetaje Cirugía de hidrocele Inserción de marcapasos o desfibrilador Endarterectomía o by-­‐pass carotídeo Cirugía oftalmológica no cataratas Múltiples extracciones dentales Riesgo Alto • • • • • • • Cirugía cardiaca Reparación aneurisma abdominal Neurocirugía Cirugía oncológica Prótesis de rodilla o cadera R.T.U próstata Biopsia renal Tabla 1: Clasificación del riesgo de sangrado de los diferentes procedimientos quirúrgicos. Antiagregación en Atención Primaria Página 39 RESUMEN DE RECOMENDACIONES114, 123 Nivel de Riesgo Cardiaco Riesgo de sangrado en la cirugía Riesgo Bajo Riesgo* Riesgo Alto** Intermedio ** Bajo riesgo + Suspender Cirugía programada: Cirugía antiagregante mantener aspirina. (Grade 1C) Mantener clopidogrel si Urgencia programada: posponer. está prescrito. posible quirúrgica: manteniendo aspirina y clopidogrel (Grade 2C) (Grade 1C) Riesgo intermedio ++ Suspender Cirugía programada: Cirugía antiagregante valorar balance (Grade 1C) programada: de posponer. riesgo. Urgencia Cirugía vital: realizarla Mantener aspirina. posible quirúrgica: manteniendo aspirina y clopidogrel (Grade 1C) (Grade 2C) Mantener clopidogrel si está prescrito. Riesgo alto +++ Suspender aspirina o Cirugía clopidogrel ( 5 días posponer. antes de la cirugía) (Grade 1C) Reintroducir dentro de las 24h después de la cirugía (Grade 1C) Antiagregación en Atención Primaria programada: Cirugía posponer. Cirugía vital: realizarla. Mantener aspirina. Cirugía vital o urgente: realizarla. Mantener aspirina (Grade 2C) Suspender clopidogrel 5 días antes de la cirugía. programada: Reintroducir Suspender clopidogrel 5 días antes de la cirugía (Grade 2C) Página 40 dentro de las 24 h siguientes a la cirugía. (Grade 2C) Tabla 2. Manejo preoperatorio en pacientes con antiagregantes en relación al Riesgo cardiaco y de sangrado. Grade: 1= recomendación fuerte, 2= recomendación débil. Modificada de: Guy Chassot P, Marcucci C Delabays A. Perioperative Antiplatelet Therapy. Am Fam Physician 2010; 82(12)1484-­‐89. * Más de 3 meses después ATPC, inserción de stent desnudo o by-­‐pass coronario ; más de 6 meses después de SCA o IM; más de 12 meses después de un stent recubierto. ** Entre 6 y 12 semanas después ATPC, inserción de stent desnudo o by-­‐pass coronario ; entre 6 y 24 semanas después de SCA o IM; más de 12 meses después de un stent recubierto de alto riesgo. ***Menos de 6 semanas después de ATPC, inserción de stent desnudo o by-­‐pass coronario, SCA, o IM (Al menos 3 meses si hay complicaciones); al menos 12 meses después de un stent recubierto, pudiendo ser mayor tiempo en casos de stent recubiertos de alto riesgo. Estas recomendaciones pueden ser modificadas teniendo en cuenta la extensión de miocardio afectado, la inestabilidad coronaria, o el riesgo espontáneo de hemorragia. Las mismas recomendaciones se aplican a la segunda generación de stent recubiertos. + Cirugía periférica y de pared, menor de ORL y ortopédicas, endoscopias sin biopsias o resección, cámara anterior del ojo, dentales. ++ Cirugía de vísceras o vascular, cirugía mayor de ORL y ortopedia, urología, endoscopias con biopsia o resección. +++Cirugía cardiaca; cirugía con sangrado masivo, cirugía en una cavidad cerrada (intracraneal, canal medular, cámara posterior del ojo). Nota: Cuando hablamos de suspender unificamos a 5 días previos a la intervención y reintroducción en las 24 horas siguientes. 124 Antiagregación en Atención Primaria Página 41 BIBLIOGRAFIA 1 Schulze H, Shivdasani RA. Mechanisms of thrombopoiesis. J Thromb Haemost 2005; 3: 1717–24 2 Cardellach F, Ausina V, Carmena R, Carreres A, Darnell A, Estapé J et al. Medicina Interna Farreras-Rozman. 16ª ed. Elsevier. Barcelona 2008 3 Florez J, Armijo JA, Mediavilla A, Amado JA, Arias JM, Ayesta FJ et al. Farmacología Clínica.3ª ed. Masson. Barcelona 1997. 4 Badimon L, Vilahur G. Enfermedad aterotrombótica coronaria: avances en el tratamiento antiplaquetario. Rev Esp Cardiol. 2008;61(5):501-13. 5 Angiolillo D, Ferreiro JL. Inhibición del receptor plaquetario P2Y12 de adenosina difosfato plaquetario: efectos beneficiosos y limitaciones de las estrategias terapéuticas actuales y perspectivas futuras. Rev Esp Cardiol. 2010;63(1):60-76. 6 Hirsh J, Dalen JE, Fuster V, Harker LB, Patrono C, Roth G. Aspirin and other platelet-active drugs. The relationship among dose, effectiveness, and side effects. Chest 1995; 108: 247S257S. 7 Patrono C. Aspirin as an antiplatelet drug. NewEngl J Med 1994; 330: 1287-94 8 Antitrombotic Trialist’ (ATT) Collaboration. Aspirin in the primary and secondary prevention of vascular disease: collaborative meta-analysis of individual participant data from randomized trials. Lancet. 2009 May 30; 373(9678): 1849–60. 9 Matías-Guiu J, Ferro JM, Alvarez-Sabín J, Torres F, Jiménez MD, Lago A. Comparison of triflusal and aspirin for prevention of vascular events in patients after cerebral infarction. The TACIP Study: A Randomized, Double-Blind, Multicenter Trial. Stroke 2003;34:840-48 10 Diener HC, Cunha L, Forbes C, Sivenius J, Smets P, Lowenthal A. European Stroke Prevention Study2: Dipyridamole and acetylsalicylic acid in the secondary prevention of stroke. J Neurol Sci1996; 143:1-13 11 Stewart K, Walters M, Dawson J. Clopidogrel and modified-release dipyridamole for the prevention of occlusive vascular events (NICE technology appraisal guidance 90). Heart. 2011 Apr;97(7):585-6. 12 Born G, Patrono C. Antiplatelet drugs. Br J Pharmacol. 2006 Jan;147 Suppl 1:S241-51 1 13 Gent M, Easton JD, Hachinski VC, Panak E, Sicurella J, Blakey JA, et al. The Canadian American ticlopidine study (CATS) in tromboembolic stroke. Lancet 1989, 1: 1215-20 14 Hass WK, Easton JD, Adams HP jr, Pryse-Phillips W, Molony BA, Anderson S et al. A randomized trial comparing ticlopidina hydrochloride with aspirin for the prevention of stroke in high-risk patients. Ticlopidine Aspirin Stroke Study Group. N Eng J Med. 1898 Aug 24;321(8): 1 501-7 15 Palomo I et al. Antiagregantes plaquetarios: mecanismos de acción y riesgos asociados al uso. Rev latinoam actual biomd.2008; 2:38-42 16 CAPRIE steering committee. A randomised, blinded, trial of clopidogrel versus aspirin in patients at risk of ischaemic events. Lancet. 1966;348:1329-39. 17 Norgard N, Mathews K, Wall G. Drug-drug interaction between clopidogrel and the proton pump inhibitors. Ann Pharmacother. 2009;43:1266—74. 18 Antman EM, Wiviott SD, Murphy SA, et al. Early and late benefits of prasugrel in patients with acute coronary syndromes undergoing percutaneous coronary intervention: A TRITON-TIMI 38 analysis. J Am Coll Cardiol. 2008;51:2028-33. 19 Husted S, Emanuelsson H, Heptinstall S, Sandset PM, Wickens M, Peters G. Pharmacodynamics, pharmacokinetics, and safety of the oral reversible P2Y12 antagonist Antiagregación en Atención Primaria Página 42 AZD6140 with aspirin in patients with atherosclerosis: A double-blind comparison to clopidogrel with aspirin. Eur Heart J. 2006;27(9):1038–1047 20 Wallentin L, Becker RC, Budaj A, Cannon CP, Emanuelsson H, Held C,et al. Ticagrelor versus clopidogrel in patients with acute coronary syndromes. N Engl J Med. 2009 Sep 10;361 (11):1045-57 21 Anderson SD, Shah NK, Yim J, Epstein BJ. Efficacy and safety of ticagrelor: a reversible P2Y12 receptor antagonist. Ann Pharmacother. 2010 Mar; 44(3):524-37. 22 Teng R, Butler K. Pharmacokinetics, pharmacodynamics, tolerability and safety of single ascending doses of ticagrelor, a reversibly binding oral P2Y(12) receptor antagonist, in healthy subjects.Eur J Clin Pharmacol. 2010 May;66(5):487-96. 23 Topol EJ, Lincoff AM, Kereiakes DJ, Kleiman NS, Cohen EA, Ferguson JJ, et al. Multi-year follow-up of abciximab therapy in three randomized, placebo-controlled trials of percutaneous coronary revascularization. Am J Med. 2002;113:1-6. 24 Dasgupta H BJ, Wood GC, Frey CM, Demko SL, Menapace FJ. Thrombocytopenia complicating treatment with intravenous glycoprotein IIb/IIIa receptor inhibitors: A pooled analysis. Am Heart J. 2000;140:206-11. 25 Carlos García R. Terapéutica con fármacos inhibidores de la agregación plaquetaria: implicaciones en la práctica anestésica y quirúrgica. Actual Med (2009);94(778):24-47 26 Ogawa H, Nakayama M, Morimoto T, Uemura S, Kanauchi M, Doi N et al. Low-dose aspirin for primary prevention of atherosclerotic events in patients with type 2 diabetes: a randomized controlled trial. JAMA 2008; 300: 2134-2141. 27 De Berardis G, Sacco M, Strippoli GF, Pellegrini F, Graziano G, Tognoni G et al. Aspirin for primary prevention of cardiovascular events in people with diabetes: meta-analysis of randomised controlled trials. BMJ 2009; 339: b4531. 28 Belch J, MacCuish A, Campbell I, Cobbe S, Taylor R, Prescott R et al. The prevention of progression of arterial disease and diabetes (POPADAD) trial: factorial randomised placebo controlled trial of aspirin and antioxidants in patients with diabetes and asymptomatic peripheral arterial disease. BMJ 2008; 337: a1840. 29 Peto R, Gray R, Collins R, wheatley K , Hennekens C, Jamrozik K, et al .Randomised trial of prophylactic daily aspirin in British male doctors. BMJ. 1998 ;296: 313-6. 30 Steering Committee for the Physicians´Health Study Research Group. Final report on the aspirin component of the ongoing Physicians´ Health Study . N Engl J Med. 1989;321 : 129-35. 31 The Medical Research Council´s General Practice Research Framework. Thrombosis prevention trial: randomized trial of low-intensity oral anticoagulation with warfarin and low-dose aspirin in the primary prevention of ischaemic heart disease in men at increased risk. Lancet 1998; 351:233-41. 32 Hansson I, Zanchetti A, Carruthers G, Dahlöf B, Elmfeldt D, Julius S, et al. Effects of intensive blood-pressure lowering and low-dose aspirin in patients with hypertension : principal results of the hypertension optimal treatment (HOT) randomized trial . HOT Study Group. Lancet. 1998; 351: 1755-62. 33 Collaborative Group of the Primary Prevention Project. Low-dose aspirin and vitamin E in people at cardiovascular risk : a randomized trial in general practice . Lancet . 2001;357:89-95. 34 Ridker PM, Cook NR, Lee IM , Gordon D, Gaziano JM , Manson JE, et al . A randomized trial of lowdose aspirin in the primary prevention of cardiovascular disease in women . N Engl J Med. 2005; 352:1293-304. 35 Ogawa H, Nakayama M, Morimoto T, Uemura S, Kanauchi M, Doi N,Jinnouchi H, Sugiyama S, Saito Y, Japanese Primary Prevention of Atherosclerosis With Aspirin for Diabetes (JPAD) Trial Investigators. Low-dose aspirin for primary prevention of atherosclerotic events in patients with type 2 diabetes: a randomized controlled trial. JAMA. 2008;300:2134–41. 36 Belch J, MacCuish A, Campbell I, Cobbe S, Taylor R, Prescott R, et al. The prevention of progression of arterial disease and diabetes (POPADAD) trial: factorial randomised placebo Antiagregación en Atención Primaria Página 43 controlled trial of aspirin and antioxidants in patients with diabetes and asymptomatic peripheral arterial disease. BMJ. 2008;337:a1840. 37 Aspirin effects on mortality and morbidity in patients with diabetes mellitus. Early treatment diabetic retinopathy study report 14. ETDRS Investigators. JAMA. 1992;268:1292–1300. 38 Pignone M, Alberts M, Colwell JA, Cushman M, Inzucchi S, Mukherjee D et al. Aspirin for Primary Prevention of Cardiovascular Events in People With Diabetes. A Position Statement of the American Diabetes Association, a Scientific Statement of the American Heart Association, and an Expert Consensus Document of the American College of Cardiology Foundation. Circulation. 2010;121:2694-2701 39 Zhang C, Sun A, Zhang P, Wu C, Zhang S, Fu M, et al . Aspirin for primary prevention of cardiovascular events in patients with diabetes: a meta-analysis . Diab Res Clin Pract.2010;87:211-8. 40 Calvin AD, Aggarwal NR, Murad MH, Shi Q, Elamin MB, Geske JB, et al. Aspirin for the primary prevention of cardiovascular events : a systematic review and meta-analysis comparing patients with and without diabetes. Diabetes Care. 2009;32:2300-6. 41 De Berardis G, Sacco M, Strrippoli GFM, Pellegrini F, Graziano G, Tognoni G, et al. Aspirin for primary prevention of cardiovascular events in people with diabetes : meta-analysis of randomized controlled trials. BMJ.2009;339:b4531. 42 Bundó M.; Pérez C.; Montero J.J.; Cobos M.D.; Aubá J.; Cabezas, C.; Arteriopatía periférica de extremidades inferiores y morbimortalidad en pacientes diabéticos tipo 2. Atención primaria 2006 ; 38(3) : 139-146. 43 Comas A, Rodríguez L, Esteban A, González-Nuevo JP, Alvarez M, García-Cañedo R, Valle A. Fiabilidad del índice Tobillo-brazo para el estudio de la arteriopatía periférica crónica de los miembros inferiores en atención primaria. Aten Primaria. 1999 Jan;23(1):47. 44 Murabito JM, D’Agostino RB, Silberschatz H, Wilson PWl. Intermittent claudication: a risk profile from the Framingham Heart Study. Circulation 1997;96:44–49. 45 Hiatt WR. Medical treatment of peripheral arterial disease and claudication. N Engl J Med 2001;344:1608–1621. 46 Collaborative overview of randomised trials of antiplatelet therapy-I: Prevention of death, myocardial infarction, and stroke by prolonged antiplatelet therapy in various categories of patients. Antiplatelet Trialists' Collaboration. BMJ. 1994 Jan 8;308(6921):81-106 47 Girolami B, Bernardi E, Prins MH, Wouter ten Cate JW, Prandoni P, Hettiarachchi R et al. Antithrombotic drugs in the primary medical management of intermittent claudication: a metaanalysis. Thromb Haemost. 1999 May;81(5):715-22. 48 Hirsch AT, Haskal ZJ, Hertzer NR, Bakal CW, Creager MA, Halperin JL et al. ACC/AHA 2005 Practice Guidelines for the management of patients with peripheral arterial disease (lower extremity, renal, mesenteric, and abdominal aortic). Circulation 2006;113(. M11):463-654. 49 Sobel M, Verhaeghe R. Antithrombotic therapy for peripheral artery occlusive disease. American College of chest physicians evidence-based clinical practice guidelines 8th Edition). Chest 2008; 133:815S-843S. 50 Dorffler-Melly J, Buller H, Koopman M, Adam D, Prins M. Antithrombotic agents for preventing thrombosis after peripheral bypass surgery. Cochrane Database Syst Rev. 2003: CD000536. 51 Division J.A , Durá R. Análisis de los ensayos clínicos y metaanálisis sobre antiagregación en prevención primaria. Med Clín Cursos (Barc).2011;3(1):11-20. 52 Fowkes F.G, Price JF, Stewart M, Buthcher I, Leng G, Pell A, Sndercock P et al. Aspirin for prevention of cardiovasclar Events in a General Population Screened for a Low Ankle Brachial Index. A randomized Controlled Trial. JAMA 2010;303(9):841-848. Antiagregación en Atención Primaria Página 44 53 Berger JS, Krantz MJ, Kittelson JM, Hiatt WR. Aspirin for the Prevention of Cardiovascular Events in Patients With Peripheral Artery Disease. A Meta-analysis of Randomized Trials. JAMA 2009;301(18):1909-1919. 54 Bell AD, Roussin A, Cartier R, Chan WS, Douketis JD, Gupta A et al; Canadian Cardiovascular Society. The use of antiplatelet therapy in the outpatient setting: Canadian Cardiovascular Society guidelines.Can J Cardiol. 2011 May-Jun;27 Suppl A:S1-59 55 American Heart Association. Heart disease and stroke statistics- 2004 update. 56 Juul-Möller S, Edvardsson N, Jahnmatz B, Rosén A, Sørensen S, Omblus R. Double-blind trial of aspirin in primary prevention of myocardial infarction in patients with stable chronic angina pectoris. The Swedish Angina Pectoris Aspirin Trial (SAPAT) Group.Lancet. 1992 Dec 12;340(8833):1421-5. 57 Ridker PM, Manson JE, Gaziano JM, Buring JE, Hennekens CH. Low-dose aspirin therapy for chronic stable angina. A randomized, placebo-controlled clinical trial. Ann Intern Med. 1991 May 15;114(10):835-9. 58 Anti-Platelet Trialists’ Collaboration. Collaborative overview of randomised trials of antiplatelet therapy-I: Prevention of death, myocardial infarction, and stroke by prolonged antiplatelet therapy in various categories of patients. Antiplatelet Trialists’ Collaboration. BMJ 1994; 308:81106 59 Pignone M, Rihal C, Ltd B. Secondary prevention of ischaemic cardiac events. En: Clin Evid 2003; 10: 188-230. 60 The Anturane Reinfarction Trial Research group. Sulfinpyrazone in the prevention of cardiac death after myocardial infarction: The Anturane Reionfarction Trial. N Engl J Med 1978; 289300. 61 Report from the The Anturane Reinfarction Italian Study. Sulfinpirazine in post myocardial infarction. Lancet 1982; 1: 237-48. 62 Klimt CR, Knatterud GL, Stamler J, Meier P. Persantine-Aspirin Reinfarction Study. Part II: Secondary coronary prevention with persantine and aspirin. J Am Coll Cardiol 1986; 7: 251-69. 63 Gent M, Blakely JA, Easton JD, Ellis DJ, Hachinski VC, Harbison JW et al. The Canadian American Ticlopidine Study (CATS) in thromboemlic stroke. Lancet 1989; 1: 1215-20. 64 Hass WK, Easton JD, Adams HP, Prysephillips W, Molony BA, Anderson S et al. Randomized trial comparing ticlopidine hydrichloride with aspirin for the presentation of stroke in high risk patients. N Engl J Med 1989; 321- 501-7. 65 Janzon L, Bergqvist D, Boberg J, Boberg M, Eriksson I, Lindgärde F et al. Prevention of myocardial infarction and stroke in patients with intermitent claudication; effects of ticlopidine: Results from STIMS, the Swedish Ticlopidine Multicenter Study. J Intern Med 1990; 227: 301-8. 66 Fiore LD, Ezekowitz MD, Brophy MT, Lu D, Sacco J, Peduzzi P et al, for the Combination Hemotherapy and Mortality Prevention (CHAMP) Study Group. Department of Veterans Affairs Cooperative Studies Program clinical trial comparing combined warfarin and aspirin with aspirin alone in survivors of acute myocardial infarction. Primary results of the CHAMP study. Circulation 2002; 105-: 557-63. 67 Annad SS, Yusuf S. Oral anticoagulation therapy in patients with coronary artery disease: a metanalisis. JAMA 1999;282: 2058-67. 68 Hurlen M, Abdelnoor M, Smith, P, Erikssen J, Arnesen, H. Warfarin, Aspirin, or Both after Myocardial Infarction. N. Engl J. Med, Vol 347 (13). September 26, 2002. 969-74. 69 Scottish Intercollegiate Guidelines Network (SIGN). Prophylaxis of venous thromboembolism. Edinburg: SIGN; 2002. (SIGN publication nº 62). 70 Derry S, Loke YK. Risk of gastointestinal hemorrhage with long-term use of aspirin: metaanalysis. BMJ 2000;321:1183-7. 71 Dyspepsia: Management of dyspepsia in adults in primary care. NICE clinical guidance 17 (2004). www.nice.org.uk/CG017. Antiagregación en Atención Primaria Página 45 72 The CURE Trial Investigators. Effects of Clopidogrel in Addition to Aspirin in Patients with Acute Coronary Syndromes without ST-Segment Elevation N Engl J Med 2001; 345(7): 494– 502. 73 Keller TT, Squizzato A, Middeldopr S. Clopidogrel plus Aspirin versus aspirin alone for preventing cardiovascular disease. Cochrane Database Syst Rev 2007; (3): CD005158 74 Chen ZM, Jiang LX, Chen YP, Xie JC, Pan HC et al. COMMIT collaborative group. Addition of clopidogrel to aspirin in 45,852 patients with acute myocardial infarction: randomised placebo-controlled trial. Lancet. 2005;366(9497):1607-21 75 Sabatine MS, Cannon CP, Gibson CM, Lopez-Sedón JL, Montalescot G et al. CLARITY-TIMI Investigators. Addition of clopidogrel to aspirin and fibrinolytic therapy for myocardial infarction with ST-segment elevation. N Engl J Med Mar 2005; 352 (12): 1179–89 76 Savage MP, Goldberg S, Bove AA, Deutsch E, Vetrovec G, et al. Effect of tromboxane A2 blockade on clinical outcome and restenosis after successful coronary angioplasty. MultiHospital Eastern Atlantic Restenosis Trial (M-HEART II). Circulation. 1995; 92: 3194-200. 77 Mehta SR, Yusuf S, Peters R, Bertrand ME, Lewis BS, et al. Effects of pretreatment with clopidogrel and aspirin followed by long-term therapy in patients undergoing percutaneous coronary intervention: the PCI-CURE study. Lancet 2001;358:527–33. 78 SteinhublSR, Berger PB, Mann 3rd JT et al. Early and sustained dual oral antiplatelet therapy following percutaneous coronary intervention: a randomized controlled trial. JAMA.2002;288:2411–2420 (Erratum JAMA 2003;289:987). 79 Eisenstein EL, Anstrom KJ, Kong DF, Shaw LK, Tuttle RH, et al. Clopidogrel Use and Longterm Clinical Outcomes After Drug-Eluting Stent Implantation. JAMA. 2007;297:159-168. 80 Baker WL, White CM. Role of Prasugrel, a Novel P2Y12 Receptor Antagonist, in the Management of Acute Coronary Syndromes. American Journal of Cardiovascular Drugs Aug 1, 2009; 9 (4): 213-229. 81 Kushner FG, Hand M, Smith SC Jr, et al. American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. 2009 Focused Updates: ACC/AHA Guidelines for the Management of Patients With ST-Elevation Myocardial Infarction (updating the 2004 Guideline and 2007 Focused Update) and ACC/AHA/SCAI Guidelines on Percutaneous Coronary Intervention (updating the 2005 Guideline and 2007 Focused Update): a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. Circulation. 2009 Dec 1;120(22):2271-306. Epub 2009 Nov 18. Erratum in: Circulation. 2010 Mar 30;121(12):e257. Disponible en: http://circ.ahajournals.org/cgi/reprint/CIRCULATIONAHA.109.192663 [acceso: 20/07/2010]. 82 Wiviott SD, Braunwald E, McCabe CH, et al. Prasugrel versus clopidogrel in patients with acute coronary syndromes. N Engl J Med. 2007;357:2001-15. 83 Antman EM, Wiviott SD, Murphy SA, et al. Early and late benefits of prasugrel in patients with acute coronary syndromes undergoing percutaneous coronary intervention: A TRITON-TIMI 38 analysis. J Am Coll Cardiol. 2008;51:2028-33. 84 National Institute for Health and Clinical Excellence. Prasugrel for the treatment of acute coronary syndromes with percutaneous coronary intervention. NICE technology appraisal guidance 182. Disponible en: http://guidance.nice.org.uk/TA182/Guidance/pdf/English [acceso: 20/07/2010] 85 Wiviott SD, Braunwald E, Angiolillo DJ et al. Greater clinical benefits of more intensive oral antiplatelet therapy with prasugrel in patients with diabetes mellitus in the TRITON-TIMI 38. Circulation. 2008;118:1626-36. 86 Wiviott SD, Braunwald E, McCabe CH, Horvath I, Keltai M, Herrmann JPR et al. Intensive oral platelet therapy for reduction of ischemic events including stent trombosis in patients with acute coronary síndromes treated with PCI and stenting in the TRITON-TIMI 38. Lancet. 2008;371:1353-63. Antiagregación en Atención Primaria Página 46 87 Montalescot G, Wiviott SD, Braunwald E, Murphy SA, Gibson CM, McCabe CH et al Prasugrel compared with clopidogrel in patients undergoing PCI for ST-elevation myocardial infarction (TRITON-TIMI 38). Lancet. 2009;373:723-31. 88 Floyd JS and Serebruany VN .Prasugrel as a Potential Cancer Promoter: Review of the Unpublished Data. Arch Intern Med.2010; 170: 1078-1080 89 Antithrombotic Trialist’s Collaboration. Collaborative meta-analisys of randomised trials of antiplatelet therapy for prevention of death, myocardial infarction, and stroke in high risk patients. BMJ 2002; 324: 71- 86. 90 Inzitari D, Piccardi B, Sarti C. A critical review of aspirin in the secondary prevention of noncardioembolic ischaemic stroke. Int J Stroke. 2010 Aug;5(4):306-18. 91 Diagnosis and initial management of acute stroke and transient ischemic attack (TIA). NICE clinical guideline 68 – Stroke 2008. 92 Guidelines for the prevention of stroke in patients with stroke or transient ischemic attack. A guideline for healthcare professionals from the American Heart Association/American Stroke Association. Stroke. 2011; 42:00-00. 93 Costa J, Ferro JM, Matías-Guiu J, Dominguez R, Alvarez-Sabín J, Torres F. Trifusal for preventing seriurs vascular events inpeople at hight risk. Cochrane Database of Systematic Reviews. 2005, Issue 3. Art, No: CD004296. 94 Halkes ph, van Gijn J, Kapelle LJ, Koudstaal PJ, Algra A; ESPIRIT Study Group Aspirin plus dipiridamole versus aspirin alone after cerebral ischaemia of arterial origin (SPIRIT): randomised controlled trial . Lancet 2006; 367: 1665-73. 95 Verro P, Gorelick PB, Nguyen d. Aspirin plus dipyridamole versus aspirin for prevention of vascular evens alter stroke or TIA: a meta-analysis. Stroke 2008; 39: 1358-63. 96 Diener HC, Bogousslavsky J, Brass LM , Cimminiello C, Csiba l, Kaste M, et al. MATCH investigators .Aspirin and clopidrogel compared with clopidrogel alone after recent ischaemic stroke or transient ischemic attack in high-risk patients ( MATCH ): randomised,double-blind , placebo-controlled trial. Lancet 2004; 364:331-7. 97 Bhatt DL, Fox KA, Hacke W, Berger PB, Black HR, Boden WE, et al Charisma Investigators. Clopidrogel and aspirin versus aspirin alone for the prevention of atherothrombotic events. N England j Med 2006; 354: 1706-17 98 PROGRESS Collaborative Group. Randomised trial of aperindopril-based blood-pressurelowering regimen among 6105 individuals with previous stroke or transient ischaemic attack. Lancet. 2001; 358:1033–1041. 99 Acha O, Hernández JL, Penado S, Cano M, Riancho JA. Factores de riesgo e ictus en pacientes de diferentes edades. Rev Clin Esp 2003;203(4):189-92. 100 Hughes M, Lip GY. Stroke and thromboembolism in atrial fibrillation: a systema- tic review of stroke risk factors, risk stratification schema and cost effectiveness data. Thromb Haemost 2008;99:295 – 304. 101 Stroke in AF working group. Independent predictors of stroke in patients with atrial fibrillation: a systematic review. Neurology 2007; 69: 546 – 554 102 Gage BF, Waterman AD, Shannon W, Boechler M, Rich MW, Radford MJ. Vali- dation of clinical classification schemes for predicting stroke: results from the National Registry of Atrial Fibrillation. JAMA 2001;285:2864 – 2870. 103 The Task Force for the Management of Atrial Fibrillation of the European Society of Cardiology (ESC). Guidelines for the management of atrial fibrillation. European Heart Journal (2010) 31, 2369–2429 doi:10.1093/eurheartj/ehq278. 104 Lip GY, Nieuwlaat R, Pisters R, Lane DA, Crijns HJ. Refining clinical risk stratifica- tion for predicting stroke and thromboembolism in atrial fibrillation using a novel risk factor-based approach: the Euro Heart Survey on atrial fibrillation. Chest 2010;137:263 – 272. Antiagregación en Atención Primaria Página 47 105 Hart RG, Pearce LA, Aguilar MI. Meta-analysis: antithrombotic therapy to prevent stroke in patients who have nonvalvular atrial fibrillation. Ann Intern Med 2007;146:857 – 867. 106 Aguilar MI, Hart R. Anticoagulantes orales para la prevención del accidente cerebrovascular en pacientes con fibrilación auricular no-valvular y sin antecedentes de accidente cerebrovascular o accidentes isquémicos transitorios (Revisión Cochrane traducida). En: La Biblioteca Cochrane Plus, 2008 Número 2. Oxford: Update Software Ltd. 107 Connolly S, Pogue J, Hart R, Pfeffer M, Hohnloser S, Chrolavicius S, Yusuf S. Clopidogrel plus aspirin versus oral anticoagulation for atrial fibrillation in the Atrial fibrillation Clopidogrel Trial with Irbesartan for prevention of Vascular Events (ACTIVE W): a andomised controlled trial. Lancet 2006; 367:1903 – 1912. 108 Aguilar M, Hart R. Tratamiento antiplaquetario para la prevención del accidente cerebrovascular en pacientes con fibrilación auricular no-valvular y ningún antecedente de accidente cerebrovascular o accidentes isquémicos transitorios (Revisión Cochrane traducida). En: La Biblioteca Cochrane Plus, 2008 Número 2. Oxford: Update Software Ltd. 109 Connolly SJ, Pogue J, Hart RG, et al. Effect of clopidogrel added to aspirin in patients with atrial fibrillation. N Engl J Med. 2009;360: 2066 –78. 110 Wann LS,. Curtis AB, January C, Ellenbogen A, Lowe J, Estes M, E. 2011 ACCF/AHA/HRS Focused Update on the Management of Patients With Atrial Fibrillation (Updating the 2006 Guideline): A Report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. Circulation 2011; 123: 104-123. DOI: 10.1161/CIR.0b013e3181fa3cf4 111 Connolly SJ, Ezekowitz MD, Yusuf S, et al. Dabigatran versus warfarin in patients with atrial fibrillation. N Engl J Med. 2009;361:1139–51. 112 Wann LS,. Curtis AB, Ellenbogen A, M Estes, Ezekowitz M, Jackman W, et als. ACCF/AHA/HRS Focused Update on the Management of Patients With Atrial Fibrillation (Update on Dabigatran): A Report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. Circulation 2011; 123: 1144-1150. DOI: 10.1161/CIR.0b013e31820f14c0 113 Pisters R, Lane DA, Nieuwlaat R, de Vos CB, Crijns HJ, Lip GY. A novel user friendly score (HAS-BLED) to assess one-year risk of major bleeding in atrial fibrillation patients: The Euro Heart Survey. Chest 2010; March 18 [Epubahead of print]. 114 Douketis JD, Berger PB, Dunn AS, Jaffer AK, Spyropulos AC, Becker RC, Ansell J. The perioperative management of antithrombotic therapy: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines (8th edition). Chest 2008; 133 (6th supl): 299S339S. 115 Cahill Ra, McGreak GT, Crowe BH, Manning BJ, Ryan DA, Cahill Mr. «Duration of increased bleeding tendency after cessation of aspirin therapy .» J Am Coll Sur, 2005: 200; 564-73. 116 Coleman JL, Alberts MJ. «Effect of aspirin dose, preparation and withdrawal on platelet response in normal volunteers.» Am J Cardiol, 2006; 98:838-41. 117 Anticoagulantes y Antigregantes en cirugía, ¿mantener o suspender? Información Farmacoterapeútica de la Comarca (Infac), 2009, Vol 17, nº 8. http://www.osanet.esukadi.net/cevime/es. 118 Burger W, Chemnitius JM, Kneissl GD, Rucker G. Low-dose aspirin for secondary cardiovascular prevention - cardiovascular risks after its perioperative withdrawal versus bleeding risks with its continuation - review and meta-analysis. J Intern Med 2005 May; 257(5):399-414. 119 Ong AT, McFadden EP, Regar E, de Jaegere PPT, van Domburg RT and SerruyLate PW. Angiographic Stent Thrombosis (LAST) Events With Drug-Eluting Stents. J. Am. Coll. Cardiol. 2005;45;2088-2092 Antiagregación en Atención Primaria Página 48 120 Kalllluza Gl, Joseph J, Lee JR, Raiznner ME, Raizner AE. Catastrophic outcomes of noncardiac surgery soon after coronary stenting. J Am Coll Cardiol 2000; 35:1288-94 121 Möllman H, Nef HM, Hamm CW. Antiplatet therapy during surgery. Heart 2010; 96:986-991 122 Agustí A, Lopez F. Antiagregantes orales en el perioperatorio, ¿mantener o retirar el tratamiento? Med Clin (Barc) 2007; 128 (17): 674-5. 123 Guy Chassot P, Marcucci C Delabays A. Perioperative Antiplatelet Therapy. Am Fam Physician 2010;82(12)1484-89. 124 Bertrand ME. When and how discontinue antiplatelet therapy . European Heart Journal Supplements (2008) 10 (Supplement A), A35-A41. Antiagregación en Atención Primaria Página 49