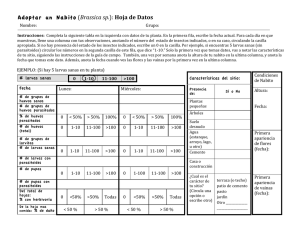
Microhimenópteros parasitoides de Trialeurodes vaporariorum
Anuncio

MICROHIMENÓPTEROS PARASITOIDES DE Trialeurodes vaporariorum (Westwood): IDENTIFICACIÓN, CARACTERIZACIÓN E INTERRELACIÓN CON PLANTAS HORTÍCOLAS Y MALEZAS ASOCIADAS DE LULES, TUCUMÁN Tesis para optar al grado de MAGÍSTER EN CIENCIAS AGRARIAS ORIENTACIÓN: PRODUCCIÓN SOSTENIBLE Tesista: Ing. Agr. Miriam Rosana Paz Director de Tesis: Ing. Agr. Ramón Vicente Fernández FACULTAD DE AGRONOMÍA Y ZOOTECNIA UNIVERSIDAD NACIONAL DE TUCUMÁN Paz, Miriam Rosana Microhimenópteros parasitoides de Trialeurodes vaporariorum Westwood : identificación, caracterización e interrelación con plantas hortícolas y malezas asociadas de Lules, Tucumán . - 1a ed. - Tucumán : Universidad Nacional de Tucumán, 2012. E-Book. ISBN 978-950-554-731-9 1. Entomología Agrícola. I. Título CDD 595.7 Fecha de catalogación: 02/05/2012 A mi esposo: Gustavo A mis hijos: Lautaro, Marianella, Leandro y Maia A mi amiga: Marcela AGRADECIMIENTOS Al Ing. Agr. Ramón Vicente Fernández, director de la tesis, por su enseñanza, apoyo, paciencia y confianza brindada durante la realización de la misma. A la Dra. María Virginia Colomo de Correa y al Dr. Enrique Gonzalez Olazo, por sus aportes, observaciones y correcciones. A la Dra. Marta Loiácono y a todo su equipo de trabajo, por su enseñanza, colaboración y buena disposición durante mi estadía como pasante del Museo de Ciencias Naturales de La Plata. Al M. Sc. Ing. Agr. Carlos López, por ayudarme en la interpretación y análisis estadísticos de los datos y tenerme tanta paciencia. A la Ing. Agr. Fátima Villagrán por ayudarme con la identificación de las malezas. A mi familia: mi esposo y mis hijos, que en todo momento me acompañaron y apoyaron, por la paciencia y los momentos que no pudimos compartir. A mis padres, que gracias a ellos estoy aquí cada día, realizándome como persona y como profesional. A mis compañeros y amigos de trabajo: Edgardo por los momentos compartidos en el campo y el laboratorio durante los muestreos y el acondicionamiento del material. Adriana y Lelia por ayudarme con los gráficos y figuras y darme animo cada vez que sentía que no iba a llegar. Ninich por los mates compartidos en el laboratorio. Los ayudantes estudiantiles: Viviana, Valeria, Francisco y Noelia por su colaboración permanente. A mis amigas: Mónica, Sofía, Ely, Mercedes, Vero, Marcela, Liliana, María, Ana, Claudia y Cristina que siempre me apoyaron y alentaron a seguir adelante. A la Facultad de Agronomía y Zootecnia y la Cátedra de Zoología Agrícola, por brindarme un lugar de trabajo. A los productores, que siempre me recibieron con buena disposición, durante los muestreos. A Marcela, que a pesar de no tenerte junto a mí, fuiste el motor de todo este ideal. A todas aquellas personas que de una u otra manera aportaron su ayuda en la realización de esta tesis. Paz, Miriam R; MICROHIMENÓPTEROS PARASITOIDES DE Trialeurodes vaporariorum (Westwood) … 1 /100 RESUMEN La “mosca blanca de los invernaderos”, Trialeurodes vaporariorum (Westwood), es una de las principales plagas en los cultivos hortícolas, ocasionando importantes daños económicos que van desde mermas de rendimiento hasta la pérdida total del cultivo. Uno de los requisitos básicos para la implementación de estrategias de manejo de plagas es el conocimiento de los factores de mortalidad y de las interrelaciones que se establecen entre los componentes del agroecosistema. Los objetivos de la presente tesis son: a) Identificar y caracterizar los microhimenópteros parasitoides de T. vaporariorum en los cultivos de tomate, pimiento, chaucha y malezas asociadas. b) Conocer posibles interrelaciones entre los parasitoides determinados y sus plantas hospederas. Las hipótesis de trabajo son: 1) En la región de estudio existe un complejo de parasitoides nativos y/o introducidos de T. vaporariorum, sobre tomate, pimiento, chaucha y malezas asociadas. 2) La planta hospedera influye en la elección del huésped (mosca blanca de los invernaderos) por parte de los parasitoides. Se realizaron muestreos periódicos quincenales en la localidad de San Isidro de Lules (Tucumán), a lo largo del ciclo de los cultivos durante los años 2002 y 2003. Las muestras consistían en hojas del tercio medio inferior de plantas de tomate, pimiento, chaucha y malezas asociadas, que presentaban pupas de T. vaporariorum con síntomas de parasitoidismo. Las mismas fueron acondicionadas en forma individual en tubos de vidrio y en un ambiente climatizado, para la obtención de los parasitoides adultos. Para la conservación e identificación de los parasitoides obtenidos se confeccionaron preparaciones microscópicas de tipo semipermanentes y se utilizaron claves taxonómicas y descripciones de diferentes autores, como así también estudios comparativos con especies ya identificadas y depositadas en el Museo de Ciencias Naturales de La Plata. Para estudiar la interrelación de la planta hospedera y los parasitoides se registró el número de pupas parasitoidizadas y no parasitoidizadas. Con estos datos se realizaron cálculos de prevalencia y selectividad de los parasitoides encontrados y un análisis estadístico aplicando un modelo de regresión logística. Se identificaron y caracterizaron en el agroecosistema de Lules, Tucumán sobre T. vaporariorum a ocho parasitoides: Encarsia desantisi Viggiani, E. formosa Gahan, E. hispida De Santis, E. inaron (Walker), E. nigricephala Dozier, E. Paz, Miriam R; MICROHIMENÓPTEROS PARASITOIDES DE Trialeurodes vaporariorum (Westwood) … 2 /100 pergandiella Howard, E. porteri (Mercet) y Eretmocerus paulistus Hempel (Aphelinidae) y al hiperparasitoide Signiphora townsendi Ashmead (Signiphoridae). A excepción de Encarsia formosa y E. porteri, las restantes especies son primeras citas para Argentina sobre T. vaporariorum. Encarsia pergandiella es la especie de mayor influencia y abundancia, siendo el controlador biológico más importante de T. vaporariorum en nuestro medio. Existe influencia de la planta hospedera sobre la selección del huésped (mosca blanca de los invernaderos) por parte de los parasitoides. La preferencia de E. pergandiella disminuye en forma decreciente desde el pimiento, al tomate y a la chaucha. La planta de “ruda” Ruta chalepensis L. presenta una gran riqueza de parasitoides de mosca blanca, lo que determinaría un gran aporte como reservorio de parasitoides hacia el agroecosistema hortícola. El rol de las malezas estudiadas en el mantenimiento de los parasitoides de la mosca blanca es escaso. Los resultados obtenidos hacen pensar en el potencial que se podría obtener con un manejo adecuado del cultivo tendiente a conservar la fauna auxiliar autóctona, mediante la implementación de programas de manejo integrado de problemas fitosanitarios en el marco de una agricultura sustentable. Paz, Miriam R; MICROHIMENÓPTEROS PARASITOIDES DE Trialeurodes vaporariorum (Westwood) … 3 /100 LISTA DE FIGURAS Gráfico 1- Evolución del consumo de productos fitosanitarios en la República Argentina en el período 1997 – 2007. Fuente CASAFE, 2007. Figura 1- Mapa de la República Argentina. Zonas de producción hortícola. Fuente SAGPyA, 2006. Figura 2- Ärea de estudio. Zonas de producción hortícola de las provincias de Jujuy, Salta y Tucumán. Fuente SAGPyA, 2006. Figura 3- Estados de desarrollo de Trialeurodes vaporariorum (Westwood.) A- Adulto. B- Huevos. C- Larvas. D- Pupas. Figura 4- Lycopersicon esculentum Mill y Phaseolus vulgaris L. A- y B- Plantas de tomate y chaucha dañadas por mosca blanca. C- y DHojas de tomate con pupas de T. vaporariorum (Westwood.) E- Hojas de chaucha con pupas de T. vaporariorum (Westwood.) Figura 5- Capsicum annum L. A- Plantas sanas de pimiento en invernadero. B- y C- Hojas de pimiento con fumagina. D- y E- Hojas de pimiento con pupas de T. vaporariorum (Westwood.) Figura 6- Aphelinidae: Coccophaginae. A- Cabeza vista de frente. B- Tórax visto desde arriba. C- Tórax visto de pérfil. Fuente De Santis, 1948a. Figura 7- Aphelinidae. A- Eretmocerus paulistus Hempel antena del macho. B- Encarsia sp. antena de la hembra. C- Encarsia sp. pata del segundo par. Fuente De Santis, 1948a. Figura 8- Aphelinidae. A- y B- Ala anterior. C- Ala posterior. Fuente De Santis, 1948a. Figura 9- Signiphora townsendi Ashmead. A- Antena del macho. B- Tarso medio del macho. C- Alas de la hembra. D- Macho. E- Hembra. Figura 10- Eretmocerus paulistus Hempel. A- Antena de la hembra. B- Antena del macho. C- Tarso medio. D- Macho. E- y F- Hembra. Paz, Miriam R; MICROHIMENÓPTEROS PARASITOIDES DE Trialeurodes vaporariorum (Westwood) … 4 /100 Figura 11- Encarsia nigricephala Dozier (Hembra). A- Antena. B- Alas y tarsos medio y posterior. C- Ala anterior. DMesoescudo con dos pares de setas. E- Adulto. Figura 12- Encarsia formosa Gahan (Hembra). A- y B- Adultos. C- Ala anterior. D- Antenas. E- Tarso medio y espolón de la tibia. Figura 13- Encarsia hispida De Santis (Hembra). A- Tarso medio. B- Ala anterior. C- Antena. D- Tórax (sensilias escutelares ampliamente separadas). E- Adulto. Figura 14- Encarsia desantisi Viggiani. A- Antena del macho. B- Antena de la hembra. C- Ala anterior del macho. D- Macho. E- Hembra. Figura 15- Encarsia pergandiella Howard. A- Tarsos medio y posterior. B- Ala anterior. C- Antenas de la hembra. DHembra. E- Macho. Figura 16- Encarsia inaron (Walker). A- Tarso medio. B- Ala anterior del macho. C- Antenas del macho. D- Hembra. E- Macho. Figura 17- Encarsia porteri (Mercet). A- Tarsos medio y posterior. B- Ala anterior. C- Tórax (sensilias escutelares ampliamente separadas). D- Hembra. Figura 18- Pupas de T. vaporariorum (Westwood) con síntomas de parasitoidismo. A- Encarsia formosa Gahan. B- E. pergandiella Howard. C- E. porteri (Mercet). D- Eretmocerus paulistus Hempel. E- y F- Puparios vacios. Tabla 5- Modelo de Regresión Logística (Afifi and Clark, 1999). Paz, Miriam R; MICROHIMENÓPTEROS PARASITOIDES DE Trialeurodes vaporariorum (Westwood) … 5 /100 1- INTRODUCCIÓN GENERAL Paz, Miriam R; MICROHIMENÓPTEROS PARASITOIDES DE Trialeurodes vaporariorum (Westwood) … 6 /100 1.1 El Control Natural de Plagas en la Agricultura Sustentable Después de la segunda guerra mundial, se produjo una verdadera revolución en la lucha contra las plagas, por la aparición de nuevos compuestos químicos de síntesis con propiedades biocidas y el desarrollo de mercados más exigentes en la calidad cosmética de los productos agrícolas, que en sus características nutricionales. A este proceso se lo conoció como “revolución verde” y se lo vio como una gran solución para el problema del hambre y la pobreza en el mundo (Chiappe, 2002). El modelo de la “revolución verde” se apoya en la tecnificación de las prácticas agrícolas, incrementando la producción de alimentos, mediante el uso de una gran dosis de insumos costosos, como los combustibles fósiles, los plaguicidas, los fertilizantes, las semillas híbridas y el riego, entre otros (Sarandón, 2002; Chiappe, 2002; Del Pino, 2002). En la Argentina el sector agropecuario emplea una variada gama de insumos naturales y sintéticos para aumentar la eficiencia productiva. La protección de los cultivos requiere la utilización de técnicas y productos fitosanitarios, como los plaguicidas químicos, siendo éstos la primera línea de defensa contra las plagas, malezas y enfermedades (Alvarado & Annone, 1999). Estas prácticas han provocado una serie de problemas ecológicos, sociales, culturales y económicos que afectan al agroecosistema y a otros sistemas como ciudades, ríos, lagos o personas (Kogan & Bajwa, 1999; Carballo & Ultrich, 2000; Sarandón, 2002; Chiappe, 2002). Así, por ejemplo, el mal uso de plaguicidas originó una gran cantidad de perjuicios como: La intoxicación plaguicidas a accidental los ocasionada trabajadores rurales por la (Greco manipulación et al., de 2002), distribuidores, personal de fábrica y almacenes. Según datos de PNUMA (1990) cada año un millón de personas en el mundo se intoxican por el uso y manipuleo de pesticidas y en nuestro país, por ejemplo, en la ciudad de La Plata, las intoxicaciones por el uso irracional de plaguicidas alcanzaron un 20% del registro de urgencias del Hospital de Niños de esa localidad (Botto, 1999). El peligro que puede causar su uso en la salud de los consumidores de productos vegetales tratados. Análisis efectuados por el laboratorio del Mercado Central de Buenos Aires durante los años 1988–89, mostraron que el 29,5 y el 14,2% de las muestras de papa y apio, presentaban restos de plaguicidas superiores a los niveles tolerables por lo que Paz, Miriam R; MICROHIMENÓPTEROS PARASITOIDES DE Trialeurodes vaporariorum (Westwood) … 7 /100 debieron ser considerados no aptos para el consumo (Limongelli et al., 1991). La contaminación con plaguicidas en cursos de agua como arroyos, lagos, ríos y embalses que son utilizados para agua de bebida o riego e incorporados en las cadenas alimenticias. La pérdida de eficiencia de los insecticidas debido al desarrollo de resistencia por parte de las especies plagas. Esto provoca el uso de nuevos productos químicos y/o mayores dosis a intervalos más cortos para obtener un mismo resultado (Sarandón, 2002; Greco et al., 2002). Una prueba de ello es que el uso de insecticidas y herbicidas han aumentado sustancialmente en la Argentina en los últimos años, mostrando una tendencia preocupante como se puede apreciar en el gráfico 1 del anexo (CASAFE, 2007). La eliminación de enemigos naturales y la probabilidad de aparición de nuevas plagas debido a una drástica disminución de la resistencia ambiental. Los enemigos naturales son individuos más susceptibles a la acción de plaguicidas que las plagas a controlar porque se mueven más y están más expuestos, desarrollan resistencia más lentamente, carecen de enzimas capaces de desintoxicarlos (Greco et al., 2002). Si bien en la Argentina la magnitud del uso de plaguicidas hasta ahora ha sido sensiblemente inferior al de países más avanzados, no se descarta que su inadecuado manejo resulte en el mediano plazo un problema, que puede alcanzar características irreversibles o difíciles de corregir (Alvarado & Annone, 1999). Por estas razones se hace imprescindible favorecer el mantenimiento y el aumento de la productividad de los sistemas agropecuarios, junto con la conservación de los recursos naturales. Así surge desde principios de los años ´80 una nueva corriente denominada agricultura sustentable, a la cual se la puede definir como “una agricultura económicamente viable, suficientemente productiva, que conserve la base de los recursos naturales y preserve la integridad del ambiente en el ámbito local, regional y global” (Sarandón & Sarandón, 1993). Tal vez una de las definiciones más conocidas sea la acuñada en 1987 por la Comisión Mundial de Medio Ambiente y Desarrollo de las Naciones Unidas, más conocida comúnmente como Comisión Brundtland, según la cual “el desarrollo sustentable es aquel que permite la satisfacción de las necesidades de las generaciones presentes sin comprometer la posibilidad de satisfacer las necesidades de las generaciones futuras” (WCED, 1987). Paz, Miriam R; MICROHIMENÓPTEROS PARASITOIDES DE Trialeurodes vaporariorum (Westwood) … 8 /100 Esta nueva agricultura requiere, un mayor y mejor conocimiento de los componentes del agroecosistema y de las interrelaciones entre ellos. Sin embargo, tradicionalmente se ha orientado la investigación y la enseñanza, hacia una agricultura de altos insumos, intensiva en capitales y tecnología, enfocando a los componentes individuales (cultivo, maleza, plaga o nutriente) y no al sistema ecológico sobre el cual se aplican estas tecnologías (Altieri, 1991). En este nuevo enfoque de protección vegetal basado en criterios ecológicos y económicos, el Manejo Integrado de Problemas Fitosanitarios (MIPF) es la filosofía más adecuada para resolver los problemas de la sanidad de los cultivos y la más compatible con la agricultura sustentable (Sarandón & Sarandón, 1993; Alcázar et al., 2000; Altieri, 2002; Greco et al., 2002). El MIPF apunta a disminuir la dependencia en el uso de agroquímicos y a hacer un mejor aprovechamiento de los recursos del sistema. Favorece la acción reguladora de los factores de resistencia ambiental, ya sean bióticos o abióticos, sobre la población plaga. Utiliza como estrategia, la armonización de distintas tácticas en un modelo conceptual orientado a mejorar la estabilidad del sistema agrícola, haciendo un mejor aprovechamiento y conservación de los recursos naturales. Se fundamenta en el conocimiento del agroecosistema, principalmente en su estructura y funcionamiento, realizando un análisis holístico de la situación mediante: La realización de monitoreos periódicos que permitan conocer la evolución de la plaga y de sus enemigos naturales. Registros periódicos del estado fenológico del cultivo y de los datos meteorológicos. La regulación de la densidad poblacional de plagas claves, de modo que la posición general de equilibrio de las mismas esté por debajo del umbral de daño económico. Para ello establece el uso del control natural y/o biológico o de las prácticas culturales, revalorizando dentro de estas últimas a aquellas que hacen más eficientes la acción de los enemigos naturales. La utilización mínima de agroquímicos, disponiendo de ellos sólo como último recurso y teniendo en cuenta que el producto cause la menor perturbación posible al medio ambiente. Uno de los métodos de control más utilizados en el MIPF es el biológico, que consiste en la regulación de especies perjudiciales a través de sus enemigos naturales. Este método es empleado exitosamente en Europa desde principios del siglo pasado y, actualmente, juega un papel central en el manejo de plagas en cultivos Paz, Miriam R; MICROHIMENÓPTEROS PARASITOIDES DE Trialeurodes vaporariorum (Westwood) … 9 /100 protegidos (Hussey & Scopes, 1985; Van Lenteren & Woetts, 1988; Van Lenteren, 1996). Los biocontroladores de plagas más utilizados por el hombre son los himenópteros y dípteros dado el grado de especificidad que presentan. El éxito de los mismos depende, en gran medida, del conocimiento de la biología de las especies intervinientes, de sus interacciones y, algunas veces, de la acción complementaria de varios enemigos naturales que atacan diferentes estados de desarrollo de la plaga o actúan en distintos momentos (Greco et al., 2002). Existen tres métodos diferentes de implementación de control biológico: Método Clásico: consiste en enriquecer el agroecosistema mediante la importación, multiplicación y colonización de parasitoides y predadores exóticos a fin de regular las poblaciones de plagas primariamente foráneas, pudiendo en algunos casos ser nativas. Método Aumentativo: este método requiere de la cría masiva y de liberaciones periódicas de enemigos naturales en grandes cantidades (inundación) o la liberación de individuos que sobrevivirán por varias generaciones subsecuentes (inoculación). La diferencia con el control biológico clásico es que no necesariamente implica la importación de enemigos naturales, sino que pueden ser nativos. Si son importados no pretende que sean integrantes permanentes del agroecosistema. Esta estrategia de control biológico es importante tenerla en cuenta en cultivos anuales donde la perturbación continua de las actividades agrícolas afectan a los enemigos naturales. Método por conservación: consiste en el aumento de los enemigos naturales presentes en el agroecosistema por manipulación de su ambiente, tornándolo de algún modo más favorable. La conservación de enemigos naturales contribuye a que éstos no constituyan un insumo que deba ser incorporado al sistema en forma muy frecuente y merece, por lo tanto, una consideración especial cuando se desea utilizar el control biológico en un marco de sustentabilidad. Esta forma de utilización de los enemigos naturales podría complementarse con otras. La manipulación del ambiente podría sumarse, por ejemplo, al uso del control biológico clásico, neoclásico o al aumento de enemigos naturales para maximizar la persistencia y el impacto de los agentes de control sobre las plagas, de modo de sinergizar los efectos de diferentes técnicas en el MIPF (Greco et al., 2002). Paz, Miriam R; MICROHIMENÓPTEROS PARASITOIDES DE Trialeurodes vaporariorum (Westwood) … 10 /100 1.2 Planteamiento del Tema y Aspectos a Desarrollar En la Argentina, la producción hortícola tuvo un aumento significativo en los últimos años, alcanzando una superficie total cultivada de 600.000 ha con una producción de 10.500.000 tn durante el período 2004–2005 (SAGPyA, 2006). Se destaca el cultivo de tomate, que representó el 16% del total de las hortalizas producidas en el país, ocupando el segundo lugar después de la papa (Brandán & Ploper, 1999; SAGPyA, 2006). La producción de hortalizas en ambientes protegidos es uno de los factores que más ha contribuido al crecimiento de este sector (Botto, 1997). En la figuras 1 y 2 del anexo se puede observar las diferentes regiones de producción hortícola del país y del noroeste argentino (SAGPyA, 2006). Esta actividad posee una gran importancia para nuestra provincia, ubicándose en tercer lugar después de la citrícola y de la caña de azúcar. Esto se debe a que ocupa unas 40.000 ha cultivadas con un valor de producción de US$ 70.000.000 anuales y genera una mano de obra permanente, tanto en precosecha como en poscosecha. Además, Tucumán produce tomate primicia, que es enviado al Mercado Central de Buenos Aires y otros mercados nacionales en los meses de septiembre a diciembre (Brandán & Ploper, 1999). Las condiciones físico-ambientales que genera el invernadero, no solo hacen posible la producción de cultivos frutihortícolas a lo largo de todo el año, sino que también favorecen el rápido desarrollo de plagas y enfermedades (Botto, 1999). Desde la campaña agrícola de 1998 al presente se observa, tanto a campo como en invernadero un marcado incremento poblacional de la plaga denominada “moscas blancas”, que provocan serios problemas a los productores, que van desde disminución de rendimiento hasta pérdida total del cultivo, como por ejemplo en chaucha (Salas et al., 1999). Existen alrededor de 1.150 especies de “moscas blancas” ubicadas taxonómicamente dentro del orden Hemiptera, suborden Sternorrhyncha, superfamilia Aleyrodoidea, familia Aleyrodidae, que se encuentran distribuidas en todas las zonas templadas y tropicales del mundo (Hayward, 1944; Mound & Halsey, 1978), y en la Argentina desde el paralelo 36° al Norte, afectando a diferentes cultivos de importancia económica como hortícolas, granos, cítricos y plantas ornamentales. En nuestro país se han registrado 13 especies de “moscas blancas” (Tapia, 1970; Mound & Halsey, 1978; Viscarret & Botto, 1997). De ellas las más importantes desde el punto de vista económico pertenecen a la subfamilia Aleyrodinae: Bemisia tabaci (Gennadius) y Aleurothrixus aepim (Göldi) que atacan algodón, Aleurothrixus Paz, Miriam R; MICROHIMENÓPTEROS PARASITOIDES DE Trialeurodes vaporariorum (Westwood) … 11 /100 floccosus (Maskell) plaga de cítricos y “la mosca blanca de los invernaderos” Trialeurodes vaporariorum (Westwood) (Tapia, 1970; Mound & Halsey, 1978). La “mosca blanca de los invernaderos”, probablemente originaria de América tropical o subtropical, es una plaga polífaga que fue citada en una gran cantidad de países y sobre más de 200 plantas herbáceas (Salas et al., 1999). En la Argentina su primera cita corresponde al año 1938 para las provincias de Catamarca y La Rioja, sobre plantaciones de zapallo (Quintanilla, 1946) y para Tucumán, se la cita por primera vez en el año 1999 en los cultivos de tomate, pepino, melón, berenjena, chaucha, algodón, zapallo, papa, angola, entre otros. Ataca principalmente a los cultivos en invernadero aunque puede producir importantes daños en cultivos al aire libre (Salas et al., 1999). Las “moscas blancas” son insectos neometabolos, que pasan por los siguientes estados: huevo, tres estadios larvales, “pupa” y adulto (Lizer & Trilles, 1949) (Fig. 3 del anexo). Su reproducción puede ser sexual o por partenogénesis. Las hembras oviponen preferentemente en el envés de las hojas jóvenes y los recubren con un polvillo céreo. Pueden colocar entre 5 a 15 huevos diarios. Una vez que se produce la eclosión, nacen las larvas caminadoras que luego se fijarán en las hojas y succionarán la savia de las mismas para alimentarse. Este período puede durar aproximadamente 4 semanas. La “pupa”, de color amarillo claro similar a la larva, presenta dos ojos rojos marcados, contorno elíptico, perfil elevado y margen dentado. Luego emerge el adulto el cual sigue alimentándose en forma similar a las larvas. El ciclo completo dura aproximadamente 40 días. El potencial biótico de la plaga depende de la planta sobre la cual se desarrolla y de las condiciones ambientales (Salas et al., 1999). Los daños que producen las “moscas blancas” sobre los cultivos son de tipo directo e indirecto. Los de tipo directo son ocasionados por larvas y adultos que al inyectar saliva tóxica y al succionar la savia de las plantas las debilitan y pueden en casos extremos provocar desecamiento y caída de las hojas afectadas. Los de tipo indirecto, se deben a la secreción de melado o “honeydew” (rocío de miel) producto de la liberación del exceso de agua y azúcares del tracto digestivo por la ingestión excesiva de savia por parte del insecto. Este melado favorece el desarrollo de hongos (Capnodium (Fumago) sp.) conocido comúnmente como fumagina (hongo negro) que produce asfixia de la planta y disminución de la función fotosintética (Hayward, 1944; Vet et al., 1980; Llorens Climent & Garrido Vivas, 1992). Además las “moscas blancas” actúan como transmisoras de enfermedades virósicas y bacterianas (Vet et al., 1980; Llorens Climent & Garrido Vivas, 1992; García Mari et al., 1994). Por otro lado, los ejemplares adultos imposibilitan el trabajo de los operarios en lo que se refiere a labores culturales y cosecha, debido a que al volar agrupadas forman nubes de Paz, Miriam R; MICROHIMENÓPTEROS PARASITOIDES DE Trialeurodes vaporariorum (Westwood) … 12 /100 pequeños insectos que son fácilmente inhalados, pudiendo incluso penetrar en los ojos. En las Figuras 4 y 5 del anexo se puede observar los daños y la infestación de mosca blanca en hojas de tomate, pimiento y chaucha. El aumento poblacional de esta plaga en nuestra región se debe a una mezcla de factores que interactúan sobre ella como: a) Los factores ambientales, que crean condiciones óptimas para el aumento de su tasa reproductiva. b) El mal uso de los plaguicidas, que provocan el desarrollo de individuos resistentes y disminuyen la resistencia ambiental al eliminar a sus enemigos naturales (parasitoides y predadores). c) El desconocimiento de los productores y técnicos sobre la existencia de los enemigos naturales y de la potencialidad de éstos como agentes de control biológico. En la provincia de Tucumán no existen programas o estrategias de manejo de plagas en cultivos hortícolas y, en el caso particular de “moscas blancas”, los productores recurren en la mayoría de las veces a técnicas de control inapropiadas. Mediante el conocimiento y uso de los insectos benéficos se puede alcanzar una mejor sanidad de las especies de plantas bajo cultivo sin tener que recurrir tanto a las aplicaciones de insecticidas, los cuales no sólo perjudican a la fauna benéfica sino también a la salud humana (intoxicaciones, residuos de plaguicidas). Los objetivos que se persiguen con el presente estudio son: aportar al conocimiento de los microhimenópteros, que se comportan como parasitoides de T. vaporariorum (Westwood), determinando géneros y especies a las que pertenecen; determinar las interrelaciones existentes entre los parasitoides encontrados y sus plantas hospederas. Los resultados pueden servir de base para la implementación de estrategias que permitan, en Lules, disminuir la densidad poblacional de T. vaporariorum recurriendo a: Medidas que favorezcan la preservación e incremento de los parasitoides presentes en la zona. Selección de o de los parasitoides más promisorios, para su multiplicación en cautiverio y posterior liberación como controladores biológicos (aumentativo). Uso armónico de los distintos métodos de control utilizados en el agroecosistema hortícola y dentro del marco de la agricultura sustentable. Paz, Miriam R; MICROHIMENÓPTEROS PARASITOIDES DE Trialeurodes vaporariorum (Westwood) … 13 /100 1.3 Estado Actual del Conocimiento 1.3.1 Los parasitoides de Trialeurodes vaporariorum (Westwood) en el mundo Dentro de los factores de mortalidad de las plagas, los parasitoides son uno de los más importantes, tanto que su conocimiento es considerado requisito básico para poder implementar en forma criteriosa cualquier estrategia de manejo de las mismas. Por este motivo cuando se plantea el uso de enemigos naturales en programas de lucha biológica contra plagas agrícolas, es necesario disponer de un inventario de aquellas especies con capacidad entomófaga (Van Lenteren & Woets, 1988; Alcazar et al., 2000). En Egipto, la mosca blanca de los invernaderos T. vaporariorum fue introducida en 1990 y se convirtió en la principal plaga de los cultivos hortícolas (Abd-Rabou, 1998). Entre los enemigos naturales de esta plaga, Polaszek et al. (1999) señalan a Encarsia formosa Gahan, E. inaron (Walker), E. lutea (Masi) y E. mineoi Viggiani, y de B. tabaci a E. acaudaleyrodis Hayat y E. protransvena Viggiani. Encarsia formosa introducida en 1996 resultó el parasitoide más efectivo en el control de la mosca blanca de los invernaderos (Abd-Rabou, 1998). En Nueva Zelanda, T. vaporariorum es la principal especie plaga de cultivos en invernadero y al aire libre. Tiene un amplio rango de hospederos y puede transmitir el pseudovirus amarillo de la remolacha a las cucurbitáceas. Su control basado principalmente en el uso de insecticidas provocó desarrollo de resistencia, lo que llevó a la implementación de técnicas basadas en el uso de enemigos naturales. El parasitoide más utilizado fue E. formosa que se expende comercialmente como producto biológico para su uso en cultivos de poroto, pimiento, tomate y cucurbitáceas, todos ellos en invernadero y como complemento del control natural realizado por E. pergandiella Howard (Martín, 2003). En España, Llorens Climent & Garrido Vivas (1992) han llevado a cabo un trabajo de investigación muy completo, donde brindan características morfológicas y biológicas de T. vaporariorum y de B. tabaci y dan a conocer las principales especies de parasitoides que presentan. Así señalan para T. vaporariorum a E. formosa, E. luteola Howard, E. partenopea Masi (= E. inaron), E. pergandiella, E. deserti Gerling & Rivnay (= E. luteola Howard), E. transversa Masi, E. meritoria Gahan, Eretmocerus corni Haldeman, Prospaltella transversa Timberlake, P. citrella porteri Mercet (= Encarsia porteri) y Aphidencyrtus aphidivorus (Mayr). De ellos E. formosa, la más importante, se cría y libera masivamente en invernaderos para el control de las “moscas blancas”. Por ejemplo, en Cataluña se hicieron liberaciones demostrativas de larvas de T. vaporariorum parasitoidizadas durante varios años, lográndose el control Paz, Miriam R; MICROHIMENÓPTEROS PARASITOIDES DE Trialeurodes vaporariorum (Westwood) … 14 /100 no sólo de T. vaporariorum sino también de B. tabaci (Bordas et al., 1981; Llorens Climent & Garrido Vivas, 1992; Carnero et al., 2000). Albajes et al. (1980) encontraron en el litoral mediterráneo español al parasitoide Encarsia tricolor Förster, quien efectuaba un buen control de T. vaporariorum, tanto a campo como en invernaderos. En la actualidad, se llevan diversos programas de manejo integrado de plagas con liberaciones controladas de E. formosa y E. tricolor en invernaderos (Llorens Climent & Garrido Vivas, 1992). En Italia, según Viggiani (1987) E. pergandiella se estableció después de ser liberada en 1980 para el control biológico de T. vaporariorum. En México, B. tabaci y T. vaporariorum se conocen desde 1920, pero recién a partir de 1978 cobran importancia como plagas al ocasionar serias pérdidas económicas por la transmisión de enfermedades virósicas en cultivos hortícolas y de algodón. Otras especies conocidas son: T. abutilonea Haldeman, A. floccosus y Bemisia argentifolii Bellows & Perring, siendo esta última la de mayor incidencia (Dirección General de Sanidad Vegetal SAGAR (México), 1995; Bravo & Flores, 2000). Entre los factores involucrados en la problemática de moscas blancas se menciona el monocultivo, el uso indiscriminado de insecticidas que trajo como consecuencia poblaciones de mosca blanca resistentes y la eliminación de sus enemigos naturales, la gran variedad de hospederos silvestres que sirven como reservorio de mosca blanca y la transmisión de virus hacen que la complejidad del problema se magnifique (Bravo & Flores, 2000). Para el control de todas ellas se utilizan parasitoides de los géneros Encarsia y Eretmocerus Haldeman (Dirección General de Sanidad Vegetal SAGAR (México), 1995; Bravo & Flores, 2000). Trialeurodes vaporariorum introducida en Hawaii probablemente antes de 1900 se comportó como plaga del cultivo de poroto durante varios años. Entre las especies de parasitoides que la regulan se pueden mencionar: Prospaltella transversa, Eretmocerus haldemani Howard, Encarsia formosa y Aleurodiphilus pergandiellus DeBach & Rose (= E. pergandiella Howard) (Gerling, 1983). En Venezuela, la especie de Aleyrodidae de mayor importancia es B. tabaci, por su amplio rango de plantas hospederas, que incluye a cultivos hortícolas, plantas ornamentales y silvestres. En orden decreciente de importancia se ubican T. vaporariorum, de reciente aparición en el país causando daños de importancia en tomate, chaucha y fresa y Aleurothrixus sp. en banano (Arnal & Ramos, 2000; Salas & Arnal, 2000). Entre la fauna benéfica que ejerce un control natural de moscas blancas se encuentran especies de parasitoides de los géneros Amitus, Encarsia, Eretmocerus y Signiphora, siendo las de Encarsia las más frecuentes y numerosas (Salas & Arnal, 2000). Para T. vaporariorum se citan a Amitus hesperidum Silvestri (Platygastridae) y Paz, Miriam R; MICROHIMENÓPTEROS PARASITOIDES DE Trialeurodes vaporariorum (Westwood) … 15 /100 E. formosa, E. nigricephala Dozier y E. pergandiella (Aphelinidae) y para B. tabaci a E. desantisi Viggiani (= E. bicolor De Santis), E. formosa, E. inaron, E. luteola, E. nigricephala, E. pergandiella, E. quaintancei Howard, E. strenua (Silvestri) y E. transvena (Timberlake) (= E. sofia Girault & Dodd) (Arnal et al., 2003). En Panamá, B. tabaci se presenta en las zonas hortícolas que se encuentran a menos de 1200 msnm que corresponde a las provincias centrales donde ocasiona los mayores problemas. En áreas hortícolas ubicadas a más de 1200 msnm predomina T. vaporariorum (Chang, 2000). Bernal Vega & Basedow (2000) reportan a los parasitoides Eretmocerus sp. y Encarsia pergandiella como los más abundantes. Las otras especies encontradas fueron E. porteri y E. hispida De Santis. En la República Dominicana también se encuentran B. tabaci y T. vaporariorum, principalmente en el cultivo de tomate, registrándose a los parasitoides E. formosa, Encarsia sp. y Amitus sp. Para un mejor control se introdujeron desde Estados Unidos otras especies de Encarsia y Eretmocerus (Porfirio, 1995). Actualmente, la preservación de los principales parasitoides y predadores se hace a través de la selectividad de plaguicidas y prácticas agrícolas (Villar et al., 2000). A partir de 1996, en Puerto Rico mediante un programa conjunto entre la Estación Experimental Agrícola de la Universidad y el gobierno federal, se liberaron más de 850.000 parasitoides de mosca blanca, que incluían a E. formosa, E. sophia, Eretmocerus mundus Mercet, E. hayati Zolnerowich & Rose, E. emiratus Zolnerowich & Rose, Eretmocerus sp. y el predador Serangium parcesetosum Sicard (Coleoptera: Coccinelidae). Estas liberaciones se complementaron con una reducción del uso de insecticidas y el establecimiento de Crotalaria juncea L. (Fabacea) como planta refugio (Pantoja & Cabrera, 2000). En la zona Andina de Colombia y Ecuador, T. vaporariorum es considerada la principal plaga (poroto, papa, tomate y cucurbitáceas), mientras que en la zona costera, lo es B. tabaci biotipo B (tomate, berenjena y melón) (Rendón et al., 2000; Valarezo & Arias de López, 2000). Para combatir ambas plagas, se realizaron aplicaciones con insecticidas de amplio espectro, que en muchos casos fueron absolutamente innecesarias. Esto trajo aparejado una serie de problemas, siendo el más importante la eliminación de los enemigos naturales. Los parasitoides que sobrevivieron fueron Encarsia sp., Eretmocerus sp., Closterocerus sp. y Amitus fuscipennis (Mac Gown & Nebeker) (Cardona, 1995; Rendón et al., 2000; Valarezo & Arias de López, 2000). A la fauna mencionada se agregan las moscas blancas: T. variabilis (Quaintance), B. tabaci biotipo A, B. tuberculata Bondar y Aleurotrachelus socialis Bondar y los microhimenópteros parasitoides Encarsia nigricephala, E. pergandiella, E. formosa, E. hispida, E. strenua, E. mineoi, Encarsia sp., Metaphycus Paz, Miriam R; MICROHIMENÓPTEROS PARASITOIDES DE Trialeurodes vaporariorum (Westwood) … 16 /100 sp., Eretmocerus californicus Howard, Eretmocerus sp. (Aphelinidae) y Amitus fuscipennis (Platygastridae) (López-Avila et al., 2000; García González & López-Ávila, 2000). De todos ellos E. nigricephala es el parasitoide con mayor distribución en Colombia y el más promisorio para control biológico por su adaptabilidad a diferentes condiciones ambientales. Amitus fuscipennis también se lo encontró en varias regiones atacando a T. vaporariorum en campo y ha mostrado ser eficiente si se le suministran condiciones favorables (baja presión de insecticidas y un adecuado manejo del cultivo). Este último ha sido estudiado en detalle en laboratorio, incluyendo aspectos de su ciclo de vida, comportamiento, parámetros poblacionales y técnicas de cría masiva. Otro parasitoide estudiado en detalle es E. formosa, el cual se introdujo en el país en varias oportunidades en cultivos bajo invernadero (García González & López-Ávila, 2000). En Perú, el ataque de T. vaporariorum en poroto, tomate y algodón ocasionó pérdidas de hasta un 50 %, a pesar de efectuarse hasta 4 aplicaciones de insecticidas orgánicos de síntesis por semana. Aplicaciones que por otro lado incidieron negativamente sobre Eretmocerus corni y Encarsia sp. registradas como parasitoides naturales (Núñez Sacarías, 1995). En Brasil, los trabajos sobre mosca blanca se iniciaron en 1996 principalmente en cultivos de tomate, melón, poroto, algodón y uva. Dentro de los estudios realizados en EMBRAPA, Universidades y otras instituciones se destacan: la obtención e identificación de enemigos naturales, biología de las moscas blancas en tomate, vid y repollo, identificación de hongos patógenos y parasitismo de E. formosa sobre B. argentifolii (Haji et al., 2000). Dentro de las especies parasitoides que afectan a T. vaporariorum se pueden citar a E. formosa, E. basicincta Gahan, E. desantisi, E. hispida, E. inaron, E. luteola, E. lycopersici De Santis, E. nigricephala y sus hiperparasitoides Signiphora aleyrodis Ashmead y S. flavopalliata group (Signiphoridae). Sobre B. tabaci se encuentran Encarsia aleurothrixi Evans & Polaszek, E. formosa, E. hispida, E. inaron, E. lutea, E. luteola, E. nigricephala y E. porteri y el hiperparasitoide S. aleyrodis (Oliveira & Laumann, 1999; Oliveira et al., 2003). Trialeurodes vaporariorum es la especie de Aleyrodidae más problemática en Chile sobre hortalizas y plantas ornamentales. Ha sido observada en los cultivos de tomate, pimentón, ají dulce, tabaco, melón, sandía, pepino, poroto, camote y alfalfa. También se ha detectado en kiwi, guayaba, palto, ciruelo, vid y eucalipto, así como en plantas ornamentales (Euphorbia, Begonia, Chrysantemum, etc.), entre las que predominan las asteráceas, y en malezas. Es una plaga primaria en invernaderos principalmente de tomate y cucurbitáceas. Para su control biológico se emplea E. Paz, Miriam R; MICROHIMENÓPTEROS PARASITOIDES DE Trialeurodes vaporariorum (Westwood) … 17 /100 formosa, E. porteri y Eretmocerus corni (Mondaca Rivas, 2000). Las dos últimas especies ya habían sido reportadas por Stuardo, en 1927, realizando un control natural de la plaga. En nuestro país existen numerosos trabajos sobre himenópteros parasitoides de plagas en diferentes cultivos, incluidos los hortícolas. Dentro de estos últimos no se cuenta con una información completa y ordenada de aquellos que realizan control natural de “moscas blancas”, ya sea bajo condiciones de campo o en invernaderos. En el Instituto Nacional de Tecnología Agropecuaria con su insectario de investigaciones para lucha biológica (IMYZA, CICA) en Castelar, provincia de Buenos Aires, se estudia desde 1993 la situación taxonómica de especies de Bemisia y Trialeurodes (Aleyrodidae) asociadas a cultivos de importancia económica como algodón, poroto y hortalizas. Se realizaron crías de T. vaporariorum determinándose para la misma: a) el tiempo de desarrollo, mortalidad de estados inmaduros y grado de preferencia para distintas plantas hospederas, y b) aspectos biológicos de sus parasitoides E. formosa y Eretmocerus sp. (Botto, 1995; López et al., 1998). Paralelamente se realizó un inventario y caracterización de los enemigos naturales, lo cual permitió seleccionar aquellos parasitoides con mayor potencial para su empleo en estrategias de control biológico. Las especies seleccionadas fueron E. formosa y Eretmocerus corni (Botto, 1999). De E. formosa, introducida al país en 1981 (De Santis, 1981a) sobre T. vaporariorum en tomate, se han estudiado los siguientes parámetros biológicos: tiempo de desarrollo, longevidad, fecundidad, tasa neta de reproducción, tiempo generacional, tasa intrínseca de incremento poblacional, patrón de parasitismo y capacidad de búsqueda. Para ello se emplearon diferentes técnicas de estudio como tabla de vida y de fecundidad, pruebas de preferencia, respuesta funcional y pruebas de competencia intraespecífica, entre otras (Botto, 1995; López & Botto, 1995a; López & Botto, 1995b; Botto, 1999). Sobre E. corni se determinaron tiempo de desarrollo, longevidad, fecundidad y parámetros poblacionales bajo condiciones de laboratorio, utilizándose las mismas técnicas que para E. formosa (Botto, 1995; Botto, 1999). Además se evaluó la interacción plaga - enemigo natural en invernadero, lo que permitió registrar los cambios numéricos de la población plaga y de sus enemigos naturales. En los últimos años se desarrollaron experiencias “piloto” de control biológico y evaluaciones de técnicas de cría masiva, almacenamiento, control de calidad, costo de producción y dosis de liberación efectiva (Botto, 1999). Viscarret et al. (2000) realizaron un relevamiento de plantas hospederas, especies de moscas blancas y sus enemigos naturales para el país. Entre las plantas hortícolas hospederas de moscas blancas y malezas asociadas señalan a Sonchus Paz, Miriam R; MICROHIMENÓPTEROS PARASITOIDES DE Trialeurodes vaporariorum (Westwood) … 18 /100 oleraceus L., Zinnia sp. (Asteraceae), Ipomoea sp. (Convolvulacea), Cucurbita maxima var. zapallito (Carr.) Millán (Cucurbitacea), Phaseolus vulgaris L. (Fabacea), Salvia splendens Kerk-Gawl (Labiada), Coleus blumes Benth (Lamiaceae), Lycopersicum esculentum Mill y Solanum melongena L. (Solanacea). Las especies de moscas blancas indicadas son: B. tabaci, T. vaporariorum y A. aepim, siendo las más frecuentes T. vaporariorum y B. tabaci (complejo). Entre los parasitoides mencionan a E. formosa, E. lycopersici, E. porteri, Encarsia sp., Eretmocerus corni y Eretmocerus sp. Otros parasitoides de moscas blanca registrados son Encarsia desantisi (huésped no especificado) (De Santis, 1967) y E. lopezi Blanchard sobre un aleiródido no identificado en cultivo de repollo, provincia de Buenos Aires (De Santis, 1948a). De Santis (1967) también recogió algunas Signiphora spp. asociadas a aleirodidos. En Tucumán se conoce la presencia, importancia, distribución y plantas hospederas de T. vaporariorum (Salas et al., 1999), pero no hay antecedentes sobre las especies de parasitoides presentes y lógicamente tampoco sobre interrelaciones ecológicas. 1.3.2 Interrelación Planta Hospedera - Parasitoide Las interacciones entre la planta hospedera, el insecto huésped y los enemigos naturales comprenden situaciones ecológicas complejas, debido a la gran cantidad de factores que influyen en el comportamiento de los organismos intervinientes. De Bach (1964) y Viggiani (1984) establecen cuatro fases principales en la selección del huésped por parte de los insectos parasitoides, a saber: a) Selección del hábitat, b) Ubicación del huésped en el hábitat, c) Aceptación del huésped y d) Explotación del Huésped. a) Selección del hábitat La planta hospedera puede influir directa o indirectamente sobre el accionar de los insectos parasitoides a través de interacciones multitróficas (Greco et al., 2002). El papel que juegan las señales químicas y físicas son de gran importancia para la orientación de las hembras durante esta fase (De Bach, 1964). Algunas características de la planta que inciden en la localización del hábitat, por parte del parasitoide son: la pubescencia, su arquitectura, la nutrición, el estado fenológico del cultivo, la liberación de sustancias químicas volátiles, la estructura de las hojas, la presencia de exudados, entre otros. Paz, Miriam R; MICROHIMENÓPTEROS PARASITOIDES DE Trialeurodes vaporariorum (Westwood) … 19 /100 Gerling (1966a) estudió el comportamiento de E. formosa en relación al grado de pubescencia de cinco plantas hospederas de T. vaporariorum. Las plantas usadas en grado ascendente de pubescencia fueron tabaco, algodón, palto, tomate y calabaza, observando que si bien el parasitoide se encontraba presente en las cinco plantas, la más pubescente tenía un menor número de “pupas” parasitoidizadas que la menos pubescente. En Brasil, Oliveira & Laumann (1999), observaron que el parasitoidismo de E. formosa sobre B. tabaci es afectado por la cantidad de tricomas que presentan las hojas de diferentes cultivares de melón (Cucurbita melo L.). Aquellas variedades con mayor cantidad de tricomas tenían menor porcentaje de parasitoidismo. Greco et al. (1998) estudiaron el comportamiento de Trichogramma exiguum Pinto & Platner sobre Diatraea saccharalis Fabricius en variedades de maíz con diferentes grados de pubescencia, determinando que el porcentaje de parasitoidismo era menor en variedades pubescentes que en las glabras. Salvo & Valladares (2005), estudiaron la influencia de la arquitectura de la planta y el aspecto de las galerías producidas por insectos minadores (Diptera: Agromyzidae), sobre el tamaño y estructura de los complejos parasíticos que los afectan. Los insectos minadores de hojas de árboles presentaron complejos parasíticos empobrecidos comparados con los de hierbas y arbustos, lo mismo ocurrió con las minas lineales con respecto a aquellas más complejas. La menor incidencia de plagas en ambientes heterogéneos como los policultivos, se debe a que los enemigos naturales encuentran sitios de refugio donde existen fuentes alternativas de alimentación como polen, néctar y huéspedes que permiten su sobrevivencia. En cambio en los monocultivos pueden llegar a extinguirse por la falta de alimentos alternativos en los períodos críticos del enemigo natural (Altieri, 1992). El néctar y polen son una fuente de aminoácidos y azúcares, los cuales son básicos e indispensables en las dietas de los parasitoides, ya que favorecen la maduración de los huevos. Las hembras en busca de estos nutrientes pueden migrar a otros hábitats (García, 1991). Es por ello fundamental el mantenimiento o establecimiento de vegetación adyacente a los campos de cultivo, que incrementen la abundancia y colonización de estos enemigos naturales (García, 1991; Altieri, 1994 citado por Nicholson, 2002). b) Ubicación del huésped en el hábitat Una vez que el parasitoide localizó la planta hospedera, comienza a buscar en forma aleatoria o directamente a su huésped, utilizando principalmente el sentido del Paz, Miriam R; MICROHIMENÓPTEROS PARASITOIDES DE Trialeurodes vaporariorum (Westwood) … 20 /100 olfato y el tacto. La búsqueda al azar se manifiesta cuando las kairomonas y otros tipos de estímulos no están involucrados (Viggiani, 1984). La liberación de sustancias volátiles juega un papel esencial en esta etapa. La presencia de plantas no hospederas, próximas a las plantas de alimentación de la victima, pueden interferir en la localización de los herbívoros debido a la producción de sustancias repelentes (García, 1991). La distribución del huésped dentro de la planta puede afectar la localización por parte del parasitoide. Una distribución agregada, favorece el accionar del parasitoide, como en el caso de los afelínidos (Viggiani, 1984). c) Aceptación del huésped La aceptación del huésped involucra el uso de las antenas, apéndices bucales, pretarsos y ovipositor. Las antenas juegan un rol importante en esta fase. La hembra, generalmente examina al huésped potencial con un rápido toqueteo de las antenas y de acuerdo al estado y dimensión del mismo será el tipo de huevo (haploide o diploide) depositado. La duración de esta fase exploratoria varía según las especies (Viggiani, 1984; García, 1991). Las antenas de algunos afelínidos están morfológicamente adaptadas para esta función (Viggiani, 1984). Los estímulos, como olor, forma, tamaño, textura y respuesta del huésped, son señales importantes para el ataque de diferentes especies de parasitoides (García, 1991). d) Explotación del Huésped El huésped conveniente es frecuentemente evaluado por una secuencia de pruebas con el ovipositor antes de colocar los huevos. En esta fase el parasitoide tiene una información estructural, física y química del huésped. La localización del sitio de oviposición es también importante en el proceso de parasitoidismo. Algunos exhiben cierta especialización, como en el caso de Encarsia lahorensis (Howard), que selecciona el área del margen del cuerpo de la mosca blanca para colocar huevos diploides, mientras las hembras vírgenes depositan los huevos haploides en el área central del cuerpo del huésped. Otros parasitoides primarios aparentemente no tienen preferencia especial (Viggiani, 1984). Paz, Miriam R; MICROHIMENÓPTEROS PARASITOIDES DE Trialeurodes vaporariorum (Westwood) … 21 /100 1.4 Objetivos Identificar y caracterizar a los microhimenópteros parasitoides de la “mosca blanca” Trialeurodes vaporariorum (Westwood) en los cultivos de tomate Lycopersicon esculentum Mill, pimiento Capsicum annum L., chaucha Phaseolus vulgaris L. y malezas asociadas, en la localidad de San Isidro de Lules, Tucumán. Conocer posibles interrelaciones entre los parasitoides identificados y sus plantas hospederas. 1.5 Hipótesis En la región en estudio existe un complejo de parasitoides nativos y/o introducidos de Trialeurodes vaporariorum, sobre tomate, pimiento, chaucha y malezas asociadas. La planta hospedera influye en la elección del huésped (mosca blanca de los invernaderos) por parte de los parasitoides. Paz, Miriam R; MICROHIMENÓPTEROS PARASITOIDES DE Trialeurodes vaporariorum (Westwood) … 2- METODOLOGÍA DE TRABAJO 22 /100 Paz, Miriam R; MICROHIMENÓPTEROS PARASITOIDES DE Trialeurodes vaporariorum (Westwood) … 23 /100 2.1 Marco Teórico Durante los años 2002 y 2003 se realizaron tareas de campo y laboratorio. Las tareas de campo se llevaron a cabo en los campos de productores de la localidad de San Isidro de Lules, Tucumán y comprendieron muestreos periódicos y recolección de hojas afectadas por Trialeurodes vaporariorum al estado de “pupa”. El acondicionamiento del material y la obtención de los parasitoides se realizaron en la Cátedra de Zoología Agrícola de la Facultad de Agronomía y Zootecnia de la Universidad Nacional de Tucumán, que cuenta con laboratorios, equipos ópticos e instrumental necesario. Para alcanzar la identificación de los parasitoides a nivel específico y la caracterización de cada uno de ellos, se trabajó con métodos cualitativos de observación (estudios morfológicos), uso de claves taxonómicas, consultas de descripciones realizadas por otros autores y comparaciones con materiales tipos. Para la determinación de la posible influencia de la planta hospedera en la elección del huésped por parte de los parasitoides se utilizaron métodos cualitativos y cuantitativos de observación y experimentación. 2.2 Tareas de campo Se realizaron muestreos periódicos a lo largo del ciclo del cultivo durante los dos años de muestreo, en campos de productores que realizaban tratamientos químicos convencionales para el control de la mosca blanca. Las muestras consistían en hojas del tercio medio inferior de las plantas de tomate, pimiento, chaucha y malezas asociadas, que presentaban ejemplares de T. vaporariorum al estado de “pupa”. Se tomaron estas hojas por ser las que contienen mayor densidad de larvas maduras y “pupas” de mosca blanca (Botto, 1999). Las malezas recolectadas fueron: Amaranthus (lividus) blitum L., A. quitensis Kunth (Amaranteacea), Bidens pilosa var minor (Blume) Sherff, Galinsoga parviflora Cav. (Asteracea), Nicotiana longiflora Cav. (Solanacea) y Oxalis corniculata L. (Oxalidacea). También se recolectaron muestras de plantas ornamentales y medicinales, que se encontraban en los jardines de las casas de los productores al lado de los invernaderos, como “alegría del hogar” Impatiens balsamina L. (Balsaminaceae) y “ruda” Ruta chalepensis L. (Rutacea). Todas las muestras fueron acondicionadas individualmente en bolsas de polietileno con sus correspondientes datos de identificación (lugar, fecha, planta hospedera, estado fenológico del cultivo, etc.) y trasladadas al laboratorio para su posterior análisis. Paz, Miriam R; MICROHIMENÓPTEROS PARASITOIDES DE Trialeurodes vaporariorum (Westwood) … 24 /100 2.3 Tareas de Laboratorio 2.3.1 Identificación y caracterización de los parasitoides de Trialeurodes vaporariorum (Westwood) Las muestras procedentes del campo fueron acondicionadas inmediatamente en el laboratorio y cada una de ellas recibió el siguiente tratamiento: 1. Separación del material por planta hospedera. 2. Observación bajo lupa binocular de las hojas recogidas para la detección de “pupas” de T. vaporariorum con síntomas de parasitoidismo. 3. Caracterización de los síntomas de parasitoidismo que presentaban las moscas blancas, en lo referente a coloración de la “pupa”, coloración y disposición de los meconios y todo aquel aspecto que resultara interesante para su identificación. Todos estos datos fueron volcados en planillas confeccionadas para este fin. 4. Recolección y acondicionamiento individual de las “pupas” parasitoidizadas en tubos de vidrio cerrados con algodón y mantenidos en un ambiente climatizado para la obtención de parasitoides adultos. Cada tubo con sus correspondientes datos de recolección. 5. Revisión diaria de los tubos de vidrio para observar el momento de la emergencia de los parasitoides adultos y realizar una descripción detallada de los caracteres morfológicos de los mismos, necesarios para la identificación como: coloración del cuerpo y apéndices, disposición de estructuras tegumentarias, posición del ovipositor, etc. 6. Acondicionamiento de los parasitoides obtenidos para su conservación y posterior identificación de la siguiente forma: a) En medio líquido. Se colocaron los especímenes en tubos de vidrio conteniendo alcohol etílico 70º o una mezcla de alcohol etílico 70º y glicerina. b) En preparaciones microscópicas. Se efectuaron las mismas siguiendo la técnica descripta por De Santis (1948a) y Cave (1995) utilizándose Hoyer como líquido de montaje. Todas las preparaciones microscópicas fueron de tipo semipermanente. Los parasitoides de coloración oscura fueron tratados previamente con hidróxido de sodio al 10% para su clarificación. Luego, se eliminó el exceso de hidróxido de sodio con agua destilada y, posteriormente, se realizó la deshidratación con alcohol etílico 70°. 7. Para la identificación de los parasitoides recogidos y acondicionados se utilizaron claves taxonómicas de diferentes autores como De Santis, (1946, Paz, Miriam R; MICROHIMENÓPTEROS PARASITOIDES DE Trialeurodes vaporariorum (Westwood) … 25 /100 1948a, 1968, 1969); Subba Rao (1974); Tryapitsyn, (1987); Yasnosh, (1987); Davis et al., (1990); Polaszek et al., (1992); Gauld & Hanson, (1995); Hanson, (1995a; 1995b); Hanson & Lasalle, (1995); Schauff & Evans, (1995) y Polaszek et al., (1999). También se efectuaron estudios comparativos con especies ya identificadas y conservadas en las colecciones del Museo de Ciencias Naturales de la Universidad Nacional de La Plata (MLP) y de la colección privada del Dr. Luis De Santis, ejemplares que fueron facilitados por la Dra. Marta Loiácono del MLP. Para la actualización de la sinonimia de las especies tratadas se consultaron los Catálogos de Heraty & Woolley, (2002) y Heraty et al., (2007). 8. Los estudios morfológicos se realizaron mediante el uso de un microscopio binocular de gran aumento. 9. Las preparaciones microscópicas de los microhimenópteros estudiados e identificados se encuentran depositados en la Cátedra de Zoología Agrícola de la Facultad de Agronomía y Zootecnia de la Universidad Nacional de Tucumán. 2.3.2 Interrelación planta hospedera – parasitoide En cada fecha de recolección se analizó por separado las “pupas” de mosca blanca provenientes de tomate, pimiento y chaucha de los años 2002 y 2003, registrándose el número de “pupas” parasitoidizadas, así como el número total revisado. Las “pupas” parasitoidizadas se acondicionaron en tubos de vidrio cerrados con algodón y mantenidos en un ambiente climatizado para la obtención de los parasitoides adultos, registrando el número de ellos según las especies determinadas y caracterizadas con anterioridad. Todos estos datos se volcaron en planillas confeccionadas a los efectos de calcular prevalencia (número de “pupas” de mosca blanca parasitoidizadas / número de “pupas” de mosca blanca revisadas; expresada en porcentaje) y selectividad de los parasitoides encontrados y realizar el diseño y análisis estadístico correspondiente. Para evaluar el efecto de los cultivos, fecha y año sobre la presencia de parasitoides de T. vaporariorum se aplicó un modelo de regresión logística (Afifi & Clark, 1999), visto el carácter categórico de la variable respuesta (presencia-ausencia de parasitoides), según la expresión: logit (Pi) = log (Pi / (1 - Pi)) = ´ xi; donde: Pi = Prob (yi = yi / xi), es la probabilidad que la variable respuesta sea presencia de parasitoides (=1); es la ordenada al origen; es la pendiente; y xi son las variables independientes. Paz, Miriam R; MICROHIMENÓPTEROS PARASITOIDES DE Trialeurodes vaporariorum (Westwood) … 26 /100 Esta función predice la probabilidad de la presencia de parasitoides (=1) con los distintos tratamientos aplicados. La incidencia de las variables explicatorias sobre la variable respuesta, se analizó en términos de probabilidades (logit). Las variables explicatorias analizadas en el modelo fueron: cultivo, fecha y año. Los parámetros de la ecuación de regresión se calcularon por el método de máxima verosimilitud (Everitt & Der, 1996). La adecuación del modelo se definió empleando los criterios de información de Akaike, (1974) y Schwarz, (1978), criterios de bondad de ajuste de Hosmer & Lemeshow, (1989) y Pearson & Deviance (Afifi & Clark, 1999) y otras herramientas de diagnóstico sobre la distribución de datos. Según, los test de normalidad de Kolmogorov & Smirnov y homogeneidad de Levene (Afifi & Clark, 1999). La importancia de los efectos principales del modelo se probó mediante el test de Wald. La incidencia de los efectos principales sobre la variable respuesta se evaluó con los coeficientes de los parámetros de la ecuación de regresión lograda y los “Odds ratio” correspondientes. Paz, Miriam R; MICROHIMENÓPTEROS PARASITOIDES DE Trialeurodes vaporariorum (Westwood) … 3- RESULTADOS Y DISCUSIÓN 27 /100 Paz, Miriam R; MICROHIMENÓPTEROS PARASITOIDES DE Trialeurodes vaporariorum (Westwood) … 28 /100 3.1 Identificación y Caracterización de Microhimenópteros Parasitoides de T. vaporariorum (Westwood) La identificación de los microhimenópteros parasitoides se hace dificultosa por ser insectos de tamaño diminuto, menos de 1 mm de largo en su mayoría. A pesar de ello la observación de algunos caracteres taxonómicos, como segmentación antenal, venación alar, número de tarsitos, separación de las sensilias escutelares, entre otros, son relativamente fáciles de determinar y permite el reconocimiento de ciertos géneros y especies. A este efecto pueden ser de utilidad informaciones adicionales como ser: lugar y forma de la emergencia desde el huésped, características de los meconios, coloración de la pupa, cortejo y comportamiento durante la cópula y características genéticas. En la actualidad la identificación a nivel de especies se realiza sobre la base de dos métodos: a) La investigación morfológica dentro de taxas. Es el más comúnmente usado, así la taxonomía de los Chalcidoidea se basa en la morfología externa, aunque algunos caracteres internos también pueden ser usados. b) Los test de aislamiento reproductivo de taxas por estudios de hibridación (Davis et al., 1990). La realización del presente estudio se basó en el primer método de identificación, utilizándose las claves taxonómicas de los siguientes autores: Superfamilia: De Santis (1969) y Gauld & Hanson (1995). Familias: De Santis (1969); Yasnosh (1987); Davis et al. (1990); Hanson & Lasalle (1995). Subfamilias: De Santis (1946) y (1948a). Género y especie de Eretmocerus: De Santis (1948a) y Yasnosh (1987). Género Encarsia: De Santis (1946) y (1948a); Yasnosh (1987); Hanson (1995a). Especies del género Encarsia: Polaszek et al. (1992); Schauff & Evans (1995) y Polaszek et al. (1999). Género Signiphora: De Santis (1968); Subba Rao (1974) y Hanson, (1995b). Especie del género Signiphora: Mineo & Viggiani (2001). A los fines de facilitar las tareas de identificación se elaboró una clave taxonómica con los parasitoides encontrados en San Isidro de Lules, Tucumán y se incorporaron a la misma aquellos parasitoides citados para nuestro país sobre T. vaporariorum y B. tabaci. La clave taxonómica elaborada se presernta en el item 3.1.1. Se consideró a B. tabaci porque a nivel mundial está siempre asociada a la mosca blanca de los invernaderos en cultivos hortícolas. Paz, Miriam R; MICROHIMENÓPTEROS PARASITOIDES DE Trialeurodes vaporariorum (Westwood) … 29 /100 También se incorporaron a la clave las especies de parasitoides identificadas por Viscarret et al. (2000) a saber: Eretmocerus corni y Encarsia lycopersici sobre T. vaporariorum, el primero en los cultivos de tomate y berenjena y el segundo en tabaco en la provincia de Buenos Aires y E. transvena sobre B. tabaci en cultivo de algodón en la provincia de Santiago del Estero. Otra especie considerada fue E. lutea, muy semejante a E. porteri y, si bien no ha sido aún encontrada en nuestro país sobre T. vaporariorum, su inclusión facilitaría la identificación de esta última. En las figuras 6 a 17 del anexo se pueden observar algunos caracteres utilizados en la elaboración de la siguiente clave de identificación, los cuales facilitarán la comprensión de la misma. 3.1.1 Clave para la Identificación de microhimenópteros parasitoides de T. vaporariorum (Westwood) 1- Antena con 3 a 6 segmentos, segmento apical muy alargado (Fig. 7A) ________ 2 1’- Antena con 7 ó más segmentos, segmento apical normal (Fig. 7B) __ Encarsia _ 4 2- Tarsos con 4 segmentos (Fig. 10C). Disco del ala anterior cubierto con pequeñas y escasas setas ________________________________________ Eretmocerus _ 3 2’- Tarsos con 5 segmentos (Fig. 9B). Disco del ala anterior con una sola seta y flecos marginales más largos que el ancho máximo del ala (Fig. 9C) _________ __________________________________ Signiphora townsendi Ashmead (Fig. 9) 3- Maza antenal larga; escudo del mesonoto con tres pares de setas. Tarsos aparentemente pentámeros con empodios muy desarrollados _______________ __________________________________________________ E. corni Haldeman 3’- Maza antenal relativamente más corta; escudo del mesonoto con dos pares de setas. Tarsos claramente tetrámeros con empodios poco desarrollados (Fig. 10 C) __________________________________________ E. paulistus Hempel (Fig. 10) 4- Tarso medio con 4 segmentos (Fig. 11B y 12E) __________________________ 5 4’- Tarso medio con 5 segmentos (Fig. 16A y 17A) ___________________________ 8 Paz, Miriam R; MICROHIMENÓPTEROS PARASITOIDES DE Trialeurodes vaporariorum (Westwood) … 30 /100 5- Ala anterior con un área evidente sin setas alrededor de la vena estigmal (Fig. 11B y C). Segundo artejo funicular de la antena del macho con complejo sensorial. Hembra con gáster (metasoma) y tórax (mesosoma) pálidos, sólo la cabeza y parte anterior del mesoescudo oscuro (Fig. 11E). _________________________ ___________________________________ Encarsia nigricephala Dozier (Fig. 11) 5’- Ala anterior completamente setosa alrededor de la vena estigmal (Fig. 12C) Segundo artejo funicular de la antena del macho sin complejo sensorial. Hembra de coloración variable desde completamente amarilla a castaño claro ________ 6 6- Espolón de la tibia media tan largo o casi tan largo como el basitarso correspondiente (Fig. 13A). Hembra con cuerpo y apéndices completamente amarillos, mesoescudo, axilas y base del gáster con zonas más oscuras (Fig. 13E) o con gáster y tórax parcialmente castaño oscuro (Fig. 14E) ________________ 7 6’- Espolón de la tibia media claramente más corto que el basitarso correspondiente (Fig. 12E). Hembra con gáster amarillo y resto del cuerpo castaño oscuro o negro (Fig. 12A y B). __________________________ Encarsia formosa Gahan (Fig. 12) 7- Hembra con cuerpo y apéndices completamente amarillos: mesoescudo, axila y base del gáster con zonas más oscuras (Fig. 13E). Antenas del macho con quinto y sexto artejos del funículo separados ______ Encarsia hispida De Santis (Fig. 13) 7’- Hembra con tórax y parte del gáster castaño oscuro (Fig. 14E). Antenas del macho con quinto y sexto artejos del funículo parcialmente fusionados (Fig. 14A) ______ ____________________________________ Encarsia desantisi Viggiani (Fig. 14) 8- Ala anterior con un área evidente sin setas alrededor de la vena estigmal (Fig. 15B). Hembra con maza antenal siempre de dos segmentos (Fig. 15C). _______ __________________________________ Encarsia pergandiella Howard (Fig. 15) 8’- Ala anterior completamente setosa alrededor de la vena estigmal (Fig. 16B). Hembra con maza antenal siempre de dos o tres segmentos ________________ 9 9- Sensilias escutelares muy próximas entre si. ____________________________ 10 9’- Sensilias escutelares ampliamente separadas (Fig. 17C). __________________ 11 10- Maza antenal de dos segmentos. Ala anterior de la hembra sin una evidente área de largas setas ____________________________ Encarsia lycopersici De Santis 10’- Maza antenal de tres segmentos. Ala anterior de la hembra con una evidente área de largas setas ___________________________ Encarsia transvena (Timberlake) Paz, Miriam R; MICROHIMENÓPTEROS PARASITOIDES DE Trialeurodes vaporariorum (Westwood) … 31 /100 11- Hembra con maza antenal claramente con 3 segmentos ___________________12 11’-Hembra con maza antenal claramente con 2 segmentos o no aparente _________ _______________________________________ Encarsia inaron (Walker) (Fig. 16) 12- Primer artejo funicular de la antena de la hembra cuadrado, menos de la mitad del largo del pedicelo. Tercera valva oscura en contraste a la segunda valvíferas ____ _________________________________________________Encarsia lutea (Masi) 12’- Primer artejo funicular de la antena de la hembra más largo que ancho, más de la mitad del largo del pedicelo. Tercera valva pálida ____________________ _______________________________________ Encarsia porteri (Mercet) (Fig. 17) Los caracteres utilizados para la realización de la presente clave están basados en las claves utilizadas para la identificación de especies, mencionadas anteriormente. En el caso de las especies incorporadas se utilizaron las descripciones realizadas por De Santis (1948a) para Eretmocerus corni, De Santis (1957) para Encarsia lycopersici y Polaszek et al. (1992) para E. transvena y E. lutea. 3.1.2 Especies identificadas. Posición taxonómica Los parasitoides encontrados sobre T. vaporariorum en los cultivos de tomate, pimiento, chaucha, ruda y alegría del hogar de la localidad de San Isidro de Lules, Tucumán, fueron identificados y pertenecen a la siguiente posición sistemática: Orden Hymenoptera Suborden Apocrita Serie Parasítica Superfamilia Chalcidoidea Familia Aphelinidae Subfamilia Coccophaginae Género Encarsia Encarsia desantisi Viggiani, 1985 Encarsia formosa Gahan, 1924 Encarsia hispida De Santis, 1948 Encarsia inaron (Walker), 1839 Encarsia nigricephala Dozier, 1937 Encarsia pergandiella Howard, 1907 Encarsia porteri (Mercet), 1927 Paz, Miriam R; MICROHIMENÓPTEROS PARASITOIDES DE Trialeurodes vaporariorum (Westwood) … 32 /100 Subfamilia Aphelininae Género Eretmocerus Eretmocerus paulistus Hempel, 1904 Familia Signiphoridae Género Signiphora Signiphora townsendi Ashmead, 1900 En las malezas asociadas a los cultivos muestreados, Amaranthus (lividus) blitum, A. quitensis, Bidens pilosa var minor, Galinsoga parviflora, Nicotiana longiflora y Oxalis corniculata, no se obtuvieron microhimenópteros parasitoides sobre T. vaporariorum. Aunque se encontraron “pupas” de mosca blanca con síntomas de parasitoidismo, éstas no llegaron a prosperar para la obtención de avispitas al estado adulto. 3.1.2.1 Orden Hymenoptera Dentro de los insectos entomófagos, el orden dominante es Hymenoptera, tanto por el número de especies que presenta como por la frecuencia y efectividad con que atacan a los insectos plagas de numerosos cultivos (Clausen, 1972). Además tiene importancia porque comprende especies que colaboran en el desarrollo de actividades económicas que realiza el hombre. Así, hay especies polinizadoras de plantas productoras de semillas y otras que son utilizadas en la producción de sustancias alimenticias como la miel y sus subproductos (Hanson, 1995c). El orden Hymenoptera comprende unas 115.000 especies descriptas distribuidas en 18 superfamilias (Gauld & Hanson, 1995). Más de la mitad de estas superfamilias son estrictamente de hábito parasitíco, una a cuatro familias son predadoras y el resto se comporta como predadores o parasitoides (Clausen, 1972). Las familias con representantes parasitoides más importantes son Ichneumonidae y Braconidae, que atacan a una amplia variedad de larvas de Lepidoptera y Coleoptera (Clausen, 1972), Encyrtidae y Aphelinidae que afectan a hemípteros y, por último, los Trichogrammatidae que se desarrollan a expensa de huevos de Lepidoptera (Clausen, 1972; Skarlato, 1987; Hanson, 1995c). Dentro del orden hay familias cuyos representantes se comportan como hiperparasitoides, entre ellas: Ichneumonidae, Eulophidae, Pteromalidae y Signiphoridae (Clausen, 1972). Los himenópteros se caracterizan por presentar reproducción de tipo partenogenética telitóquica. Esta característica es una adaptación específica de este grupo de insectos y se da con mayor frecuencia en las especies de himenópteros Paz, Miriam R; MICROHIMENÓPTEROS PARASITOIDES DE Trialeurodes vaporariorum (Westwood) … 33 /100 parasitoides que en otros insectos entomófagos. La familia Aphelinidae con sus géneros Aphelinus Dalman, Aphytis Howard, Encarsia Förster y Prospaltella Ashmead es una de las más representativas con este tipo de reproducción. Se ha encontrado en algunas especies, en forma ocasional machos haploides, pero éstos, a veces son incapaces de acoplarse o si se acoplan, la progenie resultante es de hembras (Clausen, 1972; Gauld & Hanson, 1995). 3.1.2.2 Superfamilia Chalcidoidea Dentro del orden Hymenoptera, los calcidoideos son de gran importancia económica. La mayoría son parasitoides de insectos fitófagos, incluyendo plagas importantes para la agricultura. Algunas especies han sido usadas exitosamente en programas de control biológico de insectos perjudiciales en numerosos cultivos (Clausen, 1972; Skarlato, 1987; Noyes, 2003). Además, la Superfamilia Chalcidoidea es reconocida por su biodiversidad como el grupo más grande de himenópteros, después de Ichneumonoidea. Se indican aproximadamente unas 19.000 especies descriptas, incluidas en 21 familias y cerca de 2.000 géneros (Skarlato, 1987; Davis et al., 1990; Hanson & Lasalle, 1995). Algunos autores estiman que aún faltan por descubrir entre 60.000 a 100.000 especies más. Actualmente, en la Argentina se conocen unas 822 especies, es decir el 4,3% de las descriptas a nivel mundial (De Santis, 1998). Los calcidoideos afectan a representantes de 14 órdenes de Insecta (Odonata, Orthoptera, Blattaria, Mantodea, Thysanoptera, Hemiptera, Psocoptera, Neuroptera, Coleoptera, Strepsiptera, Lepidoptera, Diptera, Siphonaptera e Hymenoptera) y dos de la Clase Arachnida (Acari y Araneae). Unas pocas especies son predadoras de ácaros y muy pocas de nematodes (Hanson & Lasalle, 1995). Los calcidoideos presentan las siguientes características morfológicas y biológicas que permiten su reconocimiento. En general son insectos pequeños de 0,2 a 0,3 mm de largo, con el pronoto latero-ventralmente redondeado y claramente separado de las tégulas (Figs. 6B y C del anexo). Las antenas están formadas por 13 artejos o menos y las patas con trocantelo siempre presente. El gáster raramente se encuentra comprimido y los pigostilos siempre están presentes. El oviscapto, por lo general, está expuesto (De Santis,1969). El primer par de alas posee venación reducida, en la mayoría esta formada por una única vena compleja, compuesta por la vena submarginal, marginal, estigmal y postmarginal (Fig. 8A del anexo). En algunas especies la vena marginal o Paz, Miriam R; MICROHIMENÓPTEROS PARASITOIDES DE Trialeurodes vaporariorum (Westwood) … 34 /100 postmarginal pueden estar ausentes y la estigmal muy reducida, pero el patrón general de venación se mantiene (Skarlato, 1987; Gauld & Hanson, 1995). Los adultos de Chalcidoidea se alimentan, generalmente, de néctar de flores y de secreciones azucaradas que liberan sus huéspedes. Las hembras, frecuentemente, succionan la hemolinfa de sus presas, a ésto se conoce como “succión del huésped” (Skarlato, 1987; Gauld & Hanson, 1995). Los estados del huésped más atacados son el de huevo y larva, pero existe un pequeño número de especies que se desarrollan a expensas de la pupa o del adulto (Clausen, 1972). Algunas familias de parasitoides son altamente específicas, entre ellas Mymaridae y Trichogrammatidae, se desarrollan exclusivamente en huevos de varios órdenes de insectos; mientras que los Eucharitidae sólo dentro de larvas y pupas de hormigas. La gran mayoría de Aphelinidae son parasitoides de cóccidos, áfidos y aleyrodidos y los Eulophidae atacan larvas de insectos productores de minas en las hojas (Clausen, 1972; Skarlato, 1987). Las larvas de calcidoideos pueden ser ectoparasitoides o endoparasitoides primarios de varios artrópodos, principalmente de insectos. Los hay también hiperparasitoides (Clausen, 1972; Skarlato, 1987). Sólo excepcionalmente se encuentran especies de hábito predador, como en Eurytomidae y Torymidae o de hábito fitófagos (Agaonidae y Tetramesa de Eurytomidae) (Skarlato, 1987). 3.1.2.3 Familia Aphelinidae El estudio de esta familia se hace dificultoso dado a que sus representantes se parecen morfológicamente a los Eulophidae y Trichogrammatidae, y biológicamente a los Signiphoridae y Encyrtidae. Existen aproximadamente 50 géneros y 1000 especies de afelínidos descriptos en el mundo, la mayoría se encuentran en las regiones tropicales y en Australia, pero algunos miembros están representados en otras regiones zoogeográficas. La dispersión de estos parasitoides a nuevas áreas se produce frecuentemente por la introducción accidental de sus hospederos (De Santis, 1948a; Viggiani, 1984; Hanson & Lasalle, 1995). En Argentina se conocen 72 especies de las presentes en el mundo (De Santis, 1998). Son insectos endoparasitoides o ectoparasitoides primarios de Hemiptera: Sternorrhyncha de las superfamilias Aphidoidea, Aleyrodoidea y Coccoidea. Unos pocos son conocidos por desarrollarse sobre otros huéspedes como Psylloidea, huevos de Orthoptera y de Lepidoptera o pupas de Diptera (De Santis, 1948a; Clausen, 1972; Viggiani, 1984; Yasnosh, 1987; Polaszek, 1991; Polaszek et al., 1992; Evans et al., 1995; Hanson & Lasalle, 1995). El hiperparasitoidismo ocurre en algunas Paz, Miriam R; MICROHIMENÓPTEROS PARASITOIDES DE Trialeurodes vaporariorum (Westwood) … 35 /100 especies de los géneros Ablerus Howard, Azotus Howard, Coccophagoides Girault, Coccophagus Westwood, Encarsia, Euxanthellus Silvestri, Lounsburyia Annecke & Compere, Marieta Motschulsky y Physcus Howard e involucra el desarrollo de ambos sexos o sólo del macho (Clausen, 1972; Viggiani, 1984; Polaszek, 1991; Polaszek et al., 1992; Hanson & Lasalle, 1995). La mayoría de los afelínidos son biparentales. Las hembras después de la cópula pueden colocar huevos fecundados (diploides) o sin fecundar (haploides), de los cuales se desarrollaran hembras o machos, respectivamente. Las hembras no fecundadas producen sólo huevos haploides, de los cuales se desarrollan machos (partenogénesis arrenótoca). La producción de machos o hembras dependen del acoplamiento y de la disponibilidad de huéspedes. Algunas especies son uniparentales y se reproducen por partenogénesis telitóquica (De Santis, 1948a; Viggiani, 1984). De Santis (1948a), realiza una descripción completa de los diferentes estados de desarrollo por los que pasan los afelínidos. Los huevos son de diferentes formas, subcilíndricos, ligeramente arqueados o reniformes y con los extremos redondeados. Son depositados en muy distintas posiciones: externamente, adheridos o enclavados al tegumento de las víctimas o en la proximidad de las mismas e internamente en la cavidad del cuerpo, a veces con localizaciones muy especiales. El estado larval tiende a ser homogéneo en forma y estructura, siendo las larvas de tipo himenopteriforme en sus tres estadios. Estas se caracterizan por tener una segmentación visible, sin espinas y carecen de papilas sensoriales, como en Prospaltella, Coccophagus, Physcus y Encarsia. Las larvas primarias endófagas son, por lo general, completamente apnéusticas y las ectófagas, en cambio, presentan un número variable de espiráculos que van de cinco a ocho pares. Al final del desarrollo larvario, antes de pasar a pupa, la larva defeca, recibiendo las deyecciones el nombre de meconio. Estas poseen una coloración, forma, superficie y localización específica que pueden proveer características adicionales para la identificación de géneros y especies (Viggiani, 1984; Yasnosh, 1987). La pupa es de tipo libre y se encuentra bien resguardada, ya sea, por el cuerpo de la víctima o por los escudos y otras defensas de estas últimas (De Santis, 1948a). Los adultos generalmente emergen del huésped realizando un orificio circular con las mandíbulas (Figs. 18A y F del anexo) y luego se ayudan con las patas para completar la salida, realizando movimientos lentos como algunas especies del género Encarsia. Una vez que emerge el adulto, realiza vuelos cortos, lo cual ocurre comúnmente en los días tibios de verano. La dispersión es probablemente ayudada por el movimiento del aire a baja velocidad (De Santis, 1948a; Clausen, 1972; Viggiani, 1984). Ocurrido el acoplamiento, las hembras están en condiciones de efectuar la Paz, Miriam R; MICROHIMENÓPTEROS PARASITOIDES DE Trialeurodes vaporariorum (Westwood) … 36 /100 puesta, para ello eligen cuidadosamente al huésped realizando comprobaciones muy singulares, procurando siempre que la progenie cuente con suficiente cantidad de alimento (De Santis, 1948a). Los afelínidos poseen poco dimorfismo sexual, en general puede afirmarse que los machos son relativamente más pequeños, de abdomen menos desarrollado y de colores más oscuros. Donde se manifiestan más las diferencias sexuales es en las antenas, resultando a veces muy distintas en longitud, coloración, número de artejos, formas de éstos y por la presencia de sensorios y setas de distinta clase que pueden llevar uno u otro sexo (De Santis, 1948a). Los adultos se alimentan principalmente de néctar, melado y otras sustancias azucaradas. Las hembras de los géneros Aphytis, Aphelinus, Coccophagus y Encarsia, entre otros, realizan succión del huésped para obtener proteínas, siendo esta actividad importante en la producción de huevos (De Santis, 1948a; Clausen, 1972; Viggiani, 1984). El ciclo de vida de los afelínidos, desde la oviposición hasta la emergencia del adulto, está relacionado con los factores climáticos y con el huésped. Bajo condiciones de campo en la primavera y el verano y con huéspedes multivoltinos tienen un ciclo de vida corto, entre 15 a 35 días (Clausen, 1972; Viggiani, 1984). El número de generaciones por año varían con las condiciones climáticas locales y es independiente de las generaciones del huésped. Algunos afelínidos asociados con especies univoltinas desarrollan más de una generación por año (Viggiani, 1984). Pasan el invierno en estado adulto, ésto se vio en especies de los géneros Aphytis, Coccophagus y Encarsia. Los endoparasitoides, están protegidos por el cuerpo del huésped y pueden sobrevivir a muy bajas temperaturas (Viggiani, 1984). Morfológicamente los afelínidos se caracterizan por ser pequeños y raramente exceden 1mm de largo. Su cuerpo, generalmente, es corto y compacto de color amarillo, grisáceo, castaño, negro o una combinación de estos colores (De Santis, 1948a; Viggiani, 1984; Yasnosh, 1987; Hanson & Lasalle, 1995). Presenta cabeza transversa tan ancha como el tórax, con ojos compuestos grandes y pilosos y ocelos dispuestos en forma de triángulo (Fig. 6A del anexo) (De Santis, 1948a). Las antenas no tienen más de 9 segmentos (Figs. 7A y B del anexo). El aparato bucal posee generalmente, mandíbulas con tres dientes, o con uno o dos dientes y un diente truncado, o raramente sin dientes. Pronoto corto y muy pequeño. Los surcos parapsidales del escudo del mesonoto están bien marcados (Fig. 6B del anexo). El primer par de alas posee la vena marginal larga, la estigmal corta y la postmarginal generalmente ausente o muy corta. Disco alar más o menos piloso, a veces con una franja glabra que baja desde la vena estigmal hasta el borde posterior del ala (Figs. 8A Paz, Miriam R; MICROHIMENÓPTEROS PARASITOIDES DE Trialeurodes vaporariorum (Westwood) … 37 /100 y B del anexo). El espolón de la tibia media generalmente es largo y delgado. Los tarsos tienen 5 segmentos y raramente el mesotarso con 4 segmentos (Fig. 7C del anexo). El metasoma esta anchamente unido al mesosoma, sin un pecíolo evidente (De Santis, 1948a; Yasnosh, 1987; Hanson & Lasalle, 1995). 3.1.2.3.1 Subfamilia Coccophaginae Dentro de Aphelinidae se encuentra la subfamilia Coccophaginae, que se caracteriza por presentar: antenas con 7 a 9 segmentos, a menudo con anillos y pestañas cortas o moderadamente largas, nunca demasiado largas. Las alas del primer par son normales con abundante pilosidad, sin franja glabra oblicua, que baje desde la vena estigmal hasta el borde posterior del ala. Las venas estigmal o postmarginal son cortas o están ausentes. Las alas posteriores varían desde muy estrechas a relativamente anchas, generalmente con mucha pilosidad. Los tarsos son homómeros (5-5-5) o heterómeros (5-4-5). El abdomen posee una segmentación más o menos perceptible (De Santis, 1948a; Polaszek & Hayat, 1992). Esta subfamilia es la que está mejor representada en la República Argentina, las especies encontradas pertenecen a los géneros Coccophagus, Encarsia, Aspidiotiphagus Howard, Ablerus, Aneristus Howard, Azotus Howard, Prospaltella, Prophyscus De Santis y Encyrtophyscus Blanchard, caracterizados todos ellos por poseer tarsos pentámeros, con excepción de algunas especies de Encarsia que son heterómeros (De Santis, 1948a). 3.1.2.3.1.1 Encarsia Förster, 1878 Muchas especies de este género resultaron ser muy exitosas en programas de control biológico en todo el mundo, particularmente en la lucha contra moscas blancas. El rol que juegan como enemigos naturales nativos de hemípteros plaga ha sido muy destacado (De Santis, 1948a; Clausen, 1972, Polaszek & Hayat, 1992; Polaszek et al., 1994; Polaszek et al., 1999; Noyes, 2003). El uso de las especies del género Encarsia para controlar biológicamente a moscas blancas se hizo a través del método clásico, pero también mediante los métodos inundativos o inoculativos. Algunos de estos trabajos mostraron excelentes resultados (Van Lenteren & Woets, 1988) y otros en cambio fallaron (Byrne et al., 1990; Gerling, 1992). Polaszek et al. (1992) indican que una de las plagas más serias en América Central es B. tabaci junto a T. vaporariorum. Las especies parasitoides asociadas Paz, Miriam R; MICROHIMENÓPTEROS PARASITOIDES DE Trialeurodes vaporariorum (Westwood) … 38 /100 comúnmente a estas plagas son los afelínidos de los géneros Encarsia y Eretmocerus. El control realizado por E. formosa contra la mosca blanca de los invernaderos T. vaporariorum resultó exitoso en muchas partes del mundo, por lo que se la utiliza comercialmente desde hace aproximadamentes 80 años (De Santis, 1948a; Gerling, 1966a; Clausen, 1972, 1978; Van Lenteren & Woets, 1988; Polaszek et al., 1992; García Mari et al., 1994; Schauff & Evans, 1995; Noyes, 2003). Haciendo una breve revisión, se comprueba que existe un gran número de enemigos naturales de B. tabaci y T. vaporariorum que fueron colectados en distintas partes del mundo. Entre los parasitoides, los más representados son los géneros Eretmocerus, Encarsia y Amitus. De ellos Encarsia es el que mayor número de especies descriptas presenta. En América del Sur las especies más comunes son: E. desantisi, E. hispida, E. nigricephala, E. pergandiella, E. porteri, E. quaintancei. En América Central, E. hispida, E. nigricephala, E. pergandiella, E. strenua. En la región del Caribe, E. hispida, E. nigricephala, E. pergandiella, E. strenua, E. luteola y E. transvena. En América del Norte, E. formosa, E. hispida, E. nigricephala, E. pergandiella, E. luteola y E. transvena. En la región Paleártica, E. adrianae LopezAvila, E. japonica Viggiani, E. strenua y E. transvena. En India y Pakistán, E. adrianae, E. brevivena Hayat, E. cibcensis Lopez-Avila, E. inaron, E. longifasciata Subba Rao, E. mohyuddini Shafee & Rizvi, E. strenua y E. transvena. En África, E. formosa, E. lutea, E. mineoi y E. transvena. En Oriente Medio, E. lutea, E. mineoi y E. luteola. En Europa, E. formosa, E. hispida, E. inaron, E. pergandiella y E. tricolor (Polaszek et al., 1992; Hoelmer, 1995). Se conocen aproximadamente, entre 200 a 500 especies de Encarsia en todo el mundo, pero probablemente faltan por descubrir el doble de este número (Polaszek et al., 1994). Morfológicamente, Encarsia se caracteriza por presentar una coloración variable desde amarillo pálido a completamente castaño oscuro, siendo los machos generalmente más oscuros que las hembras. Poseen la cabeza igual o un poco más ancha que el cuerpo, las antenas tienen siete a ocho segmentos con maza de uno a tres antenitos. El escutelo es mucho más ancho que largo con las axilas bien marcadas penetrando la escápula, posee dos pares de setas y un par de placas con sensilias (sensilias escutelares). El primer par de alas tiene la vena marginal no más corta que la submarginal; estigmal corta y flecos marginales más cortos que el ancho máximo del ala. Las patas con tarsos pentámeros o a veces los tarsos de la pata media con cuatro segmentos. El gáster posee siete terguitos y el ovipositor se encuentra expuesto. La genitalia del macho es larga y angosta (De Santis, 1948a; Yasnosh, 1987; Polaszek et al., 1999). Paz, Miriam R; MICROHIMENÓPTEROS PARASITOIDES DE Trialeurodes vaporariorum (Westwood) … 39 /100 3.1.2.3.1.1.1 Encarsia desantisi Viggiani, 1985 (grupo Luteola) Encarsia bicolor De Santis, 1948. Encarsia bicincta De Santis, 1981. Encarsia desantisi Viggiani, 1985. Ubicación taxonómica: Hymenoptera: Aphelinidae: Coccophaginae. Diagnosis: Longitud 0,7–0,8 mm. Hembra: cabeza, mesosoma, base del metasoma y penúltimos dos terguitos pardo claros (Fig. 14E del anexo). Antena de la hembra con maza claramente biarticulada (Fig. 14B del anexo). Macho predominantemente oscuro con patas pálidas (Fig. 14D del anexo) y con el quinto y sexto segmento antenal parcialmente fusionados (Fig. 14A del anexo). Sensilias escutelares ampliamente separadas entre sí. Formula tarsal 5-4-5. Espolón de la tibia media del mismo largo que el basitarso correspondiente. Primer par de alas uniformemente setosas (Fig. 14C del anexo) (De Santis 1948a, 1981a; Polaszek et al., 1992; Cave, 1995). Hospederos: Bemisia tabaci (De Santis, 1948a, 1981a; Polaszek et al., 1992; Cave, 1995). Distribución: Venezuela (Polaszek et al., 1992; Cave, 1995; Heraty & Woolley, 2002), Brasil (De Santis, 1948a, 1981a; Polaszek et al., 1992; Cave, 1995; Heraty & Woolley, 2002), Honduras y Costa Rica (Cave, 1995), Argentina (De Santis, 1948a, 1981a, Heraty & Woolley, 2002). Biología: Las hembras de E. desantisi depositan huevos diploides en las larvas de moscas blancas, de donde emergen hembras. En cambio, nacen machos cuando colocan huevos haploides en larvas maduras de su misma especie. El período de desarrollo es de 15-16 días (Cave, 1995). Es posible observar la pupa del parastoide a través del tegumento de la mosca blanca parasitoidizada. La pupa del parasitoide que origina una hembra es de coloración castaña oscura, siendo más oscuro el meconio que se dispone a los costados del cuerpo. Las pupas que originan machos son castañas oscuras, con meconio de coloración y disposición similares a las de las hembras. Material examinado: Se identificaron cinco hembras y 15 machos de E. desantisi sobre T. vaporariorum en plantas de “ruda” R. chalepensis de San Isidro de Lules, Tucumán. Se realizaron estudios morfológicos comparativos con especímenes del MLP: 19 hembras y cinco machos de E. bicolor, determinadas por el Dr. De Santis procedente de Brasil: Sao Paulo, Campinas sobre B. tabaci (V-80, Lourençao coll.). Observaciones: Esta especie muy común en América del Sur, citada para el país sobre B. tabaci puede ser confundida con E. hispida también de amplia difusión. Para Paz, Miriam R; MICROHIMENÓPTEROS PARASITOIDES DE Trialeurodes vaporariorum (Westwood) … 40 /100 su diferenciación se debe tener en cuenta la coloración del tórax y gáster de la hembra y el grado de separación entre el quinto y el sexto artejo funicular del macho. 3.1.2.3.1.1.2 Encarsia formosa Gahan, 1924 (grupo Luteola) Trichaporus formosus Gahan, 1924. Encarsia formosa Viggiani, 1988. Ubicación taxonómica: Hymenoptera: Aphelinidae: Coccophaginae. Diagnosis: Longitud 0,6 mm. Hembra: cabeza (excepto antenas) y tórax completamente castaño oscuros o negros, metasoma pálido amarillento (Figs. 12A y B del anexo). Macho similar a la hembra pero con el metasoma negro. Antena de la hembra con el segundo artejo funicular con un sensilio. Antena del macho con el quinto y sexto artejo funicular separados. Cada axila al menos con seis celdas reticuladas longitudinales. Sensilias escutelares ampliamente separadas. Formula tarsal 5-4-5. Espolón de la tibia media con un largo menor que la mitad del basitarso correspondiente (Fig. 12E del anexo). Primer par de alas uniformemente setosas y vena marginal con seis a ocho setas largas (Fig. 12C del anexo). (Polaszek et al., 1992; Schauff & Evans, 1995; Polaszek et al., 1999). Hospederos: Aleyrodidae: Aleuroglandulus malangae Russell, Aleurotrachelus trachoides (Back), Aleyrodes lonicerae Walker, A. proletella (Linneaus), Dialeurodes chittendeni Laing y D. citri (Ashmead) (Polaszek et al., 1992; Schauff & Evans, 1995; Polaszek et al., 1999: Heraty & Woolley, 2002). Aleyrodes spiraeoides Quaintance, B. tabaci (Gerling, 1967; Polaszek et al., 1992; Schauff & Evans, 1995; Polaszek et al., 1999; Heraty & Woolley, 2002). T. vaporariorum (Peck, 1963; Polaszek et al., 1992; Schauff & Evans, 1995; Polaszek et al., 1999; Heraty & Woolley, 2002). B. argentifolii, Crenidorsum sp., Tetraleurodes mori (Quaintance) y Trialeurodes abutilonea (Schauff & Evans, 1995). T. variabilis (Gerling, 1967; Schauff & Evans, 1995). Distribución: Cosmopolita (Peck, 1963; Gerling, 1983; Polaszek et al., 1992; Schauff & Evans, 1995; Polaszek et al., 1999; Heraty & Woolley, 2002). En Argentina, E. formosa fue introducida para el control biológico de T. vaporariorum (De Santis, 1981a), pero no existe información sobre la efectividad de su uso. En otros países como Egipto, Nueva Zelanda y España, también fue introducida y realizó un efectivo control de T. vaporariorum y de B. tabaci (Bordas et al., 1981; Llorens Climent & Garrido Vivas, 1992; Abd-Rabou, 1998; Carnero et al., 2000; Martín, 2003). Biología: El origen de E. formosa es incierto pero se cree que proviene de las regiones tropicales o subtropicales de América (Clausen, 1978). Es una especie uniparental y solitaria. Los machos son poco comunes, pero cuando están presentes se desarrollan Paz, Miriam R; MICROHIMENÓPTEROS PARASITOIDES DE Trialeurodes vaporariorum (Westwood) … 41 /100 sobre larvas de su misma especie (Gerling, 1966a, 1983; Schauff & Evans, 1995). La hembra se comporta como endoparasitoide primario de larvas y “pupas” de moscas blancas (Gerling, 1967; Clausen, 1978). Prefiere el tercer y cuarto estadio larval del huésped para realizar la postura. Cuando E. formosa esta a medio desarrollar dentro de la larva de mosca blanca, ésta se vuelve negra (Fig. 18A del anexo). Con temperaturas de 20°C requiere 28 días para completar su desarrollo desde huevo al estado adulto. A medida que aumenta la temperatura su desarrollo es más rápido (Clausen, 1978). En nuestro país, López & Botto (1995a) observaron que bajo condiciones de laboratorio, la longevidad de los adultos fue de 10,9 días, el máximo de moscas blancas atacadas fue de 13,8 larvas/día, a una densidad de 40 larvas/día y con una eficiencia máxima del 64% a bajas densidades (5-10 larvas/día). También se evaluaron otros parámetros biológico como supervivencia, fecundidad específica, tasa intrínseca de crecimiento poblacional, tasa neta de reproducción y tiempo generacional sobre cultivos de tomate en el INTA, Castelar provincia de Buenos Aires (López & Botto, 1995b). Botto (1999) realizó además, experiencias “piloto” de control biológico en invernáculos experimentales, indicando que la dosis de liberación semanal de E. formosa es de 2–3 pupas/m2 durante el ciclo de cultivo y a partir del momento en que se observen las primeras moscas blancas en “trampas amarillas” y en las plantas. Estos niveles de liberación fueron suficientes para mantener a la plaga a niveles de abundancia subeconómicos. No obstante estas dosis deben ajustarse convenientemente de acuerdo con los niveles de infestación inicial del cultivo. Material examinado: Se identificaron ocho hembras de E. formosa sobre T. vaporariorum en plantas de “ruda” R. chalepensis de San Isidro de Lules, Tucumán. Se realizaron estudios morfológicos comparativos con especimenes del MLP, identificadas por el Dr. De Santis. En este caso se observó el siguiente material: siete hembras de E. formosa procedentes de Buenos Aires, colectadas sobre Aleyrodidae (I-81, Mosquera col.) y seis hembras colectadas sobre T. vaporariorum procedentes de Córdoba (Home, col.). Observaciones: Especie cosmopolita, señalada como el más efectivo parasitoide de T. vaporariorum, fue introducida a nuestro país desde Canadá en 1981. 3.1.2.3.1.1.3 Encarsia hispida De Santis, 1948 (grupo Luteola) Encarsia hispida De Santis, 1948. Encarsia meritoria Viggiani, 1989. Ubicación taxonómica: Hymenoptera: Aphelinidae: Coccophaginae. Paz, Miriam R; MICROHIMENÓPTEROS PARASITOIDES DE Trialeurodes vaporariorum (Westwood) … 42 /100 Diagnosis: Longitud 0,6–0,8 mm. Hembra completamente amarilla limón (Fig. 13E del anexo) y macho más oscuro con el dorso de la cabeza, márgenes laterales del mesoescudo y escutelo pálidos. Antenas del macho con el quinto y sexto segmento funicular separados. Sensilias escutelares ampliamente separadas (Fig. 13D del anexo). Fórmula tarsal 5-4-5. Espolón de la tibia media tan largo como el basitarso correspondiente (Fig. 13A del anexo). Primer par de alas uniformemente setosas (Fig. 13B del anexo) (De Santis, 1948b; Polaszek et al., 1992; Cave, 1995; Schauff & Evans, 1995). Hospederos: Aleyrodidae: Aleuroglandulus malangae, Aleurothrixus porteri Quaintance & Baker, Siphoninus phillyreae (Haliday), T. vaporariorum y B. tabaci (Polaszek et al., 1992; Cave, 1995; Schauff & Evans, 1995; Heraty & Woolley, 2002; Arnal et al., 2003). T. variabilis y T. abutilonea (Cave, 1995; Schauff & Evans, 1995). Aleyrodes spiraeoides, B. argentifolii, Dialeurodes sp., Tetraleurodes acaciae (Quaintance), Trialeurodes floridensis (Quaintance) (Peck, 1963; Schauff & Evans, 1995) y Aleurotrachelus socialis (Heraty & Woolley, 2002). Distribución: Brasil, Chile, República Dominicana, Guadeloupe, Honduras, Jamaica, México, Puerto Rico, Venezuela, Bermudas, Bahamas y Trinidad (Polaszek et al., 1992; De Santis & Fidalgo, 1994; Cave, 1995; Schauff & Evans, 1995; Heraty & Woolley, 2002). De Santis (1948a) y De Santis & Esquivel (1966) citan esta especie sobre Aleyrodidae en Argentina en la provincia de Santa Fé. También se la encontró sobre S. phillyreae en arbolado urbano de Fraxinus excelsior L. (Oleaceae) en la provincia de Mendoza (Viscarret et al., 2000). Biología: Su reproducción es arrenótoca y posiblemente por autoparasitismo. La hembra es endoparasitoide solitaria de larvas de mosca blanca (Cave, 1995). Encarsia hispida presenta una pupa que puede observarse perfectamente por transparencia a través del tegumento de la mosca blanca. La pupa del parasitoide es muy clara, parece transparente con dos meconio castaño claros en forma de puntos a los costados de la pupa. Material examinado: Se identificaron dos hembras de E. hispida sobre T. vaporariorum en cultivo de pimiento C. annum y tres hembras en plantas de “ruda” R. chalepensis, de San Isidro de Lules, Tucumán. Se realizaron estudios comparativos con ejemplares holotipo y paratipo del MLP. Se estudiaron una hembra holotipo y 22 paratipos hembras de E. hispida determinadas por el Dr. De Santis procedentes de la ciudad de Rosario, Santa Fé, (V-47, Hack col.) sobre Aleyrodidae en Salvia splendens (Loiacono et al., 2003). Paz, Miriam R; MICROHIMENÓPTEROS PARASITOIDES DE Trialeurodes vaporariorum (Westwood) … 43 /100 3.1.2.3.1.1.4 Encarsia inaron (Walker), 1839 (grupo Inaron) Aphelinus inaron Walker, 1839. Aphelinus idaeus Walker, 1839. Encarsia partenopea Masi, 1910. Encarsia indifferentis Mercet, 1929. Trychaporus aleyrodis Mercet, 1930. Trichaporus partenopea Mercet, 1931. Encarsia inaron Graham, 1976. Encarsia brassicae Shafee & Darvas, 1984. Encarsia borealis Hulden, 1986. Encarsia inaron Hayat, 1989. Ubicación taxonómica: Hymenoptera: Aphelinidae: Coccophaginae. Diagnosis: Hembra con cabeza y tórax castaño oscuro, gáster pálido con un sombreado de distinta intensidad (Fig. 16D del anexo). Maza antenal castaña de 2 segmentos. Macho completamente castaño oscuro (Fig. 16E del anexo) con el quinto y sexto segmento funicular separados y abundantes sensilias longitudinales en todos los antenitos (Fig. 16C del anexo). Tórax con escultura reticulada y celdas simples. Sensilias escutelares ampliamente separadas. Fórmula tarsal 5-5-5 (Fig. 15A del anexo). Primer par de alas uniformemente setosas (Fig. 16B del anexo) (Polaszek et al., 1992; Schauff & Evans, 1995; Polaszek et al., 1999). Hospederos: Aleyrodidae: Acaudaleyrodes citri Priesner & Hosney, Aleyrodes singularis Danzig, Asterobemisia carpini (Koch), A. paveli (Zahradnik), Bulgarialeurodes cotesii (Maskell), Bemisia sp., Siphoninus inmaculatus (Heeger) y S. phillyreae (Polaszek et al., 1992; Schauff & Evans, 1995; Heraty & Woolley, 2002). Aleyrodes lonicerae, A. proletella, B. tabaci y T. vaporariorum (Polaszek et al., 1992; Schauff & Evans, 1995; Polaszek et al., 1999; Heraty & Woolley, 2002). Aleuroglandulus malangae, Aleurotrachelus trachoides, Aleyrodes spiraeoides, Dialeurodes chittendeni, D. citri (Polaszek et al., 1999). Bemisia argentifolii (Schauff & Evans, 1995). Aleyrodes brassicae Walker, A. elevatus Silvestri, Pealius quercus Signoret, Tetraleurodes hederae Goux (Heraty & Woolley, 2002). Distribución: Europa, norte de África y Asia. Introducida en Norte América (Polaszek et al., 1992; Schauff & Evans, 1995; Polaszek et al., 1999; Heraty & Woolley, 2002). En otros países es muy importante el control natural y biológico que ejerce esta especie sobre la mosca blanca S. phillyreae (Pickett & Pitcairn, 1999; Mondaca Rivas, 2000; Nguyen & Avas, 2000; Martín, 2003; entre otros). En Argentina se la encontró en Paz, Miriam R; MICROHIMENÓPTEROS PARASITOIDES DE Trialeurodes vaporariorum (Westwood) … 44 /100 la provincia de Mendoza sobre la misma plaga en fresno del arbolado urbano (Holgado & Mácola, 1998). Biología: Tanto las hembras como los machos de E. inaron se desarrollan como endoparasitoides primarios de mosca blanca, siendo más comúnmente asociado a la “mosca blanca cenicienta”, S. phillyreae. La hembra ovipone sobre el tercer y cuarto estadio larval de la mosca blanca. Con temperaturas de 25°C, su ciclo de vida dura aproximadamente 21 días (Pickett, 1997). Las pupas de E. inaron, que pueden verse a través del tegumento de la mosca blanca atacada, son grisáceas al igual que los meconios cuando originan hembras y de color gris oscuro cuando dan machos. Material examinado: Se identificaron tres hembras y dos machos sobre T. vaporariorum en plantas de “ruda” R. chalepensis, de San Isidro de Lules, Tucumán. Se realizaron estudios morfológicos comparativos con especímenes del MLP, observándose tres hembras y 10 machos de E. inaron, provenientes de Luján de Cuyo, Mendoza en MLP (XII-97, Mácola & Holgado cols.) y determinados por el Dr. De Santis. Observaciones: Registrada sobre T. vaporariorum en Brasil, en Argentina sólo se encontró parasitoidizando a S. phillyreae en la provincia de Mendoza. Se diferencia del resto de las otras especies de Encarsia, por presentar las sensilias escutelares ampliamente separadas y las hembras con maza antenal claramente de dos segmentos. 3.1.2.3.1.1.5 Encarsia nigricephala Dozier, 1937 (grupo Cubensis) Encarsia nigricephala Dozier, 1937 Ubicación taxonómica: Hymenoptera: Aphelinidae: Coccophaginae. Diagnosis: Longitud 0,6 mm. Hembra: cabeza y parte anterior del mesoescudo oscuros y el resto del cuerpo amarillo pálido (Fig. 11E del anexo). Macho: predominantemente oscuro y escutelo pálido. Antena del macho con el segundo segmento funicular más largo que el tercero y con un complejo sensorial; la hembra con el primer segmento funicular más corto que el pedicelo y maza antenal de tres segmentos (Fig. 11A del anexo). Mesoescudo con dos pares de setas (Fig. 11D del anexo). Sensilias escutelares ampliamente separadas. Fórmula tarsal 5–4–5 (Fig. 11B del anexo). Primer par de alas con un espacio desnudo alrededor de la vena estigmal, con su extremo algo aguzado (Figs. 11B y C del anexo) (Polaszek et al., 1992; Cave, 1995; Schauff & Evans, 1995). Hospederos: Aleyrodidae: T. vaporariorum, B. tabaci (Polaszek et al., 1992; Cave, 1995; Schauff & Evans, 1995; Heraty & Woolley, 2002; Arnal et al., 2003) y T. Paz, Miriam R; MICROHIMENÓPTEROS PARASITOIDES DE Trialeurodes vaporariorum (Westwood) … 45 /100 abutilonea (Cave, 1995; Schauff & Evans, 1995; Heraty & Woolley, 2002). B. argentifolii, T. floridensis (Schauff & Evans, 1995; Heraty & Woolley, 2002). Aleurodicus dispersus Russell, Aleurotrachelus atratus Hempel, Crenidorsum sp., Dialeurodes kirkaldyi (Kotinsky) (Heraty & Woolley, 2002). Distribución: Barbados, Colombia, Grenada, Guadeloupe, Guatemala, Honduras, Jamaica, México, Estados Unidos (Florida), Puerto Rico y Venezuela (Polaszek et al., 1992; Cave, 1995; Schauff & Evans, 1995; Heraty & Woolley, 2002), Brasil (De Santis, 1989; Polaszek et al., 1992; Cave, 1995; Schauff & Evans, 1995; Heraty & Woolley, 2002) y Ecuador (Heraty & Woolley, 2002). De Santis & Fidalgo (1994) la citan en Santiago del Estero, Argentina sobre B. tabaci. Biología: Su reproducción es arrenótoca y posiblemente por autoparasitismo. La hembra es endoparasitoide solitaria de larvas de mosca blanca (Cave, 1995). En E. nigricephala no se puede observar la pupa del parasitoide a través del tegumento de la mosca blanca. Al igual que en E. formosa se distinguen cambios en el huésped, el cual se torna de color dorado oscuro con bandas negras en la zona de la cabeza y hacia los costados del cuerpo. Por lo tanto para observar los caracteres de la pupa del parasitoide se debe disectar el material examinado. Material examinado: Se identificaron tres hembras de E. nigricephala sobre T. vaporariorum en el cultivo de tomate L. esculentum en San Isidro de Lules, Tucumán. Se realizaron estudios comparativos con ejemplares del MLP, observándose ocho hembras de E. nigricephala sobre B. tabaci procedentes del INTA La María, Santiago del Estero (22-II-90, Peterlín col.), determinadas por el Dr. De Santis; una hembra y un macho, sobre B. tabaci en Glycine max (L.) Merr. en 1991 determinados por G. A. Evans. Observaciones: Esta especie registrada en Santiago del Estero sobre B. tabaci se diferencia claramente de las otras especies de Encarsia por presentar la cabeza y la parte anterior del tórax negro contrastando con el resto del cuerpo de color amarillo. 3.1.2.3.1.1.6 Encarsia pergandiella Howard, 1907 (grupo Parvella) Encarsia pergandiella Howard, 1907. Encarsia versicolor Girault, 1908. Encarsia bemisiae De Santis, 1981. Aleurodophilus pergandiellus De Bach & Rose, 1981. Encarsia tabacivora Viggiani, 1985. Encarsia pergandiella Viggiani, 1988. Ubicación taxonómica: Hymenoptera: Aphelinidae: Coccophaginae. Paz, Miriam R; MICROHIMENÓPTEROS PARASITOIDES DE Trialeurodes vaporariorum (Westwood) … 46 /100 Diagnosis: Longitud 0,6 a 0,7 mm. Hembra de color amarillo, a veces con bandas levemente oscuras en la base del metasoma (Fig. 15D del anexo). Mesoescudo del macho con triángulo invertido oscuro y escutelo pálido (Fig. 15E del anexo). Antena de la hembra con maza de dos segmentos (Fig. 15C del anexo), la del macho con los dos últimos segmentos parcialmente fusionados. Fórmula tarsal 5–5–5 (Fig. 15A del anexo). Primer par de alas con espacio desnudo alrededor de la vena estigmal, oscurecidas (ahumadas) por debajo de la vena marginal y el largo máximo de los flecos marginales más largos que la mitad del ancho máximo del ala (Fig. 15B del anexo) (Gerling, 1966b; De Santis, 1981b; Polaszek et al., 1992; Cave, 1995; Schauff & Evans, 1995). Hospederos: Aleyrodidae: B. tabaci (De Santis, 1981a; Polaszek et al., 1992; Cave, 1995; Schauff & Evans, 1995; Heraty & Woolley, 2002). Trialeurodes variabilis (Polaszek et al., 1992; Cave, 1995; Schauff & Evans, 1995; Heraty & Woolley, 2002). T. vaporariorum (Peck, 1963; Gerling, 1966b; Polaszek et al., 1992; Cave, 1995; Schauff & Evans, 1995; Heraty & Woolley, 2002). Bemisia tuberculata, Tetraleurodes mori y Aleuropleurocelus sp (Cave, 1995). Trialeurodes abutilonea (Dysart, 1966; Cave, 1995; Schauff & Evans, 1995; Heraty & Woolley, 2002). Aleurodicus dispersus, Aleuroglandulus malangae, Aleuroplatus elemerae Mound & Halsey, Aleurothrixus floccosus, Aleurotrachelus trachoides, Bemisia argentifolii, Dialeurodes citri, D. kirkaldyi, Trialeurodes floridensis (Schauff & Evans, 1995). Aleyrodes sp., Aleuroplatus coronata (Back) (Peck, 1963; Schauff & Evans, 1995). Aleyrodes azaleae Baker & Moles (Peck, 1963; Gerling, 1966b; Heraty & Woolley, 2002). Aleurotrachelus socialis, Trialeurodes packardi Morrill, T. variabilis (Heraty & Woolley, 2002). Aleuroplatus coronatus (Quaintance) y Aleyrodes spiraeoides (Gerling, 1966b; Heraty & Woolley, 2002). Distribución: Costa Rica, El Salvador, Granada, Guadaloupe, Honduras, Italia, México, Estados Unidos, Puerto Rico y Venezuela (Polaszek et al., 1992; Cave, 1995; Schauff & Evans, 1995; Heraty & Woolley, 2002); Brasil y Colombia (De Santis, 1981a, 1989; Polaszek et al., 1992; Cave, 1995; Schauff & Evans, 1995; Heraty & Woolley, 2002); España (Peck, 1963); Australia, Guatemala e Israel (Heraty & Woolley, 2002). Encarsia pergandiella se estableció en Italia después de ser liberada en 1980 para el control biológico de T. vaporariorum (Polaszek et al., 1992) e introducida a Hawai desde California contra la misma plaga (Gerling, 1983). En Tucumán, Argentina, se encontró a E. pergandiella en cultivo de soja afectando a B. tabaci (Viscarret et al., 2000). Biología: Es un endoparasitoide solitario (Gerling, 1966b). Su reproducción es biparental y la cópula es muy corta, dura sólo siete segundos. La hembra ovipone Paz, Miriam R; MICROHIMENÓPTEROS PARASITOIDES DE Trialeurodes vaporariorum (Westwood) … 47 /100 preferentemente sobre el segundo y tercer estadio larval de la mosca blanca. Cuando coloca huevos en huéspedes pequeños emergen adultos de menor tamaño de lo normal y las alas anteriores son angostas y con largos flecos (Viggiani, 1984). También existe en esta especie autoparasitismo o hiperparasitoidismo. La hembra deposita huevos diploides, los cuales producen hembras en larvas de moscas blancas. Los huevos haploides son depositados en larvas del tercer estadio o pupas de su misma especie o de Eretmocerus spp., de donde emergen machos. El período de desarrollo es de 15 a 16 días (Gerling, 1966b; Viggiani, 1984; Cave, 1995). Gerling (1966b) realizó todos los estudios de este parasitoide sobre T. vaporariorum, observando características biológicas tales como comportamiento frente al huésped, longevidad, fecundidad, entre otros. En laboratorio se observó que las pupas que originan hembras son de color amarillo claro con meconio castaño claro y distribuido en forma irregular a los costados del cuerpo (Fig. 18B del anexo). En pupas que originan machos se distinguen por transparencia los rasgos del adulto y los meconios de color castaño oscuro se disponen de igual manera que en la hembra. Material examinado: En San Isidro de Lules, Tucumán y sobre T. vaporariorum se identificaron 45 hembras y 10 machos de E. pergandiella en el cultivo de pimiento C. annum; 17 hembras y 6 machos en tomate L. esculentum; 12 hembras en chaucha P. vulgaris; 5 hembras y 20 machos en alegría del hogar I. balsamina; 1 hembra y 1 macho en “ruda” R. chalepensis. Se realizaron estudios comparativos con ejemplares holotipo y paratipo del MLP, observándose una hembra holotipo y 17 paratipos hembras de E. bemisiae procedente de Brasil: Sao Paulo, Campinas (XII-79, Lourençao coll.) sobre B. tabaci determinadas por el Dr. De Santis (Loiácono et al., 2003). Observaciones: Especie registrada en Tucumán sobre B. tabaci en soja (Viscarret et al., 2000) pero no como parasitoide de T. vaporariorum. Presenta tarsos pentámeros y ala anterior con una evidente área sin setas alrededor de la vena estigmal que permite diferenciarla del resto de las especies de Encarsia. 3.1.2.3.1.1.7 Encarsia porteri (Mercet), 1927 (grupo Lahorensis) Prospaltella citrella porteri Mercet, 1927. Prospaltella porteri Blanchard, 1937. Encarsia porteri Polaszek, 1991. Ubicación taxonómica: Hymenoptera: Aphelinidae: Coccophaginae. Diagnosis: Longitud 0,6 a 0,8 mm. Cabeza, tórax y gáster amarillo limón (Fig. 17D del anexo). Hembra con maza antenal con 3 segmentos y primer artejo funicular más largo Paz, Miriam R; MICROHIMENÓPTEROS PARASITOIDES DE Trialeurodes vaporariorum (Westwood) … 48 /100 que ancho (más de la mitad del largo del pedicelo). Triángulo ocelar oscuro al menos en el borde interno de los ocelos en marcado contraste con el resto de la cabeza. Parte anterior del mesoscudo y axilas con pigmentación oscura, aumentando en forma variable. Sensilias escutelares ampliamente separadas (Fig. 17C del anexo). Fórmula tarsal 5–5–5 (Fig. 17A en anexo). Primer par de alas hialinas y uniformemente setosas (Fig. 17B del anexo). Ovipositor con la tercera válvula pálida (De Santis, 1948a; Polaszek et al., 1992; Cave, 1995). Hospederos: Aleyrodidae: Aleurothrixus aepim, A. porteri, y B. tabaci (Polaszek et al., 1992; Cave, 1995; Heraty & Woolley, 2002); Aleurocanthus sp. y T. vaporariorum (De Santis, 1979; Polaszek et al., 1992; Cave, 1995; Heraty & Woolley, 2002); Aleurothrixus floccosus (De Santis, 1979); Colias vauthieri Guérin - Meneville, Gnorismoschema operculella (Zeller), Rachiplusia nu Guenée (Rojas, 1968; De Santis, 1979; Viggiani, 1984); Heliothis zea (Boodie) (Guerrero et al., 1993); Anticarsia gemmatalis (Hűbner) y Pseudoplusia includens (Walker) (Ovruski & Frías, 1995) y Copitarsia turbata (Herrich & Schaffer) (Lamborot et al., 1995). Distribución: América Central (Cave, 1995) y América del Sur en los países de Argentina, Brasil y Chile (Polaszek et al., 1992; Cave, 1995). De Santis (1979, 1989) la cita en Perú sobre T. vaporariorum. En Argentina, se la cita sobre Aleurothrixus granelli Blanchard en la provincia de Chaco (De Santis, 1941; De Santis, 1948a; De Santis & Esquivel, 1966). Viscarret et al. (2000) menciona a E. porteri parasitoidizando al complejo B. tabaci en cultivos de algodón (Gossypium hirsutum) y soja (Glycine max) en las provincias de Santiago del Estero y Tucumán, respectivamente y sobre T. vaporariorum en salvia (Salvia splendens) en Ituzaingo, Buenos Aires. En la provincia de Mendoza, Holgado & Mácola (1998) la encontraron sobre S. phillyreae. Biología: La hembra de E. porteri es parasitoide primario en larvas de mosca blanca y coloca huevos diploides, de los cuales nacen hembras; mientras que en los huevos de algunas especies de Lepidoptera se desarrollan los machos como parasitoides primarios, a ésto se conoce con el nombre de “parasitoides heterotróficos” (Rojas, 1968; Viggiani, 1984; Polaszek, 1991; Polaszek et al., 1994; Cave, 1995). Ovruski & Frías (1995) indican que en el cultivo de soja del Departamento Burruyacu, Tucumán (Argentina), el 66,67% de los huevos de Anticarsia gemmatalis y Pseudoplusia includens (Lepidoptera: Noctuidae) estaban parasitoidizadas por E. porteri. En pruebas realizadas en laboratorio también se obtuvo esta especie a partir de huevos de los siguientes lepidópteros: Ephestia kuehniella Zeller, Eucosma aporema Walsingham y Plutella xylostella Linnaeus (Rojas, 1968). Con respecto a las características que presentan las “pupas” de mosca blanca parasitoidizadas por hembras de E. porteri Paz, Miriam R; MICROHIMENÓPTEROS PARASITOIDES DE Trialeurodes vaporariorum (Westwood) … 49 /100 pudo observarse que son de coloración amarillo limón con meconio de color castaño claro, dispuestas hacia la región posterior del abdomen. A medida que avanza su desarrollo, la pupa oscurece y se torna de color castaño claro y los meconios castaño rojizos. Todas estas características pueden observarse dada la transparencia del tegumento del huésped (Fig. 18C del anexo). Material examinado: Se identificaron 17 hembras de E. porteri sobre T. vaporariorum de las cuales 10 se encontraron en el cultivo de tomate (L. esculentum), 3 en pimiento (C. annum) y 4 en chaucha (P. vulgaris) de San Isidro de Lules, Tucumán. Se realizaron estudios comparativos con descripciones taxonómicas de E. lutea de diversos autores (Polaszek et al., 1992; Schauff & Evans, 1995; Polaszek et al., 1999) por la gran similitud que existen entre ellas. Observaciones: Especie citada para Argentina sobre T. vaporariorum y otras moscas blancas, puede ser confundida con E. lutea que también es cosmopolita, altamente polífaga y además de biología semejante. La diferencia con E. lutea es que esta última presenta la tercera válvula del ovipositor pardo oscura a negra y el primer artejo funicular de la hembra cuadrangular. 3.1.2.3.2 Subfamilia Aphelininae Esta subfamilia ha sido caracterizada morfológicamente por el Dr. De Santis (1948a). Los caracteres diagnósticos de la misma son: antenas con tres a seis artejos, excepcionalmente ocho, casi siempre provistas de anillos y setas cortas o moderadamente largas. El primer par de alas es normal, con numerosas setas discales y con una franja glabra oblicua, regular, que baja desde la vena estigmal hasta el borde posterior del ala, la cual es incompleta o está confusamente señalada. Las setas marginales del ala son muy cortas. Los tarsos son pentámeros, raramente tetrámeros. El abdomen con segmentación más o menos perceptible. De acuerdo con el mismo autor, los géneros presentes en la República Argentina son: Aphelinus, Eretmocerus, Marietta Motschulsky y Aphytis. 3.1.2.3.2.1 Eretmocerus Haldeman, 1850 A nivel mundial se conocen unas 30 especies del género Eretmocerus (Hanson, 1995a). En la Argentina solamente dos: E. paulistus y E. corni, ambos sobre Aleyrodidae (De Santis, 1948a, 1998). Algunas especies del género Eretmocerus fueron introducidas a diversos países para el control de diferentes biotipos de mosca blanca. Eretmocerus haldemani Paz, Miriam R; MICROHIMENÓPTEROS PARASITOIDES DE Trialeurodes vaporariorum (Westwood) … 50 /100 fue introducido en Hawai desde California para el control de la mosca blanca de los invernaderos (Gerling, 1983). Eretmocerus se caracteriza por presentar una coloración que varía desde amarillo pálido a amarillo anaranjado. La maza antenal es siempre alargada (de 10 a 16 veces más larga que ancha). En el primer par de alas se encuentra una franja glabra, oblicua irregular y poco definida. La nervadura marginal es corta, sólo un poco más larga que la vena estigmal. Los tarsos son tetrámeros, muy raramente pentámeros (De Santis, 1948a; Yasnosh, 1987). Hay dimorfismo sexual que se evidencia en las antenas, así la de los machos poseen solamente tres artejos (escapo, pedicelo y maza muy alargada con numerosos sensorios); mientras que las de las hembras poseen cinco (escapo, pedicelo, dos artejos anillos y maza relativamente corta y con escasos sensorios) (Figs. 10A y B del anexo) (De Santis, 1948a; Yasnosh, 1987). Son parasitoides primarios de moscas blancas (De Santis, 1948a; Viggiani, 1984; Yasnosh, 1987) y sólo excepcionalmente puede atacar cochinillas (De Santis, 1948a). La hembra deposita los huevos haploides y diploides sobre el cuerpo del huésped, el primer estadio larval es ectoparasitoide y los otros estadios son endoparasitoides (Viggiani, 1984). López & Botto (1997) encontraron a Eretmocerus sp. parasitoidizando a la mosca blanca de los invernaderos T. vaporariorum en cultivo de tomate y analizaron los siguientes parámetros biológicos: longevidad, tasa de supervivencia, fertilidad, tasa intrínseca de crecimiento poblacional, tasa reproductiva neta y tiempo generacional, mediante la construcción de tablas de vida. 3.1.2.3.2.1.1 Eretmocerus paulistus Hempel, 1904 Eretmocerus paulistus Hempel, 1904. Ubicación taxonómica: Hymenoptera: Aphelinidae: Aphelininae Diagnosis: Longitud 0,84 mm. Hembra de color amarillo pálido, más marcado en la cabeza y antenas apenas ennegrecidas (Fig. 10E del anexo). Macho con cabeza, porción anterior del escudo, metanoto y propodeo ennegrecidos (Fig. 10D del anexo). Ojos negros y ocelos rojizos. Cabeza casi tan ancha como el tórax. Maza antenal relativamente corta. Antenas de la hembra con cinco segmentos y del macho con tres segmentos (Figs. 10A y B del anexo). Escudo del mesonoto con dos pares de setas. Primer par de alas hialinas con nervaduras apenas ennegrecidas. Vena submarginal con dos setas largas y gruesas sobre el borde superior y marginal, con tres setas gradualmente más largas hacia la vena estigmática (Fig. 10F del anexo). Tarsos Paz, Miriam R; MICROHIMENÓPTEROS PARASITOIDES DE Trialeurodes vaporariorum (Westwood) … 51 /100 claramente tetrámeros con empodios poco desarrollados (Fig. 10C del anexo) (De Santis, 1948a). Hospederos: Aleyrodidae: Aleurothrixus howardi Quaintance, A. floccosus (De Santis, 1948a, 1967; Esquivel, 1950; De Santis & Esquivel, 1966) y T. vaporariorum (Gerling, 1983). Distribución: Brasil (De Santis, 1948a) y Haití (De Santis, 1948a, 1979); México y Perú (De Santis, 1979); Chile (De Santis, 1981a); Hawai (Gerling, 1983); Cuba (De Santis & Fidalgo, 1994) y Argentina, Tucumán (De Santis, 1948a, 1967; Esquivel, 1950; De Santis & Esquivel, 1966). Biología: Tanto machos como hembras se comportan como endoparasitoides primarios de moscas blancas. Cuando el parasitoide es una hembra, el tegumento de la “pupa” de la mosca blanca es de color amarillo claro con meconios anaranjados a los costados del cuerpo. En el caso del macho la “pupa” de la mosca blanca se torna hinchada de color amarillo dorado (Fig. 10D del anexo). No se puede observar la pupa del parasitoide por transparencia y, por lo tanto, se debe disectar el material examinado. Material examinado: Se identificaron dos hembras y dos machos de E. paulistus en cultivo de pimiento (C. annum); una hembra en tomate (L. esculentum); un macho en chaucha (P. vulgaris) todos sobre T. vaporariorum en San Isidro de Lules, Tucumán. Se realizaron estudios comparativos con especímenes del MLP, observándose: un macho de E. paulistus determinado por el Dr. De Santis procedente de Roque Saenz Peña, Chaco (febrero de 1949) sobre hojas de algodonero sin específicar el huésped (Leg. Zunino) y una hembra, sin datos de colección (VI-48). Esta especie fue citada para Tucumán sobre Aleurothrixus floccosus y A. howardi, pero no como parastoide de T. vaporariorum. Puede ser confundida con E. corni, citada para Argentina, incluso para Tucumán sobre B. tabaci, por lo cual se hizo necesario un estudio comparativo. Es así que se revisó el siguiente material: una hembra sobre pupas de Aleyrodidae en tomate procedente de Bahia Blanca (29-IX-48 Leg. Quintana); cinco machos sobre T. vaporariorum procedentes de La Cruz, Chile (XII-68, Rojas col.); cuatro hembras y seis machos sobre Aleyrodidae en lechuga procedente de La Plata (I-49 Leg. F. Q); una hembra y un macho sobre Aleyrodidae en Río Santiago (VIII-38 Leg. D. S.) todos estos materiales fueron identificados por el Dr. De Santis. Observaciones: A diferencia de E. paulistus, presenta maza antenal larga, escudo mesonotal con tres pares de setas y tarsos aparentemente pentámeros con empodios muy desarrollados (De Santis, 1948a). Paz, Miriam R; MICROHIMENÓPTEROS PARASITOIDES DE Trialeurodes vaporariorum (Westwood) … 52 /100 3.1.2.4 Familia Signiphoridae La familia Signiphoridae es reducida en cuanto a número de especies, conociéndose aproximadamente unas 75 especies a nivel mundial (Clausen, 1972; Tryapitsyn, 1987; Davis et al., 1990; De Santis, 1998). Existe controversia con respecto al número de géneros incluidos en esta familia. De Santis (1968) divide a Signiphoridae en dos subfamilias: Signiphorinae Howard y Thysaninae Peck. Para la primera, indica los géneros Kerrichiella Rozanov y Signiphora Ashmead y para la segunda los géneros Clytina Erdoes, Chartocerus Motschulsky, Thysanus Walker, y Neosigniphora Rust dando a conocer las especies identificadas y descriptas hasta ese momento en el mundo por diversos autores. Subba Rao (1974), considerá la familia con seis géneros: Clytina, Thysanus, Kerrichiella, Chartocerus, Signiphora, y Rozanoviella Subba Rao, con su correspondiente clave taxonómica. Woolley (1988), (citado por De Santis (1998) y por Mineo & Viggiani (2001)), se ocupa de la filogenia y clasificación de este grupo y reconoce como válidos cuatro géneros: Chartocerus, Thysanus, Clytina y Signiphora, todos los cuales, excepto Clytina, tienen representantes en la Argentina. Los géneros Matritia Mercet, Xana Kurdjumov, Signiphorina Nikol’skaya y Neocales Risbec son tratados como sinónimos de Thysanus; y Signiphorella Mercet, Kerrichiella y Rozanoviella como sinónimos de Signiphora. En la Argentina se conocen sólo 16 especies, lo que representa un 2,66 % de la fauna mundial (De Santis, 1998). Los signifóridos son cosmopolitas, aunque la mayoría de las especies se encuentran en la región Neotropical. No poseen gran importancia desde el punto de vista del control biológico y han sido muy poco usados, probablemente porque algunas especies presentan comportamiento hiperparasitoide (Hanson, 1995b). Se caracterizan por ser insectos muy pequeños de 0,5 a 2 mm de largo. Poseen el cuerpo compacto, aerodinámico, o a veces alargados y chatos. De coloración variada, desde completamente negro a enteramente amarillo anaranjado. Antenas cortas, con cuatro a siete antenitos. Segmentos del funículo presentan forma de anillos, en número de dos a cuatro y la maza se caracteriza por ser muy larga y no segmentada. Mandíbulas con dos a tres dientes. Mesoescudo sin notaulices. Axilas unidas al escutelo formando una sola banda transversa. Alas del primer par normales, con disco alar glabro, flecos marginales generalmente largos, vena marginal larga, estigmal muy corta y postmarginal ausente. Espolón de la tibia media dentado. Tarsos Paz, Miriam R; MICROHIMENÓPTEROS PARASITOIDES DE Trialeurodes vaporariorum (Westwood) … 53 /100 pentámeros. Propodeo formando un área media triangular. Pigostilos localizados en la punta del abdomen (Tryapitsyn, 1987; Davis et al., 1990; Hanson, 1995b). Los signifóridos son insectos solitarios que se comportan como ectoparasitoide de otros calcidoideos y proctotrupoideos y endoparasitoides de cóccidos, psílidos, áfidos y algunos dípteros (Clausen, 1972; Tryapitsyn, 1987; Davis et al., 1990; Hanson, 1995b). Algunas especies se comportan como hiperparasitoides de larvas maduras o pupas de calcidoideos y platygasteroideos (Clausen, 1972; Davis et al., 1990; Hanson, 1995b; Mineo & Viggiani, 2001). En América Central, Signiphora aleyrodis y S. townsendi son hiperparasitoides obligados de afelínidos sobre Aleyrodidae (Hanson, 1995b). Poseen reproducción partenogenética telitóquica, la producción de machos es menor al 1% y se da a altas temperaturas. Las hembras adultas realizan succión del huésped para obtener proteínas para la oviposición. Las larvas son de tipo himenopteriformes (Hanson, 1995b). 3.1.2.4.1 Signiphora Ashmead, 1880 El género Signiphora comprende unas 50 especies distribuidas en el mundo (Hanson, 1995b). En Argentina, se encuentran especies que afectan aleyródidos, entre ellas: S. caridei Bréthes encontrada sobre Aleurothrixus sp. en Buenos Aires, S. xanthographa Blanchard sobre A. floccosus, en La Plata, y sobre A. howardi en Paraná, Entre Ríos. También hay especies que afectan cóccidos como S. merceti Malenotti sobre Aspidiotus heredae Balachowsky en cítricos de Corrientes (Blanchard, 1936). S. aspidioti Ashmead sobre Aleyrodidae en Río Negro (De Santis, 1981a). S. flavopalliata Ashmead sobre Aonidiella aurantii (Maskell) y S. haywardi Blanchard sobre Hemiberlesia rapax (Comstock) ambas, en Tucumán (De Santis, 1967). Otras especies de Signiphora encontradas en nuestro país son: S. fax Girault, S. flavopalliata desantisi De Santis, S. f. occidentalis Howard, S. lutea Rust, S. bifasciata Ashmead, S. hyalinipennis Girault, S. mexicana Ashmead, S. perpauca Girault, S. townsendi y S. tumida De Santis (De Santis, 1998). Presentan un cuerpo compacto, con cabeza hipognata y depresión facial. Mandíbulas con 2 dientes. Funículo de la antena del macho y de la hembra con 3 segmentos. Pronoto corto y transverso. Espolón de la tibia media casi igual al largo del tarsito medio o un poco más corto. Vena marginal del ala anterior aproximadamente del mismo largo que la vena estigmal, largo máximo de los flecos marginales exceden el ancho máximo del ala (De Santis, 1968; Subba Rao, 1974; Tryapitsyn, 1987). Paz, Miriam R; MICROHIMENÓPTEROS PARASITOIDES DE Trialeurodes vaporariorum (Westwood) … 54 /100 3.1.2.4.1.1 Signiphora townsendi Ashmead, 1900 Thysanus townsendi Ashmead, 1900. Signiphora townsendi Ashmead, 1900. Signiphora townsendi Girault, 1913. Ubicación taxonómica: Hymenoptera: Signiphoridae Diagnosis: Longitud 0,45 a 0,60 mm. Hembra de color miel, con el vértice de la cabeza, margen del clipeo, pronoto, parte del lóbulo medio del mesoescudo y los primeros cinco a seis terguitos del gáster más oscuros (Fig. 9E del anexo). Presenta una franja amarilla limón que se extiende desde la parte distal del lóbulo medio del mesoescudo hasta la parte distal del propodeo (Fig. 9D del anexo). Alas anteriores con una banda oscura en correspondencia a la venación alar. Mandíbula bidentada, palpo maxilar con dos segmentos y labial con un segmento. Antenas con tres anillos pequeños, transversales, de dimensiones ligeramente crecientes desde el primero al tercero (Fig. 9A del anexo). Lóbulo medio del mesoescudo transversalmente reticulado con dos setas en su parte posterior. Escutelo transverso, subtrapezoidal, con cuatro setas largas en el margen distal y sensilias escutelares entre las setas medias. Alas anteriores con una seta sobre la vena submarginal, cuatro largas en el margen anterior, dos más en el margen posterior de la vena marginal, una sobre la vena estigmal y dos microsetas sobre la celda costal. Alas posteriores con los flecos marginales más largos que el ancho máximo del ala (Fig. 9C del anexo) y con dos setas sobre la vena marginal. Fórmula tarsal 5-5-5 (Fig. 9B del anexo). Segundo par de patas con el basitarso largo, casi el doble del basitarso de las patas posteriores. Macho más pequeño que la hembra (Fig. 9D del anexo) (Mineo & Viggiani, 2001). Hospederos: Aleyrodidae: Aleyrodes sp. y Aleurothrixus sp. (De Santis, 1979) y A. floccosus (Mineo & Viggiani, 2001). Diaspididae: Aspidiotus sp. (De Santis, 1979). Distribución: México, Perú, Argentina (De Santis, 1979), Uruguay (De Santis, 1989) e Italia (Mineo & Viggiani, 2001). Biología: La “pupa” de la mosca blanca atacada por el parasitoide, cuando origina una avispa hembra, es de color castaño o caramelo con líneas transversales grisáceas en la zona del abdomen. Cuando da origen a una avispa macho es grisácea con meconio de color castaño oscuro distribuido en forma irregular a los costados del abdomen. Material examinado: Sobre T. vaporariorum se identificaron tres hembras y un macho de S. townsendi en cultivo de tomate (L. esculentum); cuatro hembras y cinco machos en “ruda” (R. chalepensis) en San Isidro de Lules, Tucumán. Se realizaron estudios comparativos con diferentes materiales porque no se contaba con claves taxonómicas. Al comparar los preparados con ejemplares del MLP se identificó a S. townsendi. Los Paz, Miriam R; MICROHIMENÓPTEROS PARASITOIDES DE Trialeurodes vaporariorum (Westwood) … 55 /100 materiales comparados fueron: 11 hembras y siete machos de S. townsendi determinados por el Dr. De Santis provenientes de la ciudad de Rosario (Santa Fé) sobre Aleyrodidae en coral rojo, (V-47, Leg. Hack); una hembra de S. aleyrodis determinada por Woolley sobre B. tabaci proveniente de Pacific lands (12-VI-91) y una hembra de la misma especie determinada por Girault proveniente de Perú en (I-10, Townsend col.); otra hembra determinada por Woolley sobre A. cardini asociado con Encarsia (VIII-83, H. L. Dossier col.); dos hembras de S. aspidioti determinadas por el Dr. De Santis, provenientes de Río Negro, Cinco Salto sobre Aleyrodidae (V-81, Porley col.); una hembra de la misma especie determinada por Woolley, proveniente de Texas: Hidalgo taes weslaco (24-VII-85, C. W. Helton col.). Además para corroborar la identificación se la comparó con la descripción realizada por Mineo & Viggiani (2001). Observaciones: Especie señalada como parasitoide de moscas blancas de los géneros Aleyrodes y Aleurothrixus entre otros, es considerada actualmente como hiperparasitoide de Aphelinidae sobre distintos aleyródidos. 3.2 Interrelación Planta Hospedera - Parasitoide Realizados los cálculos de prevalencia y selectividad de los parasitoides de T. vaporariorum encontrados en los cultivos de tomate, pimiento y chaucha para los años 2002 y 2003 se obtuvo: a) Prevalencia (Tabla 1) Los resultados para el año 2002 muestran, en pimiento, sobre un total de 1196 “pupas” de mosca blanca revisadas, 198 (16,55%) resultaron parasitoidizadas, mientras que en chaucha sobre 2301, sólo 5 (0,22%) estaban infestados. La prevalencia de parasitoides en tomate fue similar a la obtenida en pimiento. Para el año 2003, los valores de prevalencia fueron de 0,70%, 0,55% y 0,13% en tomate, pimiento y chaucha, respectivamente. Paz, Miriam R; MICROHIMENÓPTEROS PARASITOIDES DE Trialeurodes vaporariorum (Westwood) … 56 /100 Tabla 1- Prevalencia de parasitoides de Trialeurodes vaporariorum en los cultivos de tomate, pimiento y chaucha, Tucumán (Argentina). Cultivo Tomate Pimiento Chaucha Año 2002 2003 2002 2003 2002 2003 N 592 4656 1196 3220 2301 12410 n 90 33 198 18 5 17 P 15,20% 0,70% 16,55% 0,55% 0,22% 0,13% N: Número de “pupas” de mosca blanca examinadas; n: número de “pupas” de mosca blanca parasitoidizadas; P: prevalencia. Del análisis de la Tabla 1 se desprende que la mosca blanca es parasitoidizada en mayor medida cuando se encuentra sobre pimiento, siguiéndole en orden decreciente tomate y chaucha. Esto podría deberse al grado de pubescencia de las hojas de las plantas estudiadas que es glabra en pimiento, medianamente pubescente en tomate y altamente pubescente en chaucha. Estudios sobre comportamiento de diferentes especies de parasitoides (Gerling, 1966a; Greco et al., 1998; Oliveira & Laumann, 1999) muestran que la pilosidad de la planta hospedera incide en forma directa sobre el porcentaje de parasitoidismo, siendo menor en las de mayor pilosidad. La prevalencia y la diversidad de parasitoides ocurrida en el año 2002, fue mucho mayor que en el 2003 para los diferentes cultivos. La Tabla 2, muestra la prevalencia de parasitoides discriminada por especies, cultivos y años. De su análisis se desprende que E. pergandiella es la única especie presente durante los dos años de estudio en los tres cultivos muestreados. Para el año 2002, su prevalencia fue de 16,55% en pimiento, 14% en tomate y 0,22% en chaucha, mientras que en el año 2003 descendió fuertemente con valores de 0,22% en pimiento, 0,21% en tomate y 0,09% en chaucha. Ésto la convierte en el controlador biológico más importante de T. vaporariorum en nuestro medio, lo que es coincidente con lo que ocurre en Panamá (Bernal Vega & Basedow, 2000) y Nueva Zelanda (Martín, 2003). En cambio, en otros países como España y Egipto la especie más efectiva es E. formosa (Llorens Climent & Garrido Vivas, 1992; Abd-Rabou, 1998) y en Colombia, lo es E. nigricephala (García González & López Ávila, 2000). Paz, Miriam R; MICROHIMENÓPTEROS PARASITOIDES DE Trialeurodes vaporariorum (Westwood) … 57 /100 Tabla 2- Prevalencia de parasitoides de Trialeurodes vaporariorum discriminada por especie en los cultivos de tomate, pimiento y chaucha, Tucumán (Argentina). Cultivo Año 2002 Tomate 2003 2002 Pimiento 2003 2002 Chaucha 2003 Parasitoide E. pergandiella E. porteri S. townsendi E. pergandiella E. porteri E. nigricephala Eretmocerus paulistus E. pergandiella E. pergandiella E. porteri E. hispida Eretmocerus paulistus S. townsendi E. pergandiella E. pergandiella E. porteri Eretmocerus pauslistus N 592 592 592 4620 4620 4620 4620 1196 3220 3220 3220 3220 3220 2301 12410 12410 12410 n 85 1 4 10 13 8 2 198 7 4 2 3 2 5 12 4 1 P 14,35% 0,17% 0,68% 0,21% 0,28% 0,17% 0,04% 16,55% 0,22% 0,12% 0,06% 0,09% 0,006% 0,22% 0,09% 0,03% 0,009% N: Número de “pupas” de mosca blanca examinadas; n: número de “pupas” de mosca blanca parasitoidizadas; P: prevalencia. Del análisis de los resultados dados a conocer para cada una de las especies, se desprende que la “ruda” presenta una gran riqueza de parasitoides de mosca blanca. Ello, probablemente se debe a que no recibe ningún tipo de tratamiento con plaguicidas. Esta planta se la encuentra frecuentemente en el entorno del invernadero, por lo tanto, está podría considerarse como reservorio importante de los parasitoides de la mosca blanca, de allí que presente una gran diversidad. Entre las especies encontradas sobre “ruda” se nombran a: Encarsia desantisi, E. formosa, E. hispida, E. inaron, E. pergandiella y S. townsendi. b) Selectividad De las variables respuestas analizadas por el modelo de regresión logística (Afifi & Clark, 1999) (Ver anexo Tabla 5), con respecto a la presencia de diferentes especies de parasitoides, sólo se obtuvieron respuestas concluyentes para E. pergandiella. El modelo utilizado no fue sensible para captar la presencia de los restantes parasitoides debido a la insuficiencia de datos (Tablas 3 y 4 con sus correspondientes gráficos). De las variables explicatorias utilizadas sólo la variable “cultivo” fue significativa (p= 0.04), configurándose así la siguiente función: logit (presencia de E. pergandiella) = - 5.6336 – 0.4095 (cultivo) La estimación de la pendiente indica que se espera que la transformación logit Paz, Miriam R; MICROHIMENÓPTEROS PARASITOIDES DE Trialeurodes vaporariorum (Westwood) … 58 /100 de la probabilidad de la presencia de E. pergandiella disminuye en 0,409 por cada unidad de incremento en cultivo. El “odds ratio”, que se genera con el exponente del parámetro estimado para el cultivo, indica que la probabilidad del evento se incrementa en 0,664 veces por cada unidad de incremento del código del cultivo. De esta manera, debido a que los cultivos tomate, pimiento y chaucha fueron codificados con los números 1, 2 y 3, respectivamente, la presencia de E. pergandiella disminuye desde el cultivo de pimiento al de chaucha. El modelo de regresión propuesto resultó adecuado sólo para el año 2002 atento a los criterios empleados y se rechazó la hipótesis global de pendiente nula (prob Chi cuadrado= 0.0001). Los valores de probabilidades estimados por Pearson (0.3394) y Deviance (0.3606) muestran la bondad del ajuste del modelo logrado. Tabla 3- Recuento de parasitoides sobre Trialeurodes vaporariorum en el año 2002. Tomate Pimiento Chaucha E. pergandiella E. porteri 85 1 198 0 5 0 S. townsendi 4 0 0 200 N° de parasitoides vivos 180 160 140 120 100 80 60 40 20 0 E. pergandiella Tomate E. porteri Pimiento S. townsendi Chaucha Paz, Miriam R; MICROHIMENÓPTEROS PARASITOIDES DE Trialeurodes vaporariorum (Westwood) … 59 /100 Tabla 4- Recuento de parasitoides sobre Trialeurodes vaporariorum en el año 2003. E. nigricephala 8 0 0 E. hispida 0 2 0 Eretmocerus S. paulistus townsendi 2 0 3 2 1 0 14 12 N° de parasitoides vivos Tomate Pimiento Chaucha E. E. pergandiella porteri 10 13 8 4 12 4 10 8 6 4 2 0 E. pergandiella E. porteri Tomate E. nigricephala E. hispida Pimiento Eretmocerus paulistus Chaucha S. townsendi Paz, Miriam R; MICROHIMENÓPTEROS PARASITOIDES DE Trialeurodes vaporariorum (Westwood) … 4- CONCLUSIONES 60 /100 Paz, Miriam R; MICROHIMENÓPTEROS PARASITOIDES DE Trialeurodes vaporariorum (Westwood) … 61 /100 1. En el agroecosistema hortícola de la localidad de San Isidro de Lules, Tucumán se identificaron y caracterizaron sobre Trialeurodes vaporariorum (Westwood) ocho especies de parasitoides pertenecientes a la familia Aphelinidae y una de la familia Signiphoridae. 2. Los parastoides identificados fueron: Encarsia desantisi Viggiani, E. formosa Gahan, E. hispida De Santis, E. inaron (Walker), E. nigricephala Dozier, E. pergandiella Howard, E. porteri (Mercet), y Eretmocerus paulistus Hempel y el hiperparasitoide Signiphora townsendi Ashmead. 3. Las especies Encarsia desantisi, E. hispida, E. inaron, E. nigricephala, E. pergandiella, Eretmocerus paulistus y Signiphora townsendi se citan por primera vez para la República Argentina sobre T. vaporariorum. 4. Existiría influencia de la planta hospedera sobre la selección del huésped (mosca blanca de los invernaderos) por parte de los parasitoides. 5. El grado de pubescencia de la planta hospedera influiría en la selección del parasitoide. 6. Encarsia pergandiella presenta una mayor frecuencia y abundancia que el resto de los parasitoides encontrados, siendo el controlador biológico más importante de T. vaporariorum en nuestro medio. 7. La preferencia de E. pergandiella sobre T. vaporariorum, disminuye en forma decreciente desde el pimiento, al tomate y a la chaucha. 8. La planta de “ruda” (R. chalepensis) presenta una gran riqueza de parasitoides de mosca blanca, lo que determinaría un gran aporte como reservorio de parasitoides hacia el agroecosistema hortícola. 9. El rol de las malezas estudiadas en el mantenimiento de los parasitoides de la mosca blanca fue escaso. Paz, Miriam R; MICROHIMENÓPTEROS PARASITOIDES DE Trialeurodes vaporariorum (Westwood) … 62 /100 A pesar, que los productores realizaron un manejo convencional de los cultivos durante todo el desarrollo de la presente tesis, se puede observar que existe una amplia lista de parasitoides de T. vaporariorum en el agroecosistema hortícola de Lules. Esto hace pensar en el potencial que se podría obtener con un manejo adecuado del cultivo tendiente a conservar la fauna auxiliar autóctona, mediante un manejo racional de los productos químicos y la implementación de métodos de control biológico basados en la conservación de los enemigos naturales. Todo esto debe realizarse dentro de programas de manejo integrado de problemas fitosanitarios en el marco de una agricultura sustentable. Paz, Miriam R; MICROHIMENÓPTEROS PARASITOIDES DE Trialeurodes vaporariorum (Westwood) … 5- BIBLIOGRAFÍA 63 /100 Paz, Miriam R; MICROHIMENÓPTEROS PARASITOIDES DE Trialeurodes vaporariorum (Westwood) … 64 /100 Abd-Rabou, S. 1998. Biological control of the greenhouse whitefly, Trialeurodes vaporariorum (Homoptera: Aleyrodidae), in Egypt. J. Egypt. Ger. Soc. Zool. 27 (E): 1-6. Afifi, A. A. & V. Clark. 1999. Computer-aided multivariate analysis. Chapman and Hall/CRC. USA. Third edition: 281-305. Akaike, H. 1974. A new look at statistical model identification. IEEE Transactions on automatic control. AV-19, 716-722. Albajes, R.; Casadevall, M.; Bordas, E.; Gabarra, R. & O. Alomar. 1980. La mosca blanca de los invernaderos Trialeurodes vaporariorum, en el Maresme II. Utilización de Encarsia tricolor (Hymenoptera: Aphelinidae) en un invernadero de tomate temprano. An INIA/Ser. Agric./N. 13:191-203. Alcázar, M. D.; Belda, J. E.; Barranco, P. & T. Cabello. 2000. Lucha integrada en cultivos hortícolas bajo plástico en Almería. Nuevas perspectivas para la utilización de enemigos naturales en los programas de Protección Integrada. Rev. Vida Rural. URL: file://A:AgroinformaciónBemisiatabaci_Métodosdecontrol.htm Altieri, M. A. 1991. Incorporando la agroecología al curriculo agronómico. Texto Base para la Reunión CLADES/FAO, sobre Agroecología y Enseñanza Agrícola en las Universidades Latino Americanas. Santiago de Chile. Altieri, M. A. 1992. Biodiversidad, agroecología y manejo de plagas. CETAL (Centro de Estudios de Tecnologías Apropiadas para América Latina y el Caribe). Chile 162 pp. Altieri, M. A. 2002. Agroecología: principios y estrategias para diseñar sistemas agrarios sustentables. En: Sarandón, J. C. (ed.), Agroecología. El camino hacia una agricultura sustentable. Ed. Cient. Amer. (E.C.A.). La Plata, Arg. pp. 49-56. Alvarado, L. & J. G. Annone. 1999. Uso racional de productos fitosanitarios. Rev. Soc. Entomol. Arg. 58(1-2): 223-226. Arnal, E. & F. Ramos. 2000. Incorporación de registros de interés a la lista de moscas blancas (Homoptera: Aleyrodidae) de Venezuela. Bol. Entomol. Venez. 15(1):97-107. Paz, Miriam R; MICROHIMENÓPTEROS PARASITOIDES DE Trialeurodes vaporariorum (Westwood) … 65 /100 Arnal, E.; Chavez, A. & F. Ramos. 2003. Parasitoides registrados en moscas blancas (Homoptera: Aleyrodidae) colectados en Venezuela durante el período 1991–2000. Entomotropica. 18(3):193-191. Blanchard, E. E. 1936. Apuntes sobre calcidoideos Argentinos, nuevos y conocidos. Rev. Soc. Entomol. Arg. 8:8-32. Bernal Vega, J. A. & T. Basedow. 2000. Inventario preliminar de parasitoides de Bemisia tabaci (Gennadius) (Homoptera: Aleyrodidae) en varias plantas hospedante en Panamá. Memoria VIII Cong. Latinoamericano y del Caribe de Manejo Integrado de Plagas y IX Taller Latinoamericano y del Caribe sobre mosca blanca y geminivirus. Panamá, Rep. de Panamá. p. 114. Bordas, E.; Gabarra, R.; Alomar, O.; Casadevall, M. & R. Albajes. 1981. La mosca blanca de los invernaderos Trialeurodes vaporariorum, en el Maresme III. Ensayo de control mediante Encarsia formosa en cuatro variedades de tomate en un invernadero de polietileno. An INIA/Ser. Agric./16: 135-145. Botto, E. N. 1995. Reporte Argentina. Memoria IV Taller latinoamericano sobre mosca blanca y gemnivirus. Zamorano, Honduras. CEIBA. 36(1):1-3. Botto, E. N. 1997. Control de plagas en cultivos protegidos en la Argentina. Posibilidades de su aplicación. Res.VII Jor. sobre Cultivos Protegidos, La Plata. pp.6-8 Botto, E. N. 1999. Control biológico de plagas hortícolas en ambientes protegidos. Rev. Soc. Entomol. Arg. 58(1-2): 58-64. Brandán, E. Z. & J. Ploper. 1999. Manual de actualización técnica en horticultura. El cultivo del tomate. Guía de estudio Cát. de Horticultura. FAZ – UNT. 24 pp. Bravo, L. & E. Flores. 2000. Bases ecológicas para el manejo integrado de la mosquita blanca en el estado de Morelos, México. Memoria VIII Cong. Latinoamericano y del Caribe de Manejo Integrado de Plagas y IX Taller Latinoamericano y del Caribe sobre mosca blanca y geminivirus. Panamá, Rep. de Panamá. p. 134. Paz, Miriam R; MICROHIMENÓPTEROS PARASITOIDES DE Trialeurodes vaporariorum (Westwood) … 66 /100 Byrne, D. N.; Bellows, J. R. & M. P. Parrella. 1990. Whiteflies in agricultural systems. In: D. Gerling (ed.), Whiteflies: their bionomics, pest status and managem. Wimborne, UK: Intercept, Andover. pp. 227-261. Carballo, M. V. & R. Ulrich. 2000. Productos fitosanitarios no sintéticos como alternativa de manejo de plagas. Memoria VIII Cong. Latinoamericano y del Caribe de Manejo Integrado de Plagas y IX Taller Latinoamericano y del Caribe sobre mosca blanca y geminivirus. Panamá, Rep. de Panamá. p. 118. Cardona, C. 1995. Memoria IV Taller Latinoamericano sobre mosca blanca y gemnivirus. Zamorano, Honduras. CEIBA. 36(1):53-65. Carnero, A.; Hernández, E.; Muñiz, M. & A. Federes. 2000. Informe de España. Memoria VIII Cong. Latinoamericano y del Caribe de Manejo Integrado de Plagas y IX Taller Latinoamericano y del Caribe sobre mosca blanca y geminivirus. Panamá, Rep. de Panamá. pp. 202 - 205. CASAFE 2007. Cámara de Sanidad Agropecuaria y Fertilizantes. URL://www.casafe.org Cave, R. D. 1995. Manual para el reconocimiento de parasitoides de plagas agrícolas en América Central. Primera Edición. Zamorano. Honduras: Zamorano Academia Press. 202 pp. Chang, R. 2000. Informe de Panamá. Memoria VIII Cong. Latinoamericano y del Caribe de Manejo Integrado de Plagas y IX Taller Latinoamericano y del Caribe sobre mosca blanca y geminivirus. Panamá, Rep. de Panamá. pp. 167 - 169. Chiappe, M. B. 2002. Dimensiones sociales de la agricultura sustentable. En: Sarandón, J. C. (ed.), Agroecología. El camino hacia una agricultura sustentable. Ed. Cient. Amer. (E.C.A.). La Plata. Argentina. pp. 83-98. Clausen, C. P. 1972. Entomophagous insects. Hafner Publishing Company, INC. New York, 688 pp. Clausen, C. P. 1978. Agriculture research service. Introduced parasites and predators of arthropod pest and weeds: a world review. Agriculture Handbook N° 480. Paz, Miriam R; MICROHIMENÓPTEROS PARASITOIDES DE Trialeurodes vaporariorum (Westwood) … 67 /100 Davis, D. R.; Mathis, W. N.; Thompson, F. C.; Gordon, R. D. & T. J. Henry. 1990. Handbook of Nearctic Chalcidoidea. Publicacion Commitee of the Entomological Society of Washington. Eds. Gordon, R. D. & T. J. Henry. 85pp. De Bach, P. 1964. Biological control of insect pests and weeds. New York, Rehinhold Publ. Co. 844pp. Del Pino, M. 2002. La agricultura orgánica. En: Sarandón, J. C. (ed.), Agroecología. El camino hacia una agricultura sustentable. Ed. Cient. Amer. (E.C.A.).La Plata. Argentina. pp. 177-188. De Santis, L. 1941. Lista de himenópteros parásitos y predadores de la República Argentina. Bol. Soc. Bras. Agron. 4(1):1-66. De Santis, L. 1946. Taxonomía de la familia Aphelinidae. Rev. Museo de La Plata n.s., 5: 1-31. De Santis, L. 1948a. Estudio monográfico de los afelínidos de la República Argentina (Hymenoptera: Chalcidoidea). Rev. Museo de La Plata n.s., 5 (Zool. 32): 23-280. De Santis, L. 1948b. Adiciones a la fauna Argentina de afelínidos (Hymenoptera: Chalcidoidea). Notas del Museo de La Plata, 13(Zool.101):43-48. De Santis, L. 1957. Adiciones a la fauna Argentina de los afelínidos, III (Hymenoptera: Chalcidoidea). Notas del Museo de La Plata, 19 (Zool. 172): 101-106. De Santis, L. & L. Esquivel. 1966. Tercera lista de Himenópteros parásitos de los insectos de la República Argentina. Rev. Museo de La Plata n.s. 9:47-217. De Santis, L. 1967. Cátalogo de los Himenópteros argentinos de la Serie Parasítica, incluyendo Bethyloidea. Com. Invest. Cient. La Plata, Bs. As. 377pp. De Santis, L. 1968. Nomenclatura y clasificación de la familia Signiphoridae (Hymenoptera: Chalcidoidea). Rev. Fac. de Agronomía (3ra época). Tomo XLIV (entrega 1ra). La Plata Rep. Arg.:7-16. Paz, Miriam R; MICROHIMENÓPTEROS PARASITOIDES DE Trialeurodes vaporariorum (Westwood) … 68 /100 De Santis, L. 1969. Apuntes de control biológico. Apéndice I. Hymenoptera clave de las familias con representantes entomófagos. Serie Didáctica N° 6. 41pp. De Santis, L. 1979. Catálogo de los Himenópteros Calcidoideos de América al Sur de los Estados Unidos. Publicación Especial. Com. Inv. Cient. Prov. de Bs. As., Gobernación, 488pp. De Santis, L., 1981a. Catálogo de los Himenopteros Calcidoideos de América del Sur de los Estados Unidos. Primer suplemento. Rev. Per. Entomol. 24:1-38. De Santis, L. 1981b. Sobre dos especies de Encarsia (Hymenoptera: Aphelinidae) del Brasil parasitoides de Bemisia tabaci (Homoptera: Aleyrodidae). Rev. Bras. Entomol. 25(1):37-39. De Santis, L. 1989. Catálogo de los Himenópteros Calcidoideos (Hymenoptera) al Sur de los Estados Unidos. Segundo Suplemento. Catalogue of the Chalcidoidea (Hymenoptera) of America south of the United States, second supplement. Acta Entomol. Chilena, 15:9-90. De Santis, L. & P. Fidalgo. 1994. Catálogo de los himenópteros calcidoideos de América al Sur de los Estados Unidos. Tercer Suplemento. Acad. Nac. Agron. y Vet. Bs. As., Argentina. 13:154pp. De Santis, L. 1998. Chalcidoidea. En: Morrone, J. J. y Coscarón, S. (eds.), Biodiversidad de Artrópodos Argentinos. Una Perspectiva Biotaxonómica. Ediciones Sur, La Plata. Argentina. pp. 408-426. Dirección General de Sanidad Vegetal / SAGAR, México, 1995. Memoria IV Taller latinoamericano sobre mosca blanca y gemnivirus. Zamorano, Honduras. CEIBA. 36(1):29-32. Dysart, R. J. 1966. Natural enemies of the banded-wing whitefly, Trialeurodes abutilonea (Hemiptera: Aleyrodidae). Ann. Entomol. Soc. Amer. 59(1): 28-33. Esquivel, L., 1950. Primer suplemento a la lista de himenópteros parásitos y predadores de los insectos de la Rep. Arg. Rev. Soc. Entomol. Arg. 14:270-296. Paz, Miriam R; MICROHIMENÓPTEROS PARASITOIDES DE Trialeurodes vaporariorum (Westwood) … 69 /100 Evans, A. G.; Polaszek, A. & F. D. Bennett. 1995. The taxonomy of the Encarsia flavoscutellum species–group (Hymenoptera: Aphelinidae) parasitoids of Hormaphididae (Homoptera: Aphidoidea). Oriental Insects. 29:33-45. Everitt, B. S. & G. Der. 1996. A handbook of Statistical analyses using SAS. Eds. Chapman & Hall/CRC. 158 pp. García, M. A. 1991. Ecología nutricional de parasitoides e predadores terrestres. En: Panizzi, A. R. & J. R. P. Parra. (eds.), Ecología nutricional de insectos e suas implicaoes no manejo de pragas. pp. 289-311. García González, J. & A. López – Ávila. 2000. Informe de Colombia. En: Memoria VIII Cong. Latinoamericano y del Caribe de Manejo Integrado de Plagas y IX Taller Latinoamericano y del Caribe sobre mosca blanca y geminivirus. Panamá, Rep. de Panamá. pp. 179 - 183. García Mari, F.; Costas Comelles, J. & F. Ferragout Pérez. 1994. Las plagas agrícolas. Ed. Agropubli, S. L. pp. 115-126. Gauld, I. D. & P. E. Hanson. 1995. The evolution, classification and identification of the Hymenoptera. In: Hanson, P. E. & I. D. Gauld. (eds.) The Hymenoptera of Costa Rica. Oxford University press. pp. 138-156. Gerling, D. 1966a. Biological studies on Encarsia formosa (Hymenoptera: Aphelinidae). Ann. Entomol. Soc. Amer. 59:152-153. Gerling, D. 1966b. Studies with whitefly parasites of southern California. I. Encarsia pergandiella Howard (Hymenoptera: Aphelinidae). The Canadian Entomologist. 98: 707-724. Gerling, D. 1967. Bionomics of the whitefly-parasite complex associated with cotton un southern California (Homoptera: Aleurodidae; Hymenoptera: Aphelinidae). Ann. Entomol. Soc. Amer. 60(6)1.306-1.321. Gerling, D. 1983. Observations of the biologies and interrelationships of parasites attacking the greenhouse whitefly, Trialeurodes vaporariorum West., in Hawaii. Proc. Hawaiian Entomol. Soc. 24(2-3): 217-225. Paz, Miriam R; MICROHIMENÓPTEROS PARASITOIDES DE Trialeurodes vaporariorum (Westwood) … 70 /100 Gerling, D. 1992. Approaches to the biological control of whiteflies. Florida Entomologist. 75 (4):446-456. Greco, N. M.; Sarandon, J. S. & P. C. Pereyra. 1998. Parasitism of Diatraea saccharalis (Lepidoptera: Pyralidae) by Trichogramma exiguum (Hymenoptera: Trichogrammatidae): Influence of Zea mays L. leaf pubescence. Ecología Austral 8: 31-35. Greco, N. M.; Sánchez, N. E. & P. C. Pereyra. 2002. Principios de manejo de plagas en una agricultura sustentable. En: Sarandón, J. C. (ed.), Agroecología. El camino hacia una agricultura sustentable. Ed. Cient. Amer. (E.C.A.). La Plata. Argentina. pp. 251-274. Guerrero, M. A.; Arretz, S. P.; Lamborot, L. & J. E. Araya. 1993. Parasitismo de huevos y larvas de Heliothis zea (Boodie) (Lepidoptera: Noctuidae) en maíz en la región Metropolitana, Chile. Acta Entomol. Chilena, 18: 65-72. Haji, F. N. P.; Lima, M. F.; Barbosa, F. R.; de Alencar, J. A.; Oliveira, M. R.; Araujo, L. H. A.; Bleicher, E.; da Silva, P. H. S. & J. S. Carneiro. 2000. Relatorio do Brasil. Memoria VIII Cong. Latinoamericano y del Caribe de Manejo Integrado de Plagas y IX Taller Latinoamericano y del Caribe sobre mosca blanca y geminivirus. Panamá, Rep. de Panamá. pp. 187 - 191. Hanson, P. E. 1995a. Aphelinidae. In: Hanson, P. E. & I. D. Gauld. (eds.) The Hymenoptera of Costa Rica. Oxford University press. pp. 282-289. Hanson, P. E. 1995b. Signiphoridae. In: Hanson, P. E. & I. D. Gauld. (eds.) The Hymenoptera of Costa Rica. Oxford University press. pp. 369-372. Hanson, P. E. 1995c. Economic importance of Hymenoptera. In: Hanson, P. E. & I. D. Gauld. (eds.) The Hymenoptera of Costa Rica. Oxford University press. pp. 89-100. Hanson, P. E. & J. Lasalle. 1995. The chalcidoid families. In: Hanson, P. E. & I. D. Gauld. (eds.) The Hymenoptera of Costa Rica. Oxford University press. pp. 266-273. Hayward, K. J. 1944. Las moscas blancas (Aleyrodidae) y su control. Est. Exp. Agr. de Tucumán. Circular N° 128. 6 pp. Paz, Miriam R; MICROHIMENÓPTEROS PARASITOIDES DE Trialeurodes vaporariorum (Westwood) … 71 /100 Heraty, J. M. & J. Woolley. 2002. Catálogo Encarsia of the World. En: Gibson, G. & J. Read Electronic format using the Biological and Systematic Information System (BASIC 3.0a). ECORC, Agriculture Canada, Ottawa. 75pp. Heraty, J. M., Woolley, J. & A. Polaszek. 2007. Catalog of the Encarsia of the World (2007). URL: http://www.faculty.ucr.edu/~heraty/Encarsia.cat.pdf Hoelmer, K. A. 1995. Whitefly parasitoids can they control field populations of Bemisia? In: Gerling, D. & R. T. Mayer (eds.), Bemisia: Taxonomy, biology, damage, control and managem. UK: Intercept, Andover. pp. 451-476. Holgado, M. G. & G. S. Mácola. 1998. Enemigos naturales de Siphoninus phillyreae (Haliday) (Homoptera: Aleyrodidae) plaga en fresnos del arbolado de Mendoza. Libro de Resúmenes. IV Cong. Arg. Entomol. Mar del Plata, Argentina. p. 133. Hosmer, W. D. & S. Lemeshow. 1989. Applied logistic regression. A wiley – Interscience publication. EE. UU. 307pp. Hussey, N. W. & N. E. Scopes. 1985. The introduction of natural enemies for pest control in greenhouse: Ecological consideration. En: Ridgway & S. B. Vinson (eds.), Biological control by augmentation of natural enemies. Insects and mites control with parasites and predators. Nueva York & Londres, Plenum Press, pp. 357–361. Kogan, M. & W. Bajwa. 1999. Integrated pest management: global reality? An. Soc. Entomol. Brasil 28(1):1-25. Lamborot, L.; Arretz, P; Guerrero, M. A. & J. E. Araya. 1995. Parasitismo de huevos y larvas de Copitarsia turbata (Herrich & Schaffer) (Lepidoptera: Noctuidae) en cultivos hortícolas en la región Metropolitana, Chile. Acta Entomol. Chilena 19:129-133. Limongelli, J. C.; Rondinone, M. C. & J. Fernández Lozano. 1991. Contaminación. Impacto de la contaminación en la calidad de los productos vegetales. INTA, Seminario Juicio a nuestra agricultura. Hacia un desarrollo sostenible. Ed. Hemisferio Sur, Buenos Aires. pp. 183 – 196. Lizer & C. Trilles. 1949. Curso de Entomología. V Metamorfosis. Publicación de Extensión cultural y didáctica N° 1: 212-256. Bs. As. Argentina. Paz, Miriam R; MICROHIMENÓPTEROS PARASITOIDES DE Trialeurodes vaporariorum (Westwood) … 72 /100 Llorens Climent, J. M. & A. Garrido Vivas. 1992. Homoptera III. Moscas blancas y su control biológico. Alicante, España. Ediciones Pisa: 67-92. Loiácono, M. S.; Gallardo, F. E. & C. B. Margaría. 2003. The types of Aphelinidae and Signiphoridae (Hymenoptera: Chalcidoidea) housed at the Museo de La Plata, Argentina. Rev. Soc. Entomol. Arg. 62 (1-2): 23-31. López-Avila, A.; Cardona Mejía, C., García González, J.; Rendón, F. & P. Hernández. 2000. La problemática de moscas blancas (Homoptera: Aleyrodidae) en cultivos anuales en el trópico alto, valles interandinos y costas de Colombia y Ecuador: reconocimiento e identificación de enemigos naturales. Memoria VIII Cong. Latinoamericano y del Caribe de Manejo Integrado de Plagas y IX Taller Latinoamericano y del Caribe sobre mosca blanca y geminivirus. Panamá, Rep. de Panamá. p. 140. López, S. & E. N. Botto. 1995a. Parámetros biológicos del parasitoide Encarsia formosa (Gahan) (Hymenoptera: Aphelinidae) en condiciones de laboratorio. Asoc. Arg. Ecol. Rev. Ecología Austral 5: 105-110. López, S. & E. N. Botto. 1995b. Efecto de la disponibilidad del huésped sobre algunos parámetros biológicos de Encarsia formosa (Hymenoptera: Aphelinidae). Rev. Vedalia 2:35-38. López, S. N. & E. N. Botto. 1997. Biology of a South American population of Eretmocerus sp. (Hymenoptera: Aphelinidae) attacking the greenhouse whitefly. Biological Control 9:1-5. López, S. N.; Viscarret, M. M. & E. N. Botto. 1998. Tiempo de vida y supervivencia de estadios inmaduros de Trialeurodes vaporariorum (Westwood) (Homoptera: Aleyrodidae) sobre dos hospederas de importancia económica. Libro de Resúmenes IV Cong. Argentino Entomol. Mar del Plata, Argentina. p. 141. Martín, N. A. 2003. Whitefly insecticide resístanse management strategy. http://www.hortnet.co.nz/publications/nzpps/resistance/whitefly.htm URL: Paz, Miriam R; MICROHIMENÓPTEROS PARASITOIDES DE Trialeurodes vaporariorum (Westwood) … 73 /100 Mineo, G. & G. Viggiani. 2001. Notizie preliminari su una Signiphora (Hymenoptera: Signiphoridae) ottenuta da Aleurothrixus floccosus (Maskell) (Homoptera: Aleyrodidae) in Italia. Boll. Lab. Entomol. Agr. Filippo Silvestri 57:159-165. Mondaca Rivas, P. 2000. Informe de Chile. Memoria VIII Cong. Latinoamericano y del Caribe de Manejo Integrado de Plagas y IX Taller Latinoamericano y del Caribe sobre mosca blanca y geminivirus. Panamá, Rep. de Panamá. pp. 199-201. Mound, L. A. & S. H. Halsey. 1978. Whitefly of the world. A systematic catalogue of the Aleyrodidae (Homoptera) with host plant and natural enemy data. British Museum (Natural History). 340 pp. Nguyen, R. & B. H. Avas. 2000. Ash whitefly, Siphoninus phillyreae (Haliday) (Insecta: Homoptera: Aleyrodidae: Aleyrodianae). University of Florida. IFAS Extension. 1-4. URL: http://edis.ifas.ufl.edu/pdffiles/IN/IN30400.pdf Nicholls, C. L. 2002. Manipulando la biodiversidad vegetal para incrementar el control biológico de insectos plagas: un estudio de caso de un viñedo orgánico en el Norte de California. En: Sarandón, J. C. (ed.), Agroecología. El camino hacia una agricultura sustentable. Ed. Cient. Amer. (E.C.A.). La Plata. Argentina. pp. 529-547. Noyes, J. S. 2003. About chalcidoids. URL: http://www.nhm.ac.uk./researchcuration/projects/chalcidoids/introduction.html Núñez Sacarias, 1995. Reporte de Perú. Memoria IV Taller latinoamericano sobre mosca blanca y gemnivirus. Zamorano, Honduras. CEIBA. 36(1):157-162. Oliveira, M. R. & R. A. Laumann. 1999. Utilizacao de parasitoides e predadores no controle da mosca branca, Bemisia tabaci (Gennadius) (Hemiptera: Aleyrodidae). In: VI Reuniao Nacional de Pesquisa de Feijao (RENAFE), Salvador. Res. do VI Renafe. 9 pp. Oliveira, M. R.; Amancio, E.; Laumann, R. A. & L. Gomes. 2003. Natural enemies of Bemisia tabaci (Gennadius) B Biotype and Trialeurodes vaporariorum (Westwood) (Hemiptera: Aleyrodidae) in Brasilia, Brazil. Rev. Neotropical Entomology 32(1):151154. Paz, Miriam R; MICROHIMENÓPTEROS PARASITOIDES DE Trialeurodes vaporariorum (Westwood) … 74 /100 Ovruski, S. M. & E. A. Frias. 1995. Presencia de Encarsia porteri (Hymenoptera: Aphelinidae) parasitoidizando huevos de Lepidópteros Noctuídos plagas del cultivo de soja en Tucumán, Argentina. Rev. Soc. Entomol. Arg. 54(1-4):25-29. Pantoja, A. & I. Cabrera. 2000. Informe de Puerto Rico. Memoria VIII Cong. Latinoamericano y del Caribe de Manejo Integrado de Plagas y IX Taller Latinoamericano y del Caribe sobre mosca blanca y geminivirus. Panamá, Rep. de Panamá. pp. 176 - 178. Peck, 1963. A catalogue of the Neartic Chalcidoidea (Insecta: Hymenoptera). Can. Entomol. Suppl. 30:239-318 Pickett, C. H. & M. J. Pitcairn. 1999. Classical biological control of ash whitefly: factors contributing to its success in California. Rev. Biocontrol. 44(2):143–158. Pickett, C. H. 1997. Encarsia inaron (Hymenoptera: Aphelinidae). URL: http://www.nysaes.cornell.edu/ent/biocontrol/parasitoids/encarsia_inaron.html PNUMA (1990). Reseña del PNUMA. Progama de las Naciones Unidas para el Medio Ambiente. Nairobi, Kenia. 48 pp. Polaszek, A. 1991. Egg parasitism in Aphelinidae (Hymenoptera: Chalcidoidea) with special reference to Centrodora and Encarsia species. Bull. Entomol. Res. 81(1):97106. Polaszek, A.; Evans, G. A. & F. D. Bennett. 1992. Encarsia parasitoids of Bemisia tabaci (Hymenoptera: Aphelinidae, Homoptera: Aleyrodidae): a preliminary guide to identification. Bull. Entomol. Res. 82, 375 – 392. Polaszek, A. & M. Hayat. 1992. A revisión of the genera Dirphys Howard and Encarsiella Hayat (Hymenoptera: Aphelinidae). Syst. Entomol. 17:181-197. Polaszek, A.; Stouthamer, R; Hunter, M. S.; Rose, M.; Ovruski, S. M.; Frias, E. & S. P. Rojas. 1994. Heterotrophic parasitoids revisited: Preliminary observations on Encarsia porteri (Mercet) (Hymenoptera: Aphelinidae). Trichogramma and other egg parasitoids Cairo (Egypt). Ed. INRA, Paris (Les Colloques, n° 73) 31-32. Paz, Miriam R; MICROHIMENÓPTEROS PARASITOIDES DE Trialeurodes vaporariorum (Westwood) … 75 /100 Polaszek, A.; Abd-Rabou, S. & J. Huang. 1999. The Egyptian species of Encarsia (Hymenoptera: Aphelinidae): a preliminary review. Zool. Med. Leiden 73:133-163. Porfirio, A. 1995. Reporte de República Dominicana. Memoria IV Latinoamericano sobre mosca blanca y gemnivirus. Zamorano, Honduras. Taller CEIBA. 36(1):39-47. Quintanilla, R. H. 1946. Zoología Agrícola. Ed. El Ateneo. pp. 280-286. Rendón, F.; García, J.; Valarezo, O.; Cardona, C.; López-Avila, A.; Bueno, J. M. & I. V. Rodríguez. 2000. Diagnóstico general y patron de uso de insecticidas para moscas blancas en Colombia y Ecuador. Memoria VIII Cong. Latinoamericano y del Caribe de Manejo Integrado de Plagas y IX Taller Latinoamericano y del Caribe sobre mosca blanca y geminivirus. Panamá, Rep. de Panamá. p. 133. Rojas, S. 1968. Notas sobre Prospaltella porteri Mercet (Hymenoptera: Aphelinidae), un nuevo parásito de huevos de lepidópteros. Rev. Chilena Entomol. 6:123-125. SAGPyA, 2006. Zonas de producción de hortalizas en la República Argentina. URL:http://www.sagpya.mecon.gov.ar/new/00/agricultura/otros/hortalizas/produccion/h ortalizas.php Salas, H.; Fernández, M. & E. Willink. 1999. La mosca blanca de los invernáculos en cultivos hortícolas de Tucumán. Rev. Avance Agroindustrial. EEAOC. N° 76:39-41. Salas, J. & E. Arnal. 2000. Informe de Venezuela. Memoria VIII Cong. Latinoamericano y del Caribe de Manejo Integrado de Plagas y IX Taller Latinoamericano y del Caribe sobre mosca blanca y geminivirus. Panamá, Rep. de Panamá. pp. 184 - 186. Salvo, A. & G. Valladares. 2005. Planta, hospedador y estructura de comunidades en parasitoides de insectos herbívoros. Libro de Resúmenes VI Cong. Arg. Entomol.. Tucumán, Argentina. p. 25. Sarandón, S. J. & R. Sarandón. 1993. Un enfoque ecológico para una agricultura sustentable. En: Goin F. y C. Goñi (eds.). Bases para una política ambiental de la R. Argentina, Sección III, Cap. 19:279-286, H. C. Diputados de la Pcia. de Buenos Aires. Paz, Miriam R; MICROHIMENÓPTEROS PARASITOIDES DE Trialeurodes vaporariorum (Westwood) … 76 /100 Sarandón, S. J. 2002. La agricultura como actividad transformadora del ambiente. El impacto de la agricultura intensiva de la revolución verde. En: Sarandón, J. C. (ed.), Agroecología. El camino hacia una agricultura sustentable. Ed. Cient. Amer. (E.C.A.).La Plata. Argentina. pp. 23-47. Schauff, M. E. & G. A. Evans. 1995. A pictorial guide to the species of Encarsia (Hymenoptera: Aphelinidae) parasitic on whiteflies (Homoptera: Aleyrodidae) in North America. Proc. Entomol. Soc. Washington 98(1):1-35. Schwarz, G. 1978. Estimating the dimension of model. Annals of Statistics. 6, 461-464. Skarlato, O. A. 1987. Keys to the insects of the European part of the USRR. Published by the Institute of Zoology Academy of Science of the USRR N° 120 Vol III, Hymenoptera Part II. pp. 39-58. Stuardo, C. O. 1927. Algunas observaciones sobre tres Afelininos parásitos de Trialeurodes vaporariorum (West.). Rev. Chil. Hist. Nat. 31:144-149. Subba Rao, B. R. 1974. The genera of Signiphoridae with description of new genus. Bull. Entomol. Res. 64:525-531. Tapia, E. A. 1970. Estudio preliminar de los Aleirodideos hallados en Argentina (Homoptera). Act. IV Congr. Latin. Zool. Vol. 1:219-234. Torres Robledo, C.; Martinez Carrillo, J. L. & J. C. Ramírez Sagahón. 2000. Informe de México. Memoria VIII Cong. Latinoamericano y del Caribe de Manejo Integrado de Plagas y IX Taller Latinoamericano y del Caribe sobre mosca blanca y geminivirus. Panamá, Rep. de Panamá. pp. 144-147. Tryapitsyn, V. A. 1987. Family Signiphoridae (Thysanidae) (Signiphorids). In: Skarlato, O. A. Keys to the insects of the European part of the USRR. Published by the Institute of Zoology Academy of Science of the USRR N° 120 Vol III, Hymenoptera Part II. pp. 938-942. Paz, Miriam R; MICROHIMENÓPTEROS PARASITOIDES DE Trialeurodes vaporariorum (Westwood) … 77 /100 Valarezo, O. & M. Arias de López. 2000. Informe de Ecuador. Memoria VIII Cong. Latinoamericano y del Caribe de Manejo Integrado de Plagas y IX Taller Latinoamericano y del Caribe sobre mosca blanca y geminivirus. Panamá, Rep. de Panamá. pp. 192 - 193. Van Lenteren, J. C. & J. Woetts. 1988. Biological and integrated pest control in greenhouses. Ann. Rev. Entomol. 33:239-269. Van Lenteren, J. C. 1996. Biological control of whitefly: A rewarding experience. En: V Siconbiol, Cong. Brasileiro Control Biológico, Anais Conferencias e Palestras, Foz Do Iguazú. Paraná, Brasil. pp. 41-43. Vet, L. E. M., van Lenteren, J. C. & J. Woets. 1980. The parasite-host relationship between Encarsia formosa (Hymenoptera: Aphelinidae) and Trialeurodes vaporariorum (Homoptera: Aleyrodidae). IX A review of the biological control of the greenhouse whitefly with suggestions for future researchs. J. Appl. Entom. 90:26-51. Viggiani, G. 1984. Bionomics of the Aphelinidae. Ann. Rev. Entomol. 29:257-276. Villar, A.; Alvarez, P.; Escarramán, V. & E. Gómez. 2000. Informe de la República Dominicana. Memoria VIII Cong. Latinoamericano y del Caribe de Manejo Integrado de Plagas y IX Taller Latinoamericano y del Caribe sobre mosca blanca y geminivirus. Panamá, Rep. de Panamá. pp. 173-175. Viscarret, M. M. & E. N. Botto. 1997. Presencia de Siphoninus phillyreae, la mosca blanca de los fresnos (Homoptera: Aleyrodidae) en la Argentina. Rev. Soc. Entomol. Arg. 56(1-4):90. Viscarret, M. M.; Botto, E. N. & A. Polaszek. 2000. Whiteflies (Hemiptera: Aleyrodidae) of economic importance and their natural enemies (Hymenoptera: Aphelinidae, Signiphoridae) in Argentina. Rev. Entomol. Chilena 26:5-11. WCED 1987. World Commission on Environment and Development: Our common future. Oxford University Press, London. Paz, Miriam R; MICROHIMENÓPTEROS PARASITOIDES DE Trialeurodes vaporariorum (Westwood) … 78 /100 Yasnosh, V. A. 1987. Family Aphelinidae (Aphelinids). In: Skarlato, O. A. Keys to the insects of the European part of the USRR. Published by the Institute of Zoology Academy of Science of the USRR N° 120 Vol III, Hymenoptera Part II. pp. 865-916. Paz, Miriam R; MICROHIMENÓPTEROS PARASITOIDES DE Trialeurodes vaporariorum (Westwood) … 6- ANEXO 79 /100 Paz, Miriam R; MICROHIMENÓPTEROS PARASITOIDES DE Trialeurodes vaporariorum (Westwood) … 80 /100 u$s (en millones) EVOLUCIÓN DEL MERCADO FITOSANITARIO ARGENTINO Gráfico 1- Evolución del consumo de productos fitosanitarios en la República Argentina en el período 1997 – 2007. Fuente CASAFE, 2007 Paz, Miriam R; MICROHIMENÓPTEROS PARASITOIDES DE Trialeurodes vaporariorum (Westwood) … ZONAS DE PRODUCCIÓN HOTÍCOLA DE ARGENTINA REGION I Jujuy, Salta y Tucumán REGION II Chaco y Formosa REGION III Misiones, Corrientes y Entre Ríos REGION IV Catamarca y La Rioja REGION V Santiago del Estero, Córdoba y San Luis REGION VI San Juan y Mendoza REGION VII Santa Fé y Buenos Aires REGION VIII La Pampa, Neuquén y Río Negro REGION IX Santa Cruz, Chubut y Tierra del Fuego Figura 1- Mapa de la República Argentina Fuente SAGPyA, 2006. 81 /100 Paz, Miriam R; MICROHIMENÓPTEROS PARASITOIDES DE Trialeurodes vaporariorum (Westwood) … 82 /100 ZONAS DE PRODUCCIÓN HORTÍCOLA DE LAS PROVINCIAS DE JUJUY, SALTA Y TUCUMÁN Figura 2 – Área de Estudio Fuente SAGPyA, 2006. ZONA A – DEL BAJO O DEL RAMAL ZONA B – VALLE CALCHAQUI ZONA C – CENTRO Y SUR DE SALTA ZONA D – CENTRO DE TUCUMAN Trancas: Poroto, arveja, frutilla, papa, choclo. Tafí Viejo: Pimiento, chaucha, zapallito, papa semilla, batata, tomate, choclo. Lules - Famaillá: Tomate, pimiento, zapallito, chaucha, papa, frutilla, batata. Monteros: Sandía, tomate, papa, pimiento. Chicligasta: Concepción, Alto Verde: Tomate, papa, pimiento, frutilla, choclo. Rio Chico. Simoca. Graneros: Papa, poroto, choclo, tomate, pimiento. ZONA E – ESTE DE TUCUMAN Paz, Miriam R; MICROHIMENÓPTEROS PARASITOIDES DE Trialeurodes vaporariorum (Westwood) … 83 /100 Paz, Miriam R; MICROHIMENÓPTEROS PARASITOIDES DE Trialeurodes vaporariorum (Westwood) … 84 /100 Paz, Miriam R; MICROHIMENÓPTEROS PARASITOIDES DE Trialeurodes vaporariorum (Westwood) … 85 /100 Paz, Miriam R; MICROHIMENÓPTEROS PARASITOIDES DE Trialeurodes vaporariorum (Westwood) … 86 /100 Frontovertex Ojos Ocelos Escrobas Línea ocelar Línea medio-frontal Cara Línea facial Mejilla Inserción antenal Clipeo A Pronoto Surcos parapsidales Parapsides Mesoescudo Tégulas Axilas Sensilias Escutelo Metanoto Propodeo Espiráculo B Surco parapsidal Axila Metanoto Parapsides Propodeo Pronoto Espiráculo Cuello Tégula Metapleura Propleura Prepecto Metacoxa Mesocoxa Procoxa Epímero Episterno C Figura 6 – Aphelinidae: Coccophaginae, A- Cabeza vista de frente. B- Tórax visto desde arriba. C- Tórax visto de pérfil. Fuente De Santis, 1948a. Paz, Miriam R; MICROHIMENÓPTEROS PARASITOIDES DE Trialeurodes vaporariorum (Westwood) … Radícula Escapo 87 /100 Pedicelo Radícula Escapo Pedicelo Funículo Anillos Maza Sensilias longitudinales Flagelo Maza A B Coxa Trocanter Fémur Tibia Espolón Basitarso Tarso C Figura 7- Aphelinidae A- Eretmocerus paulistus Hempel antena del macho. B- Encarsia sp. antena de la hembra. C- Encarsia sp. Pata media. Fuente: De Santis, 1948a. Paz, Miriam R; MICROHIMENÓPTEROS PARASITOIDES DE Trialeurodes vaporariorum (Westwood) … Nervadura estigmática Celda costal Pterostigma Nervadura postmarginal Speculum Nervadura submarginal Retináculo A Disco alar Pestañas o setas discales Franja glabra Ángulo humeral Pestañas o setas marginales Placas sensoriales B Nervadura submarginal Celda costal Nervadura marginal C Figura 8- Aphelinidae A- y B- Ala anterior. C- Ala posterior. Fuente De Santis, 1948a. 88 /100 Paz, Miriam R; MICROHIMENÓPTEROS PARASITOIDES DE Trialeurodes vaporariorum (Westwood) … 89 /100 Paz, Miriam R; MICROHIMENÓPTEROS PARASITOIDES DE Trialeurodes vaporariorum (Westwood) … 90 /100 Paz, Miriam R; MICROHIMENÓPTEROS PARASITOIDES DE Trialeurodes vaporariorum (Westwood) … 91 /100 Paz, Miriam R; MICROHIMENÓPTEROS PARASITOIDES DE Trialeurodes vaporariorum (Westwood) … 92 /100 Paz, Miriam R; MICROHIMENÓPTEROS PARASITOIDES DE Trialeurodes vaporariorum (Westwood) … 93 /100 Paz, Miriam R; MICROHIMENÓPTEROS PARASITOIDES DE Trialeurodes vaporariorum (Westwood) … 94 /100 Paz, Miriam R; MICROHIMENÓPTEROS PARASITOIDES DE Trialeurodes vaporariorum (Westwood) … 95 /100 Paz, Miriam R; MICROHIMENÓPTEROS PARASITOIDES DE Trialeurodes vaporariorum (Westwood) … 96 /100 Paz, Miriam R; MICROHIMENÓPTEROS PARASITOIDES DE Trialeurodes vaporariorum (Westwood) … 97 /100 Paz, Miriam R; MICROHIMENÓPTEROS PARASITOIDES DE Trialeurodes vaporariorum (Westwood) … 98 /100 Paz, Miriam R; MICROHIMENÓPTEROS PARASITOIDES DE Trialeurodes vaporariorum (Westwood) … 99 /100 Tabla 5- Modelo de Regresión Logística (Afifi and Clark, 1999). -------------------------------------------- Año=1 -------------------------------------------- The LOGISTIC Procedure Model Information Data Set Response Variable Number of Response Levels Number of Observations Frequency Variable Sum of Frequencies Model Optimization Technique WORK.PERGA pupa 2 20 conteo 20248 binary logit Fisher's scoring Response Profile Ordered Value pupa Total Frequency 1 2 1 0 29 20219 Probability modeled is pupa=1. NOTE: 10 observations having zero frequencies or weights were excluded since they do not analysis. contribute to the Model Convergence Status Convergence criterion (GCONV=1E-8) satisfied. Deviance and Pearson Goodness-of-Fit Statistics Criterion Deviance Pearson DF Value Value/DF Pr > ChiSq 1 1 0.8359 0.9128 0.8359 0.9128 0.3606 0.3394 Number of unique profiles: 3 The LOGISTIC Procedure Model Fit Statistics Criterion Intercept Only Intercept and Covariates 439.772 447.688 437.772 437.929 453.761 433.929 AIC SC -2 Log L Testing Global Null Hypothesis: BETA=0 Test Chi-Square DF Pr > ChiSq 3.8434 4.1494 3.9851 1 1 1 0.0499 0.0416 0.0459 Likelihood Ratio Score Wald Analysis of Maximum Likelihood Estimates Parameter DF Estimate Standard Error Wald Chi-Square Pr > ChiSq Intercept Cultivo 1 1 -5.6336 -0.4095 0.4634 0.2051 147.8056 3.9851 <.0001 0.0459 Odds Ratio Estimates Effect Cultivo Point Estimate 95% Wald Confidence Limits 0.664 0.444 0.993 Association of Predicted Probabilities and Observed Responses Percent Concordant Percent Discordant Percent Tied Pairs -------------------------------------------- 26.6 15.0 58.4 586351 Año=2 Somers' D Gamma Tau-a c 0.116 0.279 0.000 0.558 -------------------------------------------- The LOGISTIC Procedure Paz, Miriam R; MICROHIMENÓPTEROS PARASITOIDES DE Trialeurodes vaporariorum (Westwood) … 100 /100 Model Information Data Set Response Variable Number of Response Levels Number of Observations Frequency Variable Sum of Frequencies Model Optimization Technique WORK.PERGA pupa 2 16 conteo 4641 binary logit Fisher's scoring Response Profile Ordered Value pupa Total Frequency 1 2 1 0 288 4353 Probability modeled is pupa=1. NOTE: 14 observations having zero frequencies or weights were excluded since they do not analysis. Model Convergence Status Convergence criterion (GCONV=1E-8) satisfied. Deviance and Pearson Goodness-of-Fit Statistics Criterion Deviance Pearson DF Value Value/DF Pr > ChiSq 1 1 223.6747 219.9936 223.6747 219.9936 <.0001 <.0001 Number of unique profiles: 3 The LOGISTIC Procedure Model Fit Statistics Criterion AIC SC -2 Log L Intercept Only Intercept and Covariates 2160.868 2167.310 2158.868 1860.453 1873.339 1856.453 Testing Global Null Hypothesis: BETA=0 Test Chi-Square DF Pr > ChiSq 302.4146 358.6273 278.9667 1 1 1 <.0001 <.0001 <.0001 Likelihood Ratio Score Wald Analysis of Maximum Likelihood Estimates Parameter DF Intercept Cultivo 1 1 Effect Cultivo Estimate Standard Error Wald Chi-Square 0.1718 0.1584 -1.3425 0.0804 Odds Ratio Estimates Point Estimate Pr > ChiSq 1.1763 278.9667 0.2781 <.0001 95% Wald Confidence Limits 0.261 0.223 0.306 Association of Predicted Probabilities and Observed Responses Percent Concordant Percent Discordant Percent Tied Pairs 71.1 8.5 20.3 1253664 Somers' D Gamma Tau-a c The SAS System 0.626 0.786 0.073 0.813 contribute to the