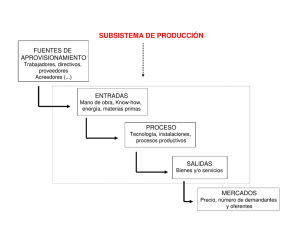
Descargar PDF Nutri Info 15
Anuncio

Nutri info 15 Nutri info EVALUACIÓN ECONÓMICA EN NUTRICIÓN Mª Victoria Calvo Hernández Ángel López Delgado Servicio de Farmacia Hospital Universitario de Salamanca 15 Nutri info 15 Nutri 1 Introducción info 15 ����������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������� 2 METODOLOGÍA DE LA EVALUACIÓN ECONÓMICA ������������������������������������������������������������������������������������������������������������������������������������� 3 CALIDAD DE LOS ESTUDIOS DE EVALUACIÓN ECONÓMICA 4 ESTUDIOS DE EVALUACIÓN ECONÓMICA EN NUTRICIÓN 3 5 �������������������������������������������������������������������������������������������������� 12 ���������������������������������������������������������������������������������������������������������� 13 5 BIBLIOGRAFÍA�������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������� 16 Fresenius Kabi España, S.A.U. Torre Mapfre - Vila Olímpica C/ Marina, 16-18 08005 Barcelona Tel. 93 225 65 65 Fax 93 225 65 75 www.fresenius-kabi.es Depósito legal: B-20965-2010 ISSN 2013-8199 Evaluación económica en nutrición EVALUACIÓN ECONÓMICA EN NUTRICIÓN Mª Victoria Calvo Hernández, Angel López Delgado. Hospital Universitario de Salamanca. 1 Introducción La demanda ilimitada de asistencia sanitaria, el constante incremento en sus costes y la limitación de los recursos disponibles han provocado una gran preocupación por la contención del gasto sanitario, enfrentándonos al reto de conciliar esta demanda creciente con la limitación de recursos y permitir así el acceso a toda la población. La realidad actual es que la capacidad técnica de los sitemas sanitarios es muy superior a su capacidad económica. Así, se está imponiendo la necesidad de elegir y priorizar entre distintas alternativas o tecnologías sanitarias, lo cual debe hacerse una vez valorados y conocidos sus costes y beneficios. Por tecnología sanitaria se entiende cualquier método utilizado para promocionar la salud, prevenir, diagnosticar y tratar enfermedades, o mejorar los cuidados sanitarios a largo plazo. Las tendencias actuales sanitarias nos orientan a una gestión de calidad, pues aunque calidad y contención de costes con frecuencia son considerados excluyentes, en realidad son complementarios. Los criterios tradicionalmente seguidos en la prestación de servicios sanitarios ya no son suficientes, siendo necesarios nuevos métodos de evaluación y apoyo a las decisiones. Tanto el prescriptor como el paciente pueden tender a actuar de forma irracional como demandantes, identificando equivocadamente mayor precio con mayor calidad. Así lo demostró un ensayo clínico en el que se administró el mismo analgésico a dos grupos que recibieron distinta información sobre su precio, y se encontró que el efecto fue significativamente superior en el grupo al que se habia comunicado un mayor precio [1]. En el pasado el proceso de formación médica estaba basado en el dogma, que en la práctica se traducía en la utilización de las prácticas recomendadas hasta que se tuvieran pruebas de su ineficacia. Esta filosofía, basada en la asunción de que los recursos son ilimitados, ya no es sotenible. Aunque antes raramente nos cuestionabamos si un determinado servicio era coste-efectivo, en la actualidad nos enfrentamos con una demanda de calidad y eficiencia en la prestación de servicios sanitarios. Ya es reconocido por diversos profesionales que la introducción de los costes en nuestras decisiones permiten una distribución equitativa de los recursos finitos [2]. Los criterios tradicionalmente seguidos ya no son suficientes, necesitando nuevos métodos de evaluación. Ante esta necesidad surgió la evaluación económica aplicada a la salud, cuyo concepto más simple es el análisis coste-efectividad asociado al deseo de obtener el máximo beneficio con los recursos disponibles, es decir obtener la máxima eficiencia. La evaluación de nuevas tecnologías resulta imprescindible en los sistemas sanitarios actuales. Toda tecnología debe ser evaluada porque la adopción prematura puede provocar importantes daños tanto al paciente como al sistema, como queda reflejado en la figura 1. Deberían adoptarse únicamente aquellas tecnologías que han demostrado su utilidad y beneficios para el sistema. Las evaluaciones económicas se introdujeron en el ámbito sanitario en la década de los años 70 en paises como EEUU y Reino Unido, considerándose en la actualidad como una modalidad de la Evaluación de Tecnologías Sanitarias (ETS). La evaluación económica se define como el análisis 3 Nutri info 15 comparativo de las alternativas posibles, evaluadas tanto en términos de costes como de beneficios. Los componentes básicos de cualquier evaluación económica son: identificar, cuantificar, valorar y comparar los costes y los beneficios de las alternativas objeto de consideración [3]. Trata de identificar las alternativas terapéuticas, o tecnológicas, que reportarán el máximo beneficio en relación a su coste, permitiendo así una distribución eficiente de los recursos. La eficiencia debe entenderse como la relación entre los recursos consumidos y los resultados obtenidos. Porque debemos tener en cuenta que una determinada tecnología, aún con mayor coste, también es eficiente siempre y cuando los beneficios obtenidos compensen el incremento del coste. Si valoramos costes y resultados podremos decidir sobre la mejor forma de gastar los recursos. Aunque el ensayo clínico, prospectivo aleatorizado y doble ciego, es considerado como el “gold estándar” en investigación clínica, con la introducción de la ETS se ha extendido un concepto más amplio de investigación que incluye, además del ensayo clínico, otros tipos de investigación, como son el metaanálisis, los estudios de efectividad comparada y los estudios de evaluación de tecnologías sanitarias. Dado que las evaluaciones económicas se basan en gran medida en la modelización de los resultados de los estudios clínicos, las dos disciplinas han tendido a su integración, siendo más difusa la frontera entre la investigación clínica y la evaluación económica. La ETS es una actividad que analiza sistemáticamente la seguridad, eficacia clínica, efectividad, costeefectidad y las consecuencias sociales, éticas y legales de la aplicación de las nuevas tecnologías. Se centra en dos aspectos fundamentales, la efectividad clínica y la relación coste-efectividad. La ETS se puede considerar como un puente entre la evidencia y el proceso de toma de decisiones, pues ofrece a los agentes decisores información basada en la evidencia de gran utilidad en la distribución de los recursos disponibles. Mientras que la investigación clínica se centra en los aspectos de eficacia y seguridad, el análisis económico analiza los costes y los beneficios de las intervenciones, incluyendo la efectividad, adherencia, complicaciones y costes, considerandose por ello como un complemento a la investigación clínica. La experiencia del National Institute for Health and Clinical Excellence (NICE) en Reino Unido, ha supuesto un antes y un después en el papel y la influencia la ETS en el proceso de toma de decisiones. Figura 1 - Evaluación de tecnologías sanitarias. TECNOLOGÍA NO EVALUADA Desinterés evaluación debería ser SNS Utilidad EVALUADA No utilidad 4 entusiasmo convicción obstáculos Evaluación económica en nutrición 2 METODOLOGÍA DE LA EVALUACIÓN ECONÓMICA 1. Valoración de costes El primer paso fundamental de la evaluación económica es el análisis y cuantificación de los recursos consumidos por la tecnología objeto del estudio. Los costes deben ser valorados por su coste de oportunidad, es decir, por su mejor uso alternativo. El coste real de un tratamiento es la suma de todos los recursos consumidos en su provisión. Los costes se clasifican en dos categorías principales, directos e indirectos, aunque también existen los costes intangibles que raramente son considerados. El coste real de un tratamiento es la suma de todos los recursos consumidos en su provisión, directos e indirectos. Los costes directos en el caso del soporte nutricional incluyen: el tratamiento nutricional, la monitorización, el tratamiento de las complicaciones, personal, gastos generales (ej. electricidad) y los costes de servicios no médicos (ej. desplazamientos al hospital). Estos costes pueden ser fijos o variables. Los fijos no dependen directamente del volumen de actividad, ej. bombas de infusión o instalaciones, y habitualmente se distribuyen proporcionalmente a los costes del tratamiento. Los costes variables están directamente relacionados con la actividad, ej. nutriciones parenterales administradas. Los costes indirectos, denominados también costes de productividad, no están directamente relacionados con los recursos consumidos en el tratamiento, más bien son los costes incurridos secundariamente, ej. el tiempo de trabajo perdido. Aunque podrían ser superiores a los costes directos, en raras ocasiones son considerados. Tres conceptos importantes son el coste medio, coste marginal y coste incremental del tratamiento o servicio. El coste medio incluye todos los costes variables más una parte proporcional de los costes fijos. El coste marginal es el cambio en el coste total producido por el incremento o decremento de una unidad o servicio producido. El coste incremental, habitualmente empleado en las evaluaciones económicas, es el coste adicional que un servicio o tratamiento impone respecto a otro [3]. El modelo ideal para calcular el coste total es la construcción de un diagrama que nos permita identificar todos los ingredientes del coste y sus cantidades, en los puntos donde entren en el proceso analizado. Conociendo las veces que cada uno de estos ingredientes son requeridos en todo el proceso, es posible calcular el verdadero coste directo del programa. 2. M étodos de evaluación económica La evaluación económica nos ofrece un marco objetivo con una estructura común que permite valorar explícitamente los costes y resultados de diferentes alternativas. En la evaluación de tecnologías sanitarias se emplean 4 diferentes técnicas de análisis, recogidas en la tabla 1. La selección y utilización de las mismas depende fundamentalmente de tres factores: el contexto del análisis, el foco de la evaluación y la naturaleza de los resultados de las alternativas a valorar. 2.1. Análisis de minimización de costes El análisis de minimización de costes solamente debería utilizarse en los casos en los que los tratamientos a comparar han demostrado resultados o beneficios totalmente equivalentes. Al tratarse únicamente de un análisis de costes, erróneamente se tiende a considerar esta metodología como la más fácil de aplicar. Sin embargo, la dificultad reside en la fase de generación de las pruebas que demuestren la equivalencia clínica entre los tratamientos a comparar. Asumir la equivalencia clínica como 5 Nutri info 15 Tabla 1. Características de las técnicas de evaluación económica Técnica de análisis Valoración del resultado Interpretación Minimización de costes Resultados idénticos de las alternativas objeto del análisis. Se necesita evidencia suficiente para demostrar la equivalencia de los resultados Asegurada la equivalencia terapéutica, la opción a elegir es la de menor coste Coste- efectividad Unidades naturales relacionadas con un objeCoste necesario para obtener una unidad aditivo terapéutico común a las alternativas a valo- cional del efecto común valorado (coste increrar, ej. muertes evitadas mental / efectividad incremental ) Coste-utilidad Si no hay objetivo terapéutico común se valora el resultado en términos de mortalidad (cantidad de vida) y morbilidad (calidad de vida) Coste-beneficio Una intervención podría ser adoptada si sus Los resultados se valoran en términos económibeneficios superan los costes. Entre dos altercos, que son comparados con los costes de la nativas se debe elegir la que presente mayor intervención objeto del análisis relación Beneficio/Coste la única justificación para la realización de este tipo de análisis es una práctica totalmente equivocada. La calidad de una evaluación económica está íntimamente relacionada con la calidad de la evidencia clínica en la cual se ha basado el análisis [4]. Algunos autores afirman que el análisis de minimización de costes únicamente es apropiado cuando la equivalencia clínica ha sido probada mediante un estudio de equivalencia diseñado al efecto [5]. En este tipo de análisis es necesario asegurar que el resultado seleccionado para determinar la equivalencia clínica debe ser, a su vez, clínicamente importante para el paciente. Además, no nos podemos conformar con la equivalencia en el resultado primario, podría darse la circunstancia de que algún resultado secundario presentara diferencias significativas, ej. posología, coste o conveniencia para el paciente. En los últimos años se ha apreciado la tendencia a emplear el análisis de minimización de costes para la comparación de las nutriciones parenterales individualizadas preparadas en farmacia con las premezcladas en bolsas tricamerales. Aunque se asumen resultados idénticos, la realidad puede ser diferente [6, 7], con el riesgo de extraer conclusiones erróneas. 6 Coste necesario para obtener un año adicional de vida ajustado con calidad (QUALY) es que solamente constituye una de las técnicas empleadas en la evaluación económica. El análisis coste-efectividad, frecuentemente utilizado en la ETS, tiene un diseño en el que los resultados son medidos en unidades de efectividad clínica, tales como años de vida ganados, infartos evitados, efectos adversos evitados o casos detectados [8]. Es aplicable cuando los efectos de las alternativas comparadas tienen un nivel de efectividad distinto pero comparten los mismos objetivos terapéuticos y, por lo tanto, pueden medirse en la misma unidad de efectividad [9]. Resulta una técnica de gran utilidad para la comparación de medicamentos alternativos dentro de una misma categoría terapéutica. Es recomendable emplear una variable de medida directa del resultado final, ej. infecciones evitadas. Cuando ello no sea posible y deban utilizarse resultados intermedios, éstos únicamente son válidos en el caso de que exista una relación, científicamente demostrada, con el resultado final. 2.2. Análisis coste-efectividad En el análisis coste-efectividad los resultados de las alternativas comparadas son valorados en términos de coste por unidad de efectividad. Como en todos los estudios de evaluación económica, el objetivo del análisis es obtener el máximo beneficio en relación a los recursos disponibles. Aunque no siempre con acierto, el término costeefectividad ha sido ampliamente utilizado en la bibliografía, considerándose erróneamente sinónimo de evaluación económica, pero la realidad Es necesario distinguir entre las intervenciones o programas que son completamente independientes y aquellas que son excluyentes. En el primer caso los costes y beneficios de la inter- Evaluación económica en nutrición vención no están afectados por la introducción de otros programas, sin embargo en los casos excluyentes la introducción de un programa representa que otro será excluido. En la evaluación de intervenciones independientes, éstas son comparadas de acuerdo a la relación coste-efectividad (CE) de cada una de ellas, y la selección se realiza de acuerdo al presupuesto. CE = Coste de la intervención Efecto producido En la práctica lo más habitual es comparar intervenciones mutuamente excluyentes, como pueden ser diferentes opciones de tratamiento para la misma patología. En este caso la regla o parámetro de decisión es la razón costeefectividad incremental (RCEI), que representa el coste necesario para obtener una unidad adicional de efectividad, y se calcula de acuerdo a la siguiente ecuación: Coste B – Coste A RCEI = Efectividad B – Efectividad A La RCEI puede tener un valor negativo, indicando que seleccionando la opción B frente a la opción A se obtiene un incremento en la efectividad con menor coste. En la figura 2 se representa el denominado plano coste-efectividad, que indica los 4 cuadrantes donde pueden situarse los valores de la RCEI. Obviamente, las alternativas dominadas no deberían ser seleccionadas, al contrario de las dominantes, que ofrecen mayor efectividad con menor coste. La selección de alternativas de mayor coste y mayor efectividad (cuadrante superior derecho) dependerá de los recursos Las alternativas dominadas no deberían ser seleccionadas, al contrario de las dominantes, que ofrecen mayor efectividad con menor coste. disponibles y de la disposición para pagar el incremento de efectividad. Recientemente se ha introducido el término coste-efectividad decremental [10], aplicado para las alternativas menos efectivas pero de menor coste (cuadrante inferior izquierdo de la figura 2). Estas opciones pueden resultar atractivas con la teoría de que sacrificar beneficios marginales en favor de ahorro importante de costes puede permitir la introducción de nuevas y más costosas tecnologías, cuya efectividad será más relevante. 2.3. Análisis coste-utilidad El análisis coste-utilidad es considerado como una variante del análisis coste-efectividad. Los resultados clínicos, o la efectividad, son medidos en años de vida ajustados por calidad de vida (AVAC), tambien conocidos como QALY (Quality Adjusted Life Years). Estos parámetros combinan cantidad y calidad de vida. Se trata de un análisis coste-efectividad en el que el resultado se ajusta con medidas referentes a la calidad de vida del paciente, calculando ésta a través de la preferencia o “utilidad” que asignan los pacientes a los estados de salud producidos por los tratamientos. Los resultados de un estudio coste-utilidad se presentan como la razón coste-utilidad incremental (RCUI): Coste B – Coste A RCUI = Utilidad B – Utilidad A La RCUI indica el coste adicional necesario para obtener un QALY adicional de resultado si cambiamos la intervencicón o tratamiento A por el B. Este tipo de análisis se emplea cuando la calidad de vida es el resultado más importante a evaluar, o cuando la alternativa terapéutica va a mejorar la expectativa de vida a costa de disminuir la calidad. El cálculo de los valores de utilidad o las preferencias se miden en una escala cardinal que recoge los estados de salud. Un año de vida en perfecto estado de salud tiene un valor de utilidad de 1, mientras que 0 es equivalente a la muerte. Esta escala admite valores negativos que corresponden con estados socialmente valorados peores que la muerte. Las puntuaciones 7 Nutri info 15 Figura 2 - Plano coste-efectividad. Coste incremental + Alternativas con mayor coste y mayor efectividad Alternativas dominadas - Efectividad incremental + Alternativas dominantes Alternativas con menor coste y menor efectividad Las líneas diagonales representan posibles umbrales de relación coste-efectividad, y su pendiente corresponde al valor de la razón coste-efectividad aceptable. para los diferentes estados de salud del paciente se puede obtener mediante métodos directos (ej. escala visual) o métodos indirectos como son los cuestionarios. El cuestionario más utilizado es el EQ-5D, que incluye 5 dimensiones a valorar por el paciente: movilidad, cuidado personal, dolor o malestar, ansiedad o depresión y capacidad para realizar las actividades cotidianas [11]. Este cuestionario está disponible en versión española y ha sido validado en diferentes grupos de población [12, 13]. El QALY integra los años de vida ganados con su calidad, multiplicándolos por las utilidades de cada estado de salud para los pacientes evaluados. El tiempo vivido en un estado de salud determinado es multiplicado por el valor de utilidad que el paciente le concede. Como ejemplo, un tratamiento cuyo resultado sea 4 años de vida ganados en perfecto estado de salud generará 4 QALY, mientras que 7 años de vida ganados con un estado de salud valorado como 0,5 en la escala, generará 3,5 QALY. 8 Intervención coste-efectiva incrementalmente Intervención coste-efectiva decrementalmente Situandonos en el plano coste-efectividad (Figura 2), para la adopción de una tecnología cuyo RCUI se sitúe en el cuadrante superior derecho, hemos de conocer el umbral para la disposición a pagar por 1 QALY ganado. No existe un consenso universal, encontrando valores arbitrarios entre los diversos autores. En una revisión reciente se sugiere que una cantidad razonable se puede situar entre 30.000 y 45.000 e/QALY [14]. En las intervenciones con menor coste pero tambien menos efectivas (cuadrante inferior izquierdo), se ha recomendado aceptar aquellas con un resultado superior a 100.000 $/QALY perdido [10]. 2.4. Análisis coste-beneficio En el análisis coste-beneficio los resultados son medidos en términos económicos. Así, se comparan los costes con los beneficios, ambos en unidades monetarias, obteniendo finalmente el beneficio neto. Aunque es un método válido para la evaluación económica, no es muy utilizado debido a la dificultad que entraña la valora- Evaluación económica en nutrición ción monetaria de los efectos de las intervenciones o tratamientos evaluados sobre la salud. En las evaluaciones económicas relacionadas con la nutrición la mayoria de los estudios son de este tipo, debido a que las intervenciones nutricionales reducen los costes a la vez que mejoran los resultados en salud [15]. 3. Análisis de sensibilidad Los estudios de evaluación económica con frecuencia se basan en supuestos y estimadas de ciertas variables. El curso natural de la enfermedad, cómo afecta éste a los resultados del análisis o el consumo de recursos empleados, todos ellos son factores asociados a un cierto grado de incertidumbre. Si ésta no es adecuadamente abordada, los resultados de un análisis económico pueden quedar invalidados. Por ello es necesario realizar un análisis de sensibilidad en todos los estudios de evaluación económica. Este análisis se define como un test de estabilidad de las conclusiones del estudio dentro de un rango plausible de valores asignados a las variables más relevantes y/o mayor incertidumbre. Las conclusiones serán robustas si el análisis de sensibilidad no muestra un cambio importante en las conclusiones. Conviene recordar que los conceptos de variabilidad e incertidumbre no son equivalentes. La variabilidad se refiere a las diferencias en los valores individuales de las variables analizadas o a posibles diferencias en los valores conocidos de los parámetros incluidos en el análisis, cuyo resultado supone heterogeneidad en costes y efectos entre grupos de pacientes. La incertidumbre se refiere a situaciones en que el verdadero valor del parámetro es desconocido y tenemos que jugar con un posible rango de valores, también puede estar asociada a situaciones en que las variaciones en los costes y efectos están afectadas por errores de muestreo y medición [16]. Las variables principalmente afectadas por la incertidumbre son los costes principales y los valores de efectividad con su variabilidad asociada (intervalo de confianza). El análisis de sensibilidad analiza el impacto de las posibles modificaciones en los valores asignados inicialmente a las variables introducidas en el análisis, a la vez que aporta la información necesaria para estimar la transferibilidad de los resultados del estudio a diferentes poblaciones y grupos de pacientes. El análisis de sensibilidad puede ser de 4 tipos: • Análisis simple, que puede ser univariante (se modifica solo una variable) o multivariante que es el más habitual. Los resultados del análisis multivariante se representan en el denominado diagrama de Tornado que permite visualizar el rango de la RCEI, o la RCUI, en función de las modificaciones efectuadas en los distintos parámetros introducidos en el análisis [17]. • Análisis del umbral, que pretende identificar el valor crítico de una o más variables del análisis por encima o por debajo del cual se modifican los resultados sustancialmente. • Análisis de extremos, que intenta conocer los resultados cuando se incluyen los valores más favorables y más desfavorables para los parámetros con mayor incertidumbre. • Análisis probabilístico, se ajusta cada variable a una distribución de probabilidad y después se efectúa un número muy elevado de simulaciones. Este análisis probabilístico se suele realizar mediante la simulación de Montecarlo que permite obtener una distribución media de los valores de RCEI con sus intervalos de confianza. Se recomienda realizar, siempre que sea posible, un análisis de sensibilidad probabilístico, puesto que proporciona una evaluación más compleja de la incertidumbre asociada a las entradas del modelo y trata las interacciones de las variables analizadas. En la actualidad el análisis de sensibilidad probabilístico es el método recomendado, pues permite la representación gráfica en el plano coste-efectividad de la función de densidad de probabilidad que define la probabilidad de que una variable se sitúe en un intervalo determinado de coste incremental frente la efectividad incremental [8]. De estos datos se puede obtener la representación de las curvas de aceptabilidad que indican la probabilidad de que un determinado valor de la RCE se sitúe por debajo del umbral de disposición a pagar y, por lo tanto, la tecnología evaluada puede considerarse coste-efectiva. En la figura 3 se representa un modelo de curva de aceptabilidad, donde puede observarse que 9 Nutri info 15 Figura 3 - Curva de aceptabilidad de tecnologías en función de la disposición a pagar. Probabilidad de ser costo-efectiva 1,0 0,9 0,8 0,7 0,6 0,5 0,4 0,3 0,2 0,1 0,0 0 5.000 10.000 15.000 20.000 25.000 30.000 Disponibilidad a pagar (€) cuanto menor es la disposición a pagar menor es la probabilidad de que una determinada tecnología o tratamiento sea introducido. 4. M odelización en los estudios de evaluación económica Los modelos se construyen para sintetizar la evidencia a la hora de estimar los costes y los resultados en salud de las nuevas tecnologías, así como para extrapolar a medio y largo plazo los costes y los efectos observados en horizontes temporales cortos. La construcción se realiza mediante estimaciones obtenidas a partir de los datos disponibles o publicados de eficacia, efectos adversos, así como de los costes de las alternativas comparadas. La modelización es un proceso transparente que permite la integración de las evidencias disponibles, refleja la incertidumbre de los datos y, en definitiva, facilita la toma de decisiones explícitas e informadas. La elección del modelo a utilizar depende del problema a estudiar y de la disponibilidad de los datos. No hay un modelo mejor que otro, los más utilizados son los árboles de decisión y los modelos de Markov. Los más frecuentemente utilizados han sido los árboles de decisión que permiten: 10 • Identificar y delimitar el problema de decisión (alternativas y consecuencias). • Estructurar el problema mediante la representación de nodos de decisión, nodos de azar y resultados finales. • Estimación de la probabilidad de obtener cada resultado (clínico o coste). En la construcción de un árbol de decisión los cambios son modelados en una secuencia temporal en términos de los eventos que pueden suceder y sus consecuencias, clínicas o económicas. Esta metodología es particularmente apropiada para las situaciones clínicas agudas donde la cronología de los eventos es importante. Se estima la probabilidad de obtener cada uno de los posibles resultados finales [18]. En un estudio reciente llevado a cabo con el objetivo de valorar la relación coste-efectividad de la suplementación de la nutrición parenteral (NP) con glutamina [19], se construyó un árbol de decisión, como está recogido en la figura 4. En él se modelan las posibles consecuencias de la decisión de administrar a pacientes críticos NP estándar o suplementada con glutamina, permitiendo calcular la probabilidad de obtener cada uno de los posibles resultados para las dos posibles decisiones [19]. Evaluación económica en nutrición Los modelos farmacoeconómicos deben tener las siguientes características: • Reproducibilidad: obtener los mismos resultados siempre. • Validez: utilizar fuentes de información basadas en la evidencia. • Credibilidad: reflejar el estado de conocimiento actual. • Transparencia: reflejar las fuentes de información y supuestos utilizados. • Flexibilidad: ser adaptable a distintas situaciones de asistencia sanitaria. Figura 4 - Arbol de decisión [20]. Probabilidad de infección Infección Planta Probabilidad de traslado Alta Probabilidad de alta Muerte Probabilidad de muerte UCI No infección NP con Glutamina Planta Alta Muerte Alta Paciente crítico Muerte Probabilidad de infección Infección Planta Probabilidad de traslado Alta Probabilidad de alta Muerte Probabilidad de muerte UCI No infección NP sin Glutamina Planta Alta Muerte Alta Muerte Nodo de decisión: administrar nutrición parenteral (NP) suplementada o no con glutamina. Nodo de azar: diferentes eventos o sucesos que pueden presentarse. La suma de todas las probabilidades en cada nodo de azar es de 1. La probabilidad de cada uno de los resultados finales se obtiene multiplicando las diferentes probabilidades a lo largo de la rama que conduce a ese resultado. 11 Nutri info 15 3 CALIDAD DE LOS ESTUDIOS DE EVALUACIÓN ECONÓMICA En la realización de una evaluación económica de tecnologías sanitarias es posible introducir sesgos metodológicos importantes que han de ser considerados en la valoración de sus resultados. Por ello se dispone de distintas guías de estandarización de este tipo de estudios [3, 16, 20]. La guía de Drummond [20] contempla tres áreas importantes: diseño del estudio, recogida de datos y análisis e interpretación de los resultados. En nuestro país se ha realizado una propuesta de guía para la estandarización metodológica de la evaluación de tecnologías, como parte de un proyecto financiado por el Ministerio de Sanidad y Consumo [16]. El documento sirve como guía para la elaboración de este tipo de estudios, y contempla 17 aspectos o dominios: 1. Alcance y objetivos del estudio. Establecer de forma clara y precisa el objetivo y la población de estudio. 2. Perspectiva del análisis. Se recomienda utilizar como regla general la perspectiva social. 3. Opciones a comparar. Se recomienda comparar la tecnología analizada con, como mínimo, la práctica clínica habitual. 4. Tipos de evaluación. Se estandarizan los 4 tipos de estudios antes comentados, y se recomienda justificar la elección. 5. Datos de eficacia/efectividad. Se recomienda utilizar datos de eficacia obtenidos en condiciones ideales del ensayo clínico y datos de efectividad obtenidos en práctica real, puesto que ambos son complementarios. 12 8. Horizonte temporal de los costes y beneficios. Se recomienda que el horizonte temporal empleado sea aquel que permita captar de manera más adecuada todos los efectos diferenciales de los tratamientos sobre la salud y los recursos. 9. Modelización. Se debe justificar la elección del modelo analítico y los parámetros clave incluidos. 10.Descuentos para costes y beneficios. Se recomienda aplicar una tasa de descuento anual para los costes y beneficios en aquellos estudios con efectos valorados a largo plazo. 11. Variabilidad e incertidumbre. Se considera imprescindible el análisis de sensibilidad para tratar la incertidumbre. 12.Equidad. El criterio es el de igualdad en la valoración de resultados. 13.Transferibilidad de resultados. La transparencia en el informe resulta imprescindible para poder juzgar la validez del análisis, y poder transferir los diferentes elementos de una evaluación económica a otro contexto distinto del original en que fueron desarrollados. 14.Presentación de resultados. Se recomienda presentar los resultados mediante un análisis incremental. 15.Limitaciones del estudio. Presentar de manera crítica los puntos débiles del estudio. 16.Conclusiones. Las conclusiones se deben desprender de los resultados obtenidos. 6. Medida y evaluación de los resultados. Se recomienda utilizar medidas clínicamente relevantes. 17. Conflicto de intereses. Se debe describir claramente quien encargó y quien financió el estudio. 7. Utilización de recursos y costes. Se debe explicitar la perspectiva del análisis, ya que puede condicionar los costes a incluir. En este trabajo se propone una lista de comprobación con 25 cuestiones para revisar un estudio de evaluación económica, de acuerdo a los principios metodológicos discutidos en la guía. Evaluación económica en nutrición 4 ESTUDIOS DE EVALUACIÓN ECONÓMICA EN NUTRICIÓN Las evaluaciones económicas tradicionalmente han sido utilizadas para el análisis de intervenciones terapéuticas (medicamentos y productos sanitarios). Sin embargo, en los últimos años la presión económica se ha extendido a todos los ámbitos de la asistencia sanitaria, por lo que este tipo de análisis ha adquirido mayor relevancia en el campo de la nutrición. Las intervenciones nutricionales compiten con el resto de tecnologías en la distribución de los recursos ofreciendo, por tanto, una excelente oportunidad para su evaluación [21]. Cabe pensar que la evaluación económica del soporte nutricional será de especial utilidad, pues el relativamente bajo coste de la nutrición comparado con sus beneficios permitirá una comparación favorable con otras tecnologías terapéuticas, a la vez que nos permite establecer su verdadero valor y posicionarla con una base científica. Los datos generados pueden servir como soporte de evidencia científica para la elaboración de guías de práctica clínica y toma de decisiones costoefectivas en la terapéutica nutricional. La evaluación económica del soporte nutricional permitirá una comparación favorable con otras tecnologías terapéuticas, a la vez que nos permite establecer su verdadero valor y posicionarla con una base científica. La evaluación económica del soporte nutricional podría clarificar los costes de la desnutrición o identificar las intervenciones nutricionales más eficientes. Concretamente, puede responder a las siguientes cuestiones: ¿Qué intervenciones nutricionales son coste-efectivas?, ¿Cuál es más coste-efectiva?, ¿Qué nutrien- tes específicos reportan mayores beneficios?, ¿Cuáles son las preferencias de los pacientes?. Las primeras referencias de evaluaciones económicas en nutrición surgen en la década de los noventa [22-25]. Ha sido recientemente cuando han empezado a aparecer más estudios farmacoeconómicos relacionados con la nutrición, de forma paralela al perfeccionamiento y expansión de esta disciplina. Por otra parte, también ha sido en los últimos años cuando se han realizado importantes avances que nos han permitido esclarecer el papel de la nutrición clínica. Las primeras referencias de evaluaciones económicas relacionadas con la nutrición surgen en la década de los noventa, cuya calidad metodológica ahora podría ser discutida [22‑25]. En los últimos años se han publicado diversos estudios de evaluación económica relacionados con la nutrición. En la revisión de Walzer et al [26] se identificaron 53 estudios, cumpliendo 32 de ellos los requisitos de calidad establecidos por los autores. La malnutrición fue la patología presente en el 32% de los estudios, aunque las alteraciones gastrointestinales estaban presentes en un elevado número de ellos. El 56% de los estudios estaban relacionados con pacientes ingresados y el 44% con pacientes de la comunidad, institucionalizados o no. De todos los trabajos analizados, solamente 8 presentaban modelos farmacoeconómicos válidos de acuerdo a la guía de calidad de Drummond, atribuyendo este hecho a que la mayoría de los análisis se han realizado con estudios clínicos y bases de datos, en los que no se han incluido los costes reales del tratamiento. Los estudios publicados se han centrado principalmente en los costes de la desnutrición [27, 28], el impacto de las intervenciones de cribado nutricional [29] o el valor de la nutrición enteral en distintos grupos de pacientes [30‑32]. Se ha demostrado el elevado impacto económico de la desnutrición, todos estos análisis, que ponen de manifiesto la reducción de las complicaciones de la desnutrición, demuestran el ahorro potencial de costes sanitarios derivado de la intervención nutricional. Los suplementos orales han sido objeto de análisis en varios estudios [33‑35]. La 13 Nutri info 15 reducción de hospitalizaciones, fundamentalmente en pacientes de edad avanzada, que se obtiene con la suplementación oral apoya estas conclusiones [36]. La nutrición enteral en poblaciones específicas de pacientes también ha sido estudiada [37, 38]. En pacientes con fractura de cadera [37], los suplementos orales no han demostrado ser costo-efectivos cuando los resultados fueron valorados en QALY, aunque si fueron efectivos para conseguir ganancia de peso. En el caso de las NP los estudios son más escasos [26], habiéndose encontrado en algunas situaciones que no es una opción coste-efectiva, como es el caso de la NP domiciliaria en pacientes oncológicos con obstrucción intestinal inoperable [39]. En este estudio de evaluación, utilizando datos de metaanálisis, la NP domiciliaria presenta una RCEI de 176.587 £/QALY, por lo que esta terapia resulta altamente ineficiente y no puede ser recomendada. Recientemente se han realizado algunas evaluaciones económicas relacionadas con el coste de las NP individualizadas en comparación con las premezcladas en bolsas tricamerales o estandarizadas [6, 7]. Se han realizado algunas evaluaciones económicas relacionadas con el coste de las NP individualizadas en comparación con las premezcladas en bolsas tricamerales. En diferentes metaanálisis los equipos de soporte nutricional han demostrado reducir las complicaciones y mejorar algunos resultados de las intervenciones nutricionales [40, 41]. La disponibilidad de personal entrenado para el cuidado y mantenimiento del catéter puede reducir el número de infecciones y, por lo tanto, ser una estrategia coste-efectiva [42]. Sin embargo, no hay suficiente evidencia para demostrar de forma concluyente la efectividad y eficiencia de los equipos de soporte nutricional como modelo de práctica profesional. En general, aunque los estudios de evaluación económica se han ido introduciendo en el área específica de la tera- 14 péutica nutricional, permanecen algunas preguntas a las que deberíamos responder, tales como el tipo de tratamiento, impacto de nutrientes específicos o duración del tratamiento. La farmaconutrición, aunque ha sido proclamada como una modalidad terapéutica eficaz como nutrición específica en determinadas situaciones, constituye una intervención insuficientemente evaluada como para recomendar su utilización de manera generalizada. Algunos nutrientes específicos, y no la combinación, sí han demostrado resultados positivos tanto desde el punto de vista económico como clínico. La suplementación de la NP con glutamina en pacientes críticos y la adicción de ácidos grasos omega 3 a la NP de pacientes críticos y pacientes quirúrgicos no críticos, han sido analizadas con la metodología de la evaluación económica, demostrando resultados positivos [17, 19]. La suplementación de la NP con glutamina y ácidos grasos omega 3 son prácticas que han sido conveniente evaluadas siguiendo la metodología de las evaluaciones económicas para valorar su relación coste-efectividad. En el estudio de glutamina, llevado a cabo desde la perspectiva de un hospital en Italia, se realizó un modelo farmacoeconómico para estimar la mortalidad, las infecciones y el coste de la estancia hospitalaria en pacientes tratados con NP suplementada y en aquellos que reciben NP estándar. Los datos incluidos en el estudio fueron obtenidos de un metaanálisis y de los costes por estancia hospitalaria y del tratamiento de la infección, siendo la NP suplementada con glutamina la opción La suplementación de la NP con glutamina en pacientes críticos y la adicción de ácidos grasos omega 3 a la NP de pacientes críticos y pacientes quirúrgicos no críticos, han sido analizadas con la metodología de la evaluación económica, demostrando resultados positivos. Evaluación económica en nutrición dominante en términos clínicos y económicos. En el análisis de sensibilidad los resultados estaban influenciados por la tasa de mortalidad, la estancia en la UCI y su coste, y el coste y dosis de glutamina administrada. Sin embargo, en todas las simulaciones realizadas, en las que se modificaron los datos iniciales dentro de los valores extremos de la distribución de probabilidades, la suplementación de la NP con glutamina resultó ser siempre la opción dominante. La conclusión del estudio es que la adición de glutamina a la NP de pacientes críticos reduce la mortalidad, las infecciones y la estancia hospitalaria, proporcionando a su vez una reducción significativa de los costes por estancia [19]. Con posterioridad a este estudio se ha publicado una revisión sistemática en la base Cochrane [43]cuyos resultados demuestran que la suplementación con glutamina da lugar a una reducción significativa en la estancia hospitalaria, aunque no encontraron diferencias significativas en el resto de los resultados analizados. Con estos datos es probable que las conclusiones del análisis anterior no se vieran afectadas. El estudio de coste-efectividad de los suplementación de la NP con ácidos omega-3 [17] ha sido realizado por los mismos autores y con una metodología similar, modelización farmacoeconómica, combinación de resultados de metaanális y datos de bases propias, y análisis de los costes en hospitales italianos. Los resultados clínicos incluidos en la simulación fueron la estancia hospitalaria, tasa de infecciones y mortalidad en UCI, y mortalidad en planta. La suplementación de las emulsiones lipídicas con ácidos grasos omega-3 reduce la tasa de infecciones y la estancia hospitalaria, por lo que los costes de esta intervención nutricional son ampliamente compensados con los beneficios. El análisis de sensibilidad demostró que los factores que principalmente afectan al coste incremental de la NP estándar sin suplementar son la estancia hospitalaria, la estancia en UCI y su coste. Este estudio se ha realizado con los costes de diferentes países europeos, sin que las conclusiones se vieran afectadas. El hecho de realizar el análisis con datos de diferentes países añade verosimilitud a la posible transferibilidad de Figura 5 - Transferibilidad de los resultados de un análisis de evaluación económica. ¿Tiene el estudio calidad aceptable y la metodología es relevante para el problema de decisión? Desarrollar un nuevo modelo analítico No Sí ¿Los tratamientos de los pacientes representados son similares a los empleados localmente? No Análisis de datos de diferentes estudios randomizados y distintas localizaciones Sí Sí No Adaptar los resultados a los parámetros locales, ej. costes Análisi estadístico de los datos Obtener nuevos datos 15 Nutri info 15 los resultados entre los países de nuestro entorno. En la figura 5 se representa esquemáticamente el concepto de transferibilidad de los resultados de una evaluación económica, que perfectamente puede aplicarse a este estudio. sea debido a que los beneficios de la nutrición pueden ser diversos, ej. infecciones, estancia, tratamiento antibiótico, etc, y los costes evitados de estos eventos superan el coste de la propia intervención nutricional. En la mayoría de los estudios de evaluación económica llevados a cabo en el campo de la nutrición, los resultados se han centrado más en ahorro de costes que en coste por resultado, es decir, se ha realizado un análisis coste-beneficio más que un análisis coste-efectividad. Ello quizás La realización de estudios de evaluación económica del soporte nutricional, en sus diferentes aspectos clínicos, permitirá establecer el tipo de nutrición más adecuado para cada paciente, así como el impacto de la misma en la calidad de vida del paciente. 5 1. Waber RL, Shiv B, Carmon Z, Ariely D. Commercial features of placebo and therapeutic efficacy. JAMA. 2008;299:1016-7. 2. Rosenbaum L, Lamas D. Cents and sensitivity--teaching physicians to think about costs. N Engl J Med. 2012;367:99-101. 3. Drummond MF, Stoodart GL, Torrance GW. Métodos para la evaluación económica de los programas de atención a la salud. Madrid: Diaz de Santos S.A.; 1991. 4. Freemantle N, Maynard A. Something rotten in the state of clinical and economic evaluations?. Health Econ. 1994;3:63-7. 5. Briggs AH, O’Brien BJ. The death of cost-minimization analysis?. Health Econ. 2001;10:179-84. 6. Magee G, Zaloga GP, Turpin RS, Sanon M. A retrospective, observational study of patient outcomes for critically ill patients receiving parenteral nutrition. Value Health. 2014;17:328-33. 7. Blanchette LM1, Huiras P, Papadopoulos S. Standardized versus custom parenteral nutrition: impact on clinical and cost-related outcomes. Am J Health Syst Pharm. 2014 Jan 15;71:114-21. 8. Phillips C. What is cost-effectiveness?. Disponible en: http://www. medicine.ox.ac.uk/bandolier/painres/download/whatis/Costeffect.pdf. Consulta el 20-11-2014. 9. Fernández de Gatta MD, Calvo MV, Hernández JM, Caballero D, San Miguel JF, Domínguez-Gil A. Cost-effectiveness analysis of serum vancomycin concentration monitoring in patients with hematologic malignancies. Clin Pharmacol Ther. 1996;60:332-40. 10. 11. 12. 16 BIBLIOGRAFÍA Nelson AL, Cohen JT, Greenberg D, Kent DM. Much cheaper, almost as good: decrementally cost-effective medical innovation. Ann Intern Med. 2009;151:662-7. Phillips C. What is a QALY?. Disponible en: http://www.medicine. ox.ac.uk/bandolier/painres/download/whatis/QALY.pdf. Consulta el 20-11-2014. Herdman M, Badia X, Berra S. El EuroQol-5D: una alternativa sencilla para la medición de la calidad de vida relacionada con la salud en atención primaria. Aten Primaria. 2001;28: 425-429. 13. Badia X, Roset M, Montserrat S, Herdman M, Segura A. The Spanish version of EuroQol: a description and its applications. European Quality of Life scale. Med Clin (Barc). 1999;112 Suppl 1:79-85. 14. De Cock E, Miravitlles M, Gonzalez-Juanatey JR, Azanza-Perea JR. Valor umbral del coste por año de vida ganado para recomendar la adopción de tecnologías sanitarias en España: evidencias procedentes de una revisión de la literatura. Pharmacoecon Span Res Artic. 2007;4:97-107. 15. Calvo MV, Gonzalez MP, Alaguero M, Perez-Simón JA. Intensive monitoring program for oral food intake in patients undergoing allogeneic hematopoietic cell transplantation: a cost-benefit analysis. Nutrition. 2002;18:769-71. 16. Bastida JL, Oliva J, Antoñanzas F, Garcia-Altes A, Gisbert R, Mar J. et al. Propuesta de guía para la evaluación económica aplicada a las tecnologías sanitarias. Gac Sanit.2010;24:154–170. 17. Pradelli L, Eandi M, Povero M, Mayer K, Muscaritoli M, Heller AR et al. E. Cost-effectiveness of omega-3 fatty acid supplements in parenteral nutrition therapy in hospitals: a discrete event simulation model. Clin Nutr. 2014;33:785-92. 18. Calvo MV, Pilar del Val M, Mar Alvarez M, Domínguez-Gil A. Decision analysis to assess cost-effectiveness of low-osmolality contrast medium for intravenous urography. Am J Hosp Pharm. 1992;49:57784. 19. Pradelli L, Iannazzo S, Zaniolo O, Muscaritoli M, Eandi M. Effectiveness and cost-effectiveness of supplemental glutamine dipeptide in total parenteral nutrition therapy for critically ill patients: a discrete event simulation model based on Italian data. Int J Technol Assess Health Care. 2012;28:22-8. 20. Drummond MF, Jefferson TO. Guidelines for authors and peer reviewers of economic submissions to the BMJ. The BMJ Economic Evaluation Working Party. BMJ. 1996;313:275-83. 21. Philipson T, Linthicum MT, Snider JT. Tutorial on health economics and outcomes research in nutrition. JPEN J Parenter Enteral Nutr. 2014;38 (2 Suppl):5S-16S. 22. Perry S, Pillar B, Radany MH. The appropriate use of high-cost, highrisk technologies: the case of total parenteral nutrition. QRB Qual Rev Bull. 1990;16:214-7. 23. Goel V. Economics of total parenteral nutrition. Nutrition. 1990;6:332-5. 24. Calvo MV, Pérez Encinas M, Nieto F, Domínguez Moronta F, Muñoz A. Cost-effectiveness of individualized enteral nutrition by a nutrition support team in laryngectomized cancer patients. Nutr Hosp.1991;6:87-93. Evaluación económica en nutrición 25. Koretz H. Clinical economics review: nutritional support. Aliment Pharmacol Ther. 1997;11:453-71. 26. 27. 35. Walzer S, Droeschel D, Nuijten M, Chevrou-Séverac H. Health economic analyses in medical nutrition: a systematic literature review. Clinicoecon Outcomes Res. 2014;6:109-24. Freijer K, Nuijten MJ, Schols JM. The budget impact of oral nutritional supplements for disease related malnutrition in elderly in the community setting. Front Pharmacol. 2012;4;3:78. 36. Freijer K, Tan SS, Koopmanschap MA, Meijers JM, Halfens RJ, Nuijten MJ. The economic costs of disease related malnutrition. Clin Nutr. 2013;32:136-41. Stratton RJ, Hébuterne X, Elia M. A systematic review and metaanalysis of the impact of oral nutritional supplements on hospital readmissions. Ageing Research Reviews. 2013;12:884– 897 37. Wyers CE, Reijven PL, Evers SM, Willems PC, Heyligers IC, Verburg AD, et al. Cost-effectiveness of nutritional intervention in elderly subjects after hip fracture. A randomized controlled trial. Osteoporos Int. 2013;24:151-62. 38. Hisashige A, Ohura T. Cost-effectiveness of nutritional intervention on healing of pressure ulcers. Clin Nutr. 2012;31:868-74. 39. Naghibi M, Smith TR, Elia M. A systematic review with meta-analysis of survival, quality of life and cost-effectiveness of home parenteral nutrition in patients with inoperable malignant bowel obstruction. Clin Nutr. 2014. pii: S0261-5614(14)00238-6. 40. Schneider PJ. Nutrition support teams: an evidence-based practice. Nutr Clin Pract. 2006;21:62-7. 28. Cangelosi MJ, Rodday AM, Saunders T, Cohen JT. Evaluation of the economic burden of diseases associated with poor nutrition status. JPEN J Parenter Enteral Nutr. 2014;38 (2 Suppl):35S-41S. 29. Kruizenga HM, Van Tulder MW, Seidell JC, Thijs A, Ader HJ, Van Bokhorst-de van der Schueren MA. Effectiveness and cost-effectiveness of early screening and treatment of malnourished patients. Am J Clin Nutr. 2005;82:1082-9. 30. 31. 32. 33. 34. Freijer K, Bours MJ, Nuijten MJ, Poley MJ, Meijers JM, Halfens RJ, et al.The economic value of enteral medical nutrition in the management of disease-related malnutrition: a systematic review. J Am Med Dir Assoc. 2014;15:17-29. De van der Schueren M, Elia M, Gramlich L, Johnson MP, Lim SL, Philipson T, et al. Clinical and economic outcomes of nutrition interventions across the continuum of care. Ann N Y Acad Sci. 2014;1321:20-40. Freijer K, Nuijten MJ. Analysis of the health economic impact of medical nutrition in the Netherlands. Eur J Clin Nutr. 2010;64:122934. Cangelosi MJ, Auerbach HR, Cohen JT. A clinical and economic evaluation of enteral nutrition. Curr Med Res Opin. 2011;27:413-22. Philipson TJ, Snider JT, Lakdawalla DN, Stryckman B, Goldman DP. Impact of oral nutritional supplementation on hospital outcomes. Am J Manag Care. 2013;19:121-8. Majka AJ, Wang Z, Schmitz KR, Niesen CR, Larsen RA, Kinsey GC, et al. Care coordination to enhance management of long-term enteral tube feeding: a systematic review and meta-analysis. JPEN J Parenter Enteral Nutr. 2014;38:40-52. 42. Fraher MH, Collins CJ, Bourke J, Phelan D, Lynch M. Cost-effectiveness of employing a total parenteral nutrition surveillance nurse for the prevention of catheter-related bloodstream infections. J Hosp Infect. 2009 ;73:129-34. 43. Tao KM, Li XQ, Yang LQ, Yu WF, Lu ZJ, Sun YM, Wu FX. Glutamine supplementation for critically ill adults. Cochrane Database Syst Rev. 2014 Sep 9;9:CD010050. 41. FICHAS TÉCNICAS: 1. NOMBRE DEL MEDICAMENTO. Dipeptiven 200 mg/ml concentrado para solución para perfusión. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA. 1 ml contiene: Alanilglutamina 200 mg (= 82,0 mg alanina, 134,6 mg glutamina). Osmolaridad teórica: 921 mosmol/l. Acidez titulable: 90-105 mmol NaOH/l. pH: 5,4 - 6.0. Para consultar la lista completa de excipientes, ver sección 6.1. 3. FORMA FARMACEUTICA. Concentrado para solución para perfusión. Solución transparente e incolora. 4. DATOS CLÍNICOS. 4.1. Indicaciones terapéuticas. Dipeptiven está indicado como parte de un régimen de nutrición clínica en pacientes en estados hipercatabólicos y/o hipermetabólicos. Debe administrarse junto con nutrición parenteral o enteral o una combinación de ambas. 4.2. Posología y forma de administración. Solución para perfusión tras mezclar con una solución para perfusión compatible. Las mezclas de soluciones con una osmolaridad superior a 800 mosmol/l, deben ser perfundidas a través de una vía venosa central. Adultos. Dipeptiven se administra en paralelo con nutrición parenteral o enteral o con una combinación de ambas. La dosis depende de la gravedad del estado catabólico y de las necesidades de aminoácidos y proteínas. En la nutrición parenteral/enteral, no se deberá exceder una dosis máxima diaria de 2 g de aminoácidos y/proteínas por kg de peso corporal. En el cálculo, habrá que tener en cuenta el aporte de alanina y glutamina a través de Dipeptiven. La proporción de aminoácidos aportados por Dipeptiven no deberá ser superior al 30% del aporte total de aminoácidos/proteínas. Dosis diaria. 1,5-2,5 ml de Dipeptiven por kg de peso corporal (equivalente a 0,3-0,5 g Alanilglutamina por kg peso corporal). Esto corresponde de 100 a 175 ml de Dipeptiven para un paciente de 70 kg peso corporal. Dosis máxima diaria: 2,5 ml, equivalente a 0,5 g de Alanilglutamina de Dipeptiven por kg peso corporal. La dosis diaria máxima de 0,5 g Alanilglutamina por kg peso corporal, debe ser administrada en combinación como mínimo con 1,0 g de aminoácidos/proteínas por kg de peso corporal y día. Incluyendo los aminoácidos aportados por Dipeptiven, esto da lugar a una dosis diaria de al menos 1,5 g de aminoácidos/proteínas por kg de peso corporal. Los ajustes siguientes son ejemplos para el aporte de Dipeptiven y aminoácidos como solución para nutrición parenteral, y/o proteínas como fórmula de nutrición enteral: Requerimiento de aminoácidos/proteínas 1,2 g/kg peso corporal por día: 0,8 g aminoácidos/proteínas + 0,4 g Alanilglutamina por kg peso corporal. Requerimiento de aminoácidos/proteínas 1,5 g/kg peso corporal por día: 1,0 g aminoácidos/proteínas + 0,5 g Alanilglutamina por kg peso corporal. Requerimiento de aminoácidos/proteínas 2 g/kg peso corporal por día: 1,5 g aminoácidos/ proteínas + 0,5 g Alanilglutamina por kg peso corporal. Dipeptiven es una solución para perfusión concentrada que no está diseñada para la administración directa. Pacientes con nutrición parenteral total. La velocidad de perfusión depende de la velocidad de perfusión de la solución vehículo y no deberá exceder 0,1 g de aminoácidos/ kg peso corporal por hora. Dipeptiven debe mezclarse con una solución vehículo de aminoácidos compatible o con un régimen de perfusión conteniendo aminoácidos, antes de la administración. Se puede diluir Dipeptiven con una solución de cloruro de sodio al 0,9% o con una solución de glucosa al 5%. Pacientes con nutrición enteral total. Dipeptiven se perfunde en forma continua durante 20-24 horas al día. Para perfusión venosa periférica, se diluye Dipeptiven para obtener una osmolaridad ≤ 800 mosmol/l (p. ej. 100 ml de Dipeptiven + 100 ml de cloruro de sodio al 0,9%). Pacientes con nutrición parenteral y enteral combinada. La dosis diaria total de Dipeptiven se debe administrar con la nutrición parenteral, es decir, mezclado con una solución de aminoácidos compatible o con un régimen de perfusión conteniendo aminoácidos, antes de la administración. La velocidad de perfusión depende de la velocidad de perfusión de la solución vehículo y se debe ajustar según las proporciones de la nutrición enteral y parenteral. Velocidad máxima de perfusión. Al añadir Dipeptiven a las mezclas de nutrición parenteral, debería regularse la velocidad máxima de perfusión dependiendo de la velocidad máxima de los demás nutrientes. Si Dipeptiven se administra solo, los estudios clínicos han mostrado que se puede administrar de manera segura una dosis de 0,5 g de Dipeptiven/kg/día en una vía venosa periférica durante 4 horas. Corresponde a 0.125 g/kg/hora (0.625 ml/kg/hora). Si se administra como parte de la nutrición parenteral total y representa 30% de la carga total de aminoácidos, la velocidad máxima de perfusión corresponde a 0,030 g/kg/hora. Duración de la administración. La duración del uso no debe ser superior a 3 semanas. Niños. La seguridad y eficacia en niños no ha sido establecida. 4.3. Contraindicaciones. Dipeptiven no deberá administrarse a pacientes con insuficiencia renal grave (aclaramiento de creatinina < 25 ml/min.), con insuficiencia hepática grave, con acidosis metabólica grave o con hipersensibilidad conocida a cualquiera de las sustancias activas o excipientes. 4.4. Advertencias y precauciones especiales de empleo. Se recomienda monitorizar 17 Nutri info 15 regularmente los parámetros de la función hepática en pacientes con insuficiencia hepática compensada. Dado que actualmente no se dispone de datos suficientes sobre la administración de Dipeptiven a mujeres embarazadas o en período de lactancia, ni en niños, no se recomienda la administración del preparado a estos grupos de pacientes. Deben controlarse los niveles de electrólitos séricos, la osmolaridad sérica, el balance hídrico, el equilibrio ácido-base así como los tests de función hepática (fosfatasa alcalina, ALT, AST) y los posibles síntomas de hiperamoniemia. Deben monitorizarse los niveles de los enzimas fosfatasa alcalina, GPT, GOT y bilirrubina, así como el balance ácido-base. La elección de una vena periférica o central depende de la osmolaridad final de la mezcla. El límite generalmente aceptado para una perfusión periférica es aproximadamente 800 mosmol/l, pero varía considerablemente con la edad y la condición general del paciente y las características de las venas periféricas. La experiencia sobre el uso de Dipeptiven durante períodos superiores a nueve días es limitada. Tras perfusiones intravenosas del producto se puede desarrollar urticaria incluso sin tener alergias a los componentes de la solución. Una razón podría ser urticaria por frío causada por perfusiones frías. Por lo tanto se recomienda realizar la perfusión con una solución de Dipeptiven a temperatura ambiente. 4.5. Interacción con otros medicamentos y otras formas de interacción. No se han descrito. 4.6. Fertilidad, embarazo y lactancia. Debido a la falta de experiencia, Dipeptiven no se debe administrar durante el embarazo y la lactancia. 4.7. Efectos sobre la capacidad de conducir y utilizar máquinas. No procede. 4.8. Reacciones adversas. Ninguno si se administra correctamente. 4.9. Sobredosis. Como en el caso de otras soluciones de perfusión, se pueden producir escalofríos, náuseas y vómitos si se excede la velocidad de perfusión recomendada para Dipeptiven. En este caso, la perfusión se debe interrumpir inmediatamente. 5. PROPIEDADES FARMACOLÓGICAS. Ver Ficha técnica cmpleta. 6. Datos farmacéuticos. 6.1. Lista de excipientes. Agua para preparaciones inyectables. 6.2. Incompatibilidades. Este medicamento no debe mezclarse con otros excepto con los mencionados en la sección 6.6. 6.3. Período de validez. 2 años. Usar inmediatamente después de la apertura del envase. Dipeptiven no debe ser conservado después de la mezcla con otros componentes. 6.4. Precauciones especiales de conservación. No conservar a temperatura superior a 25 °C. Conservar en el envase original. 6.5. Naturaleza y contenido del envase. Frascos de vidrio de 50 ml y, 100 ml. Vidrio incoloro tipo II. Puede que solamente estén comercializados algunos tamaños de envase. 6.6. Precauciones especiales de eliminación y otras manipulaciones. Dipeptiven es una solución para perfusión concentrada que no está diseñada para la administración directa. El envase y la solución deben ser inspeccionados visualmente previamente a su uso. Utilizar sólo si la solución es transparente, libre de partículas y si el envase está intacto. Para un solo uso. La adición del concentrado a la solución vehículo antes de la administración, deberá realizarse bajo condiciones asépticas. La correcta mezcla y la compatibilidad deben ser comprobadas. Los restos de solución no utilizados deben desecharse. Dipeptiven se perfunde mediante una solución vehículo. Para los detalles, ver la sección 4.2. La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local. 7. TITULAR DE LA AUTORIZACION DE COMERCIALIZACION. Fresenius Kabi Deutschland GmbH. 61346 Bad Homburg v.d.H. ALEMANIA. 8. NÚMERO DE AUTORIZACIÓN DE COMERCIALIZACIÓN. 61.771. 9. FECHA DE LA PRIMERA AUTORIZACIÓN/ RENOVACIÓN DE LA AUTORIZACIÓN. Septiembre 1997/Marzo 2008. 10. FECHA DE LA REVISIÓN DEL TEXTO. Abril 2013. 11. RÉGIMEN DE PRESCRIPCIÓN. Medicamento sujeto a prescripción médica (Incluido en el SNS). Uso hospitalario. SMOFlipid® 20% - 1. NOMBRE DEL MEDICAMENTO. SMOFlipid® 200 mg/ml emulsión para perfusión. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA. 1000 ml de emulsión para perfusión contienen: Aceite de soja, refinado: 60,0 g; Triglicéridos de cadena media: 60,0 g; Aceite de oliva, refinado: 50,0 g; Aceite de pescado, rico en ácidos omega-3: 30,0 g; Aporte energético total: 8,4 MJ/l (=2000 kcal/l); Valor del pH: aprox. 8; Osmolalidad: aprox. 380 mosm/kg. Para consultar la lista completa de excipientes ver sección 6.1. 3. FORMA FARMACÉUTICA. Emulsión para perfusión. Emulsión blanca homogénea. 4. DATOS CLÍNICOS. 4.1 Indicaciones terapéuticas. Aporte de energía, ácidos grasos esenciales y ácidos grasos omega-3 en pacientes, como parte de un régimen de nutrición parenteral, cuando la nutrición oral o enteral es imposible, insuficiente o está contraindicada. 4.2 Posología y forma de administración. La dosificación y velocidad de perfusión deberán establecerse en función de la capacidad del paciente para eliminar la grasa infundida (ver sección 4.4). Adultos: La dosis estándar es 1,0-2,0 g de grasa/kg de peso corporal (p.c.)/día, correspondiente a 5-10 ml/kg de p.c./día. La velocidad de perfusión recomendada es 0,125 g de grasa/kg p.c./hora, equivalente a 0,63 ml de SMOFlipid®/kg p.c./hora y no debe sobrepasar 0,15 g de grasa/kg p.c./hora, equivalente a 0,75 ml de SMOFlipid®/kg p.c./hora. Población pediátrica: Neonatos y bebés: La dosis inicial debe ser 0,5-1,0 g grasa/kg p.c./ día, seguida de un incremento sucesivo de 0,5-1,0 g grasa/kg p.c./día hasta 3,0 g grasa/ kg p.c./día. Se recomienda no exceder la dosis diaria de 3 g grasa/kg p.c./día, correspondiente a 15 ml de SMOFlipid®/ kg p.c./día. La velocidad de perfusión no debe exceder 0,125 g grasa/ kg p.c./día. En prematuros y neonatos con bajo peso de nacimiento, SMOFlipid® debe ser infundido de forma continua durante 24 horas. Niños: Se recomienda no exceder la dosis diaria máxima de 3 g grasa/ kg p.c./día, correspondiente a 15 ml de SMOFlipid®/ kg p.c./día. La dosis diaria debe ser incrementada gradualmente durante la primera semana de administración. La velocidad de perfusión no debe exceder 0,15 g grasa/ kg p.c./día. Forma de administración: Perfusión intravenosa en una vena periférica o central. 4.3 Contraindicaciones. Hipersensibilidad a la proteína de pescado, de huevo, de soja o de cacahuete, o a cualquiera de las sustancias activas o excipientes. Hiperlipidemia grave. Insuficiencia hepática grave. Alteraciones graves de la coagulación sanguínea. Insuficiencia renal grave sin posibilidad de hemofiltración o diálisis. Shock agudo. Contraindicaciones generales de una terapia de perfusión: edema pulmonar agudo, hiperhidratación e insuficiencia cardiaca descompensada. Condiciones inestables (por ejemplo, condiciones post-traumáticas graves, diabetes mellitus descompensada, infarto agudo de miocardio, ictus, embolia, acidosis metabólica, sepsis grave y deshidratación hipotónica). 4.4 Advertencias y precauciones especiales de empleo. La capacidad para la eliminación de lípidos es una característica individual y, por tanto, deberá monitorizarse de acuerdo con las rutinas clínicas. Esto se lleva a cabo generalmente comprobando los niveles de triglicéridos. Debe prestarse especial atención a pacientes con un marcado riesgo de hiperlipidemia (como pacientes con dosificación elevada de lípidos, sepsis grave y bebés con peso de nacimiento extremadamente bajo). Durante la perfusión, la concentración de triglicéridos séricos, en general, no deberá exceder 3 mmol/l. Deberá considerarse una reducción de la dosis o una interrupción de la emulsión lipídica, si las concentraciones de triglicéridos en suero o en plasma, durante o después de la perfusión, exceden 3 mmol/L. Una sobredosis puede dar lugar a un síndrome de sobrecarga lipídica, (ver sección 4.8). Hasta el momento actual existe poca experiencia en tratamientos con SMOFlipid® durante más de 14 días. Este producto contiene aceite de soja, aceite de pescado y fosfolípidos de huevo, que muy raramente pueden causar reacciones alérgicas. Se han observado reacciones alérgicas cruzadas entre la soja y el cacahuete. SMOFlipid® deberá administrarse con precaución si el metabolismo lipídico está alterado, como en casos de insuficiencia renal, diabetes mellitus, pancreatitis, alteración de la función hepática, hipotiroidismo y sepsis. Existe una experiencia limitada en el tratamiento de pacientes con diabetes mellitus o con insuficiencia renal. La administración de ácidos grasos de cadena media de forma aislada, puede provocar acidosis metabólica. Este riesgo se reduce en una gran parte mediante la perfusión simultánea de los ácidos grasos de cadena larga incluidos en SMOFlipid®. La administración concomitante de carbohidratos eliminará este riesgo. Por lo tanto, se recomienda la perfusión simultánea de carbohidratos o una solución de aminoácidos que contenga carbohidratos. Deben realizarse análisis de laboratorio de forma regular, generalmente asociados con la monitorización de la nutrición intravenosa. Esto incluye niveles de glucosa en sangre, pruebas de función hepática, equilibrio ácido base, balance de fluidos, recuento sanguíneo y electrolitos. Ante cualquier signo o síntoma de reacción anafiláctica (como fiebre, escalofríos, erupción cutánea o disnea) debe interrumpirse inmediatamente la perfusión. SMOFlipid® debe administrarse con precaución en neonatos y prematuros con hiperbilirrubinemia, y en casos de hipertensión pulmonar. En neonatos, particularmente en prematuros con nutrición parenteral de larga duración, deberá monitorizarse el recuento sanguíneo de plaquetas, los ensayos de la función hepática, y los triglicéridos en suero. Los altos niveles de lípidos en plasma pueden interferir con algunos análisis sanguíneos de laboratorio, ej. Hemoglobina. Debe evitarse la adición de otros medicamentos o sustancias a SMOFlipid® si no se conoce la compatibilidad (ver secciones 6.2 y 6.6). 4.5 Interacción con otros medicamentos y otras formas de interacción. La heparina, administrada a dosis clínicas, produce un aumento transitorio de la liberación de lipoproteinlipasa a la circulación. Esto provoca inicialmente un aumento de la lipólisis plasmática, seguido de una disminución transitoria en el aclaramiento de triglicéridos. El aceite de soja tiene un contenido natural en vitamina K1. Sin embargo, el contenido en SMOFlipid® es tan bajo que no se espera una influencia significativa en el proceso de coagulación en pacientes tratados con derivados de la cumarina. 4.6 Fertilidad, embarazo y lactancia. No existen datos disponibles sobre la administración de SMOFlipid® en mujeres embarazadas o en periodo de lactancia. No se dispone de estudios en animales sobre toxicidad durante la reproducción. La nutrición parenteral puede ser necesaria durante el embarazo y la lactancia. SMOFlipid® sólo deberá administrarse a mujeres embarazadas o en periodo de lactancia después de una cuidadosa consideración. 4.7 Efectos sobre la capacidad para conducir y utilizar máquinas. No procede. 4.8 Reacciones adversas. Reacciones adversas observadas durante la administración de emulsiones grasas: Trastornos respiratorios, torácicos y mediastínicos. Raras (≥1/10.000 a <1/1.000): Disnea. Trastornos gastrointestinales. Poco frecuentes (≥1/1.000 a <1/100): Pérdida de apetito, vómitos, nauseas. Trastornos vasculares. Raras (≥1/10.000 a <1/1.000): Hipotensión, hipertensión. Trastornos generales y alteraciones en el lugar de administración. Frecuentes (≥1/100 a <1/10): Ligero aumento de la temperatura corporal. Poco frecuentes (≥1/1.000 a <1/100): Escalofríos. Raras (≥1/10.000 a <1/1.000): Reacciones de hipersensibilidad (ej. Reacciones anafilácticas o anafilactoides, erupciones cutáneas, urticaria, rubor, cefalea), sensación de calor o frío, palidez, cianosis, dolor en el cuello, espalda, huesos, pecho y lumbares. Trastornos del aparato reproductor y de la mama. Muy raras (<1/10.000): Priapismo. Si se producen estos efectos secundarios o si el nivel de triglicéridos durante la perfusión se eleva por encima de 3 mmol/l, deberá detenerse la perfusión de SMOFlipid® o, si es necesario, continuarla a una dosis reducida. SMOFlipid® siempre debe formar parte de un tratamiento de nutrición parenteral completa incluyendo aminoácidos y glucosa. Las náuseas, vómitos e hiperglicemia son síntomas relacionados con las situaciones clínicas donde está indicada la nutrición parenteral y pueden estar asociados con la nutrición parenteral. Se recomienda la monitorización de los triglicéridos y de la glucosa en sangre para evitar niveles elevados, lo que podría ser perjudicial. Síndrome de sobrecarga grasa: Una alteración en la 18 Evaluación económica en nutrición capacidad de eliminación de triglicéridos puede dar lugar a un “Síndrome de sobrecarga lipídica” como consecuencia de una sobredosis. Los posibles signos de una sobrecarga lipídica deben ser controlados. La causa puede ser genética (diferente metabolismo individual) o el metabolismo lipídico puede estar afectado por una enfermedad previa o en curso. Este síndrome también puede aparecer durante una hipertrigliceridemia severa, incluso a la velocidad de perfusión recomendada, y asociada con un cambio repentino de la situación clínica del paciente, como deterioro de la función renal o infección. El síndrome de sobrecarga lipídica se caracteriza por hiperlipemia, fiebre, infiltración grasa, hepatomegalia con o sin ictericia, esplenomegalia, anemia, leucopenia, trombocitopenia, desórdenes de la coagulación sanguínea, hemólisis y reticulocitosis, ensayos de la función hepática anormales y coma. Todos los síntomas son generalmente reversibles si se detiene la perfusión de la emulsión lipídica. Si aparecen signos de sobrecarga lipídica, deberá interrumpirse la perfusión. 4.9 Sobredosis. La sobredosis que provoca un síndrome de sobrecarga lipídica puede producirse como resultado de una velocidad de perfusión demasiado rápida, o crónicamente a las velocidades de perfusión recomendadas en relación con un cambio de las condiciones clínicas de los pacientes, como un deterioro de la función renal o una infección. Una sobredosificación puede producir efectos adversos (ver sección 4.8). En estos casos la perfusión de lípidos debe interrumpirse o, si es necesario, continuar a una dosis reducida. 5. PROPIEDADES FARMACOLÓCICAS. 5.1 Propiedades farmacodinámicas. Grupo farmacoterapéutico: Soluciones para Nutrición Parenteral, emulsiones grasas. Código ATC: B05BA02. La emulsión grasa tiene un tamaño de partícula y unas propiedades biológicas similares a las de los quilomicrones endógenos. Los constituyentes de SMOFlipid®: aceite de soja, triglicéridos de cadena media, aceite de oliva y aceite de pescado, tienen sus propias propiedades farmacodinámicas, con excepción de su contenido energético. El aceite de soja tiene un elevado contenido en ácidos grasos esenciales. El ácido graso omega-6, ácido linoleico, es el más abundante (aprox. 55 – 60%). El ácido alfa-linolénico, un ácido graso omega-3, constituye ap roximadamente el 8%. Esta parte de SMOFlipid® proporciona la cantidad necesaria de ácidos grasos esenciales. Los ácidos grasos de cadena media se oxidan rápidamente y proporcionan al organismo una forma de energía, inmediatamente disponible. El aceite de oliva proporciona básicamente energía en forma de ácidos grasos mono-insaturados, que son mucho menos propensos a la peroxidación que cantidades equivalentes de ácidos grasos poli-insaturados. El aceite de pescado se caracteriza por un elevado contenido en ácido eicosapentaenoico (EPA) y ácido docosahexaenoico (DHA). El DHA es un importante componente estructural de las membranas celulares, mientras que el EPA es un precursor de eicosanoides como las prostaglandinas, tromboxanos y leucotrienos. La vitamina E protege a los ácidos grasos insaturados frente a la peroxidación lipídica. Se han realizado dos estudios en pacientes con necesidad de nutrición parenteral a largo plazo. El objetivo principal en ambos estudios fue demostrar la seguridad. El objetivo secundario en uno de los estudios que se realizó en población pediátrica fue el de demostrar la eficacia. Dicho estudio fue segregado por grupos de edad (1 mes - < 2 años, y 2-11 años respectivamente. Ambos estudios demostraron que SMOFlipid® tiene el mismo perfil de seguridad que el medicamento comparado (Intralipid 20%). En el estudio pediátrico, la eficacia se midió a partir del incremento de peso, la altura, el índice de masa corporal, la pre-albúmina, la proteína de unión a retinol, y el perfil de ácidos grasos. No se hallaron diferencias entre grupos en ninguno de los parámetros a excepción del perfil de ácidos grasos tras 4 semanas de tratamiento. El perfil de ácidos grasos en pacientes tratados con SMOFlipid® reveló un incrementó en ácidos grasos omega-3 en las lipoproteínas plasmáticas y los fosfolípidos de los eritrocitos de la sangre, siendo un reflejo de la composición de la emulsión lipídica prefundida. 5.2 Propiedades farmacocinéticas. Los triglicéridos individuales tienen diferente velocidad de eliminación, pero SMOFlipid® como mezcla se elimina con mayor rapidez que los triglicéridos de cadena larga (LCT) con niveles de triglicéridos más bajos durante la perfusión. El aceite de oliva tiene la velocidad de eliminación más lenta de todos los componentes (algo menor que los LCT) y los triglicéridos de cadena media (MCT) la más rápida. El aceite de pescado en una mezcla con LCT tiene la misma velocidad de eliminación que los LCT solos. 5.3 Datos preclínicos sobre seguridad. En los estudios preclínicos no se observaron efectos diferentes a los ya esperados después de la administración de dosis elevadas de lípidos, basándose en estudios de toxicidad a dosis única, dosis repetidas y de genotoxicidad llevados a cabo con la emulsión SMOFlipid®. En un estudio de tolerancia local en conejos se observó una ligera inflamación transitoria después de la administración intra-arterial, paravenosa o subcutánea. Después de la administración intramuscular se observó en algunos animales una inflamación transitoria moderada junto con necrosis tisular. En un estudio realizado en cobayas (estudio de Maximización) el aceite de pescado mostró sensibilización dérmica moderada. Un ensayo de antigenicidad sistémica no presentó evidencias de potencial anafiláctico del aceite de pescado. 6. DATOS FARMACÉUTICOS. 6.1 Lista de excipientes. Glicerol, Lecitina de huevo, dl-α-Tocoferol, Agua para preparaciones inyectables, Hidróxido sódico para ajuste de pH, Oleato sódico. 6.2 Incompatibilidades. Este medicamento no debe mezclarse con otros, excepto con los mencionados en la sección 6.6. 6.3 Periodo de validez. 2 años. Período de validez después de la primera apertura del envase. Se ha demostrado la estabilidad física y química durante 24 horas a 25°C. Desde un punto de vista microbiológico, el producto debería utilizarse inmediatamente. Si no es utilizado inmediatamente, el tiempo de conservación hasta su utilización y las condiciones previas a su uso son responsabilidad del usuario y normalmente no deberían ser superiores a 24 horas, conservándose entre 2-8°C. 6.4 Precauciones especiales de conservación. No conservar a temperatura superior a 25ºC. No congelar. Período de validez después de mezclar. Desde un punto de vista microbiológico, si se realizan adiciones a SMOFlipid®, el producto debería utilizarse inmediatamente. Si la mezcla no es utilizada inmediatamente, el tiempo de conservación hasta su utilización y las condiciones previas a su uso son responsabilidad del usuario y normalmente no deberían ser superiores a 24 horas, conservándose entre 2-8 °C, a no ser que las adiciones hayan sido realizadas bajo condiciones asépticas controladas y validadas. 6.5 Naturaleza y contenido del envase y de los equipos especiales para su utilización, administración o implantación. Frascos de vidrio (tipo II, incoloro) con tapón de caucho butilo. Bolsa Excel. La bolsa Excel consta de una bolsa interna (envase primario) con una sobrebolsa. Entre la bolsa interna y la sobrebolsa se coloca un absorbente de oxígeno y un indicador de integridad ( Oxalert TM ). La bolsa interna Excel consta de un copolímero de poli(propileno/etileno), un elastómero termoplástico y un copoliéster. La sobrebolsa consta de polietileno tereftalato y poliolefina, o polietileno tereftalato, poliolefina y copolímero etilen-vinil alcohol (EVOH). El absorbente de oxígeno consta de polvo de hierro en un sobrecito de polímero. El indicador de integridad consta de una solución sensible al oxígeno dentro de un sobrecito de polímero. La sobrebolsa, el absorbente de oxígeno y el indicador de integridad deben desecharse después de la apertura de la sobrebolsa. El indicador de integridad (Oxalert TM ) reacciona con el oxígeno libre y cambia de color de transparente a negro en caso de que la sobrebolsa esté dañada.Tamaños de envase: Frascos de vidrio: 100 ml; 10 x 100 ml; 250 ml; 10 x 250 ml; 500 ml; 10 x 500 ml. Bolsa Excel: 100 ml; 10 x 100 ml; 250 ml; 10 x 250 ml; 500 ml; 12 x 500 ml. Puede que solamente estén comercializados algunos tamaños de envases. 6.6 Precauciones especiales de eliminación y otras manipulaciones. Utilizar sólo si la emulsión es homogénea. Para la bolsa Excel: El indicador de integridad (Oxalert) deberá ser inspeccionado antes de retirar la sobrebolsa. Si el indicador es negro, es que el oxígeno ha penetrado en la sobrebolsa y el producto debe desecharse. Inspeccionar la emulsión visualmente por si aparece separación de fases antes de la administración. Asegurar que la emulsión final para perfusión no muestre ninguna señal de separación de fases. Para un solo uso. Cualquier resto de emulsión sobrante debe desecharse. Aditivos: SMOFlipid® puede mezclarse asépticamente con aminoácidos, glucosa y soluciones de electrolitos para formar mezclas de Nutrición Parenteral Total (NPT) “Todo-En-Uno”. La compatibilidad de los diferentes aditivos y el tiempo de almacenamiento de las diferentes mezclas, están disponibles por parte del titular de la autorización de comercialización a petición de los interesados. Las adiciones deben realizarse asépticamente. Debe rechazarse cualquier mezcla sobrante después de la perfusión. La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local. 7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN. Titular: Fresenius Kabi AB. 751 74 Uppsala. Suecia. Representante Local: Fresenius Kabi España S.A.U. C/Marina 16-18. 08005 Barcelona. España. 8. NÚMERO DE AUTORIZACIÓN DE COMERCIALIZACIÓN. 66.581. 9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN. 6-Febrero- 2004/ 1-Octubre-2008. 10. FECHA DE REVISIÓN (PARCIAL) DEL TEXTO. Noviembre 2010. 11. RÉGIMEN DE PRESCRIPCIÓN Y DISPENSACIÓN. Con receta médica. Uso hospitalario. Medicamento ético. 12. CONDICIONES DE LA PRESTACIÓN FARMACÉUTICA DEL SNS. No financiado. 19 N U T R I C I Ó N PA R E N T E R A L La llevamos en la sangre 2203 ED.: Enero 2015 ¿y todavía lo dudas? Puede acceder a todos los Nutri info en: http://www.fresenius-kabi.es/aula/nutrinfo.asp Fresenius Kabi España, S.A.U. Torre Mapfre - Vila Olímpica C/ Marina, 16-18 08005 Barcelona Tel. 93 225 65 65 Fax 93 225 65 75 www.fresenius-kabi.es