Esmya, INN-ulipristal acetate - European Medicines Agency
Anuncio

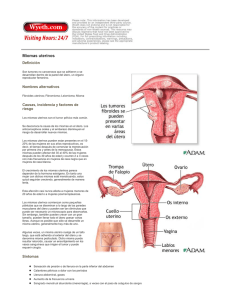
EMA/334810/2015 EMEA/H/C/002041 Resumen del EPAR para el público general Esmya ulipristal acetato El presente documento resume el Informe Público Europeo de Evaluación (EPAR) de Esmya. En él se explica cómo el Comité de Medicamentos de Uso Humano (CHMP) ha evaluado dicho medicamento y emitido un dictamen favorable para su autorización de comercialización así como unas recomendaciones sobre las condiciones de su uso. ¿Qué es Esmya? Esmya es un medicamento que contiene el principio activo ulipristal acetato. Se presenta en comprimidos (5 mg). ¿Para qué se utiliza Esmya? Esmya se utiliza en el tratamiento de síntomas de moderados a graves de miomas uterinos, que son tumores no cancerosos (benignos) de la matriz (útero) en mujeres adultas que todavía no se encuentran en la menopausia. Se administra a mujeres antes de someterse a intervenciones quirúrgicas de los miomas y también puede administrarse de forma intermitente a largo plazo en otras mujeres. Este medicamento solo se podrá dispensar con receta médica. ¿Cómo se usa Esmya? Esmya se toma por vía oral y la dosis recomendada es un comprimido al día durante tres meses como máximo. El ciclo de tratamiento de tres meses puede repetirse. Se recomienda iniciar el tratamiento siempre durante la primera semana del ciclo menstrual (hemorragia menstrual). Para mayor información, consulte el prospecto. 30 Churchill Place ● Canary Wharf ● London E14 5EU ● United Kingdom Telephone +44 (0)20 3660 6000 Facsimile +44 (0)20 3660 5555 Send a question via our website www.ema.europa.eu/contact An agency of the European Union © European Medicines Agency, 2015. Reproduction is authorised provided the source is acknowledged. ¿Cómo actúa Esmya? El principio activo de Esmya, el ulipristal acetato, es un «modulador selectivo del receptor de la progesterona». Actúa bloqueando el receptor de una hormona del organismo llamada progesterona, que participa en el control del crecimiento del revestimiento de la matriz. En algunas mujeres, la progesterona puede favorecer el crecimiento de miomas, que pueden provocar síntomas como hemorragia uterina intensa (sangrado de la matriz durante el período menstrual o fuera de él), anemia (recuentos bajos de glóbulos rojos, debidos a la hemorragia) y dolor abdominal (como dolor menstrual o dolor en el vientre). Cuando se bloquea la actividad de la progesterona, las células de los miomas dejan de dividirse y finalmente mueren, lo cual reduce el tamaño de los miomas y reduce los síntomas que provocan. ¿Qué tipo de estudios se han realizado con Esmya? Esmya se ha estudiado en dos estudios principales con 549 mujeres que padecían miomas uterinos sintomáticos e iban a someterse a una intervención quirúrgica para extirpar los miomas. En ambos estudios el tratamiento duró tres meses (un tratamiento). • En el primer estudio se investigaron los efectos de Esmya en comparación con placebo (un tratamiento ficticio) en mujeres adultas con hemorragia uterina intensa y anemia. Se administraron también suplementos de hierro a todas las pacientes para tratar la anemia. Los principales criterios de valoración de la eficacia fueron las reducciones de la hemorragia intensa y de la anemia asociada, así como del tamaño de los miomas. • En el segundo estudio principal se investigaron los efectos de Esmya en comparación con otro medicamento utilizado para tratar los miomas, la leuprorelina. El principal criterio de valoración de la eficacia fue la capacidad del tratamiento para reducir la hemorragia uterina intensa. El tratamiento a largo plazo con Esmya se ha estudiado en un estudio principal en el que participaron 451 mujeres con miomas uterinos sintomáticos, que recibieron 4 ciclos de Esmya de 3 meses de duración cada uno. El principal criterio de valoración de la eficacia fue el porcentaje de mujeres que habían tenido más de un día de oligometrorragia (hemorragia uterina mínima) en un periodo de 35 días. ¿Qué beneficios ha demostrado tener Esmya durante los estudios? Esmya mejoró los síntomas de mujeres que padecían miomas uterinos sintomáticos e iban a someterse a una intervención quirúrgica para extirparlos. • En el primer estudio, un 91,5 % de las mujeres que tomaron Esmya durante 3 meses mostraron una reducción de la hemorragia menstrual en comparación con un 18,8 % de las mujeres que tomaron placebo. El tamaño de los miomas fue también menor en las mujeres tratadas con Esmya que en las que recibieron el placebo. • En el segundo estudio, el tratamiento de 3 meses con Esmya fue tan efectivo como la leuprorelina para reducir la hemorragia uterina intensa, pues un 90,3 % de las mujeres tratadas con Esmya mostraron una reducción de la hemorragia en comparación con un 89,1 % de las mujeres tratadas con leuprorelina. En el estudio a largo plazo con Esmya, el 49 % de las mujeres que recibieron 5 mg de Esmya (95 de las 195 mujeres evaluadas) no sufrieron más de un día de oligometrorragia en un periodo de 35 días después de cada uno de los 4 ciclos de tratamiento, y el 70 % no tuvieron más de un día de Esmya EMA/334810/2015 Página 2/3 oligometrorragia en un periodo de 35 días al finalizar el cuarto ciclo de tratamiento. También se observó una reducción en el tamaño de los miomas. ¿Cuál es el riesgo asociado a Esmya? Los efectos adversos más frecuentes de Esmya (observados en más un paciente de cada 10) son amenorrea (ausencia de período menstrual) y engrosamiento endometrial (engrosamiento del revestimiento de la matriz). Para consultar la lista completa de efectos adversos notificados sobre Esmya, ver el prospecto. No se debe administrar a mujeres embarazadas o que estén dando el pecho, que sufran hemorragias de la región genital de causa desconocida o por motivos diferentes de los miomas uterinos, o que padezcan cáncer de la matriz, del cuello uterino, de ovarios o de mama. La lista completa de restricciones puede consultarse en el prospecto. ¿Por qué se ha aprobado Esmya? El CHMP concluyó que los beneficios de Esmya son mayores que sus riesgos y recomendó autorizar su comercialización. El CHMP decidió que Esmya había demostrado su eficacia para reducir la hemorragia y la anemia así como el tamaño de los miomas en mujeres que iban a someterse a una intervención quirúrgica para extirpar los miomas. Esmya también demostró ser eficaz para reducir la hemorragia y el tamaño de los miomas cuando se utilizó intermitentemente por periodos más prolongados (hasta 4 ciclos de tratamiento). No hubo problemas de seguridad importantes. Aunque se observó engrosamiento endometrial en algunas pacientes, este desaparece normalmente tras el tratamiento. ¿Qué medidas se han adoptado para garantizar un uso seguro de Esmya? Se ha elaborado un plan de gestión de riesgos para garantizar que Esmya se administra de una forma lo más segura posible. Basándose en este plan, la información sobre seguridad se ha incluido en el Resumen de las Características del Producto y el prospecto de Esmya, incluidas las precauciones pertinentes que deberán seguir los profesionales sanitarios y los pacientes. La empresa que comercializa Esmya se cerciorará de que los médicos que vayan a recetar este medicamento reciban material informativo que contenga datos importantes acerca de la seguridad de Esmya, entre otros recomendaciones para el control y el tratamiento de los cambios endometriales que se producen con el uso de Esmya. Otras informaciones sobre Esmya La Comisión Europea emitió una autorización de comercialización válida en toda la Unión Europea para el medicamento Esmya el 23 de febrero de 2012. El EPAR completo de Esmya se puede consultar en el sitio web de la Agencia: ema.europa.eu/Find medicine/Human medicines/European Public Assessment Reports. Para mayor información sobre el tratamiento con Esmya, lea el prospecto (también incluido en el EPAR) o consulte a su médico o farmacéutico. Fecha de la última actualización del presente resumen: 06-2015 Esmya EMA/334810/2015 Página 3/3