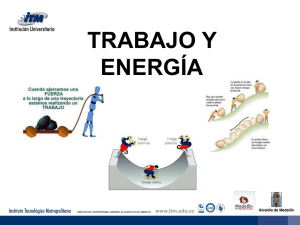
41Mecánica cuántica
Anuncio

1186 Capítulo 41 Mecánica cuántica 41.1 Interpretación de la mecánica cuántica 41.2 La partícula cuántica bajo condiciones frontera 41.3 La ecuación de Schrödinger 41.4 Una partícula en un pozo de altura finita 41.5 Efecto túnel a través de una barrera de energía potencial 41.6 Aplicaciones del efecto túnel 41.7 El oscilador armónico simple Dos de los avances tecnológicos actuales en física pueden verse en un corral cuántico. El primero comprende el control sobre átomos individuales. Este corral se forma colocando átomos de hierro en un anillo en forma de estadio sobre una superficie de cobre. El segundo es la capacidad para formar imágenes de átomos individuales con un microscopio de barrido de efecto túnel. El corral se puede usar para estudiar los estados cuantizados de electrones atrapados en una pequeña región. (Cortesía de IBM Research, Almaden Research Center. Prohibido su uso no autorizado.) 41 Mecánica cuántica En este capítulo se introduce la mecánica cuántica, teoría sumamente acertada para explicar el comportamiento de partículas microscópicas. Esta teoría, creada en la década de los veinte del siglo pasado, por Erwin Schrödinger, Werner Heisenberg y otros, hace posible entender una multitud de fenómenos en donde intervienen átomos, moléculas, núcleos y cuerpos sólidos. La exposición en este capítulo surge del modelo de partícula cuántica que fue desarrollado en el capítulo 40, e incorpora algunas de las características de ondas bajo condiciones frontera que se exploraron en el capítulo 18. También se exponen aplicaciones prácticas de mecánica cuántica, incluyendo el microscopio de barrido de efecto túnel y dispositivos a nanoescala que podrían usarse en las computadoras cuánticas del futuro. Por último, se regresa al oscilador armónico simple presentado en el capítulo 15 para examinarlo desde el punto de vista de la mecánica cuántica. 41.1 Interpretación de la mecánica cuántica En el capítulo 40 se presentaron algunas ideas nuevas y extrañas. En particular, se concluyó, con base en evidencia experimental, que la materia y la radiación electromagnética a veces se modelan mejor como partículas y a veces como ondas, dependiendo del fenómeno que se observe. Es posible mejorar la comprensión de la física cuántica si se hace 1186 Cap_41_Serway(2).indd 1186 9/11/08 6:35:13 PM Sección 41.1 Interpretación de la mecánica cuántica 1187 otro enlace conceptual entre partículas y ondas, con el uso de la noción de probabilidad, término que se introdujo en el capítulo anterior. Primero hay que explicar la radiación electromagnética con el modelo de las partículas. La probabilidad por unidad de volumen de hallar un fotón en una región determinada del espacio en un instante, es proporcional al número N de fotones por unidad de volumen en ese tiempo: Probabilidad V N V El número de fotones por unidad de volumen es proporcional a la intensidad de la radiación: N V I Ahora, se enlaza el modelo de partícula y el modelo de onda recordando que la intensidad de radiación electromagnética es proporcional al cuadrado de la amplitud del campo eléctrico E para la onda electromagnética (ecuación 34.24): I E2 Igualando el principio y el fin de esta sucesión de proporcionalidades, tiene Probabilidad V E2 (41.1) Por lo tanto, para la radiación electromagnética la probabilidad por unidad de volumen de hallar una partícula asociada con esta radiación (el fotón) es proporcional al cuadrado de la amplitud de la onda electromagnética asociada. Al reconocer la dualidad onda-partícula de la radiación electromagnética y la materia, se debería sospechar una proporcionalidad paralela para una partícula material: la probabilidad por unidad de volumen de hallar la partícula es proporcional al cuadrado de la amplitud de una onda que represente la partícula. En el capítulo anterior aprendió que hay una onda de De Broglie asociada con cualquier partícula. La amplitud de la onda de De Broglie asociada con una partícula no es una cantidad que se pueda medir, porque la función de onda que representa una partícula es, por lo general, una función compleja, como se verá a continuación. En contraste, el campo eléctrico para una onda electromagnética es una función real. La cuestión análoga a la ecuación 41.1 relaciona el cuadrado de la amplitud de la onda con la probabilidad por unidad de volumen de hallar la partícula. En consecuencia, a la amplitud de la onda asociada con la partícula se le llama simplemente amplitud de probabilidad, o función de onda, y se simboliza con . En general, la función de onda completa para un sistema depende de las posiciones de todas las partículas del sistema y del tiempo, por lo cual se escribe ( r̂ 1, r̂ 2, r̂ 3, . . . , r̂ j , . . . , t), donde r̂ j es el vector de posición de la j-ésima partícula del sistema. Para muchos sistemas de interés, incluso los que se estudian en este texto, la función de onda es matemáticamente separable en espacio y tiempo y se puede escribir como un producto de una función de espacio c para una partícula del sistema y una función del tiempo compleja:1 ( r̂ 1, r̂ 2, r̂ 3, . . . , r̂ j , . . . , t) c( r̂ j)eivt (41.2) 1 1. donde v( 2pf ) es la frecuencia angular de la función de onda e i Para cualquier sistema en el que la energía potencial sea independiente del tiempo y dependa sólo de las posiciones de las partículas dentro del sistema, la información importante acerca del sistema está contenida dentro de la parte espacial de la función de onda. Función de onda dependiente del espacio y el tiempo La forma estándar de un número complejo es a ib. La notación e iu es equivalente a la forma estándar como sigue: 1 e iu cosu i senu Por lo tanto, la notación e i sen vt. Cap_41_Serway(2).indd 1187 ivt de la ecuación 41.2 es equivalente a cos (vt) i sen (vt) cos vt 9/11/08 6:35:19 PM 1188 Capítulo 41 Mecánica cuántica 2 , — n rme n Densidad de probabilidad |c|2 PREVENCIÓN DE RIESGOS OCULTOS 41.1 P(x, y, z)dV |c |2dV La función de onda pertenece a un sistema Lo común en mecánica cuántica es asociar una función de onda con una partícula. La función de onda, sin embargo, está determinada por la partícula y su interacción con su entorno, de modo que pertenece más propiamente a un sistema. En muchos casos la partícula es la única parte del sistema que experimenta un cambio, por lo que se ha desarrollado dicha asociación. En el futuro el estudiante verá ejemplos en los que es más correcto considerar la función de onda del sistema que la función de onda de la partícula. Función de onda para una partícula libre La parte del tiempo es simplemente el factor eivt. Debido a eso, es fundamental entender c en cualquier problema. La función de onda c con frecuencia es una estimado complejo. El cuadrado absoluto |c |2 c *c, donde c * es el complejo conjugado2 de c, es siempre real y positivo, y es proporcional a la probabilidad por unidad de volumen de hallar una partícula en un punto determinado en algún instante. La función de onda contiene en su interior toda la información que se pueda conocer acerca de la partícula. Aunque c no se puede observar, se puede medir la cantidad real |c |2, que se interpreta como sigue. Si c representa una sola partícula, entonces |c |2; conocida como densidad de probabilidad, es la probabilidad relativa por cada unidad de volumen que la partícula encontrará en cualquier punto determinado en el volumen. Esta interpretación también se puede establecer de la manera siguiente: si dV es un elemento de volumen pequeño rodeando algún punto, la probabilidad de hallar la partícula en el elemento de volumen es (41.3) Esta interpretación probabilística de la función de onda fue sugerida primero por Max Born (1882-1970) en 1928. En 1926, Erwin Schrödinger (1887-1961) propuso una ecuación de onda que describe la manera en que la función de onda cambia en el espacio y el tiempo. La ecuación de onda de Schrödinger, que se examina en la sección 41.3, representa un elemento clave en la teoría de la mecánica cuántica. Los conceptos de mecánica cuántica, que a veces parecen extraños, se crearon a partir de ideas clásicas. De hecho, cuando sus técnicas de mecánica cuántica se aplican a sistemas macroscópicos, los resultados son en esencia idénticos a los de la física clásica. Esta mezcla de los dos planteamientos se presenta cuando la longitud de onda de De Broglie es pequeña en comparación con las dimensiones del sistema. La situación es similar al acuerdo existente entre la mecánica relativista y la mecánica clásica cuando v c. La sección 40.5 mostró que la ecuación de De Broglie relaciona la cantidad de movimiento de una partícula con su longitud de onda mediante p h/l. Si una partícula libre ideal tiene una cantidad de movimiento conocida en forma precisa px, su función de onda es una onda sinusoidal infinitamente larga de longitud de onda l h/px, y la partícula tiene igual probabilidad de estar en cualquier punto a lo largo del eje x (figura 40.18a). La función de onda c para esta partícula libre que se mueve a lo largo del eje x se puede escribir como c 1x 2 Ae ikx (41.4) donde k 2p/l es el número de onda angular (ecuación 16.8) de la onda que representa la partícula y A es una amplitud constante.3 Funciones de onda unidimensionales y valores permitidos Esta sección expone únicamente sistemas unidimensionales, donde la partícula debe estar ubicada a lo largo del eje x, de modo que la probabilidad |c |2 dV en la ecuación 41.3 se modifica para convertirse en |c |2 dx. La probabilidad de que la partícula se encuentre en el intervalo infinitesimal dx alrededor del punto x es P 1x2 dx 0 c 0 2 dx (41.5) Aun cuando no es posible especificar la posición de una partícula con certeza completa, es posible por medio de |c |2 especificar la probabilidad de observarla en una región que rodea Para un número complejo z a ib, el complejo conjugado se encuentra al cambiar i a i: z* a ib. El producto de un número complejo y su complejo conjugado es siempre real y positivo: es decir z*z (a ib)(a ib) a 2 (ib)2 a2 (i )2b 2 a2 b 2. 2 3 Para la partícula libre, la función de onda completa, con base en la ecuación 41.2 , es (x, t) Ae ikxeivt Ae i(kx vt) A[cos(kx vt) i sen(kx vt)] La parte real de esta función de onda tiene la misma forma que las ondas unidas para formar paquetes de onda en la sección 40.6. Cap_41_Serway(2).indd 1188 9/11/08 6:35:20 PM Sección 41.1 Interpretación de la mecánica cuántica un punto x determinado. La probabilidad de hallar la partícula en el intervalo arbitrario a x b es b Pab 0 c 0 2 dx 1189 c ⎪2 ⎪ψ (41.6) a La probabilidad Pab es el área bajo la curva de |c |2 en función de x entre los puntos x a y x b, como en la figura 41.1. Experimentalmente, existe la probabilidad finita de hallar una partícula en un intervalo cerca de algún punto en algún instante. El valor de esa probabilidad debe encontrarse entre los límites 0 y 1. Por ejemplo, si la probabilidad es 0.30, hay 30% de probabilidad de hallar la partícula en el intervalo. Porque la partícula debe estar en algún lugar a lo largo del eje x, la suma de las probabilidades en todos los valores de x debe ser 1: 0 c 0 2 dx 1 (41.7) x a b Figura 41.1 La probabilidad de que una partícula se encuentre en el intervalo a x b es el área bajo la curva de densidad de probabilidad de a a b. Condición de normalización sobre c Valor esperado para la posición x Valor esperado para una función f(x) Cualquier función de onda que satisfaga la ecuación 41.7 se dice que está normalizada. La normalización quiere decir, simplemente, que la partícula existe en algún punto en el espacio. Una vez conocida la función de onda para una partícula, es posible calcular la posición promedio a la que se espera hallarla después de muchas mediciones. Esta posición promedio se denomina valor esperado de x y está definido por la ecuación 8x9 c*x c dx (41.8) (Se usan paréntesis . . . para indicar valores permitidos.) Además, es posible hallar el valor esperado de cualquier función f(x) asociado con una partícula si se usa la siguiente ecuación:4 8 f 1x2 9 c*f 1x2c dx (41.9) Pregunta rápida 41.1 Considere la función de onda para la partícula libre, ecuación 41.4. ¿En qué valor de x es más probable que la partícula se encuentre en un tiempo determinado? a) En x 0, b) a pequeños valores de x, c) a grandes valores de x, o d) en cualquier punto a lo largo del eje x. c(x ) EJEMPLO 41.1 Una función de onda para una partícula c(x )5 Ae 2ax Considere una partícula cuya función de onda se grafica en la figura 41.2 y se proporciona por c 1x2 Ae 2 ax 2 A) ¿Cuál es el valor de A si se normaliza esta función de onda? x 0 SOLUCIÓN Conceptualizar La partícula no es una partícula libre porque la función de onda no es una función sinusoidal. La figura 41.2 indica que la partícula está restringida a permanecer Figura 41.2 (Ejemplo 41.1) Una función de onda simétrica para una partícula, conocida por 2 c(x) Ae ax . 4 Los valores esperados son análogos a los “promedios ponderados”, en los que cada valor posible de una función se multiplica por la probabilidad de la ocurrencia de dicho valor antes de sumar sobre todos los c*f 1x 2c dx en lugar de f 1x2 0 c 0 2 dx , porque f(x) posibles valores. El valor esperado se escribe como se puede representar mediante un operador (como una derivada) en lugar de una simple función multiplicativa en tratamientos más avanzados de mecánica cuántica. En estas situaciones, el operador se aplica sólo a c y no a c *. Cap_41_Serway(2).indd 1189 9/11/08 6:35:21 PM 1190 Capítulo 41 Mecánica cuántica cerca de x 0 en todo momento. Piense en un sistema físico en el que la partícula siempre permanece cerca de un punto determinado. Los ejemplos de tales sistemas son un bloque en un resorte, una canica en el fondo de un tazón y la plomada de un péndulo simple. Categorizar Porque el enunciado del problema describe la naturaleza ondulatoria de una partícula, este ejemplo requiere un planteamiento cuántico en lugar de uno clásico. 0 c 0 2 dx 1Ae 2 dx ax 2 2 A2 2ax 2 e dx 1 2ax 2 dx b Analizar Aplique la condición de normalización, ecuación 41.7, para la función de onda: 12 A2 e 2ax 2 0 A2 a dx 2ax 2 e Exprese la integral como la suma de dos integrales: dx e 1 0 0 0 e 2ax 2 dx 2a 1 x2 2 e Cambie la variable de integración de x a x en la segunda integral: 0 1 dx 2 2ax 2 e dx 0 2ax 2 e dx 2ax 2 e Invierta el orden de los límites, lo que introduce un signo negativo: dx 0 A2 a e Sustituya esta expresión para la segunda integral en la ecuación 1): 2ax 2 dx 0 dx b 2ax 2 e 1 0 2A2 22 e 2ax 2 1 dx 0 e Evalúe la integral con la ayuda de la tabla B.6 en el apéndice B: 2ax 2 1 2 dx 0 2A2 a 12 Sustituya este resultado en la ecuación 2) y resuelva para A: p b B 2a S 1 p B 2a a A 2a 1>4 b p B) ¿Cuál es el valor esperado de x para esta partícula? 8x 9 SOLUCIÓN 1Ae c*x c dx ax 2 2 x 1Ae ax 2 2 dx Evalúe el valor esperado con la ecuación 41.8: 32 2ax 2 A2 xe 8x 9 A2 a Como en el inciso A), exprese la integral como una suma de dos integrales: dx 0 xe 2ax 2 dx xe 2ax 2 dx b 0 0 0 xe 2ax 2 dx xe 2a 1 x2 2 Cambie la variable de integración de x a x en la segunda integral: 0 1 dx 2 xe 2ax 2 dx 0 xe Invierta el orden de los límites, lo que introduce un signo negativo: Cap_41_Serway(2).indd 1190 2ax 2 dx xe 2ax 2 dx 0 9/11/08 6:35:23 PM Sección 41.2 Sustituya esta expresión para la segunda integral en la ecuación 3): 1191 La partícula cuántica bajo condiciones de frontera 8 x9 A2 a xe 2ax 2 dx xe 0 2ax 2 dx b 0 0 Finalizar Conocida la simetría de la función de onda en torno a x 0 en la figura 41.2, no es de sorprender que la posición promedio de la partícula está en x 0. En la sección 41.7, se mostró que la función de onda estudiada en este ejemplo representa el estado de menor energía del oscilador armónico cuántico. 41.2 La partícula cuántica bajo condiciones frontera La partícula libre expuesta en la sección 41.1 no tiene condiciones frontera; puede estar en cualquier parte del espacio. La partícula en el ejemplo 41.1 no es una partícula libre. La figura 41.2 muestra que la partícula siempre está restringida a posiciones cerca de x 0. En esta sección se investigarán los efectos de la restricciones sobre el movimiento de una partícula cuántica. Una partícula en una caja En esta sección se aplican algunas de las ideas desarrolladas para un problema físico sencillo: una partícula confinada a una región unidimensional del espacio, un problema de una partícula en una caja (aun cuando la “caja” ¡sea en una sola dimensión!). Desde el punto de vista clásico, si una partícula rebota elásticamente hacia atrás y hacia adelante lo largo del eje x entre dos paredes impenetrables separadas por una distancia L, como se muestra en la figura 41.3a, se modela como una partícula bajo repidez constante. Si la rapidez de la partícula es u, la magnitud de su cantidad de movimiento mu permanece constante, al igual que su energía cinética. (Recuerde que en el capítulo 39 se usó u para la rapidez de la partícula y distinguirla de v, la rapidez de un marco de referencia.) La física clásica no impone restricciones a los valores de la cantidad de movimiento y energía de una partícula. El planteamiento mecánico cuántico para este problema es muy diferente y requiere que se encuentre la función de onda apropiada que sea consistente con las condiciones de esta situación. Ya que las paredes son impenetrables, no existe probabilidad alguna de hallar la partícula fuera de la caja, de modo que la función de onda c(x) debe ser cero para x 0 y para x L. Para ser una función que trabaje bien matemáticamente, c(x) debe ser continua en el espacio. No deben existir saltos discontinuos en el valor de la función de onda en cualquier punto.5 Por lo tanto, si c es cero fuera de las paredes, también debe ser cero en las paredes, esto es, c(0) 0 y c(L) 0. Sólo se permiten las funciones de onda que satisfagan estas condiciones de frontera. La figura 41.3b, la representación gráfica del problema de la partícula en una caja, muestra la energía potencial del sistema partícula-entorno como función de la posición de la partícula. Mientras la partícula está dentro de la caja, la energía potencial del sistema no depende de la ubicación de la partícula y es posible escoger su valor igual a cero. Fuera de la caja, debe asegurarse de que la función de onda sea cero. Puede hacer esto al definir la energía potencial del sistema como infinitamente grande si la partícula estuviera fuera de la caja. Por lo tanto, la única forma de que una partícula pueda estar fuera de la caja es si el sistema tiene una cantidad infinita de energía, lo que es imposible. La función de onda para una partícula en la caja se expresa como una función senosoidal real:6 5 Si la función de onda no fuera continua en un punto, la derivada de la función de onda en ese punto sería infinita. El resultado lleva a dificultades en la ecuación de Schrödinger, por lo cual la función de onda es una solución, como se explicó en la sección 41.3. 6 Esto se demuestra explícitamente en la sección 41.3. Cap_41_Serway(2).indd 1191 L u m x a) ` ` U x 0 L b) Figura 41.3 a) Partícula de masa m y rapidez u, confinada a rebotar entre dos paredes impenetrables separadas por una distancia L. b) Función de energía potencial para el sistema. 9/11/08 6:35:23 PM 1192 Capítulo 41 Mecánica cuántica ` ` c3 ` n53 |c 3| n52 |c 2| ` 2 n53 2 c2 c1 n52 |c 1| 2 n51 x L 0 L 0 n51 x b) a) Figura 41.4 Primeros tres estados permitidos para una partícula confinada a una caja de una dimensión. Los estados se muestran sobrepuestos en la función de energía potencial de la figura 41.3b. a) Funciones de onda c para n 1, 2 y 3. b) Densidades de probabilidad |c |2 para n 1, 2 y 3. Las funciones de onda y las densidades de probabilidad se grafican verticalmente desde ejes separados que están corridos verticalmente para mayor claridad. Las posiciones de estos ejes sobre la función de energía potencial sugieren las energías relativas de los estados. A sen a c 1x 2 2px b l (41.10) donde l es la longitud de onda de De Broglie asociada con la partícula. Esta función de onda debe satisfacer las condiciones frontera en las paredes. La condición frontera en c(0) 0 ya está satisfecha porque la función seno es cero cuando x 0. Para la condición frontera en c(L) 0, se tiene c 1L2 0 A sen a 2pL b l que sólo puede ser verdadera si 2pL l np S l 2L n (41.11) donde n 1, 2, 3, . . . En consecuencia, sólo se permiten ciertas longitudes de onda para la partícula. Cada una de las longitudes de onda permitidas corresponde a un estado cuántico para el sistema, y n es el número cuántico. Incorporando la ecuación 41.11 en la ecuación 41.10 proporciona Funciones de onda para una partícula en una caja c 1x2 A sen a 2px b 2L>n A sen a npx b L (41.12) Al normalizar esta función de onda se demuestra que A 12>L . (Vea el problema 15.) Por lo tanto, la función de onda normalizada para la partícula en una caja es Función de onda normalizada para una partícula en una caja cn 1x2 2 npx sen a b BL L (41.13) Las figuras 41.4a y b son representaciones gráficas de c en función de x y |c |2 en función de x para n 1, 2 y 3 para la partícula en una caja.7 Observe que aun cuando c puede ser positiva o negativa, |c |2 siempre es positiva. Como |c |2 representa una densidad de probabilidad, un valor negativo para |c |2 no tendría sentido. Una inspección más a fondo de la figura 41.4b muestra que |c |2 es cero en las fronteras, lo cual satisface las condiciones frontera. Además, |c |2 es cero en otros puntos, dependiendo del valor de n. Para n 2, |c |2 0 en x L/2; para n 3, |c |2 0 en x L/3 y en x 2L/3. El número de puntos cero aumenta en uno cada vez que el número cuántico aumente en uno. Observe que n 0 no se permite porque, según la ecuación 41.12, la función de onda sería c 0. Ésta no es una función de onda físicamente razonable; por ejemplo, no puede ser normalizada porque 0 c 0 2 dx 102 dx 0, pero la ecuación 41.7 dice que esta integral debe ser igual a 1. 7 Cap_41_Serway(2).indd 1192 9/11/08 6:35:24 PM Sección 41.2 PREVENCIÓN DE RIESGOS OCULTOS 41.2 Porque las longitudes de onda de la partícula están restringidas por la condición l 2L/n, la magnitud de la cantidad de movimiento de la partícula también está restringida a valores específicos que se hallan a partir de la expresión para la longitud de onda de De Broglie, la ecuación 40.15: p h l h 2L>n Recordatorio: La energía pertenece a un sistema Con frecuencia se hace referencia a la energía de una partícula en un lenguaje común. Al igual que en la prevención de riesgos ocultos 41.1, en realidad se describe la energía del sistema de la partícula y cualquier medio que tenga que ver con el establecimiento de las paredes impenetrables. Para la partícula en una caja, el único tipo de energía es la energía cinética que pertenece a la partícula, que es el origen de la descripción común. nh 2L Se señala la energía potencial del sistema igual a cero cuando la partícula está dentro de la caja. Por lo tanto, los valores permitidos de la energía del sistema, que simplemente es la energía cinética de la partícula, son proporcionados por 1 2 2 mu En En a p2 1nh>2L2 2 2m 2m h2 b n2 8mL 2 n 1, 2, 3, p (41.14) Esta expresión muestra que la energía de la partícula está cuantizada. La energía mínima corresponde al estado fundamental, que es el estado de energía mínima para cualquier sistema. Para la partícula en una caja, el estado fundamental corresponde a n 1, para el cual E1 h2/8mL2. Como En n2E1, los estados excitados correspondientes a n 2, 3, 4, . . . tienen energías dadas por 4E1, 9E1, 16E1, . . . La figura 41.5 es un diagrama del nivel de energía que describe los valores de energía de los estados permitidos. Porque la menor energía de una partícula en la caja es diferente de cero, según la mecánica cuántica, la partícula nunca puede estar en reposo. La mínima energía que puede tener, corresponde a n 1 y se denomina energía del estado fundamental. Este resultado contradice el punto de vista clásico, en el que E 0 es un estado aceptable, como son todos los valores positivos de E. Energías cuantizadas para una partícula en una caja ENERGÍA n Pregunta rápida 41.2 Considere un electrón, un protón y una partícula alfa (un núcleo de helio), cada una atrapada por separado en cajas idénticas. i) ¿Cuál partícula corresponde al estado de energía más alto? a) El electrón, b) el protón, c) la partícula alfa, d) la energía de estado fundamental es la misma en los tres casos. ii) ¿Cuál partícula tiene la mayor longitud de onda cuando el sistema está en el estado fundamental? a) El electrón, b) el protón, c) la partícula alfa, d) las tres partículas tienen la misma longitud de onda. 4 E4 5 16E1 3 E3 5 9E1 2 E2 5 4E1 1 E1 E 50 Energía de estado fundamental E 1 . 0 Figura 41.5 Diagrama del nivel de energía para una partícula confinada a una caja unidimensional de longitud L. La mínima energía permitida es E1 h2/8mL2. Pregunta rápida 41.3 Una partícula está en una caja de longitud L. De pronto, la longitud de la caja se aumenta a 2L. ¿Qué ocurre con los niveles de energía que se muestran en la figura 41.5? a) Nada, no se ven afectados. b) Se separan más. c) Se acercan más entre sí. EJEMPLO 41.2 1193 La partícula cuántica bajo condiciones frontera Partículas micro y macroscópicas en cajas A) Un electrón está confinado entre dos paredes impenetrables con una separación de 0.200 nm. Determine los niveles de energía para los estados n 1, 2 y 3. SOLUCIÓN Conceptualizar En la figura 41.3a, imagine que la partícula es un electrón y las paredes están muy juntas. Categorizar Los niveles de energía se evalúan con una ecuación desarrollada en esta sección, así que este ejemplo se clasifica como un problema de sustitución. Use la ecuación 41.14 para el estado n 1: E1 h2 11 2 2 8me L 2 1.51 Cap_41_Serway(2).indd 1193 10 8 19.11 18 J 16.63 10 31 10 34 J # s22 kg2 12.00 10 10 m22 9.42 eV 9/11/08 6:35:25 PM 1194 Capítulo 41 Mecánica cuántica Con la ecuación En n2E, encuentre las energías de los estados n 2 y n 3: E2 12 2 2E1 4 19.42 eV 2 37.7 eV E3 13 2 2E1 9 19.42 eV 2 84.8 eV B) Encuentre la rapidez del electrón en el estado n 1. SOLUCIÓN Resuelva la expresión clásica para energía cinética para la rapidez de la partícula: S 1 2 2m e u K 12 Reconozca que la energía cinética de la partícula es igual a la energía del sistema y sustituya En por K: Sustituya valores numéricos del inciso A): u 2 11.51 B 9.11 2E n B me u 18 10 31 10 2K B me u J2 106 m>s 1.82 kg ¡Con sólo colocar el electrón en la caja resulta en una rapidez mínima del electrón igual a 0.6% de la rapidez de la luz! C) Una pelota de beisbol de 0.500 kg está confinada entre dos paredes rígidas de un estadio que se puede modelar como una caja de 100 m de longitud. Calcule la rapidez mínima de la pelota de beisbol. SOLUCIÓN Conceptualizar En la figura 41.3a, imagine que la partícula es una pelota de beisbol y las paredes son las del estadio. Categorizar Esta parte del ejemplo es un problema de sustitución en el que se aplica el planteamiento cuántico a un objeto macroscópico. Use la ecuación 41.14 para el estado n 1: E1 Use la ecuación 1) para encontrar la rapidez: h2 112 2 8mL 2 u 16.63 34 J # s2 2 8 10.500 kg2 1100 m2 2 2 11.10 B 10 10 71 J2 1.10 6.63 0.500 kg 10 36 71 10 J m>s Esta rapidez es tan pequeña que el objeto se puede considerar en reposo, que es lo que uno esperaría para la rapidez mínima de un objeto macroscópico. ¿Qué pasaría si? ¿Y si se batea una línea franca de modo que la pelota de beisbol se mueve con una rapidez de 150 m/s? ¿Cuál es el número cuántico del estado en el que ahora reside la pelota de beisbol? Respuesta Se espera que el número cuántico sea muy grande porque la pelota de beisbol es un objeto macroscópico. De la ecuación 41.14, calcule el número cuántico n: 1 2 10.500 1 2 2 mu Evalúe la energía cinética de la pelota: n 8mL 2E n B h2 kg2 1150 m>s2 2 5.62 8 10.500 kg2 1100 m2 2 15.62 B 16.63 10 34 J # s2 2 103 J 103 J 2 2.26 1037 Este resultado es un número cuántico tremendamente grande. Conforme la pelota de beisbol empuja el aire fuera de su camino, golpea el suelo y rueda hasta detenerse, se mueve a través de más de 1037 estados cuánticos. Dichos estados están tan juntos en energía que no se pueden observar las transiciones de un estado al siguiente. En vez de ello, se ve lo que parece ser una variación uniforme en la rapidez de la bola. La naturaleza cuántica del universo simplemente no es evidente en el movimiento de objetos macroscópicos. Cap_41_Serway(2).indd 1194 9/11/08 6:35:26 PM Sección 41.2 EJEMPLO 41.3 La partícula cuántica bajo condiciones frontera 1195 Valores esperados para la partícula en una caja Una partícula de masa m está confinada a una caja unidimensional entre x 0 y x L. Encuentre el valor esperado de la posición x de la partícula en el estado caracterizado por el número cuántico n. SOLUCIÓN Conceptualizar La figura 41.4b muestra que la probabilidad para que la partícula esté en una posición determinada varía con la posición dentro de la caja. ¿Puede predecir cuál será el valor esperado de x a partir de la simetría de las funciones de onda? Categorizar El enunciado del ejemplo clasifica el problema: enfóquese en una partícula cuántica en una caja y en el cálculo de su valor esperado de x. Analizar En la ecuación 41.8, la integración de a se reduce a los límites 0 a L porque c 0 en todas partes, excepto en la caja. Sustituya la ecuación 41.13 en la ecuación 41.8 para encontrar el valor esperado para x: L 8x 9 0 2 L Evalúe la integral al consultar una tabla de integrales o por integración matemática:8 xc cn*x cn dx 8x9 L x sen2 a 0 2 x ≥ L 4 2 2 L2 c d L 4 2 npx 2 sen a b d dx BL L npx b dx L x sen a 2 npx b L np 4 L cos a 2 L npx b L ¥ np 2 8 a b L 0 L 2 Finalizar Este resultado demuestra que el valor esperado de x está en el centro de la caja para todos los valores de n, lo que se esperaría de la simetría del cuadrado de las funciones de onda (la densidad de probabilidad) en torno al centro (figura 41.4b). La función de onda n 2 en la figura 41.4b tiene un valor de cero en el punto medio de la caja. ¿El valor esperado de la partícula puede estar en una posición donde la partícula tenga probabilidad cero de existir? Recuerde que el valor esperado es la posición promedio. Por lo tanto, la partícula tiene tanta probabilidad de encontrarse a la derecha del punto medio como a la izquierda, así que su posición promedio está en el punto medio aun cuando su probabilidad de estar ahí sea cero. Como analogía, considere un grupo de estudiantes para el que la calificación promedio del examen final sea 50%. No hay requisito de que algún estudiante logre una calificación de exactamente 50% para que el promedio de todos los estudiantes sea 50 por ciento. Condiciones frontera sobre partículas en general La explicación de la partícula en una caja es muy similar a la realizada en el capítulo 18 acerca de las ondas estacionarias en cuerdas: Porque los extremos de la cuerda deben ser nodos, las funciones de onda para las ondas permitidas deben ser cero en las fronteras de la cuerda. Ya que la partícula en una caja no puede existir fuera de la caja, las funciones de onda permitidas para la partícula deben ser cero en las fronteras. Las condiciones frontera sobre las ondas en la cuerda conducen a longitudes de onda y frecuencias cuantizadas de las ondas. Las condiciones frontera sobre la función de onda para la partícula en una caja conducen a longitudes de onda y frecuencias cuantizadas de la partícula. Para integrar esta función, primero sustituya sen2(npx/L) con 12 (1 cos 2npx/L) (consulte la tabla B.3 en el apéndice B), lo que permite que x se exprese como dos integrales. En tal caso la segunda integral se puede evaluar mediante integración parcial (sección B.7 en el apéndice B). 8 Cap_41_Serway(2).indd 1195 9/11/08 6:35:27 PM 1196 Capítulo 41 Mecánica cuántica En mecánica cuántica es muy común que las partículas dependan de las condiciones frontera. Debido a eso, se introduce un nuevo modelo de análisis, la partícula cuántica bajo condiciones frontera. En muchas formas este modelo es similar al de las ondas bajo condiciones frontera estudiado en la sección 18.3. De hecho, las longitudes de onda permitidas para la función de onda de una partícula en una caja (ecuación 41.11) son idénticas en forma a las longitudes de onda permitidas para las ondas mecánicas en una cuerda fija en ambos extremos (ecuación 18.4). El modelo de la partícula cuántica bajo condiciones frontera difiere en algunas formas del modelo de las ondas bajo condiciones de frontera: En la mayoría de los casos de partículas cuánticas, la función de onda no es una fun- ción simple como la función de onda para onda sobre cuerdas. Además, la función de onda para una partícula cuántica puede ser una función compleja. Para una partícula cuántica, la frecuencia se relaciona con la energía a través de E hf, de modo que las frecuencias cuantizadas conducen a energía cuantizadas. Puede no haber “nodos” inmóviles asociados con la función de onda de una partícula cuántica bajo condiciones frontera. Sistemas más complicados que la partícula en una caja tienen funciones de onda más complicadas, y algunas condiciones de frontera pueden no conducir a ceros de la función de onda en puntos fijos. En general, la interacción de una partícula cuántica con su ambiente representa una o más condiciones frontera y, si la interacción restringe a la partícula a una región finita del espacio, resulta en cuantización de la energía del sistema. Las condiciones frontera sobre las funciones de onda cuánticas se relacionan con las coordenadas que describen el problema. Para la partícula en una caja, la función de onda debe ser cero en dos valores de x. En el caso de un sistema tridimensional como el átomo de hidrógeno que se explica en el capítulo 42, el problema se presenta mejor en coordenadas esféricas. Dichas coordenadas, una extensión de las coordenadas polares planas introducidas en la sección 3.1, consisten en una coordenada radial r y dos coordenadas angulares. La generación de la función de onda y la aplicación de las condiciones frontera para el átomo de hidrógeno están más allá del enlace de este libro. Sin embargo, en el capítulo 42 se examinará el comportamiento de algunas funciones de onda del átomo de hidrógeno. Las condiciones frontera sobre las funciones de onda que existen para todos los valores de x requieren que la función de onda tienda a cero conforme x → (de modo que la función de onda se puede normalizar) y permanecer finita conforme x → 0. Una condición frontera sobre cualquier parte angular de las funciones de onda es que agregar 2p radianes al ángulo debe regresar la función de onda al mismo valor, porque una adición de 2p resulta en la misma posición angular. Pregunta rápida 41.4 ¿Cuál de las siguientes opciones mostrará niveles cuantizados de energía? a) Un átomo en un cristal, b) un electrón y un protón en un átomo de hidrógeno, c) un protón en el núcleo de un átomo pesado, d) todo lo anterior, e) nada de lo anterior. 41.3 La ecuación de Schrödinger En la sección 34.3 se explicó la ecuación de una onda de radiación electromagnética, que se sigue de las ecuaciones de Maxwell. Las ondas asociadas con partículas también satisfacen la ecuación de onda. La ecuación de onda para partículas materiales es diferente de la asociada con fotones, porque las partículas materiales tienen una energía en reposo diferente de cero. La ecuación de onda apropiada fue creada por Schrödinger en 1926. Al analizar el comportamiento de un sistema cuántico, el planteamiento es determinar una solución a esta ecuación y luego aplicarle las condiciones frontera apropiadas. La solución proporciona las funciones de onda permitidas y los niveles de energía del sistema. La adecuada manipulación de la función de onda hace posible, por lo tanto, calcular todas las características mensurables del sistema. Cap_41_Serway(2).indd 1196 9/11/08 6:35:28 PM Sección 41.3 1197 La ecuación de Schrödinger La ecuación de Schrödinger, como se aplica a una partícula de masa m confinada a moverse a lo largo del eje x e interactuar con su ambiente por medio de una función de energía potencial U(x), es Uc Ec (41.15) donde E es una constante igual a la energía total del sistema (la partícula y su ambiente). Porque esta ecuación es independiente del tiempo, por lo común se le conoce como ecuación de Schrödinger independiente del tiempo. (En este texto no se revisa esta ecuación.) La ecuación de Schrödinger es consistente con el principio de conservación de energía mecánica de un sistema. El problema 25 muestra, para una partícula libre y una partícula en una caja, que el primer término de la ecuación de Schrödinger se reduce a la energía cinética de la partícula multiplicada por la función de onda. Por lo tanto, la ecuación 41.15 indica que la energía total es la suma de la energía cinética y la energía potencial, y que la energía total es una constante: K U E constante. En principio, si se conoce la función de la energía potencial U para el sistema, es posible resolver la ecuación 41.15 y obtener las funciones de onda y energías para los estados permitidos del sistema. Porque U puede ser dicontinuo con la posición, puede ser necesario obtener soluciones a la ecuación para diferentes regiones del eje x. Las soluciones a la ecuación de Schrödinger en diferentes regiones deben unirse fácilmente en las fronteras; es necesario que c(x) sea continua. Además, dc/dx también debe ser continua para valores finitos de la energía potencial.9 Resolver la ecuación de Schrödinger puede ser difícil, dependiendo de la forma de la función de energía potencial. Así como está, la ecuación de Schrödinger ha sido sumamente útil para explicar el comportamiento de sistemas atómicos y nucleares, mientras que la física clásica no ha podido explicar este comportamiento. Además, cuando se aplica mecánica cuántica a cuerpos macroscópicos, los resultados concuerdan con la física clásica. Ecuación de Schrödinger independiente del tiempo (AIP Emilio Segré Visual Archives). U 2 d 2c 2m dx 2 ERWIN SCHRÖDINGER Físico teórico austriaco (1887-1961) Schrödinger es mejor conocido como uno de los creadores de la mecánica cuántica. Su método para abordar la mecánica cuántica demostró ser matemáticamente equivalente a la mecánica de matrices más abstracta creada por Heisenberg. Schrödinger también escribió importantes ensayos técnicos sobre mecánica estadística, visión de color y relatividad general. Repaso de la partícula en una caja Para ver cómo es aplicado el modelo de partícula cuántica bajo condiciones frontera a un problema, piense de nuevo en una partícula en una caja unidimensional de longitud L (véase la figura 41.3) y analícela con la ecuación de Schrödinger. La figura 41.13b representa el diagrama de energía potencial que describe este problema. Un diagrama de energía potencial como éste es útil para comprender y resolver problemas con la ecuación de Schrödinger. Debido a la forma de la curva de la figura 41.3b, a veces se dice que la partícula en la caja está en un pozo cuadrado,10 donde un pozo es una región de la curva de cara hacia arriba en un diagrama de energía potencial. (Una región de cara hacia abajo se denomina barrera, la cual será investigada en la sección 41.5.) La figura 41.3b muestra un pozo cuadrado infinito. En la región 0 x L, donde U 0, exprese la ecuación de Schrödinger en la forma d 2c dx 2 2mE c U2 k 2c (41.16) donde k 9 10 PREVENCIÓN DE RIESGOS OCULTOS 41.3 Pozos de potencial Un pozo de potencial, como el de la figura 41.3b, es una representación gráfica de la energía, no una representación ilustrada, de modo que si pudiera observarse no se vería así. Una partícula se mueve sólo horizontalmente en una posición vertical fija en un diagrama de energía potencial, lo que representa la conservación de la energía del sistema de la partícula y su ambiente. 22mE U Si dc/dx no fuera continua, no podría evaluar d 2c/dx 2 en la ecuación 41.5 en el punto de discontinuidad. Se denomina pozo cuadrado incluso si tiene forma rectangular en un diagrama de energía potencial. Cap_41_Serway(2).indd 1197 9/11/08 6:35:28 PM 1198 Capítulo 41 Mecánica cuántica La solución a la ecuación 41.16 es una función c cuya segunda derivada es el negativo de la misma función multiplicada por una constante k 2. Las funciones seno y coseno satisfacen este requisito. Por lo tanto, la solución más general a la ecuación es una combinación lineal de ambas soluciones: c(x) A sen kx B cos kx donde A y B son constantes que están determinadas por las condiciones de normalización y frontera. La primera condición frontera en la función de onda es que c(0) 0: c(0) A sen 0 B cos 0 0 B 0 lo cual significa que B 0. Debido a eso, la solución se reduce a c(x) A sen kx Con la segunda condición frontera, c(L) 0, cuando es aplicada a la solución reducida, se obtiene c(L) A sen kL 0 Esta ecuación podría satisfacerse si A 0, pero significaría que c 0 en todas partes, lo cual no es una función de onda válida. Se cumple la condición frontera si kL es un múlti12mE > U plo entero de p, es decir, si kL np, donde n es un entero. Sustituyendo k en esta expresión da 22mE L np U Cada valor del entero n corresponde a una energía cuantizada llamada En. Al resolver para las energías permitidas En, kL En a h2 b n2 8mL2 (41.17) que son idénticas a las energías permitidas en la ecuación 41.14. Si sustituye los valores de k en la función de onda, las funciones de onda permitidas cn(x) están dadas por cn 1x2 A sen a npx b L (41.18) que es la función de onda (ecuación 41.12) que se usó en la explicación inicial de la partícula en una caja. 41.4 I II U III E 0 L x Figura 41.6 Diagrama de energía potencial de un pozo de altura U y longitud L finitas. Una partícula está atrapada en el pozo. La energía total E del sistema partícula-pozo es menor que U. Cap_41_Serway(2).indd 1198 Una partícula en un pozo de altura finita Ahora considere una partícula en un pozo de potencial finito, es decir, un sistema que tenga una energía potencial que sea cero cuando la partícula está en la región 0 x L y un valor finito U cuando la partícula está fuera de esta región, como en la figura 41.6. Si la energía total E del sistema es menor que U, según la física clásica, la partícula estaría de modo permanente ligada en el pozo de potencial. Si la partícula estuviera fuera del pozo, su energía cinética tendría que ser negativa, lo que sería imposible. No obstante, según la mecánica cuántica, existe una probabilidad finita de que la partícula pueda encontrarse fuera del pozo, incluso si E U. Es decir, la función de onda c por lo general es diferente de cero fuera del pozo —en las regiones I y III en la figura 41.6—, de modo que la densidad de probabilidad |c|2 también es diferente de cero en estas regiones. Si bien esto puede ser una noción extraña, el principio de incertidumbre dice que la energía del sistema es incierta. Esto permite que la partícula se encuentre fuera del pozo mientras la violación aparente de la conservación de la energía no exista en ninguna forma posible de medir. En la región II, donde U 0, las funciones de onda permitidas son de nuevo sinusoidales porque representan soluciones de la ecuación 41.16. Sin embargo, las condiciones 9/11/08 6:35:29 PM Sección 41.4 Una partícula en un pozo de altura finita 1199 frontera ya no requieren que c sea cero en los extremos del pozo, como fue el caso con el pozo cuadrado infinito. La ecuación de Schrödinger para las regiones I y III se puede escribir como 2m 1U d 2c dx 2 U E2 2 c (41.19) Porque U E, el coeficiente de c en el lado derecho necesariamente es positivo. Por lo tanto, exprese la ecuación 41.19 en la forma d 2c dx 2 C 2c (41.20) donde C 2 2m(U E)/2 es una constante positiva en las regiones I y III. Como se puede verificar por sustitución, la solución general de la ecuación (41.19) es c Ae Cx BeCx (41.21) donde A y B son constantes. Esta solución general sirve como punto de partida para determinar la solución apropiada para las regiones I y III. La solución debe permanecer finita cuando x Æ . En la región I, donde x 0, la función c debe excluir el término BeCx . Se requiere que B 0 en la región I para evitar un valor infinito de c para valores negativos grandes de x. Del mismo modo, en la región III, donde x L, la función c no debe contener el término Ae Cx; esto se logra al tomar A 0 en esta región. Esta opción evita un valor infinito de c para valores positivos grandes de x. Por esto, las soluciones en las regiones I y III son cI Ae Cx cIII Be Cx para x 6 0 para x 7 L En la región II la función de onda es sinusoidal y tiene la forma general cII(x) F sen kx G cos kx donde F y G son constantes. Estos resultados muestran que las funciones de onda fuera del pozo de potencial (donde la física clásica prohíbe la presencia de la partícula) decaen exponencialmente con la distancia. A valores negativos grandes de x, cI se aproxima a cero; a valores positivos grandes de x, cIII se aproxima a cero. Estas funciones, junto con la solución sinusoidal en la región II, se muestran en la figura 41.7a para los primeros tres estados de energía. Al evaluar la función de onda completa, se requieren las siguientes condiciones frontera: cI cII y dcI dx cII cIII y dcII dx dcIII en x dx c | c| 2 c | c| 2 c | c| 2 I II 0 III L a) Cap_41_Serway(2).indd 1199 dcII dx en x I 0 L II 0 Figura 41.7 a) Funciones de onda c y b) densidades de probabilidad |c|2 para los tres estados de energía más bajos para una partícula en un pozo de potencial de altura finita. Los estados se muestran sobrepuestos en la función de energía potencial de la figura 41.6. Las funciones de onda y densidades de probabilidad están graficadas en sentido vertical desde ejes separados que están desplazados verticalmente para mayor claridad. Las posiciones de estos ejes sobre la función de energía potencial sugieren las energías relativas de los estados. III L b) 9/11/08 6:35:30 PM 1200 Capítulo 41 Mecánica cuántica Estas cuatro condiciones frontera y la condición de normalización (ecuación 41.7) son suficientes para determinar las cuatro constantes A, B, F y G, y los valores permitidos de la energía E. La figura 41.7b grafica las densidades de probabilidad para estos estados. Observe que en cada caso las funciones de onda dentro y fuera del pozo de potencial se unen fácilmente en las fronteras. La idea de atrapar partículas en pozos de potencial se emplea en el creciente campo de la nanotecnología, que se refiere al diseño y aplicación de equipos que tienen dimensiones que van de 1 a 100 nm. Es frecuente que la fabricación de estos aparatos comprenda la manipulación de átomos individuales, o pequeños grupos de átomos, para formar estructuras tales como el corral cuántico de la fotografía con que se inicia este capítulo. Un campo de acción de la nanotecnología, de interés para los investigadores, es el punto cuántico, una región pequeña que es cubierta de cristales de silicio y actúa como pozo de potencial. Esta región atrapa electrones con energías cuantizadas. Las funciones de onda para una partícula en un punto cuántico parecen semejantes a las de la figura 41.7 si L está en el orden de nanómetros. El almacenamiento de información binaria con el uso de puntos cuánticos es un campo activo de investigación. Un esquema binario sencillo comprendería asociar un uno con un punto cuántico que contenga un electrón y un cero con un punto vacío. Otros esquemas involucran celdas de puntos múltiples tales que las distribuciones de electrones entre los puntos corresponden a unos y ceros. Hay varios laboratorios de investigación que estudian las propiedades y aplicaciones potenciales de los puntos cuánticos. Es posible que en los próximos años se publique continuamente información de estos laboratorios. 41.5 U cI c II c III U I II III E x L Figura 41.8 Función de onda c para una partícula que incide desde la izquierda en una barrera de altura U y ancho L. La función de onda es sinusoidal en las regiones I y III, pero decae exponencialmente en la región II. La función de onda está graficada verticalmente desde un eje ubicado en la energía de la partícula. PREVENCIÓN DE RIESGOS OCULTOS 41.4 “Altura” en un diagrama de energía La palabra altura (como en altura de barrera) se refiere a una energía en los análisis de barreras en los diagramas de energía potencial. Por ejemplo, podría decirse que la altura de la barrera es de 10 eV. Por otra parte, el ancho de barrera es igual que en el uso tradicional de esa palabra; es una medición de la distancia física real entre los dos lados verticales de la barrera. Cap_41_Serway(2).indd 1200 Efecto túnel a través de una barrera de energía potencial Considere la función de energía potencial que se ilustra en la figura 41.8. En esta situación, la energía potencial tiene un valor constante U en la región de ancho L y es cero en todas las otras regiones.11 Una función de energía potencial de esta forma se llama barrera cuadrada, y U se denomina altura de la barrera. Un fenómeno muy interesante y peculiar se presenta cuando una partícula en movimiento encuentra una barrera como ésta de altura y ancho finitos. Suponga que una partícula de energía E U incide en la barrera desde la izquierda (figura 41.8). Clásicamente, la partícula sería reflejada por la barrera. Si la partícula debiera existir en la región II, su energía cinética sería negativa, lo cual no es permitido desde el punto de vista clásico. En consecuencia, la región II, y por tanto la región III, son clásicamente prohibidas para la partícula que incide desde la izquierda. Sin embargo, según la mecánica cuántica, todas las regiones son accesibles a la partícula, cualquiera que sea su energía. (Aun cuando todas las regiones son accesibles, la probabilidad de que la partícula se encuentre en una región clásicamente prohibida es muy baja.) De acuerdo con el principio de incertidumbre, la partícula puede estar dentro de la barrera mientras el intervalo durante el cual está en ella sea corto y consistente con la ecuación 40.24. Si la barrera es relativamente angosta, este corto intervalo puede permitir que la partícula se mueva a través de la barrera. Planteando esta situación con una representación matemática. La ecuación de Schrödinger tiene soluciones válidas en las regiones I, II y III. Las soluciones en las regiones I y III son sinusoidales, como en la ecuación 41.12. En la región II, la solución es exponencial semejante a la ecuación 41.21. Si se aplica la condición frontera de que las funciones de onda de las tres regiones y sus derivadas deben unirse fácilmente en las fronteras, es posible hallar una solución completa, como la que representa la curva de la figura 41.8. Porque la probabilidad de localizar la partícula es proporcional a |c |2, la probabilidad de encontrar la partícula más allá de la barrera en la región III es diferente de cero. Este resultado está en completo desacuerdo con la física clásica. El movimiento de la partícula en el lado lejano de la barrera se denomina efecto túnel o penetración de barrera. La probabilidad del efecto túnel se puede describir con un coeficiente de transmisión T y un coeficiente de reflexión R. El coeficiente de transmisión representa la probabilidad de que la partícula penetre al otro lado de la barrera, y el coeficiente de reflexión es la 11 Es común en física referirse a L como la distancia de un paso paro el ancho de una barrera. 9/11/08 6:35:31 PM Sección 41.5 Efecto túnel a través de una barrera de energía potencial 1201 probabilidad de que la partícula sea reflejada por la barrera. Puesto que la partícula incidente, es reflejada o transmitida, se requiere que T R 1. Una expresión aproximada para el coeficiente de transmisión que se obtiene cuando T 1 (una barrera muy ancha o una barrera muy alta, es decir, U E) es T e2CL donde C 22m 1U (41.22) E2 (41.23) U Este modelo cuántico de penetración de barrera y específicamente la ecuación 41.22, muestran que T puede ser diferente de cero. El hecho de que el fenómeno de efecto túnel pueda observarse experimentalmente proporciona más confianza en los principios de la física cuántica. Pregunta rápida 41.5 ¿Cuál de los siguientes cambios aumentaría la probabilidad de transmisión de una partícula a través de una barrera de potencial? (Puede escoger más de una respuesta.) a) Reducir el ancho de la barrera, b) aumentar el ancho de la barrera, c) reducir la altura de la barrera, d) aumentar la altura de la barrera, e) reducir la energía cinética de la partícula incidente, f) aumentar la energía cinética de la partícula incidente. EJEMPLO 41.4 Coeficiente de transmisión para un electrón Un electrón de 30 eV incide sobre una barrera cuadrada de 40 eV de alto. A) ¿Cuál es la probabilidad de que el electrón penetre por efecto túnel a través de la barrera, si su ancho es 1.0 nm? SOLUCIÓN Conceptualizar Ya que la energía de la partícula es menor que la altura de la barrera de potencial, se espera que el electrón se refleje de la barrera con una probabilidad de 100%, de acuerdo con la física clásica. Sin embargo, debido al efecto túnel, hay una probabilidad finita de que la partícula pueda aparecer en el otro lado de la barrera. Categorizar La probabilidad se evalúa con una ecuación desarrollada en esta sección, así que este ejemplo se clasifica como un problema de sustitución. 1.6 10 19 J b 1.6 10 18 J U E 40 eV 30 eV 10 eV a 1 eV Evalúe la cantidad U E que aparece en la ecuación 41.23: 1 2 2CL 2 22 19.11 10 1.055 Evalúe la cantidad 2CL con la ecuación 41.23: T e 2CL 31 kg 2 11.6 10 34 e 32.4 10 J#s 8.5 18 J2 10 11.0 10 9 m2 32.4 15 A partir de la ecuación 41.22, encuentre la probabilidad del efecto túnel a través de la barrera: B) ¿Cuál es la probabilidad de que el electrón penetre por el efecto túnel a través de la barrera, si su ancho es 0.10 nm? SOLUCIÓN En este caso, el ancho L en la ecuación 1) es un décimo de grande, así que se evalúa el nuevo valor de 2CL: 2CL A partir de la ecuación 41.22, encuentre la nueva probabilidad del efecto túnel a través de la barrera: T 10.12 132.42 e 2CL e 3.24 3.24 0.039 En la parte A), el electrón tenía aproximadamente una oportunidad en 1014 de pasar por el efecto túnel a través de la barrera. Sin embargo, en la parte B), el electrón tiene una probabilidad mucho mayor (3.9%) de penetrar la barrera. Por lo tanto, Cap_41_Serway(2).indd 1201 9/11/08 6:35:32 PM 1202 Capítulo 41 Mecánica cuántica ¡reducir el ancho de la barrera en sólo un orden de magnitud aumenta la probabilidad de efecto túnel de penetración de barrera en casi 12 órdenes de magnitud! 41.6 Aplicaciones del efecto túnel Como ha visto, el efecto túnel es un fenómeno cuántico, una manifestación de la naturaleza ondulatoria de la materia. Existen numerosos ejemplos (en escalas atómica y nuclear) en los que el efecto túnel es muy importante. Desintegración alfa Una forma de desintegración radiactiva es la emisión de partículas alfa (núcleos de átomos de helio) por núcleos pesados e inestables (capítulo 44). Para que una partícula alfa escape del núcleo, debe penetrar una barrera cuya altura sea varias veces mayor que la energía del sistema núcleo-partícula alfa. La barrera se debe a una combinación de la fuerza nuclear de atracción (que se explica en el capítulo 44) y la repulsión de Coulomb (explicada en el capítulo 23) entre la partícula alfa y el resto del núcleo. En ocasiones, una partícula alfa logra el efecto túnel a través de la barrera, lo cual explica el mecanismo básico para este tipo de desintegración y las grandes variaciones en las vidas medias de diversos núcleos radiactivos. La figura 41.8 muestra la función de onda de una partícula que penetra por efecto túnel a través de una barrera en una dimensión. Una función de onda similar que tenga simetría esférica describe la penetración de barrera de una partícula alfa que sale de un núcleo radiactivo. La función de onda existe tanto dentro como fuera del núcleo, y su amplitud es constante en el tiempo. De esta forma, la función de onda describe correctamente la pequeña pero constante probabilidad de que el núcleo decaerá. El momento de decaimiento no se puede predecir. En general, la mecánica cuántica implica que el futuro es indeterminado. Esta característica está en contraste con la mecánica clásica, a partir de la cual se puede calcular la trayectoria de un objeto con una precisión muy alta a partir del conocimiento preciso de su posición y su velocidad iniciales y de las fuerzas que se ejercen sobre él. No piense que el futuro es indeterminado simplemente porque se tiene información incompleta acerca del presente. La función de onda contiene toda la información acerca del estado de un sistema. A veces se pueden hacer predicciones precisas, como la energía de un sistema enlazado, pero en ocasiones sólo se pueden calcular probabilidades acerca del futuro. Las leyes fundamentales de la naturaleza son probabilísticas. Por lo tanto, parece que el famoso enunciado de Einstein acerca de la mecánica cuántica, “Dios no juega con dados”, estaba equivocado. Se puede usar un detector de radiación para demostrar que un núcleo decae mediante emisión de una partícula en un momento particular y en una dirección particular. Para puntualizar el contraste entre este resultado experimental y la función de onda que la describe, Shrödinger imaginó una caja que contenía un gato, una muestra radiactiva, un contador de radiación y un frasco de veneno. Cuando un núcleo en la muestra decae, el contador dispara la administración del veneno letal al gato. La mecánica cuántica predice correctamente la probabilidad de encontrar al gato muerto cuando la caja se abra. Antes de que la caja se abra, ¿tiene el gato una función de onda que lo describa como fraccionalmente muerto, con alguna oportunidad de estar vivo? Esta pregunta sigue bajo continua investigación, nunca con gatos reales sino a veces con experimentos de interferencia construidos sobre el experimento descrito en la sección 40.7. ¿El acto de medir cambia el sistema de un estado probabilístico a uno definido? Cuando una partícula emitida por un núcleo radiactivo se detecta en una posición particular, ¿la función de onda que describe a la partícula cae instantáneamente a cero en todas las demás partes del universo? (Einstein llamó a tal cambio de estado una “espantosa acción a distancia”.) ¿Hay una diferencia fundamental entre un sistema cuántico y un sistema macroscópico? Las respuestas a estas preguntas son desconocidas. Fusión nuclear La reacción básica que suministra energía al Sol e indirectamente a casi todo lo demás en el sistema solar, es la fusión, que se estudia en el capítulo 45. En una etapa del proceso que se presenta en el núcleo del Sol, los protones se aproximan entre sí a distancias tan pequeñas que se fusionan para formar un núcleo de deuterio. (Véase la sección 45.4.) Cap_41_Serway(2).indd 1202 9/11/08 6:35:32 PM El microscopio de barrido de efecto túnel El microscopio de barrido de efecto túnel (STM, scanning tunneling microscope), permite a los científicos obtener imágenes detalladas de superficies con resoluciones comparables al tamaño de un solo átomo. La figura 41.9, que ilustra la superficie de un trozo de grafito, demuestra lo que puede hacer el STM. Lo que hace tan sorprendente esta imagen es su resolución de cerca de 0.2 nm. Para un microscopio, la solución está limitada por la longitud de onda de la luz usada para hacer la imagen. En consecuencia un microscopio óptico, tiene una resolución no mayor a 200 nm, que es cerca de la mitad de la longitud de onda de la luz visible, por lo que nunca podría mostrar el detalle que se muestra en la figura 41.9. El microscopio de barrido de efecto túnel logra tan excelente resolución al usar la idea básica que se muestra en la figura 41.10. Una sonda eléctricamente conductora con una aguja muy delgada se coloca cerca de la superficie bajo estudio. El espacio vacío entre la aguja y la superficie representa la “barrera”, que se ha explicado, y la punta y la superficie son las dos paredes del “pozo de potencial”. Porque los electrones obedecen más las reglas cuánticas antes que las reglas de Newton, pueden “perforar un túnel” hasta el otro lado de la barrera hacia el espacio vacío. Si se aplica un voltaje entre la superficie y la aguja los electrones de los átomos de la superficie material pueden perforar un túnel de preferencia desde la superficie hacia la aguja para producir una corriente de filtración cuántica. De esta manera, la aguja ejemplifica la distribución de electrones que están justo encima de la superficie. En el espacio vacío entre la punta y la superficie, la función de onda electrónica cae exponencialmente (véase la región II en la figura 41.8 y el ejemplo 41.4). Para distancias punta-superficie z 1 nm (es decir, más allá de unos cuantos diámetros atómicos), esencialmente no ocurre el efecto túnel. Este comportamiento exponencial hace que la corriente de electrones que provocan filtración cuántica de la superficie a la punta dependan en gran medida de z. Al observar la corriente de filtración cuántica cuando la aguja explora en toda la superficie, los investigadores obtienen una medida sensible de la topografía superficial de la distribución electrónica. El resultado de esta exploración se emplea para tomar imágenes como la de la figura 41.9. En esta forma, el STM puede medir la altura de las características de la superficie con una tolerancia de no más de 0.001 nm, ¡aproximadamente 1/100 el diámetro de un átomo! Es posible ver lo sensible que es el STM si examina la figura 41.9. De los seis átomos de carbono de cada anillo, tres aparecen más abajo que los otros tres. En realidad, los seis átomos están a la misma altura, pero todos tienen distribuciones electrónicas ligeramente diferentes. Los tres átomos que aparecen más bajos están ligados a los otros átomos de carbono directamente bajo ellos en la capa atómica que sirve de base; en consecuencia, sus distribuciones electrónicas, que provocan el enlace, se extienden hacia abajo por debajo de la superficie. Los átomos de la capa superficial que aparecen más arriba no están directamente sobre los átomos de la subcapa y, por esto, no están ligados a ningún átomo subyacente. Para estos átomos que aparecen más arriba, la distribución electrónica se extiende por encima de la superficie. Esta densidad electrónica extra es lo que provoca que estos átomos aparezcan más arriba en la figura 41.9, porque lo que el STM traza es la topografía de la distribución electrónica. El STM tiene una seria limitación: su operación depende de la conductividad eléctrica de la muestra y la aguja. Por desgracia, casi todos los materiales resultan malos conductores eléctricos en sus superficies. Incluso los metales, que por lo general son excelentes conductores eléctricos, están cubiertos de óxidos no conductores. Un microscopio más reciente, el microscopio de fuerza atómica (AFM, atomic force microscope), supera esta limitación. Figura 41.9 Superficie de grafito según se “ve” con un microscopio de barrido de efecto túnel. Este tipo de microscopio permite a los científicos ver detalles con una resolución lateral de alrededor de 0.2 nm y una resolución vertical de 0.001 nm. Los contornos que se ven aquí representan una distribución semejante a anillos de átomos individuales de carbono en la superficie del cristal. z piezo yp iez o Según la física clásica, estos protones no pueden superar penetrar la barrera causada por la repulsión eléctrica entre ellos. De cualquier modo, desde el punto de vista de la mecánica cuántica, los protones sí pueden lograr el efecto túnel a través de la barrera y fusionarse. Cap_41_Serway(2).indd 1203 1203 Aplicaciones del efecto túnel Photo courtesy of roger A. Freedman and Paul K. Hansma, University of California, Santa Barbara Sección 41.6 x piezo A Figura 41.10 Vista esquemática de un microscopio de barrido de efecto túnel. Una exploración de la punta sobre la muestra puede revelar contornos de la superficie hasta un nivel atómico. La imagen de un STM está compuesta por una serie de exploraciones desplazadas lateralmente unas de otras. 9/11/08 6:35:33 PM 1204 Capítulo 41 Mecánica cuántica Figura 41.11 a) La estructura física de un dispositivo de efecto túnel resonante. b) Diagrama de energía potencial que muestra la doble barrera que representa las paredes del punto cuántico. c) A través del dispositivo se aplica un voltaje. La distorsión de la curva de energía potencial hace que uno de los estados en el punto cuántico resuene con la energía del electrón incidente. Punto cuántico Contacto metálico (2) Contacto metálico (1) Arseniuro de aluminio Canal de electrones de arseniuro de galio Sustrato estructural a) U Energía de electrón Niveles de energía en el punto cuántico x b) U Resonancia x c) Dispositivos de efecto túnel resonante Amplíe el análisis del punto cuántico de la sección 41.4 con la exploración del dispositivo de efecto túnel resonante. La figura 41.11a muestra la construcción física de tal dispositivo. La isla de arseniuro de galio en el centro es un punto cuántico ubicado entre dos barreras formadas a partir de las delgadas extensiones de arseniuro de aluminio. La figura 41.11b muestra ambas barreras de potencial encontradas por electrones incidentes desde la izquierda y los niveles de energía cuantizados en el punto cuántico. Esta situación difiere de la que se muestra en la figura 41.8 en que hay niveles de energía cuantizados a la derecha de la primera barrera. En la figura 41.8, un electrón que penetra por efecto túnel a través de la barrera se considera una partícula libre y puede tener cualquier energía. En contraste, en la figura 41.11b, conforme el electrón con la energía que se muestra encuentra la primera barrera no tiene niveles de energía disponibles en el lado derecho de la barrera, lo que reduce enormemente la probabilidad de filtración cuántica. La figura 41.11c muestra el efecto de aplicar un voltaje: el potencial disminuye con la posición conforme se mueve a la derecha a través del dispositivo. La deformación de la barrera de potencial resulta en un nivel de energía en el punto cuántico que coincide con la energía de los electrones incidentes. Esta “resonancia” de energías da su nombre al dispositivo. Cuando se aplica el voltaje, la probabilidad de efecto túnel aumenta de manera considerable y el dispositivo porta corriente. De esta forma, el dispositivo se puede usar como un interruptor muy rápido a una escala nanotecnológica. Transistores de efecto túnel resonante La figura 41.12a muestra la adición de un electrodo de compuerta en lo alto del dispositivo de efecto túnel resonante sobre el punto cuántico. Este electrodo convierte el Figura 41.12 a) La adición de un electrodo de compuerta a la estructura en la figura 41.11 la convierte en un transistor de efecto túnel resonante. b) Diagrama de energía potencial que muestra la doble barrera que representa las paredes del punto cuántico. c) Se aplica un voltaje al electrodo de compuerta. El potencial en la región del punto cuántico cae, junto con los niveles de energía cuantizados. Contacto metálico, fuente (2) Punto Contacto metálico, Contacto metálico, cuántico compuerta (1) drenado (1) Arseniuro de aluminio Canal de electrones de arseniuro de galio U Energía de electrón U Resonancia Sustrato estructural a) Niveles de energía en punto cuántico x b) x c) Cap_41_Serway(2).indd 1204 9/11/08 6:35:34 PM Sección 41.7 El oscilador armónico simple 1205 dispositivo en un transistor de efecto túnel resonante. La función básica de un transistor es la amplificación, que convierte un voltaje variable pequeño en un gran voltaje variable. La figura 41.12b, que representa el diagrama de energía potencial para el transistor de efecto túnel, tiene una pendiente en el fondo del punto cuántico debido a la distinción de voltajes en la fuente y los electrodos de consumo. En esta configuración, no hay resonancia entre las energía de electrón fuera del punto cuántico y las energías cuantizadas dentro del punto. Al aplicar un pequeño voltaje al electrodo de compuerta, como en la figura 41.12c, las energías cuantizadas se pueden colocar en resonancia con la energía del electrón afuera del pozo y se presenta efecto túnel resonante. La corriente resultante causa un voltaje a través de un resistor externo que es mucho más grande que el voltaje de la compuerta; por esto, el dispositivo amplifica la señal de entrada al electrodo de compuerta. 41.7 El oscilador armónico simple Considere una partícula que se somete a una fuerza restauradora lineal F kx, donde x es la posición de la partícula respecto al equilibrio (x 0) y k es una constante. El movimiento clásico de una partícula sometida a esta fuerza es armónico simple, el cual estudió en el capítulo 15. La energía potencial del sistema es, de la ecuación 15.20. 1 2 2 2m v x 1 2 2 kx U donde la frecuencia angular de vibración es v 1k>m. En la mecánica clásica, si la partícula se desplaza desde su posición de equilibrio y se suelta, oscila entre los puntos x A y x A, donde A es la amplitud del movimiento. Además, su energía total E es, a partir de la ecuación 15.21, E K 1 2 2 kA U 1 2 2 2m v A En el modelo clásico, cualquier valor de E es permitido, incluso E 0, que es la energía total cuando la partícula está en reposo en x 0. Ahora investigaremos cómo es tratado el oscilador armónico simple desde el punto de vista cuántico. La ecuación de Schrödinger para este problema se obtiene al sustituir U 12mv2x 2 en la ecuación 41.15: U 2 d 2c 2m dx 2 1 2 2 2m v x c Ec (41.24) La técnica matemática para resolver esta ecuación está fuera del alcance de este libro. No obstante, es de utilidad pensar en una solución. Tome la siguiente función de onda para el cálculo: c Be Cx 2 (41.25) Al sustituir esta función en la ecuación 41.24, se encuentra que es una solución satisfactoria a la ecuación de Schrödinger, siempre y cuando mv C y E 12 Uv 2U Resulta que la solución que se ha calculado corresponde al estado fundamental del sistema, que tiene una energía 12v. Como C mv/2 se deduce de la ecuación 41.25 que la función de onda para este estado es c Be 1m v>2U2x 2 (41.26) Función de onda para el estado fundamental de un oscilador armónico simple Energías cuantizadas para un oscilador armónico simple donde B es la constante a ser determinada desde la condición de normalización. Este resultado es sólo una solución a la ecuación 41.24. Las soluciones restantes que describen los estados excitados son más complicadas, pero todas las soluciones incluyen el factor 2 exponencial e Cx . Los niveles de energía de un oscilador armónico están cuantizados, como es de esperarse, porque la partícula oscilatoria está destinada a estar cerca de x 0. La energía para un número cuántico arbitrario n es En 1n 1 22 Uv n 0, 1, 2, p (41.27) El estado n 0 corresponde al estado fundamental, cuya energía es E0 v; el estado n 1 corresponde al primer estado excitado, cuya energía es E1 32v, y así sucesivamente. 1 2 Cap_41_Serway(2).indd 1205 9/11/08 6:35:34 PM 1206 Capítulo 41 Mecánica cuántica U(x) 11 បω E5 — 2 El diagrama del nivel de energía para este sistema se ilustra en la figura 41.13. Observe que las separaciones entre niveles adyacentes son iguales y están dadas por DE0 v E4 –92 បω E3 –72 បω E2 –52 បω E បω E1 –32 បω E0 –12 បω 0 x Figura 41.13 Diagrama del nivel de energía para un oscilador armónico simple, sobrepuesto en la función de energía potencial. Los niveles están igualmente espaciados, con una separación v. La energía de estado fundamental es E0 12 v. EJEMPLO 41.5 (41.28) Advierta que los niveles de energía para el oscilador armónico de la figura 41.13 están igualmente espaciados, tal como lo propuso Planck para los osciladores en las paredes de la cavidad que se utilizó en el modelo de radiación de cuerpo negro de la sección 40.1. La ecuación 40.4 de Planck para los niveles de energía de los osciladores se distingue de la ecuación 41.27 sólo en el término 12 adicionado a n. Este término adicional no afecta la energía que se emite en una transición, dada por la ecuación 40.5, que es equivalente a la ecuación 41.28. El hecho de que Planck generara estos conceptos sin la ecuación de Schrödinger es testimonio de su genio. Calor específico molar del gas hidrógeno En la figura 21.7 (sección 21.4), que muestra el calor específico molar del hidrógeno como función de la temperatura, la vibración no contribuye al calor específico molar a temperatura ambiente. Explique por qué, modelando la molécula de hidrógeno como un oscilador armónico simple. La constante de resorte efectiva para el enlace en la molécula de hidrógeno es 573 N/m. SOLUCIÓN Conceptualizar Imagine el único modo de vibración disponible para una molécula diatómica. Este modo (que se muestra en la figura 21.6c) consiste en los dos átomos que siempre se mueven en direcciones opuestas con igual rapidez. Categorizar Este ejemplo se clasifica como un problema de oscilador armónico cuántico, con la molécula modelada como un sistema de dos partículas. Analizar El movimiento de las partículas en relación con el centro de masa se analiza al considerar la oscilación de una sola partícula con masa reducida m. (Véase el problema 39.) ¢E Con la ecuación 41.28, calcule la energía necesaria para excitar la molécula desde su estado vibratorio fundamental a su primer estado vibratorio excitado: Sustituya valores numéricos y note que m es la masa de un átomo de hidrógeno: Iguale esta energía con 32kBT a partir de la ecuación 21.4 y encuentre la temperatura a la cual la energía cinética traslacional molecular promedio es igual a la requerida para excitar el primer estado vibratorio de la molécula: Cap_41_Serway(2).indd 1206 11.055 ¢E Uv 10 U 34 2 3a 8.74 10 kB 20 J k Bm J # s2 3 2 k BT T m2 2m m 1m 2 m1 m2 m Use el resultado del problema 39 para evaluar la masa reducida de la molécula de hidrógeno, en la que las masas de las dos partículas es la misma: b U 1 2m k B 12m U 2k Bm 2 1573 N>m2 B 1.67 8.74 2 3a 8.74 1.38 27 10 10 20 10 10 8.74 kg 10 20 J J 20 23 J J>K b 4.22 103 K 9/11/08 6:35:36 PM Resumen 1207 Finalizar La temperatura del gas debe ser mayor que 4000 K para que la energía cinética traslacional se compare con la energía requerida para excitar el primer estado vibratorio. Esta energía de excitación debe venir de colisiones entre moléculas, de modo que si las moléculas no tienen suficiente energía cinética traslacional, no se pueden excitar al primer estado vibratorio y la vibración no contribuye al calor específico molar. Por tanto, la curva en la figura 21.7 no se eleva a un valor que corresponda a la contribución de la vibración hasta que el gas hidrógeno se eleva a miles de kelvin. La figura 21.7 muestra que los niveles de energía rotacional deben estar más cercanamente espaciados en energía que los niveles vibratorios porque se excitan a una temperatura menor que los niveles vibratorios. Los niveles de energía traslacional son los de una partícula en una caja tridimensional, donde la caja es el contenedor que retiene el gas. Estos niveles están dados por una expresión similar a la ecuación 41.14. Porque la caja es macroscópica en tamaño, L es muy grande y los niveles de energía están muy juntos. De hecho, están tan juntos que los niveles de energía traslacional se excitan a una fracción de un kelvin. Resumen DEFINICIONES La función de onda para un sistema es una función matemática que se puede escribir como un producto de una función espacio c para una partícula del sistema y una función en el tiempo compleja: ° 1r 1, r 2, r 3, p , r j , p , t2 S S S S c 1 rj 2 e S ivt La posición observada x de una partícula, promediada sobre muchos ensayos, se llama valor esperado de x y se define por (41.2) 8x 9 donde v (( 2pf ) es la frecuencia angular de la función de onda e i 11. La función de onda contiene dentro de sí toda la información que se puede saber acerca de la partícula. c *x cdx (41.8) CONCEPTOS Y PRINCIPIOS En mecánica cuántica, una partícula en un sistema se puede representar mediante una función de onda c(x, y, z). La probabilidad por unidad de volumen (o densidad de probabilidad) de que una partícula se encontrará en un punto es |c|2 c *c, donde c* es el complejo conjugado de c. Si la partícula está confinada a moverse a lo largo del eje x, la probabilidad de que se ubique en un intervalo dx es |c|2 dx. Además, la suma de todas estas probabilidades en todos los valores de x debe ser 1: 0 c 0 2dx (41.7) 1 Esta expresión se llama condición de normalización. Si una partícula de masa m está confinada a moverse en una caja unidimensional de longitud L cuyas paredes son impenetrabales, entonces c debe ser cero en las paredes y fuera de la caja. Las funciones de onda para este sistema están dadas por c 1x2 A sen a npx b L n 1, 2,3, p (41.12) donde A es el máximo valor de c. Los estados permitidos de una partícula en una caja tienen energías cuantizadas conocidas por En a h2 b n2 8mL2 n 1, 2, 3, p (41.14) La función de onda para un sistema debe satisfacer la ecuación de Schrödinger. La ecuación de Schrödinger independiente del tiempo para una partícula confinada a moverse a lo largo del eje x es U 2 d 2c 2m dx 2 Uc Ec (41.15) donde U es la energía potencial del sistema y E es la energía total. Cap_41_Serway(2).indd 1207 (continúa) 9/11/08 6:35:36 PM 1208 Capítulo 41 Mecánica cuántica MODELO DE ANÁLISIS PARA RESOLUCIÓN DE PROBLEMAS c c I II 0 III L Partícula cuántica bajo condiciones frontera. Una interacción de una partícula cuántica con su ambiente representa una o más condiciones frontera. Si la interacción restringe la partícula a una región finita del espacio, la energía del sistema está cuantizada. Todas las funciones de onda deben satisfacer las siguientes cuatro condiciones frontera: 1) c(x) debe permanecer finita conforme x tiende a 0; 2) c(x) debe tender a cero conforme x tiende a ; 3) c(x) debe ser continua para todos los valores de x y 4) dc/dx debe ser continua para todos los valores finitos de U(x). Si la solución a la ecuación 41.15 es por partes, debe aplicar las condiciones 3) y 4) a las fronteras entre regiones de x en las que se ha resuelto la ecuación 41.15. Preguntas O indica pregunta complementaria. 1. ¿Cuál es la importancia de la función de onda c? 2. O La probabilidad de encontrar cierta partícula cuántica en la sección del eje x entre x 4 nm y x 7 nm es 48%. La función de onda de la partícula c(x) es constante en este intervalo. i) ¿Qué valor numérico se puede atribuir a c(x)? a) 0.48, b) 0.16, c) 0.12, d) 0.69, e) 0.40, f) 0.35. ii) ¿Cuál es su unidad? a) nm, b) (nm)1/2, c) (nm)1/3, d) (nm)1, e) (nm)1/2, f) (nm)1/3. 3. O i) ¿Cada uno de los siguientes enunciados, del a) al j), es verdadero o falso para un fotón? ii) ¿Cada uno de los enunciados es verdadero o falso para un electrón? Haga una lista de sus respuestas. a) Es una partícula cuántica que se comporta en algunos experimentos como una partícula clásica y en algunos experimentos como una onda clásica. b) Su energía en reposo es cero. c) Su energía en reposo es distinta de cero. d) Porta energía en su movimiento. e) Porta cantidad de movimiento en su movimiento. f) Su movimiento se describe mediante una función de onda que tiene una longitud de onda y satisface una ecuación de onda. g) Para un movimiento unidimensional, la ecuación de onda es 0 2E 0 2E m 0P 0 2 2 0x 0t donde la función de onda E es la magnitud del campo eléctrico, con una ecuación similar para B E/c. h) Para un movimiento unidimensional, la ecuación de onda es U 2 d 2c Uc 2m dx 2 donde E es la energía constante. 2 intermedio; 3 desafiante; Cap_41_Serway(2).indd 1208 Ec i) La intensidad de la onda es proporcional al cuadrado de su función de onda. j) La intensidad de la onda se mide a partir de la proporción a la que las partículas cuánticas bombardean un detector. 4. O Una partícula cuántica de masa m1 está en un pozo cuadrado con paredes infinitamente altas y 3 nm de longitud. Clasifique, las situaciones de la a) a la e) de acuerdo con la energía de mayor a menor de la partícula y note cualquier caso de igualdad. a) La partícula de masa m1 está en el estado fundamental del pozo. b) La misma partícula está en el estado excitado n 2 del mismo pozo. c) Una partícula con masa 2m1 está en el estado fundamental del mismo pozo. d) Una partícula de masa m1 está en el estado fundamental de un pozo de 6 nm de longitud. e) Una partícula de masa m1 está en el estado fundamental de un pozo de 3 nm de longitud y el principio de incertidumbre se ha vuelto inoperante; esto es, la constante de Plank se redujo a cero. 5. Para una partícula cuántica en una caja, la densidad de probabilidad en ciertos puntos es cero, como se observa en la figura 41.4b. ¿Implica esto que la partícula no pueda moverse por estos puntos? Explique. 6. Explique la correspondencia entre la energía del estado fundamental y el principio de incertidumbre. 7. O Dos pozos cuadrados tienen la misma longitud. El pozo 1 tiene paredes de altura finita, y el pozo 2 tiene paredes de altura infinita. Ambos pozos contienen partículas cuánticas idénticas, una en cada pozo. i) ¿La longitud de onda de la función de onda del estado fundamental es a) mayor para el pozo 1, b) mayor para el pozo 2 o c) igual para ambos pozos? ii) ¿La magnitud de la cantidad de movimiento del estado fundamental es a) mayor para el pozo 1, b) mayor para el pozo 2 o c) igual para ambos pozos? iii) ¿La energía del estado fundamental de la partícula es a) mayor para el pozo 1, b) mayor para el pozo 2 o c) igual para ambos pozos? razonamiento simbólico; razonamiento cualitativo 9/11/08 6:35:37 PM Problemas 8. ¿Cuál es la ecuación de Schrödinger? ¿Cómo se utiliza para 11. Un filósofo dijo una vez que “es necesario, para la existencia describir fenómenos cuánticos? 9. O Un haz de partículas cuánticas con energía cinética de 2 eV se refleja a causa de una barrera de potencial de ancho pequeño y altura original de 3 eV. ¿Cómo cambia la fracción de las partículas que se reflejan conforme la altura de la barrera se reduce a 2.01 eV? a) Aumenta. b) Disminuye. c) Permanece constante en cero. d) Permanece constante en 1. e) Permanece constante con algún otro valor. 10. O Suponga que una corriente de filtración cuántica en un dispositivo electrónico pasa a través de una barrera de energía potencial. La corriente de filtración cuántica es pequeña porque el ancho de la barrera es grande y la barrera es alta. Para aumentar la corriente más efectivamente, ¿qué debe hacer? a) Reducir el ancho de la barrera. b) Reducir la altura de la barrera. c) Cualquiera de las opciones a) o b) es igualmente efectiva. d) Ninguna de las opciones a) o b) aumenta la corriente. 1209 misma de la ciencia, que las mismas condiciones siempre produzcan los mismos resultados”. En vista de lo que ha estudiado en este capítulo, presente un argumento que demuestre que este enunciado es falso. ¿Cómo podrían cambiarse las palabras del enunciado para que fuera verdadero? 12. En mecánica cuántica es posible que la energía E de una partícula sea menor a la de la energía potencial, pero en la mecánica clásica esto no es posible. Explique por qué. 13. O A diferencia del diagrama idealizado de la figura 41.10, una representativa utilizada por un microscopio de efecto túnel más bien está dentada a escala atómica, con varios puntos espaciados de manera irregular. Para tal aguja, ¿la mayor parte de la corriente de efecto túnel se presenta entre la muestra y a) todos los puntos de la punta por igual, b) el punto ubicado de manera más central, c) el punto más cercano a la muestra o d) el punto más alejado de la muestra? Problemas Sección 41.1 Una interpretación de la mecánica cuántica 1. Un electrón libre tiene una función de onda c 1x2 Ae i 15.00 1010x2 donde x está en metros. Encuentre a) su longitud de onda de De Broglie, b) su cantidad de movimiento y c) su energía cinética en electrón volts. 2. La función de onda para una partícula es c 1x 2 B p 1x 2 a 6. 7. a2 2 para a 0 y x . Determine la probabilidad de que la partícula esté situada en algún punto entre x a y x a. 8. 9. Sección 41.2 La partícula cuántica bajo condiciones en la frontera 3. Un electrón está confinado a una región unidimensional en donde la energía de su estado fundamental (n 1) es 2.00 eV. a) ¿Cuál es la longitud L de la región? b) ¿Cuánta energía se necesita para estimular al electrón a su primer estado excitado? 4. Un electrón que tiene una energía de aproximadamente 6 eV se mueve entre paredes infinitamente altas que tienen 1.00 nm de separación. Encuentre a) el número cuántico n para el estado de energía que el electrón ocupa y b) la energía precisa del electrón. 5. Un electrón está contenido en una caja unidimensional de 0.100 nm de longitud. a) Dibuje un diagrama del nivel de energía para el electrón con niveles hasta de n 4. b) Encuentre las longitudes de onda de todos los fotones que 2 intermedio; 3 desafiante; Cap_41_Serway(2).indd 1209 10. 11. pueden ser emitidos por el electrón al hacer transiciones hacia abajo que puedan, en última instancia, llevarlo del estado n 4 al estado n 1. Una esferita de 5.00 g de masa se desliza sobre un alambre horizontal de 20.0 cm de largo. Su rapidez es 0.100 nm/año, así que aparentemente está en reposo. Trate este sistema como una partícula cuántica en un pozo unidimensional con paredes de altura infinita. Calcule el número cuántico del estado descrito. Un láser de rubí emite luz de 694.3 nm. Suponga que la luz de esta longitud de onda se debe a la transición de un electrón en una caja del estado n 2 al estado n 1. Encuentre la longitud de la caja. Un láser emite luz con una longitud de onda l. Suponga que esta luz se debe a la transición de un electrón en una caja de su estado n 2 a su estado n 1. Encuentre la longitud de la caja. La energía potencial nuclear que enlaza protones y neutrones en un núcleo se puede aproximar a veces mediante un pozo cuadrado. Imagine un protón confinado en un pozo cuadrado infinitamente alto con una longitud de 10.0 fm, el diámetro nuclear típico. Calcule la longitud de onda y la energía asociada con el fotón emitido cuando el protón se mueve del estado n 2 al estado fundamental. Identifique la región del espectro electromagnético a la cual pertenece esta longitud de onda. Un protón está confinado a moverse en una caja unidimensional de 0.200 nm de longitud. a) Encuentre la energía más baja posible del protón. b) ¿Qué pasaría si? ¿Cuál es la energía más baja posible de un electrón confinado a la misma caja? c) ¿Cómo puede explicar usted la gran diferencia en los resultados de los incisos a) y b)? Utilice el modelo cuántico de la partícula en una caja para calcular los primeros tres niveles de energía de un neutrón atrapado en razonamiento simbólico; razonamiento cualitativo 9/11/08 6:35:38 PM 1210 Capítulo 41 Mecánica cuántica un núcleo atómico de 20.0 fm de diámetro. Explique si las diferencias en el nivel de energía muestran un orden de magnitud realista. 12. Un fotón con una longitud de onda l es absorbido por un electrón confinado a una caja. En consecuencia, el electrón se mueve del estado n 1 al estado n 4. a) Encuentre la longitud de la caja. b) ¿Cuál es la longitud de onda del fotón emitido en la transición de ese electrón del estado n 4 al estado n 2? 13. Para una partícula cuántica de masa m en el estado fundamental de un pozo cuadrado con longitud L y paredes de altura infinita, la incertidumbre en la posición es Dx L. a) Use el principio de incertidumbre para estimar la incertidumbre en su cantidad de movimiento. b) Porque la partícula permanece dentro de la caja, su cantidad de movimiento promedio debe ser cero. En tal caso su cantidad de movimiento al cuadrado promedio es p2 (Dp)2. Estime la energía de la partícula. Establezca cómo se compara el resultado con la energía de estado fundamental real. 14. Una partícula en un pozo cuadrado infinitamente profundo tiene una función de onda conocida por 2 2px sen a b BL L c2 1x 2 para 0 x L ; de otro modo es cero. a) Determine el valor esperado de x. b) Determine la probabilidad de hallar la partícula cerca de L/2, al calcular la probabilidad de que la partícula se encuentra en el intervalo 0.490L x 0.510L. c) ¿Qué pasaría si? Determine la probabilidad de hallar la partícula cerca de L/4, al calcular la probabilidad de que la partícula se encuentre en el intervalo 0.240L x 0.260L. d) Demuestre que el resultado del inciso a) no contradice los resultados de los incisos b) y c). 15. La función de onda para una partícula confinada a moverse en una caja unidimensional es c 1x 2 A sen a npx b L Utilice la condición de normalización sobre c para demostrar que 2 BL Sugerencia: Debido a que la longitud de la caja es L, la función de onda es cero para x 0 y para x L, de modo que la condición de normalización (ecuación 41.6) se reduce a A L 0 c 0 2 dx 1 0 16. Un electrón está atrapado en un pozo de potencial de profundidad infinita de 0.300 nm de longitud. a) Si el electrón está en su estado fundamental, ¿cuál es la probabilidad de encontrarlo dentro de 0.100 nm de la pared izquierda? b) Identifique la probabilidad clásica de encontrar el electrón en este intervalo y establezca cómo se compara con la respuesta al inciso a). c) Repita los incisos a) y b) si supone que la partícula está en el estado de energía 99. 17. Un electrón en un pozo cuadrado infinitamente profundo tiene una función de onda conocida por c2 1x 2 2 2px b sen a BL L para 0 x L; de otro modo es cero. ¿Cuáles son las posiciones más probables del electrón? Explique cómo identificarlos. 2 intermedio; 3 desafiante; Cap_41_Serway(2).indd 1210 18. Una partícula cuántica en el estado n 1 está en un pozo cuadrado de profundidad infinita con paredes en x 0 y x L. Sea un valor arbitrario de x entre x 0 y x L. a) Encuentre una expresión para la probabilidad, como función de , de que la partícula se hallará entre x 0 y x . b) Dibuje la probabilidad como una función de la variable /L. Seleccione valores de que vayan de 0 a 1.00 en pasos de 0.100. c) Explique porqué la función de probabilidad debe tener valores particulares en /L 0 y en /L 1. d) Encuentre el valor de para el cual la probabilidad de hallar la partícula entre x 0 y x sea el doble de la probabilidad de hallar la partícula entre x y x L. Puede resolver numéricamente la ecuación trascendental para /L. 19. Una partícula cuántica en un pozo cuadrado de profundidad infinita tiene una función de onda conocida por c1 1x 2 2 px sen a b BL L para 0 x L; de otro modo es cero. a) Determine la probabilidad de hallar la partícula entre x 0 y x L/3. b) Utilice el resultado de este cálculo y argumentos de simetría para hallar la probabilidad de encontrar la partícula entre x L/3 y x 2L/3. No evalúe de nuevo la integral. c) ¿Qué pasaría si? Establezca cómo se comparan los resultados del inciso a) con la probabilidad clásica. Sección 41.3 La ecuación de Schrödinger 20. La función de onda de una partícula cuántica es c(x) A cos(kx) B sen(kx) donde A, B y k son constantes. Demuestre que c es una solución de la ecuación de Schrödinger (ecuación 41.15), si la partícula está libre (U 0), y encuentre la energía E correspondiente de la partícula. 21. Demuestre que la función de onda c Aei(kx vt) es una solución a la ecuación de Schrödinger (ecuación 41.13), donde k 2p/l y U 0. 22. En una región del espacio, una partícula con energía total cero tiene una función de c 1x 2 Axe x 2>L2 a) Encuentre la energía potencial U como función de x. b) Haga un dibujo de U(x) con x. 23. Una partícula cuántica de masa m se mueve en un pozo de potencial de longitud 2L. Su energía potencial es infinita para x L y para x L. Dentro de la región L x L, su energía potencial se conoce por U 2x 2 mL 1L 2 x 2 2 U 1x 2 2 Además, la partícula está en un estado estacionario que es descrito por la función de onda c(x) A(1 x 2/L2) para L x L, y por c(x) 0 en todas las demás partes. a) Determine la energía de la partícula en términos de , m y L. Sugerencia: Utilice la ecuación de Schrödinger, ecuación 41.15. b) Demuestre que A a 15 1>2 b 16L c) Determine la probabilidad de que la partícula se encuentre entre x L/3 y x L/3. razonamiento simbólico; razonamiento cualitativo 9/11/08 6:35:39 PM Problemas 24. Considere una partícula cuántica que se mueve en una caja unidimensional en la cual las paredes están en x L/2 y x L/2. a) Escriba las funciones de onda y densidades de probabilidad para n 1, n 2 y n 3. b) Dibuje la función de onda y las densidades de probabilidad. Sugerencia: Haga una analogía para el caso de una partícula en una caja en la cual las paredes están en x 0 y x L. 25. Demuestre que el primer término de la ecuación de Schrödinger, (/2m)(d 2c/dx 2), se reduce a la energía cinética de la partícula cuántica multiplicada por la función de onda a) para una partícula en movimiento libre, con la función de onda conocida por la ecuación 41.4, y b) para una partícula en una caja, con la función de onda conocida por la ecuación 41.13. Sección 41.4 Una partícula en un pozo de altura finita 26. Trace la función de onda c(x) y la densidad de probabilidad |c(x)|2 para el estado n 4 de una partícula cuántica en un pozo de potencial finito. (Véase la figura 41.7.) 27. Suponga que una partícula cuántica está atrapada en su estado fundamental en una caja que tiene paredes infinitamente altas (figura 41.4a). Ahora suponga que la pared de la izquierda se baja de pronto a una altura y ancho finitos. a) Trace cualitativamente la función de onda para la partícula para un tiempo breve posterior. b) Si la caja tiene una longitud L, ¿cuál es la longitud de la onda que penetra la pared izquierda? Sección 41.5 Efecto túnel a través de una barrera de energía potencial 28. Un electrón con energía total E 4.50 eV se aproxima a una barrera rectangular de energía con U 5.00 eV y L 950 pm, como se muestra en la figura P41.28. De acuerdo con la mecánica clásica, el electrón no podría pasar por la barrera porque E U. No obstante, según la mecánica cuántica, la probabilidad de obtener el efecto túnel no es cero. Calcule esta probabilidad, que es el coeficiente de transmisión. Energía L E Electrón x 0 Figura P41.28 Problemas 28, 29 y 31. 29. ¿Qué pasaría si? En el problema 28, ¿en cuánto tendría que aumentar el ancho L de la barrera de potencial, para que la probabilidad de que un electrón incidente de 4.50 eV muestre un efecto túnel a través de la barrera sea de una en un millón? 30. Calcule la probabilidad de transmisión de efecto túnel mecánico cuántico en cada uno de los siguientes casos. a) Un electrón con un déficit de energía de U E 0.010 0 eV incide sobre una barrera de ancho L 0.100 nm. b) Un electrón con un déficit de energía de 1.00 eV incide sobre la misma barrera. c) Una partícula alfa (masa 6.65 1027 kg) con un déficit de energía de 1.00 MeV incide sobre una barrera de 1.00 fm de ancho. d) Una bola de boliche de 8.00 kg con un déficit de energía de 1.00 J incide sobre una barrera de 2.00 cm de ancho. 31. Un electrón con energía cinética E 5.00 eV incide sobre una barrera con un grosor L 0.200 nm y una altura U 10.0 eV 2 intermedio; 3 desafiante; Cap_41_Serway(2).indd 1211 (figura 41.28). ¿Cuál es la probabilidad de que el electrón a) logre el efecto túnel a través de la barrera? b) ¿Será reflejado? 32. Un electrón tiene una energía cinética de 12.0 eV. Si incide sobre una barrera rectangular con una altura de 20.0 eV y un grosor de 1.00 nm, ¿en qué factor aumentaría la probabilidad de que el electrón presente efecto túnel a través de la barrera, suponiendo que absorbe toda la energía de un fotón (con una longitud de onda de 546 nm) de luz verde en el instante en que alcance la barrera)? Sección 41.6 Aplicaciones del efecto túnel 33. Un microscopio de barrido de efecto túnel (STM) puede determinar con precisión las profundidades de formas superficiales, porque la corriente que pasaría por su punta es muy sensible a las diferencias en el ancho de la brecha entre la aguja y la superficie de la muestra. Suponga que en esta dirección la función de onda del electrón cae exponencialmente con una longitud de decaimiento de 0.100 nm; es decir, con C 10.0/nm. Determine la relación entre la corriente cuando la aguja del STM está 0.500 nm sobre la figura superficial y cuando la aguja está a 0.515 nm sobre la superficie. 34. El criterio de diseño para un microscopio de barrido de efecto túnel especifica que debe ser capaz de detectar, en la muestra bajo su aguja, la figura superficial con una diferencia en altura de sólo 0.002 00 nm. ¿Qué cambio porcentual en la transmisión electrónica debe ser capaz de detectar la electrónica del STM para lograr esta resolución? Suponga que el coeficiente de transmisión electrónica es e2CL con C 10.0/nm. Sección 41.7 El oscilador armónico simple Nota: El problema 41 del capítulo 16 del volumen I se puede asignar a esta sección. 35. Demuestre que la ecuación 41.26 es una solución de la ecuación 41.24 con una energía E 12v. 36. La función de onda de un oscilador armónico unidimensional es c U 1211 bx 2 Axe a) Demuestre que c satisface la ecuación 41.22. b) Encuentre b y la energía total E. c) ¿Esta función de onda es para un estado fundamental o para un primer estado excitado? 37. Un oscilador armónico simple cuántico consta de un electrón ligado por una fuerza restauradora proporcional a su posición relativa a cierto punto de equilibrio. La constante de proporcionalidad es 8.99 N/m. ¿Cuál es la longitud de onda más larga de luz que puede excitar el oscilador? 38. a) Normalice la función de onda para el estado fundamental de un oscilador armónico simple. Es decir, aplique la ecuación 41.7 a la ecuación 41.26 y encuentre el valor necesario para la constante B, en términos de m, v y constantes fundamentales. b) Determine la probabilidad de hallar el oscilador en un angosto intervalo d/2 x d/2 alrededor de su posición de equilibrio. 39. Dos partículas con masas m1 y m2, que están unidas por un resorte ligero con una constante de fuerza k, vibran a lo largo de una recta con centros de masa fijos. a) Demuestre que la energía total 1 2 2 m 2u 2 1 2 2 m 1u 1 1 2 2 kx se puede escribir como mu kx , donde u |u1| |u2| es la rapidez relativa de las partículas y m m1m2/(m1 m2) es la masa reducida del sistema. Este resultado demuestra que 1 2 2 1 2 2 razonamiento simbólico; razonamiento cualitativo 9/11/08 6:35:41 PM 1212 Capítulo 41 Mecánica cuántica el par de partículas con vibraciones libres se puede modelar con precisión como una sola partícula que vibra en el extremo de el resorte que tiene fijo su otro extremo. b) Derive la ecuación 1 2 2 kx 1 2 2 mu constante respecto a x. Siga adelante y demuestre que el sistema ejecuta un movimiento armónico simple. Encuentre su frecuencia. 40. La energía total de un sistema formado por una partícula y un resorte, en el que la partícula se mueve con movimiento armónico simple a lo largo del eje x, es E px 2 kx 2 2 2m donde px es la cantidad de movimiento de la partícula y k es la constante del resorte. a) Con el uso del principio de incertidumbre, demuestre que esta expresión también se puede escribir como px 2 E 2 kU 8p x 2 2m K 1 4U U Uv 4 k Bm Uv 2 Problemas adicionales 41. Al mantener una rapidez constante de 0.8 m/s, una canica rueda en una y otra dirección en una caja de zapatos. Haga una estimación del orden de magnitud de la probabilidad de que pueda escapar a través de la pared de la caja por el efecto de túnel cuántico. Exprese las cantidades que tome como datos y los valores que mida o estime para ellos. 42. Una partícula de masa 2.00 1028 kg está confinada a una caja unidimensional de longitud 1.00 1010 m de longitud. Para n 1, ¿cuáles son a) la longitud de onda de la partícula, b) su cantidad de movimiento y c) su energía de estado fundamental? 43. Un electrón está representado por la siguiente función de onda independiente en el tiempo: c 1?x 2? Ae e? Ae ax para x 7 0 para x 6 0 ax a) Trace la función de onda como función de x. b) Trace la densidad de probabilidad que represente la verosimilitud que tiene el electrón de encontrarse entre x y x dx. c) Únicamente un valor infinito de energía potencial puede producir la discontinuidad en la derivada de la función de onda en x 0. A un lado de esta característica argumente que c(x) puede ser una función de onda físicamente razonable. d) Normalice la función de onda. e) Determine la probabilidad de hallar el electrón en algún lugar en el intervalo de: x1 1 2a a x2 1 2a 44. Compruebe que suponer que n 0 para una partícula cuántica en un pozo de potencial infinitamente profundo conduce a una violación del principio de incertidumbre px x /2. 45. Un electrón en un pozo de potencial infinitamente profundo tiene un estado fundamental de 0.300 eV de energía. 2 intermedio; 3 desafiante; Cap_41_Serway(2).indd 1212 R 1k 1 1k 1 k222 k222 donde k1 2p/l1 y k2 2p/l2 son los números de onda para las partículas incidentes y transmitidas. Continúe como sigue. Demuestre que la función de onda c1 Ae ik x Be ik x satisface la ecuación de Schrödinger en la región 1, para x 0. En este caso, Ae ik x representa el haz incidente y Beik x las partículas reflejadas. Demuestre que c2 Ce ik x satisface la ecuación de Schrödinger en la región 2, para x 0. Imponga las siguientes condiciones frontera: c1 c2 y dc1/dx dc2/dx en x 0, para hallar la correspondencia entre B y A. Luego evalúe R B 2/A2. b) Una partícula que tiene una energía cinética E 7.00 eV incide desde una región donde la energía potencial es cero sobre una en la que U 5.00 eV. Encuentre la probabilidad de que sea reflejada y la probabilidad de que sea transmitida. 1 b) Demuestre que la energía mínima del oscilador armónico es Emín a) Demuestre que el fotón emitido en una transición desde el estado n 3 hasta el estado n 1 tiene una longitud de onda de 517 nm que hace luz verde visible. b) Halle la longitud de onda y la región espectral para cada una de las otras cinco transiciones que toma lugar entre los cuatro niveles de energía más bajos. 46. Ciertas partículas que inciden desde la izquierda se comparan con el escalón de energía potencial que se muestra en la figura P41.46. Situado en x 0, el escalón tiene una altura U. Las partículas tienen energía E U. Según la mecánica clásica, sería de esperar que todas las partículas siguieran avanzando, aunque con una menor rapidez. De acuerdo con la mecánica cuántica, una parte de las partículas son reflejadas en el escalón. a) Demuestre que el coeficiente de reflexión R para este caso es 1 1 1 2 Partícula incidente E U U 50 Figura P41.46 Problemas 46 y 47. 47. Ciertas partículas que inciden desde la izquierda se encuentran con un escalón de energía potencial como se muestra en la figura P41.46. El escalón tiene una altura U en x 0 y las partículas tienen una energía E 2U. De manera clásica, todas las partículas pasarían a la región de energía potencial más alta a la derecha. No obstante, según la mecánica cuántica, una parte de las partículas se reflejan en la barrera. Utilice el resultado del problema 46 para determinar la fracción de las partículas incidentes que son reflejadas. (Esta situación es semejante a la reflexión y transmisión parciales de luz que incide en una interfase entre dos medios diferentes.) 48. Un electrón está atrapado en un punto cuántico. El punto cuántico puede ser modelado como una caja unidimensional con paredes rígidas de 1.00 nm de longitud. a) Trace las funciones de onda y densidades de probabilidad para los estados n 1 y n 2. b) Para el estado n 1, calcule la probabilidad de hallar el electrón entre x1 0.150 nm y x2 0.350 nm, donde x 0 es el lado izquierdo de la caja. c) Repita el inciso b) para el estado n 2. d) Calcule las energías en electrón razonamiento simbólico; razonamiento cualitativo 9/11/08 6:35:42 PM Problemas volts de los estados n 1 y n 2. Sugerencia: Para los incisos b) y c), utilice la ecuación 41.5 y tome nota de que 1 sen 2ax 4a 49. Un átomo en un estado excitado de 1.80 eV sobre el estado fundamental permanece en ese estado excitado 2.00 ms antes de pasar al estado fundamental. Encuentre a) la frecuencia y b) la longitud de onda del fotón emitido. c) Encuentre la incertidumbre aproximada en la energía del fotón. 50. Un electrón está confinado a moverse en el plano xy en un rectángulo cuyas dimensiones son Lx y Ly. Es decir, el electrón está atrapado en un pozo de potencial bidimensional que tiene longitudes de Lx y Ly. En esta situación, las energías permitidas del electrón dependen de dos números cuánticos, nx y ny. Las energías permitidas se conocen por 1 2x sen2 ax dx h 2 n x2 a 8m e L x 2 E n y2 L y2 b a) Si Lx Ly L, encuentre las energías de los cuatro niveles más bajos de energía para el electrón. b) Elabore un diagrama del nivel de energía para el electrón, y determine la diferencia de energía entre el segundo estado excitado y el estado fundamental. 51. Para una partícula cuántica descrita por una función de onda c(x), el valor esperado de una cantidad física f (x) asociado con la partícula está definido por 8f 1x 2 9 8x2 9 L2 3 L2 2n2p 2 52. Una partícula está descrita por la función de onda c 1x 2 A cos a • 0 2p x L L b para x L 4 4 ¶ para otros valores de x a) Determine la constante de normalización A. b) ¿Cuál es la probabilidad de que la partícula se encuentre entre x 0 y x L/8 si se mide su posición? Sugerencia: Use la ecuación 41.6. 53. Una partícula tiene una función de onda c 1x 2 2 e μB a 0 x>a para x 7 0 ∂ para x 6 0 a) Encuentre y trace la densidad de probabilidad. b) Encuentre la probabilidad de que la partícula esté en cualquier punto donde x 0. c) Demuestre que c está normalizada, y luego encuentre la probabilidad de que la partícula esté entre x 0 y x a. 54. Una partícula cuántica de masa m está colocada en una caja unidimensional de longitud L. ¿Qué pasaría si? La caja es tan pequeña que el movimiento de la partícula es relativista, de modo que K p2/2m no es válido. a) Deduzca una expresión para ha- 2 intermedio; 3 desafiante; Cap_41_Serway(2).indd 1213 llar los niveles de energía cinética de la partícula. b) Suponga que la partícula se trata de un electrón en una caja de longitud L 1.00 1012 m. Encuentre su energía cinética más baja posible. ¿Cuál es el porcentaje de error de la ecuación no relativista? Sugerencia: Véase la ecuación 39.23. 55. Considere un “cristal” formado por dos núcleos y dos electrones, como se muestra en la figura P41.55. a) Tomando en cuenta todos los pares de interacciones, encuentre la energía potencial del sistema como función de d. b) Si se supone que los electrones están restringidos a una caja unidimensional de longitud 3d, encuentre la energía cinética mínima de los dos electrones. c) Encuentre el valor de d en el cual la energía total es mínima. d) Compare este valor de d con la separación de los átomos en el litio, el cual tiene una densidad de 0.530 g/cm3 y una masa atómica de 7 u. Este tipo de cálculo se puede usar para estimar la densidad de los cristales y de ciertas estrellas. q1 q2 q1 q2 q1 e d d q2 e d Figura P41.55 56. Oscilador armónico simple excitado. La función de onda c *f 1x2 c dx Para una partícula en una caja unidimensional que se prolonga de x 0 a x L, demuestre que 1213 c 1x 2 Bxe 1m v>2U2x 2 es una solución al problema del oscilador armónico simple. a) Encuentre la energía de este estado. b) ¿En qué posición es menos probable encontrarla? c) ¿En qué posiciones es más probable encontrarla? d) Determine el valor de B necesario para normalizar la función de onda. e) ¿Qué pasaría si? Determine la probabilidad clásica de encontrar la partícula en un intervalo de un pequeño ancho d centrado en la posición x 2(/mv)1/2. f) ¿Cuál es la probabilidad real de ubicar la partícula en este intervalo? 57. Normalización de funciones de onda. a) Encuentre la constante de normalización A para una función de onda formada por los dos estados más bajos de una partícula en una caja: c 1x 2 A c sen a px b L 4 sen a 2px bd L b) Una partícula está descrita en el espacio a x a por la función de onda c 1x 2 A cos a px b 2a B sen a px b a Determine la correspondencia entre los valores de A y B necesarios para la normalización. Sugerencia: Utilice la identidad sen 2u 2 sen u cos u. 58. Las funciones de onda normalizadas para el estado fundamental, c0(x), y el primer estado excitado, c1(x), de un oscilador armónico cuántico son c0 1x 2 a a 1>4 b e p ax 2>2 c1 1x 2 a 4a 3 1>4 b xe p ax 2>2 razonamiento simbólico; razonamiento cualitativo 9/11/08 6:35:44 PM 55 1214 Capítulo 41 Mecánica cuántica donde a mv/. Un estado combinado, c01(x), se construye a partir de estos estados: está abierta, el número de electrones que llegan a la pantalla en un segundo es 25.0 veces el número de electrones que llegan a la pantalla por segundo cuando sólo está abierta la número 2. Cuando ambas están abiertas, se genera un patrón de interferencia en donde la interferencia destructiva no está completa. Encuentre la relación entre la probabilidad de que un electrón llegue a una interferencia máxima a la probabilidad de que un electrón llegue a un mínimo de interferencia adyacente. Sugerencia: Utilice el principio de sobreposición. c01 1x 2 1 3 c0 1x 2 c1 1x 2 4 22 El símbolo ⟨q⟩s denota el valor esperado de la cantidad q para el estado cs(x). Calcule los siguientes valores esperados: a) ⟨x⟩0, b) ⟨x⟩1 y c) ⟨x⟩01. 59. Un experimento de difracción electrónica de dos rejillas se realiza con rejillas de anchos desiguales. Cuando sólo la rejilla 1 Respuestas a las preguntas rápidas 41.1 d) La densidad de probabilidad para esta función de onda es c 2 c *c (Aeikx )(Ae ikx ) A2, que es independiente de x. En consecuencia, es igualmente probable que la partícula se encuentre en cualquier valor de x, lo que es consistente con el principio de incertidumbre. Si la longitud de onda se conoce con precisión (de acuerdo con un valor específico de k en la ecuación 41.4), no es posible conocer la posición de la partícula. 41.2 i) a) En la ecuación 41.14, resulta n 1 para la energía del estado fundamental lo cual muestra que la energía es inversamente proporcional a la masa de la partícula. ii), d) La longitud de onda está determinada por la longitud L del pozo. 2 intermedio; 3 desafiante; Cap_41_Serway(2).indd 1214 41.3 c) Según la ecuación 41.14, si L aumenta, todas las energías cuantizadas se hacen más pequeñas. Por lo tanto, los niveles de energía se acercan entre sí. Cuando L se muestra macroscópica, los niveles de energía están tan cerca unos con otros que no puede observase el comportamiento cuantizado. 41.4 d) Las partículas en los tres incisos a), b) y c) son parte de un sistema enlazado. 41.5 a), c), f) Disminuir la altura de la barrera y aumentar la energía de la partícula reduce el valor de C en la ecuación 41.23, lo que aumenta el coeficiente de transmisión en la ecuación 41.22. Reducir el ancho L de la barrera aumenta el coeficiente de transmisión en la ecuación 41.22. razonamiento simbólico; razonamiento cualitativo 9/11/08 6:35:46 PM 42.1 Espectros atómicos de los gases 42.2 Los primeros modelos del átomo 42.3 Modelo de Bohr del átomo de hidrógeno 42.4 Modelo cuántico del átomo de hidrógeno 42.5 Las funciones de onda para el hidrógeno 42.7 El principio de exclusión y la tabla periódica 42.8 Más sobre los espectros atómicos: el visible y el rayo X 42.9 Transiciones espontáneas y estimuladas 42.10 Láser 42.6 Interpretación física de los números cuánticos Esta calle en el distrito Ginza, en Tokio, despliega muchos letreros formados con lámparas de neón de colores brillantes. La luz de estas lámparas tiene su origen en transiciones entre estados de energía cuantizados en los átomos contenidos en las lámparas. En este capítulo se investigarán dichas transiciones. (© Ken Straiton/Corbis) 42 Física atómica En el capítulo 41 se presentaron algunos de los conceptos y técnicas básicas empleadas en la mecánica cuántica, junto con sus aplicaciones en diferentes sistemas unidimensionales. En este capítulo se aplica la mecánica cuántica a los sistemas atómicos. Gran parte del capítulo está enfocado a la aplicación de la mecánica cuántica en el estudio del átomo de hidrógeno. Por diferentes razones es importante comprender el átomo de hidrógeno, que es el sistema atómico más simple: 䊏 El átomo de hidrógeno es el único sistema atómico que puede resolverse en forma exacta. 䊏 La mayor parte de lo aprendido durante el siglo xx respecto al átomo de hidrógeno con su electrón único es aplicable a iones de un solo electrón, tales como He y Li2. 䊏 El átomo de hidrógeno ha demostrado ser un sistema ideal para realizar pruebas precisas de la teoría en comparación con experimentos y para mejorar la comprensión global de la estructura atómica. 䊏 Los números cuánticos utilizados para caracterizar los estados permitidos del hidrógeno también se utilizan para investigar átomos más complejos, y esta descripción permite comprender la tabla periódica de los elementos. Este discernimiento es uno de los más grandes triunfos de la mecánica cuántica. 䊏 Es necesario conocer a fondo los conceptos básicos sobre la estructura atómica, antes de intentar comprender las complejidades de las estructuras moleculares, así como la estructura electrónica de los sólidos. 1215 Cap_42_Serway.indd 1215 9/11/08 6:36:36 PM 1216 Capítulo 42 Física atómica La solución matemática completa de la ecuación de Schrödinger, aplicada al átomo de hidrógeno, proporciona una descripción completa y armónica de las propiedades del átomo. Sin embargo, porque los procedimientos matemáticos requeridos están fuera del alcance de este libro, se omiten muchos de los detalles. Se estudian las soluciones para ciertos estados del hidrógeno, junto con los números cuánticos empleados para caracterizar los diferentes estados permitidos. Además, se explica el significado físico de los números cuánticos y el efecto de un campo magnético en ciertos estados cuánticos. En este capítulo aparece un nuevo concepto físico, el principio de exclusión. Este principio resulta de enorme importancia para entender las propiedades de los átomos con varios electrones, así como la organización de los elementos en la tabla periódica. Por último, se aplican los conocimientos adquiridos de la estructura atómica a fin de describir los mecanismos incluidos en la producción de rayos X y la operación de un láser. 42.1 PREVENCIÓN DE RIESGOS OCULTOS 42.1 ¿Por qué se les llama líneas? La expresión “líneas espectrales” se utiliza muy a menudo para describir la radiación a causa de los átomos. Las líneas son visibles porque la luz atraviesa una rejilla larga y muy estrecha para poder ser separada por longitud de onda. Usted verá muchas referencias a estas “líneas” tanto en física como en química. Espectros atómicos de los gases Como se indicó en la sección 40.1, todos los objetos emiten una radiación térmica, caracterizada por una distribución continua de longitudes de onda. En marcado contraste con este espectro de distribución continua, está el espectro de línea discreto que se observa cuando un gas a baja presión se somete a una descarga eléctrica. (La descarga eléctrica se presenta cuando el gas es sometido a una diferencia de potencial que produce un campo eléctrico mayor que la resistencia dieléctrica del gas.) La observación y el análisis de estas líneas espectrales se conoce como espectroscopia de emisión. Cuando se examina la luz de una descarga de gas con un espectrómetro (véase la figura 38.15), es posible ver que está constituida por algunas líneas brillantes de color sobre un fondo por lo general oscuro. Este espectro de línea discreto difiere en gran medida del arco iris continuo de colores observado cuando se examina un sólido resplandeciente con el mismo instrumento. La figura 42.1a muestra que las longitudes de onda contenidas en un espectro de línea particular son características del elemento que emite la luz. El espectro de línea más simple, que se describe con detalle, es el del átomo de hidrógeno. Porque que no hay dos elementos que tengan el mismo espectro de línea este fenómeno es una técnica práctica y sensible para identificar los elementos que están presentes en muestras desconocidas. Otra forma de la espectroscopia, muy útil para analizar sustancias, es la espectroscopia de absorción. Un espectro de absorción se obtiene al pasar una luz blanca de una fuente continua a través de un gas o una solución diluida del elemento que se está analizando. Un espectro de absorción está constituido por una serie de líneas oscuras sobre- l (nm) 400 500 600 700 500 600 700 H Figura 42.1 a) Espectros de líneas de emisión para el hidrógeno, el mercurio y el neón. b) Espectro de absorción del hidrógeno. Observe que la líneas oscuras de absorción se presentan en las mismas longitudes de onda que las líneas de emisión del hidrógeno en a). (K.W. Whitten, R.E. Davis, M.L. Peck y G.G. Stanley, General Chemistry, 7a. Edición, Belmont, CA, Brooks/ Cole, 2004.) Cap_42_Serway.indd 1216 Hg Ne a) H 400 b) 9/11/08 6:37:01 PM Sección 42.1 puestas al espectro continuo de la fuente de luz, como se muestra en la figura 42.1b para el hidrógeno atómico. El espectro de absorción de un elemento tiene muchas aplicaciones prácticas. Por ejemplo, el espectro continuo de la radiación emitida por el Sol debe pasar a través de los gases más fríos de la atmósfera solar. Las diferentes líneas de absorción observadas en el espectro solar han servido para identificar elementos en la atmósfera del Sol. En los primeros estudios del espectro solar, los científicos descubrieron que ciertas líneas no coincidían con ningún elemento conocido. ¡Se había descubierto un nuevo elemento! Este nuevo elemento fue llamado helio, por la palabra en griego para Sol, helios. El helio fue aislado posteriormente en los gases subterráneos de la Tierra. Con esta técnica los científicos han podido examinar la luz desde otras estrellas, aunque nunca se han detectado elementos distintos de aquellos presentes en la Tierra. La espectroscopia de absorción también ha resultado útil para analizar la contaminación por metales pesados de la cadena alimenticia. Por ejemplo, la primera determinación de altos niveles de mercurio en el atún fue realizada mediante la espectroscopia de absorción atómica. Las emisiones discretas de luz a causa de las descargas de gas se utilizan en los letreros de “neón” como los que aparecen en la fotografía al inicio de este capítulo. El neón, el primer gas utilizado en este tipo de letreros y la causa de su nombre, emite poderosas radiaciones en la región roja del espectro. Como resultado, un tubo de vidrio lleno con gas neón emite una brillante luz roja cuando el voltaje aplicado provoca una descarga continua. Los primeros letreros utilizaban diferentes gases para producir distintos colores, aunque su brillo era por lo general mucho menor. Muchos de los letreros de “neón” actuales contienen vapor de mercurio, que emite una fuerte luz en la región ultravioleta del espectro electromagnético. El interior del tubo de vidrio está cubierto con un material que emite un color en particular al absorber la radiación ultravioleta del mercurio. El color de la luz que emite el tubo depende del material escogido. Las luces fluorescentes domésticas funcionan de la misma manera, con un recubrimiento de material que emite luz blanca en el interior del tubo de vidrio. Entre los años 1860 y 1885, por medio de mediciones espectroscópicas, los científicos acumularon gran cantidad de datos sobre las emisiones atómicas. En 1885, un maestro de escuela suizo, Johann Jacob Balmer (1825-1898), descubrió una ecuación empírica que predecía correctamente las longitudes de onda de cuatro líneas de emisión visibles del hidrógeno: Ha (rojo), Hb (azul-verde), Hg (azul-violeta) y Hd (violeta). La figura 42.2 muestra estas y otras líneas (en la región ultravioleta) en el espectro de emisión del hidrógeno. Las cuatro líneas visibles se presentan en las longitudes de onda de 656.3 nm, 486.1 nm, 434.1 nm y 410.2 nm. El conjunto completo de líneas se conoce como la serie de Balmer. Las longitudes de onda de estas líneas pueden describirse mediante la siguiente ecuación, la cual es una modificación realizada por Johannes Rydberg (1854-1919) a la ecuación original de Balmer: 1 l RHa 1 22 1 b n2 n 3, 4, 5, p (42.1) en donde R H es una constante conocida como la constante de Rydberg. con un valor de 1.097 373 2 107 m1. Los valores enteros de n variaban entre 3 y 6 para producir las cuatro líneas visibles entre 656.3 nm (rojo) y 410.2 nm (violeta). La ecuación 42.1 además describe las líneas ultravioletas del espectro en la serie de Balmer cuando n tiene un valor mayor a n 6. El límite de la serie es la longitud de onda más corta en la serie y corresponde a n → , con una longitud de onda de 364.6 nm, como se muestra en la figura 42.2. Las líneas espectrales observadas coinciden con la ecuación empírica, la ecuación 42.1, dentro de 0.1 por ciento. Otras líneas espectrales del hidrógeno fueron encontradas después del descubrimiento de Balmer. Estos espectros se conocen como las series Lyman, Paschen y Brackett, en honor a sus respectivos descubridores. Las longitudes de onda de estas series se calculan al aplicar las siguientes ecuaciones empíricas: 1 1 b n 2, 3, 4, p RHa1 (42.2) l n2 1 l Cap_42_Serway.indd 1217 RHa 1 32 1 b n2 n 4, 5, 6, p 1217 Espectros atómicos de los gases (42.3) l (nm) 486.1 656.3 364.6 410.2 434.1 Figura 42.2 Serie de Balmer de líneas espectrales para el átomo de hidrógeno, con varias líneas que indican la longitud de onda en nanómetros. (El eje de la longitud de onda horizontal no está a escala.) La línea marcada como 364.6 es la longitud de onda más corta y se encuentra en la región ultravioleta del espectro electromagnético. Las demás líneas se encuentran dentro de la región visible. Serie de Balmer Serie de Lyman Serie de Paschen 9/11/08 6:37:02 PM 1218 Capítulo 42 Física atómica Serie de Brackett 1 l RHa 1 42 1 b n2 n 5, 6, 7, p (42.4) No existe una base teórica para las ecuaciones anteriores; simplemente funcionan. En las cuatro ecuaciones aparece la misma constante RH y las ecuaciones tienen enteros pequeños. En la sección 42.3 se explica el notable logro en la teoría del átomo del hidrógeno que hizo posible obtener una explicación para estas ecuaciones. Stock Montage, Inc. 42.2 JOSEPH JOHN THOMSON Físico inglés (1856–1940) Premio Nobel de física en 1906, Thompson es considerado el descubridor del electrón. Su estudio de la deflexión de los rayos catódicos (electrones) en un campo eléctrico inició el campo de la física de las partículas subatómicas. Electrón Los primeros modelos del átomo En la época de Newton el átomo estaba modelado como un esfera diminuta, dura e indestructible. Si bien este modelo proporcionó una buena base para la teoría cinética de los gases, fue necesario diseñar nuevos modelos cuando los experimentos revelaron la naturaleza eléctrica de los átomos. En 1897, J. J. Thomson estableció la relación carga a masa para los electrones. (Véase la figura 29.14 en la sección 29.3.) El año siguiente propuso un modelo que describe al átomo como una región en la cual una carga positiva está dispersa en el espacio, con electrones incrustados por toda la región, en forma muy similar a las semillas dentro de una sandía o las pasas dentro de un pan (figura 42.3). De esta forma, el átomo como entidad sería eléctricamente neutro. En 1911, Ernest Rutherford (1871-1937), junto con sus estudiantes Hans Geiger y Ernest Marsden, realizó un experimento que demostró que el modelo de Thomson podría no ser correcto. En este experimento proyectaron un haz de partículas alfa con carga positiva (núcleos de helio) hacia una delgada hoja de metal, como objetivo en la figura 42.4a. La mayor parte de las partículas atravesaron la hoja como si se tratara de espacio vacío, pero algunos de los resultados del experimento fueron sorprendentes. Muchas de las partículas desviadas de su trayectoria original se dispersaban en ángulos muy grandes. ¡Algunas partículas incluso eran desviadas hacia atrás, invirtiendo por completo la dirección de su trayectoria! Cuando Geiger informó a Rutherford que algunas de las partículas alfa eran dispersadas hacia atrás, Rutherford escribió: “Fue probablemente el evento más increíble que me ha ocurrido en la vida. Fue casi tan increíble como disparar una bala (de artillería) de 15 pulgadas sobre papel tisú, y que regresara para golpearte”. Estas deflexiones tan grandes no eran predichas por el modelo de Thomson. De acuerdo con este modelo, la carga positiva de un átomo en la hoja de metal se dispersa en un volumen tan grande (todo el átomo) que no existe una concentración de cargas positivas lo suficientemente fuertes para causar deflexiones importantes de las partículas alfa con cargas positivas. Es más, los electrones tienen tan poca masa en comparación con las partículas alfa que tampoco producirían estas grandes dispersiones en ángulos amplios. Rutherford explicó sus sorprendentes resultados al desarrollar un nuevo modelo atómico, que suponía que la carga positiva en el átomo estaba concentrada en una región reducida en comparación con el tamaño de éste. Rutherford llamó a esta concentración de carga positiva el núcleo del átomo. Se hace la suposición de Carga positiva distribuida en todo el átomo Fuente de partículas alfa Objetivo Pantallas de plomo Figura 42.3 Modelo del átomo de Thomson: electrones con carga negativa dentro de un volumen de carga positiva continua. Cap_42_Serway.indd 1218 a) Pantallas de destellos b) Figura 42.4 a) Técnica de Rutherford para observar la dispersión de partículas alfa de una delgada hoja objetivo. La fuente es una sustancia radiactiva que ocurre naturalmente, como el radio. b) Modelo planetario del átomo de Rutherford. 9/11/08 6:37:03 PM Sección 42.3 1219 Modelo de Bohr del átomo de hidrógeno que todos los electrones pertenecientes al átomo se encuentran en un volumen relativamente grande fuera del núcleo. Para explicar la razón por la cual los electrones no son atraídos hacia el núcleo debido a la fuerza de atracción eléctrica, Rutherford los representó moviéndose en órbitas alrededor del núcleo de la misma forma en que los planetas giran alrededor del Sol (figura 42.4b). Por esta causa, con frecuencia el modelo se conoce como el modelo planetario del átomo. Existen dos dificultades básicas con el modelo planetario de Rutherford. Como vio en la sección 42.1, un átomo emite (y absorbe) ciertas frecuencias características de radiación electromagnética y no otras; pero el modelo de Rutherford no puede explicar este fenómeno. La segunda dificultad es que los electrones de Rutherford están sometidos a la aceleración centrípeta. De acuerdo con la teoría del electromagnetismo de Maxwell, las cargas aceleradas de forma centrípeta con una frecuencia ƒ deberían emitir ondas electromagnéticas con una frecuencia ƒ. Por desgracia, este modelo clásico conduce a una predicción de autodestrucción cuando se le aplica al átomo. Conforme el electrón emite, la energía es llevada más allá del átomo, el radio de la órbita del electrón disminuye gradualmente, y su frecuencia de revolución se incrementa. Este proceso conduciría a una frecuencia siempre creciente de la radiación emitida y al colapso final del átomo cuando el electrón se precipita hacia el núcleo (figura 42.5). e “plop” Figura 42.5 Modelo clásico del núcleo del átomo. Debido a que el electrón acelerado emite energía, la órbita decae hasta que éste se precipita hacia el núcleo. 42.3 Modelo de Bohr del átomo de hidrógeno Dado el caso descrito en el final de la sección 42.2, todo estaba listo para que Niels Bohr en 1913 presentara un nuevo modelo del átomo de hidrógeno que evita las dificultades del modelo planetario de Rutherford. Bohr aplicó las nociones de los niveles cuantizados de energía de Planck (sección 40.1) para los electrones atómicos en órbita. La teoría de Bohr fue históricamente importante para el desarrollo de la física cuántica, y parece explicar las series de líneas espectrales descritas por las ecuaciones 42.1 a 42.4. A pesar de que este modelo hoy se considera obsoleto y ha sido completamente reemplazado por una teoría mecánica cuántica probabilística, es posible utilizar este modelo para desarrollar los conceptos de la cuantización de la energía y de la cantidad de movimiento angular como se aplica en sistemas a nivel atómico. Bohr combinó las ideas de la teoría cuántica original de Planck, el concepto de Einstein del fotón, el modelo planetario de Rutherford del átomo y la mecánica newtoniana para llegar a un modelo semiclásico en términos de algunos postulados revolucionarios. Las ideas básicas de la teoría de Bohr, según se aplican al átomo de hidrógeno, son las que siguen: 1. El electrón se mueve en órbitas circulares alrededor del protón bajo la influencia de fuerza eléctrica de atracción, como se muestra en la figura 42.6. 2. Sólo ciertas órbitas del electrón son estables. Cuando está en alguno de estos estados estacionarios, como los llamaba Bohr, el electrón no emite energía en forma de radiación. En consecuencia, la energía total del átomo permanece constante y puede utilizarse la mecánica clásica para describir el movimiento del electrón. El modelo de Bohr afirma que el electrón acelerado de manera centrípeta no emite radiación continua, perdiendo energía y finalmente girando en los núcleos, como predijo la física clásica según el modelo planetario de Rutherford. 3. La radiación es emitida por el átomo cuando el electrón hace una transición de una órbita inicial más energética a una órbita de menor energía. Esta transición no puede visualizarse ni tratarse de manera clásica. En particular, la frecuencia ƒ del fotón emitida en la transición se relaciona con el cambio en la energía del átomo y no es igual a la frecuencia del movimiento orbital del electrón. La frecuencia de la radiación emitida se determina por la expresión de la conservación de energía Ei Ef hf me F e v r (42.5) donde Ei es la energía en el estado inicial, Eƒ es la energía en el estado final, y Ei Eƒ. Además, la energía en un fotón incidente puede ser absorbida por el átomo, pero sólo si el fotón tiene una energía que iguala de manera exacta la diferencia en energía entre un estado permitido del átomo y un estado de energía superior. Cap_42_Serway.indd 1219 e Figura 42.6 Diagrama que representa el modelo de Bohr del átomo de hidrógeno. El electrón girando sólo puede estar en órbitas específicas de radios discretos. 9/11/08 6:37:04 PM 1220 Capítulo 42 Física atómica Foto cortesía de AIP Niels Bohr Library, Margarethe Bohr Collection Una vez ocurrida la absorción, el fotón desaparece y el átomo hace una transición al estado de energía superior. NIELS BOHR Físico danés (1885-1962) Bohr fue un activo participante en el temprano desarrollo de la mecánica cuántica y aportó gran parte de su estructura filosófica. Durante los años 20 y 30 dirigió el Instituto para Estudios Avanzados en Copenhague. El instituto fue un imán para los mejores físicos del mundo y proporcionó un foro para el intercambio de ideas. Cuando Bohr visitó Estados Unidos en 1939 para asistir a una conferencia científica, trajo noticias sobre la fisión del uranio, que había sido observada por Hahn y Strassman en Berlín. Los resultados fueron los cimientos del arma nuclear desarrollada en Estados Unidos durante la Segunda Guerra Mundial. A Bohr se le otorgó el premio Nobel de física en 1922 por su investigación sobre la estructura de los átomos y la radiación emanada por éstos. 4. El tamaño de la órbita permitida del electrón queda determinado por una condición impuesta sobre la cantidad de movimiento angular orbital del electrón: las órbitas permitidas son aquellas para las cuales la cantidad de movimiento angular orbital del electrón en relación con el núcleo se cuantiza y es igual a un múltiplo entero de h/2p, m evr nU n 1, 2, 3, p (42.6) donde me es la masa del electrón, v la rapidez del electrón en su órbita y r es el radio orbital. La suposición 3 implica cualitativamente la existencia de un espectro de línea de emisión característico discreto y también un correspondiente espectro de línea de absorción del tipo que se muestra en la figura 42.1 para el hidrógeno. Con estas cuatro suposiciones, se calculan los niveles de energía permitidos y los valores cuantitativos de las longitudes de onda de las emisiones del átomo de hidrógeno. La energía potencial eléctrica del sistema que se muestra en la figura 42.6 se conoce por la ecuación 25.13, U ke q 1q 2/r ke e 2/r, donde ke es la constante de Coulomb y el signo negativo surge de la carga –e del electrón. Por lo tanto, la energía total del átomo, la cual está constituida por la energía cinética del electrón y la energía potencial del sistema, es E K U 1 2 2 m ev ke e2 r (42.7) El electrón es una partícula en movimiento circular uniforme, así que la fuerza eléctrica kee 2/r 2 ejercida sobre el electrón debe ser igual al producto de su masa y su aceleración centrípeta (ac v2/r): kee2 r2 v2 m ev 2 r kee2 m er (42.8) Por la ecuación 42.8, la energía cinética del electrón es igual a 1 2 2 m ev K kee2 2r Al sustituir este valor de K en la ecuación 42.7, se encuentra que la energía total del átomo es igual a1 E kee2 2r (42.9) Porque la energía total es negativa, lo que indica un sistema electrón y protón unidos, es necesario adicionarle al átomo energía en la cantidad de kee 2/2r para remover el electrón y hacer que la energía total del sistema sea igual a cero. Para obtener una expresión para r, los radios de las órbitas permitidas, resuelva las ecuaciones 42.6 en función de v2 e igualando los resultados con la ecuación 42.8: v2 rn 1 Cap_42_Serway.indd 1220 n2 U 2 mekee2 n2 U 2 m e 2r 2 n kee2 m er 1, 2, 3, p (42.10) Compare la ecuación 42.9 con su contraparte gravitacional, la ecuación 13.18. 9/11/08 6:37:04 PM Sección 42.3 Modelo de Bohr del átomo de hidrógeno 1221 La ecuación 42.10 muestra que los radios de las órbitas permitidas tienen valores discretos: están cuantizados. El resultado es con base en la suposición de que el electrón sólo puede existir en ciertas órbitas permitidas determinadas por el entero n. La órbita con el radio más pequeño, llamado el radio de Bohr a 0, corresponde a n 1 y tiene el valor a0 U2 m eke e 2 0.052 9 nm (42.11) Radio de Bohr Radios de órbitas de Bohr para el hidrógeno Energías permitidas del átomo de hidrógeno de Bohr Al sustituir la ecuación 42.11 en la ecuación 42.10 se obtiene la expresión general para el radio de cualquier órbita en el átomo de hidrógeno: rn n 2a 0 n 2 10.052 9 nm2 (42.12) La teoría de Bohr predice el valor del radio de un átomo de hidrógeno con un orden correcto de magnitud, en términos de mediciones experimentales. Este resultado fue un triunfo impactante para la teoría de Bohr. En la figura 42.7 se muestran a escala las primeras tres órbitas de Bohr. La cuantización de los radios de la órbita conduce a la cuantización de la energía. Al sustituir rn n2a 0 en la ecuación 42.9, obtiene En k ee 2 1 a b 2a 0 n 2 n 1, 2, 3, p (42.13) Al insertar valores numéricos a la expresión, se tiene 13.606 eV n2 n 1, 2, 3, p (42.14) Sólo las energías que satisfagan esta ecuación están permitidas. El nivel de energía más bajo, el estado fundamental, tiene n 1 y una energía E1 13.606 eV. El siguiente nivel de energía, el primer estado excitado, tiene n 2 y una energía E2 E1/22 3.401 eV. La figura 42.8 es un diagrama de los niveles de energía, que muestra las energías de estos estados de energía discretos y los números cuánticos n correspondientes. El nivel más alto, corresponde a n (o r ) y E 0. Note cómo las energías permitidas del átomo de hidrógeno difieren de las de la partícula en una caja. Las energías de partícula en una caja (ecuación 41.14) aumenta con n2, de modo que se separan más en energía conforme n aumenta. Por otra parte, las energías del átomo de hidrógeno (ecuación 42.14) varían inversamente con n2, de modo que su separación en energía se vuelve más pequeña conforme n aumenta. La separación entre niveles de energía tiende a cero conforme n tiende a infinito y la energía tiende a cero. La energía cero representa la frontera entre un sistema enlazado de un electrón y un protón y un sistema no enlazado. Si la energía del átomo se eleva del estado fundamental a cualquier energía mayor que cero, el átomo está ionizado. La energía mínima necesaria para ionizar el átomo en su estado fundamental se conoce como energía de ionización. Como puede verse en la figura 42.8, la energía de ionización del hidrógeno en el estado 5 4 3 2 9a 0 4a 0 e a0 Cap_42_Serway.indd 1221 e Primeras tres órbitas del átomo de hidrógeno circulares que predice el modelo de Bohr. 0.544 2 0.850 4 1.512 Serie de Paschen Serie de Balmer 3.401 Serie de Lyman 1 Figura 42.7 E (eV) 0.00 n ENERGÍA En 13.606 Figura 42.8 Diagrama de los niveles de energía para el átomo de hidrógeno. Los números cuánticos están dados a la izquierda y las energías (en electrón volts) a la derecha. Las flechas verticales representan las cuatro transiciones de energía más bajas para cada una de las series espectrales mostradas. Las flechas de colores para la serie de Balmer indican que estas series se presentan en la luz visible. 9/11/08 6:37:06 PM 1222 Capítulo 42 Física atómica fundamental, de acuerdo con los cálculos de Bohr, es de 13.6 eV. Esto ha representado otro logro importante de la teoría de Bohr, ya que había sido medida la energía de ionización para el hidrógeno como 13.6 eV. Las ecuaciones 42.5 y 42.13 pueden utilizarse para calcular la frecuencia del fotón emitido cuando el electrón hace una transición de una órbita exterior a una interior: Frecuencia de un fotón emitido por el hidrógeno Ei f Ef kee2 1 a 2a 0h n f 2 h 1 b n i2 (42.15) Porque la cantidad observada experimentalmente es la longitud de onda, resulta conveniente utilizar c f l y expresar la ecuación 42.15 en función de la longitud de onda: 1 l f c kee2 1 a 2 2a 0hc n f 1 b n i2 (42.16) Un hecho notable es que esta expresión, que es simplemente teórica, es idéntica a la forma general de las correspondencias empíricas descubiertas por Balmer y Rydberg, que aparecen en las ecuaciones 42.1 a 42.4, 1 l PREVENCIÓN DE RIESGOS OCULTOS 42.2 El modelo de Bohr es fantástico, pero … El modelo de Bohr predice correctamente la energía de ionización para el hidrógeno y las características generales del espectro del hidrógeno, pero no toma en cuenta los espectros de átomos más complejos y es incapaz de predecir muchos de los detalles sutiles del espectro del hidrógeno y de otros átomos simples. Experimentos de dispersión muestran que el electrón en un átomo de hidrógeno no se mueve en un círculo plano alrededor del núcleo. Más bien, el átomo es eférico. La cantidad de movimiento angular del átomo en el estado fundamental es cero y no ប. Cap_42_Serway.indd 1222 RHa 1 b n i2 1 n f2 (42.17) siempre que la constante ke e 2/2a 0hc sea igual a la constante de Rydberg, obtenida en forma experimental. No mucho después de que Bohr demostró que estas dos cantidades coinciden con una aproximación de 1%, este trabajo fue reconocido como el logro que coronaba su nueva teoría cuántica del átomo de hidrógeno. Además, Bohr demostró que todas las series espectrales del hidrógeno tienen una interpretación natural en su teoría. Las diferentes series corresponden a las transiciones a diferentes estados finales caracterizados por el número cuántico nf . La figura 42.8 muestra el origen de estas series espectrales como transiciones entre niveles de energía. Bohr extendió de inmediato su modelo para el hidrógeno a otros elementos, en los cuales se habían retirado todos los electrones, menos uno. Estos sistemas tienen la misma estructura que el átomo de hidrógeno, con excepción de la carga nuclear, que es mayor. Se sospechaba la existencia de elementos ionizados, tales como He, Li2 y Be3, en atmósferas estelares ardientes, donde las colisiones atómicas con frecuencia tienen suficiente energía para eliminar por completo uno o más electrones atómicos. Bohr demostró que muchas líneas misteriosas observadas en los espectros del Sol y de varias otras estrellas no podían deberse al hidrógeno, sino que, como predijo correctamente en su teoría, las atribuía simplemente al helio ionizado. En general, el número de protones en el núcleo de un átomo se conoce como número atómico de los elementos y está dado por el símbolo Z. Para describir un solo electrón en órbita alrededor de un núcleo fijo de carga Ze, la teoría de Bohr da rn En 1n 2 2 ke e 2 Z 2 a b 2a 0 n 2 a0 Z n (42.18) 1, 2, 3, p (42.19) Si bien la teoría de Bohr era exitosa en cuanto a que coincidía con algunos resultados experimentales con el átomo de hidrógeno, también sufría de algunas inconsistencias. Una de las primeras indicaciones de que la teoría de Bohr necesitaba modificarse se presentó cuando se emplearon técnicas espectroscópicas mejoradas para examinar las líneas espectrales del hidrógeno. Se descubrió que muchas de las líneas de la serie de Balmer y otras no eran de ninguna manera líneas sencillas. Por el contrario, cada una de ellas era un grupo de líneas muy cercanas entre sí. Además, surgió una dificultad adicional cuando se observó que, en algunas situaciones, ciertas líneas espectrales sencillas se dividían en tres líneas muy cercanas entre sí cuando se colocaba a los átomos en un campo magnético poderoso. Los esfuerzos realizados para explicar estas y otras desviaciones del modelo de Bohr llevaron a modificaciones a la teoría y, con el tiempo, a una teoría de reemplazo que se explica en la sección 42.4. 9/11/08 6:37:07 PM Sección 42.3 Modelo de Bohr del átomo de hidrógeno 1223 Principio de correspondencia de Bohr Cuando se estudió la relatividad se determinó que la mecánica newtoniana es un caso especial de la mecánica relativista y sólo es utilizable cuando v es mucho menor que c. De manera similar, la física cuántica está de acuerdo con la física clásica cuando la diferencia entre los niveles cuantizados se desvanecen. Este principio, establecido por primera vez por Bohr, se llama principio de correspondencia.2 Por ejemplo, considere un electrón que gira alrededor del átomo de hidrógeno con n 10 000. Para estos valores tan grandes de n, las diferencias de energía entre niveles adyacentes tiende a cero y, por tanto, los niveles son prácticamente continuos. En consecuencia, el modelo clásico tiene una precisión razonable al describir el sistema para valores grandes de n. De acuerdo con la imagen clásica, la frecuencia de la luz emitida por el átomo es igual a la frecuencia de revolución de los electrones en sus órbitas alrededor del núcleo. Los cálculos muestran que para n 10 000, esta frecuencia difiere de la calculada por la mecánica cuántica en menos de 0.015%. Pregunta rápida 42.1 Un átomo de hidrógeno está en su estado fundamental. Sobre el átomo inciden muchos fotones, cada uno con una energía de 10.5 eV. ¿Cuál es el resultado? a) el átomo es excitado a un nivel superior permitido, b) el átomo se ioniza o c) los fotones pasan por el átomo sin interactuar. Pregunta rápida 42.2 Un átomo de hidrógeno hace una transición desde el nivel n = 3 al nivel n = 2. Después hace una transición del nivel n = 2 al nivel n = 1. ¿Qué transición da como resultado la emisión de un fotón con una longitud de onda más larga? a) La primera transición, b) la segunda transición o c) ninguna, debido a que las longitudes de onda son las mismas en ambas transiciones. EJEMPLO 42.1 Transiciones electrónicas en el hidrógeno A) El electrón en un átomo de hidrógeno hace una transición del nivel de energía n 2 al nivel fundamental (n 1). Encuentre la longitud de onda y la frecuencia del fotón emitido. SOLUCIÓN Conceptualizar Imagine al electrón en una órbita circular alrededor del núcleo, como en el modelo de Bohr en la figura 42.6. Cuando el electrón realiza una transición hacia un nivel estacionario inferior, emite un fotón con una frecuencia determinada. Categorizar Los resultados se evalúan con ecuaciones desarrolladas en esta sección, así que este ejemplo se clasifica como un problema de sustitución. 1 l Use la ecuación 42.17 para obtener l, con ni 2 y nf 1: l Use la ecuación 34.20 para encontrar la frecuencia del fotón: 4 3R H 3 11.097 f c l RHa 4 1 b 22 1 12 107 m 1 2 3.00 108 m>s 1.22 10 7 m 3R H 4 1.22 2.47 10 7 m 122 nm 1015 Hz B) En el espacio interestelar se han observado átomos de hidrógeno enormemente excitados, llamados átomos de Rydberg. Encuentre la longitud de onda a la que los radioastrónomos deben sintonizar para detectar señales de electrones que caen del nivel n 273 al nivel n 272. 2 El principio de correspondencia es en realidad el punto de partida del postulado 4 de Bohr respecto a la cuantización de la cantidad de movimiento angular. Para ver cómo surge el postulado 4 del principio de correspondencia, véase de J. W. Jewett, Physics Begins With Another M . . . Mysteries, Magic, Myth, and Modern Physics (Boston, Allyn & Bacon, 1996), pp. 353-356. Cap_42_Serway.indd 1223 9/11/08 6:37:08 PM 1224 Capítulo 42 Física atómica SOLUCIÓN 1 l Use la ecuación 42.17, esta vez con ni 273 y nf 272: l Resuelva para l: RHa 1 n f2 1 b n i2 1 10 8R H 9.88 RHa 1 b 12732 2 1 12722 2 1 10 2 11.097 19.88 8 10 8R H 9.88 107 m 1 2 0.922 m C) ¿Cuál es el radio de la órbita del electrón para un átomo de Rydberg para el que n 273? SOLUCIÓN r 273 Use la ecuación 42.12 para encontrar el radio de la órbita: 12732 2 10.052 9 nm2 3.94 mm ¡Este radio es suficientemente grande para que el átomo esté a punto de volverse macroscópico! D) ¿Qué tan rápido se mueve el electrón en un átomo de Rydberg para el que n 273? SOLUCIÓN Resuelva la ecuación 42.8 para la rapidez del electrón: v kee2 B m er 8.02 18.99 B 19.11 109 N # m2>C2 2 11.60 10 31 kg2 13.94 10 10 6 19 C22 m2 3 10 m>s ¿Qué pasaría si? ¿Y si la radiación del átomo de Rydberg en el inciso B) se trata según la teoría clásica? ¿Cuál es la longitud de onda de la radiación emitida por el átomo en el nivel n 273? Respuesta Desde la perspectiva clásica, la frecuencia de la radiación emitida es la de la rotación del electrón alrededor del núcleo. 1 v f T 2pr Calcule esta frecuencia con el periodo definido en la ecuación 42.15: 8.02 103 m>s v f 3.24 108 Hz 2pr 2p 13.94 10 6 m 2 Sustituya el radio y la rapidez de los incisos C) y D): 3.00 108 m>s c 0.926 m l f 3.24 108 Hz Encuentre la longitud de onda de la radiación a partir de la ecuación 34.20: Este valor es menos de 0.5% diferente de la longitud de onda calculada en el inciso B). Como se indicó en el análisis del principio de correspondencia de Bohr, esta diferencia se vuelve incluso menor para valores mayores de n. 42.4 Modelo cuántico del átomo de hidrógeno En la sección anterior se describió la forma en que el modelo de Bohr considera al electrón una partícula en órbita alrededor del núcleo en niveles de energía cuantizados no radiantes. Este planteamiento lleva a un análisis que combina conceptos clásicos y cuánticos. Si bien en algunos resultados experimentales el modelo coincide con éxito, no es capaz de explicar otros resultados. Estas dificultades se eliminan cuando se utiliza un modelo completamente cuántico que incluya la ecuación de Schrödinger, para describir el átomo de hidrógeno. Cap_42_Serway.indd 1224 9/11/08 6:37:08 PM Sección 42.4 z El procedimiento formal para resolver el problema del átomo de hidrógeno es sustituir la función de energía potencial adecuada en la ecuación de Shcrödinger, encontrar soluciones a la ecuación y aplicar condiciones frontera como se hizo para la partícula en una caja del capítulo 41. La función de energía potencial para el átomo de hidrógeno se debe a la interacción eléctrica entre el electrón y el protón: U 1r 2 ke e2 r 0 2c 0y 2 0 2c b 0z 2 Uc Ec Es fácil resolver esta ecuación para el átomo de hidrógeno si las coordenadas rectangulares se convierten a coordenadas polares esféricas, una ampliación de las coordenadas polares planas presentadas en la sección 3.1. En coordenadas polares esféricas, un punto en el espacio se representa por las tres variables r, u y f, donde r es la distancia radial desde el origen, r 1x 2 y 2 z 2. Con el punto representado al extremo de un r̂ vector de posición , como se muestra en la figura 42.9, la coordenada angular u define su posición angular respecto al eje z. Una vez proyectado el vector de posición sobre el plano xy, la coordenada angular f define la posición angular de la proyección (y por lo tanto del punto) respecto al eje x. La conversión de la ecuación de Schrödinger tridimensional independiente del tiempo para c(x, y, z) a la forma equivalente para c (r, u, f) es simple pero muy tediosa, y aquí se omiten los detalles.3 En el capítulo 41 se separó la dependencia con el tiempo de la dependencia con el espacio en la función general de la onda, . En este caso del átomo de hidrógeno se separan las tres variables del espacio al escribir la función de onda como el producto de las funciones de cada variable individual: c 1r, u, f2 P u r y (42.20) donde ke 8.99 109 N m2/C2 la constante Coulomb y r la distancia radial desde el protón (situado en r 0) y el electrón. El procedimiento matemático para el problema del átomo de hidrógeno es más complicado que para una partícula en una caja, porque el átomo es tridimensional y U depende de la coordenada radial r. Si se amplía la ecuación de Schrödinger independiente del tiempo (ecuación 41.15), a coordenadas rectangulares tridimensionales, el resultado es: U 2 0 2c a 2m 0x 2 1225 Modelo cuántico del átomo de hidrógeno f x Figura 42.9 Un punto P en el espacio se localiza por medio S de un vector de posición r . En coordenadas cartesianas, las componentes de este vector son x, y y z. En coordenadas polares esféricas, el punto queda definido por r, es decir, la distancia desde S el origen; u, el ángulo entre r y el eje de las z, y f, el ángulo entre el eje de las x y una proyección de S r sobre el plano xy. R 1r2 f 1u2 g 1f2 De esta manera, la ecuación de Schrödinger, que es una ecuación diferencial parcial tridimensional puede transformarse en tres ecuaciones diferenciales ordinarias: una para R(r), otra para ƒ(u) y una más para g(f). Cada una de estas funciones está sujeta a condiciones frontera. Por ejemplo, R(r) debe permanecer finita conforme r → 0 y r → , y g(f) debe tener el mismo valor que g(f 2p). La función de energía potencial dada en la ecuación 42.20 sólo depende de la coordenada radial r y no de cualquiera de las coordenadas angulares; por lo tanto, sólo aparece en la ecuación para R(r). Como resultado, las ecuaciones para u y f son independientes del sistema particular y sus soluciones son válidas para cualquier sistema que muestre rotación. Cuando se le aplica el conjunto completo de condiciones frontera a las tres funciones, se obtienen tres distintos números cuánticos para cada estado permitido del átomo de hidrógeno, uno para cada ecuación diferencial. Dichos números cuánticos están restringidos a valores enteros y deben corresponder a los tres grados de libertad independientes (tres dimensiones espaciales). El primer número cuántico, asociado con la función radial R(r) de la función ondulatoria completa, es conocido como número cuántico principal y se le asigna el símbolo n. La ecuación diferencial para R(r) lleva a funciones que dan la probabilidad de encontrar el electrón a una cierta distancia radial del núcleo. En la sección 42.5 se describen 3 Las descripciones de las soluciones a la ecuación de Schrödinger para el átomo de hidrógeno están disponibles en libros de física moderna, como en R. A. Serway, C. Moses y C. A. Moyer, Física moderna, 3a. edición, Belmont, CA: Brooks/Cole, 2005. Cap_42_Serway.indd 1225 9/11/08 6:37:09 PM 1226 Capítulo 42 Física atómica dos de estas funciones de ondas radiales. Las energías de los estados permitidos para el átomo de hidrógeno se determinan al relacionar n como Energías permitidas del átomo cuántico de hidrógeno PREVENCIÓN DE RIESGOS OCULTOS 42.3 Sólo en el caso del hidrógeno la energía depende de n La sugerencia en la ecuación 42.21 de que la energía sólo depende del número cuántico n sólo es válida para el átomo de hidrógeno. Para átomos más complicados, se utilizan los mismos números cuánticos desarrollados aquí para el hidrógeno. Los niveles de energía para estos átomos dependerán principalmente de n, pero lo harán en menor grado de otros números cuánticos. Restricciones a los valores de los números cuánticos del átomo de hidrógeno En Los números cuánticos definen un sistema Es común asignar los números cuánticos a un electrón. Sin embargo, recuerde, que estos números cuánticos aparecen de la ecuación de Schrödinger, la cual involucra una función de la energía potencial para el sistema del electrón y del núcleo. Por lo tanto, es más correcto asignar los números cuánticos al átomo, pero es más popular asignarlos a un electrón. Aquí se sigue esta última práctica, ya que es la más común. ke e 2 1 b 2a 0 n 2 13.606 eV n2 n 1, 2, 3, p (42.21) Este resultado está perfectamente de acuerdo con el obtenido en la teoría de Bohr (ecuaciones 42.13 y 42.14). Esta coincidencia es extraordinaria porque la teoría de Bohr y la teoría cuántica completa llegan al resultado desde puntos de partida completamente diferentes. El número cuántico orbital, simbolizado como , resulta de la ecuación diferencial para f(u) y se asocia con el movimiento angular orbital del electrón. El número cuántico orbital magnético m resulta de la ecuación diferencial para g(f). Tanto como m son enteros. En la sección 42.6 se amplía el análisis de estos dos números cuánticos y también se presenta un cuarto número cuántico (no entero), resultado de un tratamiento relativístico del átomo de hidrógeno. La aplicación de las condiciones frontera de las tres partes de una función ondulatoria completa lleva a correspondencias importantes entre los tres números cuánticos, como también a ciertas restricciones respecto a sus valores: Los valores de n son enteros que pueden ir de 1 a Los valores de son enteros que pueden ir de 0 a n 1 PREVENCIÓN DE RIESGOS OCULTOS 42.4 a Los valores de m son enteros que pueden ir de a Por ejemplo, si n 1, sólo están permitidos 0 y m 0. Si n 2, puede ser 0 o 1; si 0, en tal caso m 0; pero si 1, entonces m puede ser 1, 0 o 1. La tabla 42.1 resume las reglas para determinar los valores permitidos de y m para una n determinada. Por razones históricas, se dice que todos los estados que tengan el mismo número cuántico principal forman una capa. Las capas se identifican por las letras K, L, M, . . . , que designan los estados para los cuales n 1, 2, 3, . . . . De igual manera, se dice que todos los estados que tengan los mismos valores de n y de forman una subcapa. Las letras4 s, p, d, f, g, h, . . . se utilizan para designar las subcapas para las cuales 0, 1, 2, 3, . . . . Por ejemplo, el estado designado como 3p tiene los números cuánticos n 3 y 1; el estado 2s tiene los números cuánticos n 2 y 0. Estas notaciones se resumen en la tabla 42.2. Aquellos estados que violen las reglas proporcionadas en la tabla 42.1 no existen. (No satisfacen las condiciones frontera de la función ondulatoria.) Por ejemplo, el estado 2d, el cual tendría n 2 y 2, no puede existir, ya que el valor más alto permitido de es n 1, el cual, en este caso, es 1. Por lo tanto, para n 2, los estados 2s y 2p están permitidos, pero 2d, 2f, . . . . no lo están. Para n 3, las subcapas permitidas son 3s, 3p y 3d. TABLA 42.1 Tres números cuánticos para el átomo de hidrógeno Número cuántico n m Nombre Valores permitidos Número de valores permitidos Número cuántico principal Número cuántico orbital Número cuántico orbital magnético 1, 2, 3, . . . Cualquier número 0, 1, 2, . . . , n 1 n , 1, . . . , 0, . . . , 1, 2 1 4 Las primeras cuatro letras provienen de las primeras clasificaciones de las líneas espectrales: nítida, principal, difusa y fundamental. Las letras restantes están en orden alfabético. Cap_42_Serway.indd 1226 9/11/08 6:37:10 PM Sección 42.5 Las funciones de onda para el hidrógeno 1227 TABLA 42.2 Notaciones de capa y subcapas atómicas n Símbolo de capa Símbolo de subcapa 1 K 0 s 2 3 4 5 6 L M N O P 1 2 3 4 5 p d f g h ¿Cuántas subcapas posibles hay para el nivel n 4 del hidrógeno? a) 5, b) 4, c) 3, d) 2 o e) 1. Pregunta rápida 42.3 Cuando el número cuántico principal es n 5, ¿cuántos valores diferentes de a) y b) m son posibles? Pregunta rápida 42.4 EJEMPLO 42.2 El nivel n 2 del hidrógeno Para un átomo de hidrógeno determine los estados permitidos que correspondan al número cuántico principal n 2 y calcule las energías de estos estados. SOLUCIÓN Conceptualizar Piense en el átomo en el estado cuántico n 2. Sólo existe uno de tales estados en la teoría de Bohr, pero la explicación de la teoría cuántica permite más estados debido a los valores posibles de y m. Categorizar Los resultados se evalúan con las reglas explicadas en esta sección, así que este ejemplo se clasifica como un problema de sustitución. A partir de la tabla 42.1, se encuentra que, cuando n 2, puede ser 0 o 1. Encuentre los posibles valores de m en la tabla 42.1: 0 S m 1 S m 0 1, 0 o 1 Por esto se tiene un estado designado como estado 2s, que se asocia con los números cuánticos n 2, 0 y m 0, y se tienen tres estados, designados como estados 2p, para los cuales los números cuánticos son n 2, 1, m 1; n 2, 1, m 0; y n 2, 1, m 1. Encuentre la energía para estos cuatro estados con n 2 a partir de la ecuación 42.21: 42.5 E2 13.606 eV 22 3.401 eV Las funciones de onda para el hidrógeno Ya que la energía potencial del átomo de hidrógeno depende solamente de la distancia radial r entre el núcleo y el electrón, algunos de los estados permitidos para este átomo pueden ser representados mediante funciones de onda que sólo dependen de r. Para estos estados, ƒ(u) y g(f) son constantes. La más simple de las funciones de onda para el hidrógeno es la que describe el estado 1s y se conoce como c1s(r): c1s 1r 2 Cap_42_Serway.indd 1227 1 2pa 0 3 e r>a0 (42.22) Función de onda para el hidrógeno en su estado fundamental 9/11/08 6:37:11 PM 1228 Capítulo 42 Física atómica en donde a0 es el radio de Bohr. (En el problema 19, es posible verificar que esta función satisface la ecuación de Schrödinger.) Observe que c1s tiende a cero conforme r tiende a y se normaliza como se presenta (véase la ecuación 41.7). Además, porque que c1s depende sólo de r, es esféricamente simétrico, esta simetría existe para todos los estados s. Recuerde que la probabilidad de encontrar una partícula en cualquier región es igual a la integral de la densidad de probabilidad 0 c 0 2 para la partícula en toda la región. La densidad de probabilidad para el estado 1s es r 0 c1s 0 2 dr Figura 42.10 Una envolvente esférica con radio r y espesor dr tiene un volumen igual a 4r2dr. a 1 be pa 0 3 2r>a0 (42.23) Ya que en la posición r 0 se supone que el núcleo está fijo en el espacio, se asigna esta densidad de probabilidad a la cuestión de ubicar el electrón. De acuerdo con la ecuación 41.3 la probabilidad de encontrarlo en un elemento de volumen dV es de 0 c 0 2 dV. Resulta conveniente definir la función de densidad de probabilidad radial P(r) como la probabilidad por unidad de distancia radial de encontrar el electrón en una capa esférica de radio r y de espesor dr. Por lo tanto, P(r)dr es la probabilidad de encontrar al electrón en esta capa. El volumen dV de esta capa, infinitesimalmente delgada, es igual a su área superficial 4pr2, multiplicada por el espesor de la capa dr (figura 42.10), de manera que la expresión de esta probabilidad es P 1r2 dr 0 c 0 2dV 0 c 0 24pr 2dr Por lo tanto, la función de densidad de probabilidad radial es P 1r 2 4pr 2 0 c 0 2 (42.24) Al sustituir la ecuación 42.23 en la ecuación 42.24, se obtiene la función de densidad de probabilidad radial para el átomo del hidrógeno en su estado fundamental: Densidad de probabilidad radial para el estado 1s del hidrógeno P1s 1r2 a 4r 2 be a 03 2r>a0 (42.25) En la figura 42.11a aparece una gráfica de la función P1s(r) con r. El pico de la curva corresponde al valor más probable de r para este estado en particular. En el ejemplo 42.3 se muestra que este pico se presenta en el radio de Bohr, la posición radial del electrón en la cual el átomo de hidrógeno se encuentra en su estado fundamental según la teoría de Bohr, otra coincidencia relevante entre la teoría de Bohr y la teoría cuántica. De acuerdo con la mecánica cuántica, el átomo no tiene una frontera definida con precisión, como lo sugiere la teoría de Bohr. La distribución de probabilidades de la figura 42.11a sugiere que la carga del electrón puede ser modelada como si se extendiera a través de una región del espacio, conocida comúnmente como nube electrónica. La figura 42.11b muestra la densidad de probabilidad del electrón en un átomo de hidrógeno en el estado 1s como una función de la posición en el plano xy. La parte más oscura de color azul de la distribución aparece en la posición r a0, lo cual corresponde al valor más probable de r para el electrón. P 1s(r) y r a 0 x a 0 0.052 9 nm r a) b) Figura 42.11 a) La probabilidad de encontrar el electrón como una función de la distancia desde el núcleo del átomo de hidrógeno en el estado 1s (fundamental). Observe que la probabilidad tiene su valor máximo cuando r es igual al radio de Bohr a0. b) Sección transversal en el plano xy de la distribución de carga electrónica esférica del átomo de hidrógeno en su estado 1s. Cap_42_Serway.indd 1228 9/11/08 6:37:12 PM Sección 42.5 EJEMPLO 42.3 Las funciones de onda para el hidrógeno 1229 El estado fundamental del hidrógeno A) Calcule el valor más probable de r para un electrón en el estado fundamental del átomo de hidrógeno. SOLUCIÓN Conceptualizar No imagine al electrón en órbita alrededor del protón como en la teoría de Bohr del átomo de hidrógeno. En vez de ello, imagine que la carga del electrón se dispersa en el espacio alrededor del protón. Categorizar Porque el enunciado del problema solicita el “valor más probable de r”, este ejemplo se clasifica como un problema en que se usa el planteamiento cuántico. (En el átomo de Bohr, el electrón se mueve en una órbita con un valor exacto de r.) Analizar El valor más probable de r corresponde al máximo en la gráfica de P1s(r) con r. El valor más probable de r se puede evaluar al hacer dP1s /dr 0 y resolver para r. d 4r 2 c a 3 be dr a0 dP1s dr Diferencie la ecuación 42.25 e iguale el resultado a cero: e 2r>a 0 d 2 1r 2 dr 2re 2r>a 0 r a0 1 d 1e dr d 0 2r>a 0 2 0 r 2 1 2>a 0 2 e 2r>a 0 0 1r>a 0 2 4e 2r>a 0 0 2r 31 12 Iguale a cero la expresión entre corchetes y resuelva para r: r2 2r>a 0 S 0 r a0 Finalizar ¡El valor más probable de r es el radio de Bohr¡ La ecuación 1) también se satisface en r 0 conforme r → . Estos puntos son ubicaciones de la probabilidad mínima, que es igual a cero, como se vio en la figura 42.11a. B) Calcule la probabilidad de que el electrón en el estado fundamental del hidrógeno se encontrará afuera del primero radio de Bohr. SOLUCIÓN Analizar La probabilidad se encuentra al integrar la función de densidad de probabilidad radial P1s(r) para este estado desde el radio de Bohr a0 hasta . P1s 1r2 dr P Establezca la integral con la ecuación 42.25: 4 a 03 a0 Ponga la integral en forma adimensional al cambiar las variables de r a z 2r/a0 y note que z 2 cuando r a0 y que dr (a0/2) dz: P 4 a 03 a0 P Evalúe la integral con integración parcial (véase el apéndice B.7): Evalúe entre los límites: a P 1 2 102 3 1 2 14 za 0 2 b e 2 z 1 2 2 1z 4 22e a r 2e 2r>a 0 a0 b dz 2 2z 2 4 dr a0 1 2 z 2e z dz 2 22 e z 5e 2 P2 0.677 o 67.7% Finalizar Esta probabilidad es mayor que 50%. La razón para este valor es la asimetría en la función de densidad de probabilidad radial (figura 42.11a), que tiene más área a la derecha del pico que a la izquierda. ¿Qué pasaría si? probable? Cap_42_Serway.indd 1229 ¿Y si se le pidiera el valor promedio de r para el electrón en el estado fundamental, en lugar del valor más 9/11/08 6:37:13 PM 1230 Capítulo 42 Respuesta Física atómica El valor promedio de r es el mismo que el valor esperado para r. Use la ecuación 42.25 para evaluar el valor promedio de r: r prom 8 r9 rP 1r2 dr r a 0 a 4 b a 03 r prom Evalúe la integral con la ayuda de la primer integral mencionada en la tabla B.6 del apéndice B: 0 r 3e 2r>a 0 4r 2 be a 03 2r>a 0 dr dr 0 a 4 3! ba b a 03 12>a 0 2 4 3 2a 0 De nuevo, el valor promedio es mayor que el valor más probable debido a la asimetría en la función de onda, como se ve en la figura 42.11a. La siguiente función de onda más sencilla del átomo de hidrógeno que sigue es la que corresponde al estado 2s (n 2, 0). La función de onda normalizada para este estado es Función de onda para el hidrógeno en el estado 2s 1 422p a 1 3>2 b a2 a0 r be a0 r>2a0 (42.26) De nuevo, c2s depende sólo de r y es esféricamente simétrica. La energía que corresponde a este estado es E 2 (13.606/4) eV 3.401 eV. Este nivel de energía representa el primer estado excitado del hidrógeno. En la figura 42.12 aparece una gráfica de la función de densidad de probabilidad radial para este estado, en comparación con el estado 1s. El trazo correspondiente al estado 2s tiene dos picos. En este caso, el valor más probable corresponde a aquel valor de r que tenga el valor más elevado de P ( 5a 0). Un electrón en el estado 2s se encontrará a una distancia mucho mayor (en promedio) del núcleo que un electrón en el estado 1s. P(r ) 0.6 0.5 c2s 1r2 1s 0.4 0.3 42.6 2s 0.2 0.1 r/a0 0.0 0 4 8 12 16 20 Figura 42.12 Función de densidad de probabilidad radial con r/a0 para los estados 1s y 2s del átomo de hidrógeno. Cap_42_Serway.indd 1230 Interpretación física de los números cuánticos La energía de un estado particular en el átomo de hidrógeno depende del número cuántico principal, n (ecuación 42.21). Ahora, vea que los otros números cuánticos en el modelo atómico correspondan físicamente. El número cuántico orbital Para iniciar esta explicación conviene recordar brevemente el modelo atómico de Bohr. Si el electrón se mueve en un círculo con radio r, la magnitud de su cantidad deSmovimiento angular respecto al centro del círculo es igual a L m evr. La dirección de L es perpendicular al plano del círculo y está definida por la regla de la mano derecha. De acuerdo con la física clásica, la magnitud L de la cantidad de movimiento angular orbital puede tener cualquier valor. Sin embargo, el modelo de Bohr del hidrógeno postula que la magnitud de la cantidad de movimiento angular del electrón está restringida a múltiplos de ; es decir, L n. Es necesario modificar este modelo, ya que predice (de manera incorrecta) que el estado fundamental del hidrógeno tiene una cantidad de movimiento angular igual a 1. Además, si en el modelo de Bohr se considera a L como cero, el electrón debe mostrarse como una partícula que oscila en línea recta a través del núcleo, lo cual es una situación físicamente imposible. Estas dificultades se resuelven con el modelo mecánico cuántico del átomo, aunque debe olvidar la representación mental de un electrón que gira en una trayectoria circular bien definida. A pesar de la ausencia de esta representación, el átomo posee de hecho una cantidad de movimiento angular y se le seguirá llamando cantidad de movimiento angular orbital. De acuerdo con la mecánica cuántica, un átomo en un estado 9/11/08 6:37:14 PM