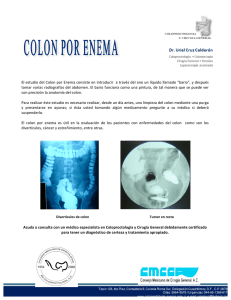
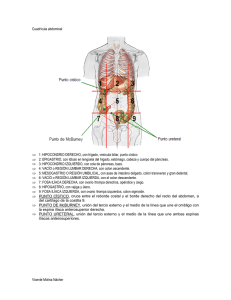
iii. surfactante colonico.
Anuncio

UNIVERSIDAD AUTONOMA DE BARCELONA FACULTAD DE MEDICINA DEPARTAMENTO DE CIRUGIA Vall d'Hebron Hospitals HOSPITAL VALL D’HEBRON SERVICIO DE CIRUGIA GENERAL Y DIGESTIVA BARCELONA 2002 2 EL SURFACTANTE COLONICO Y LA HIDROFOBICIDAD DE SUPERFICIE. PAPEL EN LA BARRERA MUCOSA DEL COLON. Tesis realizada por: D. José Luis Sánchez García para optar al grado de Doctor en Medicina y Cirugía. Dirección de la tesis: Prof. Manuel Armengol Carrasco. Prof. Francisco Guarner Aguilar. 3 D. Manuel Armengol Carrasco, Catedrático de Cirugía de la Universidad Autónoma de Barcelona y Jefe de Servicio de Cirugía General del Hospital Vall d’Hebron de Barcelona y D. Francisco Guarner Aguilar, Doctor en Medicina y especialista en Aparato Digestivo del Hospital Vall D’Hebron de Barcelona CERTIFICAN: Que el trabajo titulado “El surfactante colónico y la hidrofobicidad de superficie. Papel en la barrera mucosa del colon” ha sido realizado bajo su dirección por el licenciado en medicina y cirugía D. JOSE LUIS SANCHEZ GARCIA para optar al grado de Doctor y reúne los requisitos para ser presentado para su lectura y defensa ante el Tribunal correspondiente. Y para que conste a los efectos oportunos, firman el presente certificado en Barcelona, a veinticinco de Enero de dos mil dos. Prof. Manuel Armengol Carrasco Prof. Francisco Guarner Aguilar 4 A mis padres. A Belén, mi hermana. A Mari Angel. 5 AGRADECIMIENTOS 6 Al Profesor Manuel Armengol Carrasco, Catedrático de Cirugía de la Universidad Autónoma de Barcelona y Jefe del Servicio de Cirugía General y del Aparato Digestivo del Hospital Vall d’Hebron de Barcelona. Mi más profundo agradecimiento por haberme permitido participar de sus cualidades científicas, clínicas y humanas durante mi periodo de formación como residente y en la actualidad como cirujano adjunto del servicio que él dirige. La orientación en la elección del tema y la dirección e incansable colaboración durante la elaboración del presente trabajo han sido indispensables para su realización. Al Profesor Francisco Guarner Aguilar, Doctor en Medicina y Cirugía y Médico Adjunto del Servicio de Aparato Digestivo del Hospital Vall d’Hebron de Barcelona por haber aceptado codirigir el presente trabajo ofreciendo infinita disponibilidad y paciencia en la misma. Al Profesor Juan Ramón Malagelada Benaprés, Profesor Titular de Aparato Digestivo de la Universidad Autónoma de Barcelona y Jefe del Servicio de Aparato Digestivo del Hospital Vall d’Hebron por las facilidades ofrecidas y la generosidad demostrada al permitir desarrollar la parte experimental del presente trabajo en el ámbito del servicio que él dirige. 7 A la Doctora Aurelia Lugea, Doctora en Ciencias Biológicas y miembro de la Unidad de Investigación del Servicio de Gastroenterología del Hospital Vall d’Hebron de Barcelona por su entusiasmo incansable, paciencia y dedicación dirigiendo la elaboración inicial del presente trabajo. Al Doctor Felipe de Lara Eisman, Profesor Titular de Cirugía de la Universidad Autónoma de Barcelona y Jefe Clínico del Servicio de Cirugía General y del Aparato Digestivo del Hospital Vall d’Hebron de Barcelona por haberme acogido bajo su tutela durante los primeros pasos en mi formación como cirujano y permitir sentirme miembro de la escuela que en su amplia carrera como cirujano ha creado. Al Dr. José Masferrer Sala, Jefe Clínico del Servicio de Cirugía General y del Aparato Digestivo del Hospital Vall d’Hebron de Barcelona pues aún siendo nuestra relación profesional corta, gracias a la personalidad asequible de la que hace gala, las enseñanzas que de él he recibido en este tiempo han sido intensas y llenas de valor. A los doctores Eloi Espín Basany, Manuel López Cano y Beatriz Sainz Villacampa, Médicos Adjuntos del Servicio de Cirugía General y del Aparato Digestivo del Hospital Vall d’Hebron de Barcelona que desde nuestro periodo de formación han demostrado una sólida amistad que se ha traducido en desinteresado aliento y ayuda a lo largo de todos estos años. A los miembros del equipo médico y de enfermería de planta e instrumentistas del Servicio de Cirugía General y del Aparato Digestivo del Hospital Vall d’Hebron de Barcelona por las facilidades demostradas en la tarea de recoger las muestras de tejido, base de la realización de la presente tesis. 8 A los miembros de la Unidad de Investigación del Servicio de Gastroenterología del Hospital Vall d’Hebron de Barcelona por las facilidades prestadas durante la realización de la fase experimental del presente trabajo. A todos ellos mi más profundo agradecimiento. 9 INDICE 10 INTRODUCCION. 1 FUNDAMENTOS. I. FENOMENOS DE SUPERFICIE. 4 1. Definiciones. 1.1. Tensión superficial. 5 1.2. Tensión interfacial. 6 1.3. Hidrofobicidad, hidrofilicidad y ángulo de contacto. 8 1.4. Relación entre estas propiedades. 10 2. Composición química de las superficies. 10 2.1. Lípidos 11 2.1.1. Lípidos no polares. 2.1.2. Lípidos polares. 2.2. Fosfolípidos 11 3. Métodos de medida. 12 II. APLICACIONES BIOLOGICAS DE LOS FENOMENOS DE SUPERFICIE. 14 1. La piel. 14 2. Los alvéolos pulmonares. 15 III. HIDROFOBICIDAD DE SUPERFICIE A LO LARGO DEL TRACTO DIGESTIVO. 1. Concepto de barrera mucosa gastrointestinal. 17 2. Estructura física de la barrera mucosa gastrointestinal. 18 2.1. Epitelio superficial. 19 2.2. Capa de moco. 21 2.2.1. Núcleo peptídico. 21 2.2.2. Oligosacáridos. 21 2.3. Surfactante gastrointestinal. 23 11 3. Regulación de la secreción del moco y del surfactante gastrointestinal. 3.1. Factor de crecimiento epidérmico. 25 26 3.1.1. Variedades de EGF y péptidos relacionados hallados en el tracto gastrointestinal. 26 3.1.2. Efectos sobre la fisiología gastrointestinal del EGF y los péptidos relacionados. 27 3.1.2.1. Relacionados con la secreción ácida gástrica. 27 3.1.2.2. Relacionados con la secreción de bicarbonato. 28 3.1.2.3. Relacionados con el intercambio de cloruro sódico y glucosa. 28 3.1.2.4. Relacionados con la secreción de cloruros. 28 3.1.2.5. Relacionados con la secreción de amilasa. 28 3.1.2.6. Relacionados con la producción de moco. 29 3.1.2.7. Control del flujo sanguíneo gastrointestinal. 29 3.1.2.8. Relacionados con la contracción del músculo liso gastrointestinal. 29 3.1.2.9. Restitución epitelial mucosa. 29 3.1.3. Modelo integrado de las diferentes acciones que sobre la fisiología del sistema gastrointestinal tienen el EGF y los péptidos con él relacionados 30 3.1.3.1. Digestión, absorción y transporte de nutrientes. 30 3.1.3.2. Protección de la mucosa y su reparación en caso de agresión. 3.2. Prostaglandinas. 31 32 3.2.1.Distribución y funciones de las prostaglandinas.34 3.2.1.1. Sistema nervioso. 35 3.2.1.2. Células sanguíneas y mastocitos. 35 3.2.1.3. Pared vascular. 35 3.2.1.4. Tejido pulmonar. 35 12 3.2.1.5. Riñón. 36 3.2.1.6. Sistema endocrino y reproductor. 36 3.2.2. Acciones de las prostaglandinas en el tracto gastrointestinal. 36 3.2.2.1. Estómago y duodeno. 36 3.2.2.2. Intestino delgado y colon. 37 3.2.2.3. Músculo liso gastrointestinal. 37 3.2.2.4. Protección de la superficie mucosa luminal. 37 IV. HIDROFOBICIDAD EN LOS DISTINTOS TRAMOS DEL TRACTO DIGESTIVO. 1. Esófago. 1.1. Histología. 1.1.1. Características microscópicas de la mucosa. 1.2. Propiedades de superficie en la mucosa esofágica. 38 38 39 2.Estómago. 2.1. Histología. 2.1.1. Estructura microscópica de la mucosa gástrica. 2.2. Propiedades de superficie de la mucosa gástrica. 40 41 42 2.2.1. La hidrofobicidad en la superficie mucosa gástrica. 43 2.2.2. Papel de los lípidos en la hidrofobicidad del moco. 44 2.2.3. Efecto sobre la propiedad de la hidrofobicidad de los distintos agentes ulcerogénicos. 44 2.2.4. Efecto sobre la hidrofobicidad de la superficie mucosa y sobre el metabolismo lipídico de los agentes gastroprotectores. 46 3.Intestino delgado: duodeno, yeyuno e íleon. 3.1. Histología. 3.1.1. Estructura microscópica de la mucosa entérica. 3.2. Propiedades de superficie de la mucosa intestinal. 47 48 50 13 V. PROPIEDADES DE SUPERFICIE A LO LARGO DE LA MUCOSA DEL INTESTINO GRUESO. 1. Anatomía del colon y recto. 52 1.1. Ciego 53 1.2. Colon ascendente 53 1.3. Colon transverso proximal 54 1.4. Colon transverso distal 54 1.5. Colon descendente 54 1.6. Sigma 54 1.7. Recto 55 2. Fisiología del intestino grueso. 2.1. Motilidad. 55 56 2.1.1. Segmentación. 56 2.1.2. Peristaltismo masivo 56 2.1.3. Antiperistaltismo 56 2.2. Absorción. 57 3. Histología de la mucosa del colon y recto. 57 4. Propiedades de superficie en la mucosa colónica. 59 4.1. Adhesividad bacteriana. 61 4.2. Lubrificación de superficies. 62 4.3. Defensa ante la presencia de factores lesivos intraluminales. 63 4.4. Absorción de moléculas desde la luz. OBJETIVOS. 64 65 MATERIAL Y METODO. MATERIAL. I. MUESTRAS DE COLON. 1.Criterios de inclusión. 67 67 14 2. Criterios de exclusión. 68 II. MATERIAL DE LABORATORIO. 1. Instrumental. 68 2. Reactivos. 69 3. Aparatos de lectura. 70 METODO. 71 I. TIEMPO PREOPERATORIO. 73 II. TIEMPO INTRAOPERATORIO. 74 III.TIEMPO DE LABORATORIO. 75 1. Preparación de la muestra. 75 2. Determinación de lípidos y fosfolípidos. 76 2.1. Extracción de lípidos. 77 2.2. Extracción de fosfolípidos. 77 2.3. Determinación de fosfolípidos. 78 3. Determinación de la hidrofobicidad. 79 3.1. Procesamiento de la muestra. 79 3.2. Diluciones. 80 3.3. Incubación de la muestra. 81 3.4. Medida de la hidrofobicidad. 83 IV. RECOGIDA DE DATOS. 84 V. ANALISIS ESTADISTICO DE LOS DATOS. 86 RESULTADOS. I. CARACTERISTICAS EPIDEMIOLOGICAS DE LA POBLACION. 87 II. PROPIEDADES DE SUPERFICIE EN LA MUCOSA DEL COLON. 92 1.Validación del tiempo de isquemia y de la temperatura de conservación de las muestras de mucosa colónica. 92 2. La hidrofobicidad en la superficie de la mucosa colónica. 94 15 3. Hidrofobicidad de la superficie mucosa del colon como propiedad presente y modificable “ex vivo”. 95 4. Influencia de la patología asociada en la hidrofobicidad de la mucosa del colon. 97 5. Hidrofobicidad de la superficie mucosa del colon como propiedad modulable “ex vivo”. 101 5.1. Citoprotección. 101 5.2. Antiinflamatorios no esteroideos. 103 5.2.1. Dosis dependencia. 5.3. Citoprotectores vs. AINE. 106 109 6. Hidrofobicidad en la superficie endoluminal de la mucosa del colon. Estudio topográfico. 111 6.1.División de la superficie colónica en siete segmentos y cuatro sectores. 111 6.2.Comparación entre hidrofobicidades en el colon dividido en siete segmentos. 115 6.3.Comparación entre hidrofobicidades en el colon en los diferentes sectores. 115 6.3.1. Colon derecho 115 6.3.2. Colon transverso 116 6.3.3. Colon izquierdo 116 6.4. Comparación entre hidrofobicidades en el colon dividido en cuatro sectores. III. SURFACTANTE COLONICO. 117 118 1. Lípidos. 118 2. Fosfolípidos. 120 3. Relación entre lípidos y fosfolípidos. 121 4. Relación entre hidrofobicidad y surfactante. 122 16 DISCUSION. 124 I. CARACTERISTICAS DE LAS MUESTRAS. 126 II. CONSERVACION DE LA MUESTRA DE MUCOSA. 127 III. METODO DE MEDIDA DE LA HIDROFOBICIDAD. 127 IV. HIDROFOBICIDAD EN LA SUPERFICIE MUCOSA DEL COLON. 128 V. MODIFICACIONES EN LAS PROPIEDADES DE SUPERFICIE DE LA MUCOSA DEL COLON TRAS SU INCUBACION EN SOLUCION FISIOLOGICA. 129 VI. INFLUENCIA DE LA PATOLOGIA ASOCIADA EN LAS PROPIEDADES DE SUPERFICIE. 130 VII. HIDROFOBICIDAD EN LA SUPERFICIE MUCOSA DEL COLON COMO PROPIEDAD MODULABLE “EX VIVO”. 1. Citoprotectores. 131 2. Antiinflamatorios no esteroideos. 132 VIII. HIDROFOBICIDAD EN LA SUPERFICIE ENDOLUMINAL DE LA MUCOSA DEL COLON HUMANO. ESTUDIO TOPOGRAFICO. IX. SURFACTANTE COLONICO. X. APLICACIONES CLINICAS DE LA PROPIEDAD DE 133 134 LA HIDROFOBICIDAD EN LA SUPERFICIE MUCOSA DEL COLON. 135 1. Neoplasia. 135 2. Enfermedad inflamatoria intestinal. 138 CONCLUSIONES. 142 BIBLIOGRAFIA. 145 17 INTRODUCCION 18 En su cara endoluminal, el tracto digestivo (esófago, estómago, duodeno, intestino delgado, colon y recto) está tapizado a lo largo de toda su extensión por mucosa. Dicha mucosa, aún siendo estructuralmente distinta en los diferentes tramos, tiene una función común a lo largo de todo el tubo digestivo: actúa como barrera para prevenir el paso de agentes lesivos y antígenos desde la luz de dicho tracto al medio interno (sangre y linfa). Esta barrera defensiva no solo está formada por el epitelio mucoso sino que además existe una capa de moco que lo tapiza y que constituye el primer componente de la denominada “barrera mucosa gastrointestinal”. La función como barrera protectora del moco gastrointestinal depende de su composición y estructura siendo ésta, la de una capa viscoelástica con propiedades de gel, formada principalmente por agua y electrolitos, glicoproteinas (mucinas) y fosfolípidos. Los fosfolípidos, estrato más superficial de la barrera, forman complejos con regiones no glicosiladas de las mucinas, estabilizando su estructura y protegiéndolas de la degradación por enzimas proteolíticas. Además, dichos fosfolípidos se disponen formando una monocapa hidrófoba sobre la mucosa, con 19 las cabezas polares unidas a cargas negativas de la capa de moco y las colas hidrófobas hacia la luz. Este estrato es el denominado surfactante gastrointestinal. Un gran número de estudios, sobretodo en tramos altos de la mucosa digestiva, la mucosa gastroduodenal, han demostrado que esta monocapa impide la difusión de iones hidrógeno desde la luz, aumentando así la resistencia de la mucosa al ácido. Así mismo se ha constatado que distintos agentes lesivos como el ácido, etanol, sales biliares, antiinflamatorios y la bacteria Helicobacter pylori reducen la hidrofobicidad de la mucosa haciéndola más susceptible al daño. Pacientes con gastritis crónica, úlcera péptica o reflujo gastroesófagico presentan valores de hidrofobicidad de la mucosa menores que los voluntarios sanos. Así mismo, agentes citoprotectores, como las prostaglandinas, el factor de crecimiento epidérmico (EGF) y los fosfolípidos exógenos, elevan el nivel de fosfolípidos en la capa de moco y aumentan la hidrofobicidad de la mucosa. En la mucosa colónica, la capa de moco forma un gel semipermeable que atrapa bacterias y previene la entrada de antígenos al medio interno. Existen estudios a cerca de las mucinas y su alteración en estados patológicos sugiriéndose que alteraciones en la composición del moco o en su función desempeñan un papel importante en el desarrollo de la enfermedad inflamatoria intestinal (1) Sin embargo, apenas se conoce el contenido en fosfolípidos de esta capa de moco ni las propiedades de hidrofobicidad de la mucosa colónica. Estudios realizados en ratas en nuestro laboratorio mostraron que la hidrofobicidad de la mucosa variaba a lo largo del trayecto colónico, siendo más alta en los tramos del colon distal (2). Estas diferencias podrían estar relacionadas con distintas funciones de permeabilidad de la mucosa a lo largo del colon, así como con la presencia de distintas especies bacterianas. 20 En humanos no se han realizado tan apenas estudios sobre la hidrofobicidad colónica, si bien es conocido el papel que desempeña la capa de moco sobre la permeabilidad y el desarrollo de estados patológicos. El presente trabajo tiene por objeto caracterizar la estructura de la barrera mucosa a nivel del colon y recto en humanos, haciendo hincapié en el surfactante, así como describir algunas de sus propiedades fisicoquímicas y biológicas con el fin de correlacionarlas con los fenómenos clínicos. 21 FUNDAMENTOS 22 I. FENOMENOS DE SUPERFICIE. La materia se puede manifestar en uno de estos tres estados: sólido, líquido o gaseoso. Cada uno de estos tres estados exhibe un conjunto de propiedades que los caracterizan y por tanto diferencian de los otros dos. Estos tres estados, a su vez, pueden relacionarse entre sí apareciendo entonces una serie de propiedades nuevas y distintas que definen esta interrelación. El sustrato físico en el cual se desarrollan estas interrelaciones y que a su vez separa cada uno de los estados fundamentales de la materia se denomina interfase. Esta interfase viene definida por dos o tres fases (sólido, líquido o gas) con sus correspondientes superficies que realmente es donde se describen una serie de propiedades nuevas. Dichas propiedades se manifiestan en forma de lo que conocemos como fenómenos de superficie (3). 23 1. DEFINICIONES. 1.1. TENSION SUPERFICIAL. En una masa líquida, las fuerzas que experimentan las moléculas que forman parte de la superficie son diferentes de las del resto de la masa. Una molécula cualquiera del interior del líquido, la cual se encuentra rodeada por todas partes de moléculas idénticas que ejercen fuerzas sobre ella, está sometida a una fuerza resultante distinta de la que corresponde a una molécula de la superficie, la cual por una parte está próxima a moléculas del líquido idénticas a ella, pero por otra está próxima a las moléculas de otro medio con propiedades diferentes. (Figura 1) Figura 1: Las fuerzas a las que está sometida una molécula de la superficie de un líquido como consecuencia de la acción de las restantes son distintas a las que operan sobre una molécula del interior de la masa líquida. Supongamos que este otro medio no existe y que al otro lado de la superficie libre se encuentra el vacío. Entonces una molécula de líquido, colocada en la superficie, será atraída hacia el interior por el resto de las moléculas, y si no se hunde en el seno de la masa líquida es porque materialmente se lo impiden las demás. Para aumentar la superficie de este líquido se deberían llevar más moléculas al exterior, y para ello se tendría que utilizar una fuerza por molécula por lo menos igual a la que tiende a llevarlas al interior. 24 La fuerza por unidad de longitud que es necesaria realizar es lo denominado como tensión superficial (4). La tensión superficial es una característica del líquido que no se altera aunque la superficie crezca o disminuya. Cuando la superficie tiende a cero como la tensión superficial del líquido se mantiene constante este líquido tiende a adoptar formas que “adapten” su volumen a esta mínima superficie. Esta es la razón por la que las pequeñas gotas de agua en el aire tienen forma esférica: ocupan, para el volumen que poseen, la estructura que presenta menos superficie. La tensión superficial da lugar a fuerzas que operan paralelas a la superficie. Si esta superficie es curvada, dichas fuerzas paralelas a la superficie dan lugar a una presión hacia el interior de la curvatura cuya magnitud viene dada por la ley de Laplace: P=T(1/R1+1/R2) Cuando se trata de una superficie esférica en la cual los dos radios de curvatura son iguales: P=T2/R 1.2. TENSION INTERFACIAL. La tensión superficial de un líquido no solamente depende de éste, sino también del medio con el que se encuentra en contacto que habitualmente es un sólido. La superficie de contacto líquido-sólido tiene una tensión superficial que normalmente es distinta de la que corresponde a la superficie líquido-aire. Además, como las moléculas gaseosas ejercen una atracción muy pequeña sobre las líquidas, la tensión superficial líquido-gas es siempre positiva. En cambio, la 25 tensión líquido-sólido, que se ha denominado tensión interfacial, puede ser positiva (el líquido no moja el sólido) o negativa (sí lo moja). El hecho de que sea negativa, por ejemplo, significa que las moléculas del sólido atraen a las del líquido más que las del líquido entre sí, y por ello el líquido tiende a tener en contacto con el sólido la máxima superficie posible. Al poner una pequeña porción de líquido sobre una plancha de un sólido determinado suele adquirir forma de gota. La superficie del líquido forma, en el contacto con el sólido, un ángulo de conjunción θ , que puede ser menor de 90º (si el líquido no moja al sólido) o mayor de 90º (si el líquido moja al sólido). (Figura 2) θ θ<90º θ θ>90º Figura 2 : Forma de la gota. Considerando que el perímetro de la superficie de contacto, en cualquiera de los casos, es una circunferencia por cada punto de esta circunferencia actúan dos fuerzas: -F1: tensión superficial, tangente a la superficie líquido-aire (TGL) -F2: tensión interfacial, tangente a la superficie líquido-sólido (TSL) El sistema estará en equilibrio cuando la proyección de la tensión superficial, F1’, y la tensión interfacial sean iguales. Es fácil comprobar que esto se verificará cuando: 26 cos θ = TSL/TGL y que de esta manera quedará definida la forma de gota. Como la tensión superficial entre el líquido y el aire (TGL) es siempre positiva, es decir, la atracción entre las moléculas líquido-líquido es más intensa que entre las líquido-sólido, cos θ será positivo, y θ menor que 90º. En cambio, si la tensión interfacial es negativa, es decir, las moléculas del sólido atraen a las del líquido más que las del líquido entre sí, o dicho de otra manera el líquido moja al sólido, cos θ es negativo, y θ mayor de 90º. 1.3. HIDROFILICIDAD, HIDROFOBICIDAD Y ANGULO DE CONTACTO. La hidrofilicidad de una superficie es el término con el que se conoce a la propiedad que caracteriza la afinidad de dicha superficie por el agua. Por el contrario, la hidrofobicidad de una superficie viene definida por la tendencia que tiene un volumen de agua depositado sobre ella a adquirir “forma de gota” más que a extenderse sobre dicha superficie (5). Cuando un pequeño volumen de líquido es depositado sobre una superficie sólida, este adquiere forma de gota. Esta forma, que se identifica como el ángulo de contacto, es la resultante del equilibrio entre las fuerzas de superficie que se dan en el triple punto de la interfase aire-líquido-sólido. Dicho ángulo de contacto tiene una relación inversa con la energía libre de la superficie del sólido. Cuando un mismo líquido (suero salino) es utilizado sobre distintas superficies sólidas con distintas energías de superficie, el ángulo de contacto aumenta si la energía de la superficie del sólido disminuye. 27 Del mismo modo cuando un líquido con menor tensión superficial que el suero salino (glicerol) es depositado sobre la misma superficie sólida, el ángulo de contacto es más cerrado. ( Figura 3) (6) L SL S Figura 3: Vectores El balance de las fuerzas de superficie localizadas en la triple fase viene definida por la ecuación de Young (7): γS = γSL + γL cos θ dónde: γS: energía libre de la superficie sólida. γSL: energía en la interfase sólido-líquido. γL: tensión superficial del líquido. θ: ángulo de contacto entre el líquido y la superficie sólida. 28 1.4. RELACIONES ENTRE ESTAS PROPIEDADES. Cuando una superficie tiene un alto grado de hidrofobicidad los valores del ángulo de contacto serán elevados, pero en cambio serán bajos los valores de tensión superficial que exhiba esta misma superficie. En caso de superficies hidrofílicas sus valores de tensión superficial son altos pero el ángulo de contacto como medida de esta propiedad tenderá a 0º como valor extremo (8). 2. COMPOSICION QUIMICA DE LAS SUPERFICIES. El conjunto de propiedades físicas englobadas como fenómenos de superficie tienen su base en la composición química de dichas superficies. Cuando nos referimos a las interfases del tipo sólido-líquido y tomando como referencia al agua como la parte líquida de dicha interfase las moléculas que forman parte de la superficie sólida se podrían dividir en dos grandes grupos según su afinidad por el agua (9): - Aquellas que tienen una afinidad grande por el agua, denominadas hidrófilas y que se caracterizan por poseer estructura química con grupos polares siendo estos fundamentalmente: -CO2H, -CH2OH, -NH2. - Aquellos que carecen de dicha afinidad, siendo denominados como hidrófobos, con estructura química no polar y siendo fundamentalmente los grupos: -CH3, -NH3. En las superficies biológicas, aún sabiendo que no es exclusivo de ellas, las moléculas que cumplen estas características y por tanto realizan esta función son los lípidos. 29 2.1. LIPIDOS. Siguiendo lo propuesto por Christie en 1987, se define como lípidos a los ácidos grasos y sus derivados así como a toda sustancia relacionada biosintéticamente o funcionalmente con estos. Desde un punto de vista físico los lípidos los podemos dividir en dos grandes grupos. (10) 2.1.1. Lípidos no polares. En este grupo se encontrarían los ácidos grasos esterificados con glicerol que serían los diglicéridos y sobretodo los triglicéridos, con función esencialmente energética y los esteroles y sus esteres cuyo ejemplo fundamental es el colesterol cuya función primordial es estructural como parte imprescindible de las membranas celulares. 2.1.2. Lípidos polares. Dentro de este apartado se englobarían los monogliceridos, los fosfolípidos (fosfatidilcolina, fosfatidiletanolamina y fosfatidilinositol) de vital importancia en la composición y funcionalidad de las membranas celulares, los galactosilglicerolípidos de los vegetales y los esfingolípidos relacionados con la piel (cerámidas) o con el sistema nervioso (esfingomielina). 2.2. FOSFOLIPIDOS. Los fosfolípidos son los lípidos más polares. Su estructura química (3) está formada sobre la base de una molécula de un polialcohol, principalmente el glicerol (CH2OH-CHOH-CH2OH), que se esterifica en un extremo por ácidos grasos y por el otro extremo por una molécula de ácido fosfórico la cual a su vez está esterificada por otra molécula de alcohol. (Figura 4) 30 El extremo fosforilado está cargado siendo fuertemente polar e hidrófilo; a su vez el otro terminal, los ácidos grasos, contrariamente es apolar y por ende hidrófobo. En una interfase con el agua, estos fosfolípidos forman una película a modo de monocapa con las cabezas hidrófilas sobre esta y las colas hidrófobas en situación opuesta. Figura 4: Fosfolípido. 3. METODOS DE MEDIDA. Durante el último siglo han sido descritas numerosas técnicas con el fin de medir la tensión interfacial y la tensión superficial (11). Todos estos métodos se basan en la utilización de principios termodinámicos y las diferencias entre unos y otros son de pequeños detalles en el planteamiento de la técnica de medida propiamente dicha. 31 El conjunto de técnicas se ha propuesto agrupar de la siguiente manera: 1.- Procedimientos relacionados con la medida de fuerzas: 1.1.- Método del aro. (Ringmethod) 1.2.- Método de la lámina. (Platemethod) 1.3.- Método del lazo. (Loopmethod) 2.- Procedimientos relacionados con medidas de presión: 2.1.- Tubos capilares. 2.2.- Máxima presión en burbujas de gas. 3.- Procedimientos geométricos: 3.1.- Método de la gota suspendida. (Pending drop method) 3.2.- Método de la gota sésil. (Sesil drop method) 3.3.- Método del volumen de la gota. 3.4.- Método de la rotación de la gota. (Spinning-drop method) 3.5.- Medida del ángulo de contacto. 4.- Procedimientos dinámicos de medida: 4.1.- Método de las ondas de superficie. 4.2.- Método de la oscilación del “jet” de líquido. De todos estos métodos los más utilizados en la actualidad son los basados en medidas de fuerza sobretodo el método de la lámina y el del aro así como el de rotación de la gota junto al de la medida del ángulo de contacto. 32 II. APLICACIONES BIOLOGICAS DE LOS FENOMENOS DE SUPERFICIE. La presencia de lípidos con propiedades que conllevan el desarrollo de fenómenos de superficie está presente en diferentes partes del organismo humano. Las más representativas serían: - La superficie cutánea. - Los alvéolos pulmonares. - La superficie mucosa endoluminal del tracto digestivo. A continuación haremos una breve reseña a cerca de las dos primeras, dejando para capítulos posteriores la exposición exhaustiva de las características tensoactivas de la mucosa del tubo digestivo ya que esto es el fin del presente trabajo. 1. LA PIEL. La epidermis, capa más superficial de la piel está recubierta en toda su extensión y en su parte más superficial por una superficie lipídica. Esta lamina superficial tiene dos orígenes: uno en los lípidos originados de la destrucción celular, sobretodo a expensas de las membranas celulares, en el 33 continuo ciclo celular en el proceso de renovación de la piel y otro en una sustancia secretada por las glándulas sebáceas, localizadas en la dermis, que se denomina sebo. El sebo es un aceite de características hidrófobas y que está constituido por varios tipos de lípidos: un 59% de triglicéridos (que es el componente principal), un 28% de esteres tipo cera y un 13% de escualeno. La elevada proporción de trigliceridos en la composición del sebo hace que este adquiera propiedades que le confieren una marcada tendencia a extenderse por superficies de características hidrofílicas como lo es la cutánea. Por todo esto la piel exhibe una serie de características que a continuación enumeramos: -Barrera defensiva frente a la penetración de sustancias químicas. -Control en la evaporación del agua a través de la superficie cutánea. -Mecanismo de defensa ante microorganismos presentes en la superficie cutánea como flora de la misma o bien los patógenos potenciales. 2. LOS ALVEOLOS PULMONARES. El funcionamiento pulmonar en lo que se refiere al intercambio gaseoso entre la sangre y el aire está sustentado en la superficie de los aproximadamente 300 millones de alvéolos. Esta superficie de extensión considerable (entre 80 y 100 m2 en el varón adulto) permite la difusión rápida de los gases así como el equilibrio de las presiones parciales a ambos lados de la pared alveolar. Los alvéolos pulmonares tienen un diámetro entre 50 y 100 micras. Están formados por una sola capa de células epiteliales. Estas células no están en contacto directo con el aire alveolar sino que están separadas por una delgadísima capa acelular de un espesor aproximado de una micra que se denomina hipofase. Esta enorme superficie alveolar conlleva varias consecuencias: 34 -Las superficies extensas implican una elevada energía de superficie. Esto implica que la tendencia natural del pulmón sería a retraerse y colapsarse. -Los alvéolos tienen diferentes tamaños con lo que se deduce por la ley de Laplace que la presión que reina en los de menor diámetro es superior a la que existe en los de diámetro mayor. La tendencia sería a compensar este gradiente de presión distendiéndose los de mayor tamaño e expensas de los menores provocando el vaciado de estos últimos en los mayores. -Estos valores elevados de tensión superficial producirían la trasudación de líquido desde la sangre hacia el interior de los alvéolos (12). En 1957 Cléments a partir del estudio de extractos pulmonares pudo de mostrar que el pulmón exhibe unas propiedades de superficie caracterizadas por una tensoactividad realmente elevada de tal manera que la tensión superficial en el alvéolo pulmonar cae a 0 dina/cm-1 cuando el pulmón se colapsa y asciende hasta 50 dina/cm-1 en la reexpansión pulmonar siendo las curvas de presióndescompresión totalmente independientes. Investigaciones posteriores pusieron de manifiesto que estas propiedades tensoactivas en la superficie alveolar pulmonar son debidas básicamente a una delgadísima capa de fosfolípidos, especialmente la dipalmitoilfosfatidilcolina (lecitina), que tapiza uniformemente la interfase aire-hipofase y que se denominó como surfactante pulmonar. Este surfactante esta sintetizado por los neumocitos tipo II presentes en los alvéolos pulmonares y en su composición química entran a formar también parte de él un grupo de apoproteinas y el ion calcio cuyas funciones están relacionadas con la más rápida distribución del fosfolípido por la superficie alveolar con el fin de optimizar sus propiedades (13). 35 III. HIDROFOBICIDAD DE SUPERFICIE A LO LARGO DEL TRACTO DIGESTIVO. 1. CONCEPTO DE BARRERA MUCOSA GASTROINTESTINAL. La barrera mucosa gastrointestinal es una estructura compleja en sus características fisicoquímicas que separa el medio interno de la luz del tubo digestivo (14). El concepto de barrera mucosa fue introducido por Davenport en los años sesenta, y se aplicó originalmente a la mucosa gástrica por su capacidad de repeler y resistir la acidez del medio intraluminal en el estómago (15). Hoy en día, dicho termino se aplica a toda la superficie del tubo digestivo. La luz gastrointestinal presenta condiciones fisicoquímicas y biológicas idóneas para la digestión de los alimentos y para el control y desarrollo de los microorganismos que constituyen el ecosistema de la flora intestinal, pero muchas de esas condiciones (pH ácido, enzimas proteolíticos, sales biliares, ambiente anaerobio, productos bacterianos, etc.) resultan altamente tóxicas para las células del huésped porque se apartan de las constantes requeridas en el medio interno. Es 36 por tanto necesaria la presencia de una estructura de separación entre el medio interno y la luz gastrointestinal, que resulte parcialmente impermeable con lo que permita mantener condiciones fisicoquímicas y biológicas distintas en cada medio, pero que a su vez constituya una interfase apta para el intercambio controlado. 2. ESTRUCTURA FISICA DE LA BARRERA MUCOSA GASTROINTESTINAL. Físicamente, la barrera mucosa gastrointestinal incluye el epitelio superficial, la capa de moco y el surfactante gastrointestinal. (Figura 5) Figura 5: Barrera mucosa gastrointestinal. Esquema. Dicha capa de moco está constituida por un gel formado por la interacción de mucinas y péptidos “trefoil” (péptidos de estructura trifoliada o en trébol) con un espesor variable de hasta 200 µm. Una monocapa constituida por fosfolípidos con propiedades anfóteras denominada surfactante gastrointestinal es la que cubre la superficie de la capa de moco. En términos generales, la barrera mucosa no es obstáculo para el intercambio de productos liposolubles, mientras que resulta prácticamente infranqueable para la inmensa mayoría de las sustancias hidrosolubles, a no ser 37 que por su particular interés para el organismo su transporte través de la mucosa se produzca mediante mecanismos activos específicos. Las propiedades dinámicas de la barrera mucosa dependen también del flujo sanguíneo de la mucosa que suministra oxígeno y nutrientes para mantener la vitalidad y las secreciones de las células mucosas, y facilita el aclaramiento de los elementos tóxicos que logran franquear la barrera. 2.1 EPITELIO SUPERFICIAL. El epitelio superficial está formado por células cilíndricas simples de aspecto columnar. Intercaladas entre ellas encontramos las células caliciformes (goblet cells) que proceden del cuello de las glándulas gástricas o del fondo de las criptas del intestino. Durante un periodo de 3 a 5 días dichas células caliciformes ascienden desde su origen hasta la superficie epitelial. A lo largo de este periodo la célula cambia de forma, reduciendo su volumen y elongándose, así como secretando gránulos de mucina que almacena en vacuolas (16). La proporción de goblet cells en el tracto gastrointestinal se hace mayor conforme nos acercamos a tramos más distales del mismo siendo de un 10% en el duodeno hasta de un 24% de las células epiteliales en el sigma (17). Las células caliciformes (goblet cells), que encontramos en el epitelio de muchas mucosas, son el único ejemplo de glándula exocrina unicelular (esto quiere decir que la glándula está formada por una única célula secretora) presente en los mamíferos. Dichas células secretan mucina que es una glucoproteina. Con la incorporación del agua la mucina se transforma en moco. En una célula caliciforme llena de producto de secreción, la zona apical está distendida por las gotas acumuladas de mucinógeno (el precursor de la mucina), mientras que el núcleo se encuentra en la zona más estrecha y basal de la célula que es fuertemente 38 basófila. La zona apical, ensanchada del citoplasma se denomina teca y la forma de la célula recuerda a un cáliz. Al microscopio electrónico se observan las gotas de mucinógeno rodeadas por membranas. La síntesis de la parte proteica del mucinógeno se produce en los ribosomas del retículo endoplasmico rugoso (RER), mientras que la glicosilación de este núcleo peptídico se realiza en el complejo de Golgi. (Figura 6) Figura 6: Célula caliciforme. Una vez sintetizada completamente la molécula de mucina esta se almacena en forma de gránulos, donde las mucinas están concentradas, rodeados de una membrana y formando vacuolas. La liberación del producto de secreción se realiza por secreción merocrina, esto es vaciando su contenido a la superficie del epitelio mucoso, y es relativamente constante durante toda la vida de la célula, es decir, aproximadamente 3 días en el caso de las células de la mucosa intestinal. Las células caliciformes cumplen entonces solo un ciclo secretor largo (18). 39 2.2. CAPA DE MOCO. El moco es secretado por las células caliciformes. Sus propiedades viscoelásticas y lubrificantes se deben a su estructura de gel, que resulta de la interacción de mucinas y péptidos “trefoil”. Las mucinas son un grupo muy heterogéneo de glucoproteinas constituidas por un núcleo peptídico y múltiples cadenas de oligosacáridos. 2.2.1. NUCLEO PEPTIDICO. La estructura de las mucinas intestinales, así como de las ubicadas en otras zonas del organismo, está formada por un núcleo peptídico (entre 1500 y 4500 aminoácidos) del cual surgen cientos de ramas con estructura de oligosacáridos; estos últimos son moléculas de gran heterogeneidad estructural y comprenden entre el 50% y el 80% del peso seco de la molécula de mucina. La estructura del núcleo peptídico se divide en dos regiones claramente diferenciadas (19): -una mayor, dominante, densamente glicosilada, resistente a las proteasas y rica en los aminoácidos serina, treonina y prolina. -un fragmento menor, pobremente glicosilado o sin glicosilar, sensible a las proteasas y rica en el aminoácido cisteina. 2.2.2. OLIGOSACARIDOS. Excepto en sus extremos N- y C- el núcleo polipeptídico de la mucina está completamente recubierto de cadenas de oligosacáridos las cuales se unen a este con un patrón repetitivo en zonas con serina o treonina. Estas cadenas varían en longitud desde uno a 20 azúcares, aunque en las mucinas del colon la mayor parte de los oligosacáridos tienen de uno a 12 azúcares (20). 40 Además de la N-acetil galactosamina que une las cadenas del péptido, otros azúcares encontrados son la fucosa, N-acetilglucosamina, galactosa y ácido siálico. Los péptidos “trefoil” han sido descritos en años recientes (21). (Figura 7) Figura 7: Péptido trefoil. Se trata de una familia de péptidos caracterizada por la presencia de una secuencia de 38 ó 39 aminoácidos que adquiere una configuración espacial en forma de trébol por medio de tres puentes laterales tipo disulfuro entre 6 residuos de cisteína integrados en la secuencia. El módulo en forma de trebol, también denominado módulo P, parece que determina la resistencia de estos péptidos frente a la digestión por proteasas, que son muy abundantes en la luz gastrointestinal, y facilita su permanencia en la barrera mucosa. En el ser humano en el tracto digestivo superior se producen el péptido pS2 y el spasmolytic polypeptide (SP), mientras que el intestinal trefoil factor (ITF) es producto de las células caliciformes del intestino delgado y grueso. El significado funcional de los distintos péptidos trefoil es prácticamente superponible, puesto que todos ellos contribuyen a la configuración del gel 41 mucoso en conjunción con las mucinas y ejercen un efecto barrera que protege las células epiteliales de las condiciones adversas del medio (22). Los péptidos trefoil son productos tan abundantes como las mucinas en la superficie del tracto gastrointestinal. La capa de moco contribuye con su grosor a crear una franja de separación en la interfase entre el epitelio, que precisa de un ambiente pericelular en condiciones próximas a las del medio interno, y la luz del tubo digestivo. El efecto protector de la capa de moco se debe en parte a la distancia física que se interpone entre el epitelio y el medio intraluminal; así, el grosor del moco retarda la difusión de iones desde la luz a la superficie epitelial (23). Algunos autores (24) sugieren que el papel del moco no es tan trascendente para la prevención de agresiones desde la luz como para la reparación de lesiones agudas en la superficie del epitelio. Debajo de la capa de moco se puede crear y mantener un microclima favorable para el desarrollo de procesos de restitución celular, que requieren condiciones adecuadas de pH, osmolaridad, etc. 2.3. SURFACTANTE GASTROINTESTINAL. El surfactante gastrointestinal es una monocapa constituida fundamentalmente por fosfolípidos con propiedades anfóteras, que cubre la superficie de la capa de moco (25). Esta monocapa tiene características tensoactivas por la cohesión lateral de sus elementos, que determina su disposición espacial en monoplano y su extensión por la superficie del moco estableciendo la interfase moco-luz gastrointestinal (26). El surfactante expresa hacia la luz gastrointestinal su cara hidrófoba y constituye, por tanto, una superficie que repele iones, enzimas, toxinas hidrosolubles y rechaza la retrodifusión de hidrogeniones hacia el epitelio. (Figura 8) 42 H+ H+ + + + + + + Superficie hidrofóbica Superficie hidrofílica Figura 8: Surfactante gastrointestinal. El componente principal del surfactante lo constituyen las fosfatidilcolinas, siendo la dipalmitoilfosfatidilcolina la más abundante. No hay grandes diferencias en su composición entre el surfactante gástrico y el intestinal, y ambos son similares al surfactante pulmonar (27). Se sabe que las prostaglandinas inducen la secreción de fosfolípidos por las células mucosas del epitelio superficial del tracto digestivo. El material surfactante se almacena en organelas celulares especificas y se segrega mediante un mecanismo prostaglandín-dependiente (28). Varios estudios experimentales señalan que el fenómeno de citoprotección está mediado y depende en gran parte de la secreción de fosfolípidos tensoactivos, ya que al aumentar la densidad del surfactante se incrementan considerablemente la impermeabilidad de la barrera y la resistencia de la mucosa (29). 43 3. REGULACION DE LA SECRECION DEL MOCO Y DEL SURFACTANTE GASTROINTESTINAL. Un gran número de sustancias con naturaleza química diversa y agrupadas bajo el término general de secretagogos, son capaces de estimular la secreción de las mucinas y de los fosfolípidos desde las vacuolas dónde están almacenadas intracelularmente hacia la superficie luminal del tracto digestivo. Dicho proceso es relativamente complejo y requiere de dos pasos intermedios desde la llegada de la molécula estimulante de la secreción: - Un receptor específico de cada secretagogo ubicado habitualmente en la membrana celular. - Un mediador, común para diferentes estímulos, intracelular. Las principales sustancias que actúan como secretagogos en la producción de mucina y fosfolípidos en el tracto digestivo se exponen a continuación. (Tabla 1) Tabla 1: Secretagogos en la producción de mucina y fosfolípidos. Neurotransmisores Hormonas Derivados del Miscelánea (30) gastrointestinales •Acetilcolina •Sustancia P •Neurotensina •Péptido •Neuromedina N intestinal (VIP) E1, E2, F2β epidérmico (EGF) •Secretina •Prostaciclina •Toxina colérica ácido araquidónico •Interleuquina 1 vasoactivo •Prostaglandinas •ATP •Factor de crecimiento Tres son los mediadores intracelulares que conducen el estímulo producido por las sustancias antes descritas hasta la secreción de los distintos componentes de la película lipídica que tapiza la superficie luminal del tracto gastrointestinal: el 44 calcio iónico, el AMP cíclico (a través de la proteinquinasa A) y la proteinquinasa C. 3.1. FACTOR DE CRECIMIENTO EPIDERMICO (EGF). En 1962 Cohen y Levi-Montalcini aislan por primera vez de las glándulas salivares submaxilares del ratón un polipéptido de 6 kD que induce la prematura erupción de los dientes y apertura de los párpados (31). Dicho péptido fue denominado como factor de crecimiento epidérmico (EGF) atribuyéndosele la propiedad de producir el crecimiento y la proliferación de numerosos tipos celulares (32). En el tracto gastrointestinal, donde el ciclo celular epitelial es entre 2 y 4 días en los mamíferos, el EGF se ha visto que juega un papel definitivo en la función de proliferación celular (33). Pero no solo el EGF y los péptidos EGF-like desarrollan un papel fundamental en la proliferación y reparación tisular del tracto digestivo; también presentan propiedades que los convierten en mediadores en la protección de la mucosa y su adaptación a las agresiones (34). 3.1.1. VARIEDADES RELACIONADOS DE EGF HALLADOS Y PÉPTIDOS EN TRACTO GASTROINTESTINAL. Tres son los péptidos relacionados con el EGF que se han aislado en el tracto gastrointestinal: TGF-α (transforming growth factor α), la amfiregulina y la betacelulina. Todos estos péptidos tienen en común una secuencia química básica, las propiedades biológicas y su afinidad por el receptor de EGF (erbB1) (35). Lo que realmente diferencia uno de otro es su distribución a lo largo del tracto digestivo siendo los más comúnmente hallados el EGF y el TGF-α. 45 Así, el EGF se encuentra abundantemente en la saliva, el duodeno (secreción procedente de las glándulas de Brunner (36)) y de la secreción pancreática. También se han aislado de la mucosa gástrica, el epitelio vellositario yeyunal, las células epiteliales del colon y de las células de las criptas del intestino delgado fetal (37). A diferencia del EGF, el TGF-α no se encuentra en las secreciones digestivas. La mucosa gastrointestinal es el lugar donde se detecta habiéndose descrito en la gástrica, intestinal, páncreas exocrino y colon. Por último los otros dos péptidos EGF-like menos comunes, la amfiregulina y la betacelulina se han aislado del colon y páncreas el primero y del hígado, intestino delgado y páncreas el segundo. 3.1.2. EFECTOS GASTROINTESTINAL SOBRE DEL EGF LA Y FISIOLOGÍA LOS PÉPTIDOS RELACIONADOS. 3.1.2.1. Relacionados con la secreción ácida gástrica. Tanto en estudios in vitro como in vivo se ha demostrado una acción directa del EGF sobre las células parietales gástricas humanas y de animales de experimentación. Dicha acción se manifiesta en el sentido de producir una reducción de la secreción gástrica ácida basal así como de la secreción ácida estimulada (38). El mecanismo por el cual se produce esta acción no está completamente definido y parece ser que realmente su acción la desarrolla en distintos puntos y en el ámbito de los mediadores intracelulares (c-AMP, calcio iónico, proteinquinasa C). 46 3.1.2.2. Relacionados con la secreción de bicarbonato. Esta regulación se desarrolla en el sentido de un estímulo a la secreción por parte de las glándulas duodenales de bicarbonato. Dicha acción parece estar mediada por el efecto que el EGF tiene sobre la síntesis de la prostaglandina E2 (39). 3.1.2.3. Relacionados con el intercambio de cloruro sódico y glucosa. Varios estudios han puesto de manifiesto el efecto que produce el EGF a nivel del intestino delgado (yeyuno e íleon) en el sentido de incrementar la absorción de agua, cloruro sódico y glucosa a lo largo de su borde en cepillo. Esta propiedad vendría mediada por la activación de la enzima fosfatidilinositol 3kinasa en el borde basolateral del enterocito (40). 3.1.2.4. Relacionados con la secreción de cloro. El efecto que sobre las células del epitelio mucoso colónico produce el EGF pasa por el de inhibir la secreción de cloro hacia la luz. Este efecto está mediado por la activación de la fosfatidilinositol 3-kinasa y la consiguiente producción de fosfolípidos (41). 3.1.2.5. Relacionados con la secreción de amilasa. Además del efecto sobre el transporte de diferentes iones y moléculas a través del epitelio gastrointestinal, se ha visto que el EGF tiene influencia sobre el acino pancreático en su secreción exocrina. Mediado por el cAMP, el EGF no solo incrementa la secreción basal de amilasa sino que también potencia la respuesta del acino al estímulo de la colecistoquinina en dicha secreción (42). 47 3.1.2.6. Relacionados con la producción de moco. Mediante una acción directa sobre las células caliciformes, el EGF induce la síntesis y secreción de mucina. Este estímulo parece que no es directo; así en la mucosa gástrica se ha visto que está mediado por las prostaglandinas y en la del intestino delgado lo es por el sistema colinérgico (43). 3.1.2.7. Control del flujo sanguíneo gastrointestinal. Estudios en perros han demostrado que la administración endovenosa del EGF provoca un rápido incremento en el flujo sanguíneo portal y de la arteria mesentérica superior con una caída de la tensión sanguínea sistémica (44). La aplicación tópica sobre la mucosa gástrica de EGF produce así mismo un incremento del flujo sanguíneo gástrico implicándose esta propiedad como uno de los factores importantes en la defensa de la mucosa frente a la agresión (45). 3.1.2.8. Relacionados con la contracción del músculo liso gastrointestinal. Al igual que en otras partes del organismo (p.e. las arterias coronarias), el EGF y sus péptidos afines actúan sobre la fibra muscular del tracto digestivo. Dicha actividad se manifiesta tanto en el músculo liso circular como longitudinal, en el estómago y en el intestino siendo su acción de estímulo de la contractilidad lo que conlleva una acción estimuladora sobre la motilidad gastrointestinal. 3.1.2.9. Restitución del epitelio de la mucosa. El término restitución hace referencia al fenómeno por el cual una zona del epitelio mucoso dañada es reparada mediante la migración de células epiteliales antes de que se produzca el proceso de proliferación celular (46). Esta propiedad también le ha sido atribuida al EGF. De nuevo parece estar mediada por las prostaglandinas y su base física radica en el aumento de la permeabilidad mucosa que supone la pérdida de las “tight junctions” entre las células. 48 3.1.3. MODELO INTEGRADO DE LAS DIFERENTES ACCIONES QUE SOBRE LA FISIOLOGÍA DEL SISTEMA GASTROINTESTINAL TIENEN EL EGF Y LOS PÉPTIDOS CON ÉL RELACIONADOS. Las propiedades anteriormente descritas para el EGF se agrupan en dos conjuntos desde el punto de vista de su relación con el aparato gastrointestinal: 1. Las relacionadas con la digestión, absorción y transporte de los nutrientes ingeridos. 2. Las relacionadas con la protección de la mucosa y su reparación en caso de agresión. Un tercer grupo de propiedades, indirectamente relacionadas con el sistema gastrointestinal serían las relativas a la proliferación y diferenciación celular. 3.1.3.1. Digestión, absorción y transporte de nutrientes. Tras la ingestión de la comida y su primera digestión en el estómago el EGF procedente de las glándulas salivares y el presente en el torrente sanguíneo actúan de manera que se estimula el vaciamiento gástrico, junto a la disminución de la secreción ácida y el estímulo de la secreción duodenal de bicarbonato lo que incrementa el pH del contenido intestinal. Así mismo se estimula la secreción pancreática de amilasas lo que lleva a la primera digestión de los carbohidratos complejos ingeridos. Todo esto junto al estímulo sobre la motilidad intestinal hace que el contenido duodenal esté a punto para ser asimilado en el siguiente tramo del tubo digestivo: el intestino delgado. En este tramo las propiedades desarrolladas están sobretodo en relación con fenómenos de absorción de sales, agua y carbohidratos. Los mecanismos puestos en práctica son tanto de activación (cotransporte de sodio-glucosa y absorción pasiva de cloruro sódico) como de inhibición (inhibición de la secreción de cloruros). Esta última acción tiene un especial significado en el colon. 49 3.1.3.2. Protección de la mucosa y reparación en caso de agresión. En este apartado no solo se incluirían funciones específicas de la protección de la mucosa como son la activación de la síntesis y secreción de moco y el estímulo de la propiedad de la restitución sino que también tienen un papel fundamental otra serie de acciones que podríamos definir como complementarias y que son la inhibición de la secreción ácida gástrica, el estímulo de la secreción duodenal de bicarbonato y la regulación del flujo sanguíneo gastrointestinal en el sentido de su facilitación. Por todo este conjunto de propiedades interrelacionadas (Tabla 2) que desarrolla el EGF y sus péptidos afines ha sido denominado por algunos autores como “péptido vigía intraluminal” (47). Tabla 2: Interrelación entre las acciones del EGF a nivel del tracto gastrointestinal. PROLIFERACION PROTECCION DIGESTION •Estímulo de la división •Síntesis y secreción de •Activación de la absorción celular. moco de cloruro sódico y glucosa •Restitución del epitelio •Estímulo para la secreción de amilasa •Inhibición de la secreción de cloruro. •Estímulo a la motilidad gastrointestinal. •Inhibición de la secreción ácida gástrica •Estimulación de la secreción de bicarbonato •Aumento del flujo sanguíneo gastrointestinal 50 3.2. PROSTAGLANDINAS. Las prostaglandinas son una familia de sustancias sintetizadas por la transformación enzimática de los ácidos grasos poliinsaturados y que se caracterizan por tener una gran variedad de actividades biológicas de naturaleza reguladora y hormonal. El nombre prostaglandina se debe al fisiólogo sueco U. S. von Euler, que en 1930 aisló una sustancia liposoluble en la próstata, vesículas seminales y suero del semen (48). Actualmente, se conocen numerosas moléculas distintas de prostaglandinas algunas de las cuales se han aislado de diferentes tejidos y otras se han sintetizado en el laboratorio. Dichas sustancias están englobadas en un conjunto que se ha denominado eicosanoides siendo todas ellas derivadas de la transformación enzimática de ácidos grasos poliinsaturados de 20 carbonos, en especial el ácido araquidónico (ácido 5, 8, 11, 14-eicosatetraenoico) que es el precursor más importante (49). (Figura 9) Figura 9: Acido Araquidónico. Los principales grupos de sustancias originadas son: -A partir del proceso de ciclo-oxigenación (50): prostaglandinas, prostaciclina y tromboxanos. 51 -A partir del proceso de lipoxigenación (51): leucotrienos, lipoxinas y anandamidas. A diferencia de otros mediadores celulares, los eicosanoides no se encuentran almacenados en sitios o células especiales sino que su presencia está extendida por todo el organismo en una gran variedad de células. Su aparición y desaparición se realizan con extraordinaria rapidez, en función de la velocidad con que se libera el ácido araquidónico a partir de los fosfolípidos de membrana. Una misma célula puede producir diversos eicosanoides; por eso, la función celular dependerá de la naturaleza del eicosanoide sintetizado, de la naturaleza de la célula donde se sintetiza, y del tipo de célula sobre la que actúa. De ahí que resulte difícil a veces predecir la acción ya que, cuando actúen varios simultáneamente, está dependerá de que las acciones de los diversos eicosanoides liberados se contrarresten o, por el contrario se asocien (52). Entre las características generales (53) de todas estas sustancias destacan las siguientes: -Su síntesis depende de manera muy precisa de estímulos de diversa cualidad: nerviosos, hormonales, mecánicos... -Su acción se circunscribe a las células más próximas a su sitio de origen. -Sus precursores son liberados a partir de los fosfolípidos de membrana por acción del estímulo inicial. -Las reacciones de ciclo-oxigenación y lipooxigenación son estereoespecíficas y autolimitantes. -En el curso de su biosíntesis se generan radicales libres de oxígeno (54) -Su acción consiste con frecuencia en reforzar o antagonizar reacciones celulares ya en marcha, y en sensibilizar a las células frente a los efectos de otros mediadores. -Funcionan como biorreguladores en los procesos de acoplamiento entre estímulo y secreción, involucrándose con frecuencia en el control de la información de nucleótidos cíclicos y de movilización del calcio. 52 El inicio de la biosíntesis es común a todos los eicosanoides. Un estímulo determinado y que puede ser de diversa índole (nervioso, antigénico, traumático, isquémico, peptídico...) provoca en la membrana celular la transformación del fosfolípido fosfatidiletanolamina, presente en la cara interna de la membrana celular, en el fosfolípido fosfatidilcolina que se encuentra en la cara más externa. La consecuencia es un cambio en la fluidez de la membrana y la activación de los enzimas fosfolipasa A2 y C lo que conlleva la producción de ácido araquidónico (55). Posteriormente y centrándonos en la vía de la ciclooxigenasa, enzimas microsomales actúan sobre al ácido araquidónico ciclándolo hacia el anillo ciclopentano y posteriormente oxidándolo (50). La catabolización de los eicosanoides se produce en muy diversos tejidos, recayendo un porcentaje elevado en el tejido dónde fueron sintetizados. El hígado, el riñón y el pulmón actúan además como órganos que metabolizan la fracción que haya podido pasar a la circulación general (56). En cuanto a su mecanismo de acción este se inicia en receptores (57) específicos para cada uno de los eicosanoides y se realiza a través de la acción de segundos mensajeros: cAMP, cGMP y fosfoinosítidos (58). 3.2.1. DISTRIBUCIÓN Y FUNCIONES DE LAS PROSTAGLANDINAS. La distribución de las prostaglandinas por los tejidos es enormemente variable. Dicha variabilidad depende de la especie animal de que se trate, del estado fisiológico o patológico e incluso de la “contaminación” de cada tejido con células de otro origen. Las funciones desarrolladas por estas moléculas son múltiples y de muy diversa índole. Todos los órganos y sistemas de la economía se ven afectados por las acciones que los eicosanoides desempeñan bien directamente sobre ellos o por efectos indirectos como consecuencia de lo desarrollado en otro órgano. 53 3.2.1.1. Sistema nervioso. En múltiples funciones de las que se llevan a cabo tanto en el sistema nervioso central como periférico tienen su importancia estas sustancias. Desde su función en la neurotransmisión cerebral (59), hasta su relación con el sistema adrenérgico pasando por la termorregulación (60) a nivel central y la nocicepción a nivel periférico. 3.2.1.2. Células sanguíneas y mastocitos. Los neutrófilos, las plaquetas, los macrófagos y los basófilos no solo son células diana de los eicosanoides sino que también son una fuente rica de prostaglandinas. Por la función transcendental que estas células desempeñan en los procesos de la inflamación y de la inmunidad inmediata y diferida estos compuestos juegan un especial papel en dichos procesos (61). Acciones de quimiotaxis y en el ámbito de la permeabilidad y el tono microvascular conllevan que las prostaglandinas desempeñen una función determinante en las manifestaciones tanto agudas como crónicas de la inflamación (62). 3.2.1.3. Pared vascular. No solo a nivel de la microcirculación las prostaglandinas desempeñan su función, también lo hacen en los grandes y medianos vasos (dos ejemplos claros son las arterias cerebrales y el ductus arteriosus fetal (63)), actuando como vasodilatadores (64). 3.2.1.4. Tejido pulmonar. Fenómenos de constricción (65) de pequeños y grandes bronquios así como edema de la mucosa de las vías respiratorias hace que los pulmones sean la sede de episodios de inflamación e inmunidad. El mecanismo de liberación de las prostaglandinas es doble; por un lado proceden de los mastocitos del intersticio pulmonar y por otro de la propia pared bronquial. 54 3.2.1.5. Riñón. La acción combinada de distintas prostaglandinas en el riñón se dirige a regular la resistencia vascular renal, facilitar el mantenimiento adecuado de la velocidad de filtración glomerular y del flujo plasmático intrarrenal, manteniendo así el intercambio adecuado de sodio y agua (66). 3.2.1.6. Sistema endocrino y reproductor. Su función se describe como mediadores entre estímulos nerviosos y humorales y la capacidad secretora de las células. Facilitan la secreción de ACTH, hormona del crecimiento y prolactina. Estimulan la producción de esteroides por las suprarrenales, la liberación de insulina y la acción sobre el tiroides a modo de tirotropina. Actúan como mediadores en la influencia noradrenérgica sobre la liberación de LH/RH (65) En el sistema reproductor las prostaglandinas han sido aisladas del suero seminal, endometrio y liquido amniótico. Su función se desarrolla en lo referente a la motilidad del esperma en el tracto genital, de las trompas, el transporte del huevo y la motilidad y maduración uterina en el útero a término (52). 3.2.2. ACCIONES DE LAS PROSTAGLANDINAS EN EL TRACTO GASTROINTESTINAL. Mención a parte merece las acciones que sobre el aparato digestivo producen las prostaglandinas (66), pues es el apartado directamente relacionado con nuestro trabajo. Las prostaglandinas que juegan un papel más directo en el funcionamiento de dicho sistema son la PGE, la PGF y la PGI2 aunque no son las únicas. 55 3.2.2.1. Secreción en estómago y duodeno. PGE y PGI2 inhiben de la secreción de jugo gástrico provocada por el alimento, la gastrina o la histamina. Dicha inhibición se produce tanto a nivel de volumen como de acidez y de contenido en pepsina mediante una acción directa sobre las células secretoras. Además las prostaglandinas son vasodilatadoras en la submucosa gástrica siendo la PGI2 reguladora local del flujo sanguíneo. El hecho de que la PGE2 sea un potente estimulante de la secreción de moco por el estómago así como de bicarbonato por las glándulas duodenales hacen de estas sustancias protectoras frente a factores lesivos. 3.2.2.2. Intestino delgado y colon. Tanto en un tramo como en otro las prostaglandinas favorecen la secreción de electrolitos y agua, fenómeno que se produce mediado por el cAMP. Concretamente en el colon la prostaglandina E2 resulta ser un potente secretagogo para el cloro. La secreción de moco en estos tramos también se ve estimulada por la acción de las prostaglandinas. 3.2.2.3. Músculo liso gastrointestinal. Su función a nivel del músculo liso es un estímulo de su contractilidad en cuanto al músculo longitudinal se refiere; a nivel de las fibras circulares la PGE tiene función relajante mientras que la PGF la tiene como estímulo de la contractilidad. En síntesis las prostaglandinas reducen el tiempo de tránsito intestinal tanto en el intestino delgado como de colon. 3.2.2.4. Protección de la superficie mucosa luminal. El estímulo generalizado en todos los órganos del tracto gastrointestinal en lo que se refiere a la síntesis y secreción de moco (67) así como la facilitación de 56 los fenómenos de restitución (68) y renovación celular configuran una de las propiedades más características de estas moléculas. IV. HIDROFOBICIDAD EN LOS DISTINTOS TRAMOS DEL TRACTO DIGESTIVO. 1. ESOFAGO. 1.1. HISTOLOGIA (18). El esófago es un tubo de unos 25 cm de longitud que comienza en la faringe a nivel del borde inferior del cartílago cricoides y termina en el estómago unos pocos centímetros por debajo del diafragma. Es la porción del tubo digestivo que presenta el músculo más desarrollado. Debido a la contracción tónica de esta capa muscular su luz es pequeña e irregular y su mucosa desarrolla unos pliegues longitudinales. 1.1.1. CARACTERÍSTICAS MICROSCÓPICAS DE excepcionalmente grueso LA MUCOSA. El epitelio es plano estratificado, y ocasionalmente queratinizado observándose capa cornea. Este epitelio se continua imperceptiblemente con el epitelio plano estratificado de la faringe, mientras que en la transición al estómago en la región del cardias bruscamente se modifica a cilíndrico simple. Así mismo la lamina muscular propia es muy gruesa en el esófago. Dos tipos de glándulas nos encontraremos en el esófago: 57 -Las glándulas cardiales ubicadas en la lámina propia de la mucosa y apareciendo sólo en una zona limitada de la parte superior e inferior del esófago pudiendo faltar las superiores. Se trata glándulas tubulares mucosas, muy ramificadas. -Las glándulas submucosas, ubicadas en la capa submucosa, su número es mayor en la mitad superior del esófago. Son glándulas tubuloacinosas, ramificadas cuyos conductos excretores más pequeños tienen epitelio cúbico o cilíndrico reemplazado por epitelio plano estratificado durante su curso por la mucosa. Ambos tipos glandulares secretan mucina cuya función principal es lubrificar la superficie mucosa esofágica para facilitar el paso del bolo alimenticio. Por otra parte en la zona del cardias la secreción mucínica jugaría un papel importante en la protección de dicha mucosa contra la digestión por el reflujo del jugo gástrico ácido. 1.2. PROPIEDADES DE SUPERFICIE EN LA MUCOSA ESOFAGICA. El esófago ha sido uno de los órganos menos estudiados desde el punto de vista de sus características de hidrofobicidad ya que su función primordial es de conducción del bolo alimenticio entre la boca y el estómago lo que hace que las funciones de digestión y absorción de los alimentos en este tramo del tracto digestivo sean inexistentes. Revisada la literatura solamente un único trabajo, el de B.A. Hills (autor que por otra parte ha publicado numerosos trabajos sobre las propiedades de superficie en la mucosa del tubo digestivo) expone resultados sobre estas características de la mucosa esofágica siendo pues los datos expuestos en este apartado los obtenidos de la mencionada publicación (69) Se han podido determinar características hidrofóbicas en la superficie mucosa esofágica, sobre todo en el epitelio más próximo al cardias, determinadas 58 por la existencia de una barrera física de fosfolípidos que se extiende sobre dicha superficie infiriéndole dichas características. Los valores de hidrofobicidad medidos con un goniómetro, en grados según la técnica de la gota, nos confirman la existencia de propiedades de este tipo en el epitelio mucoso esofágico si bien cuando los comparamos con los que se obtienen en idénticos estudios sobre la mucosa gástrica resultan ser, en valor absoluto, mucho menores los esofágicos. Dicha barrera fosfolipídica se ve drásticamente afectada, llegando a desaparecer, cuando incubamos una muestra de mucosa esofágica en un medio que contiene sales biliares lo cual explica la sensibilidad del esófago en la práctica clínica a la esofagítis por reflujo biliar. 2. ESTOMAGO. 2.1. HISTOLOGIA (18). El estómago es la parte más ensanchada del tracto digestivo y comunica el esófago con el duodeno. El bolo alimenticio, que tras la masticación adquiere una consistencia blanda, se acumula durante un cierto tiempo en el estómago donde tras sufrir de una acción mecánica y química se transforma en un líquido espeso denominado quimo. Por tanto el estómago actúa por un lado como reservorio y por otra parte como órgano digestivo participando de la absorción de ciertas sustancias. La unión del estómago con el esófago se llama cardias mientras que la salida del estómago al duodeno se denomina píloro. A la izquierda del cardias el estómago forma una cúpula por encima del plano horizontal que se denomina fundus. Los bordes gástricos lateral cóncavo y medial convexo se denominan curvaturas menor y mayor respectivamente. La curvatura menor tiene una hendidura, la incisura angularis, donde pasa de una disposición horizontal a una 59 vertical y que separa la parte mayor y más central del estómago, el cuerpo gástrico de la porción más distal y que termina en el esfínter pilórico denominada antro gástrico. La mucosa gástrica es gruesa y posee una superficie blanda aterciopelada. Su color es rosado aclarándose cerca del cardias y del píloro. En el estómago vacío y contraído la superficie forma numerosos pliegues longitudinales, las arrugas gástricas, que desaparecen cuando el estómago se llena. Así mismo se identifica un entramado de cisuras que dividen la superficie mucosa en pequeños campos convexos, las áreas gástricas, cuyas dimensiones son de 1-6 mm. En cada área se puede observar un pequeño orificio que llevan a cavidades en forma de embudo: las criptas gástricas. 2.1.1. ESTRUCTURA MICROSCÓPICA DE LA MUCOSA GÁSTRICA. El epitelio superficial es del tipo cilíndrico simple, alto y recubre toda la superficie libre así como las criptas continuándose con el epitelio cilíndrico simple del intestino. Las células del epitelio superficial son todas secretoras de moco y representan en conjunto un epitelio secretor. Su citoplasma esta lleno de gránulos de mucígeno que se colorean por el método de PAS. El contenido celular de gránulos mucígenos disminuye a medida que se penetra en las criptas y simultáneamente las células se hacen más bajas. Toda la mucosa gástrica está ocupada por glándulas tubulares simples, las glándulas gástricas, que se abren en el fondo de las criptas gástricas. Estas glándulas son distintas en las diferentes zonas del estómago describiéndose tres zonas mucosas que no están delimitadas claramente: •Glándulas cardiales. Son glándulas tubulares muy ramificadas; sus células son esencialmente mucosas similares a las de las glándulas pilóricas. Además podemos encontrar alguna célula endocrina. 60 •Glándulas corpofúndicas. Son glándulas rectas y perpendiculares a la superficie mucosa aunque ocasionalmente se pueden ramificar y están algo curvadas y enrolladas en la muscularis mucosae. Cada túbulo glandular se compone de tres secciones: una parte principal profunda, un cuello medio y un istmo superior mediante el cual la glándula se abre al fondo de la cripta (a menudo varias glándulas en cada una). En estas glándulas corpofúndicas encontramos 4 tipos celulares distintos: - Células principales. Se encuentran en mayor número en la parte principal de la glándula. Contienen gránulos de pepsinógeno, estadio precursor de la enzima proteolítica pepsina. - Células parietales. Su localización primordial es en cuello de la glándula aunque también las encontramos en el adenómero. Su función es la secreción del ácido clorhídrico. - Células mucosas del cuello. Las encontramos entre las células parietales y su secreción es de mucina. - Células endocrinas secretoras de glucagón. •Glándulas pilóricas. Son tubulares simples pero mucho más ramificadas que las corpofúndicas. Sus células son de dos tipos: las mucosas y las endocrinas que secretan gastrina. 2.2. PROPIEDADES DE SUPERFICIE DE LA MUCOSA GASTRICA. Desde que en el siglo XVIII Spallanzani demostrara que el jugo gástrico humano tiene la capacidad de digerir la carne, los investigadores del aparato gastrointestinal se han preguntado a cerca del mecanismo por el cual la superficie luminal gástrica resiste la autodigestión por dicha secreción (70). A mediados de los años 60 Davenport introduce el concepto de “barrera mucosa gástrica”, demostrando que el epitelio de la mucosa gástrica de los 61 mamíferos es resistente al ácido intraluminal y a otros electrolitos siendo susceptible de ser lesionado por otros agentes liposolubles (71). Los mecanismos por los cuales está resistencia aparece son múltiples y de naturaleza diversa (72): -Bombas de intercambio iónico. -Secreción de bicarbonato por las células del epitelio superficial tanto a nivel intraluminal como intersticial. -Flujo sanguíneo local mantenido y con débito elevado. -Rapidez en la reparación de la superficie en la mucosa lesionada. -Evidencia de una monocapa lipídica con características de gel en la superficie de la mucosa que le confiere propiedades de hidrofobicidad y por tanto de resistencia al ácido. En cuanto a este último mecanismo de defensa nos tenemos que remontar 150 atrás cuando Beaumont relaciona la resistencia al ácido de la mucosa gástrica con la capa de moco que la cubre (14). 2.2.1. LA HIDROFOBICIDAD DE LA SUPERFICIE MUCOSA GÁSTRICA. Numerosos estudios recientes han puesto de manifiesto la existencia de esta propiedad. En 1983, empleando el método del ángulo de contacto, se demuestra que la superficie mucosa gástrica del perro exhibe valores de hidrofobicidad elevados (entre 75º y 90º) (73). Estudios posteriores han puesto de relieve dicha propiedad en las superficies mucosas gástricas de numerosas especies de mamíferos incluido el hombre (74). 62 2.2.2. PAPEL DE LOS LÍPIDOS EN LA HIDROFOBICIDAD DEL MOCO. Al principio de los años 80, Waseff y colaboradores (75) ponen de manifiesto la presencia de concentraciones valorables de fosfolípidos con propiedades tensoactivas como la dipalmitoil-fosfatidilcolina (DPPC) en la mucosa gástrica y buscan una relación incluso embriológica con el surfactante pulmonar ya que este fosfolípido es componente primordial de dicha sustancia. Diez años después en un nuevo trabajo (76), Smith ratifica la presencia de esta DPPC como componente de la fracción lipídica del moco gástrico si bien tan solo en menos de un 10% de su fracción fosfatidilcolínica lo que supone concentraciones de hasta cuatro veces menos de lo propuesto por Wasef. No obstante, en nuevos estudios se ha comprobado que las concentraciones de estos fosfolípidos tensoactivos en el moco gástrico no son constantes y su síntesis y secreción depende de secretagogos gástricos como de la acción de agentes protectores o lesivos sobre la mucosa gástrica (14). 2.2.3. EFECTO SOBRE HIDROFOBICIDAD DE LA PROPIEDAD DISTINTOS DE LA AGENTES ULCEROGÉNICOS. Durante los últimos años y basado en experimentos con animales tanto in vivo como in vitro, se creía que numerosos agentes lesivos para la mucosa gástrica como el ácido acetil salicílico y otros salicilatos, el etanol, las sales biliares y las fosfolipasas entre otros llevaban a cabo su acción actuando a nivel del metabolismo de los fosfolípidos y como consecuencia alterando la propiedad de la hidrofobicidad. Esta tesis, que apoya el concepto de que la propiedad de la hidrofobicidad de superficie es pieza clave en el mantenimiento de la barrera mucosa gastrointestinal, debió ser reinterpretada a partir de las experiencias de Goddard 63 (77) que demostraron que el efecto sobre la propiedad de la hidrofobicidad de la superficie mucosa no viene precedido por un sustrato de alteración en la síntesis de los lípidos sino más bien por una interacción directa sobre la monocapa de fosfolípidos a nivel molecular. Así, posteriores estudios demostraron que los antiinflamatorios no esteroideos (AINES) los cuales poseen en su estructura química un grupo carboxilo libre, forman a través de éste, fuertes enlaces electrostáticos con las “cabezas” con carga positiva de los fosfolípidos con lo que se incrementa la solubilidad de dichos fosfolípidos en el agua y por consiguiente se neutralizan sus propiedad tensoactivas (78) (79). En parecida línea cabría señalar el mecanismo íntimo por el cual el Helicobacter pylori produce el desarrollo de gastritis crónica activa y ulcera péptica. Dos son estos mecanismos: (Figura 10) -La producción por parte del H. pylori de una fosfolipasa (80) que provoca por una parte la lesión en la capa de surfactante y por otra parte la asimilación por la bacteria de estos fosfolípidos con el fin de utilizarlos como mecanismo de defensa dentro del medio ácido donde subsiste el germen (81). -La síntesis así mismo de una segunda enzima del tipo ureasa que generaría a partir de la urea una elevada concentración de grupos amonio en el espesor del moco gástrico los cuales competirían con los lugares de enlace electrostático de las “cabezas” positivas de los fosfolípidos produciéndose una disrrupción de la monocapa y por tanto de las características tensoactivas que esta le confiere (82). 64 Figura 10: Mecanismos de ulcerogénesis del H. Pylori 2.2.4. EFECTO SOBRE LA HIDROFOBICIDAD DE LA SUPERFICIE MUCOSA Y SOBRE EL METABOLISMO LIPÍDICO DE LOS AGENTES GASTROPROTECTORES. El concepto “citoprotección” fue acuñado a mediados de los años 70 por Robért y colaboradores tras demostrar que determinados tipos de prostaglandinas y sus análogos a dosis más bajas de las necesarias para inhibir la secreción ácida gástrica eran capaces de proteger la mucosa gástrica ante la acción de distintos factores ulcerogénicos (14). Los mecanismos clásicos por los cuales se produciría este efecto serían: -Incremento en la secreción de moco. -Incremento en la producción de bicarbonato por la mucosa. -Reducción de la permeabilidad vascular. 65 -Mantenimiento del flujo sanguíneo gástrico. Estudios posteriores de tipo morfológico pusieron de manifiesto que realmente el epitelio de superficie de la mucosa gástrica de ratas pretratadas con prostaglandinas y sometidas posteriormente a la acción de agentes ulcerogénicos aparecía lesionado si bien el tejido glandular se mantenía indemne (83). Ante esto se decidió sustituir el término “citoprotección” por el más preciso de “gastroprotección”. Añadiendo a los efectos clásicos antes descritos de las prostaglandinas sobre las propiedades de barrera de la mucosa gástrica se ha comprobado que estas sustancias tienen la capacidad de incrementar la propiedad de la hidrofobicidad de superficie mediante la estimulación de la biosíntesis y/o acumulación de los fosfolípidos por parte de las células de dicha mucosa (84). 3. INTESTINO DELGADO: DUODENO, YEYUNO E ILEON. 3.1. HISTOLOGIA (18) El intestino delgado es un órgano tubular de entre 4 y 5 metros de largo que se inicia en el píloro y termina en la válvula ileocecal continuándose con el intestino grueso. Macroscopicamente el intestino delgado se divide en tres porciones aunque el paso de una a otra es imperceptible y su estructura histológica es la misma. Estas tres secciones serían una proximal, retroperitoneal excepto en sus tres primeros centímetros y de unos 25-30 cm de longitud denominada duodeno y otra mucho más larga fijada por el mesenterio a la pared posterior del abdomen con cierta movilidad y recubierta de peritoneo que se conoce como intestino delgado y que se divide en un tramo proximal (2/5) denominado yeyuno y ubicado en el cuadrante superior izquierdo del abdomen y otra más distal, de mayor longitud (3/5), ubicada en el cuadrante inferior derecho abdominal que termina en la válvula ileocecal y que se denomina ileon. 66 En el intestino delgado se produce el tránsito del quimo, mientras sufre degradación química completa a compuestos absorbibles por los vasos sanguíneos y linfáticos de la mucosa. La capacidad de absorber los componentes degradados del alimento por parte de la mucosa del intestino delgado está incrementada por diferentes rasgos estructurales que producen un gran aumento de su superficie luminal que viene a ser de unos 250 m2. Las válvulas conniventes de Kerking son unos pliegues circulares visibles macroscópicamente que se extienden como semilunas ocupando los 2/3 de la luz. Estos están especialmente desarrollados en el yeyuno, faltando en los 5 cm proximales del duodeno y en la última mitad del íleon. Su existencia aumenta la superficie de la mucosa en 3 veces. Las vellosidades intestinales son evaginaciones de la mucosa formadas por un núcleo de tejido conectivo y recubiertas por epitelio de superficie. Su tamaño promedio es de 1 mm y su forma es digitiforme o foliacea. Estas vellosidades tapizan densamente toda la superficie mucosa intestinal lo que le confiere un aspecto aterciopelado, así mismo su presencia aumenta en 10 veces dicha superficie. 3.1.1. ESTRUCTURA MICROSCÓPICA DE LA MUCOSA ENTÉRICA. El epitelio que reviste la mucosa del intestino delgado es cilíndrico simple. En él diferenciamos 4 tipos celulares: células absortivas, caliciformes, endocrinas y las células de Paneth. Las células absortivas son cilíndricas altas. Su superficie libre presenta un borde en cepillo conocido como “chapa estriada”. Esta chapa estriada, con un espesor de 1 µm aparece formada por microvellosidades paralelas muy juntas que aumenta la superficie de la mucosa intestinal en 20 veces. Estas vellosidades a su vez están cubiertas de una gruesa capa de filamentos que se conoce como cubierta 67 superficial. Sus funciones son de dos tipos: una función protectora y otra como soporte de enzimas intestinales del tipo peptidasa, disacaridasas (sacarasa, maltasa, isomaltasa y lactasa) y lipasa. Las células caliciformes que se encuentran insertadas entre las células absortivas, se reconocen por ser fuertemente PAS positivas debido a su contenido en mucinógeno. Las células endocrinas son de cuatro tipos en el intestino delgado según el producto de su secreción: secretoras de secretina, colecistoquinina, enteroglucagon y serotonina (células argentafines). Las células de Paneth localizadas únicamente en el fondo de las criptas tienen función desconocida aunque se sabe que exhiben características da células secretoras con una secreción rica en proteínas y cinc. Por otro lado es necesario hablar ahora de otras dos estructuras, esta vez glandulares, que si bien no se encuentran localizadas en su totalidad en la mucosa desembocan a este nivel: - Las criptas de Lieberkühn que corresponden a glándulas tubulares simples, que drenan entre las vellosidades y que se extienden a lo largo de la lámina propia y muscularis mucosae. Así mismo en la profundidad de dichas criptas hallamos células muy indefernciadas precursoras tanto de células absortivas como de caliciformes. - Las glándulas de Brunner, muy desarrolladas en el duodeno y que van disminuyendo en número según accedemos a tramos más distales del intestino delgado. Se trata de glándulas tubulares ramificadas y otras simples localizadas principalmente en al submucosa y cuyos conductos excretores desembocan en las criptas de Lieberkühn. Su secreción (13) es mucosa muy rica en iones bicarbonato lo que hace que su pH sea básico. La misión de esta secreción es la de protección de la mucosa, sobre todo duodenal, fijándose a ella y ligando los iones bicarbonato. 68 3.2. PROPIEDADES DE SUPERFICIE DE LA MUCOSA INTESTINAL. De la misma manera que ocurre a lo largo de toda la superficie endoluminal del tubo digestivo la del intestino delgado también está tapizada por una capa lipídica compuesta en su estrato más superficial de fosfolípidos. Dicho manto lípidico (denominado como “fuzzy coat” en la literatura inglesa) tiene un triple origen en el caso del intestino delgado: - Lípidos de membrana originados de la destrucción celular. - Fosfolípidos, ácidos biliares y colesterol a partir de la bilis. - Lípidos y sus productos de degradación con origen en la ingesta y degradados por los enzimas pancreáticos. Debido al íntimo y amplio contacto que supone la extensa superficie del intestino existe un sistema defensivo a este nivel que se sustenta en dos pilares fundamentalmente: - La presencia de característicos acúmulos de linfocitos T en el espesor del epitelio intestinal. - La colonización por parte del Lactobacilo (10) de la superficie intestinal lo que conlleva por un lado la competencia con la colonización por parte de otros gérmenes patógenos (como los bacilos gram negativos que colonizan el intestino grueso) en dicha superficie así como un estímulo inmunológico mantenido. El papel del surfactante intestinal en este tramo del tubo digestivo está más relacionado con la estabilización de esta colonización por huéspedes específicos para cada especie tanto en el tipo de germen (Lactobacilli) como en su concentración (1.000.000 de unidades formadoras de colonias). 69 Como ya hemos reseñado en apartados anteriores la función primordial del intestino delgado es la de digestión y absorción principalmente de nutrientes (84). La absorción de agua en este tramo no es tan importante siendo la parte importante en esta función el colon sobretodo el lado derecho. En esta función de la absorción las propiedades de superficie que caracterizan al surfactante tienen un papel fundamental y lo desarrollan a nivel de las uniones intercelulares laterales (“tight junctions”). El espacio entre células en su región más lateral es un camino bloqueado por unas fuerzas de superficie que conducen a la aposición entre lípidos y proteínas de membrana (85). La presencia del surfactante intestinal a nivel de estas uniones basoleterales entre las cédulas facilita la apertura de los puentes inercelulares laterales y como consecuencia un camino para el paso de moléculas desde la luz intestinal al medio interno (86). Dicho surfactante, aislado posteriormente en intestino humano, tiene similar composición en distintas especies de mamíferos siendo a su vez química y estructuralmente diferente de los lípidos que conforman la estructura de las membranas del borde apical en cepillo y del borde basolateral de las células epiteliales (87). 70 V. PROPIEDADES DE SUPERFICIE DE LA MUCOSA DEL INTESTINO GRUESO. 1. ANATOMIA DEL COLON Y RECTO. El intestino grueso comprende el tramo de tubo digestivo que se extiende desde el final del íleon (válvula ileocecal) hasta el ano y tiene por término medio una longitud de 135 cm. (Figura 11). Su calibre es máximo en su tramo inicial, el ciego, y disminuye gradualmente en dirección distal, aunque de nuevo se dilata en la porción más inferior del recto. En su curso describe un arco que rodea las asas de intestino delgado. Se distingue fácilmente de este último por su mayor calibre, su aspecto saculado, la posesión en muchas zonas de apéndices grasos (los apéndices epiploicos), la adherencia de una parte (el colon transverso) al epiplon mayor y su mayor fijación. El rasgo más destacado de la pared del colon es la concentración de la capa muscular longitudinal externa en tres estrechas bandas o tenias, más cortas que el propio intestino, de manera que éste queda fruncido dando lugar a la formación de las típicas haustras. 71 Desde un punto de vista topográfico el intestino grueso lo podemos dividir en cuatro grandes sectores que a su vez se subdividirían hasta definir siete segmentos (88). (Tabla 3) Tabla 3: División del colon en sectores y segmentos. SECTORES COLON DERECHO COLON TRANSVERSO COLON IZQUIERDO RECTO SEGMENTOS •Ciego •Colon ascendente •Proximal (ángulo hepático) •Distal (ángulo esplénico) •Colon descendente •Sigma •Recto 1.1. CIEGO. Con estructura de fondo de saco, el ciego se aloja en la fosa ilíaca derecha por encima de la mitad externa del ligamento inguinal. Dos estructuras anatómicas destacan en relación con el ciego; el apéndice vermiforme y la válvula ileocecal. Este es el lugar dónde se inserta el íleon y su función principal es la de antirreflujo del contenido fecal hacia la luz del intestino delgado. 1.2. COLON ASCENDENTE. De unos 15 cm de longitud comunica el ciego con el colon transverso ocupando el parietocólico derecho y apoyándose en el hueso iliaco, el músculo cuadrado lumbar y el polo inferior renal. 72 1.3. COLON TRANSVERSO PROXIMAL. Originado en el ángulo hepático del colon se extiende unos 15 cm. horizontalmente apoyandose sobre la segunda porción duodenal y la cabeza del páncreas 1.4.COLON TRANSVERSO DISTAL. Continuación en el plano horizontal y a lo largo de una longitud de 20 cm. del colon transverso hasta el ángulo esplénico del colon lugar de fijación de este al diafragma mediante el ligamento frenocólico. El epiplon mayor, estructura grasa que cuelga de la curvatura mayor del estómago, desciende por delante del colon transverso y asciende después para fijarse laxamente a su cara anterior y ala cara superior del mesocolon transverso. 1.5.COLON DESCENDENTE. El siguiente segmento tiene un curso vertical a lo largo del espacio parietocólico izquierdo, comprende los siguientes 20 cm del trayecto colónico y pone en comunicación el ángulo esplénico del colon con el colon sigmoide a nivel del músculo psoas izquierdo. 1.6.SIGMA. Con forma de asa su longitud es muy variable pudiendo medir desde 15 hasta 60 cm siendo por termino medio de una longitud de 38 cm. Habitualmente se localiza en la mitad izquierda de la pelvis uniéndose con el recto a nivel del tercer segmento sacro. 73 1.7. RECTO. Tramo final del intestino grueso de unos 15 cm de longitud y que termina en el ano. Su localización es en la pelvis menor por debajo de la reflexión peritoneal. Colon transverso proximal Colon transverso distal Colon descendente Colon ascendente Ciego Recto Sigma Figura 11: Anatomía del colon 2. FISIOLOGIA DEL INTESTINO GRUESO. (13) En el ser humano, el colon recibe el contenido ileal, absorbe agua y electrolitos y actúa de reservorio para la materia fecal resultante, hasta que está en condiciones de ser evacuada del recto. Se ha calculado que entre 800 y 1000 ml de líquido penetran en el colon diariamente procedentes del íleon aunque solamente 150 ml de estos se expulsan con las heces. 74 2.1. MOTILIDAD EN EL INTESTINO GRUESO. Cuatro son los tipos de movimientos que observamos en esta parte del tracto digestivo. 2.1.1. SEGMENTACION. Son movimientos mezcladores y de amasado principalmente y en menor medida de progresión del contenido colónico a intervalos regulares que se caracterizan por su pequeña amplitud y se observan con una frecuencia de unas tres a ocho veces por minuto. 2.1.2. PERISTALTISMO MASIVO. Se considera como el principal modo de transporte del colon. Aparece con mayor frecuencia inmediatamente después de una comida cuando están aumentadas todas las formas de actividad motora del colon. Este movimiento consiste en una súbita desaparición de las haustras de unos cuarenta cm de colon estrechándose éste considerablemente a modo de una cinta. Este estado de cosas dura solamente entre dos y tres segundos y retorna inmediatamente al aspecto haustrado normal. 2.1.3. ANTIPERISTALTISMO. Este movimiento frecuente en otras especies animales, en el hombre solo se observa ocasionalmente. Son ondas que se desplazan proximalmente desde el ángulo hepático al ciego y desde el colon pélvico al descendente fundamentalmente. En resumen, todo este conjunto de movimientos desarrollados por el intestino grueso provocan que lo ingerido en un momento dado entre en el ciego cuatro horas y media más tarde alcanzando el colon pélvico alrededor de dieciocho 75 horas después. No obstante estos tiempos no son constantes y dependen tanto de la cantidad como de la calidad del contenido colónico. 2.2. ABSORCION EN EL INTESTINO GRUESO. Las principales sustancias absorbidas son el agua y los electrolitos. Además se absorben el amoniaco, las sales biliares, la urea, la glucosa y algunos fármacos como la hidrocortisona y la morfina. Se ha calculado que cada día se absorben en el colon y en el recto unos 500 ml de agua y unos 70 mM de sodio. La absorción de sodio parece depender de un mecanismo activo desarrollándose concomitantemente una absorción pasiva de agua. Por otro lado se produce una secreción de potasio a la luz del colon de un modo activo y contra un gradiente de concentración de hasta 15 nM/l. En cuanto al amoniaco este se absorbe en proporción a su concentración en la luz y dependiendo del pH de la misma siendo facilitada esta por valores básicos de este. 3. HISTOLOGIA DE LA MUCOSA DEL COLON Y RECTO. (18) La superficie mucosa luminal del intestino grueso es relativamente lisa, pues a diferencia del intestino delgado no presenta vellosidades. El epitelio es cilíndrico alto. El borde en cepillo de las células absorbentes es más bajo que en el intestino delgado, apareciendo células caliciformes en mayor cantidad, especialmente en las criptas de Lieberkühn, donde casi todas las células suelen ser células caliciformes. Las criptas de Lieberkühn, glándulas simples, no ramificadas, tubulares y mixtas del tubo digestivo, están ocupadas por un enorme número de células caliciformes. Estas criptas son más largas y más rectas que en el intestino delgado. 76 En el fondo de las mismas se encuentran otros tipos celulares como células epiteliales más indiferenciadas (regenerativas) y distintas células endocrinas, que producen principalmente enteroglucagón. Las células caliciformes (goblet cells), que encontramos en el epitelio de muchas mucosas, son el único ejemplo de glándula exocrina unicelular que encontramos en los mamíferos; esto quiere decir que la glándula está formada por una única célula secretora. Dichas células secretan mucina que es una glucoproteina. Con la incorporación del agua la mucina se transforma en moco. En una célula caliciforme llena de producto de secreción, la zona apical está distendida por las gotas acumuladas de mucinógeno (el precursor de la mucina), mientras que el núcleo se encuentra en la zona más estrecha y basal de la célula que es fuertemente basófila. La zona apical, ensanchada del citoplasma se denomina teca y la forma de la célula recuerda a un cáliz. Al microscopio electrónico se observan las gotas de mucinógeno rodeadas por membranas. La síntesis de la parte proteica del mucinógeno se produce en el retículo endoplásmico rugoso, mientras que los glucosaminoglucanos ácidos sulfatados son sintetizados e incluidos en el complejo de Golgi La liberación del producto de secreción se realiza por secreción merocrina, esto es vaciado de su contenido a la superficie del epitelio mucoso, y es relativamente constante durante toda la vida de la célula, es decir, aproximadamente 3 días en el caso de las células de la mucosa intestinal. Las células caliciformes cumplen entonces solo un ciclo secretor largo. 77 4. PROPIEDADES DE SUPERFICIE EN LA MUCOSA DEL COLON. El epitelio glandular en general y los fosfolípidos mantienen una serie de interrelaciones que conforman una serie de propiedades fisicoquímicas entre las que se encuentran englobadas las denominadas propiedades de superficie. Si bien el surfactante pulmonar es el ejemplo mejor y más extensamente estudiado de lo anteriormente expuesto, el moco que recubre el epitelio de la mucosa del tracto gastrointestinal se caracteriza por una serie de propiedades, algunas de las cuales se incluirían dentro de las denominadas de superficie, que han hecho de esta parte del organismo objeto de múltiples estudios en el marco de su funcionalismo en relación con esta faceta (12). Las primeras investigaciones a cerca del surfactante y sus propiedades en el tracto gastrointestinal fueron realizadas en el estómago, siendo este órgano el mejor y más extensamente estudiado con el paso del tiempo. No obstante el resto del tubo digestivo también ha sido estudiado en relación con sus propiedades de superficie. Dado que la función principal del intestino delgado es la de absorción de nutrientes, es en el colon y recto donde las propiedades de superficie en su mucosa recobran un mayor protagonismo y se relacionan con numerosas funciones que esta parte del tubo digestivo desarrolla. En estudios en perros se ha comparado la composición y distribución del surfactante en distintas zonas del tubo digestivo (esófago, estómago, duodeno medio, yeyuno medio y segmentos medios del colon), concluyéndose que existe una composición similar entre las distintas zonas estudiadas. Así mismo en este estudio se pone de manifiesto la capacidad lubricante que desarrolla dicho surfactante en la superficie del tubo digestivo redundando en la propiedad de protección ya no solo ante noxas de tipo químico sino también ante las que actuarían mediante una agresión de tipo mecánico (89). 78 Otros estudios llevados a cabo en conejos han puesto de manifiesto las diferencias regionales entre los valores de hidrofobicidad medidos en tramos de intestino delgado y los medidos en tramos de colon. Así mismo, dichos valores se ven modificados tanto en el proceso de maduración del animal como en el de fenómenos que cursen con inflamación de la mucosa. En una como en otra ocasión los cambios en las propiedades de esta mucosa se traducen en último termino, en alteraciones de la capa de moco que tapiza el epitelio (90). En similar línea y con experimentos diseñados para provocar inflamación en la mucosa colónica, en este caso de ratas, se demuestra que la interacción del agente que induce la inflamación lo hace mediante una reacción con los fosfolípidos del surfactante colónico conduciendo esto a la neutralización de sus funciones; consiguientemente la propiedad de la hidrofobicidad en dicha superficie mucosa del colon queda significativamente disminuida o incluso abolida lo que facilitará la acción mediada inmunológicamente de la sustancia química que desencadena todo este proceso (91). En modelos experimentales sobre ratas realizados en el laboratorio del servicio de gastroenterología del hospital Vall d’Hebron de Barcelona se vuelve a poner de manifiesto el papel modulador sobre las propiedades de superficie (concretamente la hidrofobicidad) de la mucosa del colon a la permeabilidad de moléculas hidrofílicas y como consecuencia la función protectora frente a toxinas (92). Una consecuencia clínica que se desprende de los resultados obtenidos de estos trabajos y que también ha sido tenida en cuenta por otros autores (93) , es la relación en su fisiopatología que enfermedades inflamatorias crónicas que afectan al intestino delgado, como por ejemplo la enfermedad de Crohn, tiene con las propiedades de superficie en los tramos de mucosa digestiva sana de estos pacientes que se encuentran alteradas en el sentido de una disminución de sus valores de hidrofobicidad. En esta misma línea se apunta el valor que la administración de fosfolípidos exógenos puede tener como tratamiento de estos pacientes. 79 Utilizando cultivos celulares para estudios de laboratorio procedentes de células de colon humano se han aislado partículas similares al surfactante, con propiedades que comparten con este (94). En trabajos realizados con muestras de recto humano se aislaron secreciones de la superficie del epitelio mucoso ricas en fosfolípidos (95) encontrándose también en mucosa de estómago y duodeno. Trabajos más recientes (96) han identificado en muestras amplias de mucosa de colon humano obtenidas de piezas operatorias o de donante para transplante la existencia de una fina película aislada de la superficie de la “membrana” que cubre las microvellosidades de los colonocitos y cuya composición química es diferente de esta compartiendo proteinas con el surfactante pulmonar. De la presencia de esta monocapa de surfactante (fosfolípidos con propiedades hidrofóbicas) en la superficie de la mucosa del intestino grueso se derivan una serie de propiedades fisiológicas relacionadas con los aspectos que a continuación detallaremos: - Fenómenos de adhesividad bacteriana. - Lubrificación de la superficie luminal mucosa y su repercusión en la motilidad colónica. - Defensa ante la presencia de factores lesivos en la luz colónica. - Absorción de los diferentes principios que circulan por la luz intestinal. 4.1. ADHESIVIDAD BACTERIANA. La propiedad de la adhesividad que exhiben la mayor parte de las especies bacterianas tiene una gran importancia como factor de virulencia en el inicio de infecciones sobre todo a nivel del tracto respiratorio, genitourinario y gastrointestinal (97). 80 La habilidad con la que numerosas especies bacterianas se fijan a las superficies mucosas de estos sistemas es esencial en el punto de partida del fenómeno de colonización. Esta adhesividad bacteriana viene mediada por dos mecanismos que en unas ocasiones serán independientes pero en otras actuarán juntos. Dichos mecanismos son los siguientes: - Uno especifico y basado en interacciones químicas del tipo receptorligando (98). - Otro, inespecífico y mediado por propiedades fisicoquímicas como son los fenómenos de superficie (hidrofobicidad) (99). Estos mismos mecanismos y ciñéndonos al tracto gastrointestinal son también los responsables de la colonización y por tanto competencia con gérmenes patógenos de la flora saprófita del colon (100). 4.2. LUBRICACION DE SUPERFICIES. A diferencia del intestino delgado el contenido que circula por la luz colónica, las heces, es de naturaleza sólida. La movilización (101) de dicha masa fecal, a menudo con forma irregular, se facilita por la existencia de una fina capa de surfactante que cubre la superficie por la cual discurre el transito colónico. Este surfactante debe cumplir una serie de propiedades químicas y físicas que lo hagan idóneo en su función lubricadora. Aunque la composición del surfactante está formada por varios tipos de fosfolípidos (fosfatidilcolina, esfingomielina, fosfatidiletanolamina, fosfatidilinositol, fosfatidilserina, y fosfatidilglicerol) el de mayor proporción (40%) es la fosfatidilcolina cuya capacidad de disminuir la fricción entre superficies se aproxima al 99%, lo que hace que la disminución del coeficiente de fricción que conlleva la superficie cubierta de dicha mezcla de distintos fosfolípidos en diferente proporción sea mayor del 75% (12). 81 Así mismo y dado que la materia fecal, al igual que la gástrica y a diferencia de la intestinal, tiene características ácidas, la distribución de las moléculas de surfactante en la superficie de la mucosa desarrolla una conformación lineal y homogénea sustentada en fuerzas de cohesión entre ellas medidas por puentes de hidrógeno a nivel del grupo fosfatidil de la molécula de fosfolípido (102). 4.3. DEFENSA ANTE LA PRESENCIA DE FACTORES LESIVOS INTRALUMINALES. El mecanismo íntimo por el cual numerosas moléculas desarrollan su acción lesiva directa sobre la mucosa colónica es distinto según se trate de fenómenos inflamatorios agudos o bien de inflamación crónica. Durante el desarrollo de fenómenos inflamatorios crónicos la activación del sistema inmunitario juega un papel primordial en la patogénesis de la colitis (103). Contrariamente en el desencadenamiento y desarrollo de la colitis aguda la participación de fenómenos de inmunidad no se da (104). La interacción exclusivamente química entre la molécula del tóxico y la del fosfolípido (105) que conlleva una anulación en sus propiedades de superficie, el impedimento a la secreción del surfactante por las células del epitelio mucoso sin relación con la destrucción celular y derivado de todo esto el aumento a la permeabilidad de macromoléculas de diferentes tamaños de características hidrofílicas son los mecanismos por los cuales los tóxicos que actúan directamente sobre la superficie mucosa del colon desarrollan su acción. 82 4.4. ABSORCION DE MOLECULAS DESDE LA LUZ. Aunque la función de absorción de sustancias desde la luz intestinal no es la principal en el intestino grueso, también existe siendo los electrolitos y el agua las moléculas principalmente involucradas en esta propiedad. Si bien algunos de los electrolitos que se absorben lo hacen mediante un sistema de transporte activo otros lo llevan a cabo a favor de gradientes de concentración y habitualmente relacionados con una concomitante absorción de agua. La disposición de la capa de surfactante sobre la superficie endoluminal del intestino grueso le confiere a dicha superficie características hidrofóbicas. La pérdida o el deterioro de dicha monocapa afectará por un lado la absorción de los iones que está relacionada con la del agua y por otro a la de moléculas que exhiben propiedades hidrofílicas. 83 OBJETIVOS 84 Los objetivos que nos hemos planteado alcanzar con el desarrollo de la presente investigación se han agrupado en cinco puntos. • Evidenciar los fenómenos de superficie y concretamente la propiedad de la hidrofobicidad que se manifiesta en la monocapa de surfactante que tapiza el moco colónico. • Analizar la relación entre las características clínicas de los pacientes (enfermedades asociadas que presentan) y los valores de hidrofobicidad de la mucosa del colon. • Estudiar ex vivo el efecto que sobre la hidrofobicidad de la mucosa del colon produce la exposición ante agentes citoprotectores y otros lesivos. • Analizar la hidrofobicidad en la superficie mucosa del colon a lo largo de los distintos segmentos en los que anatómicamente se divide. • Analizar la composición fosfolipídica del surfactante colónico y su relación con las propiedades de superficie que presenta la mucosa. 85 Como consecuencia de todo esto plantearemos posibles implicaciones de estos fenómenos y sus bases fisicoquímicas en entidades clínicas concretas tanto a nivel de su etiopatogenia como de su tratamiento. 86 MATERIAL 87 I. MUESTRAS DE COLON. Las muestras de mucosa colónica utilizadas en el presente trabajo provienen todas de piezas operatorias procedentes de pacientes intervenidos en la Unidad de Cirugía Colorectal del Servicio de Cirugía General y del Aparato Digestivo del Hospital Vall d’Hebron de Barcelona. La indicación de la intervención quirúrgica como tratamiento de una determinada patología así como la técnica quirúrgica empleada en cada caso se han establecido de acuerdo con los protocolos del centro y en último caso dependen de la decisión del cirujano o equipo quirúrgico responsable del paciente. 1. CRITERIOS DE INCLUSION. - Muestras procedentes de pacientes intervenidos quirúrgicamente para serles extirpado parte o todo el colon y/o el recto de forma electiva. - Muestras procedentes de dichas piezas operatorias de pacientes cuya patología no afecta de forma difusa a la mucosa colónica 88 2. CRITERIOS DE EXCLUSION. - Pacientes intervenidos de forma urgente. - Pacientes que no han recibido limpieza colónica preoperatoria o la que recibieron fue incompleta o distinta a la protocolizada. - Pacientes con enfermedades que afectan difusamente a la mucosa del colon y recto principalmente enfermedad inflamatoria intestinal (enfermedad de Crohn y colitis ulcerosa), colitis isquémica, infecciosa o de cualquier otra etiología y enfermedades sistémicas (vasculitis y otras). - Pacientes que han recibido tratamiento previamente con radioterapia sobre la pelvis cuando se trata de muestras obtenidas del recto. II. MATERIAL DE LABORATORIO. 1. INSTRUMENTAL. • Papel secante • Pinzas de disección • Tijeras de Castroviejo • Batea metálica • Portaobjetos de vidrio. • Viales de vidrio. • Rejilla metálica portaviales • Baño(Thermomix BM. B. Braun Biotech International). • Congelador (AEG. SANTO). • Matraz de decantación 89 • Tubos de Eppendorf • Papel de filtro Whatman nº 1 (Whatman International. Maidstone, England). • Micropipetas de 100, 200, 1000 y 5000 µL. • Puntas de pipeta • Centrifugadoras (GERHARDT MAG-H y HEIDOLPH REAX 2000). • Balanza de precisión (OHAUS GALAXY TM 110). • Tiras reactivas para medida del pH. 2. REACTIVOS. • Nitrógeno líquido (Merck) • Metanol absoluto (Merck) • Cloroformo absoluto (Merck) • Cloruro potásico 0.1 Molar (Merck) • Acido sulfúrico 10 Normal (Merck) • Peróxido de hidrógeno al 30% (Merck) • Urea al 5% (Merck) • Molibdato de amonio al 5% (Merck) • Reductor de Fiske-Subbarow (Merck) • Carbógeno (Oxígeno y dióxido de carbono en mezcla comprimida). • Mouse Epidermal Grow Factor (Sigma, St. Louis, MO, USA) • Prostaglandina E2 (ácido 5Z,11α, 13E,15S-11,15-dihidroxi-9oxoprosta-5,13-dienoico). (Sigma, St. Louis, MO, USA) • Indometacina (ácido 1-p-clorobenzoil-5-metoxi-2-metilindol-3acético). (Sigma, St. Louis, MO, USA) 90 • Diclofenaco (ácido 2-2,6-diclorofenilamino-bencenoacético) (Sigma, St. Louis, MO, USA). 3. APARATOS DE LECTURA. • Goniómetro (Model 100-00 NRL Contact Angle Goniometer. RaméHart, Mountain Lakes, NJ, USA). 91 METODO 92 El método utilizado en el presente trabajo se puede dividir en tres fases consecutivas en el tiempo y dependientes una de otra. Previamente y dentro del periodo preoperatorio existe una selección del paciente siguiendo los criterios de inclusión que se han definido en el material. Una primera fase es aquella que comprende la preparación preoperatoria del paciente que va a ser sometido a la intervención quirúrgica a través de la cual obtendremos los especímenes (muestras de mucosa colónica) que servirán como sustrato de nuestros experimentos. A continuación se desarrolla la fase en la cual se obtiene dicho especimen, en el área quirúrgica, y tras la resección del colon. Por último, el periodo que se desarrolla en el laboratorio que a su vez tiene dos etapas claramente diferenciadas; la que se refiere a la determinación de lípidos y fosfolípidos que se lleva a cabo de una manera diferida en muestras de tejido congelado y la que incumbe a la determinación de las propiedades de superficie de la mucosa colónica (hidrofobicidad) que esta es necesario realizarla en tejido en fresco y por consiguiente inmediatamente a la llegada de la muestra al laboratorio. En la siguiente pagina esquematizamos los pasos que seguimos en el método del presente trabajo. 93 CRITERIOS DE INCLUSION Y EXCLUSION. SELECCIÓN DE PACIENTES INTERVENCION QUIRURGICA. OBTENCION DE LA MUESTRA PROCESO EN EL LABORATORIO LECTURA EN FRESCO HIDROFOBICIDAD CONGELACION DETERMINACION DE LIPIDOS Y FOSFOLIPIDOS ELABORACION DE RESULTADOS. ESTADISTICA 94 I. TIEMPO PREOPERATORIO. Los pacientes sometidos a cirugía colorectal electiva y siguiendo el protocolo vigente en nuestro hospital requieren una preparación preoperatoria, la cual expondremos seguidamente. Anteriormente al ingreso se recomienda al paciente y por un periodo no inferior a 48-72 horas hacer una ingesta exenta de alimentos ricos en residuos con el fin de disminuir el contenido fecal colónico lo máximo posible. El día previo a la intervención con el paciente ingresado y en dieta absoluta, comenzando entre las 8:00 y las 9.00 horas se administra vía oral al paciente entre 3 y 4 litros de solución evacuante Bohm reconstituida, consumida a razón de 250 ml cada 15 minutos, hasta que la totalidad del volumen haya sido ingerido o el afluente rectal es claro y exento de restos fecales. La composición química de dicha solución es la siguiente. (Tabla 4) Tabla 4: Composición química de la solución evacuante. COMPUESTO QUIMICO g / 250 ml DE SOLUCIÓN Polietilenglicol 15 gramos Cloruro sódico 0.365 gramos Cloruro potásico 0.186 gramos Sulfato sódico 1.4 gramos Bicarbonato sódico 0.42 gramos Bifosfonato sódico 0.12 gramos Cuando cesan las deposiciones líquidas perfundimos un suero glucosado al 5% a ritmo de 1000cc cada 24 horas. Una hora después de haber finalizado la preparación intestinal mecánica se administra el antibiótico oral: neomicina 1 g. y eritromicina base 1 g. tres dosis, la segunda 2 horas después de la primera y la tercera 9 horas después de la segunda. 95 Estos antibióticos tienen función descontaminante intraluminal siendo irreabsorbibles. El mismo día de la intervención, a las 7:00 horas, se administra al paciente 20 mg por vía subcutánea de enoxaparina sódica como medida profiláctica de la trombosis venosa. Durante la inducción anestésica y como profilaxis antibiótica se administra 2 g endovenosos de cefoxitina o bien 600 mg de clindamicina junto a 80 mg de gentamicina, así mismo endovenosos, en caso de alergia a los β-lactámicos. II. TIEMPO INTRAOPERATORIO. Según la localización de la patología por la cual se interviene el paciente se procede a un tipo u otro de resección de colon. El tipo de resección que se realiza se lleva a cabo según el criterio del cirujano responsable del paciente y esta viene definida por la situación en los diferentes segmentos del colon de la patología. En general se agrupan en dos grandes bloques los tipos de resección que se aplican en la cirugía del colon dependiendo del segmento colónico subsidiario de ser resecado: •Resecciones típicas. (Tabla 5) •Resecciones más o menos amplias que las anteriores. Una vez ligado el pedículo vascular no debe pasar un tiempo mayor a treinta minutos hasta el inicio del procesamiento de la pieza (tiempo de isquemia). Durante este periodo de tiempo la pieza se conserva totalmente sumergida en suero fisiológico (77 mM de Cl y 77 mM de Na-0.9 g de cloruro sódico- en 500 ml de solución) y en la nevera a 4 ºC. 96 Se seccionan dos o tres rodetes de 3 cm de ancho cada uno de los segmentos de colon que estudiaremos trasladándose inmediatamente y sumergidos así mismo en suero fisiológico al laboratorio. Tabla 5: Resecciones típicas de colon. TIPO DE RESECCION COLONICA HEMICOLECTOMIA DERECHA HEMICOLECTOMIA IZQUIERDA LOCALIZACION DE LA MUESTRA -CIEGO -COLON ASCENDENTE -COLON TANSVERSO PROXIMAL -COLON TRANSVERSO DISTAL -COLON DESCENDENTE -SIGMA SIGMOIDECTOMIA -SIGMA RESECCION ANTERIOR DE RECTO -SIGMA -RECTO AMPUTACION ABDOMINOPERINEAL -SIGMA -RECTO III. TIEMPO DE LABORATORIO. 1. PREPARACION DE LA MUESTRA. Una vez en el laboratorio se colocan las piezas, cuya mucosa será procesada, sumergidas en solución fisiológica modificada de Krebs-Ringer-Tris con un pH de 7.4 y a una temperatura de 4ºC. (Tabla 6) 97 Tabla 6: Solución fisiológica modificada. Composición. COMPONENTE CONCENTRACION (mM/L) GLUCOSA 11.1 CLORURO SODICO (NaCl) 118.3 CLORURO POTASICO (KCl) 4.7 SULFATO MAGNESICO (MgSO4) 1.2 FOSFATO POTASICO (KH2PO4) 1.2 CLORURO CALCICO (CaCl2) 2.5 BICARBONATO SODICO (NaHCO3) 2.5 De cada rodete de colon se diseca la mucosa del resto de la pared colónica seccionándose longitudinalmente dicha mucosa en muestras de 2 x 3 cm que se pesarán. El número de muestras necesarias de cada segmento de colon es como mínimo de 9. Una de estas muestras la reservamos y congelamos en nitrógeno líquido a –80ºC para la determinación de lípidos y en las ocho restantes medimos la parte correspondiente a la hidrofobicidad. 2. DETERMINACION DE LIPIDOS Y FOSFOLIPIDOS. Tras el proceso de disección de la mucosa colónica, una de las nueve secciones en las que subdividimos cada pieza de colon se pesa y congela en nitrógeno líquido a –80ºC reservándose para ser utilizada en esta determinación. Todas estas secciones de mucosa se homogeneizan en suero fisiológico. 98 El homogeneizado se redisuelve en metanol-cloroformo (1:1) para la extracción de la fase lipídica, según el método de Folch (106). Posteriormente y tras evaporación en atmósfera de nitrógeno, las muestras se resuspenden en benzeno y el contenido de fosfolípidos se mide a través de la determinación del fósforo inorgánico según el método descrito por Ames (107). 2.1. EXTRACCIÓN DE LÍPIDOS. Para n ml de homogeneizado en suero fisiológico de tejido añadimos 5n ml de metanol absoluto y lo mantenemos en agitación durante 30 minutos a temperatura ambiente. Seguidamente añadimos 5n ml de cloroformo agitando vigorosamente durante 15 minutos más. Posteriormente lo filtramos en Whatman nº1 y resuspendemos de nuevo el residuo en metanol cloroformo. Finalmente evaporamos el extracto con atmósfera de Nitrógeno a sequedad obteniendo los lípidos presentes en la muestra la cual denominaremos extracto A. 2.2. EXTRACCIÓN DE FOSFOLÍPIDOS. Resuspendemos el extracto A en 5 ml de cloroformo y lo vertimos en un matraz de decantación. Lavamos el tubo que contenía dicho extracto A con 3 ml de metanol y lo añadimos al matraz. Volvemos a lavar dicho tubo con 2 ml de cloruro potásico (KCl) 0.1 Molar y lo añadimos al matraz. Agitamos el matraz, abriéndolo para sacar el aire y lo ponemos en posición normal. Con esto conseguimos que quede la fase acuosa arriba y la fase orgánica debajo. 99 Decantamos la fase acuosa y la evaporamos en atmósfera de nitrógeno a sequedad obteniendo lo que denominaremos como extracto B. En la fase acuosa se puede determinar el fósforo inorgánico correspondiente a otras moléculas que no sean proteínas ni fosfolípido 2.3. DETERMINACIÓN DE FOSFOLÍPIDOS. Resuspendemos el extracto B en 1 ml de benceno. Ponemos 0.5 ml de dicha suspensión en un vial de vidrio y lo evaporamos en atmósfera de nitrógeno a sequedad. Añadimos 0.5 ml de ácido sulfúrico 10 Normal (para preparar dicha concentración de sulfúrico se añaden poco a poco 28 ml de ácido sulfúrico concentrado a una probeta puesta en hielo y que contenga 72 ml de agua destilada, dejando lo resultante en hielo hasta que se enfríe). Colocamos la muestra en estufa (200ºC) durante 3 horas. Dicha muestra se calcina con lo que el líquido adquiere color negro. Añadimos ahora una gota de peróxido de hidrógeno al 30% con lo que el líquido quedará blanco o casi blanco. Recolocamos la muestra en la estufa a idéntica temperatura durante 90 minutos más, repitiendo la operación si la muestra no queda transparente. Sacamos la muestra y le añadimos una gota de urea al 5%. Por último y para determinar el fósforo inorgánico (108) tratamos la muestra añadiendo 4.4 ml de agua destilada, 0.2 ml de molibdato de amonio al 5% y por último, ya que es lo que inicia la reacción, 0.2 ml de reductor de Fiske-Subbarow 0.158 g/ml. Se coloca el vial en un baño a 100ºC durante 7 minutos. La muestra toma un color azul. 100 Mediante la siguiente fórmula determinamos la cantidad de los distintos fosfolípidos presentes en lo aislado: µg de fosfolípido = µmoles de fósforo inorgánico x peso molecular del fosfolípido 3. DETERMINACION DE LA HIDROFOBICIDAD. 3.1. PROCESAMIENTO DE LA MUESTRA. Cada uno de los ocho segmentos de mucosa colónica destinados al estudio de las propiedades de superficie es procesado de diferente manera: 1- Sumergido durante 60 minutos en solución fisiológica (segmento no procesado). 2- Sumergido durante 60 minutos en 3 ml. de solución fisiológica inyectando durante este tiempo carbógeno al medio y calentado en estufa a 37ºC. 3- Sumergido durante 60 minutos en un volumen total de 3 ml. de solución fisiológica y EGF inyectando durante este tiempo carbógeno al medio y calentado en estufa a 37ºC. 4- Sumergido durante 60 minutos en un volumen total de 3 ml. de solución fisiológica y PGE2 inyectando durante este tiempo carbógeno al medio y calentado en estufa a 37ºC. 5- Sumergido durante 60 minutos en un volumen total de 3 ml. de solución fisiológica y diclofenaco (150 µL) inyectando durante este tiempo carbógeno al medio y calentado en estufa a 37ºC. 6- Sumergido durante 60 minutos en un volumen total de 3 ml. de solución fisiológica y diclofenaco (300 µL) inyectando durante este tiempo carbógeno al medio y calentado en estufa a 37ºC. 101 7- Sumergido durante 60 minutos en un volumen total de 3 ml. de solución fisiológica e indometacina (150 µL), inyectando durante este tiempo carbógeno al medio y calentado en estufa a 37ºC. 8- Sumergido durante 60 minutos en un volumen total de 3 ml. de solución fisiológica e indometacina (300 µL ), inyectando durante este tiempo carbógeno al medio y calentado en estufa a 37ºC. Previamente a la incubación medimos el pH de cada uno de los diferentes medios. 3.2. DILUCIONES. La preparación previa de las distintas sustancias con las cuales se procesa la mucosa de colon requiere la dilución de las mismas en distintos disolventes según las características fisicoqímicas de cada una de ellas. EGF: en solución fisiológica. PGE2: el vial de 1 mg se diluye en 20 ml de etanol absoluto. DICLOFENACO: 10 mg de diclofenaco en 10 ml de agua destilada agitando posteriormente INDOMETACINA: 10mg de indometacina en 10 ml de bicarbonato sódico al 5% en peso/volumen (5mg de HCO3Na en 100ml de agua destilada) agitándolo en caliente hasta que la solución adquiera color amarillo. Estas diluciones en lo que se refiere al EGF y a la PGE2 se llevan a cabo y se congelan en volúmenes adecuados contenidos en viales de Eppendorf para su utilización en el momento que se disponga de muestra de colon. En cuanto a la dilución del diclofenaco y de la indometacina esta tiene que llevarse a cabo en el momento de ser utilizada ya que sus propiedades no se mantienen con la congelación. 102 3.3. INCUBACIÓN DE LA MUESTRA. Se sacan del congelador los Eppendorf necesarios (según tamaño de la pieza) de PGE2 o de EGF para que se vayan descongelando a temperatura ambiente. Los tubos de EGF contienen 100 µl de solución fisiológica, con una concentración de 60µg de EGF/ml, de forma que hay 6 µg de EGF por tubo. Los tubos de PGE2 tienen 1 ml de solución fisiológica, con una concentración de 9 µg/ml. Colocamos agua destilada en el baño donde incubaremos las muestras de mucosa de forma que el nivel del agua llegue a la mitad de los viales, sin que estos se muevan. Ponemos el termostato a 37ºC y comprobamos que se alcanza exactamente esta temperatura. Utilizamos una gradilla del tamaño ajustado al baño y viales de vidrio (20 ml de volumen) suficientes. Preparamos la solución fisiológica y la dejaremos en la mesa junto a micropipetas de 5000, 1000 y 100 (o 200) µl, las puntas de pipeta necesarias, el material quirúrgico de disección y el papel de filtro. El lavado de la pieza de colon se hace en un vaso lleno de solución fisiológica enterrado hasta la mitad en una bandeja con hielo agitando dicha pieza en la solución ayudándonos con unas pinzas. A continuación, ponemos la pieza sobre papel de filtro humedecido con solución fisiológica fría y disecamos la mucosa del resto de las capas de la pared del colon. Cortamos dicha mucosa en fragmentos de unos 3x2 cm y los colocamos en otro vaso con solución fisiológica limpia y fría. Reservamos un fragmento para determinar la hidrofobicidad a tiempo 0 (sin incubar). 103 El volumen de incubación total será de 3 ml (3000 µL). Ponemos 1 pieza de colon por vial con lo que incubaremos grupos de 7 viales por zona de colon. (Tabla 7). Tabla 7: Diluciones en la incubación. CONTROL EGF PGE2 DICLOFENACO 45 g DICLOFENACO 90 g INDOMET. 45 g INDOMET. 90 g SOLUC. FISIOL. 3000 µL 2900 µL 2333 µL EGF PGE2 DICLOF. INDOMET. 100µL 667 µL 2850 µL 150 µL 2700 µL 300 µL 2850 µL 150 µL 2700 µL 300 µL Colocamos los viales en una gradilla, introduciremos en cada vial un inyector de carbógeno de tal manera que la punta del inyector produzca el burbujeo del líquido contenido en el vial pero no contacte con la muestra de mucosa y pondremos dicha gradilla en el baño. Incubamos durante 1 hora. Una vez transcurrido este tiempo se extraen las piezas de colon de los viales cuidadosamente con ayuda de unas pinzas y se depositan sobre papel de filtro humedecido con solución fisiológica, con la cara luminal hacia arriba. Extendemos la pieza y la colocaremos arrastrándola sujetando los bordes de la misma con unas pinzas sobre un portaobjetos de cristal. Posteriormente dejamos secar al aire, a temperatura ambiente y durante el tiempo que sea necesario dichos fragmentos de mucosa colónica. 104 3.4. MEDIDA DE LA HIDROFOBICIDAD. Una vez que hemos comprobado que la superficie de la mucosa está completamente seca se coloca el porta que la contiene sobre la plataforma del goniómetro. Este goniómetro-microscopio (Figura 12) consta básicamente de un cuentagotas, una fuente de luz, un sistema de lentes, una regla con forma semicircular graduada con valores de ángulo de contacto y un sistema de cremalleras y ruedas que permite mediante movimientos de rotación y de aproximación proyectar sobre la regla semicircular las líneas tangentes que nos determina el valor de ángulo de contacto correspondiente a la gota formada sobre la muestra de tejido que se está estudiando. Figura 12: Goniómetro. 105 A continuación, previo desecho de la primera y mediante el cuentagotas que está fijo en el aparato depositamos separadas entre ellas 5 gotas de suero salino de 5 µL cada una sobre el lado luminal de la mucosa. Ahora ya se puede medir el ángulo que forma la gota en la interfase airelíquido-sólido que es un índice de la hidrofobicidad del tejido, de tal manera que cuanto mayor es el ángulo de contacto mayor es la hidrofobicidad y menor la permeabilidad de la mucosa a sustancias hidrofílicas y iones. IV. RECOGIDA DE DATOS. Los parámetros evaluados se recogieron mediante una base de datos diseñada con el sistema MICROSOFT ACCESS 97. En la siguiente página exponemos los parámetros objeto del presente estudio agrupados en la columna de la izquierda y subdivididos en la columna de la derecha (Tabla 8). 106 Tabla 8: Parámetros de la base de datos. FILIACION DATOS ANTROPOMETRICOS ENFERMEDADES ASOCIADAS PATOLOGIA PRIMARIA LOCALIZACION DE LA PATOLOGIA PRIMARIA Nombre y apellidos Número de historia clínica Fecha de nacimiento Sexo Peso Talla Diabetes Mellitus Hipertensión arterial Broncopatía Cardiopatía Dislipemia Enfermedad diverticular del colon Tumor benigno de colon Poliposis colónica Tumor maligno de colon Tumor benigno de intestino delgado Ciego Colon ascendente Colon transverso proximal Colon transverso distal Colon descendente Sigma Recto NUMERO DE MUESTRAS OBTENIDAS LOCALIZACION DE LAS MUESTRAS OBTENIDAS PESO DE LA MUESTRA VALOR DE ANGULO DE CONTACTO Ciego Colon ascendente Colon transverso proximal Colon transverso distal Colon descendente Sigma Recto Solución fisiológica EGF PGE2 Diclofenaco (150 µL) Diclofenaco (300 µL) Indometacina (150 µL) Indometacina (300 µL) Solución fisiológica EGF PGE2 Diclofenaco (150 µL) Diclofenaco (300 µL) Indometacina (150 µL) Indometacina (300 µL) 107 V. ANALISIS ESTADISTICO DE LOS DATOS. El estudio estadístico ha sido realizado mediante el programa informático GRAPHPAD INSTAT 3.0. (San Diego, California, EUA). Como primer paso en el desarrollo estadístico de este trabajo se valora mediante el test de Kolmogorov y Smirnov (109) si las poblaciones estudiadas siguen una distribución gaussiana (normal). Cuando los grupos no siguen la distribución normal las variables se describen mediante los valores de mediana, valor máximo y valor mínimo. La comparación entre estos grupos se realizó mediante los siguientes tests no paramétricos: -La U de Mann-Whitney para comparar dos muestras no relacionadas. -El análisis de la varianza de Kruskal-Wallis para comparar tres o más muestras no relacionadas aplicando el post-test de las múltiples comparaciones de Dunn. -El coeficiente de correlación de Spearman. Cuando la distribución poblacional es la normal, la descripción de las variables la hacemos mediante la media y el error estándar (típico) de la media (SEM). Entonces los tests estadísticos aplicados son: -La t de Student con la corrección de Welch para dos muestras. -El análisis de la varianza (ANOVA) para comparar tres o más muestras con el post-test de las comparaciones múltiples de Tukey-Kramer. El nivel de significación estadística aceptado ha sido del 5% (p<0.05) 108 RESULTADOS 109 La exposición de los resultados obtenidos en el presente trabajo se ha dividido en tres apartados para facilitar su comprensión: 1. Características epidemiológicas de la población. 2. Resultados relacionados con las propiedades de superficie de la mucosa colónica. 3. Resultados relacionados con la naturaleza del surfactante colónico. I. CARACTERISTICAS EPIDEMIOLOGICAS DE LA POBLACION. Las muestras de mucosa colónica objeto de este estudio se obtuvieron de 74 pacientes. La edad media de este grupo fue de 66 años con un rango entre 17 años y 85 años. La distribución por sexos de esta población fue de 40 varones (54.054%) y 34 mujeres (45.945%). (Tabla 9) 110 Tabla 9: Características demográficas de la población. Población del estudio (n) 74 Distribución por edades: Edad media: 66 años Rango de edad: 17-85 años Distribución por sexos: Varones: 40 (54.054%) Mujeres: 34 (45.945%) De los 74 pacientes que componen la población objeto del presente trabajo, 46 (62.162 %) no referían patología asociada y 28 (37.837 %) presentaban antecedentes patológicos reseñables. En estos 28 enfermos se detectaron cuatro casos de patologías asociadas coincidentes, lo que supone un total de 32 casos de patología asociada. Las patologías asociadas halladas en la población en estudio se detallan en la siguiente tabla. (Tabla 10) Tabla 10: Patologías asociadas. PATOLOGIA NUMERO DE PACIENTES DISLIPEMIA 3 DIABETES MELLITUS 5 BRONCOPATIA CRONICA 7 HIPERTENSION ARTERIAL 8 CARDIOPATIA 9 111 Los pacientes en los cuales coincidieron dos enfermedades asociadas fueron cuatro y lo hicieron tal y como se reseña en el siguiente cuadro. (Tabla 11) Tabla 11: Asociación de antecedentes patológicos. HTA Y DIABETES MELITUS 2 PACIENTES HTA Y CARDIOPATIA 1 PACIENTE CARDIOPATIA Y DISLIPEMIA 1 PACIENTE La distribución porcentual de la población con patologías asociadas se refleja con respecto al total de la población en estudio mediante un diagrama circular. (Figura 13) Figura 13: Patología asociada. 38% SIN PATOLOGIA ASOCIADA (46 PACIENTES) 62% CON PATOLOGIA ASOCIADA (28 PACIENTES) La distribución en tanto por ciento dentro del grupo de población con antecedentes patológicos viene representada en el siguiente gráfico. (Figura 14) 112 Figura 14: Antecedentes patológicos. 25% DISLIPEMIA 22% DIABETES MELLITUS BRONCOPATIA CRONICA 28% 16% HIPERTENSION ARTERIAL CARDIOPATIA 9% La patología por la cual se intervinieron estos 74 pacientes quedó distribuida de la siguiente manera. (Tabla 12) Tabla 12: Patología actual. PATOLOGIA NUMERO DE PACIENTES TUMOR MALIGNO DE COLON: ADENOCARCINOMA 63 PSEUDOMIXOMA PERITONEAL 1 ENFERMEDAD DIVERTICULAR 8 POLIPOSIS DE COLON 1 TUMOR BENIGNO DE ILEON 1 La distribución en porcentajes de dicha patología viene reflejada en el siguiente diagrama circular. (Figura 15) 113 Figura 15: Patología actual. 87% Neoplasia Enfermedad diverticular Poliposis colónica Tum. Benigno ileon 1%1% 11% Del conjunto de estos 74 pacientes se obtuvieron 134 muestras de mucosa colónica. La distribución por segmentos colónicos de estas muestras quedó de la siguiente manera. (Tabla 13) Tabla 13: Distribución de las muestras en los segmentos colónicos. SEGMENTO DE COLON NUMERO DE MUESTRAS CIEGO 15 COLON ASCENDENTE 15 COLON TRANSVERSO PROXIMAL 15 COLON TRANSVERSO DISTAL 15 COLON DESCENDENTE 17 SIGMA 37 RECTO 20 114 La distribución en porcentajes de las muestras en cuanto a su localización viene reflejada en el siguiente diagrama circular. (Figura 16) Figura 16: Distribución de las muestras de mucosa en los diferentes segmentos del colon. 13% CIEGO 28% 11% COL ASC. COL. TRV. PROX COL. TRV. DIST COL. DES. 11% SIGMA 11% 15% 11% RECTO II. PROPIEDADES DE SUPERFICIE EN LA MUCOSA DEL COLON. 1. VALIDACION DEL TIEMPO DE ISQUEMIA Y DE LA TEMPERATURA DE CONSERVACION DE LAS MUESTRAS DE MUCOSA COLONICA. Como paso previo al estudio de la propiedad de la hidrofobicidad en la mucosa colónica se valido en una muestra de 20 especimenes el efecto que sobre los valores de ángulo de contacto tienen: -El tiempo de isquemia, medido en minutos desde la ligadura del pedículo vascular. -La temperatura de conservación de dicho especimen, diferenciando entre ambiente (22ºC) y frío (4ºC). 115 Los resultados medios obtenidos expresados en porcentajes del valor de hidrofobicidad a tiempo 0 de isquemia vienen reflejados de la siguiente forma. (Tabla 14) Tabla 14: Efecto de la isquemia y la temperatura sobre la mucosa colónica. TIEMPO DE ISQUEMIA AMBIENTE (22ºC) FRIO (4ºC) 30 90% 99.5% 60 85% 90% 120 80% 83% 150 71% 80% 180 64% 72% (minutos) Cuando representamos en una gráfica los valores obtenidos durante la validación del efecto de la temperatura y el tiempo de isquemia en las muestras de mucosa colónica estudiadas vemos que con un tiempo de isquemia máximo de 30 minutos y en unas condiciones de conservación de la muestra en frío los valores de hidrofobicidad medidos como valor de ángulo de contacto se aproximan a los que se obtienen de muestras que no han sufrido isquemia y no han requerido ningún tipo de conservación. (Figura 17) 116 PORCENTAJE DE LA HIDROFOBICIDAD A TIEMPO 0 Figura 17: Validación del tiempo de isquemia y la temperatura de conservación de las muestras. 120 100 80 AMBIENTE (22ºC) 60 FRIO (4ºC) 40 20 0 30 60 120 150 180 TIEMPO DE ISQUEMIA (minutos) 2. LA HIDROFOBICIDAD EN LA SUPERFICIE MUCOSA COLÓNICA. De la población objeto de nuestro estudio formada por 74 pacientes se obtuvo en total 134 muestras de mucosa colónica. En cada muestra se midieron cinco valores de hidrofobicidad. 74 Pacientes 134 5 670 Muestras de Medidas por Valores de mucosa colónica muestra hidrofobicidad En este primer grupo de 134 muestras obtenemos los valores de ángulo de contacto en tejido sin procesar (el cual hemos denominado en el método como grupo “al aire”), siendo este el grupo control. 117 Su distribución poblacional es la siguiente. (Tabla 15) Tabla 15: Hidrofobicidad en la mucosa colónica. Grupo control. N MEDIA DESVIACION ESTANDAR ERROR ESTANDAR DE LA MEDIA MINIMO MAXIMO MEDIANA LIMITE INFERIOR DE CONFIANZA PARA UN 95% LIMITE SUPERIOR DE CONFIANZA PARA UN 95% TIPO DE DISTRIBUCION POBLACIONAL CONTROL 134 39.5223 0.6456 0.0557 38 41 39.5 39.413 39.632 NORMAL 3. HIDROFOBICIDAD DE LA SUPERFICIE MUCOSA DEL COLON COMO PROPIEDAD PRESENTE Y MODIFICABLE “ EX VIVO”. Comparamos los valores de hidrofobicidad, como valores de ángulo de contacto, entre muestras de mucosa de colon sin incubar (grupo “control”) y muestras incubadas en un medio que solo contiene solución fisiológica (grupo “solución fisiológica”). (Tabla 16). 118 Tabla 16: Hidrofobicidad en la mucosa colónica. Grupo solución fisiológica. CONTROL SOLUCION FISIOLOGICA N 134 134 MEDIA 39.5223 42.291 DESVIACION ESTANDAR 0.6456 0.5596 ERROR ESTANDAR DE LA MEDIA 0.0557 0.0483 MINIMO 38 41 MAXIMO 41 44 MEDIANA 39.5 42 39.413 42.196 39.632 42.386 9062.5 26984 LIMITE INFERIOR DE CONFIANZA PARA UN 95% LIMITE SUPERIOR DE CONFIANZA PARA UN 95% SUMA DE RANGOS Los estadísticos aplicados y los resultados obtenidos son (Tabla 17) Tabla 17: Control / Solución fisiológica. Significación estadística. U de MANN-WHITNEY= 17.5 U’= 17939 P 0.0001 119 4. INFLUENCIA DE LA PATOLOGIA ASOCIADA EN LA HIDROFOBICIDAD DE LA MUCOSA DEL COLON. Del total de las 134 muestras de mucosa colónica obtenidas de los 74 pacientes objeto del presente trabajo, 47 pertenecen a pacientes con patología asociada y 87 a pacientes sin patología acompañante. La distribución por patologías de estas 47 muestras quedan divididas en cinco grupos correspondientes a los cinco antecedentes patológicos detectados en este grupo de población. (Tabla 18) Tabla 18: Número de muestras en cada patología asociada. PATOLOGIA ASOCIADA NUMERO DE MUESTRAS DISLIPEMIA 5 DIABETES MELLITUS 7 HIPERTENSION ARTERIAL 10 BRONCOPATIA CRONICA 12 CARDIOPATIA 13 TOTAL 47 Comparamos los resultados de hidrofobicidad obtenidos en las 47 muestras de pacientes en los cuales se asocia alguna enfermedad como antecedente patológico con los obtenidos de las 87 muestras de los pacientes que no refieren tener antecedentes patológicos en su historia clínica. (Tabla 19). 120 Tabla 19: Asociación de patología. Número de muestras (N) Media Desviación estándar(SD) Mediana Mínimo Máximo Error estándar de la media (SEM) Límite inferior de confianza para un 95% Límite superior de confianza para un 95% PATOLOGIA ASOCIADA 47 39.340 0.6351 39 38 41 SIN PATOLOGIA ASOCIADA 87 39.643 0.6283 40 38 41 0.092 0.067 39.154 39.510 39.527 39.778 La distribución estadística que siguen estos dos grupos es la normal en el caso del que no asocia antecedentes patológicos (p>0.1 para un KS de 0.363) mientras que el primer grupo no la sigue (p< 0.0001 para un KS de 0.1114). Ante esto se han aplicado tests estadísticos no parámetricos cuyos resultados se exponen en la siguiente tabla. (Tabla 20). Tabla 20: Resultados estadísticos. Suma de rangos U de Mann-Whitney U’ p Patología asociada: 2652.5 Sin patología asociada: 6392.5 1524.5 2564.5 0.0141 121 En el contexto de las muestras provenientes de pacientes con antecedentes patológicos buscamos si existen diferencias entre los distintos grupos según las cinco patologías asociadas que hemos encontrado. (Tabla 21) Tabla 21: Patologías asociadas. DIABETES MELLITUS HTA 7 10 12 13 5 39 39 39.583 39.3076 40 0.5774 0.4714 0.6686 0.4804 0.7071 39 38 40 39 38 40 39.5 39 41 39 39 40 40 39 41 0.2182 0.1491 0.1930 0.1332 0.3162 38.466 38.663 39.159 39.017 39.122 39.534 39.337 40.008 39.598 40.878 Número de muestras (N) Media Desviación estándar (SD) Mediana Mínimo Máximo Error estándar de la media (SEM) Límite inferior de confianza para un 95% Límite superior de confianza para un 95% BRONCOPAT. CARDIOPAT. DISLIP. La distribución estadística que siguen estos cinco grupos es la normal. (Tabla 22) Tabla 22: Valores de la prueba de Kolmogorov-Smirnov de normalidad. KS DIABETES MELLITUS 0.2627 HTA BRONCOPATIA CARDIOPATIA DISLIPEMIA 0.2125 0.1721 0.1860 0.1791 122 En cada uno de los cinco grupos el valor de la p es mayor de 0.1 lo que implica la posibilidad de aplicar test normales. El no haber hallado diferencias significativas entre las desviaciones estándar de los cinco grupos tras la aplicación del método de Bartlett (estadístico de Bartlett de 2.139 para una p=0.7102) nos permite la aplicación del análisis de la varianza (ANOVA) del cual resulta una p=0.0109 (<0.05). De la aplicación del test de las comparaciones múltiples de Tukey-Kramer como post-test se deduce que la p<0.05 se dará siempre que el valor de q>4.033. En la comparación de los cinco grupos dos a dos esta condición se define en dos de ellos. (Tabla 23) Tabla 23: Significación estadística dentro del grupo con enfermedades asociadas. DIABETES MELLITUS / DISLIPEMIA q=4.231 (p 0.05) HTA / DISLIPEMIA q=4.523 (p 0.05) En el resto de las comparaciones dos a dos los valores de la q son menores de 4.033 lo que supone una p>0.05. 123 5. HIDROFOBICIDAD DE LA SUPERFICIE MUCOSA DEL COLON COMO PROPIEDAD MODULABLE “ EX VIVO”. Compararemos los valores de hidrofobicidad, como valores de ángulo de contacto, entre las muestras incubadas solo con solución fisiológica y las incubadas en un medio que contiene dicha solución y sustancias citoprotectoras (EGF y PGE2) y otras lesivas (antiinflamatorios no esteroideos: diclofenaco e indometacina). 5.1. CITOPROTECCION. Los parámetros estadísticos obtenidos de la incubación de las muestras de mucosa de colon en un medio con citoprotectores han sido los siguientes. (Tabla 24) Tabla 24: Citoprotección. N Media Desviación estándar (SD) Error estándar de la media (SEM) Límite inferior de confianza para un 95% Límite superior de confianza para un 95% SOL. FISIOL. 134 42.291 0.5596 EGF 134 49.4477 0.6201 PGE2 134 47.3208 0.6082 0.0483 0.0535 0.0525 42.196 49.343 47.218 42.386 49.553 47.424 La aplicación de la prueba de Kolmogorov-Smirnov en estos tres grupos de valores nos indica que no siguen una distribución normal lo cual nos lleva al empleo de pruebas estadísticas no paramétricas para su comparación. (Tabla 25) 124 Tabla 25: Prueba de Kolmogorov-Smirnov. SOLUCION EGF PGE2 0.2729 0.2167 FISIOLOGICA 0.2131 KS p 0.0001 ( 0.05) El test estadístico que en este caso corresponde ser aplicado es la ANOVA para no paramétricos de Kruskal-Wallis (Tabla 26) y el post-test de las comparaciones múltiples de Dunn. (Tabla 27). Tabla 26: ANOVA de Kruskal-Wallis. N SOLUCION FISIOLOGICA EGF PGE2 ESTADISTICO KW MEDIANA MINIMO MAXIMO SUMA DE RANGO RANGOS PROMEDIO 134 42 41 44 9045 67.5 134 134 49 47 48 45 51 49 44773 27186 334.12 202.86 363.92 ( p 0.0001) Tabla 27: Test de las comparaciones múltiples de DUNN. SOLUCION FISIOLOGIA versus EGF SOLUCION FISIOLOGIA versus PGE2 EGF versus PGE2 DIFERENCIA ENTRE PROMEDIO DE RANGOS SIGNIFICACION ESTADISTICA -266.62 SI (p 0.001) -135.38 SI (p 0.001) 131.25 SI (p 0.001) 125 La representación gráfica de las diferencias entre los valores de hidrofobicidad medidos como ángulo de contacto en las muestras sometidas al efecto de sustancias citoprotectoras la representamos en el siguiente diagrama de barras. (Figura 18). Figura 18: Efecto de los citoprotectores sobre la hidrofobicidad. 49 ANGULO DE CONTACTO 50 45 47 42 40 35 30 SOL.FISIOL EGF PGE2 5.2. ANTIINFLAMATORIOS NO ESTEROIDEOS. Los parámetros estadísticos obtenidos de la incubación de las muestras de mucosa de colon en un medio con antiinflamatorios no esteroideos han sido los siguientes. (Tabla 28) 126 Tabla 28: AINE. N Media Desviación estándar (SD) Error estándar de la media (SEM) Límite inferior de confianza para un 95% Límite superior de confianza para un 95% SOL. FISIOL. 134 42.291 0.5596 DICLOFEN. 134 35.4328 0.6654 INDOMET. 134 35.9701 0.4056 0.0483 0.0574 0.0350 42.196 35.320 35.901 42.386 35.546 36.039 La aplicación de la prueba de Kolmogorov-Smirnov en estos tres grupos de valores nos indica que no siguen una distribución normal lo cual nos lleva al empleo de pruebas estadísticas no paramétricas para su comparación. (Tabla 29) Tabla 29: Prueba de Kolmogorov-Smirnov. KS p SOLUCION FISIOLOGICA 0.2131 DICLOFENACO INDOMETACINA 0.3468 0.0001 ( 0.05) 0.4622 El test estadístico que en este caso corresponde ser aplicado es la ANOVA para no paramétricos de Kruskal-Wallis (Tabla 30) y el post-test de las comparaciones múltiples de Dunn. (Tabla 31). 127 Tabla 30: ANOVA de Kruskal-Wallis. SOLUCION FISIOLOGICA DICLOFENACO INDOMETACINA ESTADISTICO KW N Mediana Mínimo Máximo Suma de rangos Rango promedio 134 42 41 44 44957 335.5 134 134 35 36 33 34 38 37 13526 22521 100.94 168.06 317.94 (p 0.0001) Tabla 31: Test de las comparaciones múltiples de DUNN. DIFERENCIA ENTRE PROMEDIO DE RANGOS SIGNIFICACION ESTADISTICA 234.56 SI (p 0.001) 167.44 SI (p 0.001) -67.127 SI (p 0.001) SOLUCION FISIOLOGIA vs. DICLOFENACO SOLUCION FISIOLOGIA vs. INDOMETACINA DICLOFENACO vs. INDOMETACINA La representación gráfica de las diferencias entre los valores de hidrofobicidad medidos como ángulo de contacto en las muestras sometidas al efecto de antiinflamatorios no esteroideos la representamos en el siguiente diagrama de barras. (Figura 19). 128 ANGULO DE CONTACTO Figura 19: Efecto de los AINE sobre la hidrofobicidad. 50 45 42 40 35 36 35 30 SOL. FISIOL DICLOFEN. INDOMET. 5.2.1. DOSIS-DEPENDENCIA. En el presente apartado comparamos el efecto que sobre los valores de hidrofobicidad tiene la exposición de las muestras de mucosa de colon a diferentes dosis de antiinflamatorios no esteroideos. Esta comparación la realizaremos por separado con dos antiinflamatorios distintos (diclofenaco e indometacina) y las dosis utilizadas serán las mismas en ambos fármacos siendo una el doble de la otra (45 µg y 90 µg). (Tablas 32 y 34). En ambos casos utilizamos tests no paramétricos pues las muestras no siguen una distribución gaussiana. (Tablas 33 y 35). 129 Tabla 32: Diclofenaco; dosis dependencia. DICLOFENACO Número de muestras (N) Media Desviación estándar(SD) Mediana Mínimo Máximo Error estándar de la media (SEM) Límite inferior de confianza para un 95% Límite superior de confianza para un 95% Dosis (45 g) 134 35.43 0.6654 35 33 38 0.0574 Doble dosis (90 g) 134 35 0.3468 35 34 36 0.0299 35.320 34.941 35.546 35.059 Tabla 33: Resultados estadísticos: diclofenaco-dosis dependencia. Suma de rangos Dosis Doble dosis 21260 14786 U de Mann-Whitney 5741 U’ 12215 p 0.0001 130 Tabla 34: Indometacina: dosis dependencia. INDOMETACINA Número de muestras (N) Media Desviación estándar(SD) Mediana Mínimo Máximo Error estándar de la media (SEM) Límite inferior de confianza para un 95% Límite superior de confianza para un 95% Dosis (45 g) 134 35.97 0.4056 36 34 37 0.0350 Doble dosis (90 g) 134 34.53 0.69 34 32 36 0.0596 35.901 34.420 36.039 34.654 Tabla 35: Resultados estadísticos: indometacina-dosis dependencia. Suma de rangos Dosis Doble dosis 25894 10153 U de Mann-Whitney 1107.5 U’ 16849 p 0.0001 131 5.3. CITOPROTECTORES vs AINES. Por último valoramos si existen diferencias entre sí en el efecto que sobre la hidrofobicidad de la mucosa del colon tienen las sustancias ya descritas. (Tablas 36 y 37). Tabla 36: ANOVA de Kruskal-Wallis. SUMA DE RANGOS RANGO PROMEDIO EGF 62729 468.12 PGE2 45142 336.88 DICLOFENACO 13526 100.94 INDOMETACINA 22521 168.06 ESTADISTICO KW 481.68 (p 0.0001) Tabla 37: Test de las comparaciones múltiples de Dunn. EGF vs PGE2 EGF vs DICLOFENACO EGF vs INDOMETACINA PGE2 vs DICLOFENACO PGE2 vs INDOMETACINA DICLOFENACO vs INDOMETACINA DIFERENCIA ENTRE PROMEDIO DE RANGOS 131.25 367.19 300.06 235.94 168.81 -67.127 SIGNIFICACION ESTADISTICA p p p p p 0.001 0.001 0.001 0.001 0.001 p 0.01 132 La representación gráfica de las diferencias entre los valores de hidrofobicidad medidos como ángulo de contacto en las muestras sometidas al efecto de citoprotectores y de antiinflamatorios no esteroideos la representamos en el siguiente diagrama de barras. (Figura 20). Figura 20: Citoprotección-AINES. ANGULO DE CONTACTO 50 49 47 45 40 35 35 36 30 EGF PGE2 DICLOFENACO INDOMETACINA 133 6. HIDROFOBICIDAD EN LA SUPERFICIE ENDOLUMINAL DE LA MUCOSA DEL COLON. ESTUDIO TOPOGRAFICO. En el presente apartado exponemos los resultados obtenidos de las comparaciones entre los valores de ángulo de contacto como medida de la hidrofobicidad en la superficie mucosa del colon a lo largo del trayecto de la misma. 6.1. DIVISIÓN DE LA SUPERFICIE COLÓNICA EN SIETE SEGMENTOS Y CUATRO SECTORES. La longitud completa del intestino grueso se divide en cuatro tramos largos, los sectores, y a su vez estos en un total de siete tramos más cortos, los segmentos, de tal manera que exceptuando el más distal en el que coincide cada sector está formado por dos segmentos. (Tabla 38) Tabla 38: Topografía colónica. SECTOR Colon derecho Colon transverso Colon izquierdo Recto SEGMENTO Ciego Colon ascendente Proximal Distal Colon descendente Sigma Recto 134 Los valores de los parámetros estadísticos hallados en los segmentos colónicos vienen reflejados en las siguientes tablas. (Tabla 39, 40, 41, 42). Tabla 39: Colon derecho: parámetros estadísticos. COLON DERECHO N Media Desviación estándar Error estándar de la media Mínimo Máximo Mediana Límite inferior de confianza para un 95% Límite superior de confianza para un 95% CIEGO 15 39.2666 0.5936 0.1533 38 40 39 COLON ASCENDENTE 15 39.5333 0.5164 0.1333 39 40 40 38.93 39.247 39.59 39.819 Tabla 40: Colon transverso: parámetros estadísticos. COLON TRANSVERSO N Media Desviación estándar Error estándar de la media Mínimo Máximo Mediana Límite inferior de confianza para un 95% Límite superior de confianza para un 95% PROXIMAL 15 39.2666 0.5936 0.1533 38 40 39 DISTAL 15 39.4666 0.639 0.1652 39 41 39 38.938 39.112 39.595 39.821 135 Tabla 41: Colon izquierdo: parámetros estadísticos. COLON IZQUIERDO COLON DESCENDENTE SIGMA N 17 37 Media 39.5294 39.7027 Desviación estándar 0.7998 0.7018 Error estándar de la media 0.1940 0.1154 Mínimo 39 38 Máximo 41 41 Mediana 39 40 39.118 39.469 39.941 39.937 Límite inferior de confianza para un 95% Límite superior de confianza para un 95% Tabla 42: Recto: Parámetros estadísticos. RECTO N 20 Media 39.6 Desviación estándar 0.5026 Error estándar de la muestra Mínimo 0.1124 39 Máximo 40 Mediana 40 Límite inferior de confianza para un 95% límite superior de confianza para un 95% 39.365 39.835 La representación gráfica de las medias de los valores de ángulo de contacto como medida de la hidrofobicidad en la superficie mucosa del colon queda expresado en forma de diagrama de barras. (Figura 21). 136 Figura 21: Representación gráfica de los valores de hidrofobicidad a lo largo del trayecto colónico. ANGULO DE CONTACTO 39,53 39,26 CIEGO 39,26 C. ASCEN. C. TRV. PROX. 39,46 C. TRV. DIST. 39,52 39,7 C. DESCEN. SIGMA 39,6 RECTO La aplicación de la prueba de Kolmogorov-Smirnov a los siete grupos nos indica que solo los tres segmentos más proximales siguen la distribución normal (p>0.05). (Tabla 43). Tabla 43: Test de la normalidad en los segmentos colónicos. CIEGO KS 0.166 COLON ASCENDT 0.35 p >0.1 0.0505 C. TRV. PROXIM. 0.34 C. TRV. DIST. 0.3671 COLON DESCENT 0.3930 SIGMA RECTO 0.3398 0.3869 0.0623 0.0351 0.0105 0.0004 0.0050 137 6.2. COMPARACIÓN ENTRE HIDROFOBICIDADES EN EL COLON DIVIDIDO EN 7 SEGMENTOS. El hecho de que todos los segmentos de colon no sigan una distribución normal nos lleva a utilizar pruebas estadísticas no paramétricas. (Tabla 44). Tabla 44: ANOVA de Kruskal-Wallis. SUMA DE RANGOS RANGO PROMEDIO CIEGO 814 54.267 COLON ASCENDENTE 1032 68.8 COLON TRANSVERSO PROXIMAL 814 54.267 COLON TRANSVERSO DISTAL 942.5 62.833 COLON DESCENDENTE 1081.5 63.618 SIGMA 2903 78.459 RECTO 1458 72.900 ESTADISTICO KW 8.960 (p=0.1758) 6.3. COMPARACIÓN ENTRE HIDROFOBICIDADES EN EL COLON DENTRO DE LOS DIFERENTES SECTORES. En el presente apartado valoraremos la existencia de diferencias entre los segmentos de colon que forman parte de un mismo sector. Expresando esto de una forma esquemática se reduciría a dos segmentos por sector en los tres sectores más proximales. 6.3.1. COLON DERECHO. La aplicación de la prueba de Kolmogorov-Smirnov que nos indica que ambas poblaciones se distribuyen según la normalidad nos permite aplicar tests parámetricos. 138 Aplicamos el t-Test para no pareados con la corrección de Welch. (Tabla 45) Tabla 45: Resultados estadísticos en el sector colon derecho. COLON DERECHO CIEGO/COLON ASCENDENTE t 1.313 con 27 grados de libertad p 0.2003 Diferencia de las medias 0.2667 Intervalo de confianza del 95% de las medias -0.1501/0.6835 6.3.2. COLON TRANSVERSO. En el presente sector y dado que el segmento distal no sigue la distribución normal aplicamos tests no paramétricos. (Tabla 46). Tabla 46: Estadística del sector colon transverso. COLON TRANSVERSO PROXIMAL DISTAL Sumatorio de rangos 218.00 247.00 U de Mann-Whitney 98.00 U’ 127.000 p 0.5668 6.3.3. COLON IZQUIERDO. Ninguna de las dos muestras (colon descendente y sigma) siguen una distribución normal con lo que aplicamos test no paramétricos. (Tabla 47) Tabla 47: Estadística del sector colon izquierdo. COLON IZQUIERDO COLON DESCENDENTE SIGMA Sumatorio de rangos 405.50 1079.5 U de Mann-Whitney 252.50 U’ 376.50 p 0.2476 139 Representamos en forma de diagrama de barras los valores de hidrofobicidad (valores de la media) a lo largo de la mucosa del colon dividida en siete segmentos que a su vez agrupamos en cuatro sectores. (Figura 22) Figura 22: Diagrama de barras; hidrofobicidad por sectores y segmentos. 39,7 ANGULO DE CONTACTO 39,7 39,6 39,6 39,53 39,52 CIEGO 39,46 39,5 C. ASCEN. C. TRV. PROX. 39,4 C. TRV. DIST. 39,3 39,26 39,26 C. DESCEN. SIGMA 39,2 RECTO 39,1 39 Colon derecho Colon transverso Colon izquierdo Recto 6.4. COMPARACIÓN ENTRE HIDROFOBICIDADES EN EL COLON DIVIDIDO EN CUATRO SECTORES. La aplicación de la prueba de Kolmogorov-Smirnov indica que los cuatro grupos de valores siguen una distribución poblacional normal lo que nos permite la aplicación de tests estadísticos paramétrcos. (Tabla 48) Tabla 48: Prueba de Kolmogorov-Smirnov. KS p COLON DERECHO 0.1318 COLON TRANSVERSO 0.1764 >0.1 COLON IZQUIERDO 0.1011 RECTO 0.1608 140 El test Bartlett nos indica que no existen diferencias significativas entre las desviaciones estándar de los grupos: estadístico de Bartlett de 4.838 para una p=1841 (p>0.05). Ambas condiciones nos permiten aplicar el test del ANOVA y como posttest el de las comparaciones múltiples de Tukey-Kramer. (Tabla 49). Tabla 49: ANOVA y test de Tukey-Kramer. ANOVA TUKEYKRAMER (p 0.05 si q 3.684) p=0.1601 Colon derecho Colon transverso Colon derecho Colon izquierdo Colon derecho Recto Colon transverso Colon izquierdo Colon transverso Recto Colon izquierdo Recto 0.2852 2.407 1.530 2.731 1.786 0.4063 q III. SURFACTANTE COLONICO. En el presente apartado exponemos la relación existente entre los valores de hidrofobicidad a lo largo de la mucosa colónica y la cantidad de surfactante (fosfolípidos) presente en cada segmento del trayecto de colon. Previamente determinamos la composición de lípidos totales y de estos la proporción de fosfolípidos. 1. LIPIDOS. En un homogeneizado de 10 muestras de mucosa de colon por segmento colónico se extrae la fracción lipídica. (Tabla 50) 141 Tabla 50: Composición lipídica de la mucosa colónica. Ciego N (número de muestras) 10 LIPIDOS (mg/g de tejido) 74.5 Colon ascendente 10 74.5 Colon transverso proximal 10 74.6 Colon transverso distal 10 74.6 Colon descendente 10 74.7 Sigma 10 74.8 Recto 10 75 SEGMENTO COLONICO La representación gráfica de la composición lipidica en general a lo largo de la mucosa colónica dividida en siete segmentos. (Figura 23). Figura 23: Distribución de los lípidos a lo largo de la superficie del colon. LIPIDOS (mg/g de tejido) 75,2 75 75 74,8 74,8 74,6 74,7 74,7 74,6 74,5 74,5 74,4 74,2 Ciego Colon ascendente Colon transverso proximal Colon transverso distal Colon descendente Sigma Recto 142 2. FOSFOLIPIDOS. Del conjunto de lípidos resultantes del homegeneizado de mucosa extraemos la fase fosfolipídica sustrato químico del surfactante colónico. (Tabla 51) Tabla 51: Composición fosfolipídica de la mucosa colónica. Ciego N (número de muestras) 10 FOSFOLIPIDOS ( M/g de tejido) 200.3 Colon ascendente 10 203.1 Colon transverso proximal 10 210.4 Colon transverso distal 10 212 Colon descendente 10 217.5 Sigma 10 223.4 Recto 10 226.2 SEGMENTO COLONICO Representamos gráficamente (en forma de diagrama de barras adosadas) dicha distribución del surfactante colónico a lo largo de los distintos segmentos colonicos. (Figura 24) FOSFOLIPIDOS (microMoles/g de tejido) Figura 24: Distribución del surfactante a lo largo de la superficie mucosa del colon. 230 223,4 220 210 210,4 200,3 212 226,2 217,5 203,1 200 190 180 Ciego Colon ascendente Colon transverso proximal Colon transverso distal Colon descendente Sigma Recto 143 3. RELACION ENTRE LIPIDOS Y FOSFOLIPIDOS. Del conjunto de todos los lípidos extraídos del homogeneizado de las diez muestras de mucosa de colon en cada segmento del mismo, se ha aislado la fracción fosfolipídica como sustrato material del denominado surfactante gastrointestinal. Ambas partes se expresan en unidades de peso relativas (por gramo de tejido), siendo en gramos los lípidos y en micromoles los fosfolípidos. La prueba estadística que aplicamos en este caso es la prueba de correlación. (Tabla 52) Tabla 52: Correlación lípidos-fosfolípidos. r Spearman 0.9820 p 0.0004 La representación gráfica mediante un diagrama de puntos unidos por una línea de la prueba estadística aplicada es la siguiente. (Figura 25) Figura 25: Representación gráfica de la correlación entre lípidos y fosfolípidos. 250 225 200 175 150 125 100 75 50 25 0 LIPIDOS (mg/g) FOSFOLIPIDOS (microM/g) CIEGO COL. ASC. COL. TRV. PROX COL. TRV. DIST. COL. DESC. SIGMA RECTO 144 4. RELACION ENTRE HIDROFOBICIDAD Y SURFACTANTE. En este último apartado estudiaremos la relación existente entre los valores de hidrofobicidad a lo largo de los diferentes siete segmentos en los que hemos dividido el trayecto mucoso colónico (expresados como valores de ángulo de contacto y medidos en grados sexagesimales) y los valores de surfactante (expresados como peso) obtenidos del homogeneizado de mucosa. La prueba estadística aplicada en este caso es el coeficiente de correlación. (Tabla 53) Tabla 53: Correlación hidrofobicidad-surfactante. r Spearman 0.7207 p 0.0881 La representación gráfica (Figura 26) en forma de diagrama de puntos unidos por una línea nos permite valorar las tendencias de los valores de hidrofobicidad y fosfolípidos a lo largo de la mucosa del colon dividida en siete segmentos: ciego-colon ascendente-colon transverso proximal- colon transverso distal-colon descendente- sigma- recto. 145 Figura 26: Representación gráfica de la correlación entre hidrofobicidad y fosfolípidos. 250 225 200 175 150 125 100 75 50 25 0 HIDROFOBICIDAD (º) FOSFOLIPIDOS (microM/g) CIEGO COL. ASC. COL. TRV. PROX COL. TRV. DIST. COL. SIGMA RECTO DESC. 146 DISCUSION 147 La luz gastrointestinal presenta condiciones biológicas y fisicoquímicas idóneas para la digestión de los alimentos y para el control y desarrollo de los microorganismos que constituyen el ecosistema de su flora. Muchas de esas condiciones (pH ácido, enzimas proteolíticas, sales biliares, ambiente anaerobio, productos bacterianos, etc.) resultan altamente tóxicas para las células del huésped porque se apartan de las constantes requeridas en el medio interno. Es por tanto necesaria la presencia de una estructura de separación entre medio interno y luz gastrointestinal, que resulte parcialmente impermeable permitiendo mantener condiciones fisicoquímicas y biológicas distintas en cada medio, pero que a la vez constituya una interfase apta para el intercambio controlado. Esta estructura de separación entre el medio interno y la luz del tubo digestivo es lo que se ha llamado barrera mucosa gastrointestinal, termino introducido en los años sesenta, originalmente aplicado a la mucosa gástrica por su capacidad de repeler y resistir la acidez de la luz del estómago, y que hoy en día se aplica a toda la superficie endoluminal del tracto digestivo. Físicamente, la barrera mucosa gastrointestinal incluye el epitelio superficial de la mucosa y sobre este una capa de moco con características de gel y espesor variable de hasta 200 µm. Por encima de esta capa de moco se extiende una monocapa constituida por fosfolípidos con propiedades anfóteras y denominada surfactante gastrointestinal. Esta monocapa tiene características 148 tensoactivas por la cohesión lateral de sus elementos, que determina su disposición espacial en monoplano y su extensión por la superficie del moco estableciendo así la interfase moco-luz gastrointestinal. El surfactante expresa hacia la luz su cara hidrófoba y constituye por tanto una superficie contra iones, enzimas y toxinas hidrosolubles. En términos generales, la barrera mucosa no es obstáculo para el intercambio de productos liposolubles, mientras que resulta prácticamente infranqueable para la inmensa mayoría de las sustancias hidrosolubles, a no ser que por su particular interés para el organismo su transporte a través de la mucosa se produzca mediante mecanismos activos específicos. Las propiedades de la barrera mucosa dependen también del flujo sanguíneo de la submucosa. Este suministra oxígeno y nutrientes para mantener la vitalidad y por ende la función de secreción de las células que se localizan en la mucosa; así mismo, facilita el aclaramiento de los elementos tóxicos que logran franquear la barrera. En el presente trabajo hemos pretendido colaborar en la definición de la superficie mucosa del colon humano en su función de barrera, ya que ésta ha sido mucho menos estudiada que la gástrica, y a diferencia del esófago donde prima una función de conducción exclusivamente y el intestino delgado donde las funciones principales son las de digestión y absorción, pensamos que el intestino grueso al desarrollar funciones de absorción de agua e iones en tramos proximales y de conducción de la materia fecal con textura sólida cuando nos acercamos a tramos más distales y poseer una rica flora bacteriana presente en su luz hace que las propiedades de superficie de su mucosa jueguen un papel principal en este tramo a diferencia de otros segmentos del tracto digestivo. 149 I. CARACTERISTICAS DE LAS MUESTRAS. Los escasos trabajos presentes en la literatura a cerca del estudio de las propiedades de barrera de la mucosa del colon se han llevado a cabo principalmente con muestras de mucosa colónica de diferentes especies de mamíferos, especialmente ratas (70), conejos (113) y menos en perros (110). Los que se han realizado sobre muestras humanas se han hecho en especímenes obtenidos habitualmente por biopsia siendo escasas las publicaciones en las que las muestras proceden de intervenciones quirúrgicas (96). En nuestro trabajo se han utilizado muestras amplias (2x3 cm) de mucosa colónica humana procedentes de piezas quirúrgicas. Esto hace que los resultados obtenidos de estos especímenes, a diferencia de los biópsicos, sean en muestras menos manipuladas, lo que creemos implica una mejora en el mantenimiento de las propiedades de superficie de la muestra. Así mismo el tratarse de muestras amplias nos ha permitido realizar varías mediciones de ángulo de contacto por muestra (cinco) (77) lo que implica poder referir una homogeneidad en los valores obtenidos. Además y como ya discutiremos más adelante, el tejido estudiado procede de colon humano lo que pensamos tiene esencial importancia a la hora de definir unos valores de ángulo de contacto que son diferentes a los publicados en la literatura en otras especies animales. Por último el número de muestras utilizadas, (N=134), hacen de nuestro trabajo el que posee la serie más larga de muestras de colon humano para el estudio de las propiedades de superficie de su mucosa, siendo los tamaños muestrales más amplios hasta ahora publicados menores de veinte (96). 150 II. CONSERVACION DE LA MUESTRA DE MUCOSA. Al utilizar muestras de mucosa procedentes de segmentos de colon obtenidos de pacientes intervenidos quirúrgicamente, la inmediatez y por consiguiente el tiempo de isquemia se ha supeditado al proceso puramente técnico de la intervención quirúrgica llevada a cabo. Hemos considerado tiempo cero de isquemia el momento en el que el cirujano extrae la pieza quirúrgica. Hemos medido hidrofobicidades a distintos intervalos de tiempo constatando que dichos valores disminuyen progresivamente conforme aumenta el tiempo llegando a ser prácticamente de la mitad (64%) a las tres horas de la extracción de la muestra. También y en el mismo orden de cosas y dado que la muestra requiere un medio de conservación hemos obtenido valores de hidrofobicidad medidos como ángulo de contacto superponibles al tiempo cero de isquemia (99.5%) en un medio frío (nevera a 4ºC) frente a los obtenidos a temperatura ambiente (22ºC) que han sido de un 90%. Con todo esto decidimos utilizar únicamente muestras de mucosa colonica procedentes de piezas que no rebasaran los treinta minutos de isquemia habiendo sido conservadas estas en suero fisiológico frío (nevera a 4ºC), condiciones iguales a las utilizadas por otros autores (96). III. METODO DE MEDIDA DE LA HIDROFOBICIDAD. Numerosos han sido los métodos descritos para cuantificar las propiedades de superficie en distintos materiales (11), siendo el método de la medida del ángulo 151 de contacto en relación con una gota en cualquiera de sus variedades el más utilizado en los distintos trabajos publicados (111) por su sencillez en la realización así como por su reproductibilidad. Al utilizar, para la obtención de los valores de ángulo de contacto, un método óptico (el goniómetro) las medidas realizadas por diferentes observadores pueden no ser todo lo uniformes que sería deseable lo cual nos ha llevado, tal y como expone en su trabajo Lichtenberger (112) a ser el mismo observador el que ha medido los 670 valores de ángulo de contacto y siempre realizados con el mismo aparato colocado en el mismo lugar. IV. HIDROFOBICIDAD EN LA SUPERFICIE MUCOSA DEL COLON. El valor de ángulo de contacto, como expresión de la propiedad de la hidrofobicidad, en la superficie de la mucosa del colon humano que hemos obtenido en nuestra población es de 39.52 ± 0.05º (N=134). Dicho valor, similar al obtenido en el esófago (69) (39.4 ± 2.4º), relacionarían ambos segmentos del tubo digestivo en su faceta de meramente conductores en detrimento de la propiedad de la digestión y de la absorción. Cuando lo comparamos con valores hallados en la superficie endoluminal gástrica (113) (66º) vemos que los valores colónicos son mucho menores que los gástricos puesto que las propiedades fisicoquímicas del contenido intraluminal gástrico hacen que la función de barrera de la mucosa gástrica sea mucho más evidente. 152 En el intestino delgado contrariamente se describen valores mucho más bajos de hidrofobicidad (70) (10º), valores necesarios para que la función primordial de esta parte del tubo digestivo, que es la absorción, se lleve a cabo. Cuando buscamos referencias en la literatura a valores de hidrofobicidad de la mucosa colónica humana estos son muy escasas (74) siendo los más numerosos estudios diseñados en modelos animales y obteniéndose valores tan dispares como alrededor de 90º en un modelo desarrollado con conejos (90) y en otros 34 ± 3º donde el animal de experimentación era la rata (2) siendo los obtenidos en este último más próximos a los de nuestro trabajo. V. MODIFICACION EN LAS PROPIEDADES DE SUPERFICIE DE LA MUCOSA DEL COLON TRAS SU INCUBACION EN SOLUCION FISIOLÓGICA. Al someter las muestras de mucosa colónica a una incubación durante sesenta minutos en un medio de características similares al medio interno (pH 7.4 y 37ºC) constituido por solución de Krebs-Ringer-Tris y oxígeno con dióxido de carbono comprimido, los valores de hidrofobicidad como medida de ángulo de contacto (42.29 ± 0.04º) aumentan con respecto a los obtenidos cuando se miden en muestras que no han sido sometidas a ningún procesamiento (39.52 ± 0.05º) siendo está diferencia estadísticamente significativa (p< 0.0001). De esta diferencia en los valores de hidrofobicidad se puede deducir lo siguiente: - El incremento en los valores de hidrofobicidad hallado en las muestras sometidas a incubación con el medio descrito es consecuencia de una acción puramente fisicoquímica sobre la película de fosfolípidos que tapiza la superficie mucosa del colon. 153 - Realmente los valores basales de hidrofobicidad son más bajos (39.52º) y su aumento (+2.77º) se explica por un efecto de carácter más biológico como consecuencia de un estímulo a la producción de surfactante por el epitelio de la mucosa. VI. INFLUENCIA DE LA PATOLOGIA ASOCIADA EN LAS PROPIEDADES DE SUPERFICIE. Como una aplicación de índole más clínico, se han dividido el conjunto de las 134 muestras de mucosa colónica en dos grupos: las provenientes de pacientes que no referían ningún tipo de antecedente patológico (87 pacientes) y las obtenidas de pacientes que en su historia clínica constaba la presencia de otras enfermedades acompañantes (47 pacientes). Cuando comparamos los valores de ángulo de contacto como expresión de la hidrofobicidad obtenemos valores más elevados en el grupo exento de patología asociada teniendo está diferencia significación estadística (p=0.01). A su vez y dentro del grupo de los pacientes con enfermedades asociadas se han contemplado la diabetes mellitus, hipertensión arterial, broncopatía crónica, cardiopatía y dislipemia. La comparación entre estos cinco grupos exhibe diferencias estadísticamente significativas (p=0.01) Dichas diferencias se refuerzan al comparar los grupos dos a dos en los casos entre dislipemia y diabetes y entre dislipemia e hipertensión arterial. Así mismo el grupo afecto de dislipemia es el que presenta unos valores de hidrofobicidad más elevados (40º). Revisada la literatura no hemos encontrado reseñas bibliográficas que relacionen los trastornos en el metabolismo lipídico con alteraciones en el funcionalismo del surfactante tanto gastrointestinal, menos 154 estudiado, como pulmonar más profundamente conocido. De los datos obtenidos en nuestro trabajo se puede exponer una relación entre la presencia de enfermedades del metabolismo de los lípidos, por otro lado muy frecuentes en la población, con un refuerzo en las propiedades de barrera mucosa gastrointestinal basando está relación de alguna manera en las vías metabólicas de síntesis de los distintos lípidos. VII. HIDROFOBICIDAD EN LA SUPERFICIE MUCOSA DEL COLON COMO PROPIEDAD MODULABLE “EX VIVO”. Una vez definida la existencia de propiedades de superficie en la cara endoluminal de la mucosa colónica valoramos si dichas propiedades son subsidiarias de ser modificadas mediante la acción de moléculas con características citoprotectoras (EGF y PGE2) o por la de moléculas cuya acción se ha visto lesiva para la mucosa del tracto digestivo (antinflamatorios no esteroideos). 1. CITOPROTECTORES. Al someter a las muestras de mucosa colónica a una incubación en un medio que contiene solución fisiológica y moléculas con características de citoprotección, concretamente factor de crecimiento epidérmico y prostaglandina E2 los valores de hidrofobicidad han sido mayores que los que se obtienen cuando las muestras son incubadas en un medio que solo contiene la solución fisiológica (control), siendo dicha diferencia estadísticamente significativa (p<0.0001). Por otro lado cuando comparamos específicamente los valores obtenidos en la incubación con EGF con los obtenidos de la hecha en un medio con PGE2 también se describen diferencias con significación estadística (p<0.001) en el 155 sentido de mayores valores de ángulo de contacto en las muestras procedentes del medio que contiene el factor de crecimiento. Estos hallazgos coinciden con lo publicado en la literatura por Lugea y colaboradores donde en distintos tramos del tubo digestivo y en animales de experimentación se ha visto que el EGF incrementa las propiedades de hidrofobicidad de la mucosa mediante el estímulo de la síntesis de fosfolípidos (36). 2. ANTIINFLAMATORIOS NO ESTEROIDEOS. El procesar la muestra de mucosa de colon con antinflamatorios no esteroideos provoca un cambio en las propiedades de superficie de dicha mucosa en el sentido de disminuir los valores de ángulo de contacto siendo esta diferencia estadísticamente significativa (p<0.0001). Cuando comparamos los resultados obtenidos con dos moléculas procedentes de familias distintas de antinflamatorios no esteroideos (el diclofenaco perteneciente al grupo de los ácidos heteroaril acéticos y la indometacina de la familia de los ácidos indolacéticos) y que actúan por diferentes mecanismos también obtenemos diferencias con significación estadística (p<0.001) en su reducción de los valores de la hidrofobicidad siendo esta reducción mayor en las muestras procesadas con el diclofenaco. Además, y coincide en las dos moléculas estudiadas, el efecto sobre la reducción de la hidrofobicidad tiene relación con la dosis de antiinflamatorio utilizada de modo que a dosis dobles la reducción de la hidrofobicidad es mayor siendo dicha diferencia estadísticamente significativa (p<0.0001). 156 VIII. HIDROFOBICIDAD EN LA SUPERFICIE ENDOLUMINAL DE LA MUCOSA DEL COLON HUMANO. ESTUDIO TOPOGRAFICO. Aunque la función de barrera mucosa es una constante a lo largo de todo el tracto digestivo, no todos los tramos de dicho tubo desempeñan idénticas funciones ni con la misma intensidad. Esófago, estómago, duodeno e intestino delgado y colon desarrollan diferentes papeles en lo que se refiere a la conducción, digestión y absorción del alimento, estando estas funciones muy relacionadas con las propiedades de superficie de la mucosa que a su vez condicionan el papel defensivo que caracteriza a esta barrera mucosa gastrointestinal. El colon humano se divide funcionalmente en dos tramos, uno derecho en el que predominan las funciones de absorción en lo que al agua se refiere y otro izquierdo o distal en el cual la principal función es la de conducción y expulsión de la masa fecal. Estudios realizados en colon de rata han puesto de manifiesto que en este animal existen diferencias entre distintos segmentos a lo largo del trayecto colónico en cuanto a los valores de hidrofobicidad (2) evidenciándose valores más altos conforme las medidas se toman de tramos colónicos más distales. En el presente trabajo, hemos dividido el colon basándonos en criterios anatómicos (siete segmentos) o bien en criterios funcionales (cuatro sectores) no habiendo hallado significación estadística entre los valores de ángulo de contacto obtenidos en las diferentes zonas aunque los valores en los tramos derechos, ciego (39.26 ± 0.15º) y colon ascendente (39.53 ± 0.13º), son inferiores a los calculados 157 para tramos izquierdos, sigma (39.70 ± 0.11º) y recto (39.6 ± 0.11º). Esta tendencia a hidrofobicidades izquierdas más elevadas la relacionamos con la función más de conducción y consiguientemente con la propiedad de la lubrificación (101) de este tramo del colon. De este mismo modo en tramos derechos prima la función de absorción del agua la cual estaría facilitada por valores más bajos de hidrofobicidad (2). IX. SURFACTANTE COLONICO. La base bioquímica del surfactante gastrointestinal está compuesta por los fosfolípidos. Estos forman parte del extracto lipídico que se obtiene de la mucosa. A su vez la propiedad de la hidrofobicidad asienta en la película de surfactante que se extiende a lo largo de la superficie mucosa del tracto digestivo. La cantidad de fosfolípidos extraídos del homogeneizado de mucosa de colon en los diferentes segmentos colónicos se correlaciona con los lípidos extraídos de dichos segmentos; dicha correlación es positiva, lo que significa que la proporción de fosfolípidos es directamente proporcional al total de lípidos del homogeneizado siendo además dicha correlación estadísticamente significativa (p<0.05). En este mismo sentido cuando correlacionamos a lo largo del trayecto del colon humano las proporciones de fosfolípidos por gramo de tejido, como sustrato químico del surfactante gastrointestinal, con los valores de ángulo de contacto como forma de expresar la propiedad de la hidrofobicidad de la mucosa del colon obtenemos un coeficiente de correlación positivo lo que se interpreta como que existe una relación directa entre la cantidad de surfactante y la propiedad de la hidrofobicidad con una significación estadística en el límite (p=0.08). 158 X. APLICACIONES CLINICAS DE LA PROPIEDAD DE LA HIDROFOBICIDAD DE LA SUPERFICIE MUCOSA EN EL COLON. Sin ser el fin del presente trabajo el describir las implicaciones fisiopatológicas y por consiguiente posibilidades terapéuticas relacionadas con alteraciones de la barrera mucosa y concretamente la monocapa fosfolipídica que es el surfactante, pensamos que una revisión de lo publicado hasta ahora sobre esto, puede completar la presente discusión y abrir las puertas a futuros trabajos que seguirían la línea de investigación que nosotros hemos pretendido recoger de los estudios precedentes que sobre esto existen en la literatura. La neoplasia y la enfermedad inflamatoria intestinal son dos de los principales procesos patológicos que afectan a la mucosa del colon; su aparición y desarrollo están relacionados con defectos en las propiedades de superficie de la mucosa. 1. NEOPLASIA. Este proceso, que es común a todo el tracto digestivo, está relacionado con el efecto directo que sobre la mucosa digestiva tienen diferentes agentes carcinogénicos presentes en la luz del tracto gastrointestinal. El agente carcinogénico presente en la luz del tracto digestivo necesita actuar directamente sobre la célula epitelial cuando se encuentra esta en la fase S de su ciclo proliferativo (114). Para ello la integridad previa de la barrera mucosa (surfactante y capa de moco) debe de estar rota. En estudios realizados en mucosa gástrica procedente de enfermos afectos de gastritis atrófica (entidad que se conoce relacionada con el desarrollo de neoplasia gástrica) se ha visto una permeabilidad anormalmente elevada para moléculas pequeñas hidrofílicas (115). 159 La propiedad de la hidrofobicidad y por lo tanto una barrera mucosa integra es uno de los mecanismos directamente implicados en la defensa de la mucosa ante la acción de moléculas carcinogénicas constatándose diferencias regionales en el desarrollo de neoplasias entre las diferentes partes del estómago (116). En el colon, el recto con un 37% de las neoplasias diagnosticadas, el sigma con un 27% y el ciego con un 14% son los tramos donde se localizan más frecuentemente las neoplasias (117). Uno de los factores que se relacionan con esto es que son zonas en las cuales el movimiento de la masa fecal es más lento y por tanto el tiempo de contacto con la mucosa mayor. En nuestro trabajo los valores de hidrofobicidad mayores corresponden al colon distal, lo que nos hace pensar en un “refuerzo” fisiológico de la barrera mucosa a este nivel y una puerta abierta para investigar en trabajos sucesivos si realmente las propiedades de superficie están alteradas en el colon afecto de neoplasia. Investigaciones recientes (118) han puesto de manifiesto el papel que la ciclooxigenasa (COX) juega en la génesis tumoral. La COX regula la síntesis de prostaglandinas desde el ácido araquidónico. Hay dos formas enzimáticas de la COX: la forma constitutiva (COX-1) y la forma inducible (COX-2). La inducción de esta segunda forma enzimática viene mediada por la acción de algunas citoquinas (TGF-α y EGF) (119) (Figura 27) Esta segunda isoenzima, la forma inducible, se sobreexpresa frecuentemente en las células de la neoplasia de colon, favoreciendo la capacidad de invasión tumoral al inhibir el fenómeno de la apoptosis y estimular la síntesis de factores promotores de la angiogénesis (120). A partir de estas observaciones se ha visto que la acción de los antiinflamatorios no esterioideos (AINE) y concretamente los que actúan inhibiendo selectivamente la ciclooxigenasa 2 (COX-2) frenan el crecimiento de las células neoplásicas (121) (122). 160 FOSFOLIPIDOS ACIDO ARAQUIDONICO EGF + COX + - AINE PROSTAGLANDINAS Figura 27: Regulación en la síntesis de prostaglandinas. Nuestro trabajo, se ha realizado en mucosa de tejido sano y hemos analizado “ex vivo” el efecto que sobre la hidrofobicidad y por consiguiente sobre su sustrato químico el surfactante (fosfolípidos) provocan las prostaglandinas (PGE2), el EGF y los antiinflamatorios no esteroideos (los utilizados no son inhibidores selectivos de la COX-2), obteniendo un aumento en los valores de ángulo de contacto (hidrofobicidad) bajo la acción de los dos primeros y una disminución cuando actúan los antiinflamatorios. Esto nos hace pensar que idénticas moléculas actuando a través de iguales vías metabólicas pero dependiendo del sustrato celular sobre el que actúen, causan efectos antagónicos. Consiguientemente, la utilización de un mismo tratamiento (los antinflamatorios no esteroideos) puede estar contraindicado en el caso de gastropatías de tipo ulceroso o por el contrario indicado como profilaxis en el desarrollo de neoplasia de colon (123). 161 2. ENFERMEDAD INFLAMATORIA INTESTINAL. La enfermedad inflamatoria intestinal (colitis ulcerosa y enfermedad de Crohn) es otra patología que afecta a la mucosa del colon, con etiopatogenia probablemente multifactorial y no del todo conocida. Dentro de todo el conjunto de factores que se imbrican en al desarrollo de la enfermedad inflamatoria se describen factores medioambientales que actúan desde la luz del colon interaccionando con el sistema inmunológico del paciente y bajo una susceptibilidad genética a la enfermedad del mismo acaba desarrollándola. (124) (Figura 28) El hecho de producirse una interacción entre moléculas intraluminales y el sistema inmunológico del enfermo implica una disrupción completa estructural o como mínimo un déficit en la función como barrera de la doble capa más externa que cubre el epitelio mucoso y que junto a este conforman la denominada barrera mucosa gastrointestinal la cual constituye el primer mecanismo de defensa ante la acción de noxas intraluminales. Modelos experimentales para el desarrollo de colitis han puesto de manifiesto que el desarrollo de esta tiene dos etapas con mecanismos de producción diferentes. Una primera etapa que incluye el desarrollo de la enfermedad aguda en la cual el mecanismo de acción es directo e independiente de factores inmunológicos y una segunda etapa con una enfermedad de características crónicas y en la cual mecanismos mediados inmunológicamente juegan un papel básico (125). Estudios realizados en muestras de mucosa provenientes de pacientes afectos de enfermedad inflamatoria intestinal han puesto de manifiesto la alteración en la función de barrera de la mucosa intestinal (126) en el sentido de 162 reducir o anular sus características de hidrofobicidad con el consiguiente aumento a la permeabilidad de la misma a moléculas presentes en la luz gastrointestinal (127). Esto no se ha descrito exclusivamente en mucosa afecta por la enfermedad, sino que también se ha visto que muestras de tejido sano de pacientes afectos por colitis ulcerosa o enfermedad de Crohn, y muestras de familiares de primer grado de enfermos de enfermedad inflamatoria intestinal pero que no sufren la enfermedad, tienen alteraciones en la composición tanto del moco como de la monocapa de surfactante que lo recubre y que a su vez cubre el epitelio mucoso del tracto gastrointestinal y por consiguiente colónico, lo que provoca que la propiedad de la hidrofobicidad en estos tejidos exhiba valores menores de los esperados con lo cual la integridad de la función de barrera se ve comprometida. Observaciones como estas implican múltiples mecanismos etiopatogénicos en el desarrollo de la enfermedad inflamatoria intestinal donde con el sustrato de alteraciones genéticas y mediados por el efecto de agentes medioambientales bien por acción directa o a través de mecanismos inmunológicos se producirían los fenómenos inflamatorios ante gastrointestinal (128). la incompetencia de la barrera mucosa 163 Predisposición genética Surfactante Moco Factores inmunológicos Factores medioambientale Propiedades de superficie Permeabilidad Fenómenos inflamatorios: -Agudos -Crónicos Figura 28: Etiopatogenia de la EII. En modelos de colitis inducida desarrollados en animales de laboratorio se ha podido constatar que el sometimiento de la mucosa inflamada ante agentes citoprotectores como pueden ser los factores de crecimiento análogos al EGF (129) y las prostaglandinas (130) hace que se produzca una reparación del tejido dañado; así mismo el tratamiento previo de los animales de experimentación con los 164 agentes antes señalados previene la lesión al reforzar la resistencia de la mucosa del colon a fenómenos agresivos. En esta línea en nuestro trabajo se ha podido demostrar que el hecho de someter las muestras de mucosa sana de colon a la acción de dichos agentes protectores representa un aumento de los valores de sus propiedades de hidrofobicidad, aumento con significación estadística (p<0.0001), lo que nos hace deducir, coincidiendo con la literatura (131) que las acciones que desarrollan dichas moléculas lo hacen en el sentido de reforzar la barrera mucosa colónica. 165 CONCLUSIONES 166 Utilizando el ángulo de contacto como medida de la hidrofobicidad en la superficie de la mucosa del colon: 1. El valor medio de dicho ángulo de contacto determinado en la superficie de la mucosa colónica humana es de 39.52 ± 0.05º. 2. La hidrofobicidad adquiere valores menores conforme aumenta el tiempo de isquemia al que se somete la mucosa del colon. 3. La hidrofobicidad de la superficie mucosa del colon se incrementa cuando dicho tejido se somete a condiciones de laboratorio que semejan las del medio interno. 4. Los valores de hidrofobicidad en la superficie mucosa del colon obtenidos cuando esta se somete a condiciones de laboratorio similares al medio interno pero además se añade Prostaglandina E2 o Factor de Crecimiento Epidérmico, moléculas con propiedades citoprotectoras, son mayores que los obtenidos en condiciones idénticas pero en un medio exento de estas dos moléculas. 167 5. El incremento en los valores de hidrofobicidad que se obtiene al someter la mucosa del colon a la acción del Factor de Crecimiento Epidérmico es mayor al que se constata al incubar dicha mucosa en un medio idéntico pero que contiene Prostaglandina E2. 6. La exposición de la mucosa colónica a un medio que contiene diclofenaco o indometacina, antiinflamatorios no esteroideos, determina la pérdida de sus propiedades de superficie. 7. La hidrofobicidad de la mucosa colónica disminuye bajo el efecto de moléculas de antiinflamatorio no esteroideo de familias distintas, diclofenaco e indometacina, siendo el efecto mayor en el caso del diclofenaco. Así mismo la dosis de antinflamatorio utilizada también influye en la disminución de los valores de ángulo de contacto. 8. La hidrofobicidad de la mucosa colónica procedente de pacientes afectos de diabetes mellitus, hipertensión arterial, broncopatía crónica, cardiopatía o dislipemia se ven disminuida frente al grupo de pacientes que no presentan estos antecedentes patológicos. En pacientes con dislipemia los valores de ángulo de contacto en las muestras de mucosa son mayores que los obtenidos del resto de las muestras provenientes de pacientes con los demás antecedentes patológicos analizados. 9. La hidrofobicidad de los distintos tramos del colon no muestra variaciones estadísticamente significativas. Sin embargo hemos observado una tendencia a presentar valores de ángulo de contacto mayores en tramos más distales del colon. 10. La variación en los valores de hidrofobicidad obtenidos en los distintos tramos del intestino grueso se relaciona directamente con la proporción de 168 fosfolípidos que hemos obtenido del homogeneizado de mucosa colónica en cada uno de ellos. 169 BIBLIOGRAFIA 170 1. Casellas F, Aguadé S, Soriano B, et al. Intestinal permeability to 99mTc DPTA in inflammatory bowel disease. Am. J. Gastroenterol. 1986;81:767-770. 2. Lugea A, Salas A, Casalot J, Guarner F, Malagelada JR. Surface hydrophobicity of the rat colonic mucosa is a defensive barrier against macromolecules and toxins. Gut. 2000;46:515-521. 3. A.S. Frumento. Biofísica. 3ª Edic. 1995. Mosby/Doyma Libros. 4. Kane JW, Sternheim MM. Física. 2ª Edic. 1998. Edit. Reverté S.A. 5. Hills BA, Butler BD, Lichtenberger LM. Gastric mucosal barrier: Hydrophobic lining to the lumen of the stomach. Am. J. Physiol. 1983;244:G561-G568. 6. Spychal RT, Marrero JM, Saverymuttu SH, Northfield TC. Measurement of the surface hydrophobicity of human gastrointestinal mucosa. Gastroenterology. 1989;97:104-111. 7. Adamson AW. Phisycal chemistry of surfaces. 4th Ed. 1982. New York: Wiley. 171 8. Magnusson K.E. Physicochemical properties of bacterial surfaces. Biochem. Soc. Trans. 1989;17:454-458. 9. F. Gremy, F. Leterrier. Biophysique Generale et Medicale. Tomo1. 1982. Edit. Flammarion Medecine-Sciences. 10. Larsson K. Lipids-molecular organization, physical functions and technical applications. 1994. The oily press ltd. 11. Weser C. Measurement of interfacial tension and surface tension. General review for practical man. GIT Fachzeitschrift für das Laboratorium, 24. 1980. 642-648 und 734-742. 12. Ganong W. F. Fisiología médica. 17ª Edición. 2000. Edit. Manual Moderno. 13. Guyton AC. Tratado de Fisiología Médica. 10 ª Edición. 2001. Edit. Interamericana 14. Guarner F. Mecanismos de la toxicidad directa de los AINE. Gastroenterología y Hepatología. 1998;21.Suplemento 3: 2-8. 15. Davenport HW. Gastric Mucosal Injury by Fatty and Acetyl Salicylic Acids. Gastroenterology. 1964; 46: 245-253. 16. Radwan KA, Oliver MG, Specian RD. Cytoarchitectural reorganization of rabbit colonic goblet cells during baseline secretion. Am. J. Anat 1990;189: 365-376. 172 17. Cheng H, Bjerknes M, Amar J. Methods for the determination of epithelial cell kinetic parameters of human colonic epithelium isolated from surgical and byopsi specimens. Gastroenterology. 1984;86:78-85. 18. Geneser F. Histología. 3ª Edición. 2000. Editorial Médica Panamericana S.A. 19. Carlstedt I, Sheehan JK. Macromolecular properties and polymericstructure of mucus glycoproteins. Mucus And Mucosa (Cyba Fundation Symp. 109). 1984. London: Pitman; 157-166. 20. Podolsky DK. Oligosaccharide structures of human colonic mucin. J. Biol. Chame. 1985;260:8262-8271. 21. Sands BE, Podolsky DK. The trefoil peptide family. Ann. Rev. Physiol. 1996; 58:253-273. 22. Kindon H, Pothoulakis C, Thim L, Devaney K, Podolsky DK. Trefoil peptide protection of intestinal epithelial barrier function: cooperative interaction with mucin glycoprotein. Gastroenterology. 1995;109:516-523. 23. Williams SE, Tunberg LA. Retardation of acid diffusion by pig gastric mucus: a potential role in mucosal protection. Gastroenterology. 1980;79:299-303. 24. Weil J, Colin Jones D, Langman MSJ, Lawson D, Logan R, Murphy M, et al. Prophylactic aspirin and peptic ulcer bleeding. Gastroenterology. 1995;108: A 256. 25. Goddard PJ, Kao YC, Lichtenberg LM. Luminal surface hydrophobicity of canine gastric mucosa is dependent on a surface mucous gel. Gastroenterology. 1990;98: 361-370. 173 26. Schmitz MGJ, Renooij W. Phospholipids from rat, human and canine gastric mucosa. Gastroenterology. 1990;99:1292-1296. 27. Butler BD, Lichtenberger LM, Hills BA. Distribution of surfactants in the canine gastrointestinal tract and their ability to lubricate. Am. J. Physiol. 1983; 244:645-651. 28. Kao YC, Lichtenberger LM. Effect of 16,16dimethyl prostaglandin E2 on the lipidic organelles of rat gastric surface mucous cells. Gastroenterology. 1993; 104:103-113. 29. Lugea A, Mourelle M, Guarner F, Domingo A, Salas A, Malagelada JR. Phosphatidylcholines as mediators of adaptive cytoprotection of the rat duodenum. Gastroenterology. 1994;107:720-727. 30. Specian R.D, Neutra M.R. Regulation of intestinal goblet cell secretion. Role of parasympathetic stimulation. Am. J. Physiol. 1982;242 (Gastrointest. Liver Physiol. 5):G370-G379. 31. Cohen S. Isolation of a mouse submandibulary gland protein accelerating incisor eruption and eyelid opening in the new-born animal. J. Biol. Chem. 1962;237:1555-1562. 32. Carpenter G. and Wahl MI, eds. Peptide growth factors and their receptors. 1991. New York: Springer- Verlag. 33. Alison MR, Sarraf CE. The role of growth factors in gastrointestinal cell proliferation. Cell. Biol. Int. 1994;18:1-10. 174 34. Uribe JM, Barret KE. Non mitogenic actions of growth factors: An integrated view of their role in intestinal physiology and pathophysiology. Gastroenterology 1997;112: 255-268. 35. Barnard JA, Beauchamp RD, Russell WE, Dubois RN, Coffey RJ. Epidermal growth factor-related peptides and their relevance to gastrointestinal pathohysiology. Gastroenterology. 1995;108:564-580. 36. Lugea A, Mourelle M, Domingo A, Salas A, Guarner F, Malagelada J.R. Epidermal growth factor increases surface hydrophobicity and resistance to acid in the rat duodenum. Am. J. Physiol. (Gastrointest. Liver Physiol). 2001; Apr; 280(4):G774-9. 37. Konturek JW, Bielanski W, Konturek SJ, Bogdal J, Oleksy J. Distribution and release of epidermal growth factor in man. Gut. 1989;30:1194-1200. 38. Konturek SJ, Bielanski W, Konturek JW, Oleksy J, Yamazaki J. Release and action of epidermal growth factor on gastric secretion in humans. Scand. J. Gastroenterol. 1989;24:485-492. 39. Marrota F, Chui DH, Fesce E, Zhong GG, Gaetano I. Duodenal bicarbonate secretion induced by human epidermal growth factor in rats is partially mediated by prostaglandins. Digestion. 1993;54:19-23. 40. Khurana S, Nath SK, Levine SA, Bowser J, Donowitz M. Brush border phosphatidylinositol 3-kinase (PI3K) mediates epidermal growth factor (EGF) stimulation of intestinal NaCl absorption and Na/H exchange (abstr). Gastroenterology. 1996;110:A337. 175 41. Uribe JM, Keely SJ, Traynor-Kaplan AE, Barret KE. Phosphatidylinositol 3kinasa mediates the inhibitory effect of epidermal growth factor on calciumdependent chloride secretion. J. Biol. Chem. 1996:271:26588-26595. 42. Stryjek-Kaminska D, Piiper A, Zeuzem S. EGF inhibits secretagogue-induced cAMP production and amylase secretion by G proteins in pancreatic acini. Am. J. Physiol. 1995:269:G676-G682. 43. Ishikawa S, Cepinskas G, Specian RD, Itoh M, Kvietys PR. Epidermal growth factor attenuates jejunal mucosal injury induced by oleic acid: role of mucus. Am. J. Physiol. 1994;30:G1067-G1077. 44. Sumi S, Inoue K, Hosotani R, et al. Effect of human epidermal growth factor (h-EGF) on splanchnic circulation in dogs. Life Sci. 1990;47:1115-1119. 45. Hui WM, Chen BW, Kung AW, Cho CH, Luk CT, Lam SK. Effect of epidermal growth factor on gastric blood flow in rats: possible role in mucosal protection. Gastroenterology 1993;104:1605-1610. 46. Lacy ER. Epithelial restitution in the gastrointestinal tract. J. Clin. Gastroenterol. 1988;10:S72-S77. 47. Playford RJ, Wright NA. Why is epidermal growth factor present in the gut lumen? Gut. 1996;38:303-305. 48. Von Euler US. Some aspects of the actions of prostaglandins. The First Heymans Memorial Lecture. Arch. Int. Pharmacodyn. Ther. 1973, 202(suppl): 295-307. 49. Garret and Grisham. Biochemistry. 2ª Edic. 1999. Saunders College Publishing. 176 50. DuBois RN, Abramson SB, Crofford L, et al. Ciclooxigenase in biology and disease. FASEB J. 1998,12:1063-1073. 51. Brash AR. Lipoxygenases: ocurrence, functions, catalysis and acquisition of substrate. J. Biol. Chem. 1999;274:23679-23682. 52. Austin SC, Funk CD. Insight into prostaglandin, leukotriene and other eicosanoid functions using mice with targeted gene disruptions. Prostaglandins Other Lipid Mediators. 1999;58:231-252. 53. Ruddy S. et al (editors). Kelley’s Textbook of Rheumatology. Vol. 1. 6ª Edic. 2001. WB Saunders Company. 54. Kulmacz R, Lands W. Peroxide tone in ecosanoid signaling. In Forman H, Cadenas E (eds.): Oxidative stress and signal transduction. 1997. New York. Chapman & Hall. 55. Roberts MF. Phospholipases: structural and functional motifs for working at an interface. FASEB J. 1996;10:1159. 56. Marnett LJ, Rowlinson SW, Goodwin DC, et al. Arachidonic acid oxygenation by COX-1 and COX-2: Mechanisms of catalysis and inhibition. J. Biol. Chem. 1999;274: 22903-22906. 57. Ushikubi F, Hirata M, Narumiya S. Molecular biology of prostanoid receptors: An overview. J. Lipid Mediat Cell Signal. 1995;12:343. 58. Narumiya S, SugimotoY, Ushikubi F. Prostanoid receptors: structures, properties and functions. Physiol. Rev. 1999;79:1193-1226. 177 59. Urade Y, Hayaishi O. Prostaglandin D2 and sleep regulation. Biochim. Biophys. Acta. 1999;1436:606-615. 60. Coceani F, Akarsu ES. Prostaglandin E2 in the pathogenesis of fever: an update. Ann. N.Y. Acad. Sci. 1998;856:76-82. 61. Jiang C, Ting AT, Seed B. Ppar-gamma agonists inhibit production of monocyte inflamatory cytokines. Nature. 1998;391: 82. 62. Heller A, Koch T, Schmeck J, et al. Lipid mediators in inflammatory disorders. Drugs. 1998;55:487-496. 63. Coceani F, Olley PM, Lock JE. Prostaglandins, ductus arteriosus, pulmonary circulation: current concepts and clinical potential. Eur. J. Clin. Pharmacol. 1980;18:75-81. 64. McLaughlin VV, Genthner DE, Panella MM, et al. Reduction in pulmonary vascular resistance with long-term epoprostenol (prostacyclin) therapy in primary pulmonary hypertension. N. Engl. J. Med. 1998;338:273-277. 65. Spannhake EW, Hyman AL, Kadowitz PJ. Bronchoactive metabolites of arachidonic acid and their role in airway function. Prostaglandins. 1981;22: 1013-1026. 66. Hardman JG, Limbird LE. Goodman and Gilman’s The Farmacological basis of the therapeutics. 10ª Edic. 2001. Edit. McGraw-Hill. 67. Kuver R, Savard C, Oda D, Lee S.P. PGE generates intracellular cAMP and accelerates mucin secretion by cultured dog gallbladder epithelial cells. Am. J. Physiol. 1994; 267(Gastrointest. Liver Physiol. 30): G998-G1003. 178 68. Zushi S, Shinomura Y, Kiyohara T, et al. Role of prostaglandins in intestinal epithelial restitution stimulated by growth factors. Am. J. Physiol. 1996;270: G757-G762. 69. Hills B.A. Oesophageal surfactant: evidence for a possible mucosal barrier on oesophageal epithelium. Aust. NZ. J. Med. 1994; 24:41-46. 70. Lichtenberger LM. The hydrophobic barrier properties of gastrointestinal mucus. Annu. Rev. Physiol. 1995;57:565-583. 71. Davenport HW. Why the stomach does not digest itself? Sci. Am. 1972;226: 86-93. 72. Allen A, Flemstrom G, Garner A, Kivilaakso E. Gastroduodenal mucosal protection. Physiol. Rev. 1993;73:823-57. 73. Hills BA, ButlerBD, Lichtenberger LM. Gastric mucosal barrier: the hydrophobic lining to the lumen of the stomach. Am. J. Physiol. 1983; 7: G561-68. 74. Spychal RT, Marrero JM, Saverymuttu SH, Northfield TC. Measurementof the surface hydrophobicity of human gastrointestinal mucosa. Gastroenterology 1989;97:104-11. 75. Wassef MK, Lin YN, Horowitz MJ. Molecular species of phosphatidylcholine from rat gastric mucosa. Biochim. Biophys. Acta. 1979;573:222-26. 76. Schmitz MGJ, Renooij W. Phospholipids from rat, human, and canin gastric mucosa. Gastroenterology. 1990;99:1292-96. 179 77. Goddard PJ, Lichtenberger LM. Does aspirin damage the canine gastric mucosa by reducing its surface hydrofobicity? Am. J. Phyiol. 1987;15:G42130 78. Lichtenberger LM, Wang ZM, Romero JJ, Barreto JC. Certain NSAIDs chemically associate with surface phospholipids: insight into mechanism and reversal of NSAID-induced gastric injuriy. Gastroenterology. 1994;106(4): A125 (Abst.). 79. Wolfe MM, et al. Gastrointestinal toxicity of nonsteroidal antiinflamatory drugs. N. Engl. J. Med. 1999; 340:1888.. 80. Ottletz A, Romero JJ, Hatzell SL, Graham DY, Lichtenberger LM. Phospholipase activity of H. pylori and its inhibition by bismuth salts: biochemical and biofisical studies. Dig. Dis. Sci. 1993;38: 2071-80. 81. Hills BA. Gastric mucosal barrier: evidence for H. pylori ingesting gastric surfactant and deriving protection from it. Gut. 1993;34: 588-93. 82. Lichtenberger LM, Romero JJ. Effect of ammonium ion on the hydrofobic and barrier properties of the gastric mucus gel layer. J. Gastroenterol. Hepatol. 1994;9:suppl1:S13-9. 83. Allen A, Flemstrom G, Garner A, Kivilaakso E. Gastroduodenal mucosal protection. Physiol. Rev. 1993;73:823-57. 84. Lugea A, Mourelle M, Guarner F, Domingo A, Salas A, Malagelada JR. Mucosal secretion of phosphatidylcolinas as mediators of adaptive cytoprotection of the rat dodenum. Gastroenterology. 1994;107:720-27. 180 85. Madara J.L, Pappenheimer J.R. Structural basis for physiological regulation of paracellular pathways in intestinal epithelia. J. Mem. Biol. 1987;100:149-164. 86. De Schryver-Kecskemeti K, Eliakim R, Carroll S, et al. Intestinal Surfactantlike Material. A novel secretory product of the rat enterocite. J. Clin. Invest. 1989;8 4:1355-1361. 87. Mahmood A, Mahmood S, De Schryver-Kecskemeti K, Alpers D.H. Characterization of proteins in rat and human intestinal surfactant-Like particles. Archives of Biochemistry and Biophysics. 1993;300:280-286. 88. Gallot D. Anatomie chirurgicale du colon. Encycl. Med. Chir. (Elsevier, ParisFrance), Techniques chirurgicales-Appareil digestif. 1998;40-535. 89. Butler BD, Lichtenberger LM, Hills BA. Distribution of surfactants in the canine gastrointestinal tract and their ability to lubricate. Am. J. Pysiol. 1983; 244 (Gastrointest. Liver Physiol. 7): G645-G651. 90. Mack D.R, Neuman A.W, Policova Z, Sherman P.M. Surface hydrophobicity of the intestinal tract. Am. J. Physiol. 1992;262 (Gastrointest. Liver Physiol. 25):G171-G177. 91. Yoshihide T, Lichtenberger L.M. Molecular association of trinitrobenzenesulfonic acid and surface phospholipids in the development of colitis in rats. Gastroenterology. 1996;110:780-789. 92. Lugea A, Salas A, Casalot J, Guarner F, Malagelada J.R. Surface hydrophobicity of the rat colonic mucosa is a defensive barrier against macromolecules and toxins. Gut. 2000; 46: 515-521. 181 93. Scheurlen C, Materna T, Loosemann B, Breuer T, Malfertheimer P, Sauerbruch T. Altered luminal surface hydrophobicity of non-inflamed mucosa in patients with Crohn’s Disease (abstr.). Gastroenterology. 1995;108: A912. 94. Tietze C.C, Becich M.J, Engle M, Stenson W.F, Eliakim R, Alpers D.H. Caco2 cell transfection by rat intestinal alkaline phosphatase cDNA increases surfactant-like particles. Am. J. Physiol.1992;263 (Gastrointest. Liver Physiol. 26): G756-G766. 95. Anderson J.T, Murray F.E, Gallacher C, Ross P.E, Milne G, Hopwood D. Novel surfactant-like lipid (SLL) of human stomach, duodenum and rectum (Abstract). Gut. 1993;34:S16. 96. Eliakim R, Goetz GS, Rubio S, et al. Isolation and caracterization of surfactant-like particles in rat and human colon. Am. J. Physiol. 1997;272 (Gastrointest. Liver Physiol. 35):G425-G434. 97. Mahmod A, Engle M.J, Hultgren S.J, et al. Role of intestinal surfactant-like particles as a potential reservoir of uropathogenic Escherichia Coli. Biochim. Biophys. Acta. 2000; Sep1,1523(1): 49-55. 98. Beachey E.H. Bacterial adherence: adhesin-receptor interactions mediating the attachment of bacteria to mucosal surfaces. J. Infect. Dis. 1981; 143: 325-345. 99. Magnusson K.E. Physicochemical properties of bacterial surfaces. Biochem. Soc. Trans. 1989; 17: 454-458. 182 100. Murray PR. Manual of Clinical Microbiology. 7ª Edic. 1999. American Society of Microbiology (ASM). 101. Torsoli A.M, Ramorino M.V, Ammaturo M.V. et al. Mass movement and intracolonic pressure. Am. J. Dig. Dis. 1971;16:693-699. 102. Adamson A.W. Physical Chemistry of surfaces 2nd Ed. 1967. New York: Wiley. 103. Dieleman L.A, Palmen M.J, Akol H, et al. Chronic experimental colitis induced by dextran sulphate sodium (DSS) is characterized by Th1 and Th2 cytokines. Clin. Exp. Inmunol. 1998;114:385-391. 104. Dieleman L.A, Ridwan B.U, Tennyson G.S, et al. Dextran sulfate sodium- induced colitis occurs in severe combined immunodeficient mice. Gastroenterology. 1994;107:1643-1652. 105. Tatsumi Y, Lichtenberger L.M. Molecular association of trinitrobenzene- sulfonic acid and surface phospholipids in the development of colitis in rats. Gastroenterology. 1996;110:780-790. 106. Folch J., Lees M, Sloane-Stanley GH. A simple method for the isolation and purification of total lipids from animal tisues. J. Biol. Chem. 1957;226: 497-509. 107. Ames B.N. Assay of inorganic phosphate, total phosphate and phosphatases. Methods Enzymol. 1966;8:115-118. 183 108. Rouser G, Siakotos A.N, Fleischer S. Quantitative analysis of phospholipids by thin-layer chromatography and phosphorus analysis of spots. Lipids. 1966;1:85-86. 109. Dallal and Wilkinson. Approximation to Lillefors’method. Am. Statistician. 1986;40:294-296. 110. Goddard P.J, Lichtenberger L.M. In vitro recovery of canine gastric mucosal surface hydrophobicity and potential difference after aspirin damage. Digestive Diseases and Sciences. 1995;40,6:1357-1359. 111. Leung F.W. Mucosal defense. (Gastroenterology and Hepatology. The comprehensive Visual Reference Stomach and Duodenum. Edit. M. Feldman). Cap. 4 1996. Edit. Churchill Livinstong. 112. Lichtenberger L.M, Wang Z, Romero J, et al. Non-steroidal anti- inflammatory drugs (NSAIDs) associate with zwitterionic phospholipids: insight into the mechanism and reversal of NSAID-induced gastrointestinal injury. Nature Medicine. 1995. Vol 1. Num. 2. February. 113. Spychal RT, Goggin PM, Marrero JM, et al. Surface hydrophobicity of gastric mucosa in peptic ulcer disease. Relationship to gastritis and Campylobacter Pylori infection. Gastroenterology. 1990; 98:1250-1254. 114. Butterworth BE, Popp JA, Conolly RB, Goldsworthy TL. Chemically induced cell proliferation in carcinogenesis. IARC Sci. Publ. 1992;116:279305. 115. Soderholm JD, Borch K, Olaison G, Franzen L. Gastric leakiness in patients with atrophic gastritis. Gut. 1994;35 Suppl. 4:A8. 184 116. Sorbye H, Svanes K. Gastric mucosal protection against penetration of carcinogens into the mucosa. Scand J. Gastroenterol. 1995;30:929-934. 117. Phillips RKS. Colorectal Surgery. 1998. Edit. Saunders. 118. Eschwege P, De Ledinghen V, Camilli T, et al. Acide Arachidonique et prostaglandines, inflammation et oncologie. Presse Med. 2001;Mar.17, 30(10): 508-10. 119. Willett C.G. Genetics of colorectal carcinoma. Cancer of the lower gastrointestinal tract. 2001; B.C. Decker Inc. Hamilton London. 120. Tsujii M, Kawano S, Tsuji S, et al. Cyclooxigenase regulates angiogenesis induced by colon cancer cells. Cell. 1998; 93: 705-16. 121. Goldman A.P, Williams C.S, Sheng H, et al. Meloxicam inhibits the growth of colorectal cancer cells. Carcinogenesis. 1998; 19: 2195-9. 122. Masferrer J.L, et al. Antiangiogenic and antitumor activities of cyclooxygenase-2-inhibitors. Cancer Res. 2000; 60:1306. 123. Smalley W, Ray WA, Daugherty J, Griffin MR. Use of nonsteroidal anti- inflamatory drugs and incidebce of colorectal cancer: a population-based study. Arch Intern. Med. 1999;159:161-6. 124. Fazio VW. Enfermedad inflamatoria intestinal del colon. En: Zinner MJ, Schwartz SI, Ellis H. (eds.) Maingot. Operaciones abdominales (10ª Edición).1998. Buenos Aires: Editorial Médica Panamericana S.A. 1161-1191. 185 125. Ni J, Chen SF, Hollander D. Effects of dextran sulphate sodium on intestinal epithelial cells and intestinal lymphocytes. Gut. 1996; 39: 234-41. 126. Munkholm P, Langholz E, Hollander D, et al. Intestinal permeability in patients with Crohn’s disease and ulcerative colitis and their first degree relatives. Gut. 1994; 35(11): 1675-6. 127. Hollander D. Intestinal permeability, leak gut, and intestinal disorders. Curr. Gastroenterol. Rep. 1999;Oct; 1 (5): 410-6. 128. Jewell DP, Warren BF, Mortensen NJ. Challenges in Inflammatory Bowel. 2001. Disease Edit. Blackwell Science. 129. Egger B, Carey HV, Proccacino F, et al. Reduced susceptibility of mice overexpressing transforming growth factor alpha to dextran sodium sulphate induced colitis. Gut. 1998; 43:64-70. 130. Tessner TG, Cohn SM, Schloemann S, Stenson WF. Prostaglandins prevent decreased epithelial cell proliferation associated with dextran sodium sulfate injury in mice. Gastroenterology. 1998;115: 874-82. 131. Lugea A, Guarner F, Malagelada JR, et al. Surface hydrophobicity of the human colonic mucosa: role of epidermal growth factor (abastrac). Gastroenterology. 1998;114: A892.