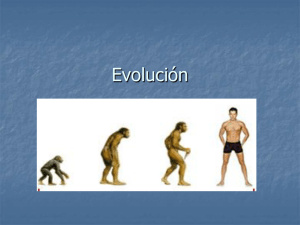
ANÁLISIS DE EXPRESIÓN DE LOS GENES DE LA RUTA
Anuncio

ANÁLISIS DE EXPRESIÓN DE LOS GENES DE LA RUTA BIOSINTÉTICA DE CAROTENOS, Y CUANTIFICACIÓN DE CAROTENOS EN HOJAS Y RAÍCES DE PLANTAS DE YUCA A DIFERENTES EDADES JACOBO ARANGO MEJIA MANABU ISHITANI DIRECTOR PAUL CHAVARRIAGA CODIRECTOR TRABAJO DE GRADO Presentado como requisito parcial Para optar al título de Biólogo PONTIFICIA UNIVERSIDAD JAVERIANA FACULTAD DE CIENCIAS CARRERA DE BIOLOGÍA Bogotá, D.C. Enero 2006 NOTA DE ADVERTENCIA Articulo 23 de la Resolución No 13 de Julio de 1946 “La Universidad no se hace responsable por los conceptos emitidos por sus alumnos en sus trabajos de tesis. Solo velará por que no se publique nada contrario al dogma y a la moral católica y por que las tesis no contengan ataques personales contra persona alguna, antes bien sea en ellas el anhelo de buscar la verdad y la justicia”. Cali, Enero 2006 Señores PONTIFICIA UNIVERSIDAD JAVERIANA Bogota D.C Estimados Señores: Yo Jacobo Arango Mejía, identificado con C.C. No. 75096489, autor del trabajo de grado titulado “Análisis de expresión de los genes de la ruta biosintética de carotenos, y cuantificación de carotenos en hojas y raíces de plantas de yuca a diferentes edades” presentado como requisito para optar al título de Biólogo en el año de 2006; autorizo a la Universidad Javeriana a: a) Reproducir el trabajo en medio digital o electrónico con el fin de ofrecerlo para la consulta en la Biblioteca General. Si b) Poner a disposición para la consulta con fines académicos, en la página web de la Facultad, de la Biblioteca General y en redes de información con las cuales tenga convenio la Universidad Javeriana. Si c) Enviar el trabajo en formato impreso o digital, en caso de que sea seleccionado para participar en concursos de trabajos de grado. Si d) Distribuir ejemplares de la obra, para la consulta entre las entidades educativas con las que la facultad tenga convenio de intercambio de información, para que este sea consultado en las bibliotecas y centros de documentación de las respectivas entidades. No e) Todos los usos, que tengan finalidad académica. Los derechos morales sobre el trabajo son de los autores de conformidad con lo establecido en el artículo 30 de la Ley 23 de 1982 y el artículo 11 de la Decisión Andina 351 de 1993, los cuales son irrenunciables, imprescriptibles, inembargables e inalienables. Atendiendo lo anterior, siempre que se consulte la obra, mediante cita bibliográfica se debe dar crédito al trabajo y a su(s) autor(es). Este documento se firma, sin perjuicio de los acuerdos que el autor(es) pacte con la Unidad Académica referentes al uso de la obra o a los derechos de propiedad industrial que puedan surgir de la actividad académica. Jacobo Arango M. C.C. 75096489 ANÁLISIS DE EXPRESIÓN DE LOS GENES DE LA RUTA BIOSINTÉTICA DE CAROTENOS, Y CUANTIFICACIÓN DE CAROTENOS EN HOJAS Y RAÍCES DE PLANTAS DE YUCA A DIFERENTES EDADES JACOBO ARANGO MEJIA APROBADO Manabu Ishitani Director Paul Chavarriaga Codirector Camilo Lopez Universidad Nacional Ivonne Balzer Universidad Javeriana ANÁLISIS DE EXPRESIÓN DE LOS GENES DE LA RUTA BIOSINTÉTICA DE CAROTENOS, Y CUANTIFICACIÓN DE CAROTENOS EN HOJAS Y RAÍCES DE PLANTAS DE YUCA A DIFERENTES EDADES JACOBO ARANGO MEJIA APROBADO Dr. Angela Umaña Decano Académico Dr. Cecilia Espíndola Director de Carrera FORMATO DESCRIPCIÓN TRABAJO DE GRADO AUTOR O AUTORES Apellidos Nombres Arango Mejía Jacobo DIRECTOR (ES) Apellidos Nombres Ishitani Manabu ASESOR (ES) O ASESOR Apellidos Nombres Chavarriaga TRABAJO PARA OPTAR POR EL TÍTULO DE: Paul Biólogo TÍTULO COMPLETO DEL TRABAJO: “Análisis de expresión de los genes de la ruta biosintética de carotenos, y cuantificación de carotenos en hojas y raíces de plantas de yuca a diferentes edades”. FACULTAD: Ciencias Básicas PROGRAMA: Carrera pregrado NOMBRE DEL PROGRAMA: Biología CIUDAD: BOGOTA AÑO DE PRESENTACIÓN DEL TRABAJO: 2006 NÚMERO DE PÁGINAS: 96 TIPO DE ILUSTRACIONES: Ilustraciones; Tablas; Gráficos y diagramas; Fotografías. MATERIAL ANEXO (Vídeo, audio, multimedia o producción electrónica): Duración del audiovisual: ___________ Minutos. Número de casetes de vídeo: ______ Formato: VHS ___ Beta Max ___ ¾ ___ Beta Cam ____ Mini DV ____ DV Cam ____ DVC Pro ____ Vídeo 8 ____ Hi 8 ____ Otro. Cual? _____ Sistema: Americano NTSC ______ Europeo PAL _____ SECAM ______ Número de casetes de audio: ________________ Número de archivos dentro del CD (En caso de incluirse un CD-ROM diferente al trabajo de grado: __________________________ DESCRIPTORES O PALABRAS CLAVES. Carotenos, expresión génica, HPLC, PCR en tiempo real, Yuca. RESUMEN DEL CONTENIDO Tres variedades de Manihot esculenta con diferencias evidentes en coloración de la raíz fueron sometidas a análisis de expresión de genes involucrados en la ruta de biosíntesis de carotenos (MeGGPS, MePSY, MePDS, MeZDS y MeLCYB) por PCR en tiempo real, y a cuantificación de carotenos totales y β-caroteno por HPLC. Plantas de tres y seis meses de edad fueron analizadas tomando muestras de hojas y raíces para establecer una relación entre fenotipo (coloración raíz), acumulación carotenos y expresión génica entre las variedades. El análisis estadístico de los resultados sugiere una relación entre coloración de la raíz (fenotipo) y contenido de carotenos totales y β-caroteno en la raíz; sin embargo los datos de expresión génica no mostraron diferencias de expresión en los genes evaluados que sostengan esta relación a nivel molecular. TABLA DE CONTENIDO 1 INTRODUCCIÓN 2 2 MARCO TEÓRICO Y REVISIÓN BIBLIOGRAFICA 4 2.1 Cultivo de la yuca 4 2.2 Calidad nutricional y contenido de carotenos 4 2.3 Carotenoides y su importancia 5 2.4 Ruta biosintética de carotenos en plantas 2.4.1 Regulación de la ruta biosintética 7 10 2.5 Biotecnología aplicada a carotenoides 12 2.6 Transformación genética en yuca 13 2.7 PCR en Tiempo Real 13 2.8 Cromatografía líquida de alta eficiencia (HPLC) 16 3 FORMULACIÓN DEL PROBLEMA Y JUSTIFICACIÓN 18 3.1 Formulación del problema 18 3.2 Justificación 18 4 OBJETIVOS 21 4.1 Objetivo General 21 4.2 Objetivos Específicos 21 5 MATERIALES Y MÉTODOS 22 5.1 Diseño de la investigación (diagrama de flujo) 5.1.1 Población de estudio y muestra 5.1.2 Variables de estudio 22 23 23 5.2 24 Métodos 5.3 Análisis de Información 5.3.1 Expresión génica 5.3.2 Cuantificación de Carotenos 30 30 31 i 6 RESULTADOS 32 6.1 Escogencia de las variedades 32 6.2 Diseño de iniciadores: 33 6.3 Extracción de ARN 34 6.4 Síntesis de ADN copia 36 6.5 Amplificación de las muestras en PCR en tiempo real 6.5.1 Cuantificación con la marca Fluorescente SYBR® Green: 6.5.2 Confirmación de la expresión génica detectada por SYBR® Green con la metodología TaqMan®: 42 6.6 45 7 7.1 Cuantificación de carotenos totales y β-caroteno: DISCUSIÓN 36 38 49 Selección de las variedades 49 7.2 Cuantificación de carotenos totales y β-caroteno: 7.2.1 Análisis de varianza: 49 50 7.3 Cuantificación de la expresión de los genes de la ruta biosintética: 52 7.4 Comentarios sobre metodología 55 8 CONCLUSIONES: 58 9 RECOMENDACIONES 59 10 LITERATURA CITADA 60 11 ANEXOS 66 11.1 Anexo 1. Protocolo de extracción de Carotenos totales y β-caroteno. 66 11.2 Anexo 2. Protocolo para cuantificación de β-caroteno por método HPLC 68 11.3 Anexo 3. Protocolo de extracción de ARN de raíz de yuca. 71 11.4 Anexo 4.Análisis de los datos de PCR en tiempo real. 74 11.5 Anexo. 5 Análisis estadístico medición carotenos totales y β-carotenos 75 ii RESUMEN Tres variedades de Manihot esculenta con diferencias evidentes en coloración de la raíz fueron sometidas a análisis de expresión de genes involucrados en la ruta de biosíntesis de carotenos (MeGGPS, MePSY, MePDS, MeZDS y MeLCYB) por PCR en tiempo real, y a cuantificación de carotenos totales y β-caroteno por HPLC. Plantas de tres y seis meses de edad fueron analizadas tomando muestras de hojas y raíces para establecer una relación entre fenotipo (coloración raíz), acumulación carotenos y expresión génica entre las variedades. El análisis estadístico de los resultados sugiere una relación entre coloración de la raíz (fenotipo) y contenido de carotenos totales y β-caroteno en la raíz; sin embargo los datos de expresión génica no mostraron diferencias de expresión en los genes evaluados que sostengan esta relación a nivel molecular. ABSTRACT Three varieties of Manihot esculenta with evident differences in root color were subjected to expression analysis of genes involved in the carotene biosynthesis pathway (MeGGPS, MePSY, MePDS, MeZDS y MeLCYB) using Real Time PCR, and to total carotene and βcarotene quantification using HPLC. Three and six month old plants were analyzed taking leaf and root samples to establish a relationship between phenotype, biochemical profile and genotype among varieties. Statistical analysis of results suggests a relationship between root color (phenotype) and total and β-carotene content; however, gene expression data did not show expression differences in the evaluated genes that may support this relationship at a molecular level. 1 INTRODUCCIÓN La yuca, (Manihot esculenta Cranzt), perteneciente a la familia Euphorbiaceae, es un cultivo de amplia distribución mundial principalmente en países en vía de desarrollo ubicados en América Latina, Asia y África. Forma parte fundamental de la alimentación de más de 500 millones de personas y alrededor de 70 millones de personas obtienen de la yuca más de 500 calorías al día por individuo. La yuca es productiva en suelos marginales, capaz de resistir enfermedades, sequía y plagas, y es flexible en su tiempo de cosecha; por eso es un cultivo muy adaptable y vigoroso que se consume en regiones donde prevalecen, muchas veces, la sequía, la pobreza y la desnutrición. La raíz de la yuca es un órgano muy rico en hidratos de carbono en forma de almidón, por lo que el aporte calórico es considerable. Entre su aporte en nutrientes se destaca la presencia de vitamina C, B2, B6, magnesio y potasio, notándose la ausencia, o en el mejor de los casos muy bajos niveles de vitamina A. Pese a la importancia que tiene como cultivo alimentario en numerosos países en desarrollo, los planes de mejora en el aporte vitamínico se iniciaron hace poco tiempo. La deficiencia de la vitamina A ha sido considerada como uno de los problemas nutricionales más comunes a nivel mundial. Los análisis de la UNICEF indican que un suministro adecuado en la dieta de vitamina A podría prevenir aproximadamente de uno a dos millones de muertes anuales entre niños de uno a cuatro años. Adicionalmente, la Organización Mundial de la Salud calcula que cada año pierden la vista más de 250,000 niños porque su consumo de vitamina A es insuficiente. La vitamina A se presenta principalmente en dos formas: como vitamina A propiamente dicha, encontrada en productos lácteos y otras fuentes de origen animal, o en forma de provitamina A (β-caroteno), que se convierte en vitamina A en el cuerpo y se encuentra en alimentos de origen vegetal. Un incremento de provitamina A (β-caroteno) en la yuca, 2 aseguraría una mejor salud visual (menos casos de ceguera), y en general una vida más saludable para la gente de las regiones más pobres del planeta. Varios grupos de investigación de distintos países, han encaminado esfuerzos para incrementar el aporte de vitamina A de los alimentos de la dieta básica humana mediante biotecnología; entre estas especies se encuentran el arroz, la canola y el tomate, en las cuales se ha logrado insertar genes que codifican enzimas de la ruta de biosíntesis de carotenoides, obteniendo variedades con niveles aumentados de carotenoides, incluyendo por supuesto el β-caroteno. Para poder generar variedades de yuca con mayores niveles de β-caroteno en la raíz, se debe conocer en detalle el funcionamiento de la ruta de biosíntesis de carotenos en este órgano. Con este objetivo presente, se pretende generar el conocimiento que permita un mejor entendimiento de la ruta biosintética de carotenos en yuca, cuantificando los niveles de expresión de los genes que codifican las enzimas de la ruta de biosíntesis de β-caroteno en la raíz y en la hoja. La cuantificación se llevó a cabo en dos edades de la planta (tres y seis meses) y a su vez en tres variedades con distintos contenidos de carotenos totales y βcaroteno, utilizando la tecnología de PCR en tiempo real. Paralelamente se establecieron los niveles de acumulación de los carotenos totales y del pigmento β-caroteno en las hojas y en la raíz de yuca con la tecnología de HPLC. El conocimiento generado en este trabajo sirvió de base para identificar puntos claves regulatorios de la ruta de biosíntesis de carotenos. El presente trabajo se enmarca dentro de un gran programa internacional llamado Harvestplus, el cual consiste en una investigación interdisciplinaria, que intenta reducir la desnutrición humana por micronutrientes, centrado en la investigación agrícola y nutricional para lograr cultivos alimentarios (fríjol, yuca, maíz, arroz, batata, trigo entre otras) con niveles más altos de micronutrientes (hierro, zinc y vitamina A). El programa Harvestplus recibe el apoyo generoso de la Fundación Bill y Melinda Gates, de la Ayuda Danesa para el Desarrollo Internacional (DANIDA), de la Agencia Sueca para el Desarrollo Internacional (SIDA), de la Agencia Estadounidense para el Desarrollo Internacional (USAID) y del Banco Mundial. 3 2 MARCO TEÓRICO Y REVISIÓN BIBLIOGRAFICA 2.1 Cultivo de la yuca La yuca es cultivada hace más de 5000 años en América tropical y hace 400 años en África. Es el alimento básico para cerca de 500 millones de personas, incluidos aquellos países en donde las enfermedades causadas por la deficiencia de vitamina A (VAD) son un serio problema (Ospina & Ceballos, 2002). Manihot esculenta es considerada como un cultivo de subsistencia, debido a su alta capacidad de adaptación a suelos ácidos e infértiles, a su relativa resistencia a malezas y plagas y a su habilidad para resistir largos períodos de sequía. Crece en áreas en donde la precipitación anual es mayor de 500 mm y la temperatura es superior a 20 °C, sin embargo algunas variedades crecen en los 2000 m de altura o áreas subtropicales, con temperatura promedio de 16 °C (Ekanayake et al, 1997). El área de cultivo de la yuca bajo condiciones marginales ha estado continuamente incrementándose, particularmente en zonas con suelos pobres y largas estaciones de sequía (Jos et al, 1990). Actualmente la yuca es cultivada en 92 países, considerándose el cuarto producto básico más importante del mundo, después del arroz, trigo y maíz; se cosechan más de 170 millones de toneladas de raíces frescas, estimándose que para el presente año su producción global podría incrementarse en un 30%. (Anónimo a, 1997) 2.2 Calidad nutricional y contenido de carotenos La yuca ha sido tradicionalmente considerada como un alimento básico, con calidad nutricional moderada, en especial la raíz tuberosa se resalta solamente como fuente de almidón, pues cerca del 90% de su peso seco lo constituyen carbohidratos (Ospina & Ceballos 2002; El-Sharkawy, 2003, Boiteux et al,2001). 4 A pesar de que se ha establecido una relación entre el color amarillo y la concentración de componentes de provitamina A en raíces de yuca (Iglesias et al, 1997), las raíces de la mayoría de los cultivares son blancas (Ospina & Ceballos 2002), cuya porción comestible tiene niveles bajos de carotenos (Jos et al, 1990). La yuca de color amarillo es un cultivo poco común en Colombia, Filipinas, Jamaica, y algunos países africanos (El-Sharkawy, 2003). Los tipos amarillo y naranja también son conocidos en Brasil, pero la mayoría de las variedades de yuca consumidas en ese país tienen bajo contenido de carotenos (Chávez et al, 2000). Los trabajos realizados por Bradbury & Holloway (1988), citado por Adewusi & Bradbury, (1993), mostraron que las raíces blancas de yuca pueden contener pequeñas cantidades de β-caroteno, en contraste con las raíces amarillas que pueden tener un contenido mucho mayor. No obstante, en muchas de las variedades amarillas, una gran cantidad de carotenoides podría existir en formas que no aportan provitamina A, como la luteína (Fregene & Puonti-Kaerlas, 2002). 2.3 Carotenoides y su importancia En general, los carotenoides juegan roles importantes en la planta, como son el de servir como protectores contra la foto oxidación en células y tejidos, como pigmentos accesorios y como determinantes estructurales de los complejos pigmento-proteína en los plastidios de plantas (Bartley & Scolnik, 1994). Los carotenoides en particular, recogen la luz radiante en la región azul del espectro (400-600 nm), una región que no es cubierta por las clorofilas. La energía absorbida por los carotenoides en estas longitudes de onda puede ser transferida al centro de reacción fotosintética vía clorofilas (Bartley & Scolnik, 1995). Adicionalmente los carotenoides actúan como atenuadores de los en estados excitados en las clorofilas que son generados durante la fotosíntesis. Los carotenos sirven también como señales en los plastos. Se cree que el gen que codifica para Fitoeno desaturasa, gen importante en la ruta biosintética de carotenos, está regulada por retroalimentación a nivel de trascripción, mediante la acumulación de productos finales de la vía de carotenogénesis (Rommel, 2001). 5 Los carotenoides son sustancias hidrofóbicas y lipofílicas virtualmente insolubles en agua. Aquellos que están basados en hidrocarbonos son colectivamente llamados carotenos, mientras que aquellos que contienen átomos de oxígeno con grupos funcionales como hidroxi, metoxi-, oxo-, epoxi-, carboxi-, aldehido, etc son comúnmente llamados xantofilas (Armstrong, 1997) La síntesis de carotenoides se lleva a cabo invariablemente en los plástidios, por ejemplo el cloroplasto, cromoplasto etc. Los carotenoides son componentes químicos de lo que colectivamente se conoce como la vía de biosíntesis de los terpenoides (Cunningham & Grantte, 1998). Los terpenoides son compuestos químicamente diversos y estructuralmente complejos construidos de unidades de isopreno de 5 carbonos, por lo que también suelen ser llamados isoprenoides. Se estima que las plantas sintetizan más de 30.000 diferentes terpenoides (Brown & Somerville, 2001), convirtiéndolo en la clase más grande de productos naturales (Bramley, 2002). Los terpenoides tienen diferentes funciones, como son las de estabilizadores de membranas (fitoesteroles), hormonas (giberelinas y ácido abcisico), pigmentos fotosintéticos (cadenas de fitol de la clorofila y carotenoides), transportadores de electrones (plastoquinona, prenilquinonas y ubiquinona), vitaminas como tocoferol (vitamina E), filoquinona (vitamina K1), (Römer et al, 2000). En adición a esas funciones fisiológicas, metabólicas y estructurales, muchos terpenoides específicos (comúnmente las familias C10, C15, y C20) sirven para comunicación y defensa (McGarvey & Croteau, 1995). En humanos, los carotenoides como el β-caroteno, son convertidos en vitamina A (retinal) por la acción de la enzima intestinal mono-oxigenasa; esta es la función de los carotenoides mejor establecida y está restringida a los carotenoides con el anillo β. La conversión de βcaroteno en la matriz intestinal depende del ambiente del carotenoide, y la tasa de conversión es 6:1 (6 µg de β-caroteno es equivalente a 1 µg de retinal), (Taylor & Ramsay, 2005). La presencia de provitamina A en la dieta puede prevenir afecciones oculares como la xeroftalmia y enfermedades oculares relacionadas con la edad como las cataratas y la degeneración macular (Fraser & Bramley, 2004). Se ha demostrado que la administración de vitamina A a los niños pequeños en las poblaciones con alimentación insuficiente 6 permite reducir en un 23% la mortalidad general. Se calcula que una medidas de este tipo permitirían evitar anualmente hasta 2,5 millones de muertes entre los niños menores de 5 años (Anónimo b, 2004) . El β- caroteno, junto con otros carotenos como el licopeno, también han sido relacionados con la disminución del riesgo de adquirir cáncer de pulmón (Wurtzel, 2001; Fraser & Bramley, 2004 ), cáncer de seno, cáncer de próstata (Agarwal, 2000) entre otros. De igual manera, estos carotenos se han relacionado con la protección contra enfermedades coronarias (Bartley & Scolnik, 1994; Palace et al, 1999). 2.4 Ruta biosintética de carotenos en plantas La biosíntesis de carotenos tiene un origen evolutivo muy antiguo, evidencia de ello es su síntesis en bacterias con fotosíntesis anaerobia y aerobia al igual que en eubacterias que no realizan fotosíntesis (Harker & Bramley, 1999). Los pasos iniciales de su síntesis han sido conservados a través del proceso evolutivo (Cerrullo, 2002). En plantas los carotenos son sintetizados y almacenados en los plastidios, existiendo evidencia substancial de la participación de las membranas plastídicas en su biosíntesis (Fraser & Bramley, 2004). Adicionalmente se han encontrado ejemplos de una diversidad bioquímica en la ruta de biosíntesis para carotenos y en la compartimentalización de sus constituyentes en tejidos específicos, como es el caso de las raíces tuberosas de yuca en donde se ha identificado en algunos cultivares la presencia de carotenos como licopeno y luteína (Boiteux et al, 2001). La ruta biosintética que envuelve la formación de los carotenoides fue elucidada entre 1950 y 1960 usando aproximaciones bioquímicas clásicas, con inhibidores específicos y mutantes bloqueando ciertos pasos en la ruta (Figura 1) (Cunningham, 2002). Isoprenil difosfato (IPP), cosiderado como el precursor de todos los isoprenoides, se isomeriza a su isomero alélico Dimetilalil difosfato (DMAPP), para luego por intermedio de la enzima Geranilgeranil difosfato sintasa (GPPS) generar un compuesto de 20 carbonos derivado de cuatro unidades de isopreno (5 carbonos) denominado Geranilgeranil 7 pirofosfato (GGPP) (Taylor & Ramsay, 2005). El GGPP es el precursor intermediario de los carotenoides y se ubica en el estroma. De este punto en adelante, toda la ruta metabólica pasa del estroma a la membrana plastidica. La primera reacción específica de la ruta de biosíntesis de carotenos es la condensación cabeza-cabeza de dos moléculas de trans de GGPP para formar fitoeno. Todas las reacciones subsecuentes involucran la conversión de esta estructura básica (Cunningham & Grantte, 1998). Figura 1. Ruta de biosíntesis de los carotenos en plantas. Abreviaciones de los genes de importancia en el estudio GGPS Geranil fitoeno sintasa PSY fitoeno sintasa, PDS fitoeno desaturasa, ZDS z-caroteno desaturasa, CRTISO caroteno isomerasa, LCYb licopeno β-ciclasa, CRTISO caroteno isomerasa (Cunningham, 2002). La reacción de síntesis de fitoeno está catalizada por la enzima Fitoeno sintasa, que se cree es un polipéptido monomérico aislado o fuertemente asociado a la membrana del cloroplasto (Cunningham, 2002). El fitoeno posteriormente sufre cuatro reacciones de desaturación, hasta formar licopeno. La introducción de dobles enlaces procede en sucesión alternante a la derecha e izquierda de la parte central de fitoeno (Cunningham, 2002). Esas desaturaciones sirven para alargar 8 las series conjugadas de enlaces carbono-carbono que constituyen el cromóforo en los pigmentos carotenoides (Fraser & Bramley, 2004). En contraste con las bacterias y hongos, en donde se realizan las reacciones de desaturación con una única enzima (crtI), en plantas son necesarias cuatro reacciones secuenciales para transformar fitoeno en licopeno, catalizadas por dos enzimas, Fitoeno desaturasa (PDS) y Z-Caroteno desaturasa (ZDS) (Shaub et al, 2005). La primera desaturasa (PDS) utiliza cada lado del simétrico fitoeno para producir z-caroteno. La segunda desatura (ZDS) lleva a cabo la reacción con z- caroteno para formar licopeno (Cunningham, 2002). Las desaturasas están asociadas a las membranas de cloroplastos y cromoplastos (Bartley & Scolnik, 1995). En las plantas producen una forma cis de licopeno, produciendo prolicopeno el cual debe ser isomerizado a la forma trans licopeno por la isomerasa recientemente identificada CRTISO (Isaacson et al, 2002). Los carotenoides en el aparato fotosintético de las plantas son componentes bicíclicos (Cunningham & Grantte, 1998). En esta reacción de ciclización sobre licopeno, son formados dos tipos de anillos, los anillos beta como un grupo final a ambos lados del βcaroteno y los anillos con α-caroteno. Estos anillos difieren únicamente en la posición del doble enlace en el anillo (Cunningham, 2002). Un único producto génico, la Licopeno β-ciclasa (LCY-β) cataliza la formación del βcaroteno (Fraser & Bramley, 2004) y de un anillo de α-caroteno a partir de licopeno. (Cunningham, 2002). La enzima que forma los anillos ε es conocida como licopeno εciclasa y provee de un anillo al α-caroteno del cual se deriva la luteína, el carotenoide predominante en los tejidos fotosintéticos de plantas y algas (Cunningham & Grantte, 1998). A partir de α-caroteno ó β-caroteno se forman los carotenoides oxigenados (xantofilas), los cuales comprenden la mayoría de los pigmentos en la membrana del tilacoide en plantas (Cunningham, 2002). 9 Regulación de la ruta biosintética La biosíntesis y la acumulación de los carotenoides en los plastos se realiza al tiempo con el ensamblaje de complejo antena para la captación lumínica y los centros de reacción, donde estos pigmentos están íntimamente asociados. (Cunningham, 2002). El papel central de los carotenoides en el desarrollo y adaptación de la planta sugiere que su síntesis es coordinada con otros procesos de desarrollo como la formación de plastos, floración y desarrollo del fruto (Fraser & Bramley, 2004). Es mucho lo que hay por conocer para responder la pregunta de ¿cuáles son los mecanismos empleados por las plantas para determinar qué carotenoides y en qué cantidad son acumulados en los plastos?. Hasta el momento existe evidencia fuerte de que la reacción catalizada por Fitoeno sintasa (PSY) es un importante punto de control para regular el flujo a través de la ruta biosintética (Welsch et al, 2001). Además de este reconocido punto regulatorio, Cunnningham en el 2002 reconoce dos puntos más: Disponibilidad de sustrato y ramificaciones de la ruta metabólica. Los carotenoides son isoprenoides formados por unidades de cinco carbonos, Isopentenil difosfato (IPP) y dimetilalil difosfato (DMAPP) los cuales son los precursores de la vía de todos los isoprenoides. Ambos, IPP y DMAPP son producidos en diferentes compartimientos por dos rutas diferentes en las células vegetales(Cunningham, 2002). La ruta del mevalonato (MVA), conocida hace bastante tiempo, que se lleva a cabo en el citosol; esta vía empieza con Acetil CoA hasta formar IPP, el cual realiza una reacción reversible con DMAPP por medio de la enzima Isopentenil Isomeraza (IPI). Por otro lado, la ruta del Metileritrol, descubierta recientemente en bacterias como cianobacterias se lleva a cabo en los plastos, sitio de síntesis de los carotenoides en las plantas. Esta ruta emplea piruvato y gliceraldehido 3 fosfato (GAP) como sustratos iniciales para finalmente producir IPP y DMAPP separadamente en una ramificación de la vía (Cunningham, 2002). La ramificación de la vía como mecanismo de regulación se hace evidente en las reacciones de ciclización en el paso de licopeno a alfa caroteno y luteína. En esta ramificación el Licopeno puede ser ciclado o por la enzima licopeno beta ciclasa (LCYβ) o 10 por la Licopeno epsilon ciclasa (LCYε); la primera le confiere dos anillos del tipo beta y la segunda uno beta y otro epsilon. Mutantes de LCYε en Arabidopsis thaliana acumulan dos veces más luteína que el tipo silvestre (Fraser & Bramley, 2004). Una ruta ramificada como la de la formación de los carotenoides, es poco probable que sea controlada por un solo proceso regulatorio; por el contrario es más probable que existan puntos de control en cada ramificación, y que además involucre eventos transcripcionales y postranscripcionales (Welsch et al, 2001). Regulación transcripcional positiva y negativa de los genes carotenogénicos ha sido encontrada en procesos tales como la maduración del tomate, desarrollo de la flor en tomate y marigold o flor de muerto (Tagetes erecta), narciso de los prados (Narcissus pseudonarcissus) y melón, y la maduración de la fruta en cítricos. De estos estudios se ha concluido que el gen PSY ejerce el mayor control en el flujo de la ruta (Welsch et al, 2002). Adicionalmente a estos procesos, la intensidad de la luz aparentemente aumenta la formación de carotenoides aumentando la expresión de ciertos genes; por ejemplo en la mostaza (Brassica sp.) el nivel de ARN mensajero del gen PSY aumenta con la luz, mientras los niveles de PDS y GGPS (Geranilgeranil pirofosfato) continúan constantes (Von Lintig et al, 1997) La retención de carotenoides en las células es una forma de regulación. Aparentemente los cloroplastos y cromoplastos difieren considerablemente en la forma de retener los productos finales de los carotenoides. En los cloroplastos los productos finales de los carotenoides están asociados con los complejos de absorción lumínica (Vishnevetsky et al, 1999). Los carotenoides que no se asocian a estos complejos se asocian con proteínas especificas como pequeños plastoglobulos. En Cromoplastos de la pimienta los productos finales de los carotenoides son esterificados y asociados con proteínas como fibrinas. La esterificación de los carotenoides aparece como un mecanismo efectivo utilizado por muchas flores (girasol, daffodil y marigold) para producir niveles altos de carotenoides. De otro lado los cromoplastos del tomate secuestran el licopeno como cristales. 11 2.5 Biotecnología aplicada a carotenoides El enorme progreso en el clonaje de genes carotenogénicos abrió la posibilidad de modificar la ruta de biosíntesis en plantas (Sandmann, 2001). Por ejemplo, la disponibilidad de clones de genes para biosíntesis de carotenos hizo posible la modificación genética del arroz para producir más β-caroteno o provitamina A en su endospermo produciendo una nueva variedad conocida como arroz dorado o “Golden rice” (Ye et al, 2000). Este progreso biotecnológico fue un éxito para la genética y para la salud pública (Wurtzel, 2001, Zimmerman & Hurrel, 2002). En canola, Brassica napus, la sobre expresión del gen crtB bacterial con un promotor específico fue suficiente para incrementar el contenido de β-caroteno 50 veces (Shewmaker et al, 1999). En marzo del presente año Paine y colaboradores (2005) publicaron una segunda versión del “Golden Rice” donde reemplazaron el gen PSY usado en el trabajo inicial de Ye et al (2000) por uno de Maíz, en combinación con la desaturasa bacterial (crtI) y observaron una producción de carotenoides 23 veces mayor en la nueva variedad de arroz. La caracterización de los niveles de expresión de genes de carotenos en yuca, podría contribuir al conocimiento de la vía metabólica y comprender mejor la forma de regulación de la ruta biosintética de β-caroteno. Por ingeniería genética se podría mejorar los puntos débiles de la ruta y así obtener nuevos cultivares con calidad nutricional mejorada. Varios estudios han demostrado que los niveles de ARN mensajero (ARNm) de los genes que se expresan en la ruta de biosíntesis son fuertemente regulados en tejidos tales como flores y frutos, indicando que los pasos transcripcionales y postranscripcionales son blancos potenciales para la regulación de la biosíntesis de carotenoides (DellaPena, 1999). Las raíces de yuca tienen la capacidad básica para sintetizar β-caroteno como muestra la identificación de cultivares con raíces amarillas con carotenos. La amplia variación en contenido de β-caroteno en las raíces de yuca, muestra que es posible que la modificación genética mejore el contenido de carotenoides aumentando el valor nutricional de la raíz (Fregene & Puonti-Kaerlas, 2002). 12 2.6 Transformación genética en yuca En Noviembre de 2004, en la revista Plant Molecular Biology, se publicó un articulo donde los principales grupos de investigación en transformación genética de yuca en el mundo, reseñaron el estado del arte de sus investigaciones y de la transformación en yuca en general. En la publicación se remarcó que la capacidad de integrar transgenes en yuca está establecida, y además esta siendo utilizada para generar plantas que expresan características de interés agronómico. Los sistemas de cultivo de tejidos de transferencia de genes que se emplean actualmente para producir estas variedades transgénicas de yuca han mejorado significativamente durante los últimos cinco años (Taylor et al, 2004). Actualmente hay programas en curso para el desarrollo de yuca con resistencia a enfermedades virales e insectos, para mejorar el contenido nutricional, para modificar la calidad y cantidad de almidón como también los contenidos cianogénicos de raíces procesadas (Taylor et al, 2004). 2.7 PCR en Tiempo Real El PCR en tiempo real (a veces llamado PCR cuantitativo) es usado para cuantificar la expresión de genes y confirmar su expresión diferencial en células tejidos y órganos. El PCR en tiempo real es usado para medir la abundancia de secuencias especificas de ADN o ARN. Los primeros instrumentos de PCR en tiempo real usaron un fluorómetro unido a un termociclador para medir la fluorescencia aumentada por marcas que como en el caso de SYBR® Green, se intercalan o se unen al surco menor del ADN de doble cadena. Durante la fase exponencial del PCR la cantidad de producto amplificado sintetizado en cada ciclo aumenta de manera casi geométrica. Por lo tanto, la producción de ADN amplificado puede 13 ser estimada en cualquier punto por la cantidad de fluorescencia emitida por marcas comerciales como SYBR Green I (Muller et al, 2002). La tecnología de PCR en Tiempo Real utiliza termocicladores que detectan fluorescencia para amplificar secuencias de nucleótidos específicas al tiempo que miden su concentración. Para lograr la cuantificación el instrumento diagrama tasas de acumulación de la secuencia de nucleótidos amplificada durante todo el curso de la reacción de PCR (Figura 2). Entre más grande sea la concentración inicial de la secuencia a evaluar (secuencia blanco) en la reacción, menor será el número de ciclos necesarios para alcanzar una producción particular de producto amplificado. (Becker et al, 1996; Gibson et al,1996; Heid et al, 1996; Freeman, 1999. Citado por Sambrook et al, 2001) Figura 2. Diagrama logarítmico de amplificación de secuencias de nucleótidos con diferentes concentraciones iniciales, detectada por florescencia emitida por la marca Brilliant® SYBR® Green (Stratagene) durante el curso de la reacción de PCR en un termiciclador DNA Engine Opticon® 2 System (MJ Research); cada línea representa una muestra amplificada, siendo la roja la de mayor concentración y la amarilla la de menor. Unidad de Biotecnología, CIAT 2005. La concentración inicial de la secuencia blanco puede por lo tanto ser expresada como el número fraccional de ciclos (CT) requerido para alcanzar dicha producción particular de producto amplificado. Un diagrama del valor de CT contra el valor log10 del numero inicial de copias de un set de estándares de concentraciones conocidas del templado, produce una línea recta (curva estándar, Figura 3) (Higuchi, et al 1993). La secuencia blanco es una muestra de concentración desconocida, la cual puede ser fácilmente cuantificable por interpolación en esta curva estándar (Bustin, 2002). 14 Figura 3. Diagrama una curva estándar construida con del valor de CT contra el valor log10 de un set de estándares de concentraciones conocidas (puntos en la gráfica) de un templado el cual produce una línea recta, Unidad de Biotecnología, CIAT 2005. La capacidad para cuantificar el DNA o RNA amplificado durante la fase exponencial del PCR, cuando ninguno de los componentes de la reacción son limitantes, resulta en una mejor precisión en la cuantificación de las secuencias blanco (Muller et al, 2002). Amplificaciones inespecíficas o la formación de dímeros de iniciadores pueden significar errores significativos al cuantificar las moléculas blanco. Varios métodos se han desarrollado para confirmar la especificidad del producto amplificado, entre ellos se encuentra la curva de denaturación térmica o curva de “Melting”. En la metodología de la curva de Melting el equipo puede ser programado para generar una curva de denaturación térmica del ADN amplificado y medir las temperaturas de denaturación o “melting” (Tm) de los productos de PCR. La forma de las curvas de “melting” indica cuáles de los productos amplificados son homogéneos y asegura que el producto correcto ha sido específicamente amplificado (Figura 4) (Ririe, 1997). Figura 4. Diagrama de curvas de denaturación térmica “melting curve” para la amplificación del gen PSY en tres muestras de hojas de yuca (líneas azul, verde y amarilla). Se aprecia especificidad en los productos amplificados al generarse una sola curva de “melting” que aparece como un pico mayor indicado por la flecha. Unidad de Biotecnología, CIAT 2005. 15 El SYBR® Green es una marca que al igual que el Bromuro de etidio, se adhiere al ADN de doble cadena emitiendo fluorescencia a medida que se va produciendo la síntesis de ADN de doble cadena en la reacción de PCR. SYBR® Green tiene un punto de excitación y emisión máximo de 494 nm y 521 nm respectivamente. La metodología de TaqMan PCR en tiempo real se basa en la utilización de pruebas que se unen al producto que se desea cuantificar. Contrario a SYBR® Green, que se une a cualquier ADN de doble cadena, el método TaqMan® utiliza una marca de fluorescencia especifica unida a la sonda que se une por complementariedad de bases a la secuencia que se pretende amplificar, dando como resultado un aumento en la especificidad y sensibilidad. Adicionalmente diferentes maracas fluorescentes están disponibles, por lo tanto varios iniciadores se pueden emplear para amplificar diferentes secuencias en un mismo tubo. 2.8 Cromatografía líquida de alta eficiencia (HPLC) La cromatografía es una técnica utilizada para la separación de los componentes de una mezcla, basada en los diferentes grados de interacción de estos componentes con dos fases materiales separadas. La naturaleza de las dos fases y el tipo de interacción puede variar y esto da origen a los diferentes tipos de cromatografía. Una de las dos fases es una fase en movimiento (fase móvil) mientras que la otra no se mueve (fase estacionaria). La mezcla que va a ser separada usualmente se diluye en la fase móvil, la cual entonces se hace mover o filtrar a través de la fase estacionaria generalmente por alta presión. Los componentes de la mezcla son retenidos por la fase estacionaria en grados variables y como resultado, se mueven junto con la fase móvil a velocidades diferentes y por lo tanto son separados (Kenkel, 1992). El sistema básico del HPLC consiste de un reservorio para el solvente, bomba, inyector, columna y detector y software para análisis. La bomba permite que la fase móvil fluya a través de todo el sistema. En la cabeza de la columna está el dispositivo de inyección el 16 cual introduce la muestra al sistema. Al final del efluente, un detector detecta los componentes de la muestra y la señal resultante es exhibida como picos en un registro grafico (cromatograma figura 5). Este registro puede detectar, a través de un software, la presencia de picos, corregir líneas base, calcular áreas y tiempos de retención y determinar la concentración de los componentes usando factores de calibración almacenados. (Kenkel, Absorbancia 450 nm (mAU) 1992). Tiémpo de retención (min) Figura 5. Cromatograma donde se detectan los compuestos carotenoides (1,2 y 3) de una muestra de raíz de yuca. La señal resultante es exhibida como un conjunto de picos. Muestra de raíz de yuca procesada en un HPLC 10cinco0 (Hewllet Packard), con una columna YMC-C30, detector ultravioleta-visible. Unidad de Biotecnología, CIAT 2005. 17 3 FORMULACIÓN DEL PROBLEMA Y JUSTIFICACIÓN 3.1 Formulación del problema Se desea conocer los niveles de expreisión de los genes carotenogenicos y la acumulación de carotenos en hojas y raíces en tres variedades de yuca. 3.2 Justificación Más de dos billones de personas, Un tercio de la población mundial, sufre por deficiencias por vitamina A, Zinc o Hierro; esto, debido a que la principal fuente de vitamina A para el hombre es de origen animal (hígado, pescado y yema de huevo), la cual esta fuera del alcance de la mayoría de personas en el tercer mundo (Adewusi & Braddury, 1993). En países pobres la población tiene dietas simples, compuestas principalmente de unos pocos alimentos básicos (yuca, trigo, arroz y maíz), los cuales son pobres en algunos macronutrientes y muchos micronutrientes esenciales (DellaPenna, 1999). Debido al elevado costo de los alimentos derivados de animales, la mayor fuente de vitamina A (cerca del 82%) son los carotenos presentes en los vegetales, particularmente β-caroteno o provitamina A (Zimmermann & Hurrell, 2002). Las dos grandes consecuencias de la deficiencia de vitamina A (VAD) son el daño al tejido epitelial y nervioso. En humanos las anormalidades en el ojo son los principales signos de deficiencia de vitamina A y son las que causan el mayor daño, llevando entre otras enfermedades, a la ceguera nocturna (pérdida de función en los bastones de la retina), xerosis (un secado general o localizado de la conjuntiva), xeroftalmia (enfermedad causada por infecciones secundarias de la superficie del ojo) y queratolmancia (un ablandamiento de la córnea que lleva a una lesión permanente de está y ceguera). Se calcula que, en los países en vías de desarrollo, el riesgo de deficiencia de vitamina A afecta a unos 200 ó 300 millones de niños en edad preescolar. Cada año, medio millón de niños se quedan ciegos deficiencia de vitamina A, y la mayoría de ellos (alrededor del 70%) fallecen en el plazo de 18 un año. También han sido asociadas a la deficiencia de vitamina A un número de enfermedades comunes a niños y adultos, incluidas diarrea, sarampión, varicela, tosferina, tuberculosis, etc (Zimmermann & Hurrell, 2002). Los análisis de la UNICEF indican que un suministro adecuado en la dieta de vitamina A podría prevenir aproximadamente de uno a dos millones de muertes anuales entre niños de uno a cuatro años (Römer et al, 2000). Los programas de intervención con vitamina A han probado ser efectivos a corto plazo (Wurtzel, 2001). Estos programas han consistido en la diversificación y suplementación de alimentos, pero se han enfrentado a limitaciones como aspectos culturales, hábitos alimenticios y condiciones económicas, además de requerir organización y seguimiento para resultar efectivos. Por ejemplo en África, desde 1990, se han distribuido dosis masivas de vitamina A en cápsulas, pero las madres, que no identifican los síntomas en sus niños, frecuentemente se niegan a retomar las dosis. Lo anterior ha dificultado que los niños en alto riesgo mantengan los niveles requeridos de vitamina A para eliminar la VAD a largo plazo (Wurtzel, 2001). Otro problema para la mayoría de los países africanos lo constituye el alto costo de los alimentos con vitamina A preformada (Hagenimana et al, 1997). Además, la vitamina A en dosis masivas puede llegar a ser tóxica al ocasionar hipervitaminosis (Zimmermann & Hurrell, 2002) En contraste, un exceso en la dieta de βcaroteno no tiene efectos perjudiciales reportados (Guerinot, 2000). Según datos de la organización “Sight and Life” del 2004, el problema en Colombia se encuentra en el nivel catalogado como Grave subclínico, solamente siendo superado por el nivel Clínico encontrado en pises del continente Africano y en la India. En el continente Suramericano los países que presentan mayor incidencia del problema de la vitamina A son Colombia, Perú y Brasil, poniendo en evidencia la gravedad del problema en nuestro país con respecto al mundo y al continente. 19 Debido a todo lo anterior, el aumento en la dieta del contenido de carotenos ha sido vista como la estrategia más efectiva para disminuir la VAD, comparada con el uso de suplementos (Römer et al, 2000; Zimmermann & Hurrell, 2002). Teniendo en cuenta la importancia de la yuca como alimento básico de amplio consumo, especialmente con presencia en las regiones donde se presenta el VAD sobre todo entre personas sin recursos, y el gran problema de salud que se presenta actualmente por deficiencia de vitamina A, se ha propuesto desarrollar variedades de yuca más nutritivas con niveles más altos de β-caroteno. Para lograrlo es determinante conocer la ruta de biosíntesis, su de regulación, e identificar los pasos limitantes para implementar estrategias biotecnológicas y/o de mejoramiento convencional para mejorar el valor nutritivo de la raíz de yuca. Para ambas estrategias resulta importante la evaluación de los niveles de expresión de los genes implicados en la biosíntesis de β-caroteno. El PCR en tiempo real proporciona la exactitud necesaria y produce resultados confiables y rápidos. El uso del PCR para amplificar productos de DNA copia que vienen de una retotranscripción de RNA total se ha convertido en una herramienta molecular de rutina para estudiar la expresión génica. (Pfaffl et al, 2002, Bustin, 2002). De otro lado se cuenta con el HPLC, que se ha usado por décadas con resultados indiscutibles en detección de compuestos químicos; por esta razón se escogió esta herramienta complementaria al PCR en tiempo real, para tener información precisa del contenido y la acumulación de β-carotenos en las hojas y raíces de las variedades a las cuales se van a evaluar sus niveles de expresión de los genes mencionados anteriormente. 20 4 OBJETIVOS 4.1 Objetivo General Contribuir al entendimiento de la síntesis y regulación de carotenos en Yuca. 4.2 • Objetivos Específicos Evaluar los niveles de expresión de los genes de la ruta biosintética de β-caroteno (GGPS, PSY, PDS, ZDS, CRTISO, LCY-β) de hojas y raíces en tres variedades contrastantes a los tres y seis meses de edad en plantas de yuca. • Determinar el contenido de carotenos totales y de β-caroteno de hojas y raíces en tres variedades de yuca contrastantes a los tres y seis meses de edad en plantas. • Establecer si existe correlación, en el tiempo, entre la acumulación de carotenos en la raíz y el nivel de expresión de los genes de la ruta dentro de cada variedad. 21 5 MATERIALES Y MÉTODOS 5.1 Diseño de la investigación (diagrama de flujo) Colecta material vegetal Hojas y Raíces Plantas de yuca de 3 y 6 meses de edad en tres variedades. Extracción ARN Total Extracción carotenoides Raíces y Hojas (AcetonaÉter de Petróleo) Hojas(Kit promega) Raíces (Trizol) Síntesis de ADNc Retrotranscriptasa (SuperScript III) Análisis de carotenos por HPLC Generación de cromatogramas Cuantificación relativa de la expresión de genes (PCR tiempo real SYBR® Green) GGPS, PSY, PDS, ZDS, CRTISO, y LCY-β Integración de picos Determinación contenido carotenos totales, β-caroteno Confirmación de la cuantificación de expresión de genes (PCR tiempo real PruebasTaqMan®) U. Freiburg, Alemania PSY, PDS y ZDS 22 Población de estudio y muestra Tres variedades de Manihot esculenta Crantz, seleccionadas con base en contenido de carotenos en la raíz, del germoplasma de yuca del CIAT, Palmira: • MBRA 253 (variedad amarilla). • CM 2772-3 (variedad crema). • CM 3306-4 (variedad blanca). Muestra Hojas jóvenes y raíces de cinco individuos por variedad, de plantas de tres y seis meses de edad. Variables de estudio Variables independientes (son constantes para ambos objetivos específicos) • Edad de la planta: tres y seis meses. • Variedad: MBRA 253, CM 2772-3 y CM 3306-4. Variables dependientes Para el primer objetivo especifico: Niveles de expresión de los genes blanco (GGPS, PSY, PDS, ZDS, CRTISO, LCY-β) en hojas y raíces, expresados en una escala relativa generada por la normalización con respecto al gen referencia 18S. Para el segundo objetivo: Contenido de carotenos totales y β-caroteno expresado en microgramos (µg) por gramo (g) de tejido fresco. 23 5.2 Métodos Previo al desarrollo de la metodología, y con la intención de cubrir la amplia variación en contenido de β-caroteno en las raíces de yuca, se llevó a cabo la escogencia de las variedades para el estudio. Se realizó un sondeo en el que se evaluaron el contenido de carotenos totales y de β-caroteno de nueve variedades sembradas en CIAT, con la finalidad de escoger las tres variedades de acuerdo a los siguientes criterios: • Variedad de mayor contenido de carotenos totales y β-caroteno en la raíz. • Variedad de menor contenido de carotenos totales y β-caroteno en la raíz. • Variedad que mostrara valores intermedios entre las dos primeras. Luego de la escogencia de las tres variedades idóneas para las mediciones propuestas (cuantificación de los niveles de expresión de genes y contenido de carotenos), se hizo una propagación clonal por medio de estacas de cada una de las variedades en el mismo lote con la finalidad de homogenizar en lo posible las condiciones. El lote se ubica en las instalaciones del Centro Internacional de Agricultura Tropical CIAT situado en la ciudad de Palmira (Valle del Cauca), con 3°31’ norte y 76°19’ oeste a 965 metros sobre el nivel del mar, con una precipitación media anual de 965 mm, humedad relativa promedio de 76% y temperatura promedio de 24 °C. (figura 6). Figura 6. Plantas de las variedades escogidas sembradas en un lote ubicado en CIAT Palmira. 24 Para el primer objetivo especifico: Cuantificar los niveles de expresión de los genes de la ruta biosintética de β-caroteno (GGPS, PSY, PDS, ZDS, CRTISO, LCY-β) de hojas y raíces en tres variedades a los tres y seis meses de edad de las plantas de yuca. • Colecta del material vegetal Se colectaron hojas y raíces de cinco plantas por cada variedad a los tres, seis de edad meses de edad (figura 7). Adicionalmente muestras de plantas de ocho meses de edad se colectaron para analizar solamente la expresión de los genes usando las sondas TaqMan (ver confirmación de la amplificación con TaqMan). Se transportaron en nitrógeno líquido al laboratorio donde se almacenaron en un congelador a -80AC hasta el momento de la extracción de ARN. A B Figura 7. Plantas de la variedad CM 3306-4 (Raíz blanca) a los tres (A) y seis meses de edad (B). • Extracción de ARN total Las muestras de raíces y hojas jóvenes para cada variedad y tiempo de colecta se maceraron individualmente en nitrógeno líquido hasta obtener un polvo fino. Para cada muestra individual se realizó una extracción. El ARN de las hojas se extrajo utilizando el especificaciones del fabricante. El ARN de raíz se extrajo con el protocolo descrito por Reilly y colaboradores en 2001, con modificaciones realizadas en la unidad de 25 biotecnología de CIAT, Palmira; donde se combina la acción de un Buffer de extracción compuesto por Tris HCL, NaCl, EDTA, SDS y PVP, con el reactivo Trizol® de Invitrogen para la extracción del ARN. Para más información ver anexo 3. El mismo proceso se llevó a cabo con muestras de hojas y raíces de plantas de 8 meses de edad, pero estas muestras sólo fueron incluidas en la cuantificación de expresión génica con la metodología TaqMan como se explicará más adelante. Una vez extraído el ARN se cuantificó por absorbancia estimando la densidad óptica de cada muestra a dos longitudes de onda diferentes absorbancia a 260 y 280 nanómetros (nm) con el espectrofotómetro GENios de TECAN®. Con esta información se calcularon las respectivas concentraciones de las muestras. Adicionalmente se realizó una estimación de la pureza del ARN con la relación A260/A280, asumiendo un rango optimo de este índice entre 1.8 y 2.2, reportado en el manual del kit de extracción de ARN “SV RNA Isolation system” de Promega®. De otro lado se revisó la integridad del ARN con corridas electroforesis donde se visualizó 1.5 µg de cada muestra de ARN en géles de agarosa a una concentración de 1% con un buffer de corrida TBE (Tris base, Ácido bórico y EDTA ). • Digestión de ADN en las muestras de ARN Previo a la síntesis de ADN copia se tomaron alícuotas iguales de ARN de cada extracción y se conformaron dos pooles de ARN, uno por tejido (hoja o raíz), de cada variedad (MBRA 253, CM 2772-3 y CM 3306-4) en el tiempo al cuál se colectó (tres y seis meses); por ejemplo: pool número uno de raíz, de la variedad MBRA 253 de 3 meses de edad. El ARN fue sometido a una digestión con la enzima “DNase I Amp Grade” de Invitrogen® siguiendo las indicaciones del fabricante. Con esa digestión se buscó que la muestra de ARN quedara libre de cualquier contaminación de ADN geonómico. Posterior a la digestión de ADN se llevó a cabo una amplificación vía PCR tomando el ARN como templado para la amplificación del gen constitutivo 18S. Si persiste la contaminación de ADN se espera la amplificación del gen 18S; de lo contrario no puede efectuarse la amplificación y se comprueba que el ARN está libre de contaminación por ADN genómico. Una vez se tuvo plena confirmación de la ausencia de ADN se procedió a la síntesis de ADN complementario. 26 • Síntesis de ADN copia A partir de aproximadamente 400 ng de ARN de cada pool se sintetizó ADN complementario (ADNc) de cadena sencilla de cada uno de los pooles conformados, usando la transcriptasa reversa SuperScript™ III “First-Strand Synthesis System” para RTPCR de Invitrogen®, de acuerdo a las especificaciones del fabricante, y hexámeros aleatorios como iniciadores. Una vez terminado el evento de retrotranscripción, las muestras se cuantificaron por absorbancia A260 / A280 realizaron diluciones a una misma concentración. • Diseño de iniciadores El diseño de los iniciadores para la cuantificación con SYBR® Green se realizó utilizando la plataforma bioinformática Vector NTI® de Invitrogen®. Se elaboraron alineamientos globales con ayuda del programa AlignX para cada uno de los genes blanco, comparando la secuencia del gen en varias especies, de esta forma se identificaron regiones conservadas entre las especies, sobre las cuales se diseñaron los iniciadores. Para aquellos genes en los que se contaba con secuencias especificas de yuca (PSY, PDS y ZDS), además de diseñar el iniciador en regiones conservadas entre especies, se tomaron las secuencias de yuca como base para el diseño de los iniciadores; de otro lado para los genes en los que no se conoce la secuencia en yuca se utilizó la secuencia consenso surgida del alineamiento de las secuencias. Los iniciadores y las sondas internas del cada gen (PSY, PDS y ZDS) cuantificado con TaqMan®, fueron diseñados por el Doctor Ralf Welsch de la Universidad de Freiburg en Alemania, tomando como base las secuencias parciales de cada gen disponibles de yuca. • Amplificación de las muestras en PCR en tiempo real con SYBR® Green Las amplificaciones de los genes de yuca MeGGPS, MePSY, MePDS, MeZDS, MeCRTISO, MeLCY-β y Me18S (el prefijo “Me” significa Manihot esculenta), se llevaron a cabo en el termociclador “DNA Engine Opticon® 2 System” de MJ Research®, 27 utilizando 2 µl de ADNc (misma concentración en las muestras) de cada pool como templado. Se utilizaron los reactivos de PCR y la marca fluorescente del “Brilliant® SYBR® Green Q. PCR Master Mix” de Stratagene, siguiendo las especificaciones del fabricante. El perfil de PCR utilizado fue el siguiente: 1. 95 °C por 1 minuto 2. 94 °C por 30 segundos 3. 58 °C por 30 s. 4. 72 °C por 30 s. 5. Lectura del plato 6. Incubar a 67 °C por 1 s. 7. Lectura del plato 8. repetir desde el paso 2, 44 veces 9. 72 °C por 5 m. Al final del PCR se elaboró una curva de denaturación térmica o curva de “melting”, en un gradiente de temperatura entre 65 y 95 °C, con lecturas del plato cada 0,2 °C. Dos réplicas técnicas se llevaron a cabo para cada muestra en cada uno de los genes. • Confirmación de la amplificación (expresión génica) de las muestras en PCR en tiempo real usando la metodología de sondas TaqMan®: Las mismas muestras de ARN utilizadas para la cuantificación de expresión genética con SYBR® Green hechas en CIAT, más el ARN de hojas y raíces de plantas de 8 meses, fueron llevadas a la universidad de Freiburg en Alemania donde se realizó un nuevo proceso de cuantificación de los genes PSY, PDS y ZDS empleando la metodología de pruebas TaqMan®. El ARN se sometió a digestión de ADN usando la enzima “DNaseI” de Quiagen®. La síntesis de ADNc se realizó con los reactivos de trascripción reversa de TaqMan®, siguiendo las indicaciones del fabricante. La amplificación se llevó a cabo en un termociclador ABI® 7000 Prism System, usando los reactivos de PCR de ABI® “Master Mix”. El gen 18S se utilizo como gen referencia, al igual que en los ensayos con SYBR® Green. El perfil de PCR utilizado fue el siguiente: 28 1. 95°C por 10 minutos. 2. 95°C por 1 minuto. 3. 68°C por 30 segundos 4. Repetir desde el paso 2, 44 veces. Para el segundo objetivo especifico • Colecta de las muestras Se colectaron muestras de hojas y raíces de cinco plantas por cada variedad (las mismas plantas utilizadas para la extracción de ARN); se transportaron al laboratorio cubriéndolas de la luz para evitar degradación de carotenos. • Extracción de carotenos Inmediatamente llegaron las muestras al laboratorio se picaron y luego se homogenizaron en el Ultraturrax (homogenizador). La extracción de los carotenoides se llevó a cabo con lavados sucesivos con solventes orgánicos (Éter de Petróleo y Acetona). Para más información ver anexo 1, donde se detalla el protocolo de extracción utilizado para la extracción y posterior cuantificación de carotenos totales y β-caroteno. • Cuantificación de carotenos totales por Espectrofotometría visible El contenido de carotenos totales se determinó utilizando la siguiente formula: Concentración en µg carotenos totales/g muestra = A450 x volumen final (ml) x 104 2592 x peso muestra (g) Donde: A450 = Absorbancia a 450 nanómetros. 104 = Constante de conversión de unidades µg/g. 2592 = Coeficiente de extinción molar de β-caroteno en éter de petróleo. • Análisis de β-caroteno por HPLC 29 La separación y cuantificación de los carotenos se hizo por HPLC, utilizando un equipo Hewllet Packard series 1050, con una columna YMC-C30, especial para separación de carotenoides, y detector ultravioleta-visible de arreglo de diodos. La detección se realizó por espectrofotometría visible leyendo la absorbancia a 450 nm. La identificación de βcaroteno se hizo teniendo en cuenta el tiempo de retención y el espectro visible comparados con un estándar comercial (Anexo 2). 5.3 Análisis de Información Expresión génica Los valores de expresión son medidas de fluorescencia emitidas en cada amplificación, y se toman del reporte del “DNA Engine Opticon® 2 System”. Con la finalidad de cuantificar los niveles de expresión de los genes de la ruta biosintética de β-caroteno se hizo una cuantificación relativa de la expresión de los genes blanco (GGPS, PDS, ZDS, CRTISO y LCY-β), empleando el método de curva estándar descrito por Livak en 1997 y posteriormente actualizado en 2001. En esta metodología, muestras de concentración conocida son usadas para construir una curva estándar que se emplea como referencia en la cuantificación de la expresión de los genes blanco. Se utilizó el gen de la subunidad ribosomal 18S como gen referencia para normalizar los valores. El gen referencia (18S) se define como una señal activa de amplificación para normalizar las diferencias en la cantidad de ADN copia adicionado a cada reacción. Los genes utilizados como referencia son genes de expresión basal, que en teoría son constantemente expresados en todas las células de todos los tejidos en una misma cantidad. La escala relativa de cuantificación se construyó dividiendo (normalizando) los valores de la fluorescencia de los genes blanco por el valor de la fluorescencia del gen referencia 30 5.3.2 Cuantificación de Carotenos A los datos de contenidos de carotenos totales y β-carotenos bajo un diseño completo al azar se les sometió a un análisis de varianza o “ANOVA” por sus siglas en inglés (analysis of variances); para determinar si las diferencias entre las comparaciones efectuadas fueron significativas desde el punto de vista estadístico con un nivel de significancia del 5% (<0.05). Aquellos análisis efectuados que arrojaron diferencias al nivel de significancia mencionado, se les aplicó la prueba de separación de medias o de rango múltiple denominada REGWQ, por las iniciales de Ryan, Einot, Gabriel, Welsch; buscando evidenciar agrupaciones de los datos para su posterior interpretación. Los análisis estadísticos se llevaron a cabo con el programa SAS, versión 9.1 (SAS Institute Inc., 2005). 31 6 RESULTADOS 6.1 Escogencia de las variedades Como se mencionó en la metodología, lo primero que se hizo fue seleccionar las variedades de acuerdo con los criterios mencionados en los materiales y métodos. Los resultados obtenidos en el sondeo ejecutado a las nueve variedades donde se les determinó el contenido de carotenos totales y β-carotenos en la raíz y el color de la misma se mostraron en la tabla 1. Destacando las variedades escogidas con negrilla ubicadas en la parte superior de la tabla. El color de las raíces de las variedades escogidas se muestra en la figura 8, donde se aprecia claramente las diferencias en la pigmentación de las raíces a los 6 meses de edad. Tabla 1 Sondeo de 9 variedades de yuca en plantas de 11 meses para la escogencia de las tres variedades para el estudio. Las variedades escogidas se ubican en las tres primeras filas y se resaltan en negrilla. Variedad MBRA 253 CM 2772-3 CM 3306-4 MBRA 337 MBRA 1251 MBRA 1087 MCOL 2279 MBRA1107 CM 523-7 Carotenos totales µg/g materia fresca 8.42 4.08 04 5.2 2.54 0.42 8.18 3.94 0.86 32 β-caroteno Color de la raíz 5.82 Amarilla 3.21 Crema 0.24 Blanca 4.3 Amarilla 1.94 Crema 0.25 Blanca 5.42 Amarilla 2.8 Crema 0.57 Blanca MBRA 253 CM 2772-3 CM 3306-4 Figura 8. Raíces de plantas de seis meses de edad de las variedades de yuca seleccionadas para el estudio. El color de la raíz está directamente relacionado con el contenido de β-caroteno, siendo la raíz amarilla (MBRA 253) la de más alto contenido de β-caroteno y la raíz blanca (CM 3306-4) la de menor contenido de β-caroteno y la crema (CM 2772-3) de contenido intermedio entre las dos. Cuantificación de la expresión génica por PCR en tiempo real: 6.2 Diseño de iniciadores: Se generaron iniciadores con base en los alineamientos descritos en los materiales y métodos (figura 9), los cuales fueron utilizados para la amplificación de los genes blanco por PCR en tiempo real. A continuación se listan un par de iniciadores para cada gen, directo identificado como “fw” por su nombre en inglés “forward” y reverso identificado como “rv” por su nombre en inglés “reverse”: • GGPS fw 5’-TGCGCTGTGGAAATGATTCATAC-3’ rv 5’-AGTGCGTCACCGGCGAGAA-3’ • PSY fw 5’-AGTTTGTGCTGAGTATGCCAAGAC-3’ rv 5’-CTACACCACACATAAATTGCCCA-3’ • PDS fw 5’-GCCATGTCAAAGGCACTTAACTT-3’ rv 5’-CTTTGAACCATGTTTCTCCTGCTGAAG-3’ • ZDS fw 5’-CAAAGAATGTGGGATCTTGTTGC-3’ rv 5’-AACATCTGGAGAACCCTTGAGCAT-3’ 33 • CRTISO fw 5’-TTCTATTCACATGGGTGTTAAAGC-3’ rv 5’-CTGGAGCCAAAGATGAATCAAG-3’ • LCY-b fw 5’-TTTGAGCTTCCTATGTATGACCC-3’ rv 5’- CTCATCAACCCAAACACCATAATT-3’ Figura 9. Alineamiento de secuencias del gen PDS de varias especies ubicadas a la izquierda en el programa AlignX, utilizado para el diseño de los iniciadores de los genes blanco. En color amarillo se resaltan las regiones más conservadas entre las especies, sitio donde se diseñaron los iniciadores. Las flechas verdes mostraron la ubicación de los iniciadores. El gen utilizado en el trabajo como gen referencia fue el gen de la unidad ribosomal 18S, de expresión basal en todas las células y tejidos. Las secuencias de los iniciadores empleados para la amplificación se diseñaron sobre la secuencia del gen de frijol y se listan a continuación: • 18S fw 5’-ATGATAACTCGACGGATCGC-3’ rv 5’-CTTGGATGTGGTAGCCGTTT-3’ 6.3 Extracción de ARN Se obtuvo ARN de muy buena calidad de ambos tejidos, hoja y raíz, con las metodologías propuestas para cada uno de los tejidos. En la figura 10 se exhibe una electroforesis en un gel de agarosa de ocho muestras de ARN extraído de hojas jóvenes, colectadas de plantas de 6 meses de edad; adicionalmente se presenta la información correspondiente a los valores de densidad óptica registradas por las lecturas de absorbancia a las longitudes de onda de 260 y 280 nanómetros (nm). En el gel se observa claramente que la integridad del 34 ARN está intacta y el índice de pureza A260/A280 se mantuvo dentro del rango referenciado en el manual del kit de Promega® utilizado para la extracción del ARN de hojas. Para determinar la cantidad de ARN total extraída en cada muestra se realizaron mediciones espectrofotométricas a 260 nanómetros (nm), donde una unidad de absorbancia (A260) es igual a 40 microgramos (µg) de ARN de cadena sencilla por mililitro. Con este calculo se establecieron las concentraciones en las que se encontraba cada uno de los ARN. 1 2 3 4 5 6 7 8 Densidad Optica A280 Muestra A260 1 0.51 0.22 2 0.45 0.20 3 0.18 0.08 4 0.23 0.11 5 0.59 0.26 6 0.27 0.13 7 0.54 0.25 8 0.29 0.14 A260 /A280 Concentración 2.27 2.25 2.11 2.19 2.29 2.06 2.16 1.99 ng 2044 1810.82 707.66 932 2340.84 1078.43 2152 1140.81 Figura 10. Electroforesis en gel de agarosa a una concentración de 1%, de muestras de ARN de hojas jóvenes de plantas de yuca de 6 meses de edad, extraídas con el kit de extracción de ARN “SV Total RNA Isolation system” de Promega®. En cada carril se cargó aproximadamente 1,5 µg de ARN. A la derecha se adjunta la información de la medición por absorbancia de la densidad óptica en cada muestra a las longitudes de onda de 260 y 280 nm; adicionalmente se incluyen el índice de pureza A260/A280 y el cálculo de la concentración de ARN en nanográmos (ng) por cada microlitro (µl). Luego de estar completamente seguro de la calidad del ARN habiéndolo revisado con los métodos anteriormente descritos, se procedió a conformar dos pooles por cada variedad, tejido y tiempo de colecta. Seguidamente se realizaron las digestiones de ADN con la enzima “DNase I Amp Grade” de Invitrogen®. Los resultados de la digestión del ADN contaminante en los pooles de ARN se corroboraron con la amplificación vía PCR del gen ribosomal 18S (figura 11); asumiendo que la no amplificación significa que no había presencia de ADN en el ARN, y por lo tanto los pooles estaban sin ADN listos para la síntesis de ADN copia por retrotranscripción. 35 /µl A1 A2 B1 B2 C1 C2 - ADN MP 100 pb Figura 11. Amplificación del gen constitutivo 18S vía PCR tomando como templado el ARN extraído de los tejidos de yuca; el tamaño de la secuencia amplificada del gen 18S es 165 pares de bases. Marcador de peso molecular (MP) “1KB plus DNA ladder de invitrogen®”. Si persiste la contaminación de ADN se espera una amplificación del gen como se observa en el control positivo de ADN de yuca identificado como ADN en el gel; de lo contrario no puede efectuarse la amplificación y se comprueba que el ARN está libre de ADN. 6.4 Síntesis de ADN copia En todos los eventos de retrotranscripción usando la transcriptasa reversa SuperScript™ III “First-Strand Synthesis System” para RT-PCR de Invitrogen®, se obtuvo ADN copia que a la postre permitió la amplificación vía PCR y posterior cuantificación de la expresión de los genes. Se realizaron diluciones de las muestras a una misma concentración (1:20) con el objetivo de amplificar una cantidad similar de templado inicial. 6.5 Amplificación de las muestras en PCR en tiempo real Se obtuvo amplificación cuantificable vía PCR en tiempo real en todos los genes blanco GGPS, PSY, PDS, ZDS, LCY-B (Figuras 12 y 13) con excepción del gen CRTISO, caroteno isomerasa, en el cual no se detectó señal de amplificación. El gen 18S utilizado 36 como referencia también mostró amplificación cuantificable, por lo que se pudo utilizar como normalizador en la cuantificación relativa de la expresión de los genes blanco. Cada uno de los genes los genes presentaron una única curva de denaturación o “melting”, indicando especificidad en el producto amplificado, lo que asegura un buen nivel de confiabilidad en los datos de cuantificación. En las Figuras 12 y 13 se ilustran ejemplos de las curvas de amplificación y “melting” para los genes evaluados. A B Figura 12. A. Diagrama de amplificación de los genes 18S en rojo (gen referencia o control), PSY ® ® en verde y ZDS en azul, detectada por florescencia emitida por la marca Brilliant SYBR Green (Stratagene) durante el curso de la reacción de PCR en un termiciclador DNA Engine Opticon® 2 System (MJ Research). B. Con los mismos colores se muestra la respectiva curva de denaturación térmica o curva de Melting de cada uno de los genes; se aprecia un solo pico por lo que se infiere que hubo amplificación de un solo producto especifico. A B Figura 13. A. Diagrama de amplificación de los genes blanco PDS en rojo, LCY-β en verde y GGPS en azul, detectada por florescencia emitida por la marca Brilliant®SYBR® Green (Stratagene) durante el curso de la reacción de PCR en un termiciclador DNA Engine Opticon® 2 System (MJ Research). Con los mismos colores se muestra la respectiva curva de denaturación térmica o curva de Melting de cada uno de los genes. B. Se aprecia un solo pico por lo que se infiere que hubo amplificación de un solo producto específico. 37 A pesar de intentar varias veces la amplificación del gen CRTISO, no pudo ser cuantificado debido a que no hubo amplificación en las muestras de ADN copia. Se intentó amplificar el gen disminuyendo la temperatura de anillaje de los iniciadores, buscando disminuir la astringencia del la reacción de PCR. Sin embargo no se obtuvo ninguna señal amplificable. Para facilitar la identificación de las tres variedades se utilizó una nomenclatura donde la variedad MBRA 253 de raíz color amarilla se le nombró “A”; la variedad CM2772-3 de raíz color crema se le llamó “C” y la variedad CM3306-4 de raíz color blanca se le llamó “B”. Cuantificación con la marca Fluorescente SYBR® Green: Se elaboraron promedios de los dos pools, cada uno (con una replica técnica) de ADN copia que representan cinco individuos de cada variedad por tiempo de colecta, y se representaron en histogramas situando juntas las barras representativas de la expresión de cada gen en hojas y raíces por cada variedad. Por lo tanto para cada gen se elaboró una gráfica que resume su expresión en cada variedad, tiempo de colecta y tejido (hoja o raíz) con su respectiva desviación estándar. La escala en la que se valoraron los resultados de expresión de genes es una escala relativa, la cual es perfectamente útil para establecer comparaciones entre las muestras sometidas a las cuantificaciones efectuadas, por lo tanto no constituye de ninguna manera una escala con valores reales. Como se mencionó anteriormente la cuantificación se llevó a cabo siguiendo los lineamientos descritos por Livak en el 2001 para la cuantificación relativa de expresión génica por el método de curva estándar. En las figuras 14 a 18 se resume el análisis de expresión efectuado a genes que codifican enzimas que participan en la síntesis de los carotenos en yuca, con la marca fluorescente SYBR® Green. 38 Abundancia relativa [ADNc/18S] Expresion realtiva del gen MeGGPS en plantas de yuca de 3 y 6 m eses 1.200 1.000 0.800 HOJAS 0.600 RAICES 0.400 0.200 0.000 3A 3C 3B 6A 6C 6B Figura 14. Análisis de expresión por PCR en tiempo real del gen MeGGPS en hojas y raíces de 3 variedades de yuca (A = Amarilla, C = Crema y B = Blanca) a los tres y seis meses de edad de la planta, usando la marca fluorescente SYBR® Green. Cada barra representa el promedio de dos pooles generados a partir de cinco individuos de cada variedad (A, B o C) y tiempo de colecta (3 y 6 meses) . En la expresión del gen MeGGPS la muestra de la variedad A, a los 6 meses presentó una baja expresión en relación con las muestras de las otras dos variedades en el mismo tiempo (figura 14). La expresión de este mismo gen en hojas fue homogénea exceptuando la muestra de la variedad blanca a los 3 meses de edad de la planta. Las expresiones observadas del gen MePSY fueron muy homogéneas entre los tejidos. En raíz las muestras de la variedad C mostraron una ligera diferencia con respecto a las otras dos variedades (figura 15) En el gen MePDS se invierte el patrón de expresión observado en los demás gráficos de expresión de los genes; el nivel de expresión de hojas y raíces se invierte observándose una expresión mayor en las raíces que en las hojas. (figura 16). 39 Abundancia relativa [ADNc/18S] Expresion relativa del gen MePSY en plantas de Yuca 3 y 6 m eses 2.000 1.800 1.600 1.400 1.200 1.000 0.800 0.600 0.400 0.200 0.000 HOJAS RAICES 3A 3C 3B 6A 6C 6B Figura 15 Análisis de expresión por PCR en tiempo real del gen MePSY en hojas y raíces de 3 variedades de yuca (A = Amarilla, C = Crema y B = Blanca) a los tres y seis meses de edad de la planta, usando la marca fluorescente SYBR® Green. Cada barra representa el promedio de dos pools generados a partir de cinco individuos de cada variedad (A, B o C) y tiempo de colecta (3 y 6 meses) . En los valores de expresión del gen MeZDS y MeLCYB (Figuras 17 y 18) se observa que la escala de valores sube con respecto a los otros genes. Los mayores valores de expresión se alcanzan en las hojas de MeZDS de plantas de 3 meses de edad (figura 17). Abundancia relativa [ADNc/18S] Expresion relativa del gen MePDS en plantas de Yuca de 3 y 6 m eses 1.600 1.400 1.200 1.000 0.800 0.600 0.400 0.200 0.000 HOJAS RAICES 3A 3C 3B 6A 6C 6B Figura 16. Análisis de expresión por PCR en tiempo real del gen MePDS en hojas y raíces de 3 variedades de yuca (A = Amarilla, C = Crema y B = Blanca) a los tres y seis meses de edad de la planta, usando la marca fluorescente SYBR® Green. Cada barra representa el promedio de dos pools generados a partir de cinco individuos de cada variedad (A, B o C) y tiempo de colecta (3 y 6 meses) . 40 Abundancia relativa [ADN/18S] Expresion del gen MeZDS en plantas de Yuca a 3 y 6 m eses 8.000 7.000 6.000 5.000 4.000 3.000 2.000 1.000 0.000 HOJAS RAICES 3A 3C 3B 6A 6C 6B Figura 17. Análisis de expresión por PCR en tiempo real del gen MeZDS en hojas y raíces de 3 variedades de yuca (A = Amarilla, C = Crema y B = Blanca) a los tres y seis meses de edad de la planta, usando la marca fluorescente SYBR® Green. Cada barra representa el promedio de dos pooles generados a partir de cinco individuos de cada variedad (A, B o C) y tiempo de colecta (3 y 6 meses). A excepción del gen PDS (figura 16), las expresiones de los genes siempre alcanzaron niveles superiores en las hojas con respecto a los encontrados en las raíces. Los datos se movieron en el rango de 0.032 encontrado en la muestra de ARN extraído de hojas de la variedad blanca a 6 meses de edad, hasta 6,28, encontrado en la muestra de hojas de la variedad blanca a tres meses de edad de la planta. Como se mencionó anteriormente las unidades son relativas y no corresponden una medida real, sin embargo son útiles para establecer relaciones comparativas entre las muestras analizadas. La escala relativa de cuantificación es generada a partir de la normalización del gen blanco (MeGGPS, MePSY, MePDS, MeZDS y MeLCYb) con el gen constitutivo ribosomal 18S utilizado como referencia. La tabla total de datos obtenidos en la cuantificación con SYBR® Green, así como los valores que se obtuvieron luego de la normalización con el gen 18S se citan en el anexo 4. 41 Abundancia relativa [ADNc/18S] Expresion relativa del gen MeLCYB plantas de Yuca de 3 y 6 m eses 6.000 5.000 4.000 3.000 HOJAS 2.000 RAICES 1.000 0.000 3A 3C 3B 6A 6C 6B Figura 18. Análisis de expresión por PCR en tiempo real del gen MePDS en hojas y raíces de 3 variedades de yuca (A = Amarilla, C = Crema y B = Blanca) a los tres y seis meses de edad de la planta, usando la marca fluorescente SYBR® Green. Cada barra representa el promedio de dos pooles generados a partir de cinco individuos de cada variedad (A, B o C) y tiempo de colecta (3 y 6 meses). Confirmación de la expresión génica detectada por SYBR® Green con la metodología TaqMan®: Tres genes (MePSY, MePDS y MeZDS) fueron cuantificados en el laboratorio del doctor Peter Beyer en la Universidad de Freiburg, Alemania, usando la tecnología TaqMan®, la cual combina la acción de los iniciadores convencionales utilizados en una amplificación por PCR convencional, con una sonda que se une a la región flanqueada por los iniciadores por complementariedad de bases, que porta la marca fluorescente que permite la cuantificación de la amplificación de la secuencia blanco. Se elaboraron promedios de las amplificaciones de ADN copia que representan 5 individuos de cada variedad por tiempo de colecta, y se representaron en histogramas situando juntas las barras representativas de la expresión de cada gen en hojas y raíces por cada variedad. Por lo tanto para cada gen se elaboró una gráfica que resume su expresión en cada variedad, tiempo de colecta y tejido (hoja o raíz) con su respectiva desviación estándar. Adicionalmente a las muestras procesadas por SYBR® Green, se incluyeron las muestras de una colecta más, de plantas de 8 meses de edad. 42 Al igual que en la cuantificación efectuada con la marca SYBR® Green se manejo una escala relativa, elaborada de la misma manera. La cuantificación se llevó a cabo siguiendo los lineamientos descritos por Livak en el 2001 para la cuantificación relativa de expresión génica por el método de curva estándar. En las figuras 19 a 22 se resume el análisis de expresión efectuado a los genes MePSY, MePDS y MeZDS de síntesis de carotenos con la marca fluorescente TaqMan®. Abundancia relativa [ADNc/18A] Expresion relativa del gen MePSY en plantas de yuca de 3, 6 y 8 meses (TaqMan) 40 35 30 25 20 15 10 5 0 HOJAS RAICES 3A 3C 3B 6A 6C 6B 8A 8C 8B Figura 19. Análisis de expresión por PCR en tiempo real del gen MePSY en hojas y raíces de 3 variedades de yuca (A = Amarilla, C = Crema y B = Blanca) a los tres, seis y ocho meses de edad de la planta, con la marca fluorescente TaqMan®. Cada barra representa el promedio cinco individuos procesados de cada variedad a cada tiempo de colecta. La diferencia más notoria entre las expresiones de hojas y raíces de un mismo gen se encuentra en el gen MePSY (figura 19 y figura 22). En los otros dos genes cuantificados (MePDS y MeZDS ,figuras 20 y 21) la diferencia no es tan fuerte como la observada en el gen MePSY. 43 Abundancia relativa [ADNc/18S] Expresion relativa del gen MePDS en plantas de yuca de 3, 6 y 8 meses (TaqMan) 3.5 3 2.5 2 HOJAS 1.5 RAICES 1 0.5 0 3A 3C 3B 6A 6C 6B 8A 8C 8B Figura 20. Análisis de expresión por PCR en tiempo real del gen MePDS en hojas y raíces de 3 variedades de yuca (A = Amarilla, C = Crema y B = Blanca) a los tres, seis y ocho meses de edad de la planta, con la marca fluorescente TaqMan®. Cada barra representa el promedio cinco individuos procesados de cada variedad a cada tiempo de colecta. En el gen MePDS se invierte el patrón de expresión observado en los genes MePSY y MeZDS; el nivel de expresión de hojas y raíces se invierte observándose una expresión mayor en las raíces que en las hojas (figura 20). Abundancia relativa [ADN/18S] Expresion relativa del gen MeZDS en plantas de yuca de 3, 6 y 8 meses (TaqMan) 8 7 6 5 4 3 2 1 0 HOJAS RAICES 3A 3C 3B 6A 6C 6B 8A 8C 8B Figura 21. Análisis de expresión por PCR en tiempo real del gen MeZDS en hojas y raíces de 3 variedades de yuca (A = Amarilla, C = Crema y B = Blanca) a los tres, seis y ocho meses de edad de la planta, con la marca fluorescente TaqMan®. Cada barra representa el promedio cinco individuos procesados de cada variedad a cada tiempo de colecta. La escala de valores subió con respecto a los otros dos genes en la expresión de MeZDS. Los mayores valores de expresión se alcanzan en las hojas de MeZDS de plantas de 3 44 meses de edad (figura 21). Resultados similares se encontraron en la cuantificación con SYBR® Green del mismo gen (figura 17). En la figura 22, se aprecia la expresión de cada gen comparando raíz contra hoja. No se discrimina por tiempo de colecta ni por variedad. La expresión más elevada se notó en las hojas del gen MePSY. La cuantificación de la expresión génica con TaqMan® fue similar a los resultados que se encontraron con SYBR® Green. Con excepción de la diferencia presentada entre hojas y raíces del gen MePSY. Abundancia relativa [ADNc/18S] Expresión relativa de genes de la ruta de carotenos Hoja Vs. Raíz en yuca 27 24 21 18 15 12 9 6 3 0 Hojas Raices PSY PDS ZDS Figura 22. Expresión de los genes PSY, PDS y ZDS en hoja y raíz en plantas de yuca. Cada barra representa el promedio de 15 muestras colectadas a lo largo de 3, 6 y 8 meses de edad de la planta. 6.6 Cuantificación de carotenos totales y β-caroteno: Al igual que en la cuantificación de expresión de los genes, las variedades fueron denominadas A, B y C, por las iniciales del color de su raíz A amarilla, B blanca y C crema. En las gráficas las barras representan el promedio de datos de tres individuos procesados individualmente para cada variedad (A, B o C) y punto de colecta (3 o 6 meses), con su respectivo valor de error estándar. Todos los cálculos estadísticos efectuados se encuentran citados en el anexo 5. 45 El resultado de la cuantificación del contenido de carotenos totales y β-carotenos en las hojas jóvenes de 3 y 6 meses de edad se mostraron en la figura 23, donde se combinan los valores tanto de carotenos totales, en verde, como el contenido de β-caroteno, en naranja en una sola barra para cada muestra. Los valores más altos se detectaron en la variedad crema (C), pero en general, los datos fueron homogéneos tanto en el contenido de carotenos totales como en β-caroteno. Carotenos totales y B-caroteno en hojas de 3 y 6 m eses de edad en tres variedades de Yuca [ug/g] Materia Fresca 1200 1000 800 carotenos totales 600 b-caroteno 400 200 0 3M A 3M C 3M B 6M A 6M C 6M B Figura 23. Contenido de carotenos totales y β-caroteno en hojas jóvenes de 3 variedades de yuca con distintos contenidos de carotenos en la raíz a tres y seis meses de edad (3M y 6 M) de la planta. Variedades: MBRA 253 (A), CM2772-3 (C) y CM3306-4 (B). Los resultados de las cuantificaciones de carotenos totales y β-caroteno de las muestras de las raíces se mostran en la figura 24; donde al igual que en los resultados de las hojas se integran en una sola barra los valores de cada variedad en un tiempo de colecta específico, siendo el color amarillo el valor para carotenos totales y el color rojo para β-caroteno. La variedad amarilla (A) siempre mostró los mayores contenidos de carotenos totales y βcaroteno, seguido por la variedad crema (C) y por último la variedad blanca (B) (figura 24). También se observa, un aumento en el contenido de carotenos totales y β-carotenos en las comparando las muestras de 3 meses y 6 meses para las variedades A y C; con la variedad B no sucedió lo mismo. 46 [ug/g] Materia Fresca Carotenos totales y B-caroteno en raices de 3 y 6 m eses de edad en tres variedades de Yuca 10 8 6 carotenos totales 4 B-caroteno 2 0 3M A 3M C 3M B 6M A 6M C 6M B Figura. 24 Contenido de carotenos totales y β-caroteno en raíces de 3 variedades de yuca a tres y seis meses de edad (3M y 6 M) de la planta. Variedades: MBRA 253 (A), CM2772-3 (C) y CM3306-4 (B). Adicionalmente se presenta una gráfica en términos porcentuales, en la que se muestra la proporción del β-caroteno con relación al contenido de carotenos totales detectados, el cual representan el 100% en la barra (figura 25). Porcentaje de B-caroteno en raíces con respecto a Carotenos totales 100% 80% 60% Carotenos totales 40% B-caroteno 20% 0% 3M A 3M C 3M B 6M A 6M C 6M B Figura 25. Contenido de β-caroteno en porcentaje siendo el contenido de carotenos totales el 100% en raíces de 3 variedades de yuca a tres y seis meses de edad (3M y 6 M) de la planta. Variedades: MBRA 253 (A), CM2772-3 (C) y CM3306-4 (B). La gráfica de porcentaje de β-caroteno con respecto a carotenos totales sugiere que la variedad amarilla aportaría la menor cantidad al total de carotenos, con respecto a las otras dos variedades, representando sólo el 12, 7 % del total en raíces de plantas de 3 meses y el 47 47% por ciento en plantas de 6 meses. Sin embargo esta observación tendrá que ser confirmada estadísticamente luego El mayor porcentaje de β-caroteno con respecto al total se presentó aparentemente en la muestra de raíz de la variedad crema a los 6 meses. Mientras que la mínima proporción de β-caroteno la mostró la muestra A a los 3 meses de edad de la planta. 48 7 DISCUSIÓN 7.1 Selección de las variedades Lo que más sobresale de los datos obtenidos en este sondeo es la alta variabilidad que presentan las variedades de yuca en cuanto al contenido de carotenos totales y β-carotenos en la raíz, lo que se traduce, en términos nutricionales, en aporte concreto de pro vitamina A de cada variedad al consumidor. Sin embargo, en el caso de las yucas con raíces amarillas, que son las que presentas contenidos más altos de β-caroteno se trata variedades no comerciales que no han sido sometidas a procesos de selección para mejorar sus condiciones de producción y su comportamiento en campo. La anterior situación se vio reflejado en el experimento en campo, puesto que las variedades CM2772-3 y CM3306-4, a las que se identificará como variedad Crema (C) y Blanca (B) respectivamente, presentaron un mejor comportamiento en campo comparativamente que la variedad MBRA 253, la cual se identificará como Amarilla (A), en términos de resistencia a plagas, vigorosidad y llenado de la raíz. Siempre las raíces de las variedades Crema y Blanca fueron más grandes que las de la variedad amarilla. 7.2 Cuantificación de carotenos totales y β-caroteno: Los datos obtenidos concernientes al contenido de β-caroteno y carotenos totales en las tres variedades resultaron satisfactorios en términos de consistencia en repeticiones biológicas efectuadas, que se tradujo en un error estándar moderado para los promedios, el cual permitió evidenciar diferencias entre las variedades. Las diferencias en la escala de valores de las mediciones de contenido de carotenos en hojas y raíces, no permitieron hacer comparaciones directas, dado que estas diferencias podrían ser del orden de 102. Por ejemplo, mientras que en la hoja se detectaron en 49 promedio 88,85 µg/g de β-caroteno, en la raíz de se detectó 0,862 µg/g. Por consiguiente los datos se analizaron independientemente para hojas y raíces. Análisis de varianza: El análisis de varianza, con un nivel de significancia del 5%, permitió establecer cinco grandes diferencias en el contenido de carotenos totales o de β-carotenos: 1. Entre variedades en el contenido de β-caroteno en las hojas. 2. Entre variedades en el contenido de β-caroteno en las raíces. 3. En la acumulación de β-caroteno en la raíz a través del tiempo 4. Entre variedades en el contenido total de carotenos en las hojas. 5. Entre variedades en el contenido de carotenos totales en las raíces. Para los casos 1 y 4, al realizar el análisis de separación de medias REGWQ, se agruparon de la misma manera ambos conjuntos de datos, encontrando un grupo representado por la variedad C, con los valores más altos, y otro grupo con las variedades A y B (anexo 5 casos 1 y 4). Al parecer las hojas mantienen niveles constantes de carotenos, independientemente del tiempo, con algunas diferencias varietales. Esto es explicable si se piensa en el papel fundamental de los carotenoides en el proceso de fotosíntesis en la hoja; donde principalmente cumplen dos funciones: una participando como pigmentos accesorios en el complejo antena, capturando radiación solar y transfiriéndola a los centros de reacción, y también actúan como atenuadores de los estados de excitación de las clorofilas que se generan durante la fotosíntesis. En este proceso el exceso de energía se disipa en forma de calor (Taylor & Ramsay, 2005). Si se agrupan los casos 2 y 3, concernientes a los valores de β-caroteno de raíz, se encontró que las tres variedades son diferentes, y que también existen diferencias en la acumulación de β-caroteno en el tiempo. Se presentó más acumulación de β-caroteno a los 6 meses que a los 3 meses, independientemente de la variedad (anexo 5, casos 2 y 3; figura 24 ). Sin embargo, el tiempo afecta diferentemente el contenido de β-caroteno en cada variedad, 50 aumentando las diferencias entre ellas. Sí existen diferencias a los tres meses, éstas se pronuncian más a los seis meses. El análisis de separación de medias encontró tres grupos estadísticamente diferentes con respecto a los casos 2 y 3, siendo la variedad A la de mayor contenido de β-caroteno (promedio de 1,489 µg/g materia fresca), seguida por la C (0,79 µg/g) y por último la B (0,307 µg/g) (figura 24). Estos resultados mostraron concordancia con los patrones vistos en el sondeo de selección de las variedades (tabla 1), confirmando que el color de la raíz es un indicador confiable del contenido de carotenos. Esta conclusión se encuentra en concordancia con estudios previos (Iglesias et al, 1997; Chavez et al, 2000; Boiteux & Carvallo, 2001). En términos de porcentaje de β-caroteno con respecto al total de carotenos, la variedad amarilla es la de menor proporción de β-caroteno de las tres variedades (figura 25). No obstante la variedad amarilla es la que mayor contenido de carotenos totales y β-caroteno acumula, por lo tanto en términos nutricionales la variedad amarilla es la que proporciona mayor cantidad neta de pro vitamina A al consumidor. No obstante, hay que precisar que aunque la variedad amarilla presenta el nivel más alto de carotenos, los niveles de aporte de provitamina A al consumidor continúan siendo muy bajos. Así, si seis microgramos de βcaroteno son convertidos en un microgramo de equivalentes de retinol (ER), y si la ingesta diaria recomendada para un niño es 400 ER (Mclaren & Frigg, 2002), el consumo de aproximadamente 1000 g diarios de yuca amarilla de seis meses de edad le proveería el requerimiento mínimo diario. Consumir un kilo de yuca diario no es plausible para un niño, por lo que sería necesario incrementar el contenido de β-caroteno al menos cuatro veces. En el caso 5 se observaron diferencias significativas en el contenido de carotenos totales en las raíces de las variedades analizadas. Como en el caso 2, referente a los contenidos de βcaroteno, la separación de medias indicó que la variedad A contiene más carotenos totales que la C, la cual a su vez tiene más que la B. No sucedió lo mismo cuando se compararon los contenidos de caroteno total en los dos tiempos de colecta. Estos hallazgos indicarían que la única fuente de variación para el contenido de carotenos totales son las variedades, y 51 que entre los 3 y 6 meses la diferencia radica en el contenido de β-caroteno. Una redistribución del contenido de β-caroteno en el tiempo indica una redistribución en el aporte de cada caroteno a los carotenos totales (figura 25 ). Según datos vistos en sondeo de plantas de 11 meses (tabla 1), la variedad A a los 6 meses de edad ya ha acumulado el 60 % de los carotenos totales que posee a los 11 meses. La Crema ha acumulado el 37% y la blanca parece haber llegado a su limite de acumulación (figura 24). 7.3 Cuantificación de la expresión de los genes de la ruta biosintética: Una de las principales observaciones de éste trabajo es que no se encontraron diferencias significativas en los niveles de expresión de los genes entre las tres variedades. Varios investigadores han logrado asociar el contenido de carotenos con la abundancia del ARN mensajero de los principales genes de la ruta biosintética. Por ejemplo, en la maduración de diferentes variedades de cítricos se pudo establecer que la acumulación de carotenos estaba fuertemente regulada por la coordinación en la expresión de los genes (Kato et al, 2004). En otro estudio de características similares, cuando se investigó el motivo de la diferencia en la acumulación de carotenos en variedades de papa con contenidos de carotenos contrastantes, se establecieron diferencias significativas en los perfiles de abundancia de ARN mensajero de los genes de la ruta biosintética, sugiriendo que el control transcripcional da lugar a grandes diferencias en contenido de carotenos. De hecho, se pudo establecer una relación inversa entre el nivel de trascrito del gen Zeaxantina epoxidasa y el contenido de carotenos en el tubérculo de la papa (Morris et al, 2004) . En contraposición con los dos trabajos anteriores en papa y cítricos, los resultados obtenidos en análisis de variedades de yuca no mostraron concordancia entre el contenido de carotenos en la raíz y los niveles de ARN mensajero de los genes de la ruta biosintética analizados. Para futuros estudios, y teniendo en cuenta los hallazgos de Morris et al en 52 2004, se sugiere incluir en el análisis genes como Zeaxantina espoxidasa, que convierten el -caroteno en otras moléculas como Xantófilas. La mayoría de los estudios que reportan una relación directa entre los niveles de ARN mensajero y la acumulación de carotenos en un órgano especifico, están relacionados con eventos de modificación genética. En éstos se ha manipulado la ruta biosintética original, insertando secuencias nuevas como promotores específicos o genes de otras especies (plantas o bacterias), que a la postre incrementan ostensible y lógicamente la producción y acumulación de carotenos (Fraser et al, 2002; Shewmaker et al, 1999; Decreux et al, 2004). Por consiguiente, al comparar los niveles de expresión de los genes manipulados de una de estas plantas modificadas genéticamente con la variedad silvestre, las diferencias saltan a la vista. Por el contrario el estudio en yuca se basó en un sistema sin manipulación genética, tomando plantas de tres variedades de yuca que conservan los patrones de expresión génica y la ruta metabólica originales. La comparación global de la expresión de los genes MePSY, MePDS, MeZDS con ambas metodologías (SYBR® Green y TaqMan®; figura 22), sin discriminar por variedades ni tiempos de colecta, evidenció el bajo nivel de trascrito del gen MePSY en la raíz con respecto a la hoja. Para los otros dos genes los niveles fueron homogéneos. El gen PSY ha sido reportado repetidamente como punto regulatorio y clave de la ruta biosintética (Cunningham, 2002; Fraser & Bramley, 2004; Taylor & Ramsay, 2005; Sandmann, 2001). Por este motivo ha sido blanco frecuente en trabajos de manipulación genética en plantas de interés alimentario, a las cuales se les ha querido aumentar la producción de carotenos en órganos específicos (Ye, et al 2000; Fraser et al, 2002; Lindgren et al, 2003). Si las hojas de yuca son tejidos productores de carotenos por excelencia, y si se relaciona esta producción con el nivel de trascrito del gen MePSY, se asumiría que una ruta de biosíntesis de carotenos muy activa poseería altos niveles de trascripción del gen PSY. Esta observación, unida a los resultados de manipulación genética de cultivos ya mencionados, 53 sugeriría que uno de los genes llamados a manipulación para incrementar el contenido de carotenos en la raíz de yuca debería ser el PSY. Obviamente, no se pueden excluir con este estudio otros genes cuya influencia en la producción y acumulación de carotenos sea igualmente importante y desconocida en yuca. El gen GGPS codifica la síntesis de la enzima GGPP responsable de la conversión de lPP y DAMPP en Geranilgeranil pirofosfato. El IPP y DAMPP son los precursores de la vía de los carotenoides y otros compuestos isoprenoides. Esta enzima juega un papel importante al determinar la cantidad de GGPP disponible para empezar la ruta de síntesis de carotenos. En la figura 14 se resume la expresión de este gen encontrada en hojas y raíces de las tres variedades estudiadas. No se encontraron expresiones diferenciales de este gen en concordancia con el contenido de β-caroteno, ni de carotenos totales. Incluso se presentó una disminución en la muestra de raíz amarilla de 6 meses con respecto a la de 3 meses, y a su vez menor expresión con respecto a las otras dos variedades (C y B) de 6 meses. Estas observaciones apuntan a que posiblemente la deferencia en contenido de carotenos no se deba a la expresión, baja o alta, del GGPS. Especulativamente, es posible que el bajo nivel de trascrito en la variedad amarilla a los seis meses tenga que ver con regulación negativa por alto contenido de carotenos. La expresión del gen MePDS en las raíces fue más alta que en las hojas para todas la variedades (figuras 16 y 20 ). Esta tendencia fue detectada con ambas metodologías (SYBR® Green y TaqMan®). Los genes PDS y ZDS codifican para las enzimas Fitoeno desaturasa y ζ caroteno desaturasa, encargadas de la desaturación del fitoeno sintetizado por PSY, generando el intermediario prolicopeno (Taylor & Ramsay, 2005). La enzima ZDS es vital en la síntesis de licopeno y su función en la ruta está muy ligada a la de PDS, cumpliendo ambas el papel de la desaturación de fitoeno para el paso a licopeno, ambas reacciones ejecutadas por la enzima crtI en bacterias (Shaub et al, 2005), la cual es frecuentemente utilizada en transformación genética de plantas. El mal funcionamiento de la enzima Fitoeno desaturasa resulta en la acumulación de fitoeno, bloqueando el flujo de la ruta biosintética de carotenos (Fraser y Bramley 2004). Por lo tanto, el hecho de que se detecten niveles altos de trascrito de MePDS (figura 23) en las raíces en comparación con 54 las hojas puede ser una indicativo que este paso no es limitante para la síntesis de carotenos en las raíces. La enzima Lycopeno beta cyclasa, codificada por el gen LCYB, es considerada un paso regulador de la vía al ser punto de ramificación. Aquí el flujo de la vía puede tomar hacia la síntesis de α- o β-caroteno (Fraser & Bramley, 2004). En el caso yuca, los niveles de expresión de LCYB en la raíz, determinados solamente con SYBR® Green, y comparados con el contenido de β-caroteno en el mismo órgano, no indicaron una relación directa. De otro lado, si la comparación se hubiera hecho con el porcentaje de β-caroteno acumulado, habría relación directa (figura 18, figura 25); de esta manera, y de forma especulativa, se podría inferir que la cantidad proporcional de producción de β-caroteno en cada variedad estría asociada a la expresión de MeLCYB. A pesar que se observaron cambios visibles en la expresión de algunos genes, las relaciones que se hicieron siempre tendieron a buscar la concordancia entre la expresión génica con el patrón de acumulación de carotenos, y con el color de las raíces. Es poco probable que en una ruta ramificada como la de la formación de los carotenoides, el control esté en manos de un solo mecanismo regulatorio, por ejemplo, regulación transcripcional; es más probable que existan varios puntos de control en cada ramificación, que involucren eventos transcripcionales y postranscripcionales (Welsch et al, 2001). 7.4 Comentarios sobre metodología La discrepancia más notoria de los resultados obtenidos con SYBR® Green y TaqMan® se encontró en el gen MePSY (Figuras 15 y 19), la cual se evidenció en la diferencia entre los niveles de expresión de hoja con respecto a los de raíz. Mientras que en la cuantificación realizada con TaqMan® en promedio se detectó una diferencia de 18 veces más en la hoja que en la raíz, con SYBR® Green se detectó solamente una diferencia 3 veces más en la hoja que en la raíz. 55 Para implicaciones netamente metodológicas, es importante que las dos técnicas utilizadas (para analizar expresión génica) apunten en una misma dirección, pues sugiere que ambas metodologías son efectivas, con diferente precisión, lo cual reduce el error. Aunque es complicado encontrar la razón exacta de la diferencia en la expresión del gen de MePSY con las dos metodologías utilizadas, es evidente que las sondas TaqMan® son más precisas en la cuantificación de la expresión génica. También es pertinente mencionar que aunque los iniciadores utilizados en ambos procesos fueron diseñados sobre la misma secuencia, no se trata del mismo par de iniciadores. La sensibilidad de los iniciadores puede ser un factor que influyó en la diferencia observada, y en la eficiencia de amplificación. Además, la diferencia no pudo estar en el ARN por que se utilizó el mismo para ambas pruebas, ni tampoco en la síntesis de ADN complementario por que las diferencias se hubieran notado en los otros dos genes evaluados (MePDS y MeZDS). La cuantificación con las pruebas TaqMan® es mucho más precisa al emitir fluorescencia estrictamente cuando se amplifica la secuencia blanco. El SYBR® Green se adhiere al ADN de doble cadena emitiendo fluorescencia cuando hay amplificación indistintamente si se amplifica el producto blanco o si se amplifica un producto inespecífico. SYBR® Green no es tan efectivo para identificar diferencias en la cuantificación de genes de baja expresión, como se puede ver en las figuras 17 y 21 de expresión del gen MeZDS cuantificado con SYBR® Green y TaqMan® respectivamente. En la variedad blanca de plantas de 6 meses de edad, donde se encontró un bajo nivel de expresión del gen, se notó que SYBR® Green (figura 17) no pudo diferenciar la expresión de hoja con respecto a la de raíz. Por el contrario, en la detección con TaqMan®, se evidenció un incremento de al menos el doble en hoja. También para detectar expresión diferencial de un gen especifico el SYBR® Green puede presentar problemas, debido a que esta marca fluorescente también cuantifica el ruido ocasionado por cualquier ADN de doble cadena presente en la amplificación, por ejemplo, el generado por dímeros de iniciadores. 56 Se debe tener en cuenta que el PCR en tiempo real solamente cuantifica los niveles de ARN mensajero (ARNm). Una cuantificación precisa de los niveles de ARNm no le dice al investigador nada acerca de los niveles de traducción o la estabilidad del ARNm. Los niveles de ARN pueden no reflejar los niveles de proteína producidos por la célula y gran cantidad de la regulación ocurre en el estado postranscripcional e incluso postraduccional. PCR en tiempo real no brinda información acerca de la actividad de la proteína, o acerca de cualquier posible mutación que puede haber ocurrido en el gen de interés. En conclusión un análisis de expresión genética completo requiere información adicional, especialmente la que deriva de ensayos inmuno-histoquímicos y bioquímicos (Bustin, 2002). 57 8 CONCLUSIONES: • Existe una relación directa entre la coloración de la raíz y los patrones bioquímicos de carotenos en la misma; sin embargo esta relación no se mantuvo a nivel molecular con la expresión de los genes estudiados. • El bajo nivel de trascrito de MePSY en la raíz, comparado con la hoja, más los diversos reportes que postulan este gen como el punto regulador en la síntesis de carotenos, apuntan a este gen como el gen blanco en estudios de manipulación genética. • Los genes MeGGPS, MePSY, MePZDS y MeLCYB presentaron una expresión mayor en hoja que en raíces. En el gen MePDS se observó lo contrario. • Existen diferencias estadísticamente significativas en el contenido de carotenos y βcaroteno en la raíz de las variedades MBRA 253 (A), CM2772-3 (C) y CM3306-4 (B); en las hojas no se conserva el mismo patrón. La yuca presenta alta variabilidad fenotípica y bioquímica en el contenido de carotenos en la raíz. • La hoja acumula mucho más carotenos que la raíz. La relación es aproximadamente 100 a 1 en la variedad amarilla que es la que acumula mayor cantidad de carotenos en la raíz. • La variedad de raíz amarilla (MBRA 253) presentó la mayor cantidad de acumulación de β-caroteno en la raíz entre las variedades estudiadas. No obstante el aporte porcentual de este compuesto a los carotenos totales fue el más bajo de las variedades estudiadas. • Se encontró una tendencia en la relación entre la expresión del gen LCYB y el porcentaje de β-caroteno con respecto a carotenos totales. 58 9 RECOMENDACIONES A pesar que se han hecho reportes sobre la regulación de la ruta biosintética de carotenos en plantas, los mecanismos empleados por éstas para determinar qué carotenoides, y en qué cantidad, son acumulados en cada tejido específico, son todavía fuente de estudio. Al parecer los mecanismos de regulación de la producción y de la acumulación de carotenos son específicos para cada tejido, y en algunos casos para cada planta; esto explica por qué frecuentemente los eventos regulatorios encontrados en un órgano específico de una planta determinada no se pueden confirmar en otra. Teniendo en cuenta los resultados obtenidos en este estudio concernientes a los patrones de expresión génica de los genes estudiados en las raíces de yuca, se proponen otros niveles de estudio que potencialmente estén influyendo, bien sea en la producción o en la acumulación de carotenos en las raíces de la yuca. Las perspectivas apuntan a regulaciones postranscripcionales como la regulación del nivel proteico, degradación de carotenos o el almacenaje de los carotenos sintetizados. El siguiente paso en el estudio está relacionado con la degradación de carotenos; donde se pretende cuantificar los productos volátiles de degradación de las raíces, buscando establecer si la tasa de degradación es la misma en las tres variedades estudiadas. 59 10 LITERATURA CITADA 1. ADEWUSI S., BRADBURY J. 1993. Carotenoids in Cassava: comparison of opencolumn and HPLC methods of analysis. J Sci Food Agric 62: 375-383. 2. ANONIMO a. 1997. Preventing Micronutrient Malnutrition. Food and Agriculture Organization of the United Nations (FAO) 3. ANONIMO b. 2004. Vitamina A para los niños del mundo. Sight and life organization. 4. AGARWAL S., & RAO A. V. 2000 Tomato lycopene and its role in human health and chronic diseases. Canadian Medical Association 163: 739-744. 5. ARMSTRONG G. A.1997 Genetics of eubacterial carotenoid biosynthesis: A colorful tale. Annual Review of Microbiology 51: 629-659. 6. BARTLEY & SCOLNIK, P. A.1995 Plant carotenoids: Pigments for photoprotection, Visual attraction, and human health. The plant Cell 7: 1027-1038. 7. BARTLEY, SCOLNIK A. & G. GUIULIANO. 1994 Molecular Biology of carotenoid Biosynthesis in plants. Annu.Rev.Plant Physiol. Plant. Mol. Biol. 45: 287-301. 8. BRAMLEY P.M. 2002.Regulation of carotenoid formation during tomato fruit ripening and development. Journal of Experimental Botany 53 (377) 2107-2113. 9. BROWN P., & SOMERVILLE C. 2001 progress in plant metabolic engineering. Proceedings National Academic of Sciences USA 98 No 16: 8925-8927. 10. BOITEUX M. F. & CARVALHO L. B. 2001 Biochemical Diversity of Carotenoids Accumulation in Cassava Storage Root, en: Cassava Biotechnology Network St Louis Missouri 11. BUSTIN S. 2002. Quantification of mRNA using real-time reverse transcription PCR (RT-PCR): trends and problems. Journal of Molecular Endocrinology. 29, 2329. 12. CERULLO G., POLLI D., LANZANI G., SILVESTRI S., HASHIMOTO H. & CODGELL R. 2002. Photosynthetic Light Harvesting by carotenoids: Detection of an Intermediate Excited State. Science Col 298, Issue 5602. 2395-2398. 60 13. CHAVEZ A. L., J. M. BEDOYA T., SANCHEZ C. IGLESIAS., CEBALLOS H. &. ROCA W 2000 Iron, Carotene, and ascorbic acid in cassava roots and leaves. Food and Nutrition Bulletin 21: 410-413 14. CUNINGHAM. F. GRANTT.1998 Genes and Enzymes of carotenoid biosynthesis in plants. Annu.Rev.Plant Physiol. Plant. Mol. Biol. 49: 557-583. 15. CUNNINGHAM F. 2002. Regulation of Carotenoid synthesis and accumulation in plants. Pure Appl. Chem. 74, No. 8, 1409-1417. 16. DECREUX L., MORRIS W., HEDLEY P., SHEPHERD T., DAVIES., MILLAM S. & TAYLOR M. 2004 metabolic engineering of high carotenoid potato tubers containing enhanced levels of β- carotene and lutein. J. Exp. Bot. 409: 81-89. 17. DELLAPENNA D. 1999 Nutritional Genomics: Manipulating Plant Micronutrients to improve Human Health. Science 258: 375-379. 18. EL-SARKAWY M. 2003. Cassava Biology and Physiology. Plant Molecular Biology. 53: 621-641. 19. EKANAYAKE J., OSIURU D. &. PORTO M . 1997 Morphology of cassava. IITA Reseach Guide 61 20 pp. 20. FRASER D. & BRAMLEY P. 2004. The biosynthesis and nutritional uses of carotenoids. Progress in Lipid research. 43 228-265. 21. FRASER D., ROMER S., SHIPTON C., MILLS P., KIANO J., MISAWA N., DRAKE R., SCHUCH W & BRAMLEY P. 2002. Evaluation of transgenic tomato plants expressing an additional phytoene synthase in a fruit – specific maner. Proceedings of the National Academy of Sciences. USA 99, 1092-1097. 22. FREGENE M. & PUONTI-KAERLAS J. 2002 Cassava Biotechnology, en: Cassava Biology, producción and utilización, editada por R. J. HILLOCKS, J. M. THRESH & A. C. BELLOTI. CABI publishing, Wallingford UK. 23. GUERINOT M. 2000. Enhanced: the Green Revolution strikes Gold. Science. 287, 5441, 241-243. 24. HAGENIMANA V. & LOW J. 2002. Potential of orange-fleshed sweet potatoes for raising vitamin A intake in Africa. Food Nutr. Bull. 21: 414-418. 61 25. HARKER M. & BRAMLEY P. Expression of Prokaryotic 1-deoxy-?-xylulose-5phosphatases in Escherichia coli increases carotenoid and ubiquinone biosynthesis. FEBS Lett. 448. 115-119. 26. HIGUCHI R., FOCKLER C., DOLLINGER G. & WATSON, R. 1993. Kinetic PCR Analysis: Real-time Monitoring of DNA Amplification Reaction. Bio/Technology 11: 1026-1030. 27. IGLESIAS, C., J. MAYER, A. L. CHAVEZ & F. CALLE, 1997 Genetic potential and stability of carotene content in cassava. Euphytica 94: 367-373. 28. ISAACSON T., RONEN G., ZAMIR D. & HIRSHBERG. 2002. Cloning of tangerine from tomato reveals a carotenoid isomerase essential for the production of β-carotene and Xanthophylls in Plants. The plant Cell. 4, 333-342. 29. JOS J., NAIR S, MOORTHY S. & NAIR R. 1990 Carotene enhancement in cassava. Journal of Root Crops 16: 5-11. 30. KERNEL J. 1992 Analytical Chemistry refresher manual. Chelsea, Lewis publishers. 358 p. 31. KATO M., IKOMA I., MATSUMOTO H., SEGUIRA M., HYODO H & YANO M. Accumulation of Carotenoids and Expression of carotenoid Biosynthetic Genes during Maturation in Citrus Fruit. 2004. Plant Physiology. Vol. 134, pp 824-837. 32. LINDAREN L., STALBRG K & HOGLUND A. 2003. Seed- specific overexpression of an endogenous Arabidopsis phytoene synthase gene results in delayed germination an increased levels of carotenoids, chlorophil and Abscisic acid. Plant Physiol. 132: 779-785. 33. LIVAK KJ. 2001. User Bulletin No.2: ABI PRISM 7700 Sequence Detection System. PE Applied Biosynthesis, Foster City, CA. 34. McGARVEY D. & CROTEAU R. 1995. Terpenoid metabolism. Plant Cell. 7 (7) 1015-1026. 35. McLAREN D. & FRIGG M. 2002. Manual de Sight and Life sobre la vitamina A en los estados de salud y enfermedad. 2 Ed. Suiza. 36. MORRIS W., DECREUX L.,GRIFFITHS W.,STEWART D. & TAYLOR M. 2004. Carotenogenesis during tuber development and storage in potato. Journal of Experimental Botany. Vol 55: No. 399 975-982. 62 37. MULLER P., JANOVAJAK H., MISEREY A. & DOBBIE Z. 2002. Processing of Gene Expression Data Generated by Quantitative Real-Time PCR. Biotechniques. 32, 1-7. 38. OSPINA B. & CEBALLOS H. 2002. La yuca en el tercer milenio. CIAT, Cali, Colombia. 39. PAINE J., SHIPTON C., CHAGGAR S., HOWELLS R., KENNEDY J., VERNON G., WRIGTH S., HINCHLIFFE F., ADAMS J., SILVERSTONE & DRAKE R. 2005. Improving the nutritional value of golden rice through increased pro-vitamin A content. Nature Biotechnology, advance on line publication. 40. PALACE P., KHAPER N., QIN Q. & SINGAL Q., 1999 Antioxidant potentials of vitamin A and Carotenoids and their relevance to heart disease. Free Radicals Biology & Medicine. 26: 746-761. 41. PFAFFL M., HORGAN G., DEMPLE L., 2002. Relative quantification or Comparative quantification in qPCR. Nucleic Acids Reasearch. 30 (9): E36 42. REILLY K., HAN Y., TOHME J. & BEECHING JR. 2001 Isolation and characterization of cassava catalase expressed during post-harvest physiological deterioration. Biochimica et biophysica Acta. 1518: 317-323. 43. RIRIE K., RASMUSSEN R.& WITTWER. 1997. Product differentiation by análisis of DNA melting curves during the polimerase Chain reaction. Anal Bichem. 245: 154-160. 44. ROMMEL S. 2001 Pathways of pastid-to-nucleus signaling. Trends in Plant Science 6 No 10: 470-478. 45. ROMER S., FRASER P., KIANO J., SHIPTON P., MISAWA N. 2000 Elevation of provitamin A content of transgenic tomato plants. Nature Biotechnology 18: 666669. 46. SAMBROOCK J. & RUSSEL D.W. 2001. Molecular Cloning: A laboratory Manual Cold Spring Harbor Press, New York. 47. SANDMANN G. 2001. Carotenoid Biosynthesis and Biotechnological Application. Arch. Biochem Biophys. 385 (1) 4-12. 48. SAS Institute Inc. 2005. SAS OnlineDoc® 9.1.3. Cary, NC: SAS Institute Inc;Available in:http://support.sas.com/onlinedoc/913/docMainpage.jsp 63 49. SHAUB P., AL-BABILI S., DRAKE R. & BEYER P. 2005. Why Is Golden Rice (Yellow) Instead of Red? . Plant Physiology Preview. www.aspb.org© 50. SHEWMAKER C., J. SHEEHY M., DALEY S., COLBURN & YANG KE, 1999. Seed-specific over expression of phytoene synthase: increase in carotenoids and other metabolic effects. The Plant Journal 20(4): 401-412. 51. TAYLOR N., CHAVARRIAGA P., RAEMARKERS K., SIRITUNGA D. & ZHANG P. 2004. Development and application of transgenic technologies in cassava. Plant Molecular Biology 56: 671-688. 52. TAYLOR M., & RAMSAY G. 2005. Carotenoid biosynthesis in plant storage organs: recent advances and prospects for improving plant food quality. Physiologia Plantarum. 124: 143-151. 53. VISHNEVETSKY M., OVADIS M., ZUKER A. & VAINSTEIN A. 1999. Molecular mechanism underlying carotenogenesis in the chromoplast: multilevel regulation of carotenoid-associated genes. The Plant Journal. 20(4), 423-431. 54. VON LINTIG J., WELSCH R., BONK M., GIULIANO G., BATSCHAUER A. & KLEINIG H. 1997. Light-dependent regulation of carotenoid biosynthesis occurs at the level of phytoene synthase expression and is mediated by phytochrome in Sinapis alba and Arabidopsis thaliana seedlings. Plant J.12(3):625-34. 55. WELSCH R., BEYER P.,HUGUENEY P., KLEINING H. & VON LINTING. 2001. Regulation and activation of phytoene synthase, a key enzyme in carotenoid biosynthesis, during morphogenesis. Planta. 211: 846-854. 56. WELSCH R., MEDINA J., GIULIANO G., BEYER P. & VON LINTING J., 2003. Structural and functional characterization of the phytoene synthase promoter from Arabidopsis thaliana. Planta 216: 523-534. 57. WETZEL C. & RODERMEL S. 1998. Regulation of expression is independent to leaf pigment content in Arabidopsis thaliana. Plant Molecular Biology. 37: 10451053. 58. WURTZEL E.T. 2001 Rice genetics: engineering vitamin A 668-671 En: Encyclopedia of genetics. Fitzray Dearborn, Chicago USA.. 64 59. YE X., AL BABILI S., KLOTI A., ZHANG J., LUCCA P. BEYER, P., & POTRYKUS, 2000 Engineering provitamin A (β-carotene) biosynthesis pathway into (carotenoid free) rice endosperm science 287: 303 –305. 60. ZIMMERMAN M., & HURREL R. 2002. Improving iron, zinc and vitamin A plant biotechnology. Current Opinion in Biotechnology. 13: 142-145. 65 11 ANEXOS 11.1 Anexo 1. Protocolo de extracción de Carotenos totales y β-caroteno. ANALISIS DE CAROTENOS. LABORATORIO DE BIOQUÍMICA, UNIDAD DE BITECNOLOGÍA Extracción de carotenos totales Protocolo:CAR-LCH-001 Aplicación: Caracterización de germoplasma Fecha: Julio del 2003 Persona a contactar: Alba Lucia Chavez (CIAT), Tejido: cinco gramos de raíz u hoja de yuca (5 g. de material) Equipo / materiales • Centrifuga refrigerada Sorvall • Ultraturrax • Tubos falcon, 50ml • Vortex • Espátula plástica • Balanza • Cilindro graduado • Cuchillo • Toallas de papel • Reactivos • Éter de petróleo, 35–65 C (J. T. Baker) • Acetona (J.T. Baker) • Agua Procedimiento Mezcle muy bien la muestra hasta completa homogenización. Tomar 5 g. de material del material. 66 Transferir a un tubo Falcon con ayuda de la espátula plástica. 4. Adicionar 5 ml de Éter de petróleo y 5 ml de Acetona.5. Homogenizar completamente por Turrax. Centrifugar a 3000 rpm a 10 ºC, por 10min. Separar la fase orgánica y transferirla a otro tuba falcon. Mezclar el Pellet con 5 ml de Éter de Petróleo y 5 ml de Acetona. Vortex corto Centrifugar a 3000 rpm a 10 ºC, por 10min. Se parar la fase acuosa y mezclarla con la del paso 7. Agregar 10 ml de agua y llevar al votex. Transferir la fase acuosa a un tubo falcon y repetir pasos 12 y 13. Transferir la fase acuosa a un tubo falcon y completar a un volumen final de 15 ml con Éter de petróleo. Cuantificar el contenido de carotenos totales usando el protocolo para carotenos totales por Colorimetría o el de β- caroteno por HPLC. Nota: Los compuestos carotenicos son degradados por la luz y el aire. 67 11.2 Anexo 2. Protocolo para cuantificación de β-caroteno por método HPLC Protocolo ID number: CAR-LCH-003 Aplicación: Fecha: Julio 2003 Contacto: Alba Lucia Chavez (CIAT). Equipo / materiales • HPLC Hewlett Packard Serie 1050 • Water, Columna YMC-C30 HPLC (250 mm, ID:4.6mm) • Centrifuga refrigerada (Sorvall) • 15 ml de tubo de centrifuga • vials para centrifuga 2 ml • filtros de 0.22 µ • jeringas platicas 3.0 ml • Balanza analítica • Pipetas 1000, 200, 20ul • Kinwipes • Reactivos • Metanol grado HPLC (J. T. Baker) • Metyl-t-butyl éter grado HPLC (J. T. Baker) • Agua grado HPLC (J. T. Baker) • Acetona grado HPLC (J. T. Baker) • β-caroteno (Sigma C0126) • mix de isomeros A-B caroteno (Sigma C4646) • Luteína (Sigma X 6250) Procedimiento 68 1. Preparación de la curva estándar de β-caroteno 1. Prepare un solución stock de 100 ppm de β-caroteno usando éter de petróleo como solvente 2. Diluya 100 ppm del stock como se describe a continuación: Concentración final de caroteno Volumen del éter Volumen del β- de petróleo (ml) del β-caroteno standard (ml) estándar 0 10 0 10 9 1 20 8 2 50 5 5 75 2.5 7.5 100 0 10 2. Análisis de la muestra 1. Cuadre la lectura de absorbancia a 450 nm. 2. Use muestras standard de β-carotene para construir la curva de calibración. 3. Diluya las muestras usando acetona. 5. Inyecte las muestras en el sistema HPLC Fases móviles HPLC: Reactivo 1 litro fase móvil A HPLC (ml) 1 litro fase móvil B HPLC (ml) Metanol 810 200 Metil-t-butirill éter 150 760 Agua 40 40 Parámetros del sistema de HPLC: 69 • Tasa da flujo: 1ml/min • Temperatura de la columna: 23 ºC • Volumen de inyección: 20 ul • Detección: UV(450 nm ) Gradiente Linear desde100%, fase móvil A hasta 100% fase móvil B durante 90 min. 70 11.3 Anexo 3. Protocolo de extracción de ARN de raíz de yuca. Extracción de RNA de raíz de Yuca Aplicación: Extracción de ARN. Fecha: Octubre, 2004 Reilly K, Han Y, Tohme J, Beeching J R. (2001) Isolation and characterization of a cassava catalase expressed during post-harvest physiological deterioration. Biochimica et Biophysica Acta. 1518: 317-323. –Modificaciones realizadas en el CIATContacto : Leonardo M. Galindo (CIAT). Revisado por: Leonardo M. Galindo Muestra: Fecha: Octubre 8/04 Raíces de Yuca. Equipo / materiales • Cuchillo (limpiado con Rnasa away). • Rallador (limpiado con Rnasa away). • Espatula (autoclavada 3 veces). • Mortero (autoclavado 3 veces). • Tubos falcon 50 ml (nuevos). • Tubos de centrifuga Beckman (autoclavados 3 veces). • Cabina de Flujo laminar. • Nitrógeno liquido. Reactivos1 • Buffer de extracción2. • Trizol. • Beta mercaptoetanol • Cloroformo. • Isopropanol. • 75% etanol. • Agua DEPC3. 71 1. Cosechar raíces de yuca con guantes plásticos lavados con Rnasa Away. NO almacenar en nitrógeno líquido. 2. Lavar las raíces muy bien con agua normal( de la llave). Pele y descarte la corteza café y corte la raíz en pedazos. Manténgalos en agua DEPC libre de Rnasas. Utilice un rallador convencional para partir trozos pequeños. Lleve los trozos al mortero (con nitrógeno líquido) a un polvo fino y almacene de 3-5 gramos en un tubo falcon estéril.. 3. Agregue 150 ul de B-Mercaptoetanol a 15 ml de Buffer de extracción por cada muestra y caliente a 60°C. 4. Adicione el Buffer precalentado a las muestras y homogenice fuertemente. Espere 5 minutos. 5. Adicione 0,5 Volúmenes del reactivo Trizol® (aprox. 8 mL) y agite fuerte con la mano por 30 segundos (invierta el tubo varias veces). 6. Encube a temperatura ambiente por 4:30 minutos (Agite cada minuto). 7. Adicione 0.2 volúmenes de cloroformo por cada ml de Trizol® (Aprox. 1.6 mL). Tape los tubos y agite suavemente por 15 segundos. 8. Centrifuge a 11000 rpm por 15 minutos a 4°C la centrifuga Beckman. 9. Transfiera la fase acuosa a un tubo nuevo (Cuidado de no tocar la fase solida) y precipite con 0,5 volúmenes de Isopopanol. Incube las muestras a temperatura ambiente por 8 minutos. Luego centrifuge a 11000 rpm por 15 minutos a 4°C. 10. Remueva el sobrenadante por inversión del tubo hacia el lado opuesto del Pellet y lávelo con10 ml de Etanol al 75%. Centrifuge a 11000 rpm por 15 minutos a Centrifuge 4°C la centrifuga Beckman. 11. Decante el sobrenadante por inversión. 12. Seque el Pellet de RNA volteando el tubo sobre una toalla de papel hasta que el etanol no se vea. Disuelva en 100-500 ul (dependiendo del tamaño del pellet) de DEPC. 1 Todos los reactivos deben ser exclusivos para RNA. 2 Buffer de extracción. 72 Concentración 1L 500 ml 250 ml 100 ml 50ml 25ml 10ml final 100mM Tris 100ml HCl pH 7.5 3 100mM NaCl 20ml 10ml 5ml 2ml 25mM EDTA 50ml 25ml 12.5ml 5ml 1% SDS 10g 5g 2.5g 1g 2% PVP K30 20g 10g 5g 2g Agua DEPC • Mezcle 50 ml de etanol al 96% (para RNA) con 1 ml de DEPC complete hasta 1L con DDH2O (en una botella autoclavada). • Agitar toda la noche. • Autoclavar. 73 11.4 Anexo 4.Análisis de los datos de PCR en tiempo real. tratamiento ggpp_3_hoja ggpp_3_hoja ggpp_3_hoja ggpp_3_raíz ggpp_3_raíz ggpp_3_raíz ggpp_6_hoja ggpp_6_hoja ggpp_6_hoja ggpp_6_raíz ggpp_6_raíz ggpp_6_raíz lcyb_3_hoja lcyb_3_hoja lcyb_3_hoja lcyb_3_raíz lcyb_3_raíz lcyb_3_raíz lcyb_6_hoja lcyb_6_hoja lcyb_6_hoja lcyb_6_raíz lcyb_6_raíz lcyb_6_raíz pds_3_hoja pds_3_hoja pds_3_hoja pds_3_raíz pds_3_raíz pds_3_raíz pds_6_hoja pds_6_hoja pds_6_hoja pds_6_raíz pds_6_raíz pds_6_raíz psy_3_hoja psy_3_hoja psy_3_hoja variedad Amarilla Blanca Crema Amarilla Blanca Crema Amarilla Blanca Crema Amarilla Blanca Crema Amarilla Blanca Crema Amarilla Blanca Crema Amarilla Blanca Crema Amarilla Blanca Crema Amarilla Blanca Crema Amarilla Blanca Crema Amarilla Blanca Crema Amarilla Blanca Crema Amarilla Blanca Crema gen ggpp ggpp ggpp ggpp ggpp ggpp ggpp ggpp ggpp ggpp ggpp ggpp lcyb lcyb lcyb lcyb lcyb lcyb lcyb lcyb lcyb lcyb lcyb lcyb pds pds pds pds pds pds pds pds pds pds pds pds psy psy psy edad 3 3 3 3 3 3 6 6 6 6 6 6 3 3 3 3 3 3 6 6 6 6 6 6 3 3 3 3 3 3 6 6 6 6 6 6 3 3 3 Blanco ngm sng 78.748 3.306 96.499 8.248 115.259 1.489 49.974 6.871 49.664 2.160 28.632 3.122 51.146 8.405 30.416 1.053 53.356 5.056 2.528 0.739 10.044 0.926 9.326 0.823 26.897 3.690 117.360 9.068 61.147 4.992 11.927 2.083 13.939 1.124 3.053 0.380 542.282 8.933 153.024 7.367 206.227 8.294 10.618 2.867 22.587 3.086 30.462 5.261 46.440 3.588 17.029 2.995 27.558 2.412 75.566 2.380 26.086 3.823 53.985 4.633 20.689 1.510 1.706 0.805 7.718 1.090 15.472 3.818 6.682 1.486 26.688 3.311 69.711 3.475 114.430 6.599 85.826 7.277 74 control 18S ngcm sngc 152.002 8.769 468.890 8.748 454.192 22.579 251.772 4.525 255.783 14.361 35.626 7.051 60.065 4.733 41.427 5.702 62.041 4.379 32.110 4.833 32.125 9.229 17.424 2.591 23.364 4.360 80.754 12.673 59.685 7.465 49.304 1.846 46.101 2.204 16.284 1.998 59.133 4.418 54.065 4.341 102.895 5.981 16.364 0.905 52.284 0.910 21.077 0.614 107.346 4.136 339.001 18.637 218.040 3.463 103.692 5.963 114.724 9.415 72.522 4.165 59.133 7.246 54.065 4.341 107.895 5.981 15.380 2.341 48.284 5.152 21.077 0.614 56.453 0.214 129.310 6.855 109.954 3.615 normalizado cm ccv 0.518 0.037 0.206 0.018 0.254 0.013 0.198 0.028 0.194 0.014 0.804 0.182 0.852 0.155 0.734 0.104 0.860 0.102 0.079 0.026 0.313 0.094 0.535 0.093 1.151 0.267 1.453 0.254 1.024 0.153 0.242 0.043 0.302 0.028 0.187 0.033 4.585 0.702 2.830 0.265 2.004 0.142 0.649 0.179 0.432 0.059 1.445 0.253 0.433 0.037 0.050 0.009 0.126 0.011 0.729 0.048 0.227 0.038 0.744 0.077 0.350 0.050 0.032 0.015 0.072 0.011 1.006 0.292 0.138 0.034 1.266 0.161 1.235 0.062 0.885 0.069 0.781 0.071 psy_3_raíz psy_3_raíz psy_3_raíz psy_6_hoja psy_6_hoja psy_6_hoja psy_6_raíz psy_6_raíz psy_6_raíz zds_3_hoja zds_3_hoja zds_3_hoja zds_3_raíz zds_3_raíz zds_3_raíz zds_6_hoja zds_6_hoja zds_6_hoja zds_6_raíz zds_6_raíz zds_6_raíz Amarilla Blanca Crema Amarilla Blanca Crema Amarilla Blanca Crema Amarilla Blanca Crema Amarilla Blanca Crema Amarilla Blanca Crema Amarilla Blanca Crema psy psy psy psy psy psy psy psy psy zds zds zds zds zds zds zds zds zds zds zds zds 3 3 3 6 6 6 6 6 6 3 3 3 3 3 3 6 6 6 6 6 6 17.780 16.612 11.730 85.105 59.027 52.284 8.458 10.277 11.458 85.043 432.789 187.803 83.521 47.747 12.909 158.040 154.584 156.831 28.553 43.374 32.938 75 2.665 2.174 1.613 6.659 2.280 7.399 2.707 1.319 0.680 5.575 33.494 9.465 3.130 6.446 1.523 5.403 6.657 3.889 0.000 0.390 4.200 91.682 76.732 26.373 60.065 46.427 62.041 33.110 32.125 17.424 33.211 68.869 56.198 55.467 79.156 26.571 106.846 339.001 223.540 103.192 113.724 12.022 5.194 6.896 2.313 13.218 21.258 4.379 7.662 9.229 2.591 3.143 6.649 4.409 4.435 0.778 3.890 4.843 46.922 18.313 10.913 6.587 0.629 0.194 0.217 0.445 1.417 1.271 0.843 0.255 0.320 0.658 2.561 6.284 3.342 1.506 0.603 0.486 1.479 0.456 0.702 0.277 0.381 2.740 0.031 0.034 0.073 0.331 0.584 0.133 0.101 0.101 0.105 0.295 0.778 0.312 0.133 0.082 0.091 0.084 0.066 0.060 0.029 0.022 0.378 11.5 Anexo. 5 Análisis estadístico medición carotenos totales y β-carotenos hplc Obs 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 14:11 Tuesday, October 18, 2005 tejido hoja hoja hoja hoja hoja hoja hoja hoja hoja hoja hoja hoja hoja hoja hoja hoja hoja hoja raíz raíz raíz raíz raíz raíz raíz raíz raíz raíz raíz raíz raíz raíz raíz raíz raíz raíz edad 3 3 3 3 3 3 3 3 3 6 6 6 6 6 6 6 6 6 3 3 3 3 3 3 3 3 3 6 6 6 6 6 6 6 6 6 rep 1 2 3 1 2 3 1 2 3 1 2 3 1 2 3 1 2 3 1 2 3 1 2 3 1 2 3 1 2 3 1 2 3 1 2 3 vari CM2772 CM2772 CM2772 CM3306 CM3306 CM3306 MBRA253 MBRA253 MBRA253 CM2772 CM2772 CM2772 CM3306 CM3306 CM3306 MBRA253 MBRA253 MBRA253 CM2772 CM2772 CM2772 CM3306 CM3306 CM3306 MBRA253 MBRA253 MBRA253 CM2772 CM2772 CM2772 CM3306 CM3306 CM3306 MBRA253 MBRA253 MBRA253 color cream cream cream white white white yellow yellow yellow cream cream cream white white white yellow yellow yellow cream cream cream white white white yellow yellow yellow cream cream cream white white white yellow yellow yellow 75 total 713.960 684.495 965.623 471.747 548.913 560.141 448.876 441.377 651.731 925.019 788.198 651.426 415.537 670.503 621.650 644.261 399.289 561.171 1.623 1.345 2.181 0.608 0.988 0.958 5.517 5.349 3.995 1.701 1.423 1.497 0.544 0.559 0.721 5.551 5.097 4.330 beta 122.230 132.792 147.161 68.309 85.850 79.484 65.491 65.368 86.224 121.825 105.855 81.819 51.818 81.265 78.390 90.712 51.309 83.390 0.360 0.200 0.380 0.370 0.230 0.170 0.730 0.600 0.560 1.320 1.045 1.437 0.258 0.375 0.438 2.256 2.558 2.233 1 inter cream_3 cream_3 cream_3 white_3 white_3 white_3 yellow_3 yellow_3 yellow_3 cream_6 cream_6 cream_6 white_6 white_6 white_6 yellow_6 yellow_6 yellow_6 cream_3 cream_3 cream_3 white_3 white_3 white_3 yellow_3 yellow_3 yellow_3 cream_6 cream_6 cream_6 white_6 white_6 white_6 yellow_6 yellow_6 yellow_6 hplc 14:11 Tuesday, October 18, 2005 2 -------------------------------------------------------------------- _TYPE_=0 ---------------------------------------------------------------------promedios------varianzas------error estandar--coef. de variacionObs tejido edad vari color _FREQ_ total beta vt vb st sb cvt cvb 1 108.014 . yellow 36 311.331 44.8558 110844.45 2347.46 55.4888 8.07510 106.939 -------------------------------------------------------------------- _TYPE_=1 ---------------------------------------------------------------------promedios------varianzas------error estandar--coef. de variacionObs tejido edad vari color _FREQ_ total beta vt vb st sb cvt cvb 2 106.182 3 105.985 4 104.030 . CM2772 cream 12 394.874 59.7019 176443.77 4018.60 121.259 18.2998 106.376 . CM3306 white 12 274.406 37.2463 85702.18 1558.30 84.509 11.3955 106.685 . MBRA253 yellow 12 264.712 37.6192 79068.63 1531.56 81.173 11.2973 106.225 -------------------------------------------------------------------- _TYPE_=2 ---------------------------------------------------------------------promedios------varianzas------error estandar--coef. de variacionObs tejido edad vari color _FREQ_ total beta vt vb st sb cvt cvb 5 111.468 6 106.261 3 yellow 18 306.079 47.5838 110772.44 2813.33 78.4476 12.5019 108.738 6 yellow 18 316.582 42.1277 117378.31 2003.92 80.7528 10.5512 108.220 -------------------------------------------------------------------- _TYPE_=3 ---------------------------------------------------------------------promedios------varianzas------error estandar--coef. de variacionObs tejido edad vari color _FREQ_ total beta vt vb st sb cvt cvb 7 109.668 8 109.770 9 109.646 3 CM2772 cream 6 394.871 67.1872 195034.12 5429.17 180.293 30.0809 111.841 3 CM3306 white 6 263.892 39.0688 83955.13 1839.20 118.290 17.5081 109.799 3 MBRA253 yellow 6 259.474 36.4955 83434.14 1601.26 117.922 16.3364 111.321 76 10 109.635 11 112.249 12 108.442 6 CM2772 cream 6 394.877 52.2167 193142.17 3277.28 179.417 23.3712 111.295 6 CM3306 white 6 284.919 35.4237 104324.40 1581.08 131.861 16.2331 113.363 6 MBRA253 yellow 6 269.950 38.7429 90451.00 1765.14 122.781 17.1520 111.410 -------------------------------------------------------------------- _TYPE_=4 ---------------------------------------------------------------------promedios------varianzas------error estandar--coef. de variacionObs tejido edad vari color _FREQ_ total beta vt vb st sb cvt cvb 13 30.4886 14 90.1838 hoja . yellow 18 620.218 88.8495 26158.27 733.814 38.1213 6.38494 26.0772 raíz . yellow 18 2.444 0.8621 3.69 0.604 0.4531 0.18325 78.6609 -------------------------------------------------------------------- _TYPE_=5 ---------------------------------------------------------------------promedios------varianzas------error estandar--coef. de variacionObs tejido edad vari color _FREQ_ total beta vt vb st sb cvt cvb 15 19.0616 16 16.6929 17 20.8157 18 68.4982 19 33.4900 20 63.7909 hoja . CM2772 cream 6 788.120 118.614 17034.41 511.199 53.2829 9.23038 16.5604 hoja . CM3306 white 6 548.082 74.186 8788.07 153.358 38.2711 5.05567 17.1041 hoja . MBRA253 yellow 6 524.451 73.749 12036.31 235.665 44.7890 6.26718 20.9190 raíz . CM2772 cream 6 1.628 0.790 0.09 0.293 0.1226 0.22096 18.4448 raíz . CM3306 white 6 0.730 0.307 0.04 0.011 0.0811 0.04192 27.2348 raíz . MBRA253 yellow 6 4.973 1.489 0.43 0.903 0.2681 0.38789 13.2060 hplc 18, 2005 14:11 Tuesday, October 3 -------------------------------------------------------------------- _TYPE_=6 ---------------------------------------------------------------------promedios------varianzas------error estandar--coef. de variacionObs tejido edad vari color _FREQ_ total beta vt vb st sb cvt cvb 21 32.8490 22 27.2701 hoja 3 yellow 9 609.652 94.7677 28036.44 969.091 55.8136 10.3767 27.4650 hoja 6 yellow 9 630.784 82.9313 27298.69 511.458 55.0744 7.5385 26.1933 77 23 48.3477 24 66.1232 raíz 3 yellow 9 2.507 0.4000 3.74 0.037 0.6445 0.0645 77.1183 raíz 6 yellow 9 2.380 1.3241 4.10 0.767 0.6753 0.2919 85.1151 -------------------------------------------------------------------- _TYPE_=7 ---------------------------------------------------------------------promedios------varianzas------error estandar--coef. de variacionObs tejido edad vari color _FREQ_ total beta vt vb st sb cvt cvb 25 9.3344 26 11.4016 27 16.5916 28 19.5200 29 23.0319 30 27.8933 31 31.4865 32 39.9865 33 14.1082 34 15.8944 35 25.6217 36 7.7365 hoja 3 CM2772 cream 3 788.026 134.061 23872.64 156.596 89.2051 7.2249 19.6069 hoja 3 CM3306 white 3 526.934 77.881 2315.68 78.849 27.7830 5.1267 9.1324 hoja 3 MBRA253 yellow 3 513.995 72.361 14242.50 144.141 68.9021 6.9316 23.2185 hoja 6 CM2772 cream 3 788.214 103.166 18713.35 405.542 78.9796 11.6267 17.3553 hoja 6 CM3306 white 3 569.230 70.491 18312.77 263.586 78.1297 9.3735 23.7733 hoja 6 MBRA253 yellow 3 534.907 75.137 15520.28 439.243 71.9265 12.1002 23.2901 raíz 3 CM2772 cream 3 1.716 0.313 0.18 0.010 0.2459 0.0570 24.8126 raíz 3 CM3306 white 3 0.851 0.257 0.04 0.011 0.1221 0.0593 24.8444 raíz 3 MBRA253 yellow 3 4.954 0.630 0.70 0.008 0.4818 0.0513 16.8447 raíz 6 CM2772 cream 3 1.540 1.267 0.02 0.041 0.0834 0.1163 9.3809 raíz 6 CM3306 white 3 0.608 0.357 0.01 0.008 0.0567 0.0527 16.1513 raíz 6 MBRA253 yellow 3 4.993 2.349 0.38 0.033 0.3563 0.1049 12.3616 78 tejido=hoja CASO 1 The ANOVA Procedure Class Level Information Class Levels Values color 3 cream white yellow edad 2 3 6 Number of Observations Read Number of Observations Used hplc 18, 2005 18 18 14:11 Tuesday, October 10 ------------------------------------------------------------------ tejido=hoja -----------------------------------------------------------------The ANOVA Procedure Dependent Variable: beta DF Sum of Squares Mean Square F Value Pr > F Model 5 9498.92108 1899.78422 7.66 0.0019 Error 12 2975.91396 247.99283 Corrected Total 17 12474.83505 Pr > F Source Source color edad color*edad 18, 2005 CONTENIDO B-CAROTENO EN HOJAS R-Square Coeff Var Root MSE beta Mean 0.761447 17.72411 15.74779 88.84951 DF Anova SS Mean Square F Value 2 1 2 7973.720443 630.443357 894.757284 hplc 3986.860222 630.443357 447.378642 16.08 2.54 1.80 11 79 0.0004 0.1368 0.2065 14:11 Tuesday, October ------------------------------------------------------------------ tejido=hoja ------------------------------------------------------------------ The ANOVA Procedure Ryan-Einot-Gabriel-Welsch Multiple Range Test for beta NOTE: This test controls the Type I experimentwise error rate. Alpha 0.05 Error Degrees of Freedom 12 Error Mean Square 247.9928 Number of Means Critical Range 2 19.809813 3 24.255218 Means with the same letter are not significantly different. REGWQ Grouping Mean N color A 118.614 6 cream VARIEDAD C B B 74.186 6 white VARIEDAD B B 73.749 hplc 6 yellow VARIEDAD A 14:11 Tuesday, October 18, 2005 13 ------------------------------------------------------------------ tejido=raiz ------------------------------------------------------------------ CASO 2 The ANOVA Procedure CONTENIDO B-CAROTENO EN RAICES Class Level Information Class Levels Values color 3 cream white yellow edad 2 3 6 Number of Observations Read Number of Observations Used hplc 18 18 14:11 Tuesday, October 18, 2005 14 ------------------------------------------------------------------ tejido=raiz ------------------------------------------------------------------ 80 The ANOVA Procedure Dependent Variable: beta DF Sum of Squares Mean Square F Value Pr > F Model 5 10.05496107 2.01099221 109.60 <.0001 Error 12 0.22017431 0.01834786 Corrected Total 17 10.27513538 Pr > F Source R-Square Coeff Var Root MSE beta Mean 0.978572 15.71274 0.135454 0.862067 Source color edad color*edad 18, 2005 DF Anova SS Mean Square F Value 2 1 2 4.24395043 3.84310088 1.96790976 hplc 2.12197522 3.84310088 0.98395488 115.65 209.46 53.63 <.0001 <.0001 <.0001 14:11 Tuesday, October 15 ------------------------------------------------------------------ tejido=raiz -----------------------------------------------------------------The ANOVA Procedure Ryan-Einot-Gabriel-Welsch Multiple Range Test for beta NOTE: This test controls the Type I experimentwise error rate. Alpha 0.05 Error Degrees of Freedom 12 Error Mean Square 0.018348 Number of Means Critical Range 2 0.1703937 3 0.2086307 Means with the same letter are not significantly different. REGWQ Grouping Mean N color A 1.48945 6 yellow VARIEDAD A B 0.79015 6 cream VARIEDAD C C 0.30660 6 white VARIEDAD B 81 hplc 18, 2005 14:11 Tuesday, October 16 ------------------------------------------------------------------ tejido=raiz ------------------------------------------------------------------ CASO 3 CONTENIDO B CAROTENO EN RAIZ POR TIEMPO The ANOVA Procedure Ryan-Einot-Gabriel-Welsch Multiple Range Test for beta NOTE: This test controls the Type I experimentwise error rate. Alpha 0.05 Error Degrees of Freedom 12 Error Mean Square 0.018348 Number of Means Critical Range 2 0.1391259 Means with the same letter are not significantly different. REGWQ Grouping Mean N edad A 1.32413 9 6 B 0.40000 9 3 ------------------------------------------------------------------ tejido=raiz -----------------------------------------------------------------contenido carotenos TOTALES en raíz a 3 y 6 meses The GLM Procedure Ryan-Einot-Gabriel-Welsch Multiple Range Test for beta NOTE: This test controls the Type I experimentwise error rate. Alpha 0.05 Error Degrees of Freedom 12 Error Mean Square 0.018348 Number of Means Critical Range 2 0.3063754 3 0.33739 4 0.3536317 5 0.3536317 Means with the same letter are not significantly different. 82 6 0.3714835 REGWQ Grouping Mean N inter A 2.3489 3 yellow_6 A6 B 1.2670 3 cream_6 C6 C C C C C 0.6300 3 yellow_3 A3 D 0.3565 3 white_6 B6 D D 0.3133 3 cream_3 C3 D D 0.2567 3 white_3 B3 ---------------------------------------------------------------------------------------------------------------------------hplc 14:11 Tuesday, October 18, 2005 23 The ANOVA Procedure Class Level Information Class Levels Values tejido 2 hoja raíz color 3 cream white yellow edad 2 3 6 Number of Observations Read Number of Observations Used hplc 18, 2005 36 36 14:11 Tuesday, October 24 caso 4 hojas carotenos totales The ANOVA Procedure Ryan-Einot-Gabriel-Welsch Multiple Range Test for total NOTE: This test controls the Type I experimentwise error rate. Alpha 0.05 Error Degrees of Freedom 24 Error Mean Square 7748.212 Number of Means Critical Range 2 74.167599 3 89.741558 Means with the same letter are not significantly different. REGWQ Grouping Mean 83 N color A 394.87 12 cream B B B 274.41 12 white 264.71 12 yellow ------------------------------------------------------------------ tejido=hoja -----------------------------------------------------------------The ANOVA Procedure Class Level Information Class Levels Values color 3 cream white yellow edad 2 3 6 Number of Observations Read Number of Observations Used hplc 18, 2005 18 18 14:11 Tuesday, October 29 ------------------------------------------------------------------ tejido=hoja -----------------------------------------------------------------The ANOVA Procedure Dependent Variable: total CONTENIDO TOTAL CAROTENOS EN HOJA DF Sum of Squares Mean Square F Value Pr > F Model 5 258736.1936 51747.2387 3.34 0.0404 Error 12 185954.4106 15496.2009 Corrected Total 17 444690.6042 Pr > F Source Source color edad color*edad 18, 2005 R-Square Coeff Var Root MSE total Mean 0.581834 20.07098 124.4837 620.2176 DF Anova SS Mean Square F Value 2 1 2 255396.6907 2009.5623 1329.9406 hplc 127698.3453 2009.5623 664.9703 8.24 0.13 0.04 0.0056 0.7250 0.9581 14:11 Tuesday, October 30 ------------------------------------------------------------------ tejido=hoja ------------------------------------------------------------------ 84 The ANOVA Procedure Ryan-Einot-Gabriel-Welsch Multiple Range Test for total NOTE: This test controls the Type I experimentwise error rate. Alpha Error Degrees of Freedom Error Mean Square Number of Means Critical Range 0.05 12 15496.2 2 156.59339 3 191.7336 Means with the same letter are not significantly different. REGWQ Grouping Mean N color A 788.12 6 cream C B B B 548.08 6 white B 524.45 6 yellow A ------------------------------------------------------------------ tejido=raiz -----------------------------------------------------------------The ANOVA Procedure Class Level Information Class Levels Values color 3 cream white yellow edad 2 3 6 Number of Observations Read Number of Observations Used hplc 18, 2005 18 18 14:11 Tuesday, October 33 ------------------------------------------------------------------ tejido=raiz ------------------------------------------------------------------ CASO 5 The ANOVA Procedure Dependent Variable: total CAROTENOS TOTALES EN RAÍZ Source Model DF Sum of Squares Mean Square F Value Pr > F 5 60.14459368 12.02891874 54.11 <.0001 85 Error 12 2.66749041 Corrected Total 17 62.81208408 R-Square Coeff Var Root MSE total Mean 0.957532 19.29402 0.471477 2.443644 Source color edad color*edad 18, 2005 0.22229087 DF Anova SS Mean Square F Value 2 1 2 60.00709251 0.07227602 0.06522514 hplc 30.00354626 0.07227602 0.03261257 134.97 0.33 0.15 Pr > F <.0001 0.5791 0.8651 14:11 Tuesday, October 34 ------------------------------------------------------------------ tejido=raiz -----------------------------------------------------------------The ANOVA Procedure Ryan-Einot-Gabriel-Welsch Multiple Range Test for total NOTE: This test controls the Type I experimentwise error rate. Alpha 0.05 Error Degrees of Freedom 12 Error Mean Square 0.222291 Number of Means Critical Range 2 0.5930914 3 0.7261836 Means with the same letter are not significantly different. REGWQ Grouping Mean N color A 4.9731 6 yellow A B 1.6282 6 cream C C 86 0.7296 6 white 0