UNIVERSIDAD VERACRUZANA
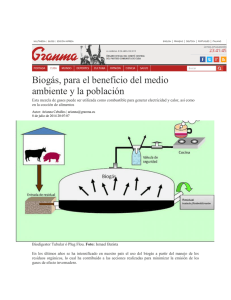
Anuncio

UNIVERSIDAD VERACRUZANA FACULTAD DE MEDICINA VETERINARIA Y ZOOTECNIA “PRODUCCIÓN DE BIOGÁS A PARTIR DE DESECHOS DE BOVINOS COMO UNA ALTERNATIVA DE ENERGÍA RENOVABLE” TESIS COMO REQUISITO PARA OBTENER EL TITULO DE: MEDICO VETERINARIO ZOOTECNISTA PRESENTA HERRERA CARRILLO GUILLERMO EDUARDO ASESOR: PH. D. EDUARDO G. CANUDAS LARA. PH.D. FRANCISCO I. JUÁREZ LAGUNES Veracruz Ver. 2010 DEDICATORIA A Dios. Por darme el conocimiento y fortaleza para poder alcanzar una meta más en mi vida. A mis padres. Edwin R. Herrera Gamboa y Ma. Guadalupe Carrillo Moreno por su amor incondicional, su comprensión e inagotable esfuerzo para que esta meta se cumpliera. Este éxito es de ustedes. A mis tres hermanos. Que siempre estuvieron a mi lado apoyándome, en especial a Edwin por siempre estar pendiente de mí. A mi abuela. Sara Moreno Cárdenas, por ser la base de la familia y siempre brindarme su amor. A mis tíos y primos. Por el apoyo que me han brindado en todo momento, ustedes hacen que mi vida tenga más alegrías, gracias por todo. A mi novia, amiga y compañera. Nazhira Torres Neme, gracias por tu apoyo, haces que las cosas complicadas se vuelvan simples. I mucho. ii AGRADECIMIENTO Ph.D Eduardo G. Canudas Lara. Gracias por todo su apoyo para la realización de este trabajo, por su amistad, por sus conocimientos, por el tiempo dedicado y por tener siempre una actitud amable y positiva. Ph.D Francisco I. Juárez Lagunes. Por su asesoría en el desarrollo de este trabajo, así como por conocimientos compartidos. todos los Ing. Físico Eduardo David Canudas Hawks. Por dedicar parte de su tiempo en la realizacion de esta tesis. Dr. José Manuel Martínez Hernández. Gracias por su amistad y colaboración para terminar esta tesis. MC. Maribel Montero Lagunes. Por su valiosa cooperación en la realización de las pruebas de laboratorio y manifestar siempre gran disponibilidad. M.V.Z María Esther Muñoz Pérez. Por el gran apoyo durante toda la carrera y por su valiosa amistad. Facultad de Medicina Veterinaria y Zootecnia. Por darme las herramientas necesarias para tener una vida profesional exitosa. iii INDICE DEDICATORIA .................................................................................................... II AGRADECIMIENTO ........................................................................................... III INDICE DE CUADROS ....................................................................................... VI INDICE DE FIGURAS ........................................................................................ VII RESUMEN ..................................................................................................... VIII 1. INTRODUCCIÓN ............................................................................................. 1 2. ANTECEDENTES ............................................................................................ 4 2.1 HISTORIA .................................................................................................. 4 2.2 FUNDAMENTOS DE LA DIGESTIÓN ANAEROBIA ................................. 5 2.3 ETAPAS DE LA DIGESTIÓN ANAEROBIA ............................................... 7 2.4 EL BIOGÁS .............................................................................................. 10 2.5 EL METANO ............................................................................................ 11 2.6 ÁCIDO SULFHÍDRICO (H2S)................................................................... 13 2.7 RELACIÓN CARBONO-NITRÓGENO..................................................... 14 2.8 TEMPERATURA ....................................................................................... 15 2.9 PH DEL MEDIO ........................................................................................ 16 2.10 MICROORGANISMOS QUE NO PRODUCEN METANO ...................... 17 2.11 SUSTRATOS ......................................................................................... 18 2.12 ORGANILODO (BIO-FERTILIZANTE) ................................................... 19 2.13 BIODIGESTORES (REACTORES)........................................................ 19 2.14 CLASIFICACIÓN DE BIODIGESTORES ............................................... 20 iv 3. JUSTIFICACIÓN ............................................................................................ 23 4. HIPÓTESIS .................................................................................................... 24 5. OBJETIVOS ................................................................................................... 25 5.1 OBJETIVO GENERAL ............................................................................. 25 5.2 OBJETIVOS ESPECÍFICOS .................................................................... 25 6. MATERIALES Y MÉTODOS .......................................................................... 26 6.1 LOCALIZACIÓN....................................................................................... 26 6.2 INSTALACIÓN Y DISEÑO DE LOS BIODIGESTORES .......................... 26 6.3 CONSTRUCCIÓN DE LOS REACTORES .............................................. 28 6.4 MATERIAL DE LABORATORIO .............................................................. 29 6.5 VARIABLES EXPERIMENTALES............................................................ 29 6.6 VARIABLES DE RESPUESTA ................................................................ 30 6.7 ANÁLISIS DE LABORATORIO ................................................................ 31 6.8 ANÁLISIS ESTADÍSTICO ........................................................................ 39 7. RESULTADOS Y DISCUSIÓN ....................................................................... 40 8. CONCLUSIONES .......................................................................................... 52 9. LITERATURA CITADA ................................................................................... 54 ANEXO .............................................................................................................. 58 v INDICE DE CUADROS CUADRO 1. ETAPAS DE LA DIGESTIÓN ANAERÓBICA...................................... 7 CUADRO 2. CLASIFICACIÓN DE LAS METANOBACTERIAS. ............................. 9 CUADRO 3: PROPIEDADES DEL BIOGÁS ........................................................... 11 CUADRO 4. GASES QUE CONFORMAN EL BIOGÁS. ....................................... 12 CUADRO 5. CONTENIDO DE METANO EN EL BIOGÁS CON DIFERENTES TIPOS DE MATERIAL ORGÁNICO. .................................................. 12 CUADRO 6. CLASIFICACIÓN DE LOS BIODIGESTORES. ................................ 21 CUADRO 7: TEMPERATURA INTERNA DE LOS REACTORES POR TRATAMIENTO. ................................................................................... 44 vi INDICE DE FIGURAS FIGURA 1. DIGESTIÓN ANAEROBIA ................................................................. 8 FIGURA 2. PUNTOS DONDE SE TOMARON LAS MUESTRAS PARA SER ANALIZADAS. ................................................................................ 30 FIGURA 3. PRODUCCIÓN TOTAL DE BIOGÁS GENERADOS POR CADA TRATAMIENTO. ............................................................................ 40 FIGURA 4. PRODUCCIÓN DE HORAS/BIOGÁS PARA ALIMENTAR UNA ESTUFA DE UN SOLO QUEMADOR CON UN GASTO DE BIOGÁS DE 8.3L/MIN. ................................................................... 41 FIGURA 5. PRODUCCIÓN DE BIOGÁS POR KILOGRAMO DE MATERIA ORGÁNICA SECA ......................................................................... 42 FIGURA 6. RELACIÓN DE LA PRODUCCIÓN DE BIOGÁS CON LA TEMPERATURA. ........................................................................... 45 FIGURA 7. RELACIÓN DE LA PRODUCCIÓN DE BIOGÁS CON EL PH. ....... 46 FIGURA 8. DEGRADACIÓN DE LA FIBRA NEUTRO DETERGENTE (CELULOSA, HEMICELULOSA Y LIGNINA). ................................ 47 FIGURA 9. CANTIDAD DE FND EN EL EXCREMENTO (FNDE), EN EL ORGANILODO (FNDO) Y DEGRADADO. ..................................... 48 FIGURA 10. CANTIDAD DE CENIZAS O MINERALES EN EL EXCREMENTO,ORGANILODO Y PASTO. ................................... 49 FIGURA 11. CANTIDAD DE LIGNINA EN EL EXCREMENTO, ORGANILODO Y PASTO........................................................................................ 50 FIGURA 12. CANTIDAD DE PROTEÍNA EN EL EXCREMENTO, ORGANILODO Y PASTO. ............................................................. 51 vii RESUMEN Herrera Carrillo Guillermo Eduardo. 2010. Producción de biogás a partir de desechos de bovinos como una alternativa de energía renovable. Tesis de licenciatura. Facultad de Medicina Veterinaria y Zootecnia. Universidad Veracruzana. Veracruz, Ver. México. EL presente trabajo se realizó en la Posta Zootécnica “Torreón del Molino” (PZTM) localizada en la Carretera Federal Veracruz-Xalapa km 14.5, Colonia ProgresoTejería, dependiente de la Facultad de Medicina Veterinaria y Zootecnia de la Universidad Veracruzana. Tiene como objetivo, valorar la producción de biogás utilizando dos sustratos diferentes (heces y pasto). Se utilizaron dos tratamientos con una repetición para cada tratamiento. Tratamiento A consistió de 50 kg de heces frescas (6.5 kg de heces en BS) más 37.5 L de agua; Tratamiento B consistió de 30 kg de heces frescas (3.9 kg de heces en BS) más 3.2 kg de pasto desecho de los comederos (2.5 kg de pasto en BS) y 54.3 L de agua. Los resultado obtenidos demuestran que el uso de heces con pasto aumenta la producción de biogás, esta mezcla de heces + pasto produjo en promedio 1,614 L de biogás diariamente a diferencia del tratamiento que solo fue alimentado con heces, produjo en promedio 750.8 L de biogás diariamente. La degradación de la materia orgánica alcanzo un máximo del 82% y el mínimo el 46%, esta variación depende principalmente de la temperatura y el pH de los biodigestores. viii 1. INTRODUCCIÓN La población del mundo pasara de 6,000 millones de personas a 8,500 millones para el año 2025. Esto indica que esta población requerirá que se incremente el suministro de alimentos, pero sin dañar el medio ambiente (Viglizzo, 1997). Los modelos tradicionales de desarrollo rural han causado graves problemas de contaminación del suelo, aire y agua. Como resultado, la agricultura, la agroindustria y la actividad humana que las acompaña, contribuyen en parte a la crisis ambiental que estamos viviendo actualmente en todo el mundo. Durante las últimas tres décadas, los países latinoamericanos adoptaron el paradigma del crecimiento económico, conocido como la “revolución verde” que inicio en México en el año de 1943 por Norman E. Borlaug (Alba Lamo, 2005). Como tal, se hizo énfasis en lograr resultados económicos a corto plazo, sin importar la integridad de los agro-ecosistemas, ni el uso racional y eficiente de los recursos naturales. Las necesidades del mercado prevalecieron y los recursos naturales fueron considerados como inagotables, por ende, su explotación fue ilimitada. Aún más grave, la distribución de los beneficios generados por el uso de los recursos naturales no siempre fue justa, y algunos sectores de la sociedad no mejoraron su calidad de vida (Botero et al., 2003). El ganado, a través de su digestión en el rumen de forraje y granos, contribuye al calentamiento global con la emisión de metano, el segundo gas con efecto invernadero en importancia. Los animales rumiantes liberan a la atmosfera posiblemente 80 millones de toneladas de este gas por año directamente y otros 35 millones de toneladas indirectamente a través de los residuos orgánicos de estos animales que regularmente son amontonados. Estos desperdicios son desechados en medios privados de oxígeno, regularmente en lagunas formadas por aguas residuales y pilas de estiércol, los que producen metano durante su descomposición. La ganadería contribuye con el 15 a 20% de las emisiones globales de metano a nivel mundial, lo que corresponde a un 3% del calentamiento global (Villar Cleves, 2006). 1 Los rumiantes, principalmente los bovinos, ovinos y caprinos, son útiles en convertir una gran cantidad de recursos renovables provenientes del pastizal natural, pasturas y residuos de cosecha, u otros subproductos en alimento; recursos alimenticios que no pueden ser usados en forma directa por el hombre (Oltjen, 1986). Uno de los problemas más críticos que enfrenta el mundo es el manejo inadecuado de los residuos producidos, tanto en el sector rural, como en el urbano e industrial. Estos materiales habitualmente se eliminan sin un tratamiento previo, por lo que pueden constituirse en agentes contaminantes de considerable alcance; afectando a los ecosistemas, alterando el equilibrio ecológico y la calidad de vida. La producción ganadera genera desechos (excretas, fertilizantes, sobrantes de riego, agua de limpieza) que son altamente contaminantes debido a que contienen materia orgánica, microorganismos y nutrimentos (Decara et al., 2004), que al ser desalojados en estanques o ríos conlleva entre muchos otros problemas a la disminución del oxígeno disponible durante su descomposición y el aumento de contenidos de amonio en el agua. Esto provoca la muerte de la vida acuática y además, amenaza la vida terrestre al ser consumida el agua por personas, animales y plantas (Gigena y Tribaldos, 1998). La digestión anaeróbica, biodigestión o metanación se refiere al uso de procesos biológicos en un medio anaeróbico para romper cadenas de moléculas complejas en sustancias más simples (Lettinga y Van Haandel, 1993). La digestión anaeróbica puede considerarse como la forma más sencilla y segura de dar tratamiento a excrementos humanos y animales en zonas rurales (Brown, 1987). En este proceso la materia orgánica se degrada para producir metano, mediante un conjunto de integraciones complejas entre distintos grupos de bacterias. (Youngfu et al., 1989). 2 El biogás es una fuente renovable de energía y el efluente (material digerido) tiene una alta concentración de nutrimentos, bajo contenido de patógenos y se encuentra prácticamente libre de semillas viables de malezas (Brown, 1987; Marchaim, 1992). La situación actual del medio ambiente y la gran cantidad de desechos orgánicos que produce la industria ganadera nos impulsa a desarrollar y poner en práctica energías alternativas que nos permitan mantener un equilibrio entre el medio ambiente y el ser humano. El uso de biodigestores en las instalaciones ganaderas permite transformar un desecho que en este caso es el excremento de bovino en un recurso; este recurso nos sirve como sustrato para producir energía renovable en forma de biogás. 3 2. ANTECEDENTES 2.1 HISTORIA El proceso de la biodigestión anaeróbica ha sido conocido y aplicado desde la antigüedad, se utiliza para el curtido de los cueros, para la obtención del etanol y ácidos orgánicos, como el acido láctico, entre otros, pero era comprendido en razón de sus productos finales y no en función de sus procesos (Taylhardat, 1986). Las primeras noticias de la existencia de la fermentación anaeróbica fueron reportadas por Volta en el año de 1776. Este autor descubrió la formación de un gas combustible sobre pantanos, lagos y aguas estancadas y relacionó la formación de biogás con la cantidad de materia orgánica depositada en su fondo. (Moncayo-Romero, 2008). Luis Pasteur al presentar los trabajos de su discípulo Gayón concluyó que la fermentación de estiércol podría ser una fuente de energía para la calefacción e iluminación. (Medina, 1984). La aplicación de la biodigestión se inició antes del siglo XX cuando el biogás era quemado para dar iluminación en Inglaterra (Brown, 1987). En el año 1868 el biólogo inglés Antonio Bechamp definió las reacciones como constituyentes de un proceso microbiológico. La formula química del gas metano (CH4) fue descubierta por Amedeo Avogadro en el año de 1821. También se reporta que los ingleses, Dalton, Henry y Davy fueron los que desarrollaron en los años de 1804 a 1810 la composición química del gas metano. (Moncayo-Romero, 2008). Para el año de 1900 es puesto en funcionamiento el primer biodigestor en Bombay, India. Charles James utilizó el gas producido en el proceso para el funcionamiento de un motor (Guevara, 1996). En los años 1930s, se mantuvo un interés creciente en la aplicación de digestión anaeróbica, especialmente en zonas rurales, donde los productos de la digestión (biogás y efluente) pueden convertirse en productos aprovechables para los agricultores (Brown, 1987). 4 En Inglaterra, Donald Camerón perfeccionó el tanque séptico y utilizó el gas que se origina en el proceso como fuente de energía. En los EEUU de Norteamérica se empezó a investigar esta tecnología en Massachusetts, por intermedio del Dr. Louis P. Kunnincutt (Guevara, 1996). Generalmente, en la mayoría de los países latinoamericanos, el biogás ha tenido un uso limitado a la cocción de alimentos y calefacción de animales de granja. A pesar de esto, el uso del biogás en la sustitución de combustibles fósiles, para la generación de electricidad en motores de combustión interna ha cobrado importancia en los últimos años (Moncayo Romero, 2008). Actualmente, con los precios del petróleo, que llegaron a superar los 110 US dólares por barril ha impulsado a muchos países a encarar estudios sobre práctica de fuentes de energía que reemplacen los habituales combustibles derivados de sistemas convencionales no renovables y se ha iniciado la construcción de varias plantas de biogás en Chile, Honduras, República Dominicana, Ecuador, Brasil, Bolivia y Costa Rica entre otros (Moncayo Romero, 2008). 2.2 FUNDAMENTOS DE LA DIGESTIÓN ANAEROBIA El desarrollo de la bioquímica para satisfacer las altas demandas de solventes químicos que requería la Primera Guerra Mundial y el impacto de problemas sanitarios productos de ella, derivaron en el desarrollo acelerado de la microbiología de los procesos anaerobios que podría ayudar eficientemente a aportar soluciones que los procesos aeróbicos (asociados al oxigeno) no habían podido solucionar. Además, la creciente población mundial requería cada vez más fuentes de energía alternas que complementarán las ya existentes (Guevara-Vera, 1996). La biodigestión anaeróbica que inicialmente se había empleado para satisfacer la demanda de energía (requerimiento de combustible), en los últimos años ha venido demostrando su potencialidad para el tratamiento de los residuos y 5 excretas de origen domésticos y agropecuarios, importante contaminante del medio ambiente. La fermentación anaeróbica se ha convertido en una técnica aliada en la lucha contra la contaminación ambiental, especialmente en el área rural en donde los efluentes urbanos y agropecuarios son transformados en residuos inofensivos para el ecosistema, mejorando la calidad de vida de sus habitantes (FAO, 1986; citado por Guevara-Vera, 1996). La digestión anaeróbica es un proceso natural microbiano que ocurre en forma espontánea en la biomasa en ausencia de oxígeno. Genera una mezcla de gases principalmente metano y dióxido de carbono, conocido como biogás, y una suspensión acuosa (organilodo) que contiene los componentes no degradados o parcialmente degradados y restos inorgánicos inicialmente presentes en la biomasa. La digestión anaeróbica es un proceso complejo desde el punto de vista microbiológico, al estar enmarcado en el ciclo anaerobio del carbono, es posible, transformar la biomasa en ausencia de oxigeno en compuestos volátiles como el CO 2 , NH 3 , N2S, N2, CH4 y otros gases. Este proceso ocurre también con el denominado "gas de pantanos" que brota en aguas estancadas, el gas natural metano, en los yacimientos petrolíferos, así como en el gas producido en el tracto digestivo de los rumiantes (Moncayo-Romero, 2008). La digestión anaeróbica es un proceso natural, que corresponde al ciclo anaeróbico del carbono, por el cual es posible que mediante una acción coordinada y combinada de diferentes grupos bacterianos en ausencia total de oxigeno, éstos puedan utilizar la materia orgánica para alimentarse y reproducirse, como cualquier especie viva que existe en los diferentes ecosistemas. (Moncayo-Romero, 2008). Cuando se acumula materia orgánica, la cual está compuesta por polímeros, como carbohidratos, proteínas, lípidos, entre otros, en un ambiente acuoso, donde los microorganismos aerobios, actúan primero, tratando de alimentarse de este sustrato. Este proceso consume el oxígeno disuelto que pueda existir. Luego de esta etapa inicial, cuando el oxígeno se agota, aparecen las condiciones 6 necesarias para que la flora anaeróbica se pueda desarrollar consumiendo también la materia orgánica disponible. Como consecuencia del proceso respiratorio de las bacterias, se genera una importante cantidad de metano (CH4), dióxido de carbono (CO2) y trazas de nitrógeno (N2), hidrógeno (H2) y ácido sulfhídrico (H2S) (Moncayo-Romero, 2008). 2.3 ETAPAS DE LA DIGESTIÓN ANAEROBIA La degradación anaerobia de la materia orgánica requiere de la intervención de diversos grupos de bacterias facultativas y anaerobias estrictas, las cuales utilizan en forma secuencial los productos metabólicos generados por cada grupo (Cuadro 1). La digestión anaerobia de la materia orgánica involucra tres grandes tróficos y cuatro pasos de la transformación (Rodríguez, 2005). Cuadro 1. Etapas de la digestión anaeróbica 1. HIDRÓLISIS GRUPO I BACTERIAS HIDROLÍTICAS 2. ACIDOGÉNESIS GRUPO I BACTERIAS FERMENTATIVAS 3. ACETOGÉNESIS GRUPO II BACTERIAS ACETOGÉNICAS 4. METANOGÉNESIS GRUPO III BACTERIAS METANOGÉNICAS El proceso se inicia con la hidrólisis de polisacáridos, proteínas y lípidos por la acción de enzimas extracelulares producidas por las baterías del Grupo l (Fig. 1). Los productos de esta reacción son moléculas de bajo peso molecular como los azucares, los aminoácidos, los ácidos grasos y los alcoholes, los cuales son transportados a través de la membrana celular; posteriormente son fermentados a ácidos grasos con menor número de átomos de carbonos como los ácidos acético, fórmico, propiónico y butírico, así compuestos reducidos como el etanol, además 7 de H2 y CO2. Los productos de la fermentación son reducidos a acetato, hidrógeno y dióxido de carbono por la acción de la bacterias del Grupo II, las cuales son conocidas como “bacterias acetogénicas productoras de hidrógeno” (Rodríguez, 2005). Figura 1. Digestión Anaerobia (Madigan, 1997; van Haandel, 1994) Finalmente las bacterias del Grupo III o metanogénicas (Cuadro 2) convierten el acetato a metano y CO2, o reducen el CO2 a metano. Estas transformaciones involucran dos grupos metanogénicos que son los encargados de llevar a cabo las transformaciones mencionadas anteriormente: acetotróficas e hidrogenotróficas. En menor proporción, compuestos como el metanol, las metilaminas y el ácido fórmico pueden también ser usados como sustratos metanogénico (Díaz-Báez, 2002). 8 Cuadro 2. Clasificación de las metanobacterias. CLASIFICACIÓN DE LAS METANOBACTERIAS ORDEN FAMILIA GENERO ESPECIES Methanobacteriates Methanobacteriaceae Methanobacterium methanoformicicumt hanobryantil thermoautotropiphic methanoruminantium metnanoarboriphilus methanosmithil Methanobrevibacter Methanococcates Methanococcaceae Methanocoecus methanovannielii methanovoltae Methanomicrobiates Methanomicrobiaceae Methanogenium Methamisarcinaceae Methanospiellum Methanomicrobium Methanosarcina methanocaraci methanomarispigri methanohongatei methanomobile methanobarkerie (Balch, 1979; tomado de Guevara-Vera, 1996). Las tasas de crecimiento de las bacterias metanogénicas son cinco veces menores que las de la fase de acetogénesis, por ello, son las que limitarán el proceso de degradación anaerobia. Son también las que condicionarán el tiempo de retención de la biomasa en el digestor, así como la temperatura del proceso (Moncayo Romero, 2008). La conversión de acetato a metano aparece como un proceso ecológico muy importante en digestores de residuos y en medios anóxicos de agua dulce, donde no hay una competencia excesiva por el acetato con otras bacterias. A pesar de que la producción de metano está muy extendida, son pocos los compuestos de carbono que sirven como precursores directos de la metanogénesis. Por lo tanto, es un proceso que depende de la producción de esos compuestos por otros organismos, a partir de la materia orgánica compleja (Moncayo-Romero, 2008). En muchos ambientes anóxicos los precursores inmediatos del metano son el H 2 y el CO 2 que se generan por las actividades de los organismos fermentadores. En el proceso general de producción de metano a partir de la 9 fermentación de un polisacárido, como la celulosa, pueden intervenir hasta cinco grupos fisiológicos de procariotas. Las bacterias celulolíticas rompen la molécula de celulosa, de peso molecular elevado, en celobiosa y glucosa libre. Por acción de los fermentadores primarios, la glucosa origina ácidos orgánicos, alcoholes, H 2 y CO 2 . Todo el hidrógeno producido es consumido inmediatamente por las bacterias metanogénicas, las acetogénicas o las reductoras de sulfato si éste se halla en alta concentración. Además el acetato puede ser convertido en metano por otros metanógenos (Moncayo-Romero, 2008). Las metanobacterias sólo pueden multiplicarse cuando está avanzada la fermentación de los sustratos primarios por acción de las bacterias anaerobias facultativas, como son la Escherichia, Enterobacter, Klebsiella o Bacillus spp. y se haya consumido todo el oxígeno disuelto, de manera que el potencial redox haya alcanzado en un valor menor que -200 mV. Además, el pH no debe bajar demasiado, debido a que los ácidos producidos por los Clostridium, no puedan inhibir el crecimiento de los metanógenos (Moncayo Romero, 2008). 2.4 EL BIOGÁS El biogás es la mezcla de gases resultantes de la descomposición de la materia orgánica (Cuadro 3), realizada por acción de microorganismos (bacterias) en un medio anaeróbico (Zapata, 1998). Está compuesto principalmente por metano y dióxido de carbono, tiene un poder calorífico de 4500 a 6500 Kcal/m3. Un metro cúbico de biogás es el equivalente de 0.6 litros de gasolina o 0.58 litros de queroseno (IIT, 1987). 10 Cuadro 3: Propiedades del biogás CARACTERÍSTICAS DEL BIOGÁS PARÁMETROS CARACTERÍSTICAS Temperatura adecuada de operación 20 a 45º C Tiempo de retención 40 -100 días Contenido energético del biogás Unos 23000 kJ/m3 (6kWh). Aproximadamente la mitad que el gas natural. Generación de biogás Producción para un bovino 0.3 a 0.5 m3 de biogás por m3 de digestor/día. Entre 0.2 y 0.4 m3 de biogás por kg de biomasa seca. 9 a 15 kg estiércol/día= 0.4 m3 gas día. FUENTE: Dias da silva y Kreling, 2006. 2.5 EL METANO El metano presente en el biogás es considerado como un gas que aporta enormemente al calentamiento global. El gas metano es un gas con efecto invernadero (GEI) mucho más potente que el dióxido de carbón, con un potencial de calentamiento 21 veces mayor que el del CO2 (Moncayo-Romero, 2008). El metano es el principal componente del biogás (Cuadro 4), y le confiere la capacidad calorífica que este tiene. El valor energético del biogás, por lo tanto, estará determinado por la concentración de metano (Cuadro 5) el cual es alrededor de 20 a 25 MJ/m3, comparado con el gas natural que tiene de 33 a 38 MJ/m3 (Zapata, 1998) 11 Cuadro 4. Gases que conforman el biogás. COMPONENTES DEL BIOGÁS Componente Fórmula química Porcentaje (%) Metano CH4 60-70 Gas Carbónico CO2 30-40 Hidrógeno H2 1.0 Nitrógeno N2 0.5 Monóxido de carbono CO 0.1 Oxigeno 02 0.1 Acido sulfhídrico H2S 0.1 FUENTE: Botero y Preston 1987. Cuadro 5. Contenido de metano en el biogás con diferentes tipos de material Orgánico POTENCIAL DE PRODUCCIÓN DE METANO Material Excretas de bovino Estiércol de gallina Estiércol de cerdo Estiércol de equino Paja Pasto Hojas Desperdicio de cocina Algas Jacinto de agua Producción de metano (%) 65 60 67 55 59 70 58 50 63 52 FUENTE: Sasse, 1984. El metano, químicamente, está compuesto por un carbono ligado a cuatro hidrógenos (CH4). Es una molécula no polar, ya que sus elementos se neutralizan entre sí. Por ser una molécula muy pequeña la fuerza de atracción es pequeña y está limitada a las fuerzas de Van der Waals, que son débiles en este tipo de 12 molécula. Esto hace que estas fuerzas de atracción sean vencidas con facilidad por la energía térmica, de modo que la fusión y la ebullición se producen a temperaturas muy bajas (p.f. -183ºC, p.e.-161.5ºC). En consecuencia, el metano es un gas a temperatura ambiente (UNAM, 2000). La combustión de este hidrocarburo sólo se efectúa a temperaturas elevadas, como las que proporcionan una llama o una chispa. Sin embargo, una vez iniciada, la reacción desprende calor, que es suficiente para mantener la temperatura alta y permitir que la combustión continúe. La cantidad de calor que se genera al quemar un mol de un hidrocarburo a dióxido de carbono y agua se llama calor de combustión: para el caso del metano, el calor de combustión es de 213 Kcal (UNAM, 2000). 2.6 ÁCIDO SULFHÍDRICO (H2S) El ácido sulfhídrico (H2S) está contenido naturalmente en el petróleo crudo, gas natural, gases volcánicos y manantiales de aguas termales. También se puede producir como resultado de la degradación orgánica bacteriana. Es además producto de la fermentación de los desperdicios de animales y humanos. El ácido sulfhídrico también puede ser producido por actividades industriales, tales como el procesamiento de alimentos, fábricas de papel, curtidurías y refinerías de petróleo. (ATSDR, 2004). El H2S es un gas inflamable, incoloro, con un olor característico a huevos podridos. Se le conoce comúnmente como ácido hidrosulfúrico o gas de alcantarilla. La gente puede detectar su olor a niveles muy bajos (ATSDR, 2004). El ácido sulfhídrico, según Botero y Preston, 1987 es un compuesto que se encuentra en concentraciones próximas al 1% en el biogás, pero esta baja concentración es suficiente para que pueda ocasionar daños corrosivos severos a estructuras de metal o equipos. Por tal razón, para la utilización de biogás en motores, se debe tratar de disminuir la concentración de H2S en el biogás, por 13 medio de filtros o sustancias que puedan atraparlo. Si el uso del biogás es para cocina también debe ser eliminado el ácido sulfhídrico debido a su alto poder corrosivo sobre las tuberías de metal. (Dias y Kreling, 2006). El sentido del olfato lo detecta en concentraciones del orden de 0.1 ppm. Irrita los ojos y afecta los pulmones al hallarse en concentraciones superiores a las detectadas por el olfato (Anaya Durand, 2001). El H2S es extremadamente corrosivo para los metales usados en los contactos eléctricos y en los motores generadores de energía eléctrica. Asimismo, el H2S es corrosivo para el acero de las cañerías y recipientes que lo contienen, esta corrosión puede ser severa si el biogás transporta agua libre, y más aún si hay CO2 presente. El H2S reacciona con los óxidos de hierro del acero formando sulfuro de hierro. Cuando esta superficie atacada es puesta en contacto con el aire, el sulfuro de hierro se oxida formando nuevamente óxidos de hierro y azufre elemental, con gran liberación de calor. Este calor generado puede encender los materiales combustibles cercanos, como hidrocarburos (adaptado de Moncayo Romero, 2008). 2.7 RELACIÓN CARBONO-NITRÓGENO La composición del desecho utilizado en el proceso anaeróbico incide en la cantidad y calidad del biogás. Las bacterias formadoras de metano usan el carbono y el nitrógeno como sus principales fuentes de nutrición (Alkalay, 1997). Existen muchos criterios en lo referente a esta relación, en general es aceptable una proporción de C:N de 20-30:1. Las excretas de humanos y de animales son ricos en nitrógeno, con una relación C:N inferior a 25:1, durante la fermentación tienen una mejor velocidad de biodegradación y de generación de gas; en cambio los residuos agrícolas son ricos en carbono, con una relación C:N superior a 30:1, pero con un generación más lenta de gas en el proceso de digestión (Guevara Vera, 1996). En general la materia prima rica en carbono produce más gas que las ricas en nitrógeno. Así mismo, es más rápida la producción de gas a partir de materias 14 primas nitrogenadas (excretas), que las ricas en carbono (pajas y tallos). Mientras en los primeros 10 días de fermentación las materias nitrogenadas generan de 34 a 46% del total de gas producido, las ricas en carbono solo aportan el 9% (FAO, 1986). 2.8 TEMPERATURA La velocidad de las reacciones químicas y bioquímicas se incrementa normalmente cuando se eleva la temperatura. Para los digestores de biogás, esto es cierto dentro del rango de temperatura tolerado por los diferentes microorganismos, tales como las bacterias acetogénicas (Schimid y Lipper, 1969). Una temperatura muy alta puede causar una declinación en el ritmo metabólico del proceso, debido a la degradación de las enzimas que son esenciales para la vida celular. Los microorganismos tienen un crecimiento y ritmo metabólico óptimos dentro de un rango de temperatura muy bien definido, que es específico para cada especie bacteriana. Particularmente, el límite superior depende de la termoestabilidad de las moléculas de proteína sintetizadas por cada tipo particular de organismo (Dominguez y Ly, 2000). La variación de temperatura puede ser más importante que un valor fijo de temperatura como factor que influye en la estabilidad del proceso (Dague, 1968). Las bacterias metanogénicas son más sensibles a los cambios de temperatura que los otros microorganismos del digestor. Esto es debido a que la velocidad de crecimiento de los otros grupos bacterianos es mayor que la de las metanobacterias. Todos los microorganismos presentes en el biodigestor pueden resistir cambios variables de temperatura hasta un lapso de dos horas aproximadamente, y pueden retornar rápidamente a los ritmos normales de producción de gas cuando la temperatura se restablece. Sin embargo, cuando la temperatura cae numerosas veces o por un tiempo prolongado, esto puede conducir a un desbalance en la proporción del microorganismo y en última instancia a problemas con el pH (Gunnerson y Stuckey, 1986). 15 Se han detectado dos regiones de temperatura para la digestión de excretas (Gunnerson y Stuckry, 1986). El rango más frío es apropiado para la vida de las bacterias mesofílicas (de 20 a 45ºC) y el segundo rango es característico de bacterias termofílicas (de 35 a 55ºC). Una ventaja de una digestión termofílica es que el ritmo de producción de metano es aproximadamente el doble de una digestión mesofílica. Por consiguiente, los biodigestores termofílicos pueden tener la mitad del volumen de un mesofílico, y aun mantener así la misma eficiencia en el proceso de producción de biogás. 2.9 pH DEL MEDIO El valor optimo de pH esta en el rango de 6.6 a 7.6 (Youngfu et al., 1989). Los ácidos grasos de cadena corta (AGCC) que se producen durante el proceso de digestión reducen el pH en la fase líquida del digestor. Si las bacterias metanogénicas no pueden convertir a los AGCC tan rápidamente como son formados por las bacterias acetogénicas, los AGCC se acumularán y causarán un descenso en el pH del medio. Sin embargo, el equilibrio CO2:HCO3 en el digestor ejerce una resistencia sustancial a los cambios de pH (Domínguez y Ly, 2000). Hay dos modos operacionales para corregir una condición desbalanceada de bajos pH en el biodigestor. La primera forma es detener la carga del biodigestor y permitir durante cierto tiempo que la población metanogénica reduzca la concentración acídica y que entonces el pH se eleve a un valor razonable. Detener la carga del digestor también hace más lenta la actividad bacteriana y por lo tanto, también se reduce la formación de AGCC. Una vez que el pH retorna a valores normales, la carga o alimentación del digestor puede continuarse a niveles bajos e irla incrementando lentamente para evitar más caídas abruptas de pH (Domínguez y Ly, 2000). Un segundo método involucra la adición de sustancias tampones o buffer para elevar el pH sin cambiar el ritmo de carga del digestor. Una ventaja de la adición 16 de buffer es que el pH puede rectificarse más rápidamente. Se suele usar para ello la cal o carbonato de calcio. El carbonato de sodio, aunque es más caro, puede prevenir la precipitación de carbonato de calcio. Debido a que los requerimientos de sustancias varían con la naturaleza de los desperdicios a procesar, el sistema de operaciones y el tipo de proceso, se han desarrollado guías para calcular los requerimientos de sustancias buffer (Pohland y Suidon, 1978). 2.10 MICROORGANISMOS QUE NO PRODUCEN METANO Son una serie de microorganismos que convierten complejos productos orgánicos en compuestos de moléculas más sencillas y pequeñas. Participan numerosos y variados microbios anaerobios y facultativos, dependiendo su número y su variedad de los materiales de fermentación (Guevara Vera, 1996). Los microbios que no producen metano pueden clasificarse en tres grupos, bacterias, mohos y protozoos, entre los cuales tienen mayor importancia los primeros (Guevara Vera, 1996). Las bacterias no metanogénicas se clasifica en siete grupos, las que descomponen la celulosa, la semi-celulosa, las proteínas, las grasas, las que producen hidrógeno, otros microbios específicos como los Thivibros y las que emplean el acido láctico (Guevara Vera, 1996). En el grupo de los mohos se han aislado numerosos mohos y levaduras en la digestión anaerobia mediante el cultivo artificial, se llega a la conclusión de que estos organismos podrían participar en el proceso de la digestión, del cual obtendrían los nutrientes para producirse (Guevara Vera, 1996). Los protozoos también intervienen en este proceso, como son Plasmodium, flagelados y amebas, aunque consideran que podrían desempeñar un papel de menos importancias en el proceso (Guevara Vera, 1996). 17 En la digestión anaerobia la mayoría de las bacterias son no-metanogénicas, y tienen una gran importancias en el desarrollo del proceso anaeróbico, ya que las bacterias productoras de biogás no pueden aprovechar directamente los compuestos orgánicos a menos que estos hayan sido degradados y convertidos en compuestos más sencillos, de menor peso molecular, lo que se logra gracias a la acción de las bacterias no-metanogénicas (Guevara Vera, 1996). 2.11 SUSTRATOS Casi todas las materias orgánicas pueden emplearse para la fermentación. El hombre en la producción de biogás utiliza principalmente diversas aguas residenciales, aguas residuales de la industria liviana y alimenticia, los desechos municipales y diversos subproductos agrícolas (residuos de cultivos y excrementos humanos y de animales), además se aprovechan algunos cultivos energéticos. La composición química principal de estos recursos son polisacáridos, proteínas, grasas y pequeñas cantidades de metabolitos, la mayoría de ellos insolubles en agua. Los sustratos más utilizados para alimentar biodigestores son: Estiércol (bovinos, cerdos, ovinos, aves, conejos, entre otros) Residuos vegetales. Basura orgánica Contenido ruminal (obtenido de rastros y mataderos municipales). Desechos de comida. Desechos de la industria productora de alcohol y vinos. 18 2.12 ORGANILODO (BIO-FERTILIZANTE) El costo de los fertilizantes químicos y la contaminación que algunos producen al medio ambiente por su uso desmedido, han provocado la búsqueda de nuevos fertilizantes que sean de menor costo y tengan menor impacto ambiental. La fermentación anaerobia además de la producción de biogás, nos proporciona organilodo. El organilodo, en comparación con el excremento fresco no tiene mal olor, no atrae insectos y puede usarse directamente en los cultivos. Su composición en promedio tiene 8.5% de materia orgánica, 2.6% de nitrógeno, 1.5% de fósforo, 1.0% de potasio y un pH de 7.5 (Botero y Preston, 1987). El organilodo puede considerarse un buen fertilizante que puede sustituir o complementarse con los fertilizantes químicos (adaptado de Soria et al., 2001). Ventajas del organilodo (adaptado de Decara et al., 2004): • Debido a su pH, funciona como un corrector de la acidez, eliminando el aluminio toxico y liberando el fósforo de sus sales insolubles y hierro. • Evita la solubilidad y lixiviación excesiva de sales. • Estabiliza la aglomeración de partículas del suelo, logrando que resistan la acción disgregadora del agua. • Favorece el desarrollo microbiano. La intensa actividad bacteriana fija nitrógeno atmosférico. 2.13 BIODIGESTORES (REACTORES) Son recipientes o tanques cerrados herméticamente para proporcionar un ambiente totalmente anaerobio. Dentro de estos recipientes se degrada el sustrato mediante la fermentación y como producto tenemos el biogás. Estos 19 tanques cuentan con una cámara o espacio de aire para almacenar el biogás que se produce. Los puntos más importantes para el diseño y armado de los biodigestores son: (Gropelli y Grampaoli). Volumen de carga: representa el volumen total de material orgánico diluido con el agua necesaria, ya listo para ser introducido al biodigestor. Volumen del biodigestor: se define como el espacio ocupado por la biomasa en digestión, representa el volumen útil para realizar la biodigestión. Se expresa en metros cúbicos (m3). Tiempo de retención: indica el tiempo conveniente que debe dejarse el material dentro del biodigestor, para que éste pueda degradarse. Se calcula dividiendo el volumen (útil) del biodigestor por el volumen de la carga diaria, en consecuencia se expresa el valor en días. Volumen de gasómetro: indica el valor máximo de almacenamiento de biogás que puede contener este reservorio. Su capacidad dependerá de las necesidades particulares de cada proyecto en función de la distribución de los consumos diarios. Velocidad de carga: representa la cantidad de materia orgánica que se introduce por unidad de volumen de digestor por día. Se expresa como kilogramos de sólidos de biodigestor por día. Este parámetro es importante porque determina la capacidad del tratamiento de residuos del reactor y el rendimiento en biogás en función de la temperatura. 2.14 CLASIFICACIÓN DE BIODIGESTORES Los biodigestores tienen una clasificación general de acuerdo a su forma de operación (Cuadro 6). La fermentación en húmedo es la más utilizada en Europa 20 y Latino América. La fermentación en seco solo se aplica generalmente en procesos industriales, este término se refiere al porcentaje de MS del sustrato que se pone en el biodigestor. Este debe ser mayor o igual al 20%. La fermentación húmeda se refiere a digestores que procesan biomasa con un porcentaje de sólidos menor a 15% (Moncayo Romero, 2008). Actualmente, se utilizan dos sistemas principales de funcionamiento de biodigestores, los de flujo discontinuos o de carga en Batch y los de flujo continuo. Cuadro 6. Clasificación de los biodigestores. PROCESO DE PERCOLACION DISCONTINUO PROCESO EN TANQUES SECUENCIALES FERMENTACION EN SECO CONTINUO PRODUCCION DE BIOGAS DIGESTOR DE PVC, PROCESO EN TUNEL PROCESO CONTINUO CONTINUO ALMACENAMIENTO Y DESCARGA ALMACENAMIENTO Y DESCARGA CONTINUA FERMENTACION EN HUMEDO PROCESO EN LOTES DISCONTINUO PROCESO EN TANQUES SECUENCIALES PROCESO DE ALMACENAIENTO Digestores discontinuos o de carga en Batch: Se cargan una vez en forma total o por intervalos durante varios días. La descarga se efectúa cuando se ha degradado la totalidad de la materia orgánica y ya no se produce biogás. Es aplicable cuando se presentan problemas operativos (falta de personal) o cuando la materia orgánica no existe en forma continua. No requiere ninguna atención diaria (Moncayo Romero, 2008). 21 Digestores de flujo continuo: Este tipo de digestor es el más utilizado en Europa y en América Latina. Se cargan diariamente en forma periódica, la biomasa debe ser fluida y homogénea. Este tipo de digestores permite controlar la digestión, con el grado de precisión que se requiera. Permite corregir anomalías que se presenten en el proceso, permite manejar las variables relacionadas, carga específica, tiempo de retención y temperatura. Las operaciones de carga y descarga de biomasa y fertilizante no requieren ninguna operación especial (Moncayo Romero, 2008). Dentro de los digestores de régimen continuo se encuentra el tipo Taiwán, este digestor ha surgido como alternativa para la producción de biogás a un bajo costo, se usa como estructura bolsas tubulares de polietileno (Pound et al., 1981). También se encuentra el tipo Chino, es un digestor de cúpula fija en forma cilíndrica, enterrados con cámaras de hidropresión. La estructura puede ser de hormigón, de ladrillos o adobes, se le puede adicionar el gasómetro. Este digestor por estar enterrado favorece el proceso fermentativo con poca influencia por los cambios de temperatura, la desventaja que presenta es que la presión del gas es variable dependiente del volumen acumulado (Guevara Vera, 1996). 22 3. JUSTIFICACIÓN Las actividades realizadas por el hombre han causado un impacto negativo en el medio ambiente por no utilizar prácticas que no dañen los recursos naturales. Este proyecto tiene la finalidad de utilizar la biodigestión como una alternativa para hacer uso de la gran cantidad de desechos orgánicos que son producidos por la ganadería y con esto reducir la contaminación ambiental por emisiones de metano, malos olores e insectos transmisores de enfermedades debido al mal uso de los desechos orgánicos. 23 4. HIPÓTESIS 1. La biodigestión anaeróbica de excretas de bovinos produce biogás para cocinar en una estufa casera. 2. La combinación de heces de bovinos con desperdicios de pasto aumenta la producción de biogás. 3. Los residuos de la biodigestión son una posible fuente de fertilizante orgánico. 24 5. OBJETIVOS 5.1 OBJETIVO GENERAL: Evaluar el potencial de la producción de biogás en un bio-reactor alimentado con desperdicio animal (excremento de bovino) y vegetal (desperdicio de pasto) como fuente de energía renovable, que además disminuya la materia orgánica en descomposición en las empresas ganaderas. 5.2 OBJETIVOS ESPECÍFICOS: 1. Medir la producción de biogás de los biodigestores. 2. Determinar la descomposición de la materia orgánica, midiendo la composición del afluente y del efluente (organilodo) del biodigestor. 3. Desarrollar un sistema alternativo para reducir la contaminación ambiental por metano y materia orgánica en descomposición con bio-reactores económicos en las empresas ganaderas. 4. Analizar el uso del organilodo (efluente) como posible fuente de fertilizante orgánico. 25 6. MATERIALES Y MÉTODOS 6.1 Localización: El presente estudio se realizó en la Posta Zootécnica “Torreón del Molino” (PZTM) localizada en la Carretera Federal Veracruz-Xalapa km 14.5, Colonia ProgresoTejería, dependiente de la Facultad de Medicina Veterinaria y Zootecnia de la Universidad Veracruzana. El clima de la región registra una temperatura media anual de 25.3ºC, siendo la temperatura máxima de 40º C, y la mínima de 17º C, precipitación anual acumulada de 1750 mm. Los vientos dominantes del norte y noroeste son de 30 a 40 km/h, los cuales pueden alcanzar rachas arriba de los 100 km/h. 6.2 Instalación y diseño de los biodigestores: Los biodigestores se instalaron en mayo del 2009 en un terreno adyacente a la sala de ordeña de la PZTM, este terreno era utilizado para depositar las excretas y basura orgánica de las vacas de ordeña sobre la superficie de una manera desordenada. Los cinco biodigestores de 5 m3 fueron enterrados en una fosa de 2 m de ancho x 11 m de largo, quedando la parte superior del biodigestor a el nivel del suelo, ubicados en paralelo uno al lado del otro. Los biodigestores usados para el experimento son de flujo continuo y fueron construidos a partir de tinacos de plástico reforzados para agua, con capacidad de 5,000 L. Los biodigestores fueron diseñados de tal manera que el 75% del volumen del tinaco sea para la fase líquida y el volumen de almacenamiento para el biogás fuera del 25%. Las características del biodigestor que ser quería era que tuviera una carga de materia orgánica en base seca (MOS) entre 1.0 y 2.0 kg/m3, un tiempo de retención (TR) de esta MOS entre 30 y 50 días, y finalmente un contenido de materia seca (MS) del influente entre 5 y 10%. Primeramente se determino cuantas heces se producían en la ordeña de la PZTM mientras las vacas se estaban ordeñando, ya que el resto del tiempo las vacas están en los potreros y se hace imposible o cuando menos impráctico recoger estas heces. Se determinó que se producían entre las 30 vacas de ordeña una cantidad promedio de 250 kg de heces por día; esta cantidad se dividió entre 5, ya que es el número 26 de biodigestores que se desea instalar con fines de hacer investigación, dio como resultado que se diseñara cada biodigestor para 50 kg de heces frescas. Se obtuvo la materia seca y la materia orgánica en BS promedio que fueron de 13% y 80% respectivamente, para estimar la cantidad de MOS. Con la información anterior se obtiene una cantidad de 6.5 kg MOS, que viene siendo la carga de materia orgánica seca. Para lograr la carga de MOS deseada el volumen necesario para la fase liquida del biodigestor debe estar entre 3.25 y 6.5 m3, esto representaría el 75% del biodigestor, este tendría un volumen total entre 4.3 y 8.7 m3, por supuesto entre más chico sea el biodigestor mas económico será. El siguiente factor que hay que estudiar es la cantidad de agua que se tendrá que añadir y por último verificar si se obtiene el tiempo de retención deseado, y si no, se tendrán que hacer los ajustes necesarios para estar en los rangos adecuados. Como la materia seca (MS) de las heces es de 15%, hay que añadirle agua para bajar esta MS entre el rango deseado (5 a 10% de MS). Se determino que se añadiría 37.5 kg de agua fresca, que es la necesaria para lavar el registro de entrada del biodigestor, esto da un porcentaje de MS de 7.43% de MS, que está en el rango adecuado; esto se obtiene de dividir la MS que es 6.5 kg entre el peso total 87.5 kg. Finalmente se va a verificar el tiempo de retención de la biomasa en el biodigestor, sí la fase liquida del biodigestor es de 3,750 L (75% de un biodigestor de 5,000 L), el tiempo de retención es de 43 días, esto indica que esta en el rango adecuado; esto se obtiene de dividir el volumen de la fase liquida (3,750 L) entre el volumen que se añade diariamente (87.5 L). Finalmente se determina que se van a usar cinco biodigestores con un volumen total de 5,000 L cada uno, con un volumen para la fase liquida de 3,750 L (75%) y 1,250 L (25%) para almacenamiento del biogás. 27 6.3 Construcción de los reactores: Para la construcción de los bio-reactores se utilizaron cinco tanques de plástico o tinacos para agua, cada uno con una capacidad de 5,000 litros. Los tanques se adquirieron sin el orificio de la tapa, esto con el fin de poder instalar una tapa de acrílico. A cada tanque se le perforó a 0.5 y un metro de la base del tanque, dos orificio de 15 cm de diámetro en lados opuestos por donde se introdujeron un tubo de PVC de 6” de 1.5 m del largo. Estos tubos se soldaron al tanque con un cautín y plástico derretido. Después de endurecido el plástico se le puso fibra de vidrio, para darle rigidez y firmeza. En la parte superior del tinaco se hizo un orificio de 50 cm de diámetro y se dejó un borde de 5 cm en donde se fija la tapa de acrílico con silicón y 36 tornillos de acero inoxidables. En la tapa de acrílico se instaló la salida del gas con un conector y manguera industrial de 19 mm de diámetro. Adicionalmente se le adapto una llave de paso (plástico) y un filtro para eliminar el H2S (ácido sulfhídrico) del biogás. El material para el filtro de H2S es el siguiente: 1) 50 cm de manguera de 50 mm de diámetro, 2) dos reductores de PVC de 50 mm a 19 mm, 3) dos coples de PVC de 19 mm, 4) un adaptador para manguera con rosca de 19 mm, 5) 14 cm de tubo de PVC de 19 mm, 6) viruta de fierro de talleres donde trabajan con tornos, y 7) pegamento de PVC. El material para la elaboración de las tapas de acrílico de los biodigestores es: 1) hoja de acrílico transparente de 3 mm de espesor, 2) pegamento silicón (sika bon®), 3) un cople de PVC de 19 mm, 4) un adaptador para manguera con rosca de 19 mm diámetro. Adicionalmente cada reactor consta de una obra civil que consiste en dos registros de mampostería de 80 cm x 80 cm en cada lado y 60 cm de profundidad por donde se añaden las heces y por donde sale el organilodo. 28 6.4 Material de laboratorio: El equipo y material de laboratorio que se utilizó es el siguiente: 1) Termómetro para laboratorio con bulbo del mercurio Brannan ® -10º C a 220ºC., 2) medidor de pH Orion ® Modelo 230 Aplus, 3) bascula tipo reloj de 20 kg, 4) medidor de gas WIZIT® Modelo: K6-35, 5) balanza analítica OHAUS ®, 6) vasos de precipitado de 100 ml, 7) charolas de aluminio, 8) cubeta de plástico de 20 L, 9) estufas de secado, 10) molino Thomas-Wiley. Laboratory Mill, model 4. Arthur H. Thomas Company, Philadelphia, PA., USA, 11) bolsas de polietileno, 12) marcador para identificar las muestras, 13) papel de China, 14) cucharas desechable, 15) ácido sulfúrico al 96%, 16) probeta de 50 ml, 17) mezcla digestora (Na2SO4, CuSO4.5H2O), 18) digestor Kjeldahl büchi K-435, 19) guantes de carnaza, 20) agua destilada, 21) destilador Kjeldahl Büchi K-314, 22) ácido Bórico al 4%, 23) matraz Erlen Meyer de 250 ml, 24) hidróxido de sodio (NaOH) al 32%, 25) solución indicadora (alcohol etílico, rojo de metilo y azul de metileno), 26) ácido clorhídrico, 27) bureta de 25 ml, 28) soporte para bureta, 29) calculadora, 30) balanza granataria, 31) desecador, 32) pinzas. 6.5 Variables experimentales: El experimento se diseño en bloques completos al azar con dos tratamientos y dos repeticiones. El tratamiento A consistió de 50 kg de heces frescas (6.5 kg de heces en MS) más 37.5 L de agua; y el tratamiento B consistió de 30 kg de heces frescas (3.9 kg de heces en MS) más 3.2 kg de pasto desecho de los comederos (2.5 kg de pasto en MS) y 54.3 L de agua. Las excretas utilizadas eran frescas, recolectadas todos los días de la sala de ordeña. Se utilizó agua de la red de distribución interna de la PZTM. La condición micro-climática era similar entre los dos tratamientos. Los biodigestores tuvieron un periodo de adaptación de tres semanas. 29 6.6 Variables de respuesta: La fase de trabajo de campo tuvo una duración de 9 semanas, iniciando el 01/11/09. Las heces de las vacas de ordeña y el pasto de desecho de los comederos de estas mismas vacas, se muestrearon cada semana inmediatamente antes de introducirlo a los biodigestores para obtener valores de proteína cruda, celulosa, hemicelulosa, lignina, cenizas, materia seca y orgánica que tenían. Las variables de respuesta que se tomaron en el siguiente experimento fueron: 1) cantidad de biogás producido, 2) la temperatura dentro del biodigestor, 3) el pH del organilodo o efluente, y 4) la proteína cruda, celulosa, hemicelulosa, lignina, cenizas, materia seca y orgánica del organilodo. Con esta información se obtuvo la cantidad de materia orgánica que se introdujo a los biodigestores, así como la cantidad que salía en forma de organilodo y determinar la cantidad de material digerido en los biodigestores. Las muestras del afluente y efluente (organilodo) fueron tomadas de la entrada y salida de los biodigestores (Fig. 2). Figura 2. Puntos donde se tomaron las muestras para ser analizadas. 30 6.7 Análisis de laboratorio: Determinación de la materia seca (MS). Este método determina el porcentaje de agua y materia seca que contiene la muestra. El procedimiento es el siguiente: en una charola de aluminio se pone a secar la muestra (excremento, organilodo) durante 10 minutos en la estufa a 105°C, posteriormente se pone en el desecador durante 3 minutos para enfriarla y finalmente se pesa en la báscula analítica. Se deposita 2 g de muestra y se vuelve a meter en la estufa durante 24hr a una temperatura de 95 a 105 °C. Se considera la humedad como la pérdida de peso. El material seco puede utilizarse para la determinación de cenizas. Calculo: Porcentaje de MS= ((PChMS-PChV)/(PChMF-PChV))*100, Donde: PChMS = Peso de la charola con la Muestra Seca PChV = Peso de la charola vacía. PChMF = Peso de la charola con la Muestra Fresca Determinación de materia mineral o cenizas Este método cuantifica el material mineral total de alimentos, el procedimiento es el siguiente: Se introduce un crisol de porcelana a la estufa a una temperatura de 100 °C durante 20 minutos, se retira el crisol de la estufa y se transfiere al desecador por 3 minutos y se pesa. Posteriormente se pesa 2 g aproximadamente de la muestra en el crisol, se lleva a la mufla para calcinar durante 8 hrs precalentada entre 550 a 600 °C. Enfriar el crisol en el desecador por 3 minutos, pesar y calcular el porcentaje de cenizas. Calculo: Porcentaje de ceniza = ((PCMS-PCV)/(PCMF-PCV))*100, Donde: PCMS = Peso del crisol con la Muestra Seca 31 PCV = Peso del crisol vacío. PCMF = Peso del crisol con la Muestra Fresca Determinación de Proteína Cruda (Método de Kjeldahl). Este método determina el nitrógeno total, en forma de amonio, de los alimentos sin diferenciar si provienen de proteína verdadera o de otra fuente proteica. En las condiciones en que se realiza la prueba no determina el contenido de nitrógeno en forma de nitratos o nitritos. Método: A) Preparación de la muestra. 1. Pesar la muestra que se va analizar (0.5g). Colocar en la balanza analítica un trozo de papel (calca o china) de 8 x 8 cm aprox. y tarar la balanza a cero (0.0000), pesar la cantidad indicada de la muestra. Una vez realizada esta operación, cuidadosamente envolver con el papel todo el contenido, teniendo suma precaución de no tirarlo, asignar un nombre o en su caso un numero a cada muestra para su identificación. Anotar los pesos de cada muestra que se vaya a analizar. Es importante que al llevar a cabo esta técnica se realice un análisis “blanco” con el papel que estamos pesando la muestra. 2. Una vez que la muestra está pesada y envuelta en el papel, se coloca dentro de uno de los tubos del digestor (Kjelhahl), teniendo en cuenta el número del tubo y el de la muestra. 3. Aplicar acido sulfúrico concentrado (H2SO4 93 al 96 %QP) a la muestra. Medir 20 ml de H2SO4 concentrado y verter dentro del tubo del digestor con mucho cuidado y resbalando el ácido por las paredes del mismo, una vez realizado este paso, colocar los tubos dentro de su gradilla. Realizar este pasó con mucha precaución, ya que se están empleando sustancias peligrosas. 32 4. Mezcla digestora. Ya que se le aplicó el ácido a la muestra, se le agrega una cucharadita de mezcla digestora (6 g aprox.) dentro del tubo. B) Digestión. Es de suma importancia mencionar que esta técnica, realizada con este equipo (Kjeldahl), se debe realizar en una campana de extracción, así como el uso obligatorio de bata, guantes y gafas de seguridad. 5. Encendido del equipo (Kjeldahl). Una vez conectado al regulador de voltaje a 220 voltios, se enciende el equipo. Posteriormente se enciende una o ambas parrillas en el nivel 10 de temperatura, así se mantendrá el equipo durante 5 minutos aprox. Una vez que el equipo se calentó se disminuye la temperatura a nivel 1 o 2, dependiendo de la materia para digestión. 6. Colocación de los tubos en el digestor (Kjeldahl). Con las muestras dentro de los tubos, éstos se colocan en la gradilla de seguridad, se colocan dentro del digestor. Una vez realizado esto, colocar el módulo de absorción, posteriormente se colocan los seguros, así como las mangueras por donde circula el vapor. 7. Temperatura y tiempo de digestión. Ya colocados y asegurados los tubos dentro del digestor, este se va a encender en la temperatura máxima (9), en este momento se va a cerrar la ventana de la campana de extracción, esperar unos minutos a que empiece a salir humo blanco de los tubos, si el humo es muy abundante y se fuga de la campana, será necesario reducir un poco la temperatura (7), observar si el humo disminuye aumentar la temperatura nuevamente. Este proceso dura alrededor de 60 minutos o cuando las muestras dentro de los tubos presenten una coloración azul claro o verdosa, este será el momento de apagar el equipo. Después que la muestra se haya vuelto clara se prolongara la ebullición unos 15 minutos más. Si se realizaron varias muestras a la vez, será necesario que todas presenten la misma coloración. 8. Enfriar la muestra. Ya que se apago el equipo, esperar 5 minutos aprox. Para que la muestra se enfrié dentro del equipo, transcurrido este tiempo, quitar 33 los seguros, así como la parte superior del equipo, esperar 5 minutos más. Después se retiran los tubos del digestor, se colocan sobre las gradillas de seguridad, esperar a que enfríen. Un indicador de que la muestra ya está en una temperatura que se puede maniobrar es cuando esta se empieza a cristalizar. Todo este proceso debe realizarse dentro de la campana de extracción. 9. Diluir el H2S04 de la muestra. Medir 50 ml de agua destilada y verter dentro del tubo de la muestra cuidadosamente, agregando poco a poco el agua por las paredes del tubo. Evitar agregar el agua bruscamente por que puede ser peligroso. Este paso se realiza con la finalidad de amortiguar un poco la reacción acido-álcali que se lleva a cabo en la destilación. C) Destilación. Antes del uso de este equipo, supervisar que este abierta la llave de paso de agua de enfriamiento y revisar que los tanques de hidróxido de sodio (NaOH) y agua destilada no estén vacios. Cabe mencionar, que es importante enjuagar el equipo entre cada muestra para limpiar de posibles residuos, esto se llevara a cabo con 150 ml aprox. de agua destilada. 10. Aplicación de NaOH a la muestra. El tubo que contiene la muestra se va a colocar dentro del destilador, se le agrega NaOH muy lentamente, hasta llegar a 150 ml aprox., esto basándonos en la graduación del equipo. 11. Captación de Nitrógeno (N). En el tubo de salida del destilado se coloca un matraz con 50 ml de solución de acido bórico. Es de mucha importancia que todo el tubo de salida quede dentro de la solución, ya que este captura el N2, si la pipeta no se encuentra dentro de la solución podemos tener pérdidas de N2. 12. Encendido del equipo. El destilador se encenderá por el tiempo que sea necesario para tener un volumen de 150 ml aprox. En este momento, se apaga el destilador y se enjuaga con agua destilada. 34 D) Titulación. Esta se realizara con una solución de acido clorhídrico a 0.1 normal. 13. Solución indicadora y titulación. Luego de que la destilación se ha realizado, en el matraz se le colocan 3 gotas de la solución indicadora (rojo de metilo-verde de bromocresol) y se agita para obtener una mezcla uniforme de color rosa (6.67 ml solución indicadora por 1 litro de acido bórico). Posterior a este paso se calibra la bureta de titulación con 25 ml de solución de acido clorhídrico al 0.1 normal, luego se van agregando poco a poco las gotas del acido y se agita el matraz constantemente hasta que la solución de acido bórico cambie de color (canela-durazno). Luego de que ha cambiado de color, se anotan los mililitros de acido clorhídrico que se usaron para realizar el cálculo de Nitrógeno de la muestra. 14. Ecuación. %N = (ml HCl de la muestra-ml HCl del blanco) x N del HCl x 1.4/peso de la muestra (g) %PC = %N x 6.25 Determinación de Fibra Detergente Neutro (FDN) con la tecnología ANKOM. Procedimiento: Pesar bolsas filtrantes (P1), ANKO F57, no presecar las bolsas, estas deben ser corregidas por un blanco, marcar las bolsas con marcador resistente a solventes. Pesar de 0.45 a 0.55 g de muestra (P2) directamente en la bolsa filtrante, sellar con calor cada bolsa. Pesar una bolsa blanco e incluirla en la corrida para determinar blanco de corrección (C1). Colocar un máximo de 24 bolsas en el suspensor, adicionar 1900-2000 ml de solución detergente neutro (Lauril sulfato de sodio, Acido etilendiaminotetraacetico, Hidróxido de sodio, Borato de sodio, 35 Fosfato disódico anhidro, Etilenglicol monoetil eter) a la temperatura ambiente en el recipiente del analizador de fibra. Encender el agitador, la temperatura, el tiempo (75 min) y cerrar el equipo. Al final de la extracción apagar la agitación y la temperatura. Abrir lentamente la válvula de drenaje hasta retirar la solución, abrir el equipo. Cerrar la válvula, adicionar 1900 ml de agua destilada (70 a 90ºC), agitar y lavar por 5 min. repetir estos lavados tres veces más. Retirar las bolsas, retirar el exceso de agua. Colocar las bolsas en un vaso de precipitado, adicionar acetona hasta cubrirlas por 3 a 5 min. Retirar las bolsas de la acetona, colocarlas en un escurridor. Completar el secado en la estufa a 102 + 2ºC, de 2 a 4 horas. Colocar las bolsas en desecantes y pesar (P3). Cálculos: %FDN = (P3 – (P1 X C1)) P2 X 100 Donde: P1 = Peso de la bolsa filtrante. P2 = Peso de la muestra inicial. P3 = Peso de la muestra al final del proceso de FND. C1 = Bolsa blanco. Determinación de Fibra Detergente Acido (FDA) con la tecnología ANKOM. Procedimiento: Pesar bolsas filtrantes (P1), ANKO F57, no presecar las bolsas, estas deben ser corregidas por un blanco, marcar las bolsas con marcador resistente a solventes. Pesar 0.45 - 0.55g de muestra (P2) directamente en la bolsa filtrante, sellar con calor cada bolsa.-Pesar una bolsa blanco e incluirla en la corrida para determinar blanco de corrección (C1). Colocar un máximo de 24 bolsas en el suspensor, adicionar 1900-2000ml de solución detergente acido (Acido sulfúrico, Bromuro cetyl trimetil amonio ) a la temperatura ambiente en el recipiente del analizador de 36 fibra. Encender el agitador, la temperatura, el tiempo (60 min) y cerrar el equipo. Al final de la extracción apagar la agitación y la temperatura. Abrir lentamente la válvula de drenaje hasta retirar la solución, abrir el equipo. Cerrar la válvula y adicionar 1900ml de agua destilada (70-90ºC), agitar y lavar por 5 min, repetir estos lavados tres veces más. Retirar las bolsas, retirar el exceso de agua. Colocar las bolsas en un vaso de precipitado y adicionar acetona hasta cubrirlas por 3-5 min. Retirar las bolsas de la acetona y colocarlas en un escurridor. Completar el secado en la estufa a 102 + 2ºC, de 2 a 4 horas. Colocar las bolsas en desecantes y pesar (P3). Cálculos: %FDA = (P3 – (P1 X C1)) P2 X 100 Donde: P1 = Peso de la bolsa filtrante. P2 = Peso de la muestra inicial. P3 = Peso de la muestra al final del proceso de FAD. C1 = Bolsa blanco. Determinación de Lignina por el método del Acido Sulfúrico con la tecnología ANKOM. Reactivos: Acido Sulfúrico (72% por peso). Mezclar manualmente para estandarizar el H2SO4 grado reactivo a una gravedad específica de 1634 g/L a 20ºC o 24.00N: Adicionar 1200 g H2SO4 a 440 ml de agua destilada en un matraz volumétrico de 1 L previamente tarado a 20ºC en baño de hielo. Estandarizar esta solución a una gravedad especifica de 1634 g/L a 20º C, removiendo o adicionando agua o H2SO4 según sea requerido. 37 Procedimiento: Seguir mismo procedimiento para FDA, después de la determinación de FDA, colocar las bolsas en un vaso de precipitados de 3 L y adicionar suficiente cantidad de H2SO4 al 72% (aproximadamente 250 ml) para cubrir las bolsas. IMPORTANTE. Las bolsas deben estar completamente secas a temperatura ambiente antes de adicionar el ácido concentrado. Si hay humedad presente en las bolsas, se generara calor por la reacción del H2SO4 en el agua, afectando los resultados. Colocar dentro del vaso precipitado de 3 L con las muestras, un vaso precipitado de 2 L para ayudar a sumergir y agitar las bolsas. La agitación se realizara al inicio y cada 30 minutos unas 30 veces. Después de 3 horas retirar el H2SO4, lavar con agua, repetir los lavados hasta obtener un pH neutro. Lavar con 250 ml de acetona por 3 minutos para remover el agua. Nota: No colocar las bolsas en la estufa hasta que toda la acetona se haya evaporado completamente. Secar en estufa a 105º C por 2 a 4 horas. Retirar las bolsas de la estufa y colocarlas directamente en bolsas de cierre fácil con desecante y remover el aire. Enfriar a temperatura ambiente y pesar (P3). Colocar la bolsa en crisol de porcelana 30 ó 50 ml) previamente tarado, calcinar a 525º C por 3 horas o más, enfriar, calcular pérdida de peso (P4). Calcular blanco de corrección para cenizas (C2) usando pérdida de peso por ignición y los pasos secuencialmente durante la corrida desde FDA y lignina. Cálculos: % Lignina Acido Detergente = (P3 – (P1X C1)) X 100 P2 % Lignina Acido Detergente = ((P3 – (P1X C1)) X 100 (En base a Materia Seca) P2 X MS % Lignina Acido Detergente = ((P4 – (P1X C2)) X 100 38 (En base a Materia Orgánica) P2 X MS Donde: P1 = Peso de la bolsa filtrante. P2 = Peso de la muestra inicial. P3 = Peso de la muestra al final del proceso de Lignina. P4 = Peso de ceniza. C1 = Bolsa blanco. C2 = Bolsa blanco para ceniza. MS = Peso en Materia seca. 6.8 Análisis estadístico: Para el análisis de las variables de respuesta se utilizó un diseño experimental en bloques completos al azar con dos tratamientos y dos repeticiones, con el siguiente modelo: Yijk = µ + Ti + Bj + eijk Donde: Yijk= Es la variable de respuesta µ= Es la media general Ti = Es el iesimo efecto del tratamiento, y Bj = Es el jesimo efecto del bloque, y eijk = Es el error experimental El análisis estadístico se realizó utilizando el paquete SAS 2001 y las medias de las variables de respuesta se compararon usando la prueba de Duncan. 39 7. RESULTADOS Y DISCUSIÓN Producción de biogás La producción de biogás se evaluó mediante la medición del volumen del biogás (litros) producido por día con un medidor de gas. La lectura del volumen se realizó diariamente durante todo el experimento. La Fig. 3 muestra la producción de biogas de los dos tratamientos, con este resultado se puede inferir que la combinacion de pasto más heces produce más biogás (98,474 L), el utilizar heces produjo (45,800 L). Figura 3. Producción total de biogás generados por cada tratamiento. Produccion Total de Biogás 100,000 a 90,000 80,000 70,000 Litros 60,000 b 50,000 40,000 30,000 20,000 10,000 0 Tratamiento Literales distintas muestra diferencia estadística (P<0.01) El biogás producido se utilizó para suministrar combustible a una estufa que se encuentra a un costado de la sala de ordeña, en la cual los empleados del lugar pueden hervir agua y cocinar sus alimentos. Se realizaron mediciones del biogás que era consumido por la estufa, obtuvimos resultados de 8.3 litro de biogás por minuto de llama de la estufa. Por lo que la producción de gas (Fig.4) alcanza para 40 utilizar una estufa en promedio 3.2 horas/día con el tratamiento de heces más pasto y 1.5 horas/día con el tratamiento de solamente heces. Es importante mencionar que en el experimento no se contaba con ningún tanque o bolsa de almacenamiento para el biogás producido, solo se almacenó 1,250 L dentro de cada reactor. La disminución de las horas de biogás a través de las semanas se debe a la disminución de la temperatura, ya que la semana 1 corresponde a una temperatura promedio dentro del reactor de 27.5º C, la última semana a 24.0º C, esto demuestra lo sensibles que son a la temperatura las bacterias metanogénicas dentro de los reactores (Cuadro 7). Figura 4. Producción de horas/biogás para alimentar una estufa de un solo quemador con un gasto de biogás de 8.3L/min. Horas estufa por dia Heces + Pasto Heces 1.6 Estufa (hora) 1.4 1.2 1.0 0.8 0.6 0.4 0.2 0.0 1 2 3 4 5 6 7 8 9 Semana La materia orgánica (MO) contiene todos los compuestos orgánicos que pueden convertirse en metano, las excretas de animales suelen tener una concentración por encima del 10%. Puesto que los requerimientos de operación de un reactor anaerobio establecen que el contenido de MS en la carga no puede exceder este valor de 10%, en muchos casos, los desperdicios de la granja deben diluirse antes de cargar el biodigestor (Loehr, 1994). 41 Las heces que se utilizaron durante el experimento tenían el 15% de materia seca (MS), este valor está por encima del rango deseado (5-10% de MS). Se determino agregarle 37.5 de agua, con esto tenemos un porcentaje de MS de 7.43%, lo que está dentro del rango, esto se obtiene de dividir la materia seca (MS) que es 6.5 kg entre el peso total 87.5 kg. Fernández reporta una producción de 300 L de biogás por kilogramo de excremento (MS); Moncayo Romero registra una producción de 370 L de biogás por kilogramo de estiércol con restos de pasto y una producción de 280 para el estiércol sin restos de pasto. Los resultados de este trabajo están por debajo de los resultados de otros autores, debemos de tomar en cuenta que la temperatura y el pH son dos factores que determinan la producción de gas, el trabajo se realizo en los meses de noviembre y diciembre en donde la temperatura ambiente desciende, este factor en conjunto con un colapso en la producción de biogás a partir de la semana 3 provocado por una sustancia (no identificada) que ingreso a los reactores junto con las heces nos lleva a obtener estos resultados. Figura 5. Producción de biogás por kilogramo de Materia Orgánica Seca (MOS). Produción biogás/kg MOS Biogás/kg MOS (L) Heces+Pasto Heces 400 350 300 250 200 150 100 50 0 1 2 3 4 5 6 7 8 9 Semana 42 Temperatura La temperatura afecta considerablemente la producción de biogás ya que las bacterias metanogénicas son muy sensibles a la temperatura. Es importante monitorear este factor para un buen funcionamiento del biodigestor. En Alemania como otros países fríos, todos los reactores cuentan con tuberías internas que circulan agua caliente para mantener la temperatura constante dentro del reactor y no baje las actividades de las bacterias metanogénicas. Esta agua caliente es generada con el mismo biogás que producen los reactores, siendo más eficiente, , por lo que se considera como una co-generación de energía, esta no se desperdicia. La temperatura interna promedio de los reactores fue de 26.5ºC para el tratamiento A (heces solamente) y de 26.4ºC para el tratamiento B (heces + pasto), por lo que no hubo diferencia entre reactores (P>0.05); sin embargo si hubo una marcada disminución en la temperatura a través del tiempo bajando la temperatura 3.5º C, de la primera semana a la última, factor que afecto grandemente la producción de biogás (Cuadro 7). Botero menciona que las temperaturas óptimas de funcionamiento de los biodigestores son entre 30º C y los 60º, siendo 30º C a 40º C para las bacterias mesofílica y 55º C a 60º C para las termofílicas. En la situación de la región central del Estado de Veracruz, la temperatura nunca llega a bajar considerablemente, tampoco se obtuvo la temperatura óptima de 30º a 40º C. La producción de biogás se podría aumentar si pudiéramos controlar la temperatura (calefacción interna) para que se mantuviera en el rango óptimo, pero aumentaría los costos de los biodigestores; se tendría que analizar si el beneficio de controlar la temperatura es una tecnología rentable para la parte central del Estado de Veracruz, como se mencionó anteriormente no es una región donde baja mucho la temperatura. 43 Cuadro 7: Temperatura interna de los reactores por tratamiento. Tratamiento A (Heces) Tratamiento B (Heces + Pasto) Promedio Semana 1 Reactor 2 28º C Reactor 5 27º C Reactor 1 28º C Reactor 3 27º C 27.5º C 2 27º C 27º C 28º C 28º C 27.5º C 3 27º C 27º C 28º C 27º C 27.3º C 4 28º C 27º C 27º C 27º C 27.3º C 5 28º C 27º C 27º C 27º C 27.3º C 6 27º C 28º C 27º C 27º C 27.3º C 7 25º C 28º C 25º C 25º C 25.8º C 8 24º C 25º C 25º C 25º C 24.8º C 9 24º C 24º C 24º C 24º C 24.0º C Promedio 26.4º C 26.7º C 26.6º C 26.3º C La producción de biogás disminuyó semanalmente debido al descenso de la temperatura dentro de los biodigestores (Fig. 6), sobre todo en las últimas semanas del experimento, se observa una mayor disminución en la producción de biogás, debido a que en la zona del trópico esta disminución de la temperatura es significativa para las bacterias metanogénicas. Es importante notar, que entre la semana 3 y 4 (Fig. 6), hubo un colapso en la producción de biogás por causas que no se pudieron identificar, pero todo indica que alguna sustancia extraña, toxica para las bacterias se introdujo en los biodigestores que disminuyó notoriamente la actividad de estas. Sin embargo en las semanas siguientes, los reactores se recuperaron y aumentó la producción de biogás. Es muy posible que dichas sustancia toxica haya sido introducida accidentalmente en las heces, como podría ser un desparasitante; puesto que el tratamiento A (solo heces) fue mucho más afectado que el tratamiento B (heces + pasto). Es importante recalcar que un biodigestor viene siendo o se puede comparar con el rumen de los animales 44 bovinos, éstos contienen bacterias que se encuentran en el rumen de los bovinos les afecta negativamente cuando se comenten errores en la alimentación de estos, de igual manera reacciona un biodigestor. El gas que se produce en el tracto digestivo de los rumiantes es el mismo que se produce en el biodigestor. Figura 6. Relación de la producción de biogás con la temperatura. Efecto de la temperatura en la producción de biogas 30 Litros 2,000 28 1,500 1,000 26 500 0 Temperatuta ºC 2,500 24 1 2 3 4 5 6 7 8 9 Semana Excremento + Pasto Excremento Temperatura ºC pH Monitorear el pH es importante para advertir el estado de salud de las bacterias dentro de los biodigestores. (Santana y Canessa, 1985) consideran que un biodigestor sano, con buena condición de bacterias, el pH debe estar cercano a 7.0. (Campos ,1985) indica que un pH inferior a 6.2 provoca una rápida caída en la producción de biogás. En la Fig. 7 se puede observar que la producción de biogás se ve afectada por el pH, aunque este efecto también coincide con la disminución de temperatura, por lo que habría que hacer estudios posteriores para determinar cuál fue realmente el efecto del pH en la disminución del biogás. 45 Figura 7. Relación de la producción de biogás con el pH. 8.0 2,000 7.5 1,500 7.0 1,000 500 6.5 0 6.0 1 2 3 4 5 6 7 8 pH Litros Efecto del pH en la producción de biogas 2,500 9 Semana Excremento + Pasto Excremento pH El calentamiento global es uno de los problemas actuales que más preocupan a la humanidad. Como se mencionó anteriormente el gas metano (CH4) es el segundo gas efecto invernadero (GEI), y aunque está en concentraciones mucho menores que el CO2 en la atmosfera, es un gas que aporta enormemente al calentamiento global, debido a que calienta la atmosfera 21 veces más que el CO2, debido a que este gas absorbe mucho mas la radiación infrarroja de la luz solar. Es decir, el hecho simplemente de capturar el metano y quemarlo a CO2, reducimos significativamente la emisión de gas efecto invernadero; si al quemarlo utilizamos esa energía producida para calentar algo o producir electricidad, entonces evitamos el uso de hidrocarburos (gas o gasolina) y se reduce el calentamiento. Uno de los beneficios más importantes de esta investigación es el uso de biodigestores q ayudan a contrarrestar el calentamiento global y trasformar estos residuos orgánicos contaminantes en un recurso muy valioso como es la energía en forma de gas o electricidad, además que el material que sale del biodigestor (organilodo) es un excelente fertilizante orgánico. Además se busca reducir el desecho gigantesco y desordenado de las excreciones de los animales, que se producen en las actividades agropecuarias, como son las lecherías o engordas de ganado. Esta materia orgánica, que son cadenas gigantescas de carbohidratos, 46 principalmente glucosa, se convierta a biogás (CH4 y CO2) y el efluente u organilodo sea el mínimo, por lo que es muy importante medir la fermentación o degradación de la materia orgánica (Fig. 8). La degradación de la biomasa fue en promedio 70%, siendo el máximo alrededor del 82% y mínimo el 46%; nótese que también la degradación es grandemente afectada por la temperatura y el pH, e inversamente relacionada con la producción de biogás. Figura 8. Degradación de la Fibra Neutro Detergente (celulosa, hemicelulosa y lignina). 90 Degradación FND (%) 80 70 60 50 40 30 20 10 5/11 12/11 19/11 26/11 3/12 10/12 17/12 24/12 31/12 Año 2009 La degradación de la fibra viene siendo la diferencia entre la cantidad de Fibra Neutro Detergente que se introdujo en los biodigestores diariamente o sea en el excremento (FNDE), así como la cantidad que salió de estos en el organilodo (FNDO). En la Fig. 9, y se puede observar que está totalmente relacionada con la temperatura y el pH del biodigestor, por lo que una vez más habría que considerar la opción de poner tuberías dentro del biodigestor que mantuvieran la temperatura constante, por arriba de los 30º C durante el invierno para lograr degradaciones superiores a 80% durante todo el año. Otra práctica común que se hace para lograr mayores degradaciones, se ponen los biodigestores en serie, esto es, al 47 biodigestor 1 se le pone todas las heces de los cinco biodigestores, el efluente o salida, es la entrada del biodigestor 2, y así sucesivamente, por lo que se logran mayores degradaciones. Para este proyecto para fines experimentales, se pusieron en paralelo, y para poner diferentes tratamientos a cada uno, además tener repeticiones. Figura 9. Cantidad de FND en el Excremento (FNDE), en el Organilodo (FNDO) y degradado. Kg FNDE kg FNDO kg Degradados Kg/día 8.00 7.00 6.00 5.00 4.00 3.00 2.00 1.00 5/11 12/11 19/11 26/11 3/12 10/12 17/12 24/12 31/12 Año 2009 Lo contrario, el material orgánico es el material mineral o cenizas, o sea, entre mayor sea la degradación de la materia orgánica, mayor será la concentración del material mineral. Podemos encontrar que hay mayor porcentaje de ceniza (Fig. 10) en el organilodo, producto de la degradación de la materia orgánica, ya que en el proceso de degradación bacteriana de la materia orgánica, los minerales no se degradan es por eso que aumenta en proporción. El porcentaje promedio del material mineral en el pasto consumido por el ganado durante el experimento fue de 5.89%, o sea 94.11% de materia orgánica; el contenido de minerales promedio en el excremento después de la digestión del pasto por los animales fue de 21.55%, esto es mayor por la degradación de la materia orgánica en el rumen; finalmente, la cantidad de material mineral en el organilodo (efluente) fue en 48 promedio durante las nueve semanas de 29.95%, aún más concentrada por la fermentación de los biodigestores. Lavado y Tabeada (2002) compararon el uso del efluente (organilodo) del biodigestor, las excretas sin digestión y un paquete de fertilización convencional, en la fertilización de un cultivo de maíz. Los resultados indicaron que el uso del efluente como fertilizante se asemeja a la fertilización tradicional. La producción de maíz con la fertilización convencional fue 1% mayor a la producción del maíz fertilizado con el efluente, sin embargo el nitrógeno residual proveniente del efluente fue de 50% del total y su liberación completa se dio en tres años; o sea el efluente liberó los nutrientes de manera lenta, esto hace que la producción del cultivo aumente en los años posteriores. También se observó que en épocas secas, el efluente logró sostener la producción del cultivo mientras que con la fertilización tradicional bajó el rendimiento. Figura 10. Cantidad de Cenizas o Minerales en el Excremento, Organilodo y Pasto. % Ceniza Excremento Organilodo Pasto 40% 30% 20% 10% 0% 1 2 3 4 5 6 7 8 9 Semana Al igual que los minerales, la lignina no se degrada por las bacterias del biodigestor, por lo que estas se concentran (Fig. 11). El pasto en promedio durante el estudio tuvo 9.84% de lignina, después de la digestión animal se concentro en promedio a 23.83% en el excremento que se utilizó en el presente estudio, 49 finalmente después de la digestión en el biodigestor, subió a 33.70% en el organilodo. Figura 11. Cantidad de Lignina en el Excremento, Organilodo y Pasto. % Lignina Excremento Organilodo Pasto 50% 40% 30% 20% 10% 0% 1 2 3 4 5 6 7 8 9 Semana En lo que se refiere a la proteína cruda (PC), esta tiene una fracción digestible y una indigestible. La parte indigestible no puede ser digerida por los microorganismos del rumen y del reactor, por lo que aumenta en concentración en las heces y el organilodo (Fig. 12). Nótese el nivel tan bajo de PC que tiene el pasto que se le dio a los animales en forma de heno durante la ordeña (3.45%), esta PC, que mas bien viene siendo N indigestible, en el excremento y organilodo se concentro a niveles de 9.12% y 11.24%. 50 Figura 12. Cantidad de Proteína en el Excremento, Organilodo y Pasto. % Proteina Cruda Excremento Organilodo Pasto 15% 12% 9% 6% 3% 0% 1 2 3 4 5 Semana 6 7 8 9 51 8. CONCLUSIONES La utilización de los biodigestores es una herramienta factible de usar en las empresas agropecuarias para desechar de manera ecológica los desechos orgánicos, como en este caso las heces del ganado y los desperdicios de pasto. Esto reduce la contaminación ambiental y por ende la producción de gases efecto invernadero como es el metano (CH4), así como los malos olores, insectos transmisores de enfermedades, los parásitos intestinales y moscas que se reproducen en las heces, entre las principales. La producción de biogás para cocinar en una estufa de gas es posible utilizando heces de ganado vacuno y desperdicio de pasto. La producción de biogás aumenta si se utiliza heces y pasto. La ventaja de usar este combustible para cocinar, es energía renovable, se reduce la necesidad de cortar leña, o comprar gas propano comercial, lo que en el primer caso reduce la deforestación y en el segundo caso reduce la cantidad de gases efecto invernadero y además representa un ahorro de dinero para los productores. En los trópicos, por las condiciones climáticas que prevalecen, es posible usar los biodigestores sin la necesidad de utilizar algún tipo de calefacción dentro de ellos. Es importante aclarar que la producción de biogás se vio estrechamente relacionada con la temperatura del biodigestor, disminuyendo la producción a medida que disminuye la temperatura en el invierno. Es necesario hacer investigaciones futuras, para analizar la conveniencia, rentabilidad de instalarles a los biodigestores un sistema de calefacción con el propio biogás que ellos producen, o con un sistema de co-generación al producir electricidad. La reducción de la materia orgánica de los desechos de los animales o plantas (desecho de pasto de los comederos) que se tiran al medio ambiente se redujo significativamente. 52 El organilodo es una fuente rica de minerales que es factible de usarse como fuente de fertilizante orgánico. Se requiere hacer futuras investigaciones para puntualizar el beneficio de este, entre ellas la utilización de la energía solar para la deshidratación del organilodo y pueda utilizarse de una manera más práctica. Finalmente se concluye, que el uso de biodigestores es una herramienta alternativa para reducir la contaminación ambiental por metano y materia orgánica en descomposición en empresas agropecuarias, y además son una fuente de producción de energía renovable que representa un ahorro de leña o gas propano para cocinar. 53 9. LITERATURA CITADA Alkalay, D 1997. Aprovechamiento de desechos agropecuarios para la producción de energía (en línea) in FAO. Biomasa para la producción de energía y alimentos. Memorias. Reunión Regional sobre Generación de Electricidad a partir de la Biomasa. La Habana, Cuba. Alba Lamo, 2005. Agroecología y Revolución Verde. Universidad Autónoma de Madrid. España. http://bah.ourproject.org/article.php3?id_article=64 Álvarez, J.M.; Caneta, L.; Moyano, C. 2001. Biomasa y Biogás. Universidad Nacional de Nordeste. Argentina.15 p. Anaya Durand A. 2001. Contaminantes en efluentes gaseosos. Facultad de Química, UNAM, Instituto Mexicano del Petróleo. México ATSDR (Agencia para Sustancias Toxicas y el Registro de Enfermedades, US). 2004. Reseña toxicológica de ácido sulfhídrico (en línea). Atlanta US. Disponible en: http://www.atsdr.cdc.gov/es/toxfags/es_tfacts114.htm. Botero B. R.; Aguilar, F.X. 2002. Estimación de los beneficios económicos totales de la producción de biogás utilizando un biodigestor (en linea). Guacino, CR, Universidad EARTH. Botero, B. R.; Preston, T. 1987. Biodigestor de bajo costo para la producción de combustible y fertilizante a partir de excretas. Manual para su instalación, operación y utilización. Centro Internacional de Agricultura Tropical, Cali, Colombia. Botero, R ; Hernández, C.; Okumoto, S.; Yeomans, J. 2003. Sistema Integrado de manejo de residuos: tecnología apropiada para el medio rural en el trópico húmedo de Costa Rica. Conferencia Electrónica: Sistemas Pecuarios Diversificados para el Alivio de la Pobreza Rural en América Latina. FAO-CATIE. Brown, 1987. Biogas systems in development. Appropriate Technology 14(3): 5-7. Campos, JMC. 1985. Diseño y construcción de biodigestores: producción microbiana, eficiencia del biodigestor, aspectos relacionados. 2ª ed. Cartago (CR): Editorial Tecnológico de Costa Rica. Canessa, E. 1985. Diseño y construcción de biodigestores: fundamentos básicos de un biodigestor 2ª Ed. Cartago (CR): Editorial Tecnológico de Costa Rica. 205p. 54 Dague, R.R. 1968. Application of digester theory to digester control. Journal of Water Pollution Control Federation, 40:2021. Decara, L.; Sandoval, G.; Funes, C. 2004. El uso de biodigestores caprinos de la provincia de Córdoba. Universidad Nacional del Rio Cuarto, Córdoba. Dias Da Silva E.; Kreling J. 2006. Evaluación de la productividad y del efluente de biodigestores suplementados con grasas residuales, Guácimo, Costa Rica. Diaz Baez, M.; Espitia, S. y Molina, F. 2002 Digestión Anaerobia una Aproximación a la Tecnología. UNIBIBLIOS. Bogotá, Colombia. Domínguez P.L.; Ly J. 2000. Biodigestores como componentes de sistemas agropecuarios integrados. Instituto de Investigaciones Porcinas. PO Box 1, Punta Brava, La Habana. FAO. 1986 Estudio Potencial bioenergetico de desechos agroindustriales y agrícolas. Cali, Colombia. Seminario Taller sobre biogás y otras fuentes alternas de energía en el medio rural. Fernández, Jesús. 2002. Energías renovables para todos. Revista “Energías Renovables”. Editado por Iberdrola. http://www.energiasrenovables.com/.../cuaderno_BIOCARBURANTES.pdf Fundación Hábitat. 2005. Biodigestores: una alternativa a la autosuficiencia energética y de biofertilizantes (en línea). Quimbaya. CO, Consultado 29/08/2006. Gigena, R.; Tribaldos, R. 1998. Análisis financiero y ambiental de la producción de Bokashi a partir de excretas de bovinos, fibra seca y microorganismos eficaces (EM), en las áreas de doble propósito y semiconfinamiento de la EARTH, como sustituto del agua para lavado. PG. EARTH, Gúacimo, CR. 69 p. Gropelli, E, y Grampaolli, O. 2001 El camino de la biodigestión. Publicación de Secretaria de Extensión. UNL. Santa Fe. Centro de Guevara Vera, 1996. Fundamentos básicos para el diseño de biodigestores anaeróbicos rurales. Producción de gas y saneamiento de efluentes. Centro Panamericano de Ingeniería Sanitaria y Ciencias del Ambiente. Lima, Perú. Gunnerson, C.G. y Stuckey, D.C. 1968. Anaerobic digestión. Principles and practices for biogás systems. The World Bank Technical Paper No. 49. Washington D.C., p 93.100. 55 IIT (Instituto de Investigaciones Tecnológicas). 1987. Plantas de biogás. Diseño, Construcción y Operación. Editorial Guadalupe. Bogota, Colombia 94p. Lavado, R.; Tabeada, M. 2002. Manual de procedimiento de aplicación de biosólidos en el campo: factibilidad de valorización agrícola de biosólidos de plantas depuradoras (en línea). Buenos Aires, AR, Convenio Aguas Argentinas. 54p. Lettinga, G.; Van Haandel, A. 1993. Anaerobic digestion for energy production and environmental protection. In: Renewable Energy. Sources for Fuels and Electricity. Johansson, T.; Kelly, H.; Reddy, A.; Williams, R. (Editors). Earthscan, Island Press. Washington. Loehr, R.C. 1994. Agricultural Waste Management. Academic Press Incopany. London. Marchaim, U. 1992. Biogas processes for sustainable development (on line). Food and Agriculture Organization of the United Nations (FAO). Agricultural Services. Bulletin 95 232 p. Accessed February 05, 2001. http://www.fao.org/documents/show_cdr.asp?url_file=/docrep/T0541E/T0541E03.h tm. Medina, 1984. Evaluación técnico-económica del uso de estanques prefabricados de asbestos-cemento; modificados para producir biogás. Tesis de grado. Facultad de Agronomía. Macaray, Aragua. Venezuela. 65p. Moncayo Romero, 2008. Dimensionamiento y diseño de biodigestores y plantas de biogás. AquaLimpia Beratende Ingenieure. Alemania. http:// www.aqualimpia.com Oltjen, J. 1986. Evaluation of a model os beef cattle growth and composition. J. Anim. Sci. 62:98. Pohland, F.G. y Suidon, T. 1978. Prediction of pH stability in biological treatment systems. In: Chemistry of Wastewater Technology (A.J Rubin, editor). Ann Arbor Science Limited, p 441. Pound, B.; Bordas, F. and Preston, T. R., 1981. Characteristics of production and function of a 15 cubic metre Red-Mud PVC biogas digester. Tropical Anim. Prod. 6: 146-153. 56 Rodriguez, J. A. 2005 Tratamiento Anaerobio de Aguas Residuales. Profesora asociada de la Universidad el Valle. Calí. Colombia http://www.bvsde.paho.org/bvsaar/fulltext/tratamiento.pdf Santana, A. 1985. Diseño y construcción de biodigestores: factores que afectan la producción microbiana de los biodigestores. In simposio centroamericano sobre aplicaciones de energía biomásica. Cartago (CR): Editorial Tecnológica de Costa Rica. 203p. Sasse, L. 1984. La planta de biogás; bosquejo y detalle de plantas sencillas. Republica Federal de Alemania, GATE-GTZ. 86p. Schmid, L.A. y Lipper, R.Z. 1969. Swine wastes, characterization and anaerobic digestion. Proceding of the Conference on Agricultural Wastes Management. Cornell. P 50-57. Soria, M.J.F; Ferrera Cerrato R.; Barra J.E; González, G.A.; Santos, J.T; Gómez, L.B.; Pérez, G.P. 2001. Producción de biofertilizantes mediante biodigestión de excreta liquida de cerdo (en linea). Terra 19(4): 353-362. Disponible en: http//www.chapingo.mx/terra/contenido/19/art353-362.pdf Taylhardat, 1986. El biogás. Fundamentos e infraestructura rural. Instituto de Ingeniería Agrícola. Facultad de Agronomía. Macaray, Aragua. Venezuela. 68p. UNAM, 2000. Universidad Nacional Autónoma de México. Metano (en línea). México, DF. Disponible en http://organica1.pquim.unam.mx/qo1/MOCAP2.htm#_Toc476376054. Viglizzo, E. 1997. El componente ambiental en la intensificación ganadera. Rev. Arg. Prod. Anim. 17(3): 271-292. Villar Cleves, 2006. Medio Ambiente y Ganadería. Especialista en Ecología, Medio Ambiente y Desarrollo. Villavicencio. Colombia. www.engormix.com/medio_ambiente_ganaderia_s_articulos_924_GDC.htm. Youngfu, Y., Yibo, Q., Yunxuan, G., Hui, Z., Yuansheng, X., Chenyong, X., Guoyuan, F., Jienquan, X., Taiming, Z. y Gan, L. 1989. The biogas technology in China. Agricultural Publishing House. Beijing, p 20-54. Zapata, A. 1998.Utiliacion del biogás para la generación de electricidad (en linea). Cali, Colombia, CIPAV. Disponible en: http//www.cipav.org.co/cipav/resch/ energy/alvaro1.htm. 57 ANEXO 58 ANEXO 1 Imagen 1. Área a un costado de la sala de ordeña donde se depositaba la basura Imagen 2. Limpieza y excavación de la fosa para los biodigestores. Imagen 3. Fosa terminada. Imagen 4. Canal para tubo de entrada. 59 Imagen 7. Los 5 enterrados en la fosa. biodigestores Imagen 8. Registros de entrada y salida construidos con ladrillos y cemento. 60 Imagen 9. Elaboración de tapas de acrílico de 3 mm de espesor. Imagen 11. Biodigestores funcionando. Imagen 10. Tapas con válvula de salida y manguera para la salida de biogás. Imagen 12. Medidor de biogás, filtros para capturar el ácido sulfhídrico y sello de agua. 61 Imagen 9. Elaboración de tapas de acrílico de 3 mm de espesor. Imagen 10. Tapas con válvula de salida y manguera para la salida de biogás. Imagen 11. Biodigestores funcionando. Imagen 12. Medidor de biogás, filtros para capturar el ácido sulfhídrico y sello de agua. 61 Imagen 12. Estufa de un solo quemador usada para el experimento. Imagen 13. Estufa utilizando biogás para calentar agua. 62 ANEXO 2 The SAS System 16:17 Monday, May 31, 2010 1 Obs NP BQ RE SE TR BG PH TE PCO CEO 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 2 2 2 1 1 1 1 1 1 1 1 1 1 2 2 2 2 2 2 2 2 2 2 3 3 3 1 2 3 4 5 6 7 8 9 10 1 2 3 4 5 6 7 8 9 10 1 2 3 HP HP HP HP HP HP HP HP HP HP HH HH HH HH HH HH HH HH HH HH HP HP HP 1914 2134 1415 1745 1974 1997 1708 1493 1193 981 1796 1935 797 129 412 374 229 336 280 195 2494 2580 1945 7.07 7.70 7.02 7.79 7.62 7.31 7.16 7.34 6.38 6.99 7.03 7.54 6.93 7.81 7.61 7.93 7.06 7.48 6.39 6.93 7.20 7.59 7.09 28 28 28 27 27 27 25 25 24 25 28 27 27 28 28 27 25 24 24 22 27 28 27 11.93 11.04 13.58 8.73 9.18 11.37 9.50 11.31 11.41 9.45 12.76 10.07 12.23 12.88 . 7.46 12.58 12.22 11.31 13.15 11.99 11.02 . 30.30 30.72 25.28 27.20 28.00 26.07 26.56 26.56 26.48 27.51 32.04 30.12 35.07 38.53 40.69 . 30.14 28.22 28.67 28.94 27.89 29.61 43.00 Obs CO LO PCE CEE FNDE FADE HE FNDO FADO 68.65 70.97 81.75 71.63 64.32 73.50 76.26 73.04 68.96 70.31 74.31 56.90 . . . 28.30 51.23 71.80 78.39 75.87 67.84 72.13 . 51.43 53.90 60.45 50.46 48.17 53.45 50.24 48.39 50.12 49.75 54.39 40.03 . . . 14.51 34.38 51.96 55.41 54.36 47.84 49.94 . CE HO 17.23 17.07 21.30 21.17 16.14 20.05 26.03 24.65 18.84 20.56 19.93 16.86 . . . 13.79 16.85 19.84 22.98 21.52 20.01 22.18 . LE 1 16.11 35.31 9.32 29.07 78.69 57.21 21.48 27.08 30.12 2 17.16 36.74 12.37 21.88 72.82 44.97 27.85 17.42 27.55 3 17.34 43.11 10.36 18.04 78.43 47.08 31.35 24.48 22.60 4 18.35 32.11 10.19 24.76 74.50 47.09 27.41 24.75 22.34 5 17.11 31.07 9.21 24.13 71.74 44.96 26.78 21.57 23.39 6 20.64 32.82 8.38 20.50 77.20 48.56 28.64 24.98 23.58 7 18.40 31.83 8.34 22.26 73.22 44.96 28.26 23.26 21.71 8 16.50 31.89 9.12 16.65 76.51 45.80 30.71 24.28 21.52 9 18.04 32.08 8.35 21.57 76.13 48.35 27.78 24.90 23.45 10 17.95 31.80 5.51 16.66 77.88 46.49 31.39 24.43 22.06 11 14.72 39.67 9.32 29.07 78.69 57.21 21.48 27.08 30.12 12 10.96 29.07 12.37 21.88 72.82 44.97 27.85 17.42 27.55 13 . . 10.36 18.04 78.43 47.08 31.35 24.48 22.60 14 . . 10.19 24.76 74.50 47.09 27.41 24.75 22.34 15 . . 9.21 24.13 71.74 44.96 26.78 21.57 23.39 16 3.54 10.97 8.38 20.50 77.20 48.56 28.64 24.98 23.58 17 11.24 23.14 8.34 22.26 73.22 44.96 28.26 23.26 21.71 18 17.89 34.07 9.12 16.65 76.51 45.80 30.71 24.28 21.52 19 17.31 38.10 8.35 21.57 76.13 48.35 27.78 24.90 23.45 20 16.34 38.02 5.51 16.66 77.88 46.49 31.39 24.43 22.06 21 13.72 34.12 9.32 29.07 78.69 57.21 21.48 27.08 30.12 22 13.74 36.20 12.37 21.88 72.82 44.97 27.85 17.42 27.55 23 . . 10.36 18.04 78.43 47.08 31.35 24.48 22.60 ___________________________________________________________________________________________ 63 NP = Número progresivo de muestra. BQ = Bloque. RE = Reactor. SE = Semana. TR = Tratamiento. BG = Biogás. pH = Potencial Hidrogeno. TE = Temperatura. PCO = Proteína cruda del organilodo. CEO = ceniza del organilodo. FNDO = Fibra neutro detergente del organilodo. FADO = Fibra acido detergente del organilodo. HO = Hemicelulosa organilodo. CO = Celulosa organilodo. LO = Lignina organilodo. PCE = Proteína cruda del excremento. CEE = Ceniza del excremento. FNDE = Fibra neutro detergente del excremento. FADE = Fibra acido detergente del excremento. HE = Hemicelulosa excremento. CE = Celulosa excremento. LE = Lignina excremento. The SAS System 16:17 Monday, May 31, 2010 2 Obs NP BQ RE SE TR BG PH TE PCO CEO 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 3 3 3 3 3 3 3 5 5 5 5 5 5 5 5 5 5 4 5 6 7 8 9 10 1 2 3 4 5 6 7 8 9 10 HP HP HP HP HP HP HP HH HH HH HH HH HH HH HH HH HH 2169 1550 1249 1354 1377 1092 237 1270 1377 479 107 333 870 1689 1489 1201 934 7.96 7.65 7.27 7.14 7.40 6.21 6.83 7.13 7.60 7.05 7.82 7.71 7.24 7.32 7.51 6.21 6.92 27 27 27 25 25 24 25 27 27 27 27 27 28 28 25 24 25 11.17 . 11.26 13.21 9.33 7.58 13.26 14.73 12.85 10.80 10.32 12.50 11.20 10.64 11.44 11.35 9.53 38.22 44.03 . 28.26 27.97 27.46 28.32 28.47 31.76 28.53 27.95 26.89 28.08 27.03 27.59 27.55 28.31 Obs 24 25 26 27 28 29 30 31 32 CO . . . 16.85 16.70 17.85 17.27 13.96 13.64 LO . . . 35.37 34.19 35.98 34.36 34.32 34.90 PCE CEE 10.19 9.21 8.38 8.34 9.12 8.35 5.51 9.32 12.37 24.76 24.13 20.50 22.26 16.65 21.57 16.66 29.07 21.88 FNDE FADE 74.50 71.74 77.20 73.22 76.51 76.13 77.88 78.69 72.82 47.09 44.96 48.56 44.96 45.80 48.35 46.49 57.21 44.97 HE 27.41 26.78 28.64 28.26 30.71 27.78 31.39 21.48 27.85 FNDO FADO . . . 73.75 73.52 75.77 71.57 69.24 66.97 78.51 75.74 72.69 73.83 74.54 73.82 73.02 73.60 . . . 52.22 50.89 53.83 51.63 48.28 48.54 53.80 56.63 49.91 51.32 53.64 54.25 52.69 52.32 CE 24.75 21.57 24.98 23.26 24.28 24.90 24.43 27.08 17.42 HO . . . 21.54 22.63 21.94 19.94 20.96 18.43 24.70 19.11 22.78 22.50 20.91 19.57 20.33 21.28 LE 22.34 23.39 23.58 21.71 21.52 23.45 22.06 30.12 27.55 64 33 34 35 36 37 38 39 40 15.81 18.95 18.41 21.29 20.22 18.14 17.45 15.54 37.99 37.68 31.50 30.03 33.42 36.11 35.24 36.78 10.36 10.19 9.21 8.38 8.34 9.12 8.35 5.51 18.04 24.76 24.13 20.50 22.26 16.65 21.57 16.66 The SAS System 78.43 74.50 71.74 77.20 73.22 76.51 76.13 77.88 47.08 47.09 44.96 48.56 44.96 45.80 48.35 46.49 31.35 27.41 26.78 28.64 28.26 30.71 27.78 31.39 24.48 24.75 21.57 24.98 23.26 24.28 24.90 24.43 16:17 Monday, May 31, 2010 22.60 22.34 23.39 23.58 21.71 21.52 23.45 22.06 3 The MEANS Procedure Variable NP BQ RE SE BG PH TE PCO CEO FNDO FADO HO CO LO PCE CEE FNDE FADE HE CE LE N Mean Std Dev Minimum Maximum 40 40 40 40 40 40 40 37 38 33 33 33 33 33 40 40 40 40 40 40 40 20.5000000 1.5000000 2.7500000 5.5000000 1220.83 7.2485000 26.2750000 11.2524324 30.1057895 70.3857576 49.9736364 20.4127273 16.3375758 33.6360606 9.1150000 21.5520000 75.7120000 47.5470000 28.1650000 23.7150000 23.8320000 11.6904519 0.5063697 1.4978617 2.9088724 708.6397909 0.4446061 1.5522936 1.6433137 4.7021747 9.4998326 7.8178969 2.6138038 3.2859645 5.4028031 1.6968704 3.7274995 2.3923245 3.5033582 2.7676047 2.5063949 2.6889968 1.0000000 1.0000000 1.0000000 1.0000000 107.0000000 6.2100000 22.0000000 7.4600000 25.2800000 28.3000000 14.5100000 13.7900000 3.5400000 10.9700000 5.5100000 16.6500000 71.7400000 44.9600000 21.4800000 17.4200000 21.5200000 40.0000000 2.0000000 5.0000000 10.0000000 2580.00 7.9600000 28.0000000 14.7300000 44.0300000 81.7500000 60.4500000 26.0300000 21.2900000 43.1100000 12.3700000 29.0700000 78.6900000 57.2100000 31.3900000 27.0800000 30.1200000 The SAS System 16:17 Monday, May 31, 2010 4 The GLM Procedure Class Level Information Class TR Levels 2 Number of observations Values HH HP 40 Dependent Variables With Equivalent Missing Value Patterns Pattern Obs 1 40 Dependent Variables BG PH TE PCE CEE FNDE FADE HE CE LE 65 2 3 4 37 38 33 PCO CEO FNDO FADO HO CO LO NOTE: Variables in each group are consistent with respect to the presence or absence of missing values. The SAS System 16:17 Monday, May 31, 2010 5 The GLM Procedure Dependent Variable: BG DF Sum of Squares Mean Square F Value Pr > F Model 1 6698604.02 6698604.02 19.75 <.0001 Error 38 12886039.75 339106.31 Corrected Total 39 19584643.78 Source R-Square Coeff Var Root MSE BG Mean 0.342033 47.69958 582.3284 1220.825 Source TR Source TR DF Type I SS Mean Square F Value Pr > F 1 6698604.025 6698604.025 19.75 <.0001 DF Type III SS Mean Square F Value Pr > F 1 6698604.025 6698604.025 19.75 <.0001 The SAS System 16:17 Monday, May 31, 2010 6 The GLM Procedure Dependent Variable: PH DF Sum of Squares Mean Square F Value Pr > F Model 1 0.00625000 0.00625000 0.03 0.8615 Error 38 7.70306000 0.20271211 Corrected Total 39 7.70931000 Source R-Square Coeff Var Root MSE PH Mean 66 0.000811 Source TR Source TR 6.211431 0.450236 7.248500 DF Type I SS Mean Square F Value Pr > F 1 0.00625000 0.00625000 0.03 0.8615 DF Type III SS Mean Square F Value Pr > F 1 0.00625000 0.00625000 0.03 0.8615 The SAS System 16:17 Monday, May 31, 2010 7 The GLM Procedure Dependent Variable: TE DF Sum of Squares Mean Square F Value Pr > F Model 1 0.02500000 0.02500000 0.01 0.9204 Error 38 93.95000000 2.47236842 Corrected Total 39 93.97500000 Source R-Square Coeff Var Root MSE TE Mean 0.000266 5.984307 1.572377 26.27500 Source TR Source TR DF Type I SS Mean Square F Value Pr > F 1 0.02500000 0.02500000 0.01 0.9204 DF Type III SS Mean Square F Value Pr > F 1 0.02500000 0.02500000 0.01 0.9204 The SAS System 16:17 Monday, May 31, 2010 8 The GLM Procedure Dependent Variable: PCE DF Sum of Squares Mean Square F Value Pr > F Model 1 0.0000000 0.0000000 0.00 1.0000 Error 38 112.2954000 2.9551421 Source 67 Corrected Total 39 112.2954000 R-Square Coeff Var Root MSE PCE Mean 0.000000 18.85960 1.719053 9.115000 Source TR Source TR DF Type I SS Mean Square F Value Pr > F 1 0 0 0.00 1.0000 DF Type III SS Mean Square F Value Pr > F 1 1.232595E-33 1.232595E-33 0.00 1.0000 The SAS System 16:17 Monday, May 31, 2010 9 The GLM Procedure Dependent Variable: CEE DF Sum of Squares Mean Square F Value Pr > F Model 1 0.0000000 0.0000000 0.00 1.0000 Error 38 541.8758400 14.2598905 Corrected Total 39 541.8758400 Source R-Square Coeff Var Root MSE CEE Mean 0.000000 17.52147 3.776227 21.55200 Source TR Source TR DF Type I SS Mean Square F Value Pr > F 1 0 0 0.00 1.0000 DF Type III SS Mean Square F Value Pr > F 1 8.077936E-29 8.077936E-29 0.00 1.0000 The SAS System 16:17 Monday, May 31, 2010 10 The GLM Procedure Dependent Variable: FNDE Source Model DF Sum of Squares Mean Square F Value Pr > F 1 0.0000000 0.0000000 0.00 1.0000 68 Error 38 Corrected Total R-Square TR Source TR 5.8738274 39 223.2054400 Coeff Var Root MSE 0.000000 Source 223.2054400 3.201075 2.423598 FNDE Mean 75.71200 DF Type I SS Mean Square F Value Pr > F 1 0 0 0.00 1.0000 DF Type III SS Mean Square F Value Pr > F 1 1.262177E-30 1.262177E-30 0.00 1.0000 The SAS System 16:17 Monday, May 31, 2010 11 The GLM Procedure Dependent Variable: FADE DF Sum of Squares Mean Square F Value Pr > F Model 1 0.0000000 0.0000000 0.00 1.0000 Error 38 478.6672400 12.5965063 Corrected Total 39 478.6672400 Source Source TR Source TR R-Square Coeff Var Root MSE FADE Mean 0.000000 7.464521 3.549156 47.54700 DF Type I SS Mean Square F Value Pr > F 1 0 0 0.00 1.0000 DF Type III SS Mean Square F Value Pr > F 1 3.231174E-28 3.231174E-28 0.00 1.0000 The SAS System 16:17 Monday, May 31, 2010 12 The GLM Procedure Dependent Variable: HE Source DF Sum of Squares Mean Square F Value Pr > F 69 Model 1 0.0000000 0.0000000 Error 38 298.7258000 7.8612053 Corrected Total 39 298.7258000 R-Square Coeff Var Root MSE HE Mean 0.000000 9.954852 2.803784 28.16500 Source TR Source TR 0.00 1.0000 DF Type I SS Mean Square F Value Pr > F 1 0 0 0.00 1.0000 DF Type III SS Mean Square F Value Pr > F 1 8.077936E-29 8.077936E-29 0.00 1.0000 The SAS System 16:17 Monday, May 31, 2010 13 The GLM Procedure Dependent Variable: CE DF Sum of Squares Mean Square F Value Pr > F Model 1 0.0000000 0.0000000 0.00 1.0000 Error 38 244.9986000 6.4473316 Corrected Total 39 244.9986000 Source Source TR Source TR R-Square Coeff Var Root MSE CE Mean 0.000000 10.70698 2.539160 23.71500 DF Type I SS Mean Square F Value Pr > F 1 0 0 0.00 1.0000 DF Type III SS Mean Square F Value Pr > F 1 2.019484E-29 2.019484E-29 0.00 1.0000 70 The SAS System 16:17 Monday, May 31, 2010 14 The GLM Procedure Dependent Variable: LE DF Sum of Squares Mean Square F Value Pr > F Model 1 0.0000000 0.0000000 0.00 1.0000 Error 38 281.9974400 7.4209853 Corrected Total 39 281.9974400 Source R-Square Coeff Var Root MSE LE Mean 0.000000 11.43063 2.724149 23.83200 Source TR Source TR DF Type I SS Mean Square F Value Pr > F 1 0 0 0.00 1.0000 DF Type III SS Mean Square F Value Pr > F 1 1.13596E-29 1.13596E-29 0.00 1.0000 The SAS System 16:17 Monday, May 31, 2010 15 The GLM Procedure Duncan's Multiple Range Test for BG NOTE: This test controls the Type I comparisonwise error rate, not the experimentwise error rate. Alpha 0.05 Error Degrees of Freedom 38 Error Mean Square 339106.3 Number of Means Critical Range 2 372.8 Means with the same letter are not significantly different. Duncan Grouping Mean N TR A 1630.1 20 HP 71 B 811.6 The SAS System 20 HH 16:17 Monday, May 31, 2010 16 The GLM Procedure Duncan's Multiple Range Test for PH NOTE: This test controls the Type I comparisonwise error rate, not the experimentwise error rate. Alpha 0.05 Error Degrees of Freedom 38 Error Mean Square 0.202712 Number of Means Critical Range 2 .2882 Means with the same letter are not significantly different. Duncan Grouping Mean N TR A A A 7.2610 20 HH 7.2360 20 HP The SAS System 16:17 Monday, May 31, 2010 17 The GLM Procedure Duncan's Multiple Range Test for TE NOTE: This test controls the Type I comparisonwise error rate, not the experimentwise error rate. Alpha 0.05 Error Degrees of Freedom 38 Error Mean Square 2.472368 Number of Means Critical Range 2 1.007 Means with the same letter are not significantly different. Duncan Grouping Mean N TR 72 A A A 26.3000 20 HP 26.2500 20 HH Ç The SAS System 16:17 Monday, May 31, 2010 18 The GLM Procedure Duncan's Multiple Range Test for PCE NOTE: This test controls the Type I comparisonwise error rate, not the experimentwise error rate. Alpha 0.05 Error Degrees of Freedom 38 Error Mean Square 2.955142 Number of Means Critical Range 2 1.100 Means with the same letter are not significantly different. Duncan Grouping Mean N TR A A A 9.1150 20 HH 9.1150 20 HP The SAS System 16:17 Monday, May 31, 2010 19 The GLM Procedure Duncan's Multiple Range Test for CEE NOTE: This test controls the Type I comparisonwise error rate, not the experimentwise error rate. Alpha 0.05 Error Degrees of Freedom 38 Error Mean Square 14.25989 Number of Means Critical Range 2 2.417 Means with the same letter are not significantly different. 73 Duncan Grouping Mean N TR A A A 21.552 20 HH 21.552 20 HP The SAS System 16:17 Monday, May 31, 2010 20 The GLM Procedure Duncan's Multiple Range Test for FNDE NOTE: This test controls the Type I comparisonwise error rate, not the experimentwise error rate. Alpha 0.05 Error Degrees of Freedom 38 Error Mean Square 5.873827 Number of Means Critical Range 2 1.552 Means with the same letter are not significantly different. Duncan Grouping Mean N TR A A A 75.7120 20 HH 20 HP 16:17 Monday, May 31, 2010 75.7120 The SAS System 21 The GLM Procedure Duncan's Multiple Range Test for FADE NOTE: This test controls the Type I comparisonwise error rate, not the experimentwise error rate. Alpha 0.05 Error Degrees of Freedom 38 Error Mean Square 12.59651 Number of Means Critical Range 2 2.272 Means with the same letter are not significantly different. 74 Duncan Grouping Mean N TR A A A 47.547 20 HH 47.547 20 HP The SAS System 16:17 Monday, May 31, 2010 22 The GLM Procedure Duncan's Multiple Range Test for HE NOTE: This test controls the Type I comparisonwise error rate, not the experimentwise error rate. Alpha 0.05 Error Degrees of Freedom 38 Error Mean Square 7.861205 Number of Means Critical Range 2 1.795 Means with the same letter are not significantly different. Duncan Grouping Mean N TR A A A 28.1650 20 HH 28.1650 20 HP The SAS System 16:17 Monday, May 31, 2010 23 The GLM Procedure Duncan's Multiple Range Test for CE NOTE: This test controls the Type I comparisonwise error rate, not the experimentwise error rate. Alpha 0.05 Error Degrees of Freedom 38 Error Mean Square 6.447332 Number of Means Critical Range 2 1.626 75 Means with the same letter are not significantly different. Duncan Grouping Mean N TR A A A 23.7150 20 HH 23.7150 20 HP The SAS System 16:17 Monday, May 31, 2010 24 The GLM Procedure Duncan's Multiple Range Test for LE NOTE: This test controls the Type I comparisonwise error rate, not the experimentwise error rate. Alpha 0.05 Error Degrees of Freedom 38 Error Mean Square 7.420985 Number of Means Critical Range 2 1.744 Means with the same letter are not significantly different. Duncan Grouping Mean N TR A A A 23.8320 20 HH 23.8320 20 HP The SAS System 16:17 Monday, May 31, 2010 25 The GLM Procedure Dependent Variable: PCO DF Sum of Squares Mean Square F Value Pr > F Model 1 4.19068108 4.19068108 1.58 0.2176 Error 35 93.02660000 2.65790286 Corrected Total 36 97.21728108 Source R-Square Coeff Var Root MSE PCO Mean 76 0.043106 14.48849 Source 11.25243 DF Type I SS Mean Square F Value Pr > F 1 4.19068108 4.19068108 1.58 0.2176 DF Type III SS Mean Square F Value Pr > F 1 4.19068108 4.19068108 1.58 0.2176 TR Source 1.630308 TR The SAS System 16:17 Monday, May 31, 2010 26 The GLM Procedure Duncan's Multiple Range Test for PCO NOTE: This test controls the Type I comparisonwise error rate, not the experimentwise error rate. Alpha 0.05 Error Degrees of Freedom 35 Error Mean Square 2.657903 Harmonic Mean of Cell Sizes 18.48649 NOTE: Cell sizes are not equal. Number of Means Critical Range 2 1.089 Means with the same letter are not significantly different. Duncan Grouping Mean N TR A A A 11.5800 19 HH 10.9067 18 HP The SAS System 16:17 Monday, May 31, 2010 27 The GLM Procedure Dependent Variable: CEO DF Sum of Squares Mean Square F Value Pr > F Model 1 0.6952526 0.6952526 0.03 0.8621 Error 36 817.3912737 22.7053132 Source 77 Corrected Total 37 818.0865263 R-Square Coeff Var Root MSE CEO Mean 0.000850 15.82755 4.765009 30.10579 Source TR Source TR DF Type I SS Mean Square F Value Pr > F 1 0.69525263 0.69525263 0.03 0.8621 DF Type III SS Mean Square F Value Pr > F 1 0.69525263 0.69525263 0.03 0.8621 The SAS System 16:17 Monday, May 31, 2010 28 The GLM Procedure Duncan's Multiple Range Test for CEO NOTE: This test controls the Type I comparisonwise error rate, not the experimentwise error rate. Alpha 0.05 Error Degrees of Freedom 36 Error Mean Square 22.70531 Number of Means Critical Range 2 3.135 Means with the same letter are not significantly different. Duncan Grouping Mean N TR A A A 30.241 19 HH 29.971 19 HP The SAS System 16:17 Monday, May 31, 2010 29 The GLM Procedure Dependent Variable: FNDO Source Model DF Sum of Squares Mean Square F Value Pr > F 1 93.749368 93.749368 1.04 0.3157 78 Error 31 2794.148838 Corrected Total 32 2887.898206 90.133833 R-Square Coeff Var Root MSE FNDO Mean 0.032463 13.48836 9.493884 70.38576 Source DF Type I SS Mean Square F Value Pr > F 1 93.74936819 93.74936819 1.04 0.3157 DF Type III SS Mean Square F Value Pr > F 1 93.74936819 93.74936819 1.04 0.3157 TR Source TR The SAS System 16:17 Monday, May 31, 2010 30 The GLM Procedure Dependent Variable: FADO DF Sum of Squares Mean Square F Value Pr > F Model 1 64.917917 64.917917 1.06 0.3102 Error 31 1890.906447 60.996982 Corrected Total 32 1955.824364 Source Source TR Source TR R-Square Coeff Var Root MSE FADO Mean 0.033192 15.62835 7.810056 49.97364 DF Type I SS Mean Square F Value Pr > F 1 64.91791695 64.91791695 1.06 0.3102 DF Type III SS Mean Square F Value Pr > F 1 64.91791695 64.91791695 1.06 0.3102 The SAS System 16:17 Monday, May 31, 2010 31 The GLM Procedure Dependent Variable: HO 79 DF Sum of Squares Mean Square F Value Pr > F Model 1 2.6531487 2.6531487 0.38 0.5417 Error 31 215.9699059 6.9667712 Corrected Total 32 218.6230545 Source R-Square Coeff Var Root MSE HO Mean 0.012136 12.93048 2.639464 20.41273 Source TR Source TR DF Type I SS Mean Square F Value Pr > F 1 2.65314866 2.65314866 0.38 0.5417 DF Type III SS Mean Square F Value Pr > F 1 2.65314866 2.65314866 0.38 0.5417 The SAS System 16:17 Monday, May 31, 2010 32 The GLM Procedure Dependent Variable: CO DF Sum of Squares Mean Square F Value Pr > F Model 1 18.4410564 18.4410564 1.75 0.1958 Error 31 327.0809496 10.5509984 Corrected Total 32 345.5220061 Source R-Square Coeff Var Root MSE CO Mean 0.053372 19.88196 3.248230 16.33758 Source TR Source TR The SAS System DF Type I SS Mean Square F Value Pr > F 1 18.44105643 18.44105643 1.75 0.1958 DF Type III SS Mean Square F Value Pr > F 1 18.44105643 18.44105643 1.75 0.1958 16:17 Monday, May 31, 2010 33 80 The GLM Procedure Dependent Variable: LO DF Sum of Squares Mean Square F Value Pr > F Model 1 14.1591188 14.1591188 0.48 0.4949 Error 31 919.9298691 29.6751571 Corrected Total 32 934.0889879 Source R-Square Coeff Var Root MSE LO Mean 0.015158 16.19539 5.447491 33.63606 Source TR Source TR DF Type I SS Mean Square F Value Pr > F 1 14.15911876 14.15911876 0.48 0.4949 DF Type III SS Mean Square F Value Pr > F 1 14.15911876 14.15911876 0.48 0.4949 The SAS System 16:17 Monday, May 31, 2010 34 The GLM Procedure Duncan's Multiple Range Test for FNDO NOTE: This test controls the Type I comparisonwise error rate, not the experimentwise error rate. Alpha 0.05 Error Degrees of Freedom 31 Error Mean Square 90.13383 Harmonic Mean of Cell Sizes 16.48485 NOTE: Cell sizes are not equal. Number of Means Critical Range 2 6.744 Means with the same letter are not significantly different. Duncan Grouping Mean N TR A 72.123 16 HP 81 A A 68.751 The SAS System 17 HH 16:17 Monday, May 31, 2010 35 The GLM Procedure Duncan's Multiple Range Test for FADO NOTE: This test controls the Type I comparisonwise error rate, not the experimentwise error rate. Alpha 0.05 Error Degrees of Freedom 31 Error Mean Square 60.99698 Harmonic Mean of Cell Sizes 16.48485 NOTE: Cell sizes are not equal. Number of Means Critical Range 2 5.548 Means with the same letter are not significantly different. Duncan Grouping Mean N TR A A A 51.419 16 HP 48.613 17 HH The SAS System 16:17 Monday, May 31, 2010 36 The GLM Procedure Duncan's Multiple Range Test for HO NOTE: This test controls the Type I comparisonwise error rate, not the experimentwise error rate. Alpha 0.05 Error Degrees of Freedom 31 Error Mean Square 6.966771 Harmonic Mean of Cell Sizes 16.48485 NOTE: Cell sizes are not equal. Number of Means Critical Range 2 1.875 82 Means with the same letter are not significantly different. Duncan Grouping Mean N TR A A A 20.7050 16 HP 20.1376 17 HH The SAS System 16:17 Monday, May 31, 2010 37 The GLM Procedure Duncan's Multiple Range Test for CO NOTE: This test controls the Type I comparisonwise error rate, not the experimentwise error rate. Alpha 0.05 Error Degrees of Freedom 31 Error Mean Square 10.551 Harmonic Mean of Cell Sizes 16.48485 NOTE: Cell sizes are not equal. Number of Means Critical Range 2 2.308 Means with the same letter are not significantly different. Duncan Grouping Mean N TR A A A 17.108 16 HP 15.612 17 HH The SAS System 16:17 Monday, May 31, 2010 38 The GLM Procedure Duncan's Multiple Range Test for LO NOTE: This test controls the Type I comparisonwise error rate, not the experimentwise error rate. Alpha Error Degrees of Freedom Error Mean Square 0.05 31 29.67516 83 Harmonic Mean of Cell Sizes 16.48485 NOTE: Cell sizes are not equal. Number of Means Critical Range 2 3.870 Means with the same letter are not significantly different. Duncan Grouping Mean N TR A A A 34.311 16 HP 33.001 17 HH 84