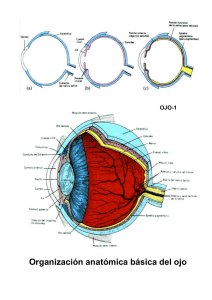
Departamento de Biología Celular e Histología Facultad de
Anuncio

Departamento de Biología Celular e Histología Facultad de Medicina Universidad de Buenos Aires 1ra. Unidad Académica Histología, Biología Celular, Embriología y Genética 2015 ORGANIZACIÓN DE LA MATERIA ORGANIZACIÓN DE LA MATERIA Esta asignatura consta de cuatro áreas: Biología Celular, Histología, Embriología y Genética. El objetivo fundamental de su enseñanza, es el conocimiento de la morfología de las células e histofisiología de los distintos tejidos y órganos, su desarrollo y organización normal, con el objeto de que los conocimientos adquiridos puedan ser aplicados por el alumno y el médico al diagnóstico y tratamiento en la práctica clínica o en la investigación experimental. Los objetivos particulares son específicos de cada área, pero todos apuntan a discutir la relación entre estructura y función, la interpretación de microfotografías de microscopía óptica y electrónica así como modelos embriológicos tridimensionales. El aspecto informativo-deductivo de la enseñanza no es el único tenido en cuenta, se pretende incentivar al alumno en el razonamiento inductivo-deductivo para eliminar el énfasis que el aprendizaje enciclopédico da a la memorización. Dada la complejidad de los conocimientos que los alumnos deben adquirir, el curso se divide en dos tipos de actividades: clases teóricas y trabajos prácticos. 1. CLASES TEÓRICAS Y SEMINARIOS DE BIOLOGÍA CELULAR, HISTOLOGÍA, EMBRIOLOGÍA Y GENÉTICA Son clases dictadas por Profesores o Auxiliares Docentes de 1:30 hs de duración. Los temas se repetirán varias veces durante cada semana en distintos horarios para que el alumno pueda concurrir en el horario más conveniente. No son obligatorios (no se toma asistencia) pero es altamente recomendable la asistencia dado que se explicarán y discutirán distintos temas del programa y esto facilitará la comprensión de los mismos. Estas clases tienen por objetivo actualizar temas que no están en los libros traducidos al español y que son recomendados en cada área. Los horarios, temas y docentes que dictarán cada clase se anuncian en la cartelera de la 1er cátedra ubicada en la Planta Principal y en la cartelera del 2do piso sector Paraguay así como en la página web de la Cátedra www.fmed.uba.ar/depto/histo1a/histo1.html. 2. TRABAJOS PRÁCTICOS DE HISTOLOGÍA Los alumnos deben asistir semanalmente y con carácter de obligatoriedad al turno que le fuera asignado. La mitad del alumnado cursará Histología en la primera mitad del año, y la otra mitad del alumnado la cursará en la segunda mitad del año. Es necesario el 80% de asistencia para obtener la regularidad. Cada TP dura 4 hs. y tiene una frecuencia semanal. El total de alumnos de una comisión se dividirá por el número de docentes asignados al turno, por lo tanto cada alumno pertenecerá a un grupo que trabajará bajo la supervisión de un docente auxiliar. El alumno deberá concurrir conociendo los contenidos teóricos del tema que se desarrollará en el trabajo práctico (consultar previamente el organigrama). Los alumnos deben estar presentes 5 min antes del inicio del TP y durante el mismo tendrán un recreo de 15 min. Para los TP de Histología se deberá concurrir con guardapolvo, lápices rojo y azul y un cuaderno de hojas lisas. Cada alumno trabajará independientemente en un microscopio óptico con preparados histológicos y microfotografías sobre los que tendrán que hacer el diagnóstico fundamentado. En el cuaderno dibujará las células, estructuras y tejidos tal cual los observa en el microscopio óptico. 3. TRABAJOS PRÁCTICOS DE EMBRIOLOGÍA El total de alumnos de una comisión se dividirá por el número de docentes asignados al turno, por lo tanto cada alumno pertenecerá a un grupo que trabajará bajo la supervisión de un 1 ORGANIZACIÓN DE LA MATERIA docente auxiliar. El alumno deberá concurrir conociendo los contenidos teóricos del tema que se desarrollará en el trabajo práctico (consultar previamente el organigrama). Los alumnos deben estar presentes 5 min antes del inicio del TP y durante el mismo tendrán un recreo de 15 min. Los alumnos deben asistir semanalmente y con carácter de obligatoriedad al turno que le fuera asignado. La mitad del alumnado cursará Histología en la primera mitad del año, y la otra mitad del alumnado la cursará en la segunda mitad del año. Es necesario el 80 % de asistencia para obtener la regularidad. Cada TP dura 4 hs. y tiene una frecuencia semanal. Los TP de Embriología, se desarrollarán utilizando modelos tridimensionales, fotos, láminas, imágenes tridimensionales y videos de embriones. En cada TP, los alumnos -junto con su Docente- desarrollarán conceptualmente los temas que figuran en el programa y en la Guía para el estudio de la Biología del Desarrollo y Embriología. La asistencia al TP es obligatoria, como también lo es asistir con el tema/los temas estudiados de forma tal que el trabajo práctico sea un lugar de discusión de las ideas actuales de la biología del desarrollo y embriología. Con el objeto de facilitar la preparación para cada TP, la guía presenta los diferentes niveles en los que se desarrollan los mismos. Durante el TP los alumnos deben desarrollar uno de los temas que figuran en la Guía. El desarrollo de esos temas tiene como objetivo que el alumno realice una pequeña tarea de investigación bibliográfica, la conceptualice y la transmita/discuta con sus compañeros. El TP incluye un seminario interno breve (aproximadamente 30´) a cargo del Jefe o encargado de turno. En el mismo se desarrollarán temas cuyo estudio, por parte de los alumnos, habitualmente presentan alguna dificultad. Dado el poco tiempo disponible para tratar exhaustivamente los distintos aspectos incluidos en cada tema del programa (morfogénesis, histogénesis, genética del desarrollo, biología celular y molecular y anomalías del desarrollo), algunos de ellos no son tratados en los TPs. El estudio de dichos temas queda bajo la responsabilidad del alumno ya que el listado de temas es la base conceptual mínima y elemental para poder trabajar en cada TP. Ej: para el TP 1 de fecundación se requiere que el alumno conozca las diferencias entre mitosis y meiosis. Ese tema es tratado en el CBC (y en el colegio secundario), por lo cual no se trata en clase sino que los alumnos deben encargase de su estudio antes de cada TP. La 1ª UA cuenta con una página en internet con una sección para biología del desarrollo y embriología; en la misma los alumnos encontrarán parte del material necesario para el estudio de la materia. La lectura de ese material es recomendable, aunque no obligatoria. Como complemento a las actividades del trabajo práctico, hay una oferta de Seminarios en biología del desarrollo y embriología de los diferentes temas que se desarrollan. La asistencia a los mismos es recomendable, aunque no obligatoria. 2 ORGANIZACIÓN DE LA MATERIA PÁGINA WEB DE LA CATEDRA En la página web de la cátedra estará toda la información requerida para cada una de las cuatro áreas. Allí se podrán consultar fechas de parciales, finales, inscripciones, turnos de seminarios y horarios de secretaría docente. Además, el alumno encontrará en las diferentes solapas: 1. PRESENTACION DE LA ASIGNATURA Y UN SEMINARIO INTRODUCTORIO. El mismo presenta contenidos que el alumno debe conocer para comenzar a cursar cualquiera de las cuatro áreas (BIOLOGIA CELULAR, HISTOLOGIA, EMBRIOLOGIA Y GENETICA). 2. ATLAS HISTOLOGICO INTERACTIVO DE LA 1ª UNIDAD ACADEMICA. El atlas permite al alumno realizar un análisis de los preparados con los que se trabaja en los TP de Histología. Es un complemento que ofrece la Cátedra al alumnado para facilitarle la tarea de aprendizaje del diagnóstico histológico. 3. PRESENTACIONES DE TEMAS DE LOS SEMINARIOS DE BIOLOGÍA CELULAR. Diapositivas complementarias a los temas de los Seminarios de Biología Celular que no se desarrollarán en profundidad en los Seminarios dictados por los docentes. Este material el alumno debe consultarlo antes de ir al Seminario de Biología Celular correspondiente con el fin de poder comprender mejor el desarrollo de los temas que se discutirán durante la clase. 4. PROBLEMAS TIPO DE BIOLOGÍA CELULAR Y DE GENÉTICA. 5. PRESENTACIONES Y RESUMENES DE TRABAJOS CIENTÍFICOS DE EMBRIOLOGÍA. EXÁMENES PARCIALES Para obtener la categoría de alumno regular se requiere: Aprobar todos los parciales. Contar con un mínimo de 80 % de presentes en los Trabajos Prácticos. Los alumnos contarán con dos oportunidades de aprobar cada parcial: el parcial original y UN solo recuperatorio por parcial. En caso de aplazo o de ausente en el parcial, los recuperatorios de los parciales podrán ser rendidos SOLAMENTE en UNA de las dos fechas posibles. En cada caso, consultar el cronograma general y los anuncios en las carteleras. El alumno que no apruebe un parcial o su correspondiente recuperatorio quedará en condición de alumno libre. Durante el ciclo 2015 se realizarán SEIS parciales: 1. Primer parcial de Histología: comprende parte del programa de Histología Seminarios de histofisiología y los Trabajos Prácticos de Histología (ver listado de temas en la cartelera de la Unidad Académica donde cursa). Se evaluará en forma oral, teórico-práctica. 2. Primer parcial de Embriología: comprende parte del programa de Embriología desarrollado en los Seminarios de Embriología y los Trabajos Prácticos Embriología (ver listado de temas en la cartelera de la Unidad Académica donde cursa). Se evaluará en forma oral, teóricopráctica 3. Parcial de Biología Celular: comprende todo el programa de Biología Celular. Se evaluará con la modalidad de Escrito Elección Múltiple (Multiple choice). 4. Segundo Parcial de Histología: comprende el resto de los temas de Seminarios de histofisiología y los Trabajos Prácticos de Histología, que se especifica en la cartelera de la Unidad Académica donde cursa. En este examen se evaluarán también temas 3 ORGANIZACIÓN DE LA MATERIA correspondientes al primer parcial, o sea es un parcial integrador. Se evaluará en forma oral, teórico-práctica. 5. Segundo Parcial de Embriología: comprende el resto de los temas de Seminarios Embriología y los Trabajos Prácticos de y Embriología que se especifica en la cartelera de la Unidad Académica donde cursa. En este examen se evaluarán también temas correspondientes al primer parcial, es decir, es un parcial integrador. Se evaluará en forma oral, teórico-práctica. 6. Parcial de Genética: comprende todo el programa de Genética dictado en los seminarios de esa disciplina. Se evaluará en la modalidad de Escrito a Desarrollar ó Elección Múltiple (Multiple choice), se informará oportunamente antes del comienzo de la cursada de Genética. SERÁ NECESARIO INSCRIBIRSE PREVIAMENTE ON LINE PARA RENDIR LOS PARCIALES RECUPERATORIOS DE BIOLOGÍA CELULAR Y GENETICA (Consultar carteleras y página web de la 1ra. Unidad Académica). PROMOCION. Los alumnos regulares podrán promocionar la asignatura si el promedio entre todos los parciales es 7 puntos o superior sin haber tenido que recuperar ningún parcial. Los alumnos que hayan promocionado, entregarán en secretaría la libreta en la primera fecha de examen final de noviembre y habrán aprobado la asignatura con una nota correspondiente al promedio de las notas de todos los parciales. EXAMEN FINAL. Al finalizar el curso, los alumnos REGULARES deberán aprobar el examen final integrador, que comprende todos los puntos del programa de las cuatro áreas que componen la asignatura. LIBRES. Los alumnos que queden en condición de LIBRES (por registrar más de 3 faltas en los TP de Histología ó Embriología; o por haber reprobado algún parcial y su recuperatorio) podrán rendir el examen final LIBRE, que incluye los exámenes prácticos de Histología y de Embriología. MUY IMPORTANTE. Para cada turno de examen final se publicará en cartelera la fecha de inscripción. La inscripción a exámenes finales es por internet, en las fechas indicadas y los alumnos deberán ratificar/rectificar su inscripción los días indicados en el cronograma de fechas de exámenes finales. Los exámenes finales se realizarán de dos maneras posibles: escrito-oral o sólo oral (el escrito puede ser a desarrollar, semi-estructurado o de elección múltiple). Dada la cantidad de alumnos que cursan en ésta cátedra se avisa que: el llamado a un turno de examen final compromete desde el día de inicio del mismo sin que quede definido el día de finalización de dicho turno (el cual dependerá de la cantidad de alumnos) por lo tanto cuando dé un examen final NO se comprometa a viajar ese día ni los días subsiguientes. INICIO DE LAS ACTIVIDADES ACADEMICAS. Los Seminarios y Trabajos Prácticos comienzan la semana del 25 de marzo. 4 HISTOLOGÍA HISTOLOGÍA GUIA DE ACTIVIDADES DE HISTOLOGIA: Esta guía tiene por objetivo orientar al alumno en el aprendizaje de la histología, jerarquizando los aspectos más importantes de la misma. Sirve para orientar las actividades a realizar en las dos modalidades de trabajo que se realizan en la 1ª Unidad Académica: Seminarios y Trabajos Prácticos. Es importante que el alumno integre los conocimientos adquiridos en Biología Celular con los de Histología. En cada Seminario la guía enuncia: los objetivos de aprendizaje, que son las conductas que deberá poder realizar el alumno al finalizar cada unidad temática. En cada Trabajo Práctico la guía contiene las siguientes partes: 1. Objetivos de aprendizaje. 2. Preparados del trabajo práctico: se indican los preparados que se observarán durante el trabajo práctico y los principales tejidos, componentes tisulares y estructuras que deben reconocerse en los mismos. 3. Guía de autoevaluación: incluye una serie de ejercicios que orientarán al alumno sobre el nivel de aprendizaje alcanzado acerca de los conocimientos teóricos de la materia (incluidos en Seminarios y TPs). Los aspectos prácticos no están incluidos. Estos últimos sólo pueden evaluarse durante el trabajo práctico. 4. Se agregan algunos anexos teóricos de difícil acceso bibliográfico. BIBLIOGRAFÍA DE HISTOLOGÍA Textos básicos Brusco HA, Lopez Costa JJ, Loidl CF, “ Histología médico-práctica”. 2014. Elsevier. Gartner L y col, “Texto y atlas de histología”. 2ª edición, Editorial Mc Graw Hill. Geneser F, “Histología”. 4ª edición, 2015, Editorial Panamericana. Junqueira y Carneiro, “Histología básica. Texto y atlas”. 4ª edición, Editorial Masson. Ross MH y col, “Histología. Texto y atlas color con Biología Celular y Molecular”. 6ª edición, Editorial Panamericana. Sobotta, Welsch,“Histología”. 2ª edición, 2008, Editorial Médica Panamericana.. Stevens y Lowe, “Histología Humana”. 2ª edición, Editorial Cúspide. Tratados Fawcett DW, “Tratado de histología”. 12ª edición, Editorial Interamericana. Weis L,“Histología”. 5ª edición, 1985, Editorial El Ateneo. Mac Cormack, “Histología de Ham”. 9ª edición, editorial Rala. Atlas ATLAS FOTOGRÁFICO INTERACTIVO DE LA PRIMERA CATEDRA DE HISTOLOGÍA. 2006, Pág. Web: http\\www.fmv.uba.ar Boya Vegue, “Atlas de Histología y Organografía Microscópica”. 2011, Editorial Panamericana. Di Fiore, “Atlas de Histología Normal” Editorial El Ateneo. (exclusivamente el atlas, dibujos). Todos los libros con Atlas incorporado (ver textos básicos) 5 HISTOLOGÍA PROGRAMA ANALÍTICO DE HISTOLOGÍA TECNICA HISTOLOGICA. Microscopio. Obtención de material. Fijación. Inclusión. Tipos y pasos. Cortes, montaje y coloración. Hematoxilina y Eosina. Coloraciones especiales. Ultraestructura celular y tisular. Concepto de tejido. Clasificación de los tejidos. Histogénesis. TEJIDO EPITELIAL. Clasificación de los epitelios. Epitelios de revestimiento. Clasificación, criterios. Estructura y ultraestructura de los epitelios. Diferenciaciones celulares. Funciones. Relaciones con membranas basales: constitución de las mismas. Células mioepiteliales. Polaridad y regeneración de los epitelios. Epitelios glandulares. Clasificaciones de las glándulas. Morfología. Ultraestructura. Función. Tipos de secreción. TEJIDOS CONECTIVOS. Concepto. Tipos de tejidos conectivos. Conectivo propiamente dicho. Clasificación. Conectivos especiales: clasificación, características. Sustancia intercelular: fibras (colágenas, elásticas y reticulares) y matriz fundamental. Características ultraestructurales y función. Composición química, características tintoriales, ultraestructura y función de las fibras. Biosíntesis del colágeno. Modelo molecular de la fibrilla colágena. Células propias del conectivo y células migrantes. Pericitos. Fibroblastos y fibrocitos. Mastocitos. Adipocitos. Ultraestructura, función, histoquímica y tinción de cada tipo celular. Células migrantes: macrófagos, linfocitos, plasmocitos y polimorfonucleares (neutrófilos y eosinófilos). TEJIDOS ESQUELETICOS. Cartílago: Clasificación. Sustancia fundamental: composición e histoquímica. Crecimiento y regeneración. Pericondrio. Tejido óseo. Sustancia intercelular. Composición y ultraestructura. Mecanismo de depósito y remoción de la sustancia inorgánica. Células: osteoblasto, osteocito y osteoclasto. Morfología, ultraestructura y función. Osteones. Periostio y endostio. Nutrición. Osteogénesis. Osificación membranosa y endocondral. Remodelación del hueso. Influencias hormonales y nutricionales sobre el tejido óseo. TEJIDO MUSCULAR: Clasificación. Músculo esquelético. Tipos de fibras. Organización de las fibras, miofibrillas y miofilamentos. Sarcómero: estructura y ultraestructura. Miofilamentos: estructura molecular de los mismos, componentes químicos y su localización. Bases moleculares de la contracción. Sistema de membranas: ultraestructura y función. Músculo liso. Morfología y ultraestructura. Bases estructurales de su contracción. Músculo cardíaco. Estructura y ultraestructura. Sistema de conducción. Discos intercalares. Gránulos secretorios. TEJIDO NERVIOSO. Técnicas especiales para su estudio. Métodos para visualizar el soma, las prolongaciones, las neurofibrillas y la mielina. Neurona: soma, dendritas, axón. Ultraestructura. Sinapsis: características estructurales, ultraestructurales y funcionales. Tipos de sinapsis. Células de la glía: astrocitos, oligodendrocitos y microgliocitos. Funciones. Célula de Schwann y mielinización. Su mecanismo. Trofismo neuronal. Degeneración y regeneración del tejido nervioso. Barrera hematoencefálica. Plexos coroideos. Líquido cefalorraquídeo. SANGRE Y HEMATOPOYESIS. Plasma y elementos figurados. Coloraciones tipo Romanovsky. Frotis de sangre. Eritrocito: cantidad, morfología, funciones. Leucocitos: tipos, formula leucocitaria absoluta y relativa. Características morfológicas y funcionales de los neutrófilos, eosinófilos y basófilos. Linfocitos y monocitos. Plaquetas: cantidad, estructura, ultraestructura y funciones. Médula ósea. Comportamiento hematopoyético. Células pluripotenciales. Diferenciación eritrocítica. Eritroblastos, reticulocitos, eritrocitos, ciclo vital. Granulopoyesis. Ciclo vital del polimorfonuclear. Progenies granulocíticas, linfocíticas y monocíticas. Trombocitopoyesis. 6 HISTOLOGÍA SISTEMA LINFOIDE. Órganos linfoides primarios y secundarios. Tejido linfoide: retículo, macrófago, células interdigitantes, células dendríticas, células de Langerhans. Células linfáticas: linfocitos, linfoblastos, plasmocitos. Linfocitos T y B. Subclases. Células accesorias. Inmunoglobulinas. Respuesta inmunitaria primaria y secundaria. Células con memoria inmunológica. Células productoras de interleuquinas. Timo: organización histológica, corpúsculo de Hassall. Circulación sanguínea. Funciones. Tipos de folículos. Circulación linfática. Bazo: organización de la pulpa roja y la pulpa blanca. Zonas T y B dependientes. Circulación esplénica, su importancia. SISTEMA CARDIOVASCULAR. Corazón. Epicardio y endocardio. Válvulas cardíacas. Sistema de conducción. Estructura general de los vasos. Ultraestructura y clasificación de los capilares. Microcirculación. Arterias: tipos, estructura de las capas. Venas: tipos, estructura. APARATO RESPIRATORIO. Vías aéreas superiores: estructura histológica y rol en fonación, conducción y acomodamiento del aire y olfación. Epitelio respiratorio: tipos celulares e importancia funcional. Tráquea bronquios y bronquiolos. Epitelio bronqueolar. Estructura histológica. Tipos de bronquiolos. Sistema de hematosis: conductos y sacos alveolares, alvéolos. Estructura y ultraestructura del alvéolo. Neumonocitos I y II. Macrófagos alveolares. Barrera de hematosis. Irrigación pulmonar. Intersticio alveolar: tejido conectivo, fibras elásticas, su importancia. Células neuroendocrinas de las vías aéreas. Pleura: estructura histológica. APARATO URINARIO. Organización del mismo. Arquitetura renal: cápsula, corteza y médula. El nefrón: sus partes (corpúsculo de Malpighi: glomérulo vascular, mesangio y cápsula de Bowman, túbulo contorneado proximal, asa de Henle y túbulo contorneado distal): estructura y ultraestructura. Túbulos colectores. Papilas, cálices y pelvis renal. Estructura histológica del uréter y vejiga. Irrigación del riñón. Circulación capilar postglomerular en nefrones yuxtamedulares y corticales superficiales. Histofisiología renal: ultrafiltración, absorción, secreción, concentración y pinocitosis. Aparato yuxtaglomerular: estructura y función. APARATO DIGESTIVO. Organización general, irrigación inervación y drenaje linfático. Lengua: estructura general. Papilas, sus tipos, corpúsculos gustativos. Glándulas intralinguales. Esófago: estructura general, glándulas. Estructura a distintos niveles. Estómago: regiones, mucosa fúndica, tipos celulares. Ultraestructura de células principales, parietales mucosas y neuroendocrinas. Histofisiología de la mucosa gástrica. Regeneración epitelial. Duodeno y yeyunoíleon: características regionales, mucosa intestinal, estructura y ultraestructura de los distintos tipos celulares. Histofisiología de la mucosa intestinal. Absorción intestinal Sistema enteroendocrino. Intestino grueso: estructura histológica del colon, apéndice secal y recto. GLÁNDULAS ANEXAS DEL APARATO DIGESTIVO. Hígado: estructura general. Lobulillo hepático, tipos de lobulación, cápsula de Glisson, espacios porta, vías biliares intra y extrahepáticas. Hepatocito: ultraestructura, polaridad, funciones. Circulación sanguínea y biliar intrahepática. Vías biliares extrahepáticas. Vesícula biliar: estructura histológica. Páncreas exócrino: estructura histológica, acinos y conductos. Glándulas salivales mayores: estructura histológica de la parótida, submaxilar y sublingual. Tipos de acinos. Sistema canalicular. GLÁNDULAS ENDOCRINAS. Características generales. Hipófisis: lóbulos y divisiones. Origen embriológico de sus componentes. Irrigación: sistema porta hipofisario. Técnicas especiales para el estudio de la adenohipófisis. Tipos celulares de la adenohipófifis: citología, ultraestructura, histoquímica y función. Neurohipófisis: relación con el hipotálamo, estructura histológica. Neurosecreción. Fibras nerviosas, pituicitos y capilares. Tiroides: estructura histológica. Folículo tiroideo, su citología. Coloide: composición y función. Células parafoliculares: citología y función. Variaciones citológicas del epitelio del folículo. Paratiroides: estructura histológica. Tipos celulares, ultraestructura y función. Suprarrenal: corteza y médula, estructura histológica. Zonas de la 7 HISTOLOGÍA corteza. Histoquímica e histofisiología de las zonas. Células cromafines, citología. Histoquímica, ultraestructura y función. Páncreas endócrino: estructura del islote de Langerhans. Tipos celulares, histoquímina, ultraestructura y función. APARATO GENITAL FEMENINO. Ovario: epitelio ovárico, corteza e hilio. Tipos de folículos. Ovogénesis. Estructura y ultraestructura del ovocito. Zona pelúcida. Ultraestructura durante la ovogénesis y la fecundación. Líquido folicular y su significado funcional. Tecas: estructura histológica. Ovulación. Cuerpo amarillo: estructura y evolución. Células intersticiales. Atresia folicular. Ciclo ovárico. Trompas de Falopio: estructura histológica y zonas. Útero: estructura histológica del endometrio. Corion y glándulas. Ciclo endometrial: estructura histológica de la mucosa en las distintas fases. Irrigación del endometrio. Histofisiología del ciclo endometrial. Cuello uterino: estructura histológica del endo y exocervix. Vagina: estructura histológica, ciclo y citología exfoliativa. Glándula mamaria: estructura histológica de la glándula en reposo, puerperal, prepuberal y en involución. Histofisiología. APARATO GENITAL MASCULINO. Testículo: albugínea: estructura. Túbulos seminíferos: morfología y estructura. Pared tubular. Membrana basal. Células mioides. Epitelio seminífero: sus componentes. Espermatogonias tipo A y B, subtipos, renovación espermatogonial. Espermatocitos, meiosis. Conducta de los cromosomas X e Y. Ultraestructura del espermatocito. Divisiones meióticas I y II. Espermatocitos secundarios. Espermiogénesis, fases de la misma. Diferenciaciones nucleares y citoplasmáticas de la espermátide. Espermiación. Espermatozoide: ultraestructura de sus regiones (cabeza, cuello, pieza intermedia y final), movilidad. Proceso de la espermatogénesis. Duración. Ciclo del epitelio seminífero. Asociaciones celulares. Onda del epitelio seminífero. Células de Sértoli: citología y ultraestructura. Compartimento del túbulo seminífero. Funciones de la célula de Sértoli. Líquido intratubular. Tejido intersticial: células de Leydig: ultraestructura y función. Espermograma normal. Vías excretoras: rete testis, tubos rectos, conductos eferentes. Epidídimo: estructura histológica y función. Conducto deferente: estructura. Uretra: estructura. Pene: estructura histológica. Glándulas anexas: vesícula seminal y próstata: su estructura histológica. SISTEMA NERVIOSO. Cerebro: sustancia blanca y corteza. Tipos y capas de la corteza. Cito y mieloarquitectura. Tipos celulares: neuronas de axón corto y largo. Organización columnar. Funciones. Cerebelo: laminillas. Capas de la corteza. Tipos celulares. Aferencias y eferencias. Glomérulo cerebeloso. Circuitos cerebelosos. Meninges y plexos coroideos. Estructura histológica. Líquido cefalorraquídeo. Médula espinal: estructura histológica. Ganglio raquideo y simpático: estructura histológica y diferencias. Ganglios parasimpáticos intramurales. PIEL Y GLÁNDULAS ANEXAS. Epidermis y dermis. Piel fina y gruesa. Estratos de la epidermis. Tipos celulares: queratinocitos, melanocitos, células de Langerhans, células de Merkel, ultraestructura y función de cada tipo celular. Dermis: sus estratos. Folículo piloso: estructura. Glándulas sudoríparas apócrinas y ecrinas: estructura y función. Glándulas sebáceas: estructura. RECEPTORES SENSORIALES. Corpúsculos de Krause, Meissner y Paccini; husos musculares y órganos tendinosos de Golgi. Receptores sensoriales del gusto: corpúsculo gustativo. Células neuroepiteliales y basales: su ultraestructura y función. Mucosa olfatoria. Células olfatorias y de sostén: ultraestructura y función. ÓRGANOS DE LOS SENTIDOS. Ojo: estructura del ojo. Esclerótica, córnea y cristalino. Células del cristalino. Coroides. Retina: histogénesis, capas y tipos celulares. Epitelio pigmentario: estructura y función. Fotorreceptores: partes, ultraestructura y función. Nutrición de los mismos. Capas plexiformes. Tipos neuronales. Histofisiología de la retina. Estructura histológica de la papila y la mácula. Glándula lagrimal: estructura. Oído interno: organización, laberinto membranoso, laberinto 8 HISTOLOGÍA vestibular y conductos semicirculares. Tipos celulares. Histofisiología. Órgano de Corti. Histofisiología del laberinto coclear. 9 HISTOLOGÍA SEMINARIOS DE HISTOLOGÍA (SH) SH1 – SEMINARIO Nº 1: MICROSCOPÍA A) OBJETO DE ESTUDIO DE LA HISTOLOGIA Y LA BIOLOGIA CELULAR Definir los propósitos de la histología, la biología celular y molecular como ciencias. Conocer los modelos y técnicas empleadas en las ciencias previamente mencionadas. Explicar las características y utilidades principales de cada una de estas técnicas. Reconocer a la Histología como una ciencia morfológica. Reconocer al microscopio óptico (MO) y al microscopio electrónico de transmisión (MET) como instrumentos de la histología y la biología celular respectivamente y a la estructura y la ultraestructura como los niveles de información morfológica aportados por estos. Explicar los conceptos de estructura y ultraestructura. Diferenciar las características morfológicas de las funcionales. Definir los conceptos de célula, tejido y órgano. Describir los componentes de un tejido. B) MICROSCOPIA Describir las características de un microscopio. Microscopios ópticos: Describir las características de un microscopio óptico (MO). Reconocer las partes constitutivas de un MO. Describir los conceptos de poder resolutivo (PR), límite de resolución (LR) y aumento (A). Conocer las posibles formas de aumentar el PR en base al análisis de la fórmula de LR. Diferenciar los conceptos de PR y A. Describir las características fundamentales de los diferentes tipos de microscopios ópticos. Ejemplificar utilidades científicas y médicas de los diferentes tipos de microscopios ópticos. Microscopios electrónicos: Describir las características de un microscopio electrónico de transmisión (MET). Describir las partes constitutivas de un MET. Comparar las características de un MO y de un MET. Reconocer las ventajas y desventajas de un MO y de un MET. Describir las características de un microscopio electrónico de barrido (MEB). Comparar las características de un MET y de un MEB. Reconocer las ventajas y desventajas de cada uno de ellos. Ejemplificar utilidades científicas y médicas de los diferentes tipos de los ME. SH2 – SEMINARIO Nº 2: TÉCNICA HISTOLÓGICA Definir el concepto de técnica histológica. Conocer las características fundamentales del estudio de material biológico en forma inmediata o in vivo y mediata o postmortem y reconocer las ventajas y desventajas de los mismos. Enumerar los pasos y fundamentos de la técnica histológica de rutina y de MET. Reconocer las principales variables aplicables en la técnica histológica. 10 HISTOLOGÍA Describir las diferentes formas de: i. Obtener el material; ii. Conservar la estructura; iii. Dar la consistencia adecuada a la muestra para que pueda ser cortada; iv. Ejecutar los cortes histológicos; v. Hacer visibles distintos componentes celulares y tisulares. Reconocer las diferencias en los pasos de la técnica histológica utilizada para MO y MET. Explicar los conceptos de basofilia y acidofilia. Conocer algunos colorantes básicos y ácidos. Mencionar los fundamentos de la coloración de los distintos componentes tisulares en base a su composición ultraestructural y bioquímica. Explicar los conceptos de ortocromasia y metacromasia. Mencionar algunos colorantes metacromáticos y reconocer componentes tisulares metacromáticos. Técnicas histológicas especiales: Explicar los conceptos de citoquímica e histoquímica. Reconocer los fundamentos, pasos y utilidades de los distintos tipos de técnicas cito e histoquímicas (PAS, Feulgen, Sudán, técnicas de detección enzimáticas, inmunohistoquímica, radioautografía, hibridización in situ). Jerarquizar la utilidad de cada una de ellas. Resolver cómo deben modificarse los pasos de la técnica histológica de acuerdo a lo que desee detectarse en el preparado. SH3 – SEMINARIO Nº 3: TEJIDO EPITELIAL A) TEJIDOS Definir el concepto de tejido. Enunciar los tipos básicos de tejido. Conocer el origen embriológico de cada uno de ellos. Ejemplificar funciones biológicas de estos tejidos y relacionarlos con su estructura. Definir los conceptos de parénquima y estroma de un órgano. B) TEJIDO EPITELIAL Definir el concepto de tejido epitelial. Describir las características morfológicas (estructurales y ultraestructurales) de los diferentes epitelios y relacionarlas con su función: revestimiento, secreción, sensibilidad, intercambio acuoso, intercambio gaseoso. Célula epitelial: explicar el concepto de polaridad celular y de dominios de membrana. Establecer relaciones entre estos dos conceptos. Reconocer las características ultraestructurales, bioquímicas y funcionales de las especializaciones de membrana de dominio apical. Explicar el concepto de cilios, microvellosidades, chapa estriada, ribete en cepillo y estereocilias. Relacionar dichas estructuras con la función de los diferentes epitelios de revestimiento. Reconocer las características ultraestructurales, bioquímicas y funcionales de las especializaciones de membrana de dominio laterobasal: zónula occludens o unión hermética, zónula adherens o uniones de anclaje, mácula adherens o desmosomas, uniones nexus, hemidesmosomas, contactos focales. Explicar la composición estructural, ultraestructural y bioquímica, origen, e importancia fisiológica de la lámina y membrana basal. Explicar las características ultraestructurales, bioquímicas y funcionales del glucocálix. Explicar los procesos de proliferación y regeneración de las células epiteliales. Justificar el criterio de clasificación del epitelio en: epitelio de revestimiento y epitelio glandular. B1) TEJIDO EPITELIAL DE REVESTIMIENTO Describir las características morfológicas (estructurales y ultraestructurales) que permiten identificar el epitelio de revestimiento en un preparado histológico de rutina y en MET. 11 HISTOLOGÍA Explicar los fundamentos de la clasificación morfológica basada en el número de capas celulares y en la forma de las células apicales. Describir las características morfológicas de cada tipo de epitelio de revestimiento. Citar ejemplos de cada uno de ellos y su localización. Relacionar su localización y características morfológicas con la función. Entender los conceptos de endotelio y mesotelio. B2) TEJIDO EPITELIAL GLANDULAR Describir las características morfológicas (estructurales y ultraestructurales) y funcionales que permiten identificarlo en un preparado histológico de rutina y MET. Explicar los fundamentos de la clasificación del epitelio glandular en exócrino y endócrino. Comprender el origen embriológico de las glándulas exócrinas y endócrinas. B2.1) TEJIDO EPITELIAL GLANDULAR EXOCRINO Describir las características estructurales que permiten identificarlo. Justificar los criterios de los distintos tipos de clasificaciones: a. Número de células. b. Mecanismo de secreción. c. Componente de secreción. d. Morfología: i) forma del adenómero; ii) ramificaciones del adenómero; iii) ramificaciones del conducto excretor. Aplicar esta clasificación a los distintos tipos morfológicos de epitelios glandulares. Enunciar ejemplos de cada uno y describir sus funciones Describir los distintos tipos morfológicos de epitelios glandulares. Establecer el diagnóstico diferencial entre los distintos tipos morfológicos de epitelios glandulares exócrinos en base a las diferencias entre: i) alvéolo, túbulo y acino; ii) acino seroso y mucoso. Mencionar técnicas especiales que sean de utilidad para el estudio de este tipo de tejido. Explicar los distintos mecanismos de secreción celular: holócrina, apócrina y merócrina. SH4 – SEMINARIO Nº 4: TEJIDO CONECTIVO NO ESPECIALIZADO Y TEJIDO ADIPOSO A) TEJIDO CONECTIVO Describir las características morfológicas propias del tejido conectivo (TC). Establecer el diagnóstico diferencial con tejido epitelial. Explicar las funciones generales del TC. Fundamentar la clasificación del TC en no especializado y especializado. Explicar el concepto de mesénquima y estroma. B) TEJIDO CONECTIVO NO ESPECIALIZADO (TCNE) Describir las características morfológicas propias del TCNE. Establecer el diagnóstico diferencial con tejido epitelial. Explicar las características morfológicas y funcionales de los distintos tipos de TCNE. Explicar los criterios de clasificación del TCNE. Explicar el diagnóstico diferencial entre los distintos tipos de TCNE. Describir la estructura, ultraestructura y funciones de los componentes celulares e intercelulares del TCNE. Explicar el concepto y el rol de sistema fagocito mononuclear. Explicar las características morfológicas y funcionales diferenciales entre los distintos componentes celulares e intercelulares del TCNE. Mencionar y fundamentar el empleo de técnicas especiales para reconocer los distintos componentes tisulares en un preparado histológico. 12 HISTOLOGÍA Explique las características estructurales que le permiten diferenciar el TC colágeno laxo y el TC colágeno denso. Explicar la importancia de la diferenciación entre células estables y migratorias. Explicar las diferencias estructurales y ultraestructurales de un fibroblasto y un fibrocito. Explicar las funciones de los fibroblastos, los estímulos que inducen su proliferación y reparación de lesiones. Explicar qué es una célula mesenquimática. Células migrantes del tejido conectivo: describir las principales características morfológicas y funcionales. Macrófago: explicar origen, activación y funciones. Plasmocito: describir esctructura y ultraestructura y relacionarlas con su función. Describir de qué células se diferencian Mastocitos: describir su ultraestructura y relacionar su rol en las relaciones alérgicas. Explicar qué es una fibra de colágeno. Explicar el proceso de síntesis, secreción y modificaciones extracelulares del colágeno (como ejemplo de síntesis de proteína de exportación) hasta la formación de las fibras de colágeno. Mencionar los distintos tipos de moléculas de colágeno y su localización tisular. Describir las fibras reticulares y elásticas. Mencionar técnicas especiales para localizarlas. C) TEJIDO ADIPOSO Reconocer al tejido adiposo como una forma especializada de TC. Explicar las características morfológicas (estructurales y ultraestructurales) y funcionales del tejido adiposo. Justificar el uso de técnicas histológicas especiales para su reconocimiento. Describir las características estructurales, ultraestructurales y funcionales del tejido adiposo pardo. Explicar las semejanzas y diferencias morfológicas (estructurales y ultraestructurales) del tejido adiposo blanco y pardo. SH5 – SEMINARIO Nº 5: TEJIDO CARTILAGINOSO Y HUESO. A) TEJIDO CARTILAGINOSO Reconocer al tejido cartilaginoso como una forma especializada de TC. Describir las características morfológicas y funcionales del tejido cartilaginoso. Describir las características estructurales, ultraestructurales y funcionales de sus componentes celulares: condroblastos, condrocitos y células condroprogenitoras. Describir las características estructurales, ultraestructurales y funcionales de la matriz cartilaginosa: componentes químicos. Importancia funcional en la nutrición del cartílago. Justificar el criterio de clasificación del tejido cartilaginoso en hialino, fibroso y elástico. Mencionar ejemplos de cada tipo y su localización en el organismo. Describir las siguientes estructuras: condroplasto, pericondrio, grupos isógenos coronarios y axiles. Explicar su significación biológica. Explicar los procesos de histogénesis, crecimiento y calcificación de este tejido. Explicar por qué mueren los condrocitos cuando se calcifica la matriz. Cartílago hialino: explicar su histogénesis y crecimiento: centros de condrificación, grupos isógenos, pericondrio; crecimiento aposicional e intersticial. Articulaciones: breve clasificación de los tipos de articulaciones. Sus componentes: cartílago articular, cápsula articular fibrosa, membrana sinovial y líquido sinovial. Procesos de degeneración y desgaste. Describir las características estructurales que permiten identificarlo en un preparado histológico de rutina. 13 HISTOLOGÍA Justificar el empleo de técnicas histológicas especiales para el estudio del tejido cartilaginoso. Describir cómo se observa el cartílago con azul de toluidina. B) TEJIDO OSEO Reconocer al tejido óseo cómo un TC especializado. Explicar las funciones del tejido óseo. Explicar los tipos de histoarquitectura del hueso: hueso compacto y esponjoso: primario o reticular y laminar. Describir la estructura y organización macroscópica y microscópica del hueso esponjoso y compacto. Explicar las principales diferencias morfológicas entre ambos: sistema de Havers (osteona, laminillas, conductos de Havers, conductos de Wolkman), periostio, endostio. Describir la estructura y función del periostio y del endostio. Describir la morfología (estructura y ultraestructura) y función de los componentes celulares: células osteoprogenitoras, osteoblastos, osteocitos y osteoclastos. Describir el origen de cada una de ellas. Describir la morfología (estructura y ultraestructura) y función de los componentes de la matriz extracelular (orgánicos e inorgánicos). Explicar el concepto de osteoplasto. Describir las características de la matriz intercelular ósea: estructura, composición, mecanismos de formación. Importancia de las vesículas de matriz. Proceso de mineralización de la matriz. Explicar los mecanismos fisiológicos que permiten el proceso de calcificación del hueso y la regulación del metabolismo del calcio en el organismo. Explicar los procesos de osteólisis osteocitaria y resorción ósea. Explicar los procesos de histogénesis ósea (osificación endocondral e intramembranosa). Relacionar la morfología de la placa epifisaria con los sucesos fisiológicos que ocurren durante la osificación. Explicar los procesos de crecimiento, modelación y remodelación ósea. Secuencia de activación, resorción y formación de hueso. Factores hormonales y nutricionales que influyen sobre el metabolismo óseo. Proceso de desmineralización del hueso en relación a la edad. Concepto de unidad remodeladora ósea (BRU). Importancia funcional de la remodelación ósea. Explicar cómo se nutren las células del tejido óseo. Comparar las siguientes características de los tejidos óseo y cartilaginoso: estructura (componentes), función, nutrición y crecimiento (aposicional). Explicar los fundamentos de dos técnicas histológicas usadas para su estudio al MO: descalcificación con posterior coloración con H&E; y por desgaste. Describir los componentes tisulares y las estructuras observadas con cada una de ellas. SH6 – SEMINARIO Nº 6: SANGRE, MÉDULA ÓSEA Y HEMOPOYESIS. A) SANGRE Reconocer a la sangre como un TC especializado. Mencionar los elementos formes de la sangre y sus funciones. Explicar qué es el plasma y mencionar su composición química. Explicar los fundamentos y utilidades de cada uno de los métodos utilizados para estudiar este tejido: extendido o frotis, recuento globular, hematocrito. Describir la técnica para realizar un frotis, indicar los colorantes usados y los resultados y utilidades de los mismos. Eritrocito: Describir y reconocer su estructura y ultraestructura. Describir sus funciones. Explicar la importancia de la hemoglobina y del citoesqueleto asociado a la membrana. Describir su ciclo vital. Explicar qué es un reticulocito y qué importancia clínica tiene su evaluación. 14 HISTOLOGÍA Plaquetas: describir y reconocer sus características estructurales y ultraestructurales. Explicar sus funciones. Neutrófilos: describir y reconocer sus características estructurales y ultraestructurales. Describir sus funciones. Describir los tipos de gránulos y su contenido, explicar el proceso de fagocitosis y relacionarlos con las funciones de este tipo celular. Eosinófilos: Describir y reconocer sus características estructurales. Describir sus funciones. Describir los tipos de gránulos y su contenido. Explicar el proceso de endocitosis y degranulación y relacionarlos con las funciones de este tipo celular. Basófilos: Describir y reconocer sus características estructurales y ultraestructurales. Describir sus funciones. Describir sus granos y su contenido. Relacionarlo con sus funciones. Explicar las diferencias y semejanzas con los mastocitos. Linfocitos: describir y reconocer sus características estructurales y ultraestructurales. Describir sus funciones. Mencionar los tipos de linfocitos. Explicar la relación entre los linfocitos B y los plasmocitos. Monocitos: describir y reconocer sus características estructurales y ultraestructurales. Describir sus funciones. Explicar el concepto y el rol de sistema fagocito mononuclear. Mencionar los valores aproximados de vida media de los elementos formes de la sangre. Explicar la utilidad médica del conocimiento de los elementos formes de la sangre mediante los métodos que sirven para estudiarlos. Explicar el concepto de fórmula leucocitaria relativa y absoluta y cómo se obtiene. Mencionar los valores normales de los recuentos de todos los elementos formes de la sangre y los valores normales del recuento leucocitario relativo. Mencione qué utilidad tiene cada una de ellas. Describir la estructura (como se observan coloreados con May-Grünwald-Giemsa y con H&E) y ultraestructura de los elementos formes de la sangre. Mencionar el colorante utilizado para reconocer los reticulocitos. Describir la estructura y ultraestructura de un reticulocito observado con este colorante. B) MÉDULA ÓSEA Y HEMATOPOYESIS Definir el concepto de hematopoyesis. Reconocer al tejido hematopoyético como un TC especializado. Describir los procesos de hematopoyesis: eritropoyesis, trombopoyesis, granulopoyesis, monopoyesis y linfopoyesis a partir de células madre hematopoyéticas. Describir la estructura y ultraestructura de las células morfológicamente reconocidas de las distintas progenies sanguíneas. Describir la estructura histológica de la médula ósea como órgano: nidos rojos y blancos, megacariocitos, vasos y células del estroma. Describir y explicar las diferencias estructurales y funcionales de la médula ósea blanca y amarilla. Mencionar los dos métodos principales utilizados para estudiar la médula ósea (extendido de punción aspiración y corte de punción biopsia). Explicar las principales diferencias y utilidades de los dos métodos. Explicar el diagnóstico diferencial entre los distintos elementos celulares de la médula ósea. Explicar el diagnóstico diferencial entre un megacariocito y un osteoclasto. Explicar el concepto de célula madre o stem cell y de célula progenitora o unidad formadora de colonia (UFC). Explicar el concepto de factores estimuladores de colonias. Conocer ejemplos y las funciones de cada uno de ellos. Regulación de la hemopoyesis. 15 HISTOLOGÍA SH7 – SEMINARIO Nº 7: TEJIDO MUSCULAR A) TEJIDO MUSCULAR Explicar las características morfológicas estructurales y ultraestructurales propias del tejido muscular. Establecer el diagnóstico diferencial entre tejidos epitelial, conectivo y muscular desde el punto de vista estructural y ultraestructural. Explicar qué es una fibra muscular, miofibrilla y miofilamento. Justificar la diferencia entre los conceptos de fibra muscular y fibra de colágeno. Explicar las características morfológicas que permiten hacer el diagnóstico diferencial entre el TC colágeno denso y el tejido muscular en un preparado histológico de rutina MÚSCULO ESTRIADO ESQUELÉTICO Describir la estructura de una fibra muscular estriada esquelética. Reconocer al músculo estriado esquelético como un sincicio celular. Describir la estructura del endomisio, perimisio y epimisio. Explique qué son las células satélites. Indique su ubicación y su importancia funcional. Describir la organización ultraestructural y la composición bioquímica de los miofilamentos. Explicar el proceso de contracción muscular a nivel ultraestructural y molecular. Describir la función del calcio en la contracción del músculo estriado esquelético y mencionar los sitios de almacenaje y acción. Acoplamiento de excitación-contracción en la fibra muscular esquelética Explicar la composición ultraestructural de un sarcómero. Mencionar los tipos de fibras estriadas esqueléticas y sus características principales: fibras rojas, intermedias y blancas. Describir su inervación motora y sensitiva. Placa neuromuscular. Explicar la histogénesis del músculo esquelético. MÚSCULO ESTRIADO CARDIACO Describir la estructura de una fibra muscular estriada cardíaca. Describir la estructura, ultraestructura y funciones de las bandas escaleriformes. Explicar la función de los gránulos secretorios de las fibras musculares de la aurícula. Explicar las características morfológicas y funcionales de las células del sistema de conducción. MÚSCULO LISO Mencionar la distribución, ubicación y relaciones en cada aparato o sistema. Describir su estructura al MO y su ultraestructura de una fibra muscular lisa. Describir las bases ultraestructurales y moleculares de la contracción. Remarcar sus diferencias con el músculo estriado. Describir la inervación del músculo liso; diferenciarlo con respecto a los demás tipos de músculo. SH8 – SEMINARIO Nº 8: TEJIDO NERVIOSO Explicar las características morfológicas distintivas del tejido nervioso. Explicar las funciones del tejido nervioso. Mencionar los componentes tisulares del sistema nervioso central (SNC): neuronas, células de la glía (astrocitos, oligodendrocitos, microglía, células ependimarias). 16 HISTOLOGÍA Describir los componentes tisulares del sistema nervioso periférico (SNP): neuronas, células de la glía (células de Schwmann, células satélites). Describir el origen embriológico del tejido nervioso que forma parte del SNC y del SNP. Diferenciar el origen embriológico de la microglía. Describir las características estructurales, ultraestructurales y funcionales de las neuronas y de las células de la glía. Describir las características estructurales y funcionales de la sustancia gris (SG) y blanca (SB). Explicar la clasificación de las neuronas según su morfología: pseudomonopolares, bipolares, multipolares. Explicar el criterio de clasificación de las neuronas Golgi tipo I y II. Importancia biológica y funcional de la misma. Describir las características estructurales y ultraestructurales de las neuronas. Describir las diferencias estructurales, ultraestructurales y funcionales entre una dendrita y un axón. Comprender la importancia funcional del transporte axonal (anterógrado y retrógrado) y su implicancia funcional. Explicar el proceso de mielinización. Describir las diferencias entre la mielinización central y periférica. Mencionar técnicas empleadas para el reconocimiento de la mielina. Comparar los axones mielínicos y amielínicos del SNP (número de axones rodeados por una célula de Schwann, velocidad de conducción, nodos de Ranvier, conducción saltatoria). Describir la estructura de un nervio (epineuro, perineuron y endoneuro): tipo de tejido que compone el epineuro, el perineuron y el endoneuro, célula que sintetiza la matriz extracelular del endoneuro. Describir las características ultraestructurales y funcionales de la sinapsis química. Mencionar los distintos tipos de sinapsis. Mencionar las técnicas de microscopia útiles para su estudio. Explicar el rol del astrocito en las sinapsis químicas del SNC. Explicar el concepto de circuitos neuronales. Explicar el concepto de trofismo neuronal Definir el concepto de neuropilo. Mencionar las técnicas histológicas especiales para observarlo con el MO. Explicar la estructura y ultraestructura de la barrera hemato-encefálica, hemato-raquídea y encéfalo-raquídea. Explicar la importancia funcional de la barrera hemato-encefálica. Mencionar en qué sitios está ausente. Describir la estructura de los plexos coroideos y su función. Describir las características estructurales y funcionales de las meninges. Explicar los fundamentos y utilidades de las distintas técnicas histológicas empleadas para el estudio del tejido nervioso. Describir las características estructurales de las células neuronales y gliales con cada una de estas técnicas. Técnica de Nissl: explique qué son los corpúsculos de Nissl, a que se debe su basofilia. Relacionar la presencia de un núcleo de cromatina laxa y la gran cantidad de corpúsculos de Nissl con la función de una neurona. Mencionar técnicas de coloración especiales para detectar astrocitos. Establecer el diagnóstico diferencial entre los tejidos epitelial, conectivo, muscular y nervioso en un preparado histológico de rutina. SH9 – SEMINARIO Nº 9: SISTEMA CARDIOVASCULAR Definir los conceptos de órgano, sistema y aparato. Definir el concepto de sistema circulatorio. Mencionar los componentes del sistema circulatorio (cardiovascular o sanguíneo y linfático). Mencionar las principales funciones de cada uno de los componentes del sistema circulatorio. 17 HISTOLOGÍA Mencionar los tejidos básicos que constituyen el sistema circulatorio. Explicar qué es el endotelio y cuáles son sus funciones. Permeabilidad, pinocitosis, trancitosis, síntesis de sustancias. Su función como barrera selectiva de intercambio, concepto de barreras hemato-tisulares. Describir la organización estructural concéntrica básica de todos los componentes del sistema circulatorio. Describir la estructura de todos los componentes del sistema circulatorio: corazón, sistema macrovascular arterias elásticas, arterias musculares, arteriolas, metarteriolas, capilares, vénulas periciticas, vénulas musculares, venas, capilares y conductos linfáticos. Mencionar ejemplos de cada tipo de vaso. Explicar el diagnóstico diferencial general entre vaso arterial y venoso. Realice un esquema de ambos tipos. Explicar la clasificación de los capilares (continuos, fenestrados y discontinuos-sinusoides-). Mencionar ejemplos de cada tipo de capilar. Correlacionar la ultraestructura de los diferentes tipos de capilares con su función en el órgano donde estén localizados. Describir brevemente la estructura, ultraestructura, ubicación y funciones de los pericitos. Modificaciones de la pared arterial en relación con la edad. Definir el concepto de sistema porta. Explicar su importancia biológica. Mencionar ejemplos de sistemas porta. Corazón: conocer su organización estructural en endocardio, miocardio y pericardio. Explicar el diagnóstico diferencial entre endocardio y epicardio. Estructuras fibrosas del corazón: válvulas cardíacas, anillos fibrosos, tabiques interventriculares y cuerdas tendinosas.Mencionar los componentes del sistema de conducción exitatorio cardíaco. Describir la estructura y ultraestructura de las fibras nodales, de Purkinje y contráctiles auriculares y ventriculares. Explicar las principales diferencias entre las fibras musculares cardíacas antes mencionadas. Vías linfáticas: Estructura de las vías linfáticas: capilares linfáticos, vasos colectores y conducto torácico. Concepto de edema. SH10 – SEMINARIO Nº 10: INMUNIDAD Y ÓRGANOS LINFÁTICOS Reconocer los componentes del sistema linfático: timo, bazo, ganglio linfático, tejido linfoide difuso y tejido linfoide folicular (tejido linfoide asociado a mucosas – MALT). Comprender el papel de timo, bazo y ganglios linfáticos en los procesos de inmunidad. Reconocer las características estructurales de los diferentes órganos linfáticos. Diferenciar órganos linfoides primarios y secundarios. Conocer los componentes del tejido linfoide: linfocitos (linfocito B y T), linfoblastos, células plasmáticas, células dendríticas, macrófagos, células interdigitadas, células de Langerhans. Células accesorias. Timo: explicar sus funciones. Describir la organización histológica (capsula, corteza y médula), componentes celulares (células epitelioreticulares, linfoblastos, linfocitos T, células dendríticas, macrófagos), componentes de la matriz extracelular y circulación sanguínea. Células epitelioreticulares: orígenes embriológicos, subtipos, corpúsculos de Hassall. Explicar los componentes de la barrera hematotímica y su función. Explicar las diferencias ultraestructurales entre las células epitelioreticulares y las células reticulares. Selección positiva y negativa de linfocitos. Ganglio linfático: esplicar sus funciones. Describir la organización histológica: folículos linfáticos primarios y secundarios (zona externa y centro germinativo), componentes celulares y de la matriz extracelular. Explicar la circulación sanguínea y linfática. Vénulas de 18 HISTOLOGÍA endotelio alto: estructura, localización y función. Explicar los procesos que se llevan a cabo en el centro germinativo y su importancia funcional. Bazo: explicar sus funciones. Describir la organización histológica: capsula, pulpa roja (sinusoides esplénicos separados por cordones esplénicos o de Billroth) y pulpa blanca (corpúsculo de Malpighi, vaina linfática periarteriolar, zonas T y B dependientes), componentes celulares y de la matriz extracelular (fibras reticulares). Explicar la circulación esplénica y su importancia. Características ultraestructurales de los sinusoides esplénicos. Tejido linfoide asociado a mucosas (MALT) y a piel (SALT): su localización y la importancia biológica del mismo. Nociones básicas sobre inmunidad: tipos de inmunidad, inmunidad ligada a mucosas y de productos de secreción. Respuesta inmune primaria y secundaria. Expansión clonal. Memoria inmunológica. Células presentadoras de antígenos. Nomenclaturas CD y CMH. Inmunidad humoral: tipos de inmunoglobulinas, Linfocitos B, su diferenciación a plasmocitos Inmunidad celular: tipos de linfocitos T. Colaboración T-B en la respuesta inmune. Reconocimiento de lo propio y lo ajeno, reacciones autoinmunes como origen de distintas enfermedades Diferenciar entre respuesta inmunitaria humoral y la mediada por células. Conocer la respuesta inmunitaria primaria y secundaria. Células productoras de interleuquinas. Inmunoglobulinas. Comprender el papel de los anticuerpos y de la activación del complemento en la respuesta inmunitaria. Diferenciar nódulo linfático primario y secundario. Explicar qué es el centro germinativo. Realizar el diagnóstico diferencial de cada órgano linfático. SH11 – SEMINARIO Nº 11: APARATO RESPIRATORIO Identificar las estructuras y órganos que forman el aparato respiratorio. Vías aéreas superiores: describir la estructura histológica de las cavidades nasales, faringe y laringe. Epitelio olfatorio y respiratorio, componentes celulares. Células neuroendocrinas. Importancia funcional. Vías aéreas inferiores: describir la estructura histológica de la tráquea y bronquios: capas mucosa, submucosa, cartilaginosa y adventicia y tipos celulares del epitelio respiratorio. Describir la estructura histológica de los bronquiolos propiamente dichos, terminales, y respiratorios: capas y tipos celulares. Conocer el diagnóstico diferencial de cada una de estas estructuras y las funciones que los diferencian. Alvéolos: tipos celulares que los componen, barrera alvéolo-capilar. Macrófagos alveolares. Sistema de hematosis: conductos, sacos alveolares y alvéolos. Estructura y ultraestructura del alvéolo. Tipos celulares: neumonocitos I y II y macrófagos alveolares. Explicar la composición de la barrera hemato-alveolar y su función. Conocer los componentes del intersticio alveolar (tejido conectivo y fibras elásticas) y su importancia funcional. Comunicación interalveolar, su importancia funcional. Circulación sanguínea del pulmon. Estructura histológica de la pleura. 19 HISTOLOGÍA SH12 – SEMINARIO Nº 12: APARATO URINARIO Reconocer los órganos que componen el aparato urinario y la organización histológica de los mismos. Principales funciones de este aparato. Riñón: explicar sus funciones. Describir la organización histológica y diferenciar las estructuras presentes en corteza y medula. Reconocer al nefrón como la unidad anátomofuncional del riñón y sus componentes estructurales: corpúsculo de Malpighi (glomérulo vascular, mesangio y cápsula de Bowman), túbulo contorneado proximal asas de Henle y túbulo contorneado distal. Conocer las funciones de cada una de estas estructuras. Diferenciar los tipos de nefronas: corticales y yuxtamedulares. Aparato yuxtaglomerular: localización, componentes (células mesangilaes extraglomerulares, macula densa, células yuxtaglomerulares) y función.Túbulos colectores (TC), cálices y pelvis renal. Irrigación del riñón. Barrera de ultrafiltrado glomerular: conocer los componentes celulares y extracelulares de la membrana de filtración glomerular, conocer los componentes de la sangre que pueden atravesarla y de qué depende la filtración de estas moléculas. Mesangio: conocer la los componentes de la matriz mesangial, conocer la función de las células mesangiales glomerulares y extraglomerulares y extracelular. Circulación sanguínea: explicar el sistema porta renal (qué es y dónde se localiza?) y su importancia funcional. Explicar el sistema renina-angiotensina-aldosterona y la regulación de la presión arterial. Túbulos colectores y hormona antidiurética. Vias urinarias: Cálices renales, uréter, vejiga y uréter: describir la organización histológica organizada en túnicas. SH13 – SEMINARIO Nº 13: TUBO DIGESTIVO Conocer los conceptos sobre degradación de alimentos, transporte, absorción y excreción de sustancias en el tubo digestivo. Describir la organización histológica general del aparato digestivo: túnicas mucosa (epitelio, lamina propia y muscular de la mucosa), submucosa, muscular, adventicia o serosa. Irrigación, drenaje linfático e inervación. Lengua: estructura general Esófago: función. Organización histológica: mucosa (epitelio plano estratificado, lamina propia con gl. esofágicas cardiales, muscular de la mucosa), submucosa (con glándulas esofágicas propiamente dichas). Estructura a distintos niveles. Glándulas esofágicas cardiales de la mucosa (glándulas tubulares mucosas ramificadas), glándulas esofágicas propiamente dichas (importancia en la protección de la mucosa esofágica. Estómago: función. Organización histológica, características ultraestructurales de los tipos celulares de las glándulas corpofúndicas (células principales, parietales mucosas y neuroendócrinas) y sus funciones. Sistema neuroendocrino difuso: tipos celulares y funciones. Histofisiología de la mucosa gástrica. Regeneración epitelial. Intestino delgado: función. Organización histológica del duodeno y yeyuno-íleon. Características ultraestructurales de los tipos celulares presentes de las glándulas de Lieberkühn. Enterocitos: funciones digestivas y absortivas. Enzimas del glucocálix, su importancia en los trastornos de absorción de hidratos de carbono. Células de Paneth. Intestino grueso: función. Organización histológica del colon, apéndice cecal y recto. Funciones inmunológicas del tubo digestivo: tejido linfoide asociado con el tracto gastrointestinal (GALT). Inervación del tubo digestivo: plexos de Meissner y de Auerbach Explicar la diferencia entre una microvellosidad, una vellosidad y una válvula connivente 20 HISTOLOGÍA SH14 – SEMINARIO Nº 14: GLÁNDULAS ANEXAS DEL TUBO DIGESTIVO Hígado: concepto del órgano como glándula mixta. Describir su organización histológica general (lobulillo hepático, tipos de lobulación, espacios portales, vías biliares intrahepáticas). Hepatocito: características estructurales y ultraestructurales, función. Irrigación hepática: sistema porta hepático, sus componentes, características de los sinusoides hepáticos. Espacio de Disse. Circulación biliar. Diferentes enfoques en la división del parénquima hepático. Tipos de lobulillos: criterios de clasificación. El hígado como órgano de defensa: fagocitosis, producción de IgA en el tubo digestivo, su captación hepática y su secreción con la bilis. Célula de Kupffer: localización y función. Describir la vía biliar.Papel del hígado en el metabolismo del colesterol. Lipoproteínas de alta, media y baja densidad. Vesícula biliar y vías extra-hepáticas: describir la estructura histológica. Pancreas exócrino: función. Describir la organización histológica (adenómero y porción excretora). Describir la estructura y ultraestructura de un acino pancreático, conocer los productos de secreción y sus funciones. Describir los conductos excretores; conocer la función de la célula centroacinar. Establecer un diagnostico diferencial con la glándula submaxilar. Control hormonal de la secreción exócrina. Glándulas salivares mayores: conocer la estructura histológica de las glándulas parótida, submaxilar y sublingual. Clasificar las glándulas según morfología de los adenómeros, mecanismo de secreción, tipo de adenómero (acino mucoso, seroso y mixto). Diferenciar los conductos excretores: intercalar, estriado o intralobulilar, interlobulillar. Inervación. Composición y función de la saliva. SH15 – SEMINARIO Nº 15: SISTEMA ENDÓCRINO Describir las características generales de las glándulas endócrinas. Origen embriológico. Definir los conceptos de hormona, órgano y célula blanco. Diversidad citológica de las células endócrinas. Nociones sobre mecanismos de acción hormonal. Mencionar las relaciones y mecanismos de regulación de las glándulas endócrinas con el Hipotálamo. Hipófisis: función. Describir la organización histológica de la glándula (adenohipófisis y neurohipófisis). Histogénesis. Conocer los distintos orígenes embriológicos de la glándula. Componentes celulares de la adenohipófisis: caracterizar los tipos celulares según su morfología, tinción y hormonas que secreta. Conocer el origen de las hormonas neurohipofisarias. Mencionar los componentes del sistema porta hipotálamo-hipofisario y su importancia funcional. Eje hipotálamo-hipofisario. Tiroides y paratiroides: describir la organización estructural de la glándula. Reconocer los tipos celulares y las funciones de cada uno de ellos. Relacionar la morfología del epitelio glandular con su estado funcional. Describir brevemente el proceso de síntesis de las hormonas tiroideas y su función. Células parafoliculares: características y función. Suprarrenal: identificar la estructura general. Reconocer la organización de la corteza en capas. Describir los tipos celulares de cada capa de la corteza y los de la médula, mencionando la ultraestructura y función de cada uno de los tipos celulares. Histogénesis. Circulación sanguínea. Páncreas endócrino: Describir los islotes de Langerhans; conocer los tipos celulares y sus funciones; técnica histológica de tinción para reconocer los tipos celulares. 21 HISTOLOGÍA SH16 – SEMINARIO Nº 16: APARATO GENITAL FEMENINO I Ovario: describir la estructura histológica del órgano (epitelio ovárico, corteza, médula e hilio). Describir la estructura histológica de los diferentes tipos de folículos (primordial, primario unilaminar y multilaminar y secundario): diferenciar oocito, zona pelúcida, células de la granulosa, líquido antral, teca interna y externa. Conocer la función de cada una de las estructuras del folículo. Explicar el proceso de ovogénesis y de atresia folicular. Describir el cuerpo lúteo o amarillo, el proceso de formación y función. Diferenciar cuerpo lúteo, cuerpo albicans y folículo atrésico. Células intersticiales. Describir el ciclo ovárico y las distintas fases del ciclo sexual. Explicar qué es el eje hipotálamo-hipofisario-ovárico. Trompas de Falopio: describir la estructura histológica del órgano. Función. Influencias hormonales sobre su epitelio. SH17 – SEMINARIO Nº 17: APARATO GENITAL FEMENINO II Útero: describir la estructura histológica del útero (endometrio, miometrio, perimetrio). Describir el ciclo endometrial: estructura histológica de la mucosa en las distintas fases (proliferativa, secretora, isquémica, menstrual). Irrigación del endometrio. Cuello uterino: describir la estructura histológica del endo y exocervix. Reconocer sus diferencias. Importancia de la zona de transición epitelial en la patología ginecológica. Cambios del trofismo epitelial hormono-dependientes. Citología exfoliativa: extendido de Papanicolaou. Características de las células superficiales, intermedias y parabasales en distintos momentos del ciclo sexual femenino. Su importancia diagnóstica. Vagina: describir la estructura histológica. Conocer el ciclo y citología exfoliativa. Glándula mamaria: describir la estructura histológica de la glándula en reposo, puerperal, prepuberal y en involución. Conocer qué tipo de glándula exócrina es según su morfología y mecanismo de secreción. Estroma de la mama: inter e intralobulillar Componentes del parénquima: célula mioepitelial y su función. Características de la secreción láctea. SH18 – SEMINARIO Nº 18: APARATO GENITAL MASCULINO Testículo: describir la estructura histológica del órgano (Albugínea, túbulos seminíferos, tejido intersticial). Túbulos seminíferos: morfología y estructura del epitelio seminífero: células germinales (espermatogonias tipo A y B, espermatocitos primarios y secundarios, espermátides tempranas y tardías), células de Sértoli, membrana basal; células mioides. Caracterizar las diferentes células del epitelio seminífero según su morfología nuclear y ubicación en el epitelio. Explicar los procesos de espermatogénesis (proliferación y diferenciación de las células germinales), espermiogénesis y espermiación. Conocer las diferenciaciones nucleares y citoplasmáticas de la espermátide. Describir la ultraestructura del espermatozoide. Onda y cilos espermáticos. Asociaciones celulares. Tejido intersticial: describir la estructura, ultraestructura y función de las células de Leydig. Espermograma normal. Conocer las vías excretoras: rete testis, tubos rectos, conductos eferentes. Describir los componentes de la barrera hemato-testicular y su importancia funcional. Describir detalladamente la regulación hormonal de la función testicular. Epidídimo: estructura histológica general, diferencias entre sus porciones. Función. Conducto deferente: estructura histológica y función. Uretra: estructura histológica general, porciones. Pene: estructura histológica. Vesícula seminal: conocer su estructura histológica y función. 22 HISTOLOGÍA Próstata: estroma prostático, características de los alvéolos prostáticos. Secreción prostática. SH19 – SEMINARIO Nº 19: PIEL Y FANERAS. Describir la organización histológica de la piel: epidermis, dermis e hipodermis. Epidermis: describir los estratos celulares y los tipos celulares que los componen. Conocer la estructura, ultraestructura y función de los queratinocitos, melanocitos, células de Langerhans y células de Merkel. Explicar el proceso de queratinización. Melanocitos: explicar el proceso de pigmentación de la pie y su importancia funcional. Células de Langerhans. Sistema inmunológico de la piel (SALT). Células de Merkel, sensibilidad cutanea. Dermis: diferenciar dermis papilar y reticular. Reconocer sus componentes (tipos de tejido conectivo, vasos, nervios, Inervación de la piel. Dermis: Unión dermo-epidérmica. Características de la dermis papilar y la reticular. Proceso reparativo de la piel. Glándulas sebáceas: características estructurales, tipo y mecanismo de secreción. Función del sebo. Glándulas sudoríparas ecrinas y apócrinas: características del adenómero y del conducto excretor, composición del sudor y función. Pelos y uñas: Folículo piloso, crecimiento del pelo. Estructura de la uña. Diferenciar la epidermis y la dermis de la piel fina y gruesa. SH20 – SEMINARIO Nº 20: SISTEMA NERVIOSO Describir la organización del sistema nervioso (central y periférico). Sistema nervioso central (SNC): reconocer la organización de la sustancia gris y blanca, cavidades ependimarias en cerebro, cerebelo y médula espinal. Describir la estructura del cerebro, cerebelo y médula espinal. Describir cómo se observan estos órganos con las principales técnicas de coloración del tejido nervioso (basofilia, Cajal, Golgi). Cerebro: reconocer la sustancia blanca, la corteza cerebral con sus distintas capas y células, la cubierta meníngea, los ventrículos y el plexo coroideo. Describir la estructura, ultraestructura y función de los principales tipos celulares. Explicar los conceptos de organización laminar y columnar de la corteza cerebral. Aferencias y eferencias. Cerebelo: reconocer la sustancia blanca, la corteza cerebelosa con sus distintas capas y células y la cubierta meníngea. Describir la estructura, ultraestructura y función de los principales tipos celulares. Describir la eferencia y las aferencias de la corteza cerebelosa. Definir el concepto y describir la estructura y ultraestructura del glomérulo cerebeloso. Con qué técnicas se puede evidenciar un glomérulo cerebeloso? Médula espinal: Reconocer las sustancia blanca y gris, las motoneuronas, neuropilo, astas anteriores y posteriores, raíces nerviosas anteriores y posteriores, surcos medio anterior y posterior, conducto ependimario, cubiertas meníngeas y nervios periféricos. Describir la estructura, ultraestructura y función de los principales tipos celulares. Diagnostico diferencial entre asta anterior y posterior con la técnica de Cajal. Explicar el diagnóstico diferencial entre los distintos órganos del SNC (cerebro, cerebelo, médula espinal). SNP: organización, estructura y función de un nervio. Clasificación. Plexos nerviosos viscerales. Ganglio raquídeo y autónomo o neurovegetativo (simpático): estructura histológica. Establecer un diagnostico diferencial entre un ganglio raquídeo, simpático y parasimpático. 23 HISTOLOGÍA SH21 – SEMINARIO Nº 21: ORGANOS DE LOS SENTIDOS Ojo: organización y estructura de sus tres capas. Conocer sus orígenes embriológicos. Características histológicas de la capa fibrosa: esclerótica cornea y conjuntiva. Histofisiología del limbo esclero-corneal. Capa media: coroides, cuerpos ciliares e iris. Epitelio y estroma. Producción de humor acuoso, su circulación y eliminación. Características del cristalino. Modificaciones con la edad. Capa interna: retina: organización en capas. Circuitos de neuronales de proyección y locales. Epitelio pigmentario. Fotorreceptores. Células de Müller. Barrera hemato-ocular. Retina: describir su organización en capas, describir la estructura, ultraestructura y función de los distintos tipos neuronales y glía. Describir la función del epitelio pigmentario y de los fotoreceptores. Mencionar el mecanismo de nutrición. Explicar brevemente la histogénesis y la histofisiología de la retina. Zonas de la retina. Oído: características generales de sus tres porciones: externa, media e interna. Conducto auditivo externo: estructura histológica. Membrana timpánica. Oído medio: estructura histológica. Trompa de Eustaquio, su importancia funcional. Oído interno: porciones ósea y membranosa; conductos semicirculares, utrículo y sáculo. Organo de Corti. 24 HISTOLOGÍA TRABAJOS PRÁCTICOS DE HISTOLOGÍA (TPH) TPH1 - TRABAJO PRÁCTICO Nº 1: MICROSCOPIA. TECNICA HISTOLOGICA. INTERPRETACION DE IMAGENES MICROSCOPICAS. HISTOQUIMICA. OBJETIVOS DEL TP Explicar el fundamento y la utilidad de las diferentes técnicas de tinción. A) MANEJO DE MICROSCOPIO ÓPTICO Reconocer los componentes ópticos y mecánicos de un microscopio óptico. Manejar adecuadamente un microscopio óptico binocular y monocular. Realizar una correcta iluminación. Enfocar correctamente con las distintas lentes objetivo. Explicar las diferencias entre un microscopio óptico y un microscopio electrónico de transmisión B) TÉCNICA HISTOLÓGICA DE RUTINA E INTERPRETACION DE CORTES HISTOLOGICOS 1) Tinción de rutina: hematoxilina y eosina (H&E) – preparados de distintos órganos. Reconocer en base a su forma y a su afinidad tintorial: el núcleo (tipo de cromatina, presencia de nucléolo), citoplasma (distintas intensidades de tinción acidófila y basófila), matriz extracelular (distintas intensidades de tinción acidófila y basófila). Interpretar las diferentes incidencias de cortes de una estructura histológica (oblicuo, longitudinal y transversal) y reconocer la relación entre la imagen bidimensional observada en un corte histológico y su estructura tridimensional original. C) TÉCNICAS HISTOLÓGICAS ESPECIALES Tinción de H&E con PAS - preparado fijo de intestino delgado: Reconocer la membrana basal del epitelio, el glucocálix de especializaciones de membrana apical y el citoplasma de células de secreción mucosa. Comparar con H&E. Tricrómico de Mallory – preparado fijo de corazón de rata: Reconocer las fibras colágenas de la matriz extracelular (celeste), el citoplasma de las fibras musculares esqueléticas cardíacas (rojo), núcleos (rojos) y los eritrocitos (naranja). Comparar con H&E. Técnica de Sudán - preparado fijo de glándula suprarrenal: Reconocer las células de secreción esteroidea con inclusiones lipídicas. Técnica de Feulgen o hematoxilina férrica – preparado fijo decélulas de cebolla: Reconocer la cromatina de células en interfase y en división celular. Técnica de localización de actividad enzimática – preparado fijo de riñón: Reconocer la localización de la enzima fosfatasa alcalina en el ribete en cepillo de los túbulos contorneados. Inmunohistoquímica – preparado fijo de cerebro de rata – GFAP o S100β. 25 HISTOLOGÍA Reconocer la expresión de proteínas específicas. Técnica de H&E con infusión de tinta china previa a la fijación (tinción vital) – preparado fijo de hígado: Reconocer los macrófagos (células de Kupffer) con partículas de tinta china fagocitadas en su citoplasma. Fotomicrografías de MET 1) Reconocer en una fotomicrografía de MET la ultraestructura de los distintos componentes celulares: núcleo (membrana nuclear, heterocromatina, eucromatina, nucléolo), organelas citoplasmáticas (aparato de Golgi, RER, REL, mitocondrias), ribosomas libres, inclusiones lipídicas, vesículas endocíticas, gránulos de secreción, membrana plasmática, citoesqueleto. APOYO TEÓRICO Partes del microscopio óptico 1. ÓPTICA Objetivos: sistema de lentes biconvexas que proporciona una imagen real, aumentada e invertida del preparado. Pueden ser secos (si sólo hay interpuesto aire entre éste y el preparado) o de inmersión (si hay otro medio distinto al aire por ejemplo aceite), su aumento puede ser de 4 o 5 X, 10X, 40X y 100X. Oculares: están ubicados en el extremo superior del microscopio y proporcionan una imagen virtual, aumentada y derecha del preparado. Su aumento suele ser de 10X. Sistema de iluminación: los microscopios más antiguos (monoculares) presentan un espejo que es necesario moverlo para hacer incidir la luz de la lámpara de luz de la mesada de trabajo con el fin de poder iluminar la totalidad del campo. En los más modernos (binoculares) la fuente luminosa está incorporada a la base del mismo. a) Condensador: enfoca la luz sobre el preparado proporcionando un cono de luz. b) Diafragma: limita el haz de luz, eliminando los rayos más desviados. c) Filtros: seleccionan las longitudes de onda de los rayos que van a incidir sobre el preparado. 2. MECÁNICA Pie Columna Platina Tubo Revólver Tornillo macrométrico Tornillo micrométrico INDICACIONES PARA EL CORRECTO USO DEL MICROSCOPIO ÓPTICO Iluminación: en los microscopios monoculares colocar el espejo tal que ilumine TODO el campo del preparado. La cara plana se emplea cuando la fuente luminosa es concreta (lámpara) mientras que la cara cóncava se utiliza cuando se emplea luz difusa. En los microscopios binoculares bastará con encender la luz y regular la intensidad de la iluminación. Luego usar el condensador y el diafragma para lograr una correcta incidencia y cantidad de luz. 26 HISTOLOGÍA Enfoque: a) Colocar el preparado en la platina con el cubreobjetos hacia arriba. IMPORTANTE, sino en seco fuerte no logrará enfocar. b) Para orientarse en el preparado utilice el objetivo de menor aumento que Ud. disponga. Acerque el objetivo hasta que esté casi en contacto con el preparado, esto se realiza mirando desde AFUERA Y NO POR LOS OCULARES. c) Una vez realizado el paso (b) observe por los oculares y comience a subir lentamente con el tornillo macrométrico hasta que aparezca la imagen. Para lograr un mejor foco mueva el tornillo micrométrico. d) Luego de recorrer todo el preparado, cambie el objetivo a seco fuerte (40X) desde el revólver y NO DESDE LOS OBJETIVOS ya que se pueden desatornillar y perder luego el foco normal. e) Terminada la observación, ubicar nuevamente el objetivo de menor aumento, elevar el tubo y retirar el preparado. NUNCA retirar el preparado en seco fuerte (40X) porque podría romper el vidrio de la preparación. CONSIDERACIONES GENERALES Con el objetivo de campo, panorámico (4X o 5X) y con el objetivo seco débil (10X) usar el tornillo MACROMÉTRICO, luego de haber logrado un enfoque aceptable puede utilizar el MICROMÉTRICO para realizar el enfoque “fino” solamente. Con el objetivo seco fuerte (40X) use solamente el tornillo MICROMÉTRICO. Ajuste la silla a una posición cómoda de observación. No apoye los dedos o cara sobre los oculares, ya que se engrasan y no permite luego la correcta observación. De hacerlo o encontrarlo sucio, limpiarlo con una carilina. TÉCNICA HISTOLÓGICA DE RUTINA (HEMATOXILINA Y EOSINA) Son los pasos a seguir para poder observar al microscopio la muestra con sus componentes. 1) Obtención del material: a) biopsias b) autopsias c) raspajes d) extendidos 2) Fijación: Paso fundamental en la técnica que tiene por objetivo preservar la estructura y/o ultraestructura del tejido y sus componentes. Esto se logra produciendo la muerte rápida de sus células, evitando la autólisis y putrefacción del tejido. Los fijadores pueden ser físicos o químicos y dentro de éstos últimos podemos clasificar fijadores simples y mezclas fijadoras. El más usado es el formol al 10% (formaraldehído al 4%) como fijador simple y el líquido de Bouin como mezcla fijadora. En estos casos como la muestra se sumerge en el fijador se habla de fijación por inmersión. Cuando la fijación se realiza por perfusión, ésta precede a la obtención de la muestra que luego recibe una fijación de inmersión de refuerzo. 3) Deshidratación: Es la completa eliminación del agua del tejido para luego poder embeberlos en medios de inclusión no hidrosolubles. Se pasa la muestra por concentraciones crecientes de alcohol (50, 70, 80, 95 y 100) para sacar toda el agua de a poco y evitar la retracción del tejido. 4) Aclaración: Es la sustitución del deshidratante elegido por una sustancia miscible con el medio de inclusión. El aclarante o líquido intermediario más utilizado es el xilol. 27 HISTOLOGÍA 5) Inclusión: Tiene como objeto endurecer la muestra para permitir su corte posterior. El medio de inclusión más usado en MO es la parafina. Para SE ME utilizan resinas epoxi. 6) Corte: Se realiza con instrumentos especiales llamados micrótomos. Éstos varían si el corte es para microscopia óptica (secciones de micrómetros) o electrónica (secciones de nanómetros). 7) Desparafinar: pasar la muestra por xilol para retirar la parafina. 8) Rehidratación: porque los colorantes son hidrosolubles. Se pasa la muestra por concentraciones decrecientes de alcohol (100, 95, 80, 70,50) y luego por agua. 9) Coloración: poner la muestra en hematoxilina. Luego ubicarla debajo de agua corriente para producir el virado de la misma. Agregar la eosina y dejar actuar por 30 segundos – 3 minutos. 10) Montaje: Tiene por objetivo preservar por largo tiempo el preparado. Se coloca una gota de bálsamo de Canadá sintético en el porta objetos y se apoya encima el cubreobjeto. INTERPRETACIÓN DE LOS CORTES. INCIDENCIA DE CORTE EJERCICIOS a. Defina poder de resolución., límite de resolución y aumento. b. Señale en qué fotografía de un preparado histológico se pueden apreciar más detalles: LR (límite de resolución), A (aumento) a. LR:0,4 μm, A:1000 b. LR:0,3 μm, A:1000 c. LR:0,4 μm, A:1500 d. LR:0,8 μm, A:2000 c. Señale con qué filtro se obtiene mayor resolución de imagen en un MO: rojo, azul o amarillo. Justifique su respuesta. d. Mencione los pasos de la técnica de rutina y explique brevemente el fundamento de cada uno de éstos. Realice un cuadro comparativo sobre el procesamiento de una muestra para MO y MET. 28 HISTOLOGÍA e. Explique el fundamento de la técnica de H&E. Defina los conceptos de acidofilia y basofilia. f. Mencione con qué técnica histoquímica identificaría cada uno de los siguientes componentes tisulares. Mencione y justifique si en alguno de estos casos debe realizarse algún cambio específico en los pasos de la técnica histológica: Triglicéridos de un adipocito, Glicoproteínas de secreción de una célula mucosa, Peroxidasa de los peroxisomas de un macrófago, ADN de células que proliferan en cultivo, Molécula de colágeno de la matriz extracelular. g. Complete el siguiente cuadro: Tinción H&E Tricrómico de Mallory PAS Sudán Inmunohistoquímica Tinción vital Técnica de actividad enzimática Fundamento de la técnica Utilidad i. Complete el siguiente cuadro: Características Radiación empleada Fuente de radiación Longitud de onda Medio presente en el tubo Lentes Tipo de imagen Límite de resolución Aumento Tamaño del campo observado Profundidad de foco Nivel de información morfológica obtenida Fijador empleado Sustancia de inclusión empleada Espesor del corte Instrumento de corte empleado Obtención de contraste (colorantes empleados) Ventajas Desventajas MO MET 29 HISTOLOGÍA TPH2 - TRABAJO PRÁCTICO Nº 2: TEJIDO EPITELIAL DE REVESTIMIENTO Y GLANDULAR EXOCRINO I. TEJIDO EPITELIAL DE REVESTIMIENTO OBJETIVOS DEL TP Reconocer los componentes de un tejido en un preparado histológico de rutina. Reconocer la estructura morfológica de los distintos tipos de tejido epitelial de revestimiento: morfología nuclear, número de capas. Comprender el concepto de polaridad celular. Identificar el dominio apical, lateral y basal y las especializaciones de dominio apical en los preparados. Identificar la membrana basal mediante tinciones especiales. Describir sus componentes. Identificar el tejido conectivo subyacente. Establecer el diagnóstico diferencial entre: Epitelio cilíndrico y cilíndrico pseudoestratificado. Epitelio cilíndrico pseudoestratificado y estratificado. Epitelio plano estratificado y polimorfo. Preparados para MO Epitelios simples: 1) Preparado de riñón - H&E: Epitelio plano simple: capa parietal cápsula de Bowman. Reconocer una única capa de células epiteliales en contacto con una luz; identificar los núcleos aplanados en corte longitudinal o esféricos en corte transversal. Epitelio cúbico simple: túbulo contorneado distal y túbulo colector. Reconocer una única capa de células epiteliales en contacto con una luz, con núcleos esféricos en corte transversal y longitudinal. Epitelio cúbico simple con ribete en cepillo: túbulo contorneado proximal. Reconocer una única capa de células epiteliales en contacto con una luz, con núcleos esféricos en corte transversal y longitudinal. Identificar las especializaciones de membrana apical. 2) Preparado de intestino delgado - H&E: Epitelio cilíndrico simple con chapa estriada y células caliciformes: epitelio luminal del órgano. Reconocer una única capa de células en contacto con la luz, con eje perpendicular a la luz mayor a su eje perpendicular a la luz y con núcleos ovalados en corte longitudinal. Identificar la chapa estriada intensamente acidófila y refringente (microvellosidades). Identificar las células caliciformes con su citoplasma apical con tinción negativa. 3) Preparado fijo de yeyuno-íleon - H&E con PAS: Membrana basal, glucocálix de especializaciones de membrana apical, célula caliciforme. Reconocer las diferentes estructuras histológicas en las cuales predominan los hidratos de carbono (PAS+). Reconocer la membrana basal y el glucocálix de la membrana apical del epitelio cilíndrico simple. Reconocer el citoplasma apical de las células caliciformes. 4) Preparado de tráquea - H&E: Epitelio cilíndrico pseudoestratificado ciliado con células caliciformes: epitelio luminal del órgano. Observar dos tipos de morfología nuclear: las células esféricas basales y las 30 HISTOLOGÍA cilíndricas de núcleo ovalado más apicales. Reconocer las cilias y microvellosidades. Reconocer las células caliciformes. Epitelios estratificados: 5) Preparado de piel - H&E: Epitelio plano estratificado queratinizado: epitelio superficial del órgano. Reconocer los distintos estratos de células del epitelio. Observar cómo va cambiando la morfología de las células en los distintos estratos e identificar las células planas en el estrato más superficial. Identificar la queratina acidófila en la superficie luminal. 6) Preparado de vejiga - H&E: Epitelio polimorfo, de transición o urotelio: epitelio luminal del órgano. Reconocer los distintos estratos de células y la morfología variable de las células más superficiales de acuerdo al grado de distensión del órgano. Fotomicrografías de MET 1) Reconocer en una fotomicrografía de epitelio de revestimiento la ultraestructura de: los distintos tipos de especializaciones de membrana de dominio lateral (zónula occludens o uniones herméticas, zónula adherens o uniones de anclaje, mácula adherens o desmosomas), basal (hemidesmosomas; placas de adhesión); los distintos tipos de especialización de membrana apical (distintos tipos de microvellosidades y cilias) en cortes longitudinal y transversal; el glucocálix; los componentes de la membrana basal. EJERCICIOS a. Describa cuáles características del tejido epitelial de revestimiento puedan ser observadas al MO y cuáles al MET. b. Explique el concepto de polaridad celular. Describa los componentes de los dominios apical, basolateral. c. Describa los tipos de uniones celulares según su localización en los diferentes dominios, componentes proteicos y función. Relacione la presencia de dichas uniones con su función en el órgano donde predominen. d. Identifique los componentes de una microvellosidad y de una cilia en una fotomicrografía de MET. e. ¿Con qué tipo de microscopio es posible observar la membrana basal y la lámina basal? ¿Con qué técnicas de tinción especiales es posible evidenciar la membrana basal? Fundamente su respuesta. 31 HISTOLOGÍA f. Complete el siguiente cuadro: Clasificación epitelio Simple plano Dibujo al MO Ejemplos y localización Función Simple cubico Simple cilíndrico Pseudoestratificado Estratificado plano Estratificado cúbico Polimorfo g. Explique qué especialización de membrana participa en la determinación de los dominios de membrana apical y basolateral de un epitelio cilíndrico. II. TEJIDO EPITELIAL GLANDULAR EXOCRINO OBJETIVOS DEL TP Reconocer la estructura morfológica de los distintos tipos de glándulas exócrinas: diferenciar conducto excretor y adenómero, morfología del adenómero. Interpretar si la glándula posee adenómero no ramificado o ramificada y si el conducto excretor es simple o compuesto. Reconocer la tinción de las diferentes células secretoras y sus componentes de secreción. Reconocer la estructura y la ultraestructura de los diferentes tipos de células glandulares. Correlacionar las afinidades tintoriales y la ultraestructura con sus funciones y productos de secreción. Preparado para MO. 1) Preparado de intestino delgado - H&E: Glándula tubular simple: glándula de Lieberkühn. Reconocer la glándula con morfología tubular formada principalmente por células cilíndricas y células caliciformes. 2) Preparado de piel - H&E: Glándula tubuloglomerular: glándula sudorípara. Reconocer en la dermis múltiples cortes de túbulos en distintas incidencias (principalmente transversal). Identificar adenómero y conducto excretor: diferenciarlos según, capas del epitelio, tamaño de la luz y tinción del citoplasma. Glándula acinar ramificada o sacular: glándula sebácea. Reconocer en la base de un folículo piloso una estructura de morfología sacular la cual corresponde al adenómero. Diferenciar: a) células basales más pequeñas, b) células citoplasma de aspecto esponjoso con tinción negativa (inclusiones lipídicas) y núcleo central y, c) hacia el centro de la glándula, células con tinción negativa y núcleo picnótico. Reconocer las ramificaciones del adenómero y el conducto excretor pequeño. 32 HISTOLOGÍA 3) Preparado de glándula submaxilar - H&E: Glándula túbuloacinar compuesta de secreción mucosa, serosa y mixta. Identificar los tres tipos de adenómeros (acinos mucosos, serosos y mixtos) según la morfología de sus células; tinción de su producto de secreción y de su citoplasma basal. Identificar los diferentes conductos excretores en base a su localización y tamaño (intralobulillares –intercalares y estriados- e interlobulillares). Fotomicrografía de MET 1) Reconocer la ultraestructura de una célula caliciforme. 2) Reconocer la ultraestructura de una célula de secreción sebácea. 3) Reconocer la ultraestructura de una célula de secreción mucosa. 4) Reconocer la ultraestructura de una célula de secreción serosa. Reconocer los componentes celulares del ciclo secretor. 5) Reconocer la ultraestructura de un acino mixto: comparar con una fotomicrografía de MO y explicar porque la medialuna de Gianuzzi es un artefacto de técnica. EJERCICIOS a. Complete los espacios vacios según los criterios de clasificación del tejido epitelial: simples A) Epitelio de revestimiento estratificados B) Epitelio glandular: Criterio: según el lugar hacia donde vierten su secreción: 1) 2) Criterio: según la forma de secreción: denominación ejemplos 1) 2) 3) Criterio: según el tipo de secreción: denominación ejemplos 1) 2) 3) Criterio: según el número de células: denominación ejemplos 33 HISTOLOGÍA 1) 2) Criterio: según su morfología: Según la forma del adenómero: denominación ejemplos 1) 2) 3) 4) Según la ramificación del conducto excretor: denominación ejemplos 1) 2) denominación 1) 2) Según la ramificación del adenómero: ejemplos b. Explique la importancia fisiológica del tejido glandular. c. Realizar un dibujo estructural al MO de: i) un acino seroso, ii) un acino mucoso, iii) una glándula sebácea, iv) una glándula sudorípara, v) una glándula tubular. d. Relacionar la afinidad tintorial de una célula de acino seroso con su actividad biosintética. e. Relacionar la afinidad tintorial de un conducto excretor estriado de una glándula submaxilar y de un conducto excretor de una glándula sudorípara con la función de estas células. f. Realizar un dibujo ultraestructural de i) una célula caliciforme, ii) una célula serosa, iii) una célula mucosa, iv) un conducto excretor estriado, v) una célula sebácea. g. Explique los diferentes mecanismos de secreción. h. Relacione en forma fundamentada los conceptos de exocitosis regulada o constitutiva con alguno de los mecanismos de secreción de las glándulas. 34 HISTOLOGÍA TPH3 - TRABAJO PRÁCTICO Nº 3: TEJIDO CONECTIVO NO ESPECIALIZADO y TEJIDO ADIPOSO I. TEJIDO CONECTIVO NO ESPECIALIZADO OBJETIVOS DEL TP Describir y reconocer las características morfológicas del TCNE. Reconocer los componentes de la matriz extracelular (fibras de colágenos, reticulares y elásticas) y celulares predominantes. Observar la abundancia relativa de cada una de esto componentes en cada tipo de TCNE. Justificar la clasificación del TCNE. Reconocer la estructura morfológica de los distintos tipos de TCNE según sus componentes predominantes. Correlacionar su morfología estructural con su función y localización. Preparados para MO 1) Preparado de piel - H&E: TC colágeno laxo (TCCL): dermis papilar. TC colágeno denso no modelado (TCCDNM): dermis reticular. Diferenciar el TCCL del TCCDNM en base a la proporción y tamaño de las fibras de colágeno y en base a la densidad celular. Diferenciar fibrocito y fibroblasto en base a su morfología nuclear y grado de compactación de la cromatina. 2) Preparado de ojo - H&E: TC colágeno denso modelado laminar (TCCDML): estroma de la córnea. Diferenciar el TCCDNM del TCCDML. Observar el predominio de la matriz extracelular, la disposición ordenada de los componentes fibrilares y los núcleos de cromatina densa de los queratocitos en distintas incidencias de corte. 3) Preparado de tendón - H&E: TC colágeno denso modelado tendinoso (TCCDMT) Diferenciar el TCCDNM del TCCDMT. Observar el predominio de la matriz extracelular, la disposición ordenada de los componentes fibrilares y la disposición ordenada de los núcleos de los tendinocitos en corte longuitudinal. 4) Preparado fijo de aorta - H&E: Fibras elásticas: túnica media del vaso. Identificar la luz del órgano tubular y el epitelio plano simple (endotelio) que lo recubre. Por debajo de este epitelio reconocer la túnica media y observar las láminas de fibras elásticas festoneadas entre los núcleos de músculo liso. Para una mejor apreciación de las láminas elásticas cerrar levemente el diafragma y mover el condensador, así las fibras se verán refringentes. 5) Preparado de aorta - Resorcina-fucsina: Fibras elásticas: túnica media del vaso. Identificar las láminas de fibras elásticas. 35 HISTOLOGÍA 6) Preparado de pulmón - Resorcina-fucsina: TC elástico: pared alveolar. Identificar con seco fuerte el tejido conectivo elástico en las paredes de los alvéolos evidenciado por las fibras elásticas de color violeta. 7) Preparado fijo de riñón o hígado - Impregnación argéntica: TC reticular: estroma del órgano. Observar la morfología y disposición de las fibras reticulares formando una red entre los hepatocitos o los túbulos renales. 8) Preparado de cordón umbilical - H&E: TC mucoso: estroma del cordón umbilical. Observar el tejido entre los grandes vasos. Identificar las células mesenquimáticas con sus prolongaciones citoplasmáticas (más acidófilas que la matriz extracelular). Observar la abundancia relativa de sustancia fundamental y fibras colágenas. Comparar la matriz extracelular del TCCL con la del TC mucoso en base a la abundancia de sustancia fundamental y fibras colágenas. Fotomicrografías de MET 1) Describir la ultraestructura de las fibras de colágeno. 2) Describir las diferencias ultraestructurales entre un fibroblasto y un fibrocito. APOYO TEÓRICO Técnicas para visualizar las distintas fibras que conforman al tejido conectivo Fibras colágenas Eosina Tricrómico de Masson: utiliza solución de bouin, hematoxilina férrica, escarlata de biebrich, fucsina ácida, ácido fosfotungstico o fosfomolíbdico, verde luz o azul de anilina y solución diferenciadora acuosa de ácido acético glacial. Resultados: núcleos (azul negruzco), colágeno (azul o verde), citoplasmas, queratina, fibras musculares y eritrocitos (rojo) Tricrómico de mallory: utiliza fucsina ácida, ácido fosfomolíbdico y solución de Mallory (azul de anilina, naranja G, ácido oxálico y agua destilada) Resultados: núcleos (rojo), citoplasma, eritrocitos, fibras musculares estriadas (naranja rojizo), músculo liso (violáceo) y tejido conectivo (azul claro) Tricrómico de Van Gieson: utiliza hematoxilina férrica, ácido pícrico y fucsina ácida Resultados: núcleos (azul negruzco), citoplasma (amarillo) y colágeno (rojo intenso) Impregnación con plata: se observan marrones las fibras colágenas Fibras reticulares Retículo de gomori (impregnación argéntica): utiliza permanganato potásico, metabisulfito potásico, alumbre férrico, plata amoniacal, formol 10%, hiposulfito sódico. Resultados: fibras reticulares (negro), fibras colágenas (amarillas). Es específica para fibras reticulares e inespecíficamente tiñe también las fibras de colágeno. PAS: ver TP 1 técnica histológica para su fundamento. Resultados: fibras reticulares (rojo oscuro a magenta) 36 HISTOLOGÍA Fibras elásticas Eosina: apenas teñidas. Mucha refringencia. Orceína: utiliza orceína, alcohol etílico 70%, ácido clorhídrico y solución de picro-carmín de índigo. Resultados: fibras elásticas (pardo negruzco), citoplasmas y demás estructuras (verde amarillento) Resorcina-fucsina: utiliza solución de resorcina fucsina, cloruro férrico, alcohol 95%, ácido clorhídrico. Resultados: fibras elásticas (azul negruzco), núcleos (azul pálido), fibras colágenas (rosa o rojo). Ésta técnica es específica para fibras elásticas e inespecíficamente tiñe fibras colágenas. EJERCICIOS a. Realice un dibujo al MO de una sección de: i) TCCL, ii) TCCDNM, iii) TCCDM laminar, iv) TCCDM tendinoso, v) TC mucoso. b. Realice un cuadro sinóptico de los tipos de TCNE, en base a los criterios de clasificación, tinciones especiales para visualizarlos, funciones que cumplen y localización. c. Explique los fundamentos de cada una de las técnicas de tinción especiales para visualizar los componentes fibrilares del TC. d. Mencione los tipos celulares del TCNE y describa sus funciones. e. Realice un esquema ultraestructural de un fibrocito y un fibroblasto. Relacione su ultraestructura con su actividad biosintética. f. Realice un esquema ultraestructural de una fibra de colágeno. Enumere los pasos de la síntesis de colágeno. g. Explique cómo participa el citoesqueleto en la migración de un fibroblasto hacia una zona de cicatrización. II. TEJIDO CONECTIVO ESPECIALIZADO: TEJIDO ADIPOSO OBJETIVOS DEL TP Explicar y reconocer las diferencias entre el TC no especializado y el TC especializado. Reconocer al tejido adiposo como un TC especializado. Describir las técnicas especiales de procesamiento y tinción para poder visualizar los componentes lipídicos. Preparados para MO 1) Preparado de piel - H&E: Tejido adiposo unilocular: hipodermis. 37 HISTOLOGÍA Identificar el epitelio, el TC no especializado subyacente y el tejido adiposo. Observar a seco fuerte los adipocitos con morfología poliédrica, con escaso citoplasma coloreado desplazado por un espacio negativo central correspondiente a una gran inclusión lipídica que fue eliminada con la técnica de rutina. Observar el núcleo también desplazado por la inclusión lipídica. Fotomicrografía de MET 1) Reconocer las diferencias ultraestructurales de un adipocito unilocular y multilocular. Observar la ausencia de mambrana alredededor de las inclusiones lipídicas EJERCICIOS a) Explique por qué no se pueden observar los componentes lipídicos de un tejido con la técnica de rutina. ¿Qué procesamiento y técnicas de tinción especiales habría que utilizar? b) Realice un esquema ultraestructural de un adipocito unilocular y uno multilocular. c) Complete el siguiente cuadro comparativo: Tejido adiposo unilocular Tejido adiposo multilocular Esquema de un adipocito al MO Densidad de mitocondrias vascularización Localización Función d) Explique qué diferencia molecular presentan las mitocondrias de las células adiposas pardas para producir calor. 38 HISTOLOGÍA TPH4 - TRABAJO PRÁCTICO Nº 4: CARTÍLAGO, HUESO, SANGRE Y HEMATOPOYESIS I. TEJIDO CARTILAGINOSO OBJETIVOS DEL TP Establecer el diagnóstico del TC cartilaginoso. Identificar los componentes tisulares (celulares y extracelulares) del cartílago. Identificar los tipos de tejido cartilaginoso según su morfología y componentes de la matriz extracelular. Preparados para MO 1) Preparado de tráquea - H&E: Cartílago hialino. Observar la tinción de la matriz extracelular y compararla con la tinción del TC circundante; reconocer el pericondrio fibroso (TCCDNM) y el pericondrio condrógeno. Diferenciar en base a su morfología, localización y tinción un condroblasto y un condrocito; identificar condroplasto o laguna y cápsula. Diferenciar grupo isógeno axil y coronario. Reconocer en la matriz extracelular el área territorial e interterritorial en base a la intensidad tintorial y observar la textura hialina de la matriz. 2) Preparado de pabellón auricular - Resorcina-fuscina con H&E: Cartílago elástico. Observar la textura de la matriz extracelular y compararla con el cartílago hialino;reconocer pericondrio; diferenciar condroblasto y condrocito; reconocer condroplasto o laguna y cápsula. Diferenciar grupo isógeno axil y coronario. Reconocer en la matriz extracelular el área territorial e interterritorial en base a la densidad de fibras elásticas. 3) Preparado fijo de fibrocartílago - H&E: Cartílago fibroso. Observar la disposición de los condrocitos en hileras entremezcladas con haces de fibras de colágeno y fibrocitos. Notar la ausencia de pericondrio. Fotomicrografía de MET 1) Reconocer la ultraestructura de un condrocito y de un condroblasto. 2) Diferenciar la ultraestructura de los componentes de la matriz extraxcelular del cartílago hialino y del fibrocartilago. EJERCICIOS a. Mencione los componentes de la matriz cartilaginosa y correlaciónelos con la función del tejido cartilaginoso. 39 HISTOLOGÍA b. Complete el siguiente cuadro comparativo: Cartílago hialino Cartílago elástico Cartílago fibroso Componentes de la matriz extracelular Disposición de condrocitos Presencia de pericondrio? Localización Función c. Explique el fundamento de la afinidad tintorial de la matriz extracelular del cartílago hialino con H&E. d. Realice un esquema estructural (al MO) de una sección de cartílago hialino. Indique: pericondrio, condroclastos, condrocitos en su laguna, grupo isógenos axiles y coronales, matriz territorial y extraterritorial. c. Realice un esquema estructural de una sección de fibrocartílago. d. Explique los mecanismos de crecimiento del cartílago. II. TEJIDO ÓSEO OBJETIVOS DEL TP Reconocer los componentes del tejido óseo y su forma de organización espacial. Describir las características estructurales y reconocer al MO el tejido óseo. Establecer un diagnóstico diferencial con el tejido cartilaginoso. Reconcer las distintas formas de organización del tejido óseo: hueso compacto y esponjoso: primario o reticular y laminar. Describir la estructura y organización macroscópica y microscópica del hueso esponjoso y compacto Establecer un diagnostico diferencial entre hueso compacto y hueso esponjoso. Explicar: a) los fundamentos de las técnicas de procesamiento del hueso para su estudio en MO (descalcificación con posterior coloración con H&E y desgaste) y b) la utilidad de cada una de ellas. Reconocer el proceso de osificación endocondral. Reconocer las diferentes zonas del proceso de osificación endocondral. Reconocer los tejidos y componentes tisulares que se observan en el proceso de osificación endocondral. Preparados para MO 1) Preparado de osificación endocondral - hueso descalcificado, H&E. Proceso de osificación endocondral. Diferenciar epífisis, metáfisis y diáfisis. Reconocer el pericondrio que rodea al cartílago (excepto en la zona articular) y el periostio que rodea a la zona de trabéculas óseas. Reconocer los distintos estadios de osificación en base a la morfología y componentes tisulares de cada zona: 40 HISTOLOGÍA a. Cartílago en reposo: condrocitos en condroplastos rodeados por una matriz extracelular basófila (matriz cartilaginosa). b. Cartílago seriado o en proliferación: condrocitos dispuestos en grupos isógenos axiles. c. Cartílago hipertrofiado: condrocitos hipertrofiados dispuestos en grupos isógenos axiles. d. Cartílago calcificado: matriz extracelular intensamente basófila (¿por qué?). e. Trabécula directriz: matriz cartilaginosa (basófila) rodeada o no por osteoblastos. f. Trabécula primaria: matriz cartilaginosa rodeada por sustancia osteoide (acidófila) y osteoblastos. g. Trabécula secundaria: matriz cartilaginosa rodeada por matriz extracelular ósea, osteocitos y osteoblastos. h. Trabécula terciaria: osteocitos y matriz extracelular ósea rodeados por osteoblastos. Reconocer el tejido hematopoyético en el espacio entre las trabéculas. Identificar a los osteoclastos con su laguna de Howship. 2) Preparado fijo de hueso - hueso seco por desgaste, tinta china: Observar arquitectura del tejido óseo. Notar la ausencia del componente orgánico. Establecer diferencias con el preparado de hueso descalcificado. Huesocompacto. Observar el periostio. Identificar las osteonas: laminillas concéntricas, osteoplastos con canalículos óseos entre las laminillas, conducto de Havers, línea de cemento, conductos de Volkman. Identificar los sistemas circunferenciales interno y externo, sistema intersticial. Hueso esponjoso. Observar las trabéculas formadas por laminillas con osteoplastos, (sin osteonas ni conductos de Havers) y rodeadas por espacios medulares. 3) Preparado de hueso - hueso descalcificado, H&E: Hueso compacto. Reconocer periostio, endostio, osteonas (conductos de Havers, osteocitos en osteoplastos, láminas); conducto medular con tejido hematopoyético. Establecer diferencias con el preparado de hueso seco. Hueso esponjoso. Reconocer periostio, endostio, médula ósea, trabéculas, osteocitos en osteoplastos. Establecer diferencias con el preparado de hueso seco. Fotomicrografía de MET 1) Diferenciar la ultraestructura de un osteoblasto (reconocer abundante RER), un osteocito, y un osteoclasto (reconocer numerosos nucleos, abundantes mitocondrias y Golgi desarollado, vacuolas absortivas, procesos citoplasmáticos en borde en cepillo, la laguna de Howship) APOYO TEÓRICO Técnicas para visualizar tejido óseo: 1) decalcificación: proceso por el cual se eliminan completamente las sales de calcio del tejido luego de haberlo fijado. Hay varios tipos de descalcificación, las más utilizadas son las químicas. Descalcificación con solución acuosa de ácido nítrico: utiliza ácido nítrico y agua destilada. Decalcifica un bloque óseo de 5mm en 12-24 horas. Para comprobar si la descalcificación es completa se usa amoníaco y oxalato amónico, que formará precipitados de hidróxido cálcico si no está completa la misma. 2) Desgaste: no hay presencia de sustancia orgánica. Se realiza macerando el hueso en agua y luego en bencina. Una vez blanco y seco, se corta una lámina con una sierra y la misma se pule con piedra 41 HISTOLOGÍA de afilar o pómez con agua para evitar mayor daño tisular. Al terminar el pulido se sumerge en alcohol absoluto y después en benzol. Luego se lo deja secar y se lo monta. EJERCICIOS a. Explique el fundamento del procesamiento del hueso por descalcificación y explique su utilidad. b. Realice un dibujo estructural de las distintas etapas del proceso de osificación endocondral, tal como se ven en un preparado descalcificado y coloreado con H&E. c. Realice un esquema estructural de un preparado por desgaste de hueso compacto. Indique: el sistema de Havers u osteonas (línea de cemento, laminillas concéntricas, osteoplastos con canalículos, canal de Havers). Periostio y endostio. d. Explique el fundamento de la tinción de la matriz extracelular ósea y la matriz cartilaginosa con H&E. e. Complete el siguiente cuadro comparativo: Osteoblasto Osteocito Osteoclasto esquema estructura ultraestructura localización función f. Complete el siguiente cuadro: Tejido cartilaginoso hialino Tejido óseo Componentes celulares Matriz amorfa Tipo de colágeno g. Justifique qué componentes del sistema de endomembranas reducen su tamaño y funcionalidad en el osteocito respecto del osteoblasto. III. SANGRE OBJETIVOS DEL TP Explicar el concepto de extendido celular y diferenciarlo de un corte histológico. Identificar las partes de un frotis o extendido sanguíneo y el comprender el fundamento de la técnica de coloración de May-Grünwald-Giemsa. Identificar los elementos figurados de la sangre en un frotis o extendido. 42 HISTOLOGÍA Preparados para MO 1) Preparado de frotis o extendido de sangre humana coloreado con May-Grünwald-Giemsa: Recorrer el frotis y localizar la cola, el cuerpo y la cabeza. Identificar en el cuerpo del frotis los elementos figurados: eritrocitos, leucocitos (granulocitos: neutrófilos, eosinófilos y basófilos, y agranulocitos: linfocitos y monocitos) y plaquetas, según su morfología celular (características de los núcleos, la abundancia de citoplasma y la tinción de las granulaciones) y su tamaño relativo al eritrocito Observar la cantidad relativa de cada uno de los elementos. Fotomicrografía de MET 1) Reconocer la ultraestructura de los elementos formes de la sangre. APOYO TEÓRICO Frotis o extendido de sangre (may-grünwald-giemsa) Se extrae una gota de sangre por punción y luego se la extiende sobre un portaobjetos. Se deposita una gota de sangre sobre un portaobjetos, luego, con otro portaobjeto posicionado a 45° se toca la gota y se arrastra hacia el otro extremo. Se flamea el portaobjetos con un mechero para lograr una fijación por calor y luego se colorea con May-Grünwald y Giemsa. El frotis presenta tres zonas: 1) la cabeza, que es donde se depositó la gota inicialmente, es excesivamente gruesa y se observan superpuestos los elementos formes; 2) el cuerpo es la zona del medio y es la zona ideal para observar el frotis ya que los elementos formes se encuentran homogéneamente distribuidos y 3) la cola, que es la zona donde los elementos formes se agrupan en cordones. Tinción de May-Grünwald-Giemsa Combina dos soluciones colorantes: May-Grünwald y Giemsa. Cada una de ellas posee colorantes ácidos y básicos. Solución de May-Grünwald: eosina y azul de metileno ambos disueltos en metanol Solución de Giemsa: eosina, azul de metileno y una serie de productos de la oxidación de este último tales como azur A, azur B, violeta de metilo y azul de metilo. Primero se cubre el extendido con la solución de May-Grünwald permitiendo que el metanol actúe como fijador químico. Luego se agrega igual volumen de agua destilada, permitiendo que la solución coloree. Se descarta el líquido y se cubre con la solución de Giemsa. Se lava con agua corriente y se deja secar al aire. EJERCICIOS a. Explique cómo se realiza un frotis y explique el fundamento de la técnica de May-GrünwaldGiemsa. Explique por qué no se utiliza H&E para su tinción. 43 HISTOLOGÍA b. Esquematice la estructura de los elementos figurados de la sangre coloreados con MayGrünwald-Giemsa. Dibuje el tamaño de los elementos en función al tamaño del eritrocito. c. Complete el siguiente cuadro comparativo: Eritrocito linfocito monocito neutrófilo eosinófilo basófilo plaquetas Dibujo estructural Tamaño morfología celular morfología nuclear Cromatina Citoplasma Contenido de gránulos inespecíficos Contenido de gránulos específicos Función Fórmula leucocitaria relativa d. Explique mediante qué mecanismos moleculares los neutrófilos reconocen las células endoteliales de los capilares de los órganos en los cuales hay procesos inflamatorios y hacia cuyo TC deben migrar. IV. TEJIDO HEMATOPOYÉTICO - MÉDULA ÓSEA OBJETIVOS DEL TP Preparados para MO 1) Preparado de médula ósea - corte histológico, H&E: Reconocer la medula ósea como órgano. Reconocer el compartimiento vascular (pared de sinusoides) y diferenciarlos de los adipocitos. Reconocer el compartimento hemopoyético: megacariocitos, nidos blancos (formas inmaduras de la serie blanca) y nidos rojos (formas inmaduras de la serie roja). 2) Preparado fijo de frotis de médula ósea de humano - extendido, May-Grünwald-Giemsa: Reconocer las diferencias entre un extendido de tejido hematopoyético y un corte histológico de médula ósea. Observar células inmaduras y maduras de las tres progenies sanguíneas, adipocitos, plasmocitos. Reconocer las diferencias entre un extendido de sangre periférica y de médula ósea. 44 HISTOLOGÍA EJERCICIOS a. Explique el diagnóstico diferencial entre un megacariocito y un osteoclasto. b. Explique por qué los nidos rojos están en cercanía a los sinusoides de la médula ósea. c. Explique qué son una célula madre y una célula progenitora hematopoyética. d. Explique en qué fase del ciclo celular se encuentran los eosinófilos y en qué fase/s pueden encontrarse las células madre hematopoyéticas. e. Explique cómo variará en el extendido de sangre la cantidad de reticulocitos ante una hemorragia. ANEXO SERIE ERITOBLASTICA Pro-eritroblasto Dibujo MO Eritrobalsto basófilo Eritroblasto policromatófilo Eritroblasto ortocromático 15-17 μm Central, cromatina gruesa granular en forma de rayos de rueda. No se obs. nucléolo. 12-15 μm Central, pequeño (7μm). Aumenta el grado de condensación de la cromatina. 8-10 μm Excéntrico. Aumenta la condensación de la cromatina (degeneración picnótica). 7-8 μm No tiene. 7 μm No tiene. Basófilo. Comienza la síntesis de hemoglobina. Aun no es detectable. Basofilia grisaceo- rojiza Escasos puntos rojos cerca del núcleo. Poca hemoglobina. Acidófilo. Abundante hemoglobina. Teñido con Azul Brillante de Crecilo (polirribosomas) Abundante hemoglobina. Naranja con Azul Brillante de Crecilo. Abundante hemoglobina. Reticulocito Eritrocito al Localización Tamaño morfología nuclear citoplasma 19-22 μm Central, grande, esférico, cromatina fina pero con tendencia a aglutinarse. 1-2 nucléolos evidentes, celeste claro. Basófilo homogéneo con región clara perinuclear. Sin hemoglobina detectable. 45 HISTOLOGÍA SERIE LINFOBLASTICA, MONOCITICA Y MEGACARIOCITICA Linfoblasto Dibujo MO Linfocito pequeño Monocito Megacariocito Plaquetas al localización MO MO y periférica Tamaño morfología nuclear 15-20 μm Central o algo exéntrico, redondo, cromatina en partículas gruesas, 1-2 nucléolos centrales. Escaso, celeste, sin gránulos. 7-10 μm Excéntrico, redondo e indentado, cromatina en grandes acumulos muy densos, no se obs. nucléolos. citoplasma sangre Escaso. Celeste pálido, escasos gránulos azurófilos. MO y periférica sangre 12-20 μm Redondo u oval en forma de herradura, cromatina fina reticular en "tablero de ajedrez", No se obs. nucléolos. Abundante, azulado o grisáceo, gránulos inespecíficos abundantes lila o azul rojizo. MO 35-160 μm Central de forma anular, multilobulado en forma irregular, cromatina densa Abundante, levemente basófilo, gránulos azurófilos finos. MO y sangre periférica 1-4 μm No tiene Levemente basófilo, gránulos diversos. SERIE GRANULOCITICA Mieloblasto Dibujo MO Promielocito Mielocito Metamielocito MO 12-18 μm Excéntrico, indentado, cromatina que se va haciendo cada vez más gruesa. Nucléolo pequeño. Rosa-azulado, gránulos específicos y menor cantidad de gránulos inespecíficos. MO 10-16 μm Excéntrico, en forma de herradura, cromatina gruesa. Abundante, rosado, escasos gránulos inespecíficos y abundantes gránulos neutrófilos, eosinófilos o basófilos segun el tipo celular. al localización Tamaño morfología nuclear MO 10-18 μm Central o algo exéntrico, redondo, cromatina en red fina. Nucléolos evidentes. MO 18-20 μm Central o algo excéntrico, ovalado o algo indentada, cromatina en fina red. citoplasma Escaso, basófilo de aspecto esponjoso, pocos gránulos azurófilos de gran tamaño. Moderado, azul-celeste o grisáceo, gránulos azurófilos inespecíficos. 46 HISTOLOGÍA SERIE GRANULOCITICA Célula en cayado. PMN Neutrófilo localización MO y sangre periférica MO y sangre periférica MO y sangre periférica Tamaño morfología nuclear 10-15 μm Excéntrico, en forma de bastón, cromatina en gránulos gruesos. 10-15 μm Núcleo exéntrico y bilobulado, cromatina muy gruesa. citoplasma Abundante, gránulos específicos de cada tipo celular. Escasos gránulos inespecíficos. 10-12 μm Excéntrico, con 2 a 5 lóbulos con cromatina bastante gruesa. No se obs nucléolo. Rosa pálido, escasos gránulos inespecíficos y gránulos finos rosa violáceos. Dibujo MO PMN Eosinófilo PMN Basófilo. al Rosa azulado, gránulos específicos gruesos grandes de tamaño uniforme MO y sangre periférica 12-15 μm Grande y en forma de letra ese. Grandes gránulos específicos de forma y tamaño irregular. Gránulos son metacromáticos. TPH5 - TRABAJO PRÁCTICO Nº 5: TEJIDO MUSCULAR Y TEJIDO NERVIOSO I. TEJIDO MUSCULAR OBJETIVOS DEL TP Reconocer los componentes del tejido muscular. Diagnosticar el tejido muscular al MO. Establecer el diagnóstico diferencial entre los distintos tipos de tejidos musculares en base a sus características histológicas. Reconocer la ultraestructura de un sarcómero y de un disco intercalar. Preparados para MO 1) Preparado de lengua - H&E: Tejido muscular estriado esquelético: fascículos musculares del órgano. Identificar fibras musculares en distintas incidencias de corte (corte longitudinal y transversal) y diferenciarlas del TC circundante. Diferenciar los núcleos de fibrocitos del TC que rodea a las fibras musculares (correspondiente al endomisio y perimisio) de los núcleos de la fibra muscular. En un corte longitudinal de la fibra muscular observar la morfología celular y la ubicación periférica de los núcleos, reconocer las estriaciones transversales (cerrar levemente el diafragma y mover el condensador) observando la banda I clara y banda A oscura. En un corte transversal de una fibra muscular observar la disposición periférica de sus núcleos. 47 HISTOLOGÍA 2) Preparado de corazón - H&E: Tejido muscular estriado cardíaco: miocardio. Identificar fibras musculares en distintas incidencias de corte. En un corte longitudinal reconocer las estriaciones transversales (cerrar levemente el diafragma y mover el condensador), observar la morfología nuclear y su posición en la fibra muscular, observar el halo de glucógeno perinuclear. Reconocer en un corte transversal de las fibras musculares la posición del núcleo, el halo perinuclear de glucógeno y apreciar el diámetro de la fibra comparado con una fibra muscular estriada esquelética y lisa. 3) Preparado de intestino delgado - H&E: Tejido muscular liso: túnica muscular del órgano. Identificar fibras musculares en distintas incidencias de corte. En un corte longitudinal reconocer la morfología celular (fusiforme), la morfología nuclear y su ubicación central, la ausencia de estriaciones y de discos intercalares,. En un corte transversal reconocer la forma circular de las fibras y el tamaño variable de las mismas dependiendo de la zona de corte en las distintas fibras, y la posición central del núcleo. Fotomicrografía de MET 1) Reconocer la ultraestructura de una fibra muscular estriada esquelética: identificar los componentes del sarcómero (banda I, A y H, línea M y Z) y tríadas. Reconocer la ultraestructura de una unión neuromuscular. 2) Reconocer la ultraestructura de una fibra muscular estriada cardíaca: identificar disco intercalar (diferenciar fascias adherens, desmosomas y uniones nexo); sarcómero y díadas. 3) Reconocer la ultraestructura de una fibra muscular lisa: identificar filamentos, cuerpos densos y uniones nexo. EJERCICIOS a. Realizar un dibujo de la estructura de los tres tipos de fibras musculares en cortes longitudinal y transversal. b. Realizar un esquema ultraestructural de un sarcómero. Indique sus componentes. c. Complete el siguiente cuadro comparativo: Músculo estriado esquelético Músculo estriado cardíaco Músculo liso Esquema al MO Morfología celular Morfología nuclear / condensación de cromatina Longitud / diámetro celular Estriaciones? Retículo sarcoplasmático Uniones intercelulares Características específicas Localización Función 48 HISTOLOGÍA d. Explique brevemente los procesos de contracción en el músculo estriado esquelética y músculo liso. e. Explique qué es una proteína motora y mencione qué proteína de este tipo participa en la contracción muscular. f. Explique qué rol cumplen los filamentos intermedios en la fibra muscular. Mencione un ejemplo. g. Justifique qué componente del sistema de endomembranas se encuentra altamente desarrollado en el músculo estriado y qué función importante cumple durante la contracción muscular. II. TEJIDO NERVIOSO OBJETIVOS DEL TP Reconocer las características morfológicas distintivas del tejido nervioso con H&E. Reconocer los componentes tisulares del sistema nervioso central (SNC): neuronas, células de la glía (astrocitos, oligodendrocitos, microglía, células ependimarias). Reconocer los componentes tisulares del sistema nervioso periférico (SNP): neuronas, células de la glía (células de Schwmann, células satélites). Reconocer la sustancia gris (SG) y blanca (SB). Explicar la clasificación de las neuronas según su morfología: pseudomonopolares, bipolares, multipolares. Explicar el criterio de clasificación de las neuronas Golgi tipo I y II. Importancia biológica y funcional de la misma. Describir las características estructurales y ultraestructurales de las neuronas. Describir las diferencias estructurales, ultraestructurales y funcionales entre una dendrita y un axón. Comprender la importancia funcional del transporte axonal (anterógrado y retrógrado) y su implicancia funcional. Explicar el fundamento y reconocer los componentes tisulares coloreados con las técnicas de Nissl (basofilia), Cajal y Golgi. Reconocer los preparados coloreados con estas técnicas. Explicar el fundamento de las técnicas especiales para estudio de los diferenctes componentes del tejido nervioso. Reconocer los componentes tisulares coloreados con estas técnicas. Identificar los diferentes componentes del tejido nervioso y diferenciar sustancia blanca (SB) y sustancia gris (SG) con las diferentes técnicas de coloración del tejido nervioso. Identificar distintas morfologías neuronales. Identificar los componentes de un nervio. Preparados para MO 1) Preparado de cerebro de rata- Técnica de Nissl: Tejido nervioso: Identificar la piamadre (TCCD con fibrocitos) en contacto con la superficie del órgano. Diferenciar SG (periférica) y SB en base a su afinidad tintorial y la disposición de los somas y glía. En SG identificar somas neuronales con corpúsculos de Nissl en su 49 HISTOLOGÍA citoplasma, las primeras porciones de sus dendritas y núcleo de cromatina laxa y nucléolo evidente. Identificar distintas morfologías neuronales (estrellada y piramidal). En la SB observar la tinción basófila pálida (a qué se debe?), identificar las células gliales (astrocitos, oligodendrocitos y microglia) y endoteliales según su morfología nuclear y grado de condensación de la cromatina. Identificar los ependimocitos revistiendo los ventrículos y los plexos coroideos. 2) Preparado de cerebelo de rata - H&E: Tejido nervioso: Identificar la piamadre (TCCL con fibrocitos) en contacto con la superficie del órgano. Diferenciar SG (periférica) de organización laminar y SB en base a su afinidad tintorial y la disposición de los somas y glía. En SG identificar somas neuronales de las células de Purkinje, de morfología piriforme, con corpúsculos de Nissl en su citoplasma, la primera porción de su dendrita primaria y núcleo de cromatina laxa y nucléolo evidente. Identificar distintas morfologías neuronales. En la SB observar la tinción acidófila, más intensa que en la SG (a qué se debe?). En la SG y SB identificar las células gliales (astrocitos, oligodendrocitos y microglia) y endoteliales según su morfología nuclear y grado de condensación de la cromatina. Reconocer las diferencias de tinción en el tejido nervioso entre H&E y Nissl. 3) Preparado de cerebelo de rata - Impregnación argéntica - Cajal: Tejido nervioso: Diferenciar SG y SB en base a la abundancia de neurofibrillas en la SB. Reconocer las neuronas de purkinje y sus prolongaciones. Reconocer las diferencias tintoriales entre la técnica de Cajal y la de Nissl. 4) Preparado fijo de cerebelo - Impregnación argéntica - Golgi: Observar la morfología de una neurona completa, con su soma, árbol dendrítico y axón. Diferenciar axones de dendritas. Observar las células gliales con sus prolongaciones citoplasmáticas. 5) Preparado fijo de cerebelo - Oro sublimado de Cajal: técnica especial para astrocitos. Observar astrocitos con sus prolongaciones citoplasmáticas y la pared de los capilares sanguíneos delimitadas por los pies chupadores de los astrocitos. 6) Preparado fijo de Nervio con H&E: Identificar en un corte transversal de un nervio el TC que rodea (epineuro) un paquete de axones en corte transversal. Dentro del nervio identificar los axones como “puntos” acidófilos correspondiente al citoplasma axonal, rodeados por un anillo negativo correspondiente a la vaina de mielina, y ésta rodeada por TC correspondiente al endoneuro que rodea a los axones con sus vainas. Entre los fascículos de axones evidenciar el TC correspondiente al perineuro. 7) Preparado fijo de médula espinal – Técnica de Weigert: técnica especial para mielina. Axones mielínicos: identifical la SB periférica y observar cortes transversales y longitudinales de axones con su vaina de mielina teñida de azul oscuro. 8) Preparado fijo de médula espinal – Técnica de Klüver Barrera: técnica especial para mielina combinada con basofilia. Identificar somas neuronales y núcleos gliales badófilos. Identificar la vaina de mielina con tinción azul. 9) Preparado fijo de nervio – Técnica de tetróxido de ósmio: mielina. 50 HISTOLOGÍA Nervio mielínico: observar la vaina de mielina con un centro negativo correspondiente al axón. Fotomicrografía de MET 1) Neurona: reconocer el soma neuronal (abundante RER y ribosomas libres, REL, Golgi, mitocondrias) con su núcleo; axones y dendritas (neurofilamentos, neurotúbulos, mitocondrias). Diferenciar segmento inicial de dendritas y axón. 2) Reconocer los componentes ultraestructurales de una sinapsis química: presinápsis (vesículas sinápticas y membrana presináptica), hendidura sináptica y postsinapsis. 3) Reconocer una espina dendrítica. 4) Diferenciar los componentes ultraestructurales de un axón mielínico y amielínicos. 5) Reconocer en un corte longitudinal de un nervio mielínico: la vaina de mielina, los nódulos de Ranvier, el axón con los neurofilamentos y neurotúbulos longitudinales y mitocondrias. 6) Reconocer en un corte transversal un axón mielínico. Señalar el axón, las líneas densas (fusión de cara citosólica de las membranas plasmáticas) e intraperiódicas (fusión de la cara extracelular de las membranas plasmáticas) y los mesos externo e interno. EJERCICIOS a. Realice un esquema ultraestructural de una sinapsis química. b. Explique las diferencias en el proceso de mielinización en el sistema nervioso periférico y en el sistema nervioso central. c. Explique los fundamentos de las técnicas especiales para estudiar el tejido nervioso. d. Esquematice la barrera hematoencefálica. Indique sus componentes. Ejemplifice la importancia funcional de la misma. e. Explique qué características fisicoquímicas debe tener una droga que penetra y actúa en el SNC. f. Explique qué proteínas motoras llevan a cabo el transporte anterógrado y retrógrado de vesículas y organelas a lo largo de los axones. g. Explique qué componente del sistema de endomembranas participa en el recambio de membrana en el terminal presináptico. h. Justifique en que etapa del ciclo celular se encuentran las neuronas. 51 HISTOLOGÍA TPH6 - TRABAJO PRÁCTICO Nº 6: SISTEMA CARDIOVASCULAR Y ORGANOS LINFATICOS I. SISTEMA CARDIOVASCULAR OBJETIVOS DEL TP Preparados para MO 3) Preparado de corazón - H&E: Endocardio: endotelio, subendotelio (TCCL/D), subendocardio (TCCL, células de Purkinje); Miocardio: músculo estriado cardíaco; Epicardio o pericárdio visceral: TCCL, vasos, nervios y tejido adiposo, mesotelio. 4) Preparado fijo corazón - Tricrómico de Mallory. Observar la distribución de las fibras de colágeno entre las fibras de músculo estriado. Diferenciar el subendotelio y el suendocardio. 5) Preparado de aorta y vena cava - H&E: Intima endotelio (núcleos transversales), subendotelio (TCCL), Arteria membrana elástica interna (gruesa). elástica Media 50-70 laminas elásticas gruesas alternado con capas músculo liso corte long. Adventicia TCCL con vasos, nervios y adipocitos. Intima endotelio (núcleos longitudinales), subendotelio (TCCL con fibras musculares lisas longitudinales de mayor espesor que la aorta). Media fibras musculares lisas escasas en disposición Vena grande circular (hasta 10 capas). Adventicia TCCL (muy desarrollada, con abundantes fascículos de fibras musculares lisas longitudinales). No confundir con túnica media!. 52 HISTOLOGÍA 6) Preparado de lengua - H&E: Intima Endotelio (núcleos transversales) Arteria Subendotelio (TCCL) Muscular Lamina elástica interna (gruesa, festoneada) Media 10-40 capas músculo liso Adventicia TCCL Intima Endotelio (núcleos transversales) Subendotelio (TCCL escaso) Lamina elástica interna delgada (ausente en Arteriola pequeño calibre) Media 1-10 capas músculo liso Adventicia TCCL (delgada) Intima Endotelio (2-4 núcleos transversales / corte) Metarteriola Media 1-2 células mus. liso / corte Adventicia TCCL (escaso) Capilar Intima Endotelio (1-2 núcleo/corte) Vénula Intima Endotelio (2-10 núcleos longitudinales/corte) pericítica Media 1-2 pericitos Intima Endotelio (2-4 núcleos transversales / corte) Vénula Media 1-2 células músculo liso/corte muscular Adventicia TCCL escaso Fotomicrografía de MET 1) Reconocer la ultraestructura de los distintos tipos de capilares: continuos, fenestrados y discontinuos. Identificar uniones intercelulares, vesículas de pinocitosis, fenestraciones, membrana basal. EJERCICIOS a. Completar el siguiente cuadro de diagnostico diferencial de capilares: Capilar continuo Capilar fenestrado sinusoide discontinuo Capilar linfático Dibujo al MET Localización Continuidad del endotelio Fenestraciones? (diámetro) Diámetro del lumen Membrana basal Espacio intercelular Uniones intercelulares Pericitos? 53 Adventicia Túnica media Túnica íntima HISTOLOGÍA Diámetro Arteria elástica 0,5 - 3cm Arteria muscular 200µm - 1cm Metaarteriola 10µm - 20 µm Vénula pericitica 10 - 50µm Vénula muscular 50 – 200µm 20µm - 200µm Endotelio Continuo Continuo 200µm – 1cm 1cm Continuo Continuo 2-4 núcleos/corte Continuo Continuo Continuo Continuo Sub endoteli o TC + musc liso long. TC + musc liso long en bifurcaciones TC escaso Ausente Ausente Ausente TC TC de espesor considerable Lámina elástica interna Presente, difícil de observar al MO Prominente Ausente Ausente Ausente Delgada, formada x algunas fibras elásticas presente Capas muscular es Capas de fibras musculares alternadas con láminas elásticas 10 – 40 capas fibras musc lisas Delgada, fenestrada en arteriolas de 50 µm, ausente en las pequeñas 1 – 10 capas fibras musc lisas. 1 – 2 fibras musc lisas Ausente 1 capa fibra musc lisa discontinua. Pocas capas fibras musc lisas Hasta 10 capas fibras musc lisas Láminas elásticas 50 – 70 láminas gruesas, concéntricas Presente en gdes arterias. Ausente en pequeñas. Ausentes Ausentes Ausentes Ausentes Ausentes Ausentes Lámina elástica externa No se diferencia. Presente Ausente Ausente Ausente Ausente Ausente Ausente TC TC relativamente delgado en espesor, fibras musc lisas TC, fibras musc lisas long. TC escaso TC Mastocitos TC TC Abundantes fibras musc liso long. Y TC Vasa vasorum Adventicia y túnica media externa Presentes Adventicia Adventicia Ausente Ausente Ausente Adventicia Adventicia Presentes Presentes Presentes Ausentes Presentes Presentes presentes Nervios Arteriola Vena Grandes venas 54 HISTOLOGÍA II. ÓRGANOS LINFÁTICOS OBJETIVOS DEL TRABAJO PRÁCTICO Preparados para MO 1) Preparado de gangliolinfático - H&E: Reconocer la organización del órgano en cápsula, corteza y médula. Corteza: folículos linfáticos primarios y secundarios, diferenciar citológicamente centro germinativo y casquete linfocitario periférico. Diferenciar paracorteza. Médula: cordones y senos medulares. Identificar vasos linfáticos subcapsular y trabecular y senos medulares. Identificar las células reticulares. 2) Preparado de bazo - H&E: Reconocer a seco débil la organización del órgano en cápsula, pulpa roja y pulpa blanca. Observar su tinción general. Cápsula: TCCDNM con fibras musculares lisas. Comparar con la cápsula del ganglio linfático. Pulpa blanca: reconocer los corpúsculos de Malpighi (arteriola central, vaina linfática periarteriolar, folículo secundario con centro germinativo, zona marginal) Pulpa roja: sinusoides esplénicos separados por los cordones esplénicos. 3) Preparado de timo - H&E: Reconocer a seco débil la organización del órgano en pseudo-lobulillos y su tinción general. Identificar: capsula, corteza y médula de cada pseudo-lobulillo. Diferenciar corteza y médula según su tinción, densidad celular y presencia de los corpúsculos de Hassall. Reconocer a seco fuerte las células epitelioreticulares con sus prolongaciones citoplasmáticas. Fotomicrografía de MET 1) Bazo: observar los sinusoides esplénicos en la pulpa roja. 2) Ganglio linfático: observar los senos linfáticos. EJERCICIOS a. Complete el siguiente cuadro de diagnostico diferencial al MO: Ganglio linfático Bazo Timo Esquema topográfico Dividido en lobulillos? Corteza y médula? Nódulos linfáticos? Corpúsculo de Hassall? Pulpa roja y blanca? Senos linfáticos? Cel. epitelioreticulares o reticulares? 55 HISTOLOGÍA TPH7 - TRABAJO PRÁCTICO Nº7: APARATO RESPIRATORIO Y APARATO URINARIO I. APARATO RESPIRATORIO OBJETIVOS DEL TRABAJO PRÁCTICO Preparados para MO 1) Preparado de Tráquea - H&E: Reconocer a seco débil la organización histológica del órgano. Reconocer a seco fuerte todos los tejidos que componen el órgano. Mucosa Submucosa Muscularcartilaginosa Adventicia Epitelio cilíndrico pseudoestratificado ciliado con células caliciformes Lamina propia: TCCL TCCL/D con glándulas mixtas submucosas. Músculo traqueal: músculo liso longitudinal Cartílago hialino con su pericondrio TCCL con vasos, nervios y cél. Adiposas 2) Preparado de Pulmón de rata- H&E: Identificar a seco débil la organización histológica del órgano: diferentes tipos de conductos aéreos de diversos tamaños rodeados por alveolos. Identificar y realizar el diagnostico diferencial de los distintos tipos de conductos aéreos: bronquios intrapulmonar, bronquiolos propiamente dichos, bronquiolos terminales y bronquiolos respiratorios. Identificarlos primero a seco débil por: el diámetro, la presencia o no de cartílago, presencia de luz lisa o festoneada, luz continua o discontinua. Luego, a seco fuerte, identificar los distintos conductos aéreos por el epitelio, el espesor de las túnicas que presenten, la presencia de células de Clara. Identificar la hoja visceral de la pleura. Bronquio intrapulmonar (≈ tráquea) Bronquiolo propiamentedicho (luz festoneada) Bronquiolo terminal (luz lisa) Bronquiolo respiratorio (luz discontinua) Conducto alveolar Pared alveolar Mucosa: Epitelio cilíndrico pseudoestratificado ciliado con células caliciformes, MB, lamina propia (TCCL) Submucosa: TCCL/D con glándulas mixtas submucosas. Músculo de Reissense, cartílago hialino Adventícia Mucosa: Epitelio cilíndrico simple ciliado con pocas cél caliciformes, lamina propia (escasa) Músculo de Reissense y placas de cartílago hialino (solo en rata) Adventicia (poco desarrollada) Mucosa: epitelio cilíndrico bajo–cúbico simple ciliado sin cél caliciformes, con cél. de Clara, lamina propia (escasa) Músculo de Resísense Mucosa: epitelio cubico simple, sin cilios, sin cél caliciformes, con > # cél. de Clara, lamina propia (muy delgada) Músculo de Reissense (muy delgado) Epitelio plano simple, capilares sanguíneos y muy escaso TC 56 HISTOLOGÍA Fotomicrografía de MET 1) Observar la ultraestructura del epitelio respiratorio: reconocer los tipos celulares. 2) Observar la ultraestructura de las células de Clara y de los neumonocitos tipo II. Reconocer los cuerpos lamelares. 3) Observar la ultraestructura de la pared alveolar: reconocer todos sus componentes. 4) Observar la ultraestructura de la barrera hemato-alveolar: reconocer sus componentes. EJERCICIOS a. Complete el siguiente cuadro comparativo sobre la organización histológica de los conductos aéreos: Tráquea Bronquio Bronquiolo ppiamente dicho Bronquiolo terminal Bronquiolo respiratorio Alvéolo Dibujo estructural al MO Diámetro relativo Numero de conductos por corte Luz lisa o festoneada? Luz continua o discontinua? Cartílago? disposición? Epitelio Tipos celulares Cantidad relativa de cel. Ciliadas Cantidad relativa de cel. Caliciformes. Células de Clara? Cantidad relativa de músculo liso Glándulas? 57 HISTOLOGÍA II. APARATO URINARIO OBJETIVOS DEL TRABAJO PRÁCTICO Preparados para MO 1) Preparado de riñón - H&E: Identificar con seco débil la organización general del órgano: capsula, corteza y medula. Corteza: reconocer los corpúsculo de Malpighi (glomérulos, capsula de Bowman hoja parietal y visceral, espacio urinario, arteriolas en el polo vascular), TCP, TCD, y TC. Realice un diagnostico diferencial de estos tres tipos de túbulos. Reconocer una mácula densa en el polo vascular. Médula: identificar las asas gruesas de Henle (túbulos recto proximal y túbulos recto distal), las asas delgadas de Henle (diferenciarla de los capilares sanguíneos) y los TC. Identificar los rayos medulares. 2) Preparado de ureter - H&E: Reconocer a seco débil la organización estructural del órgano en túnicas (túnica mucosa, muscular y adventicia). A seco fuerte identificar el tipo de epitelio (utotelio o polimorfo). 3) Preparado de vejiga - H&E: Reconocer a seco débil la organización estructural del órgano en túnicas (túnica mucosa, muscular y serosa). A seco fuerte identificar el tipo de epitelio (utotelio o polimorfo). Fotomicrografía de MET 1) Reconocer los componentes ultraestructurales de la barrera de filtración glomerular: espacio capsular, pedicelos de los podocitos, ranura de filtración, lámina rara externa, lámina densa, lámina rara interna, citoplasma de las células endoteliales, fenestraciones del endotelio con diafragma, luz del capilar. 2) Reconocer la ultraestructura de un TCP, un TCD, un asa delgada de Henle y un TC: diferenciarlos por presencia de microvellosidades, # y disposición de mitocondrias, vesículas endocíticas. EJERCICIOS a. Realizar un esquema ultraestructural de la barrera de ultrafiltración glomerular. b. Realizar un esquema con los componentes de un nefrón. 58 HISTOLOGÍA c. Completar el siguiente cuadro comparativo de diagnostico diferencia al MO de los distintos tipos de túbulos y capilar sanguíneo: TCP Túbulo recto proximal Asa delgada de Henle Túbulo recto distal TCD Tubulo colector vaso sanguíneo Dibujo al MO Localización Diámetro Tipo de epitelio Nº núcleos/corte Disposición núcleos? de los Tinción del citoplasma Cantidad relativa de microvellosidades? TPH8 - TRABAJO PRÁCTICO Nº8: TUBO DIGESTIVO Y GLANDULAS ANEXAS I I. TUBO DIGESTIVO OBJETIVOS DEL TRABAJO PRÁCTICO Preparados para MO 1) Preparado de esófago - H&E. Identificar a seco débil las túnicas (mucosa, submucosa, muscular y adventicia). Identificar a seco fuerte el epitelio plano estratificado no queratinizado, el tejido conectivo por debajo y la muscular de la mucosa (capa longitudinales: paquetes aislados de músculo liso corte transversal), las glándulas de tipo mucoso en la submucosa, las capas de tejido muscular liso y/o estriado esquelético y la adventicia. 59 HISTOLOGÍA 2) Preparado de estómago - H&E Identificar a seco débil las cuatro túnicas (mucosa, submucosa, muscular y serosa). Identificar a seco fuerte la mucosa (epitelio cilíndrico simple, criptas gástricas y glándulas fúndicas: observar las características morfológicas, tintoriales y de distribución de los distintos tipo celulares); la muscular (observar el espesor) y el mesotelio peritoneal (epitelio plano simple). 3) Preparado de duodeno - H&E Identificar a seco débil las cuatro túnicas (mucosa, submucosa, muscular y serosa). Identificar a seco fuerte la mucosa (epitelio cilíndrico simple con células caliciformes y chapa estriada), la submucosa (glándulas de Brunner: acinos mucosos), muscular y serosa. 4) Preparado de yeyuno-ileon - H&E Identificar a seco débil las cuatro túnicas (mucosa, submucosa, muscular y serosa). Identificar a seco fuerte la mucosa (vellosidades intestinales: epitelio cilíndrico simple con células caliciformes y chapa estriada, glándulas de Lieberkhun, lamina propia con músculo de Bruke y vaso linfático quilífero, muscular de la mucosa), submucosa (observar acumulos linfáticos, plexos nerviosos de Meissner); muscular (plexos nerviosos de Auerbach) y serosa. 5) Preparado de intestino grueso - H&E Identificar a seco débil las cuatro túnicas (mucosa, submucosa, muscular y serosa). Identificar a seco fuerte la mucosa (epitelio cilíndrico simple con chapa estriada y abundantes células caliciformes, lamina propia de TCCL), submucosa (observar los abundantes acumulos linfáticos), muscular. 6) Preparado fijo de placas de Peyer - H&E 7) Preparado fijo de Cripta de Lieberkhun con células de Paneth - H&E EJERCICIOS a. Completar el siguiente cuadro de diagnostico diferencial al MO: Órgano ESOFAGO superior inferior ESTOMAGO cardias fundus INTESTINO píloro duodeno yeyuno ileon INTESTINO GRUESO colon Esquema topográfico Función Epitelio Lamina propia Muscular de la mucosa Submucosa Muscular Adventicia/ serosa 60 HISTOLOGÍA II. GLANDULAS ANEXAS I OBJETIVOS DEL TRABAJO PRÁCTICO Preparados para MO 1) Preparado de glándula salival submaxilar - H&E: Identificar a seco débil la estructura histológica de la glándula: lobulillos y conductos interlobullilares. Observar la proporción relativa de acinos serosos/mucosos. Identificar a seco fuerte: acinos serosos, mucosos y mixtos; conductos intercalares, intralubulillares e interlobulillares. Función de los conductos intercalares 2) Preparado de vesícula biliar - H&E Identificar a seco débil la organización del órgano en túnica mucosa (epitelio cilíndrico alto simple y LP), muscular, adventicia o serosa (peritoneo visceral). (Ausencia de muscular de la mucosa y submucosa!) Identificar a seco fuerte el epitelio de revestimiento. Fotomicrografía de MET 1) Glándula salival: reconocer la ultraestructura de un acino seroso (identificar en la región basal de la célula serosa un RER y Golgi muy desarrollado y ribosomas libres y en la región apical los gránulos de cimógeno electrondenso), mucoso (identificar en la región apical de la célula mucosa Golgi bien desarrollado y gránulos de muscinógeno apicales) y mixtos. Reconocer un conducto estriado o intralobulillar (reconocer las mitocondrias basales en disposición perpendicular a la MB) EJERCICIOS a. Realizar un cuadro comparativo con las principales características de cada órgano (epitelio, células, glándulas, estructuras, etc.) que le permita hacer un diagnostico diferencial al MO. b. Realizar un esquema de una vellosidad intestinal señalando los tejidos que la componen 61 HISTOLOGÍA TPH9 - TRABAJO PRÁCTICO Nº9: GLANDULAS ANEXAS DEL TUBO DIGESTIVO II Y SISTEMA ENDÓCRINO I. GLANDULAS ANEXAS DEL TUBO DIGESTIVO II OBJETIVOS DEL TRABAJO PRÁCTICO Preparados para MO 1) Preparado de hígado - H&E Reconocer a seco débil la organización estructural del órgano: capsula, lobulillos hepáticos delimitados por TC, vena cetrolobulillar y los espacios porta con sus componentes. Reconocer a seco fuerte la cápsula de Glisson (TCCD) Reconocer a seco fuerte las trabéculas de hepatocitos y entre estos, lo sinusoides que desembocan en la vena centrolobulillar. Observar la morfología y las características tintoriales de un hepatocito. Reconocer los espacios porta o de Kiernan y sus componentes: rama de la vena porta, rama de la arteria hepática y conducto biliar. 2) Preparado de páncreas - H&E Reconocer a seco débil la organización estructural del órgano (acinos pancreáticos, conductos excretores e islotes de langerhans). Reconocer a seco fuerte la porción exócrina: identificar los acinos de tipo seroso (observar su tinción), las células centroacinares y los conductos excretores rodeados de TC. Reconocer a seco fuerte la porción endócrina: islotes de Langerhans formado por cordones celulares anastomosados entre sí y capilares sinusoides. II. SISTEMA ENDÓCRINO OBJETIVOS DEL TRABAJO PRÁCTICO Preparados para MO 1) Preparado de hipófisis - Tricrómico de Mallory Identificar a seco débil la adenohipófisis (pars distalis, pars intermedia y pars tuberalis) y la neurohipófisis (pars nervosa) y diferenciarlas según su coloración y características estructurales. Adenohipófisis: identificar a seco fuerte las células cromófilas “basófilas” y “acidófilas” y cromófobas. Reconocer cordones celulares con disposición de tipo acinar, el TC y los capilares sinusoides que se dispone entre estos cordones. Neurohipófisis: reconocer a seco fuerte el aspecto fibroso y las escasas células. Identificar los pituicitos (forma fusiforme y cromatina relativamente laxa) y los cuerpos de Herring. Pars intermedia: reconocer las células basófilas y vesículas con contenido coloide (Quistes de Rathke). 2) Preparado de tiróides - H&E Identificar a seco débil la estructura de la glándula: reconocer los folículos tiroideos revestidos por una capa de células foliculares. 62 HISTOLOGÍA Identificar a seco fuerte el epitelio glandular plano-cubico-cilíndrico simple (dependiendo del grado de actividad de la glándula) que contiene el coloideo tiroideo (contenido amorfo, homogéneo y eosinófilo), los delgados tabiques de TCCL (TC parafolicular) con gran cantidad de vasos. Si se observa, reconocer las células parafoliculares (citoplasma claro, núcleo central) dispuestas aisladas o en grupos entre las células foliculares, dentro de la lámina basal pero sin contactar con la luz. 3) Preparado de paratiroides - H&E Reconocer a seco débil un parénquima glandular dispuesto en codones anastomosados y capilares sanuíneos. Reconocer a seco fuerte las células principales (núcleo central esférico y citoplasma eosinófilo claro) y las células oxífilas (citoplasma eosinófilo) 4) Preparado de glándula suprarrenal - H&E Reconocer a seco débil la organización estructural de la glándula: identificar capsula, corteza y medula. Observar las afinidades tintoriales de corteza y medula. Reconocer a seco fuerte la capsula: TCCD con nervios y vasos que envía tabiques de TC hacia el interior de la glándula. Reconocer a seco fuerte las diferentes regiones que forman la corteza: Corteza glomerular: observar células pequeñas agrupadas en forma de glomérulos, citoplasma ligeramente acidófilo, núcleo central de cromatina grumosa. Corteza fascicular: observar cordones radiales celulares separados por sinusoides. Identificar células con citoplasma “vacuolado” (espongiocitos). Corteza reticular: observar las pequeñas células acidófilas dispuestas en forma de red. Reconocer a seco fuerte la médula (ligeramente basófila): observar células poliédricas con citoplasma basófilo y núcleo grande y vesiculoso (células cromoafines). EJERCICIOS a. Realice un dibujo de la ultraestructura de una célula secretora de esteroides. b. Realice un dibujo al MO de un lobulillo hepático con la triada portal c. Realice un dibujo al MO de un acino pancreático con la célula centroacinar, y un conducto intercalar e interlobulillar. d. Realice un esquema topográfico de la hipófisis. Realice un detalle al MO de una sección de la adenohipófisis y de la neurohipofisis. e. Realice un esquema topográfico de una glándula suprarrenal. Realice un detalle al MO de una sección de la corteza glomerular, fascicular y reticular y de la médula. f. Realice un detalle al MO de un folículo tiroideo. 63 HISTOLOGÍA TPH10 - TRABAJO PRÁCTICO Nº10: APARATO GENITAL FEMENINO OBJETIVOS DEL TRABAJO PRÁCTICO Preparados para MO 1) Preparado de ovario de gato- H&E: Reconocer a seco débil la organicación estructural: cápsula (epitelio cúbico simple), corteza (presencia de folículos ováricos), médula (TCCL + vasos sanguineos), hilio. Reconocer a seco fuerte: Folículo primordial: oocito + MB + capa unilaminar de células foliculares planas. Folículo primario: oocito + membrana pelúcida + una o más capas de células de la granulosa cúbicas. Folículo secundario preantral: oocito + membrana pelúcida + varias capas de cél. de la granulosa + antro en formación + teca interna + teca externa. Folículo secundario antral: oocito + membrana pelúcida + células de la granulosa organizadas en corona radiata y cúmulo ooforo + varias capas de cél. de la granulosa + antro completo + teca interna + teca externa. Folículos atrésicos Cuerpo lúteo 2) Preparado de trompa de falopio - H&E: Reconocer a seco débil la organización histológica en túnicas: mucosa con pliegues ramificados, muscular y serosa Reconocer en seco fuerte la mucosa (epitelio cilíndrico simple ciliado + TCCL), muscular (capa circular interna y longitudinal externa), serosa. 3) Preparado de útero de humano - H&E: Reconocer a seco débil la organización histológica: endometrio, miometrio. El perimetrio no se observa en estos preparados. Reconocer a seco fuerte el endometrio: epitelio cilíndrico ciliado, glándulas uterinas y lámina propia con TCCL y vasos sanguíneos. Reconocer a seco fuerte el miometrio: músculo liso con TC 4) Preparado fijo de cuello uterino de humano – H&E: Observar a seco débil la organización histológica: endocervix, exocervix Observar a seco fuerte el endocervix (mucosa con epitelio cilíndrico simple y glándulas cervicales tubuloalveolares) y el exocervix (mucosa con epitelio plano estratificado). Observar el TC y músculo liso por debajo del epitelio. Observar los quistes de Naboth y los folículos linfáticos. 5) Preparado de extendido vaginal de humano- Papanicolaou: Reconocer células basales, parabasales, cianofilas superficiales y eosinofilas superficiales, elementos no vaginales (eritrocitos, leucocitos, bacilos, mucus). Reconocer si el extendido corresponde a una mujer en edad fértil o menopáusica. Determinar en el caso de extendidos de mujer en edad fértil en qué etapa del ciclo se encuentra. 64 HISTOLOGÍA 6) Preparado de glándula mamaria túbulo alveolar ramificada - H&E: Glándula en reposo: reconocer los conductos excretores y las células mioepiteliales. Reconocer los gruesos tabiques interlobulillares de TCCD y el abundante estroma intralobulillar de TCCL Glandula en actividad: establecer el diagnostico diferencial con la glándula en reposo: observar el aumento en el número de alveolos (con producto de secreción), el adelgazamiento de los tabiques interlobulillares y del estroma intralobulillar. Reconocer las células mioepiteliales. Reconocer el conducto galactóforo. Fotomicrografía de MET 1) Observar la ultraestructura de los componentes de un folículo secundario. 2) Observar la ultraestructura de un cuerpo lúteo. Diferenciar las células tecoluteínicas de las granuloluteínicas. EJERCICIOS a. Complete el siguiente cuadro según las distintas fases: Día del ciclo 1 Día del ciclo 13-14 Día del ciclo 26-27 Ovario Útero Hormonas b. Complete el siguiente cuadro sobre los distintos folículos ováricos: Folículo Capas de células foliculares Morfología cél. foliculares Membrana pelúcida Tecas Líquido folicular Cúmulus ooforus Primordial Primario Secundario Secundario maduro ANEXO: COLPOCITOLOGÍA Extendido vaginal: el material debe ser extraído de la pared externa del fondo de saco lateral de la vagina, aspirándolo con una pipeta o arrastrándolo con una espátula. Luego de ser depositado sobre un portaobjeto, es fijado y coloreado. Entre las técnicas de tinción más comunes tenemos la de Shorr y la de Papanicolaou. Elementos del colpocitograma: Normales: células vaginales, células cervicales, células de la sangre, gérmenes de la flora vaginal. Anormales: células inflamatorias, células neoplásicas, tricomonas, hongos, gérmenes patógenos. 65 HISTOLOGÍA Técnica de tinción: Técnica tinción Colorante nuclear Colorante citoplasmático Células eosinófilas Células cianófilas Nucleos picnóticos Núcleos no picnóticos Ventajas Shorr Biebrich escarlata Verde rápido / Naranja G rojas Verde azulado Rojo azul Técnica simple y rápida Desventajas Se observa poco detalle nuclear y citoplasma no transparente. Los eritrocitos se observan retraídos Papanicolau Hematoxilina de Harris Naranja G / Eosina / Ligth green Rojo-naranja Azul Púrpura Azul-violeta excelente detalle nuclear y transparencia El contraste entre las células cianófilas y eosinófilas a veces no es nítido. Tipos celulares de las diferentes capas del epitelio vaginal en un colpocitograma: Estrato Basal Zona Dibujo al MO Células Intermedio Profunda y parabasal Tamaño (µm) Núcleo Células extendido Cilíndricas en empalizada, forma redondeada u oval Forma oval y poligonal 12 -25 6-8µm, vesiculoso, picnótico. Cianófilas profundas 20-30 6-9µm, comienza a tener características picnóticas Cianófilas intermedias no Superficial Profunda funcional Poliédricas aplanadas, con granulaciones 35-60 Picnótico Poliédricas, grandes aplanadas 35-60 picnótico Cianófilas superficiales Eosinófilas superficiales y Fases del ciclo sexual normal y correlación con el colpocitograma Una vez comenzados los ciclos ovulatorios se destacan en el colpocitograma modificaciones citológicas que pueden ser clasificadas en fases o períodos: Período menstrual Día del ciclo 1-5 Postmenstrual 5-10 Preovulatorio 10-13 ovulatorio 13-15 Postovulatorio 15-17 luteínico 17-25 Premenstrual 25-28 Elementos vaginales Predominan las células cianófilas intermedias. Las células están agrupadas y presentan pliegues. Predominan las células cianófilas intermedias, las células están separadas y poco plegadas. Predominan las células superficiales. Células aisladas, desaparecen las agrupaciones. Predominan las células eosinófilas superficiales. Células planas y bien coloreadas. Disminuyen las células eosinófilas y aumentan las cianófilas superficiales. Pocas intermedias. Hay algunas células plegadas. Disminuyen aún más las células eosinófilas, predominan las células intermedias, hallándose algunas naviculares. Las células están agrupadas, se observa degeneración celular y reducción de tamaño. Predominio de células intermedias, algunas naviculares. Pocas células eosinófilas. Disminuye la agrupación celular. Índice picnótico 11-14 % 14-23 % 27-47 % 47-67 % Elementos no vaginales Eritrocitos y leucocitos. Macrófagos y células endometriales. Abundante mucus. Prácticamente desaparecen los eritrocitos y leucocitos. Poco mucus. Ausencia de eritrocitos y leucocitos Ausencia de elementos (extendido limpio). 55-38 % Mucus grumoso. Presencia de algunos leucocitos. 38-15 % Mucus espeso y abundante. Presencia de algunos leucocitos 11-15 % Abundantes leucocitos. Pueden aparecer eritrocitos. algunos Bibliografía: Leoncini, L.F. Colpocitograma. Ed. Panamericana. 66 HISTOLOGÍA TPH11 - TRABAJO PRÁCTICO Nº11: APARATO GENITAL MASCULINO Y PIEL I. APARATO GENITAL MASCULINO OBJETIVOS DEL TRABAJO PRÁCTICO Preparados para MO 1) Preparado de testículo y epidídimo - H&E + PAS: Reconocer a seco débil la capsula (túnica albugínea con su túnica vascular), los cortes transversales de los túbulos seminíferos y de los túbulos epididiarios. Túbulo seminífero: reconocer a seco fuerte los componentes celulares del epitelio seminífero estratificado. Identificar las células germinales (espermatogonias A clara y oscura, espermatogonias B, espermatocito I, espermátidas tempranas y tardías) y las células de Sertoli, en base a su posición en el epitelio, la morfología y tamaño nuclear, la cromatina. Reconocer la lamina propia donde de apoya el epitelio seminífero. Reconocer el intersticio de TC con vasos y células de Leydig. Epidídimo: reconocer a seco fuerte el epitelio pseudoestratificado cilíndrico con células basales bajas y células principales altas con estereocilias, los espermatozoides en su lumen y la capa de músculo liso que rodea al túbulo. Reconocer el intersticio de TCCL y músculo liso rodeando los túbulos. 2) Preparado de conducto deferente - H&E: Reconocer a seco débil las túnicas mucosa, muscular y adventicia. Reconocer a seco fuerte la mucosa (epitelio cilíndrico pseudoestratificado con estereocilias, lamina propia), músculo liso (MLI, MCM, MLE), adventicia (TCCL con vasos y nervios). 3) Preparado de próstata: glándula tubuloalveolar - H&E: Reconocer a seco fuerte los alveolos glandulares con epitelio cúbico a cilíndrico simple, el estroma de TC con fibras musculares lisas. 4) Preparado fijo de vesícula seminal - H&E Observar a seco débil la mucosa con numerosos pliegues anastomosados, la muscular y la adventicia. Observar a seco fuerte el epitelio pseudoestratificado cilíndrico, lámina propia de TCCL, la muscular y la adventicia. Fotomicrografía de MET 1) Observar la ultraestructura del epitelio seminífero. 2) Observar la ultraestructura de un espermatozoide 3) Observar la ultraestructura de una célula de Leydig. 67 HISTOLOGÍA EJERCICIOS a. Realice un dibujo al MO de una sección del epitelio seminífero con una célula de Sertoli, una espermatogonia A clara, A oscura y B, un espermatocito I, una eespermátida temprana y tardía, la MB y el intersticio con una célula de Leydig. II. PIEL OBJETIVOS DEL TRABAJO PRÁCTICO Preparados para MO 1) Preparado de piel fina - H&E: Identificar a seco débil las capas de la piel: epidermis, dermis e hipodermis. Reconocer a seco fuerte la epidermis (epitelio plano estratificado queratinizado) e identificar los diferentes estratos celulares por sus características tintoriales y la morfología de las células que lo componen (estrato basal, espinoso, granuloso y corneo). Identificar células basales, queratinocitos, gránulos de queratohialina, melanina. Reconocer a seco fuerte la dermis papilar (TCCL) y la dermis reticular (TCCDNM). Reconocer a seco fuerte las gl. sudoríparas (diferenciar adenómero y conducto excretor) y sebáceas. Identificar un folículo piloso. 2) Preparado de piel gruesa - H&E: Identificar a seco débil las capas de la piel (epidermis, dermis e hipodermis) Reconocer a seco fuerte la epidermis (epitelio plano estratificado queratinizado) e identificar los diferentes estratos celulares por sus características tintoriales y la morfología de las células que lo componen (estrato basal, espinoso, granuloso, lúcido, lúcido y corneo). Identificar células basales, queratinocitos, gránulos de queratohialina. Notar la ausencia de melanina. Observar la diferencia en el espesor del epitelio con la piel fina. Reconocer a seco débil la dermis papilar (TCCL) y la dermis reticular (TCCDNM). Reconocer a seco fuerte la presencia de gl. sudoríparas y notar la ausencia de gl. sebáceas y folículos pilosos. Fotomicrografía de MET 1) Observar la ultraestructura de un queratinocito en el estrato espinoso: identificar los desmosomas entre las celular. 2) Observar la ultraestructura de un queratinocito en el estrato granuloso: identificar los granulos de queratohialina, los cuerpos laminares y las uniones desmosomas entre las células. 3) Observar la ultraestructura de una célula de Merkel. 4) Observar la ultraestructura de un melanocito: identificar las prolongaciones citoplasmáticas entre los queratinocitos y los gránulos de melania. 68 HISTOLOGÍA TPH12 - TRABAJO PRÁCTICO Nº12: SISTEMA NERVIOSO Y ÓRGANOS DE LOS SENTIDOS I. SISTEMA NERVIOSO OBJETIVOS DEL TRABAJO PRÁCTICO Preparados para MO 1) Preparado de cerebelo - basofilia: Reconocer a seco débil la sustancia gris cubierta por la piamadre (cubierta meníngea) y la sustancia blanca central. Reconocer en la SB los oligodendrocitos, astrocitos y microglía. Reconocer a seco fuerte los núcleos de los fibrocitos de la piamadre Reconocer a seco fuerte la organización de la corteza cerebelar en tres láminas: Molecular: neuronas estrelladas, en cesto y células gliales, Pukinje: neuronas de Purkinje con sus raíces dendríticas primarias, Granular: neuronas grano, Golgi y células gliales. Reconocer lo espacios libre de somas que corresponderían a la ubicación de un glomérulo cerebeloso. 2) Preparado de cerebelo - Cajal: Reconocer a seco débil la SG y SB. Reconocer a seco fuerte las 3 láminas de la corteza cerebelosa. Molecular: identificar las dendritas de las neuronas grano (fibras paralelas), ,Pukinje: identificar los axones de las células en cesto rodeando el soma de las células de Purkinje, Granular: reconocer las condensaciones de neurofibrillas como un glomérulo cerebeloso. 3) Preparado de cerebro de rata - Técnica de Nissl: Reconocer a seco débil la SG y SB, la organización en láminas de la corteza cerebral, los ventrículos y los plexos coroideos. Reconocer a seco fuerte los fibrocitos de las menínges. Reconocer a seco fuerte la organización de la corteza cerebral en seis láminas: i. molecular: pocas neuronas pequeñas. ii. granulosa externa: pequeñas neuronas piramidales y estrelladas. iii. piramidal externa: pequeñas neuronas piramidales. iv. granulosa interna: neuronas estrelladas. v. piramidal interna: neuronas piramidales grandes. vi. de células fusiformes: neuronas fusiformes. Reconocer a seco fuerte la sustancia blanca central y las células gliales. Reconocer a seco fuerte los ventrículos, el epitelio ependimario que lo recubre y los plexos coroideos con abundantes capilares sanguíneos. Realzar un diagnostico diferencial entre la corteza cerebral y la cerebelosa con basofilia. 69 HISTOLOGÍA 4) Preparado de médula espinal - Cajal: Reconocer a seco débil la organización histológica: SG y SB, astas anteriores y posteriores, raíces nerviosas anteriores y posteriores, surcos medio anterior y posterior, conducto ependimario, cubiertas meníngeas y nervios periféricos. Reconocer a seco fuerte las motoneuronas, la organización del neuropilo, las incidencias de corte de los axones según su trayectoria en la medula espinal y los nervios periféricos. 5) Preparado de ganglio raquídeo - H&E, Cajal: 6) Preparado de ganglio simpáticodel SNA - H&E: 7) Preparado fijo de ganglio parasimpáticodel SNA - H&E: EJERCICIOS a. Realice un dibujo topográfico al MO de la medula espinal. b. Complete el siguiente cuadro de los componentes de la corteza cerebelar: Capa Somas (neuronas y glía) Dendritas Axones aferentes Axones eferentes Molecular Purkinje Granulosa c. Complete el siguiente esquema de los componentes de la corteza cerebral: Capa Somas (Neuronas y glía) Dendritas Axones aferentes Axones eferentes I II III IV V VI 70 HISTOLOGÍA I. OJO OBJETIVOS DEL TRABAJO PRÁCTICO Preparados para MO 1) Preparado de ojo - H&E: Reconocer a seco débil la organización histológica del ojo. Reconocer a seco fuerte las distintas estructuras histológicas que lo componen: Cornea: epitelio anterior (plano estratificado no queratinizado), membrana basal de Bowman, lámina propia (TCCDML avascular), membrana basal de Descemet y epitelio posterior (plano simple). Cristalino: Esclerótica: TCCDNM vascular con fibroblastos y melanocitos. Iris: tejido conectivo laxo vascularizado tapizado por una doble capa epitelial. Músculo dilatador y esfinter de la pupila. Cuerpos ciliares: constituido por tejido conectivo rico en fibras elásticas y vasos y revestido por una doble capa de células epiteliales Coroides: estructura vascular que se encuentra entre la esclerótica por fuera y la retina por dentro. Constituida por vasos de pequeño calibre y capilares. Retina: formada por varias capas: I. epitelio pigmentario, II. segmento externo de conos y bastones, III. segmento interno de conos y bastones, IV. limitante externa, V. granulosa externa: somas de conos y bastones, VI. plexiforme externa: sinapsis entre fotoreceptores, bipolares, y amacrinas, VII. granulosa interna: somas de células bipolares, horizontales, amacrinas y de Müller, VIII. plexiforme interna: sinapsis entre bipolares, amacrinas y ganglionares, IX. ganglionar: somas de células ganglionares, X. fibras del nervio óptico: axones de las células ganglionares; XI. limitante interna. Nervio óptico Fotomicrografía de MET 1) Reconocer la ultraestructura de un cono y un bastón. EJERCICIOS a. Realice un esquema topográfico del ojo, indicando sus túnicas. b. Realice un esquema al MO de las capas de la retina. 71 BIOLOGÍA CELULAR BIOLOGÍA CELULAR PROGRAMA ANALÍTICO DE BIOLOGIA CELULAR METODOS DE ESTUDIO DE LA CÉLULA. Microscopía. Límite de resolución de los instrumentos formadores de imágenes. Fenómenos de difracción e interferencia. Microscopía de contraste de fases: fundamentos y aplicaciones. Microscopía de polarización. Birrefringencia. Microscopía electrónica de transmisión. Dispersión de electrones. Resolución del MET. Similitudes y diferencias entre el MO y MET. Intensificación del contraste mediante elementos de peso molecular elevado. Ultramicrotomía. Criofractura. Microscopía electrónica de barrido. Difracción de rayos X. Estudio de la célula viva. Cultivos celulares. Técnicas histológicas. Bases de la fijación. Fundamentos de la coloración de las células. Microscopía de fluorescencia. Autofluorescencia y fluorocromos. Metacromasia. Acidofilia y basofilia. Citoquímica. Métodos para la localización de ácidos nucleicos, lípidos y glucoproteinas. Técnicas histoquímicas para actividades enzimáticas. Inmunocitoquímica, métodos directos e indirectos. Marcación con oro coloidal. Localización de iones inorgánicos. Microrradiografía. Métodos autorradiográficos para microscopía de luz y electrónica. Marcadores y sensibilidad. Hibridación in situ. Fraccionamiento celular. Observación de fracciones: su contenido estructural. Microscopía de partículas y macromoléculas. Tinción negativa. Sombreado. Técnica de microscopía electrónica para ácidos nucleicos, microextendidos. Técnicas cuantitativas en microscopía. Citofotometría. Autorradiografía cuantitativa. Contenido informático de imágenes: relación entre estructura e imagen. Digitalización de imágenes. Citometría de flujo: aplicaciones. Análisis elemental mediante sonda electrónica. Reconstrucciones tridimensionales por cortes seriados. Aplicaciones de la computación a la microscopía. ORGANIZACIÓN GENERAL DE LA CÉLULA. Niveles de organización. Organismos procariontes y eucariontes. Arquibacterias y evolución celular. Diferenciación entre pro y eucariontes. Organismos uni y pluricelulares. Diferenciación celular. Biología celular y molecular de la célula. Estructura general del citoplasma y del núcleo. MEMBRANA CELULAR. Composición química de las membranas. Membrana del eritrocito. Ultraestructura. La unidad de membrana: su interpretación estructural. Modelos moleculares. Bicapa lipídica. Miscelas. Liposomas. Modelo de mosaico fluido. Propiedades de la membrana. Fusión de membranas. Receptores. Su movilidad. Formación y flujo de membranas. Poros. Nociones generales de permeabilidad. Permeabilidad de la membrana plasmática. Transporte activo y pasivo. Co-transporte. Sistema de Carriers. Aspectos dinámicos de la membrana celular: fagocitosis, pinocitosis, exocitosis. Asimetría de la membrana. Diferenciaciones de la membrana. Microvellosidades. Uniones estrechas y compartimientos tisulares. Espacio intercelular. Desmosomas: ultraestructura. Tonofilamentos. Unión nexo: ultraestructura. Conexón: esquema molecular. Acoplamiento eléctrico y metabólico. Cubierta celular: composición. Reconocimiento celular, su mecanismo. Fibronectina. Transducción de información a través de la membrana. EL CITOESQUELETO. Microtúbulos: composición, localización de la tubulina y demás componentes. Ultraestructura. Protofilamentos. Organización molecular del microtúbulo. Dímeros de tubulina y periodicidades. Polaridad de los microtúbulos, crecimiento, polimerización in vivo. Extremos protegidos y libres. Hipótesis de la inestabilidad dinámica. Rol de la transducción de la información en la forma celular y en la morfogénesis. Heterogeneidad de microtúbulos. Axonemas. Estructura de cilios y flagelos. Dobletes y subfibras A y B. Brazos de dineína. Aparato ciliar. Centros formadores de microtúbulos. Centríolos y cinetocoros, su rol. Crecimiento flagelar. Movimiento ciliar. Flagelos: modelos. Síndrome de cilia inmóvil. Replicación de los centríolos. El citoplasma fundamental: características. Microfilamentos. Actina. Localización y propiedades. Papel de la citocinesis, movimiento ameboide y ciclosis. Acción de las citocalasinas. Arquitectura microtrabecular. Visualización inmunocitoquímica. Rol de proteínas fijadoras de actina. Filamentos intermedios: ultraestructura. Relación con láminoproteinas. Propiedades y 72 BIOLOGÍA CELULAR localización de los filamentos de queratina, desmina, vimentina y cinemina. Cambios durante la división celular. SISTEMA DE ENDOMEMBRANAS. Retículo endoplásmico. Compartimentos celulares. Relación del retículo con ribosomas. Riboforinas. Retículo liso. Glucógeno particulado. Microsomas. Ultraestructura. Funciones del retículo endoplásmico. Biosíntesis de membrana. Proteínas de exportación. Teoría de la señal, partícula de reconocimiento de la señal. Tránsito y secreción de proteínas. Exocitosis y endocitosis. Vesículas recubiertas. Clatrina. Endosomas. Aparato de Golgi. Tinciones diferenciales. Ultraestructura: dictiosomas, sus caras. GERL. Citoquímica del Golgi. Glicosiltransferasa. Funciones del Golgi. Ciclo secretor. Modificaciones y procesamiento de proteínas secretadas. Lisosomas. Ultraestructura. Tipos y poblaciones lisosomales. Citoquímica del lisosoma. Ciclo lisosomal. Funciones. Autofagia y crinofagia. Tesaurismosis: enfermedades hereditarias con compromiso lisosomal. Fagocitosis. Pinocitosis. Micropinocitosis. Microcuerpos y peroxisomas. Ultraestructura, citoquímica, contenido y función. MITOCONDRIAS. Morfología in vivo y luego de la fijación. Número y variedad morfológica en tipos celulares. Ultraestructura. Cámara externa e interna. Matriz. Partículas F1. Diferencias entre membranas externa e interna. Compartimentalización de enzimas. Funciones mitocondriales. Nociones generales sobre respiración celular, cadena respiratoria y fosforilación oxidativa: su localización subcelular. Biogénesis de las mitocondrias. Hipótesis de la simbiosis. ADN mitocondrial: tamaño, forma y contenido codificante. Mitorribosomas. Código genético de la mitocondria. Interrelación entre el núcleo celular y las mitocondrias. EL NÚCLEO CELULAR. Envoltura nuclear. Diferenciación de superficie nuclear y citoplasmática. Lámina nuclear, proteínas que la integran, rol en el ciclo celular. Complejo de poro. Ultraestructura, componentes, intercambio núcleo-citoplasma, mecanismos de transporte. Cromatina y cromosomas, composición química. ADN nuclear: cantidad, tamaño, morfología. Valor C o haploide del contenido de ADN. Histonas. Proteínas no histónicas nucleares. Matriz nuclear y armazón cromosómica. Componentes y organización. Topoisomerasa II y ADN asociado al armazón. Lazos y dominios de ADN en el núcleo interfásico. Nucleosomas. Organización molecular. Ultraestructura del nucleosoma y la fibra de cromatina. Fibra unitaria de 10 nm. Fibra de 30 nm. Modelo del solenoide. Lazos de cromatina. Índice de compactación del ADN en la cromatina. El cromosoma, morfología y clasificación. Regiones diferenciadas: telómeros, centrómeros y constricciones secundarias. Cromátides: organización. Molécula de ADN cromosómica. Replicación del ADN cromosómico. Cromosomas “en arlequín” por reemplazo con nucleótidos bromados. Replicación del ADN nuclear: mecanismos. Fragmentos de Okasaki. Replicones: número y características. Síntesis de tipo reparativo: características e importancia en patología. Heterocromatinas facultativa y constitutiva. Diferencias. ADN satélite. Secuencias únicas y repetidas. Bandeado cromosómico. Corpúsculo de Barr: su presencia en tipos celulares. Metilación de las bases y su relación con la inactivación génica. DIVISIÓN CELULAR. Ciclo celular, etapas y sus valores promedio en diferentes tipos celulares. Determinación del tiempo promedio de generación celular por bloqueo mitótico y por autorradiografía. Características de las fases. Condensación prematura de los cromosomas inducida por fusión. Regulación del ciclo celular: chalonas y factores de crecimiento. Dinámica del ciclo celular. Poblaciones celulares estáticas, en expansión y en renovación. Mitosis. Descripción de las fases. Aparato mitótico. Cinetocoro, su relación con el centrómero. Estructura y citoquímica. Microtúbulos cinetocóricos y polares. Polaridad de los microtúbulos del huso mitótico. Ensamblamiento del microtúbulo. Movimientos cromosómicos. Movimiento anafásico. Modelos del movimiento: equilibrio dinámico. Citocinesis. Métodos de estudio del cariotipo. Cultivo de linfocitos sanguíneos. Métodos de bandeado cromosómico. Técnicas C, G y R. Bandas Q. Cariotipo humano normal. Meiosis. Descripción de sus etapas. Sinapsis y complejos sinaptonémicos. Visualización de los complejos microextendidos. Ultraestructura y función del complejo sinaptonémico. Cariotipado de complejos sinápticos. Quiasmas y recombinación génica. Mecanismos 73 BIOLOGÍA CELULAR moleculares de la recombinación. Modelo de Halliday. Nódulos de recombinación. Disyunción meiótica. Conducta de los cromosomas sexuales. Corpúsculo XY. Región pseudoautosomal humana. FUNCIONES DEL NÚCLEO CELULAR. Contenido informativo del ADN. Flujo de la información genética: dogma central. El código genético. Número de codones posibles en un código de tripletes; codones usados. Encuadre y punto de partida del mensaje. Codones de iniciación y de terminación. Mutaciones. Secuenciación del genomio humano. Endonucleasas de restricción. Fundamentos de la ingeniería genética. Transcripción génica. Características estructurales e histoquímicas de la cromatina durante la transcripción: descondensación y accesibilidad a nucleasas. Visualización de la transcripción con el ME. Polaridad de la transcripción. Tipos de ARN polimerasas: localización y función. ARN mensajero: estructura. Características de sus extremos. Intrones y exones en el ADN. Procesamiento del producto primario de transcripción. Empalme. Partículas de ribonucleoproteínas. Características y funciones. Visualización con ME de los intrones. Lazos R. Hibridización de ácidos nucleicos, sus aplicaciones. El nucléolo: número y localización. Organizadores nucleolares. Ultraestructura y citoquímica del nucléolo. Genes ribosomales. Biogénesis del ARN ribosómico. Ribosomas. Ultraestructura y composición. Subunidades. Organización molecular y funciones. ARN de transferencia. Estructura secundaria y terciaria. SÍNTESIS DE PROTEÍNAS. Elementos necesarios. Ribosomas: polirribosomas, ciclo ribosomal. Factores de iniciación, localización y funciones. Complejo de iniciación. Alargamiento de la cadena peptídica, factores de elongación. Papel de la subunidad mayor del ribosoma en la síntesis proteica. Terminación de la cadena, factores de liberación. Diferencias entre la síntesis proteica en pro y eucariontes. Diferencias entre las síntesis de proteínas nucleares, citosólicas, proteínas de membranas y proteínas de exportación. INTEGRACIÓN CELULAR, CONTROL GÉNICO Y DIFERENCIACIÓN CELULAR: Tipos especiales de organización cromosómica. Cromosomas plumulados: su organización en asas. Transcripción y replicación de los cromosomas plumulados. Cromosomas politénicos. Bandas e interbandas. Localización de genes. Puffs y sitios de hiperactividad transcripcional. Sistemas de regulación génica en procariontes. Operón lac. Regulación génica en eucariontes. Compactación de la cromatina. Metilación del ADN. Proteínas ligadoras de ADN. Diferenciación celular: interacciones entre núcleo y citoplasma. Transplante nuclear. Heterocariontes artificiales por fusión celular. Control transcripcional y postranscripcional del flujo de información génica. Modificaciones de la información génica. Amplificación génica. Transposones, retrovirus y retrovirus endógenos. Recombinación somática en células linfoides. Oncogenes vírales y celulares. Programación del desarrollo, genes homeóticos, homeocajas. BIBLIOGRAFÍA DE BIOLOGÍA CELULAR Textos básicos Cooper GM & Hausman RE. “La Célula”. 2014, 6ª Edición, Editorial Marbán Cooper´s. “La Célula de bolsillo”. 2007, Editorial Marbán. Alberts y col. “Introducción a la Biología Celular”. 2006, 2ª Edición, Editorial Panamericana. Textos de consulta Albers; Bray; Lewis, Raff y Watson. “Biología Molecular de la Célula”. Editorial Omega Lodish H y col. “Biología celular y molecular”. 2002, 4ª Edición, Editorial Panamericana. Becker y col. “El mundo de la Célula”. 2007, 6ª Edición, Editorial Pearson. 74 BIOLOGÍA CELULAR Paniagua y col. “Biología Celular”. 3ª Edición, Editorial Mc Graw Hill. Luque. “Biología Celular e Ingeniería Genética”. Edición 2001, Editorial Harcou.rt Lewin. “Genes VII”. Edición 2001, Editorial Marbán. 75 BIOLOGÍA CELULAR SEMINARIOS DE BIOLOGÍA CELULAR SBC INTRODUCTORIO - SEMINARIO WEB:ORGANIZACIÓN ESTRUCTURAL Y MOLECULAR DE LA CÉLULA. MÉTODOS DE ESTUDIO A. El plan de organización de la materia viva. a. Niveles de organización en biología. b. Teoría celular. c. Células procarionte y eucarionte: similitudes y diferencias. La Escherichia Coli como modelo de célula procarionte. d. Virus y plásmidos: sus componentes. B. Composición química de los seres vivos. a. Macromoléculas: proteínas, lípidos, hidratos de carbono, ácidos nucléicos (Generalidades, clasificación de cada grupo, elemento sillar de cada una, tipo de union entre los mismos, etc). b. Componentes inorgánicos de la célula. c. Acidos nucléicos: bases nitrogenadas, nucleósidos, nucleótidos, oligo y polinucléotidos. Ejemplos: ADN, ARNs, cofactores enzimáticos (NAD+, NADH2, FAD, FADH2, etc). d. Proteínas: aminoácidos y unión peptídica. i. Estructura primaria, secundaria, terciaria y cuaternaria de las proteínas. ii. Proteínas estructurales y enzimáticas. e. Hidratos de carbono: monosacáridos, disacáridos, oligo y polisacáridos. Glicoproteínas. f. Lípidos: triglicéridos, fosfolípidos y colesterol. Glicoproteínas C. Plan de organización básico de la célula eucarionte. a. Diversidad morfológica y de tamaño. b. Membrana plasmática. c. Núcleo. d. Compartimentalización intracelular. Organelas e inclusiones. e. La matriz citoplasmática (citosol). Composición química y principales funciones. Funciones celulares básicas. Relaciones entre la ultraestructura citoplasmática y nuclear, tinción y funciones celulares. Características generales de las mitocondrias. f. Mitocondrias: morfología tamaño, distribución, orientación y número en los distintos tipos celulares. Organización estructural de una mitocondria: membranas externa e interna, matríz y crestas mitocondriales: componentes y funciones. Aspectos funcionales: transporte de electrones, fosforilación oxidativa, Ciclo de Krebs, -oxidación de ácidos grasos. Biogénesis de las mitocondrias: organela semiautónoma, su posible origen procarita (ADN, ARNs, ribosomas mitocondriales). g. Peroxisomas. Estructura y características generales, Funciones. Origen y crecimiento. D. Microscopía óptica y electrónica. Poder resolutivo, límite de resolución, aberraciones. Tipos de microscopios ópticos y electrónicos. 76 BIOLOGÍA CELULAR SBC1 - SEMINARIO Nº1: MEMBRANA PLASMÁTICA A. Composición química y organización estructural de la membrana celular. a. Componentes químicos de las membranas: lípidos, proteínas, hidratos de carbono. b. Estructura: aspecto morfológico de las membranas. La unidad de membrana. c. Modelos moleculares de la membrana d. Las relaciones entre los componentes de la membrana y sus funciones. Fosfolípidos y colesterol. Proteínas: integrales o intrínsecas (de un solo paso, de dos o varios pasos, unidas a la bicapa lipídica simplemente por un ácido graso o por un oligosacárido unido a fosfatidilinositol). Extrínsecas o periféricas. Proteínas de transmembrana. Glicocalix: estructura y funciones. B. Permeabilidad relativa de la membrana plasmática. Transporte activo y pasivo. Cotransporte. Sistema de carriers. C. Aspectos dinámicos de la membrana celular: fagocitosis, pinocitosis, exocitosis. D. Fenómenos de interrelación celular: glicocalix y el reconocimiento celular, las funciones enzimáticas de la superficie celular. E. Las señales intercelulares a. Interacciones celulares mediante inductores intracelulares solubles (ligandos). Inducciones endocrina, paracrina, yuxtacrina y autocrina. b. Características de la unión ligando-receptor. Receptores citosólicos (hormonas esteroides, óxido nítrico) y de membrana (factores de crecimiento y hormonas peptídicas). c. Interacciones célula-célula y célula matriz extracelular. Familias de moléculas de adhesión que vinculan células entre sí (CAM) o con la matríz extracelular (SAM). Uniones homotípicas y heterotípicas, homofílicas y heterofílicas (selectinas, familia de IgG, integrinas, etc). Señales inducidas por dichas interacciones. F. La superficie celular y sus diferenciaciones. Concepto de diferenciación de membrana, aspecto al microscopio óptico, ultraestructura y funciones. SBC2 - SEMINARIO Nº2: CITOESQUELETO A. Características generales del citoesqueleto. a. Definición, componentes, organización. b. Funciones. B. Microtúbulos. a. Características generales (Polaridad, inestabilidad dinámica, etc). b. Organización molecular. Proteínas estructurales y asociadas. c. Aspectos funcionales Organelas microtubulares permanentes (cilios, flagelos, cuerpos basales y centríolos) y estructuras microtubulares transitorias (ásteres y huso mitótico). Participación en el transporte intracelular: Kinesina y Dineína 77 BIOLOGÍA CELULAR La viabilidad celular depende de la integridad del citoesqueleto. Drogas que afectan la polimerización de los microtúbulos: taxol, vinblastina, colchicina, etc., pueden actuar como citotóxicos y quimioterápicos antitumorales. C. Actina. d. Características generales. e. Organización molecular. Proteínas estructurales y asociadas. f. Aspectos funcionales Estructura celular y especializaciones Movilidad y desplazamiento celular. Estructura y funcionamiento básico de la actina en la contracción muscular D. Microfilamentos y Filamentos intermedios a. Definición, carcterísticas generales, clasificación. b. Organización molecular. Proteínas estructurales y de regulación. c. Funciones: Fenómenos de adhesión y migración celular. Interacciones celulares: citoesqueleto-matríz extracelular. Estructuras de superficie generadas por la contractilidad del citoesqueleto del cortex: lamelipodios, filipodios, blels, etc. Generación de contactos focales y la formación de fibras de stress. SBC3 - SEMINARIO Nº3: SISTEMA DE ENDOMEMBRANAS A. Sistema de endomembranas o sistema vacuolar: características y propiedades generales, delimitación de los compartimentos. Relaciones dinámicas entre ellos. a. La envoltura nuclear o carioteca. Membrana nuclear, poros, complejo del poro. Lámina nuclear: composición química y funciones. b. Retículo Endoplasmático: características estructurales generales, sus diferentes porsiones, propiedades citoquímicas y aspectos funcionales. RER: síntesis de proteínas de exportación y de membranas. Hipótesis del péptido señal. Inicio del proceso de glicosilación de proteínas. N-Glicosilaciones sobre la asparagina. REL: síntesis de glucógeno (glicosomas) y su degradación. Síntesis de lípidos.Procesos de detoxificación. c. Aparato de Golgi: estructura y compartimentalización. Funciones. B. Biogénesis de membranas. Reciclaje de membranas. C. Integración del sistema de endomembranas: la secreción celular. a. Secreción constitutiva y regulada. Conceptos. Formación de vesículas con cubierta. b. Métodos de estudio y distintas etapas del proceso de secreción celular en una célula tipo. Fraccionamiento celular y Radioautografía. D. Endosomas y Endocitosis mediada por receptor. a. Formación de vesículas con cubierta. b. Endosomas c. Dinámica morfofuncional de los endosomas temprano y tardío. d. Endolisosoma. Conversión del endosoma en lisosoma. A. Lisosomas. 78 BIOLOGÍA CELULAR a. Características estructurales y bioquímicas: enzimas hidrolíticas. b. Tipos de lisosomas. c. Ciclo de digestión lisosomal. d. Origen de los lisosomas. Receptor manosa-6-fosfato. e. Funciones lisosomales. f. Autofagia. Tipos de autofagia:Macroautofagia2: Microautofagia 3: autofagia mediada por chaperonas (CMAcma) g. Patologías de depósito: Tesaurismosis, producidas por falta o déficit de alguna enzima lisosomal. SBC4 - SEMINARIO Nº4: EL NÚCLEO INTERFÁSICO Y LOS ÁCIDOS NUCLÉICOS. CROMATINA Y ESTRUCTURA CROMOSÓMICA. EL NUCLÉOLO. A. Estructura y funciones generales del núcleo. a. La envoltura nuclear o carioteca. b. Matríz nuclear (hacer referencia a la clase de citoesqueleto: laminas A, B, C, nucleoesqueleto, etc). B. La cromatina. a. Composición química. Acidos nucléicos: bases nitrogenadas, nucleósido, nucleótido, unión fosfodiéster, polinucléotidos. ADN: composición química y características estructurales. Modelo de Watson y Crick. Citoquímica. ARN: composición química. Generalidades. Proteínas nucleares: histonas y no-histonas. b. Grados de empaquetamiento de la cromatina. c. Eucromatina y heterocromatina (constitutiva y facultativa): significado funcional. C. Los cromosomas a. Elementos básicos del cromosoma: cromátide, centrómero, telómero y orígenes de replicación. ADN centromérico y proteínas centroméricas. b. Los cromosomas humanos, su morfología. Cariotipo humano normal. E. El nucleolo. a. Composición química. Ultraestructura. Sectores granular y fibrilar. b. Funciones. F. Duplicación del ADN: características del proceso de duplicación del ADN. (semiconservadora, bidireccional, discontinua y asincrónica). Replicón. Estructura de la horquilla de replicación. Enzimas participantes. Fragmentos de Okazaki. Dinámica de los extremos cromosómicos. El reloj telomérico. Telomerasa, inmortalización y cáncer. G. Mecanismos de reparación del ADN. a. Mecanismos asociados a la replicación del ADN. La ADN Polimerasa y su capacidad de proof-reading Mecanismos de reparación de malapareamiento de bases inmediatamente postreplicación. Recombinación mitótica o meiótica. Acción de la -Polimerasa. 79 BIOLOGÍA CELULAR b. Sistemas de reparación del ADN no asociados a la replicación. Mecanismos de reparación en la desaminación y alquilación de bases. Reparación de los daños por radiación UV. Genes reparadores de miss-matches. H. Recombinación genética: homóloga y no homóloga. I. El ADN mitocondrial a. Duplicación de las mitocondrias. b. Flujo de información genética a partir del ADN mitocondrial. c. Características del ADN mitocondrial (ADNmt). Semejanzas y diferencias con el ADN nuclear de los eucariontes y el ADN procariota. Genes mitocondriales. d. Características de ARNm, ARN-t, ARNr. e. Ribosomas mitocondriales. Diferencias y semejanzas con los ribosomas eucariontes citoplasmáticos y los procarióticos. SBC5 - SEMINARIO Nº5: EL GENOMA HUMANO Y SU ESTRUCTURA. TRANSCRIPCIÓN Y PROCESAMIENTO DE LOS DISTINTOS TIPOS DE ARN PRECURSORES A. Estructura de ADN humano. Clasificación de las secuencias del ADN humano. a. Tipos de secuencia según el número de bases que integran el patrón de repetición (satélites, minisatélites, microsatélites). b. Tipos de secuencias según su función. ADN de funciones estructurales: ADN satélites y teloméricos. B. Contenido informativo del ADN. a. Dogma central de la biología molecular. Concepto de genoma. Concepto de gen. b. Estructura y organización del gen: intrón, exón, promotor, secuencias reguladoras (enhancer, etc). Diferencias entre genes eucariontes y procariontes. Duplicación de genes. C. Transcripción del ADN. a. Características generales del proceso de transcripción en eucariontes y en procariontes: descondensación cromatínica, sensibilidad a nucleasas, polaridad, etc. b. Tipos de ARN (mensajero, ribosomales, de transferencia y otros ARNs [ARN pequeños citoplasmáticos (ARNsc) y nucleares (ARNsn)]. c. ARN Polimerasas. Diferencias entre procariotas y eucariotas. D. Características de la transcripción de cada uno de los tipos de ARNs. E. Procesamiento de los ARNs. a. Propiedades generales del procesamiento: clivaje, emplame, modificaciones terminales y modificaciones de nucleósidos (metilaciones). b. Procesamiento del ARN mensajero: extremos 3' y 5'. Secuencias intercaladas, corte y empalme (splicing). Rol de los ARN pequeños citoplasmáticos y nucleares. Procesamiento alternativo del transcripto primario. c. Procesamiento del ARN ribosomal: organizador nucleolar, genes determinantes del ARNr, papel del nucléolo, ARNr 5S. 80 BIOLOGÍA CELULAR d. Procesamiento del ARN de transferencia: genes determinantes del ARNt. Precursores y formas maduras. Estructura secundaria. F. Código genético a. Definición y características (Universalidad y excepcionalidad de las mitocondrias) b. Concepto de codón y anticodón. c. Encuadre del mensaje. d. Mutaciones. Concepto. Clasificación y efecto sobre la síntesis de proteínas. G. La síntesis de proteínas o traducción. a. Elementos involucrados: ARN mensajero Ribosomas: Composición química. Los diferentes ARNr y las proteínas. Estructura y biosítesis. ARN de transferencia. Fidelidad en la síntesis proteica, los aminacil-ARNt. Enzimas participantes. b. Etapas de la síntesis proteica: iniciación, elongación y terminación. Factores proteicos participantes en cada una de ellas, enzimas y requerimiento energético. Mecanismos de regulación. Estabilidad y degradación del ARNm. c. Características del proceso de síntesis de proteínas intracelulares, de exportación y de membrana. d. Acción de antibióticos sobre distintas etapas de la síntesis de proteínas en células procariontes. H. Mecanismos de modificación (activación y finalización) de la acción biológica de las proteínas. a. Glicosilación, degradación parcial, fosforilación ec. b. Ubiquitinización. Proteasomas. Chaperonas. I. Síntesis de proteínas en las mitocondrias: Modelo del sistema de incorporación de proteínas sintetizadas en el citosol hacia la matríz mitocondrial. Acción de las proteínas chaperonas pertenecientes a la familia hsp70 mitocondriales. SBC6 - SEMINARIO Nº6: REGULACIÓN DE LA EXPRESIÓN GÉNICA EN EUCARIONTES Y PROCARIONTES A. Regulación en procariontes. a. Sistemas de inducción: operón Lac. b. Sistemas de represión: operón Trp. c. Papel del complejo CAP-cAMP. C. Regulación en eucariontes. a. Caracteristicas generales. Comparación con los organismos procariontes. Nuevos niveles (nucleosomas, compactación de la cromatina, fosforilación de histonas, metilación de bases, varias ARN-Polimerasas intervienen en la transcripción, presencia de envoltura nuclear, etc). b. Redundancia y amplificación del ADN. Secuencias únicas de ADN y secuencias repetitivas intercaladas y en tándem (satélites, minisatélites, microsatélites). Ordenes de complejidad en la organización estructural de la cromatina. 81 BIOLOGÍA CELULAR c. Regulación de la transcripción: promotor, estimulador o enhancer, factores reguladores de la transcripción. d. Regulación a nivel de la maduración o procesamiento del ARNm. Procesamiento alternativo por señales de poliadenilación y por variaciones en el splicing (no se acepta más el concepto un gen - una proteina). e. Regulación a nivel de la traducción: la fosforilación del IF2 detiene la iniciación de la síntesis protéica. Estabilidad y degradación del mensajero f. Regulación a nivel post-traduccional por modificación de las proteinas: fosforilación, ubiquitinación, acetilación, etc. g. Transposones y elementos transponibles. SBC7 - SEMINARIO Nº7: REGULACIÓN DEL CICLO CELULAR. LA DIVISIÓN CELULAR: MITOSIS Y MEIOSIS A. Ciclo celular: a. Períodos del ciclo celular y eventos moleculares más importantes b. Regulación del crecimiento: sistemas de péptidos y enzimas intracelulares (ciclinas, Cdk, inhibidores). Puntos de control (checkpoints). B. Mitosis: a. La mitosis en el ciclo celular. Descripción general de sus fases: eventos estructurales, bioquímicos y moleculares. El ciclo de los centrosomas. Las funciones básicas celulares durante la mitosis b. Aparato mitótico. Cinetocoro. Centrómero. c. Microtúbulos cinetocóricos y polares. d. Huso mitótico. Ensamblado y polaridad de los microtúbulos. e. Movimiento anafásico. Citocinesis. C. Meiosis: a. La meiosis y su relación con la reproducción sexual. La meiosis y la gametogénesis. Semejanzas y diferencias con la mitosis. Descripción general: Meiosis I y II. b. Fenómenos esenciales y consecuencias genéticas de la meiosis c. Complejos sinaptonémicos: sus componentes proteínicos. Rol de las cohesinas. Proteína REC8. Quiasmas. d. Par XY. Conducta durante la meiosis e. Recombinación genética durante la meiosis: mecanismos moleculares, Rad51. Nódulos de recombinación. f. Segregación de los cromosomas homólogos. Errores del proceso: No disyunción (concepto). 82 BIOLOGÍA CELULAR SBC8 – SEMINARIO Nº8: REGULACIÓN DEL CRECIMIENTO. TRANSDUCCIÓN DE SEÑALES. LA CÉLULA TUMORAL COMO MODELO DE INTEGRACIÓN EN BIOLOGÍA CELULAR A. Transducción de señales:Conceptos generales sobre los mecanismos de transducción de señales. Adenilatociclasa- AMPc. Guanilatociclasa - GMPc. Ciclo del fosfatidil-inositol (IP3-DAG-Ca2+). Calcio: rol de este catión en múltiples y trascendentales funciones celulares. B. Regulación del crecimiento a. Clasificación de las subpoblaciones celulares: estáticas, en expansión y en renovación b. Factores de crecimiento y receptores. c. Vías de transducción de la señal mitogénica. d. Concepto de muerte celular como factor de regulación C. Biología de la célula tumoral a. El cáncer como modelo de enfermedad molecular adquirida. Conceptos generales sobre qué es el cáncer y su etiología. Mutaciones somáticas y tumores. b. Concepto de protooncogen. Mecanismos de activación. Procesos celulares controlados por el producto de protooncogenes. Concepto de oncogen. c. Concepto de gen supresor de tumores. Mecanismos de activación. Gen de la proteína Rb. Gen de la proteína p53. Genes que regulan la sobrevida/apoptosis celular. Su participación en la etiología del cáncer. d. Fenotipo de la célula neoplásica. Aspectos estructurales, moleculares y funcionales. Progresión tumoral: Cascada metastásica. Invasión primaria y secundaria. Rol de las proteasas e inhibidores. Angiogénesis. TALLER DE BIOLOGÍA CELULAR 1 TALLER DE BIOLOGÍA CELULAR 2 TALLER DE BIOLOGÍA CELULAR 3 TALLER DE BIOLOGÍA CELULAR 4 83 GENÉTICA GENÉTICA MÉDICA PROGRAMA ANALÍTICO DE GENÉTICA MÉDICA ENFERMEDADES HEREDITARIAS. Enfermedades hereditarias y componentes hereditarios de enfermedades comunes. Genealogías. Nomenclatura. Dominancia, codominancia y pleiotropía. Epistasis. Consanguinidad: coeficientes. Efectos. Carga genética. Ley de Hardy-Weimberg. Determinación de frecuancias génicas. Aplicaciones del estudio de gemelos. Concordancia. Cuantificación de componente hereditario. DETERMINACIÓN SEXUAL. Determinación sexual. Mecanismos generales. Antígeno H-Y. Genes determinantes de la formación del testículo. Aspectos cromosómicos. Genes de feminización testicular y sus efectos. Ligamento y recombinación. Mapas genéticos. Genes ligados al sexo (al X). Ligamiento parcialal sexo y recombinación entre X e Y. Inactivación del cromosoma X: lyonización, compensación de dosis. Síndromes cromosómicos y genéticos de intersexualidad. HERENCIA POLIGÉNICA. Alelos múltiples. Grupos sanguineos. Sistema Rh. Herencia poligénica. Caracteres cuantitativos. Herencia poligénica y deficiencia mental. Dermatoglifos. Aplicaciones de su estudio. Genética de poblaciones humanas. Relevamiento genético. Amniocentesis y biopsia de vellosidad coriónica. GENÉTICA BIOQUÍMICA. Aberraciones genéticas del metabolismo. Mecanismos patogénicos de las enfermedades hereditarias. Galactosemia. Hemoglobinopatías: aspectos genéticos. Métodos de asignación de genes normales y anormales a cromosomas. Uso de los polimorfismos de longitud de los fragmentos de restricción. Asesoramiento genético y consejo genético. Terapia experimental del gen anormal. CITOGENÉTICA MÉDICA. Citogenética médica. Cariotipado: métodos. Variaciones cromosómicas numéricas: poliploidía, aneupolidía. Trisomías y monosomías en la especie humana. Inversiones cromosómicas; sus efectos meióticos. Translocaciones recíprocas en el hombre. Comportamiento meiótico. Cromosoma Philadelphia. Aspectos citogenéticos y moleculares del síndrome de Down. No-disyunción: posibles mecanismos. Polimorfismos de heterocromatina. Anomalías cromosómicas en células tumorales. Intercambio de cromátidas hermanas. Sitios frágiles. Infertilidad de causa genética. Análisis de células meióticas. Cariotipo de espermatozoides: uso de ovocitos denudados. BIBLIOGRAFÍA DE GENÉTICA MÉDICA Textos básicos Jorde, Carey, Bamshad. “Genética médica”. 2011, 4ª. Edicion, Editorial Elsevier. Solari. “Genética médica. Fundamentos y aplicaciones en medicina”. 2011, 4ª Edicion, Editorial Panamericana. Emery´s. “Genética médica”. 2001, 10ª Edicion, Editorial Marbán. Thompson & Thompson. “Genética en medicina”. 2004,5ª Edicion, Editorial Mason. 84 GENÉTICA SEMINARIOS DE GENETICA MÉDICA SG1 - SEMINARIO Nº1: GENOMA HUMANO Tamaño y organización del genoma humano. Genoma nuclear y mitocondrial. Comparación del genoma humano con el de otras especies. ADN codificante y no codificante. Tipos de secuencias de ADN: repetitivas, de secuencia única. Concepto de gen: estructura y función. Técnicas de estudio del ADN, enzimas de restricción, electroforesis de ácidos nucleicos. SG2 - SEMINARIO Nº2: MUTACIONES Mutación: definición y clasificación. Mecanismos mutacionales y el papel de las mutaciones en la evolución. Agentes mutagénicos. SG3 - SEMINARIO Nº3: TÉCNICAS DE ESTUDIO Estudios moleculares para la detección de mutaciones: Southern Blot: Fundamentos de la técnica. Ejemplo de aplicación: Análisis de polimorfismos de ADN para pruebas de paternidad e identificación forense. PCR: Fundamentos de la técnica. Ejemplos de aplicación: PCR alelo específica. Secuenciación: Fundamentos de la técnica. Aplicaciones. Metodologia Indirecta (método de ligamiento). SG4 - SEMINARIO Nº 4: PATRONES DE HERENCIA CLASICA I Conceptos de genotipo y fenotipo. Clasificación de Los defectos genéticos: monogénicos, cromosómicos, multifactoriales y ambientales. El árbol genealógico: símbolos y utilidad. Conceptos de casos familiares y esporádicos. Heterogeneidad genética y fenocopias La herencia monogénica o mendeliana. Conceptos de dominancia y recesividad. Patrones de herencia clásicos: autosómico dominante, autosómico recesivo: caracteres. Concepto de locus y alelo. Aspectos de la expresión fenotípica: penetrancia y expresividad Patrones de herencia autosómico dominante: ejemplos de enfermedades y mecanismo molecular involucrado (Acondroplasia, Hipercolesterolemia familiar, Neurofibromatosis). Nociones de diagnóstico molecular. SG5 - SEMINARIO Nº 5: PATRONES DE HERENCIA CLASICA II 85 GENÉTICA Patrones de herencia autosómico recesivo: Consanguinidad y endogamia. Ejemplos (fenilcetonuria, albinismo, fibrosis quistica). Pesquisa neonatal de enfermedades metabólicas. Patrones de herencia ligada al X recesivo y ligado al X dominante: características. Inactivación del X y lyonización. Ejemplos de enfermedades y mecanismo molecular involucrado (Distrofia muscular de Duchenne, hemofilia A, daltonismo, incontinencia pigmenti, raquitismo hiposfosfatemico, Síndrome de Rett). Patrones de herencia ligada al Y. Nociones de diagnostico molecular. SG6 - SEMINARIO Nº6: CROMOSOMOPATÍAS I Concepto de euploidía y aneuploidía. El estudio cromosómico: utilidad y técnicas. Clasificación de las anomalías cromosómicas: numéricas y estructurales. Anomalías cromosómicas numéricas: trisomías, monosomías y poliploidías. La no-disyunción meiótica y mitótica Los mosaicismos cigóticos y el rescate de las triso-mías. Las trisomías más frecuentes en nacidos vivos: trisomía 21 (síndrome de Down), trisomía 18 (sindrome de Edwards) y trisomía 13 (síndrome de Patau). Anomalías numéricas de los cromosomas sexuales: monosomía del X (síndromes de Turner) y trisomía XXY (síndrome de Klinefelter). Mujer XXX y varón XYY. Anomalías de línea pura y mosaicismos. SG7 - SEMINARIO Nº 7: CROMOSOMOPATÍAS II Las anomalías cromosómicas estructurales: tipos, mecanismos y consecuencias. Rearreglos cromosómicos balanceados y desbalanceados: consecuencias en el fenotipo y la herencia. Translocaciones recíprocas y robertsonianas (Síndrome de Down por translocación). Deleciones: 4 p- (síndrome de Wolf-Hirschorn) y 5 p- (síndrome de Cri du chat). Inversiones y duplicaciones. Cromosomas marcadores. Síndromes de genes contiguos y por microdeleción. FISH: utilidad y técnica. SG8 - SEMINARIO Nº 8: PATRONES DE HERENCIA III Mutaciones dinámicas: amplificación génica. Fenómeno de la anticipación. Concepto de alelos premutados y con mutación completa. Ejemplos de enfermedades y mecanismo molecular involucrado (Enfermedad de Huntington, Fragilidad del X). Impronta genómica. Disomía uniparental. Ejemplos: Síndromes de Prader-Willi y Angelman. Enfermedades mitocondriales: Mecanismos de producción. Ejemplos: Neuropatía óptica del Leber (LHON), síndrome de Kearn-Sayre. Concepto de heteroplasmia. 86 GENÉTICA SG9 - SEMINARIO Nº9: HERENCIA MULTIFACTORIAL. Características de la herencia multifactorial. Poligenia en rasgos de valores continuos. La regresión a la media. Hipótesis del umbral. Genética de los desórdenes comunes del adulto: diabetes, hipertensión, enfermedad coronaria, malformaciones congénitas. Los riesgos de recurrencia en las enfermedades de herencia multifactorial. Nociones de asesoramiento genético. Marco ético. SG10 - SEMINARIO Nº 10: TALLER DE GENÉTICA I a. Armado y construcción de genealogías. b. Resolución de “casos problema”. TALLER DE GENÉTICA III: a. Aplicación de las técnicas de biología molecular en la genética médica. SG11 - SEMINARIO Nº11: TALLER DE GENÉTICA II a. Interpretación de casos problema sobre distintos patrones de herencia. b. Interpretación de cariotipos y nomenclatura. TALLER DE GENÉTICA IV: a. Interpretación de casos problemas de enfermedades prevalentes con compromiso genético. SG12 - SEMINARIO Nº2: REPASO 87 EMBRIOLOGÍA EMBRIOLOGÍA BIBLIOGRAFÍA DE EMBRIOLOGÍA Respecto a la bibliografía, ésta representa un desafío ya que no hay un texto que abarque toda la materia ni en calidad ni en extensión. Se sugiere que el alumno se respalde en alguno (ver textos básicos) y complemente con otros. Un detalle de la bibliografía por Tema puede ser consultada en la página web de embriología: Textos básicos Larsen. “Human Embryology”. 2009, 4ª Edición, Elsevier-Churchill Livingston. Carlson. “Embriología humana y Biología del desarrollo”. 4ª Edición, Elsevier Moore. "Embriología Clínica". 7ª Edición, Editorial Elsevier. Textos de expansión del conocimiento Gilbert. “Biología del desarrollo”. 2005, 7ª Edicion, Editorial Médica Panamericana o en internet: http://www.ncbi.nlm.nih.gov/bookshelf/br.fcgi?book=dbio (gratis, on line). Wolpert. “Principios del Desarrollo”. 3ª Edición, Panamericana, Hamilton, Boyd y Mossman. “Embriología Humana”. Ver PDF en la página web de embriología También el alumno encontrará material básico y expansión del conocimiento en la página web de embriología: http://www.fmed.uba.ar/depto/histo1a/ 88 EMBRIOLOGÍA PROGRAMA DE EMBRIOLOGÍA Primer Parcial Fecundación. Morfología de las gametas masculina y femenina. Transportre de gametas. Proceso de capacitación del espermatozoide: mecanismos y etapas. Concepto de reacción acrosómica. Interacciones entre gametas y reconocimiento entre espermatozoide y ovocito. Interacción del espermatozoide con las envoluras del ovocito. Penetración de la membrana pellúcida y proceso de fusión de gametas Concepto de activación del ovocito. Principales eventos durante la activación del ovocito: bloqueo de la poliespermia, reactivación de la meiosis, incremento del metabolismo. Aportes de cada gameta –masculina y femenina- al desarrollo del cigoto. Segmentación o clivaje de la célula huevo –cigoto- y etapas preimplantatorias Características de los ciclos proliferativos durante la primera semana de desarrollo. Rol de las moléculas de adhesión celular en el desarrollo de un organismo pluricelular? Origen de las moléculas de adhesividad celular y de uniones intercelulares. Polaridad de las blastómeras. Concepto de determinación y diferenciación celular: procesos que llevan a la primera determinación. Experimento de W. Roux y H. Driesch. Conclusiones que se pueden obtener de estos experimentos. Concepto de control materno de la segmentación. Concepto de “huevo de regulación”. Concepto de “no equivalencia” de los núcleos de las gametas. Compactación de las blastómeras y procesos de cavitación de la mórula. Conceptos de totipotencialidad y pluripotencialidad. Concepto de decidua y ventana de implantación. Etapas de la implantación explicando sus características principales. Reconocimiento materno de la gestación. Evolución del embrión desde estado de blastocisto hasta el estado de néurula. Descripción a nivel de microscopía óptica y electrónica de embriones de etapa gastrular -2da y 3er semana de la gestación-. Formación de la línea primitiva y el nódulo. Movilización de células durante la formación de la línea primitiva y luego del ingreso en ella. Análisis del experimento de Spemann-Mangold Conclusiones que se pueden obtener del mismo. Derivados celulares del nódulo. Funciones del nódulo y de sus estructuras derivadas en el embrión. Dinámica de la formación y evolución de la línea primitiva. Polaridad embrionaria. Concepto de información posicional y simetría bilateral visceral. Concepto de “mapas de destino”. Desarrollo ontogénico del mesodermo. Determinación y difereciación de la placa neural. Adquisición del plan anatómico de los cordados Adquisición de la forma cilíndrica: pasaje del estado de embrión plano al de cilíndrico. Concepto de celoma. Concepto de metamerización. Descripción de la anatomía y microanatomía -interna y externa- de embriones humanos del período somítico: embrión de 14 pares de somitas –Heuser-, embrión de 28 y 35 pares de somitas. Circulación sanguínea en embriones de período somítico. Modificaciones anatómicas del sistema nervioso durante el período somítico. Evolución del mesodermo paraxial. Formación y evolución de placodas y crestas neurales. Regionalización del endodermo y del mesénquima anexo -tubo digestivo primitivo-: criterios que avalan esta regionalización. Período somítico Organización metamérica de crestas neurales y sistema nervioso. Identidad cráneo-caudal de las estructuras embrionarias: expresión de los genes HOX y adquisición de la identidad de segmento. Concepto de esbozo de un órgano. Relación entre el epitelio y el mesénquima durante la formación de un esbozo. Concepto de campo morfogenético: descripción del esbozo de miembro como modelo de campo morfogenético. Análisis de los experimentos de duplicaciones de estructuras distales del esbozo de miembro. 89 EMBRIOLOGÍA Formación de la placenta. Concepto de invasión trofoblástica secundaria. Análisis de la estructura definitiva de la placenta. Concepto de “barrera” placentaria o membrana vásculo sincicial. Funciones placentarias: endócrinas, nutricionales, excretoras, metabólicas e inmunológicas. Cambios estructurales y funcionales en la placenta conforme avanza la gestación. Principales alteraciones que pueden observarse en la morfología de la placenta. SEMINARIOS DE EMBRIOLOGÍA Primer Parcial Fecundación. SEMINARIO 1 Gametas masculina y femenina: gametogénesis y morfología. capacitación del espermatozoide: mecanismos y etapas. Transporte de gametas. Proceso de Segmentación o clivaje de la célula huevo –cigoto- y etapas preimplantatorias SEMINARIO 2 Aportes de cada gameta –masculina y femenina- al desarrollo del cigoto. Concepto de “no equivalencia” de los núcleos de las gametas. Características de los ciclos proliferativos durante la primera semana de desarrollo. Rol de las moléculas de adhesión celular en el desarrollo de un organismo pluricelular. Moléculas de adhesividad celular y de uniones intercelulares de origen materno y de origen cigótico. Evolución del embrión desde estado de blastocisto hasta el estado de néurula. SEMINARIO 3 Evolución del epiblasto: formación de la línea primitiva y el nódulo. Concepto de organizador y línea primitiva. Movilización de células durante la formación de la línea primitiva y luego del ingreso en ella. Desplazamientos celulares en el epiblasto, ingreso en el blastocele y migración. Adquisición del plan anatómico de los cordados SEMINARIO 4 Determinación y diferenciación de la placa neural. Formación y evolución de placodas. Formación y evolución de las crestas neurales. Morfógenos y generación de bordes en el ectodermo para la formación de la placa neural, crestas y placodas. Período somítico SEMINARIO 5 Concepto de esbozo de un órgano. Relación entre el epitelio y el mesénquima durante la formación de un esbozo. Concepto de campo morfogenético: descripción del esbozo de miembro como modelo de campo morfogenético. Formación de la placenta. SEMINARIO 6 Reconocimiento materno de la gestación. Funciones placentarias: endócrinas, nutricionales, excretoras, metabólicas e inmunológicas. Unidad feto materna placentaria. 90 EMBRIOLOGÍA TEXTOS COMPLEMENTARIOS DE EMBRIOLOGÍA Sobre capacitación (TPE1) Existen en la naturaleza diversas formas de fertilización. Se denomina fecundación externa a aquella en la cual las gametas son emitidas al medio ambiente. En este caso, las gametas poseen capacidad fecundante desde el momento mismo de ser liberadas. En el caso de los mamíferos, entre los cuales se incluye el hombre, la fertilización es "interna". El concepto de fertilización interna alude a que las gametas masculinas son depositadas, a través de un proceso denominado eyaculación, en la porción inicial del tracto genital femenino. El encuentro entre las gametas de ambos sexos, que ocurre luego del ascenso de los espermatozoides, se produce en la región ístmico-ampular de las trompas de Falopio. Por lo tanto, tiene lugar en cavidades especializadas del tracto genital femenino. En los mamíferos, las gametas masculinas recién eyaculadas poseen escasa capacidad fecundante. Sin embargo, ésta aumenta luego de transcurrido un período dentro del tracto genital femenino. Este cambio en la capacidad fecundante de los espermatozoides se denomina capacitación. Genéricamente, el término alude a la serie de procesos que sufren los espermatozoides durante su permanencia en el tracto genital femenino, y que tienen como resultado un incremento neto en su capacidad fecundante. Los espermatozoides recién eyaculados conforman una población altamente heterogénea desde diversos puntos de vista. Ella se manifiesta tanto a nivel morfológico como funcional. Como ejemplo, se estima que sólo alrededor del 10% de las gametas dentro de un eyaculado típico llega a capacitarse. A medida que los espermatozoides atraviesan el oviducto, sin embargo, la homogeneidad aumenta mediante la pérdida desproporcionadamente alta de células anormales. Por lo tanto, podría decirse que la capacitación es acompañada, en la práctica, por un proceso de selección. La capacitación es un fenómeno complejo, que implica modificaciones bioquímicas y funcionales en varios compartimientos del espermatozoide. A nivel de la membrana plasmática se puede observar una caída en la concentración de colesterol, así como cambios en el repertorio de proteínas de membrana expuestas al medio. Asimismo, hay un incremento neto en la exposición de cargas negativas en la membrana plasmática del espermatozoide. Se produce un aumento en la concentración intracitoplasmática de calcio iónico, del pH y de la actividad ATPasa. Esto lleva a una modificación global en el espermatozoide que conduce a la reacción acrosómica. Las modificaciones bioquímicas y funcionales también permiten los cambios en el patrón de motilidad –hiperactivación-. Los eventos incluidos en la capacitación ocurren de forma gradual a medida que el espermatozoide entra en contacto con los distintos microambientes que constituyen el tracto genital femenino. Concepto de totipotencialidad La Real Academia Española explica: Célula Totipotente f. Biol. Célula embrionaria con capacidad para generar un organismo completo. Potente: (adj.) Que tiene poder, eficacia o virtud para algo. Toti (del Latín): Todo. El año 1952, Seidel destruyó una célula de un embrión de conejo de dos células, y la célula (blastómera) remanente produjo un embrión entero. Existen otros registros de los años 50 que intentan explicar el fenómeno de la totipotencialidad, y hasta el día de hoy parecen estar en el centro de interés de muchos investigadores, la medicina regenerativa y la ética médica. Existen varias acepciones del término totipotente en Biología del desarrollo. De ellos mencionaremos dos. Una de esas acepciones está ejemplificada por las propiedades de la célula huevo o algunas 91 EMBRIOLOGÍA blastómeras muy tempranas que poseen: a) la capacidad de originar todos los tipos celulares, terminalmente diferenciados o no, que integran un organismo completo y, además y b) poseen “patrón” o capacidad para generar el sistema de referencia temporo-espacial que permiten la operación integrada de los comportamientos celulares involucrados en el desarrollo normal. Otra acepción del término puede ser ejemplificada por algunas blastómeras tempranas que sólo poseen la propiedad a) del párrafo precedente pero carecen de la propiedad b), vale decir, la capacidad de instalar el (los) sistemas (s) de referencia necesarios para el desarrollo de un organismo completo. Finalmente, con gradaciones diversas, se aplican los términos toti o pluripotencia para aludir a una variedad de células madres, presentes durante el desarrollo embrionario, o en el estado de diferenciación terminal, que poseen grados diferentes de restricción de linaje (se hallan diferentemente indeterminadas), en consecuencia pueden, si son introducidas en un sistema en desarrollo, integrarse al mismo y originar una amplia gama de tipos celulares y tejidos derivados, pero tampoco pueden dirigir el desarrollo de tales sistemas. Ejemplo claro de un tipo celular que muestra esta capacidad: la blastomera. En humanos, las blastomeras son el resultado de las primeras dos o tres divisiones o segmentaciones de la célula huevo y al parecer mantendrían esa potencialidad hasta el estadio de 4-8 blastomeras (estado de mórula) para perderse a medida que avanza el desarrollo. La primera determinación La primera determinación refiere a la sucesión de eventos que llevan a la aparición de 2 tipos celulares diferentemente determinados, vale decir, con diferente potencia evolutiva. Esta primera determinación, seguida de la diferenciación celular, ocurre durante las primeras mitosis. Vale decir, durante la primera fase de la segmentación de la célula huevo. Mientras el embrión viaja desde el tercio distal de la trompa hacia la cavidad uterina, sufre una serie de cambios y transformaciones que culminan con la formación del blastocisto y la diferenciación de 2 poblaciones celulares. Entre los procesos que llevan a esa primera determinación, se describe la polarización de las células de la mórula. La polarización comienza con la expresión, e inserción en la membrana, de diversas moléculas de adhesividad celular–inicialmente de origen materno-. Posteriormente se ensamblan las uniones estrechas y adherens en la mebrana plasmática de las células periféricas de la mórula –futuro trofoblasto- y uniones GAP en las células más profundas –futuro MCI-. La expresión y localización laterobasal de la bomba Na/K ATPasa moviliza iones y agua hacia el interior de la mórula, forma la cavidad del blastocisto y desplaza al Macizo celular interno hacia uno de los polos del blastocisto-. De esa forma el blastocisto queda compuesto por dos poblaciones celulares diferentes: el trofoblasto o macizo celular externo y el macizo celular interno (MCI) o embrioblasto. Mientras el MCI formará todos los tejidos embrionarios y algunos extraembrionarios, el MCE formará tejidos extraembrionarios únicamente. Determinación - diferenciación y células troncales pluripotenciales Mientras transcurre el desarrollo, las células que componen al embrión sufren modificaciones estructurales y funcionales. De esta forma surge una gama de tipos celulares especializados, distintos entre sí en morfología y comportamiento. Este proceso de cambio fenotípico, que en las condiciones normales de desarrollo es irreversible, recibe el nombre de "diferenciación celular". La diferenciación celular es un proceso gradual y de una duración que varía dependiendo del tipo celular que se considere; puede abarcar más de un ciclo de división celular. La diferenciación está precedida de cambios de desarrollo que ocurren en el nivel molecular, vinculados a reprogramaciones de la información genética, que modifican el estado evolutivo pero que, en general, no poseen manifestaciones estructurales. 92 EMBRIOLOGÍA Para una población celular embrionaria dada, entre los estados a) indiferenciado y b) diferenciado, algunos autores proponen una secuencia de eventos de reprogramación genética en la que, 1) primero las células adquieren una cierto grado de especificidad (Especificación] pero retienen plasticidad y a continuación 2) un proceso de pérdida de plasticidad que lleva a que la especificidad adquirida en el estado previo quede fija o irreversible (Determinación o compromiso). La manera paradigmática de poner en evidencia el grado de determinación o compromiso de una población celular dada -de la cual se sabe que normalmente debería diferenciarse en un cierto sentido--, consiste en trasplantarla a otro sitio del propio embrión. En caso de que la población celular trasplantada se diferencie normalmente –de acuerdo a su posición original-, aún en el entorno atípico, se concluye que la misma se hallaba ya determinada en el momento de realizarse el trasplante. Otro resultado posible es que las células trasplantadas adquieran un modo de evolución acorde con el sitio al que fueron trasplantadas. En este segundo caso se puede afirmar que estaban indeterminadas al momento del trasplante. Sin embargo, experimentalmente puede demostrarse que estas células pueden encontrarse en uno de al menos dos estados diferentes: especificadas o no especificadas. Si las células en cuestión son llevadas a un medio “neutro” (libre de señales con sentido biológico de desarrollo) y en dicho medio evolucionan de acuerdo a su sitio de origen, se admite que las mismas se hallaban especificadas al momento del trasplante. Vale decir, habían recibido señales en su sitio de origen que condicionaron su desarrollo en el medio neutro. Por el contrario, en el caso de que las células trasplantadas al medio “neutro” no desarrollen características dependientes de su sitio de origen se concluye que las mismas no habían adquirido especificidad de lugar al momento de ser trasplantadas. Así, de acuerdo a las definiciones planteadas por algunos autores, las células pasarían a través de tres estados de especificidad creciente: a) un estado inicial carente de propiedades específicas de lugar, b) la adquisición de la especificidad de lugar pero reteniendo plasticidad y c) una etapa final en la que la especificidad se fija o determina. La noción de “especificidad de lugar” aquí utilizada está referida a los procesos de selección de vías evolutivas, que llevan a la formación de diferentes tipos de tejidos y órganos, se hallan espacialmente organizados. Otro factor importante es el tiempo de desarrollo, pues tanto las capacidades de “señalizar” (inducir) como la capacidad de responder a ellas (competencia) son dependientes de la historia previa de las células, -tiempo de desarrolloEs necesario aclarar que, al menos en este contexto, los términos “irreversibilidad” o “unidireccionalidad” son utilizados en referencia a los procesos de determinación que acontecen a lo largo del desarrollo embrionario normal. Un proceso biológico ordinariamente irreversible puede dejar de serlo en condiciones patológicas, o bajo manipulaciones experimentales. Fue recientemente descubierto que es posible transformar (ciertas) células terminalmente diferenciadas en células troncales pluripotentes, mediante la transducción artificialmente inducida de tan sólo cuatro factores de transcripción (Oct4, Sox2, Klf4 y c-Myc). Estas células comparten algunas propiedades de las células troncales embrionarias y difieren de ellas en muchos aspectos. Plan anatómico de los cordados Con el comienzo del estudio sistemático de la morfología de los seres vivientes pudo apreciarse que las especies se pueden clasificar según aspectos esenciales de su anatomía; tales como el patrón de simetría o la disposición de hojas germinativas. La suma de estas características anatómicas se denominó “plan corporal básico”. Las entidades taxonómicas agrupadas según similar configuración anatómica recibe el nombre de “filums”. Las similitudes observables dentro de cada filum no son casuales. Por el contrario, consisten en el reflejo de la ascendencia común de los distintos organismos que los integran. Las similitudes entre especies pertenecientes a cada filum no se atenúan sino que, por el contrario, tienden a volverse aún más marcadas durante la vida prenatal. Asimismo, es posible describir una etapa en la ontogenia en la cual la similitud estructural es máxima entre embriones de un mismo filum. Esa 93 EMBRIOLOGÍA etapa o estadio filo y ontogenéticamente común se denomina “estado filotípico”. Para el caso de los mamíferos, nosotros pertenecemos al filum de los cordados, junto con otros órdenes tales como las aves y los anfibios. Nuestro estado filotípico corresponde al estadio de desarrollo conocido como “faríngula”, que en el Homo sapiens es alcanzado luego de alrededor de la 4ta semana de gestación. Las características principales de este estadio son: Ejes de polaridad cefalocaudal y dorsoventral claramente definidos, dispuestos de forma ortogonal. Resultan en un cuerpo provisto de simetría bilateral. Tres hojas germinativas (endodermo, mesodermo y ectodermo), dispuestas en forma concéntrica. Mesodermo troncal disecado en hojas parietal y visceral por una cavidad excavada dentro del mismo (celoma). Un tubo digestivo extendido cefalocaudalmente, con orificios independientes de entrada y salida. Sistema nervioso centralizado, constituido por un tubo neural en posición dorsal y provista de grados variables de cefalización. Un elemento estructural macizo, conocido como notocorda, ventral y paralelo al neuroeje. Tejidos adyacente al tubo digestivo proximal (faringe) provista de especializaciones seriadas conocidas como arcos branquiales. Eje corporal extendido más allá del final del tubo digestivo, conformando una cola post-anal. Organización segmentaria a nivel de mesodermo paraaxil, faringe, y al menos parte delsistema nervioso. Con sutiles excepciones, dependientes de cada especie en particular, puede afirmarse que todos estos rasgos quedan establecidos durante la gastrulación y luego de esta. PREGUNTAS PARA AUTOEVALUACIÓN Todos los alumnos deben estar en condiciones de discutir los temas acá propuestos en los exámenes del Primer Parcial y en el examen final. TEMAS CORRESPONDIENTES AL TRABAJO PRÁCTICO Y SEMINARIO 1 Describir cómo interactúan las gametas durante el proceso de fecundación Describir la morfología de las gametas masculina y femenina. ¿Cuáles son los recorridos de las gametas masculina y femenina hasta encontrarse en las trompas? ¿En qué consiste el proceso de capacitación del espermatozoide? ¿En qué consiste la reacción acrosómica? ¿Qué es el folículo ovárico? ¿Por qué es considerado una unidad funcional? ¿Concepto de reconocimiento entre espermatozoide y ovocito? ¿Cómo se produce la penetración de la membrana pelúcida? ¿Cómo es el proceso de fusión de gametas? ¿En qué consiste la activación del ovocito? ¿En qué consiste la reacción cortical? ¿Cuáles son los aportes del espermatozoide al cigoto? TEMAS CORRESPONDIENTES AL TRABAJO PRÁCTICO Y SEMINARIO 2 Describir los cambios de morfología del embrión de 2 células hasta el blastocisto preimplantatorio. ¿Cuáles son las características de los ciclos proliferativos durante la primera semana de desarrollo? 94 EMBRIOLOGÍA ¿Cuál es el papel de las moléculas de adhesión celular en el desarrollo de un organismo pluricelular? ¿Cuál es su origen? ¿Cómo se define la polaridad de las blastómeras? ¿Cómo se produce la primera determinación? (Nota: se asume que se poseen los conceptos de determinación y diferenciación) Describa en el experimento de Roux y Driesch. ¿Cuáles son las conclusiones que se pueden obtener de los mismos? WILHELM ROUX Tomando huevos de rana que acababan de dividirse por primera vez, realizo una serie de experimentos en los cuales destruía una de las dos células y observaba el desarrollo de otra. Resultados: Encontró que siempre obtenía sólo medio embrión: unas veces la mitad delantera, otras la posterior o una de las mitades longitudinales. HANS DRIESCH Driesch en lugar de destruir una de las dos células hijas, las separo parcialmente. Resultado: Observó que cada blastómera desarrollaba un embrión completo. Explique el proceso de primera determinación del embrión de mamífero” - o algo similar. ¿A qué alude el término “control materno de la segmentación?” ¿A qué alude el concepto de “huevo de regulación”? ¿A qué alude el concepto de “no equivalencia” de los núcleos de las gametas? ¿En qué consiste la compactación de las blastómeras? ¿En qué consiste la cavitación de la mórula? Defina los conceptos de totipotencialidad y pluripotencialidad. Describir las etapas y los mecanismos mediante los cuales el blastocisto es incorporado a la decidua Concepto de decidua ¿En qué consiste la reacción decidual? ¿Qué es la ventana de implantación? Identificar cada una de las etapas de la implantación explicando sus características principales ¿En qué consiste el reconocimiento materno de la gestación? TEMAS CORRESPONDIENTES AL TRABAJO PRÁCTICO Y SEMINARIO 3 Descripción del embrión desde blastocisto hasta néurula Describir en cortes de MO y ME embriones gastrulares ¿Cómo se forman la línea primitiva y el nódulo? ¿De qué manera se movilizan las células durante la formación de la línea primitiva y luego de ingresar por ella? Describa en el experimento de Spemann-Mangold ¿Cuáles son las conclusiones que se pueden obtener del mismo? Se secciona el labio dorsal del blastópor de un embrión y se transfiere al blastocele de otro embrión mediante una micropipeta. Resultado: Luego de algunas horas, se observa la formación de un doble embrión. ¿Cuáles son los derivados celulares del nódulo? ¿Qué funciones cumplen? Describa la dinámica de la LP (elongación/regresión) ¿Qué entiende por polaridad embrionaria? ¿Cuál es el concepto de información posicional? ¿Cómo se quiebra la simetría bilateral visceral? ¿Qué entiende por “mapas de destino”? ¿Cómo es el desarrollo ontogénico del mesodermo? ¿Qué entiende por “inducción neural”? 95 EMBRIOLOGÍA TEMAS CORRESPONDIENTES AL TRABAJO PRÁCTICO Y SEMINARIO 4 y 5 Adquisición del plan anatómico de los cordados ¿Qué entiende por plegamiento embrionario? ¿Qué entiende por celoma? ¿Qué entiende por metamerización? ¿Qué entiende por placodas? ¿Cuál es la anatomía y cuáles las modificaciones anatómicas del sistema nervioso durante el período somítico? ¿Cómo puede ser regionalizado el endodermo? ¿Qué criterios usaría? Mencione y señale en maquetas y láminas los principales derivados del ectodermo, mesodermo y endodermo. ¿Cómo se regionaliza el mesodermo embrionario? ¿Cómo se inicia el desarrollo de las crestas neurales? ¿Cómo evolucionan? ¿Qué entiende por organización metamérica de las crestas neurales? ¿Cómo adquieren la identidad cráneo-caudal? ¿Cómo es la circulación del embrión de cuarta semana? ¿Cómo evoluciona el mesodermo paraxial? ¿Cómo adquieren su identidad cráneo-caudal? Describir la anatomía interna y externa de los embriones de 25, 28 y 35 días de desarrollo. ¿Cuáles son los mesénquimas en donde se forman los vasos que conforman la circulación básica del periodo somítico? ¿Cómo se relacionan los productos de los genes HOX con la adquisición de la identidad de segmento? (Tubo neural, cresta neural, mesodermo paraxial, etc.) ¿Qué entiende por esbozo de un órgano? Describa e interprete el experimento de intercambio de mesénquimas en esbozos del tubo digestivo. Se intercambia el mesénquima que rodea al edodermo del estómago. Se colocan diferentes mésénquimas. Resultado La diferenciación de tipo de órgano se hace acorde al tipo de mesénquima o a la región de mesénquima usado. ¿Qué entiende por campo morfogenético? ¿Cómo describiría el desarrollo de los miembros? Describa e interprete el experimento de duplicaciones de estructuras distales del esbozo de miembro. Se extirpa el área correspondiente a la zona de actividad polarizante (ZAP) de un esbozo de miembro y se trasplanta al extremo distal y anterior de otro esbozo de órgano. Resultado Se duplican, en espejo, las estructuras según la información recibida por los morfógenos formados en la ZAP. TEMAS CORRESPONDIENTES AL TRABAJO PRÁCTICO Y SEMINARIO 6 ¿Cómo es el desarrollo ontogénico de los tejidos que conforman la placenta? ¿Cómo es la estructura definitiva de la placenta? Identifique los tejidos que conforman la “barrera” placentaria o membrana vásculo sincicial. (Cortes histológicos, esquemas, etc.) ¿Qué entiende por invasión trofoblástica secundaria? ¿Cuáles son los cambios que se observan en la placenta conforme avanza la gestación? ¿Cuáles son las principales alteraciones que pueden observarse en la morfología de la placenta? ¿Cuáles son las funciones atribuibles a la placenta? 96