Tema 2. CONTROL DE LA ACTIVIDAD OVÁRICA EN LA CERDA
Anuncio

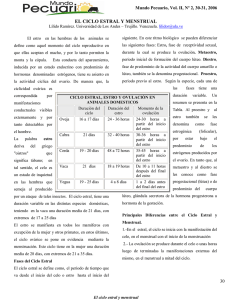
Tema 2. CONTROL DE LA ACTIVIDAD OVÁRICA EN LA CERDA (Rodríguez et al., 2008) José Luis Guzmán Guerrero Universidad de Huelva INDICE Introducción: Biotecnología ganado porcino Control de la actividad ovárica – – – – reproductiva en Concepto, ventajas e inconvenientes Bases del empleo de los métodos de control de la actividad ovárica. Ciclo estral de la cerda y su control neuroendocrino Empleo práctico de los métodos de control de la actividad ovárica Métodos de manejo y hormonales utilizados en cerdas: Sincronización del estro en hembras cíclicas (nulíparas o multíparas) Inducción de la ovulación en hembras acíclicas (prepuberales, lactantes y destetadas) Sobrealimentación o “flushing alimenticio” Control de la iluminación INTRODUCCIÓN. BIOTECNOLOGÍA REPRODUCTIVA EN GANADO PORCINO La biotecnología de la reproducción porcina incluye el conjunto de técnicas derivadas de la biología celular y molecular destinadas a garantizar la bioseguridad y la trazabilidad reproductivas, incrementar el rendimiento reproductivo y asegurar la reproducción asistida (Bonet et al, 2006). Técnicas utilizadas masivamente en la práctica Control de la actividad ovárica (sincronización del estro y control de la ovulación) Inseminación artificial (IA) (mayor impacto en la producción animal) Diagnóstico de gestación Control del parto Otras técnicas que se han desarrollado en menor grado: Maduración y fecundación “in vitro” de oocitos (FIV) Inyección intracitoplasmática de espermatozoides (ICSI) Filtración seminal Refrigeración y criopreservación de espermatozoides Producción “in vitro” de embriones porcinos Criopreservación embrionaria (vitrificación) Transferencia de embriones (TE) vía no quirúrgica Sexaje de espermatozoides (citometría de flujo) y de embriones Modificación genética de cerdos (transgénesis) (donadores de tejidos y órganos específicos para la mejora de la salud humana, modelos de enfermedades humanas, generación de productos biofarmaceuticos) Clonación reproductiva o terapéutica Genética molecular: detección de marcadores genéticos CONCEPTO, VENTAJAS E INCONVENIENTES DEL CONTROL DE LA ACTIVIDAD OVÁRICA Concepto: “Inducción de celos y ovulaciones en el momento deseado mediante diferentes métodos, bien a animales individuales o a grupos con el fin de sincronizar sus celos y ovulaciones” Ventajas: 1. Planificación de la producción y organización de la empresa ganadera: - Agrupamiento de cubriciones y partos - Control de la alimentación y manejo - Instalaciones y mano de obra - Comercialización 2. Ritmo de reproducción: * Acortar el IDC * Anestro estacional * Inducción de la pubertad 3. Inseminación artificial y transferencia de embriones 4. Selección por descendencia: * Hijos de la misma edad * Hijos criados en las mismas condiciones 5. Equilibrar camadas 6. “Todo dentro todo fuera” Inconvenientes: 1. Factor económico 2. Respuesta a los tratamientos 3. Bienestar animal (ganadería ecológica) Bases del empleo de los métodos de control de la actividad ovárica Es necesario el conocimiento de: Las bases fisiológicas de los procesos que queremos modificar Las situaciones en las que son posibles los diferentes tratamientos El estado hormonal en el que se encuentra el animal a tratar Las hormonas disponibles en el mercado Los posibles efectos secundarios y adversos derivados de una mala aplicación de las mismas Los procesos patológicos susceptibles de tratamiento hormonal Ciclo estral de la cerda Fenómenos que tienen lugar entre dos celos consecutivos Duración: 21 días (19-23) Frecuencia del ciclo estral: – – Poliéstrica continua Tendencia a la estacionalidad reproductiva: anoestro estacional (“síndrome de infertilidad estacional”): junio-septiembre (fotoperiodo y temperatura, nutrición, estrés) (gráfico 1): Elevados niveles de prolactina y bajos de FSH, LH, progesterona y estrógenos Retraso del momento de aparición de la pubertad en nulíparas Anestro postpuberal Alargamiento del IDCelo Incremento de la tasa de anestros post-destete: >10 días post-destete (grafico 2) Disminución de la fertilidad: < 65 % Aumento de las pérdidas embrionarias tempranas: repetidoras acíclicas “Síndrome del aborto otoñal”: sube la tasa de abortos 2 a 5 puntos Otros: – – – – Celos silenciosos: no detectados Menor prolificidad Alargamiento del parto Patología ovárica: quistes foliculares luteinizados o cuerpos lúteos persistentes (López Herrero, 1999) • Fases del ciclo estral: – Folicular o estrogénica: (desde el día 14-16 al 21del ciclo) (3 a 6 días) • Proestro: (2-3-4 días) – Inicio de crecimiento de varios folículos ováricos (50 folículos antrales pequeños (1-6 mm), de los cuales de 10-20 prosiguen su crecimiento hasta 8-12 mm, ovulatorios) – Estímulo de la FSH – LH: alta frecuencia y baja amplitud – Comienzan a producirse estrógenos: vulva aumentada de tamaño, rojiza y busca al macho y se montan entre si • Estro: (40-70 h) (2-3 días) (menor en nulíparas, 54 h) – – – – – Crecimiento folicular terminal hasta folículos maduros ovulatorios (10-20) Alta concentración de estrógenos circulantes Manifestaciones claras de celo (reflejo de inmovilidad) Descarga preovulatoria de LH Ovocitación: último tercio estro (a las 35-45 h) (alrededor de las 36 h) (dura 2-4 h) – Luteínica: (primeros 13-16 días del ciclo) • Metaestro: (7 días) (se incluye total o parcialmente en el estro) – Se organiza el cuerpo lúteo (cuerpo rubrum) – Comienza la secreción de progesterona – También actúa la relaxina: luteinización de las células de la granulosa • Diestro: (9 días) (hasta el día 16 del ciclo) – – – – Actuación del cuerpo lúteo Máxima producción de progesterona hasta alcanzar un máximo a los 8º-12º días Inactividad sexual Regresión del cuerpo lúteo: acción de la PGF2α del útero, entre los día 12 y 16 del ciclo PRL (Falceto et al., ) Desarrollo folicular desde el folículo antral: desarrollo continuo hasta la ovulación FACTORES NUTRICIONALES Y GENÉTICOS (Reclutamiento (Selección) Aumento de PG y disminución de progesterona) 1. 2. 3. (Dominancia) E2 = 17-β estradiol (Ziecick et al., 1996) Folículos independientes del control gonadotropo: folículos preantrales (0,19-1,1 mm de diámetro). Control intraovárico exclusivamente. Folículos FSH-dependientes: 1,1 a 2,0 mm Folículos FSH y LH-dependientes: > 2 mm (Driancourt et al., 1995; tomado de Falceto Recio et al., 2005) (Williams et al., 2004) (Martinat-Botté,2009) mama