El papel del sueño de ondas lentas en la regulación homeostática
Anuncio

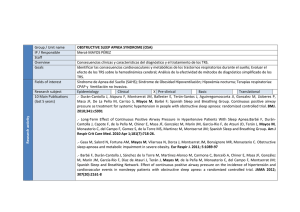
SUEÑO DE ONDAS ORIGINAL LENTAS EFECTO PROTECTOR DE LA GH (HORMONA DEL CRECIMIENTO) EN CULTIVOS DE CÉLULAS DEL SISTEMA NERVIOSO CENTRAL Resumen. Objetivo. Estudiar el efecto protector de la hormona del crecimiento (GH) in vitro en los cultivos de células de cortezas de embriones de ratas cuando se administra radioterapia. Material y métodos. Se han realizado cultivos de las células de las cortezas de embriones de ratas en el 17º día. Después de 24 horas de incubación de los cultivos con la GH (dosis, 500 ng/mL) sin sueros, las placas con los cultivos recibieron tratamiento radioterápico en una dosis de 3 Gy por placa, y se mantuvieron a continuación en estufa durante más de 24 horas para observar el efecto comparativo de la radioterapia en los cultivos irradiados con y sin la GH. Por medio de la técnica de TUNEL para verificación de la apoptosis celular hicimos un estudio comparativo para valorar si había diferentes grados de apoptosis en las placas de cultivos celulares con y sin la GH tras la administración de radioterapia. Conclusión. La GH, en la dosis empleada, causa un significativo aumento de la celularidad en las células cultivadas al ser una hormona proliferativa, factor comprobado por otros estudios realizados previamente. A través de la realización de la técnica de apoptosis en los cultivos de las células de la corteza de embriones de ratas apreciamos que, en las placas irradiadas que recibieron GH, hubo significativamente menos apoptosis celular que en los cultivos sin GH, la cual ejerce un efecto protector sobre estas células. Creemos que la GH ejerce un efecto protector sobre las células del SNC de embriones de ratas in vitro, y puede ser objeto de estudio su efecto protector in vivo. [REV NEUROL 2002; 34: 208-11] Palabras clave. Apoptosis. Corteza cerebral. Cultivos celulares. Hormona de crecimiento. Neurona. Radioterapia. EFEITO PROTECTOR DA HORMONA DE CRESCIMENTO EM CULTURAS DE CÉLULAS DO SISTEMA NERVOSO CENTRAL Resumo. Objectivo. Estudar o efeito protector da hormona de crescimento (HC) in vitro em culturas de células do córtex de embriões de ratos quando se administra radioterapia. Material e métodos. Realizaram-se culturas das células de embriões em ratos no 17º dia. Após 24 horas de incubação das culturas com HC (dose de 500 ng/ mL) sem soros, as placas com as culturas receberam tratamento radioterapêutico na dose de 3 Gy por placa, e de seguida foram mantidas em estufa durante mais de 24 horas para se observar o efeito comparativo da radioterapia nas culturas com e sem a HC. Através da técnica de TUNEL, para verificação da apoptose celular, realizámos um estudo comparativo para avaliar se havia diferentes graus de apoptose nas placas de culturas celulares com e sem a HC, após a administração de radioterapia. Conclusões. A HC na dose utilizada causa um aumento significativo da celularidade nas células cultivadas e que a HC é uma hormona proliferativa, factor comprovado por outros estudos realizados previamente. Através da técnica de apoptose, nas culturas das células do córtex de embriões de ratos, verificámos que nas placas irradiadas que receberam HC, houve significativamente menos apoptose celular do que nas culturas sem HC, exercendo esta hormona um efeito protector sobre estas células. Cremos que a HC exerce um efeito protector sobre as células do SNC de embriões de ratos in vitro e que o seu efeito protector in vivo pode ser objecto de estudo. [REV NEUROL 2002; 34: 208-11] Palavras chave. Apoptose. Córtex cerebral. Culturas celulares. Hormona de crescimento. Neurónio. Radioterapia. El papel del sueño de ondas lentas en la regulación homeostática del sueño A.I. Puente-Muñoz a, D.A. Pérez-Martínez b, I. Villalibre-Valderrey a THE ROLE OF SLOW WAVE SLEEP IN THE HOMEOSTATIC REGULATION OF SLEEP Summary. Objectives. The homeostatic regulation of sleep is based on the model devised by Borbély in 1982. During the sleepwaking cycle there is an interaction between the natural tendency to sleep, which increase as the vigil is prolonged (S process) and the circadian variation (C process). In this study, we aimed to find how slow activity (0.5-4.5 Hz) during sleep (SWA), mainly registered in phases 3 and 4, may be an indicator of process S. Patients and methods. We compared two groups of persons: 10 with chronic sleep deprivation (CSD) (less than 6 hours of sleep/day) as compared with 10 persons who slept more than 6 hours per day, using spectral analysis of their delta activity during sleep. Results. There was a predominance of delta activity in the group of persons with CSD as compared with the control group. Conclusions. An increase in SWA was accompanied by an increased tendency to sleep and may therefore be considered to be a marker for this. This marker allows conditions associated with hypersomnolence due to alteration of process S to be identified. [REV NEUROL 2002; 34: 211-5] Key words. Sleep deprivation. Sleep homeostasis. Slow activity. Slow wave sleep. INTRODUCCIÓN El mecanismo último por el cual el hombre se mantiene despierto durante el día y siente sueño durante la noche está aún por aclarar. Son muchas las teorías propuestas y los modelos formulados sobre ese complejo engranaje que se encarga de regular el ciclo vigilia-sueño. De todos estos modelos, quizás uno de los más completos sea el descrito por Borbély en 1982, que integra los dos mecanismos fundamentales que regulan el sueño [1,2]. Por una parte, la Recibido: 18.08.01. Aceptado tras revisión externa sin modificaciones:26.10.01. a Unidad de Sueño. Servicio de Neurofisiología Clínica. Hospital Clínico Universitario San Carlos. b Unidad de Neurología. Hospital Central de la Cruz Roja. Madrid, España. Madrid. E-mail: [email protected] Resultados parciales de este trabajo se presentaron en la XXXVIII Reunión Anual de la Sociedad Española de Neurofisiología Clínica. Barcelona, diciembre 2000. Correspondencia: Dra. Ana Isabel Puente Muñoz. Guayaba, 21, 3.º B. E-28044 2002, REVISTA DE NEUROLOGÍA REV NEUROL 2002; 34 (3): 211-215 211 A.I. PUENTE-MUÑOZ, ET AL Tabla I. Características generales de ambos grupos. Pacientes Sueño Hora del día Figura. Modelo de los dos procesos de Borbély. (Modificado de [1]). 10 10 Edad 50,3 55,1 9/1 9/1 Test de Epworth 15,00 9,3 Test de Zung (depresión) 36,2 37,4 0,47 Test de Zung (ansiedad) 35,8 36,9 0,57 a homeostasis del sueño hace que el hombre sienta somnolencia por la noche pero no durante el día, ya que la necesidad de sueño va aumentando a lo largo de la jornada. De este modo, habitualmente al final del día el hombre ha acumulado varias horas de vigilia y comienza sentir somnolencia, preludio del episodio principal de sueño. Por otra, la ritmicidad circadiana que rige la mayoría de las funciones vitales. La tendencia al sueño varía a lo largo del día, manteniendo los niveles más bajos hacia las 12 del mediodía y las 18 horas de la tarde [6,7]. Por la noche, entre las 20 horas y las 8 de la mañana, se produce el episodio principal de sueño de Lavie, y hacia las 15 horas de la tarde el secundario, coincidiendo este último con la somnolencia pospandrial o siesta [4,5]. Borbély denominó proceso S a la homeostasis y proceso C al ritmo circadiano, y fue capaz de relacionarlos y explicar su influencia sobre el sueño mediante el ya citado modelo de los dos procesos (Figura). Posteriormente, el propio Borbély y otros autores buscaron un marcador biológico que reflejara este control y llegaron a la conclusión de que el sueño de ondas lentas (SWS, del inglés slow-wave sleep) (fases 3 y 4) refleja fielmente el control homeostático [1,2]. Establecieron que el análisis espectral de la actividad delta es el mejor indicador del SWS, pero sin considerar la actividad lenta que pueda aparecer durante la fase 2 [8,9]. De este modo, a medida que se prolonga la vigilia, el proceso S se ve incrementado de forma exponencial y, en consecuencia, el SWS en el episodio de sueño posterior ofrecerá valores superiores a los considerados como normales. Toda aquella situación que suponga un aumento de la vigilia previa al período de sueño supondrá un incremento en la proporción de sueño lento, o más concretamente, de la actividad delta [1,2,4,7], considerada como marcador de la tendencia al sueño. Actualmente existen varios estudios en los que se comprueban las variaciones electroencefalográficas en pacientes sometidos a períodos de privación total o parcial de sueño en el laboratorio. En este trabajo se pretende estudiar la arquitectura del sueño y, más concretamente, el comportamiento del sueño de ondas lentas en pacientes con una privación crónica de sueño superior a seis meses. PACIENTES Y MÉTODOS Pacientes. Criterios de inclusión y exclusión Se seleccionaron 10 pacientes que acudieron consecutivamente a nuestra consulta por excesiva somnolencia diurna; una mujer y nueve varones con una edad media de 50,4 años (margen 34-68 años), que fueron comparados con 10 controles sanos (una mujer y nueve varones) con edad media de 55,1 años (margen 43-63 años). No existieron diferencias significativas entre ambos grupos respecto a edad, sexo o puntuación en la escala de Zung para depresión y ansiedad. Los criterios de inclusión para el estudio fueron: 1. Presencia de excesiva somnolencia diurna. 212 p N Sexo varón/mujer Vigilia Controles 0,24 0,03 a Resultado significativo con p ≤ 0,05. Tabla II. Análisis de las medias obtenidas en los parámetros de sueño. Pacientes Latencia sueño (min) Tiempo de sueño total Controles p 7,65 11,75 0,30 371,05 363,58 0,81 Proporción fase 1 17,38% 36,79% 0,09 Proporción fase 2 46,27% 41,58% 0,50 Proporción fase 3 19,02% 8,7% 0,04 a Proporción fase 4 10,22% 4,86% 0,26 Tiempo de sueño lento total (min) 98,84 Proporción sueño lento 29,24% Latencia REM (min) 78,36 Proporción REM a 7,55% 48,78 0,08 13,56% 0,06 197,08 8,98% 0,04 a 0,73 Resultado significativo con p≤ 0,05. 2. Número de horas de sueño al día (nocturno y diurno), referidas por el paciente, inferior a 6 horas, al menos durante los seis meses previos a la consulta. Los criterios de exclusión fueron: 1. Número de horas de sueño al día superior a 6. 2. Presencia de antecedentes de cataplejía, parálisis de sueño o alucinaciones hipnagógicas. 3. Presencia de ronquido o trastornos respiratorios. 4. Presencia de una causa psiquiátrica u orgánica que justificara hipersomnolencia. 5. Uso de medicación, incluyendo fármacos psicoestimulantes, que pudiese afectar a la estructura del sueño. Procedimientos Para valorar la excesiva somnolencia diurna se realizó en todos los pacientes un test de Epworth [12,13], considerando como significativos los valores superiores a 10;el estado de ánimo fue valorado mediante el test de Zung [14,15], significativo cuando era superior a 40. Ninguno de los pacientes presentó un índice de apnea-hipoapnea superior a 10. A todos los participantes del estudio se les solicitó que no hicieran siesta, tomaran alcohol o sustancias con cafeína, tanto el día del estudio como el previo. Se informó adecuadamente a todos los participantes acerca del propósito del estudio, y se les solicitó un consentimiento informado. Se realizó un estudio polisomnográfico (PSG) nocturno, según los criterios de Rechtschaffen y Kales [16], usando épocas de 30 segundos. Todos los registros duraron un mínimo de 7 horas. El montaje incluyó electrooculograma (EOG), electromiograma (EMG) mentoniano, electroencefalograma (EEG) C3-A2 y C4-A1. Se registró flujo oronasal mediante un sensor de tipo termistor y movimientos torácicos con banda torácica. Se monitorizó la saturación arterial de O 2 mediante un oxímetro aplicado en el dedo (Oxypleth ®). Finalmente se efectuó un EMG de superficie en el músculo tibial anterior de ambas piernas. REV NEUROL 2002; 34 (3): 211-215 SUEÑO DE ONDAS LENTAS Tabla III. Análisis del aumento de más del 25% de sueño de ondas lentas (SWS) entre ambos grupos. Existe un aumento significativo en el grupo de pacientes (7 frente a 1 con p= 0,02) con una odds ratio de 21 (95% CI; 1,8-248). SWS (<25%) SWS (>25%) Total Controles 9 1 10 Pacientes 3 7 10 Total 12 8 20 Tabla IV. Análisis del aumento de más del 10% de sueño de fase 3 entre ambos grupos. Existe un aumento significativo en el grupo de pacientes (9 frente a 1 con p< 0,001) con una odds ratio de 81 (95% CI; 4,4-1.504). Fase 3 (<10%) Fase 3 (>10%) Total Controles 9 1 10 Pacientes 1 9 10 10 10 20 Total En cada uno de los registros se consideró el sueño de ondas lentas (SWS) como los estadios tres y cuatro del sueño NREM [1,2,17,18]. Se valoraron los microarousals como la aparición del ritmo alfa o theta bien diferenciado del ritmo de base durante un período de 3 a 10 segundos [19]. Cuando este ritmo alfa permanecía durante más de 10 segundos se consideró como un despertar. Se valoró la eficiencia del sueño, la proporción de fases 1, 2, 3, 4 y REM, la latencia de sueño y vigilia intrasueño. Se cuantificaron los movimientos periódicos de las piernas siguiendo los criterios de Coleman [20] (series de cuatro eventos o más, con duración entre 0,5-5 segundos y con intervalos de 4 a 90 segundos). Se realizó un análisis espectral de las frecuencias EEG mediante la transformación rápida de Fourier. Se utilizó un filtro de paso de 0,16-30 Hz y se estudiaron las frecuencias de paso delta o SWA (del inglés, slow-wave activity) (0,75-4,50). Todos los valores se expresaron como porcentajes respecto al tiempo de sueño total (TST). Los registros se cuantificaron mediante un sistema de cuantificación automática (SAC® ). Análisis estadístico Se compararon las medias de edad, escala de Zung, test de Epworth, horas de sueño al día, latencia de sueño en minutos, TST en minutos, latencia de sueño REM en minutos y proporción de cada una de las fases de sueño respecto al TST, mediante un análisis de diferencias entre medias utilizando la t de Student. Para analizar la diferencia entre ambas poblaciones se estableció como criterio diagnóstico una proporción de SWS mayor del 25% respecto al TST. Asimismo, se estableció como criterio diagnóstico una diferencia mayor del 10% en la proporción de sueño de fase 3 respecto al TST. Se empleó para el análisis la prueba de χ2 con la corrección del test exacto de Fisher, dado el tamaño de la muestra. Siguiendo la metodología de un estudio de casos y controles se determinó la odds ratio para cada criterio diagnóstico. Todos los análisis estadísticos se realizaron mediante el programa informático SPSS v. 10.0 (Chicago, Illinois), y se estableció como criterio de significación una p ≤ 0,05. RESULTADOS Se estudiaron 10 pacientes que consultaron por excesiva somnolencia diurna y 10 controles sanos seleccionados aleatoriamente. En la tabla I se resumen las características de ambos grupos y se puede comprobar su homogeneidad. Únicamente se diferencian en los criterios de inclusión. El número de horas de sueño fue significativamente menor en los pacientes con privación crónica de sueño (PCS) –media de 4,7 h frente a las 8 h del grupo control–; el test de Epworth reveló valores superiores en el grupo de PCS (15 h) frente a los de los controles (9,3 h). Hallazgos poligráficos Los resultados de la poligrafía nocturna se muestran en la tabla II. No hemos encontrado diferencias significativas en la latencia de sueño ni en el TST. En REV NEUROL 2002; 34 (3): 211-215 el análisis de la proporción de cada fase de sueño se observó un aumento significativo de la fase 3 entre los pacientes (19,02% frente al 8,7%, con una p= 0,04) y una tendencia, en el límite de la significación estadística, hacia el aumento del sueño de ondas lentas (fases 3 y 4) entre el grupo de pacientes frente al de controles (29,24% frente a 13,56%, con una p= 0,06). Es probable que el reducido tamaño de la muestra no haya permitido obtener una diferencia significativa en este parámetro tal como se refleja en la literatura. La latencia de sueño REM, aunque se encuentra dentro de los límites normales, muestra diferencias significativas entre ambos grupos (78,36 min frente a 197,08 min, con una p= 0,04), sin que se acompañe de un aumento de la proporción total de sueño REM (7,55% frente al 8,98%, con una p= 0,73). El aumento de la proporción de sueño REM, conocido como ‘rebote REM’, es un hallazgo inconstante en la noche de recuperación; se observa con mayor frecuencia en las noches posteriores, pero tampoco de forma constante. Por el contrario, el SWS está sujeto a una regulación mucho más fina, y constituye un hallazgo más constante encontrar una presión de SWS aumentada tras una vigilia previa prolongada. Para facilitar el análisis en el estudio de casos y controles se estableció como criterio diagnóstico un aumento mayor del 25% de sueño de ondas lentas (fases 3 y 4), considerando como valores normales del 20 a 25% [6,17], entre el grupo de pacientes y el grupo control (Tabla III). Al analizar este parámetro, se observó que siete sujetos en el grupo de pacientes y uno del grupo control cumplían este criterio, estableciéndose una diferencia significativa (p= 0,02) y una odds ratio de 21 (95% CI; 1,8-248). Como segundo criterio diagnóstico se analizó un aumento mayor del 10% de fase 3 entre ambos grupos, considerando que los valores normales en este caso se encuentran entre el 3 y el 8% [16] (Tabla IV). Con este criterio nueve sujetos en el grupo de pacientes, y tan sólo uno en el grupo control, presentaron una proporción mayor del 10% de fase 3 (p< 0,001), estableciéndose una oddsratio de 81 (95% CI; 4,4-1.504). DISCUSIÓN El modelo de los dos procesos combina la tendencia natural al sueño (proceso S) con el ritmo circadiano (proceso C). A lo largo del día la necesidad de sueño va aumentando de forma exponencial hasta que se cumple un número suficiente de horas de vigilia, momento en el que se produce el sueño. Habitualmente coincide con el período nocturno, ya que existe un acoplamiento con el ritmo circadiano (Figura). El marcador clínico propuesto de esa tendencia al sueño es el SWS y, más concretamente, la actividad lenta SWA o actividad delta (0,5-4,5 Hz). Ya desde 1937 se conoce que el sueño de ondas lentas es un reflejo de la intensidad de sueño [1,2]. Se comprobó que los pacientes que mostraban una proporción de SWA elevada, tenían una menor capacidad de respuesta frente a estímulos externos. Es decir, cuanto mayor proporción de SWS, más profundo se puede considerar el sueño del individuo. Si consideramos de una forma global el comportamiento del SWS, al principio del sueño es máxima y, poco a poco, va descendiendo hasta que al final del mismo prácticamente no se produce SWS [21]. Este comportamiento es similar al mostrado por el proceso S (tendencia al sueño) propuesto por Borbély en su modelo, por lo que es un excelente candidato para convertirse en el marcador fisiológico de la homeostasis del sueño. Este dato fue posteriormente comprobado por diferentes estudios que se llevaron a cabo mediante análisis espectrales de las frecuencias EEG en registros de siesta diurna, realizados tras diferentes intervalos de vigilia, los cuales mostraron un progresivo aumento de la proporción de SWA a medida que se prolongaba la vigilia [22-24]. En nuestros pacientes hemos observado que la proporción de SWA es mayor respecto a los controles con diferencias estadísticamente significativas. Este hallazgo sugiere que el proceso S, en ellos, se encuentra por encima de los valores que se podrían considerar como normales, o al menos por encima de los niveles mostrados por el grupo control; de hecho, no llega nunca a recuperar los niveles basales. Según el modelo de los dos procesos este incremento del proceso S se justifica en el mayor número de 213 A.I. PUENTE-MUÑOZ, ET AL horas de vigilia previa al sueño mostrada por nuestros pacientes, así como en el insuficiente número de horas de sueño que en todos los casos era inferior a seis y que no permite la recuperación de los valores basales. Recientemente se ha propuesto que el responsable del aumento en la SWA es la ausencia de sueño y no la vigilia como tal. Incluso se han publicado estudios que comprueban cómo el aumento en la SWA se produce también tras períodos de estupor que no constituye vigilia real [31]. En nuestro estudio la privación de sueño es crónica, ya que todos nuestros pacientes presentaban una historia de al menos seis meses de evolución. La proporción de SWS se mantiene elevada, de forma estadísticamente significativa, con respecto a los controles. Este dato se podría interpretar como una ausencia de fenómeno de habituación, es decir, la arquitectura de sueño permanece alterada y no recupera una estructura normal a pesar del discurrir del tiempo. En experiencias previas se ha podido comprobar cómo existía una tendencia al acortamiento del sueño superficial (fases 1 y 2), mientras que el SWS aumentaba [25]. El aumento del SWS en la noche de recuperación es un dato bastante constante que incluso podría emplearse como índice de la buena calidad del sueño [9]. Si analizamos la distribución de las fases 3 y 4 en nuestros pacientes llama la atención que el aumento del SWS se produce a expensas de la fase 3, la cual se encuentra aumentada de forma estadísticamente significativa. Sin embargo, la fase 4, a pesar de mostrar valores superiores a los del grupo control (sin significación estadística) se encuentran dentro de los límites normales. No existen datos en la literatura acerca de este hecho. Con relación al comportamiento de otros grafoelementos típicos del sueño sólo existen datos sobre los spindles. Al parecer, existe una correlación negativa entre ellos y la SWA, de tal modo que estos pacientes presentarían spindles en menor proporción. Otros autores llegan incluso a afirmar que la presentación de los mismos muestra una morfología en forma de U, siendo mayor en los primeros y últimos episodios NREM. A juzgar por estos autores, es el ritmo circadiano el encargado de controlar su frecuencia de presentación. Por lo tanto, en estos pacientes las neuronas talamocorticales hiperpolarizadas exhibirían oscilaciones fundamentalmente en la frecuencia de la SWA dado su control por el proceso S y en menor medida en la de los spindles [32-36]. No obstante, en nuestro estudio no hemos encontrado diferencias significativas entre los dos grupos con respecto a los spindles. La latencia de sueño muestra valores normales aunque con tendencia al acortamiento y no revela diferencias significativas con respecto al grupo control. Este resultado puede interpretarse como consecuencia de la privación crónica de sueño. Nuestros pacientes tienen una necesidad de sueño superior a la de los controles y, en consecuencia, son capaces de conciliar el sueño en menos tiempo. Además, como corresponde a un paciente con privación crónica de sueño, todos refieren que cuando las circunstancias sociolaborales (fines de semana, épocas de vacaciones, etc.) lo permiten, duermen más horas. Llama la atención que, en contra de lo que se pudiera pensar, en la noche de recuperación registrada en el laboratorio, el TST no es superior al del grupo control, ya que ofrece valores de eficiencia de sueño dentro de los límites normales, y sin diferencias significativas entre ambos grupos. De aquí surge una pregunta: ¿es probable que en las noches en que duermen más de 6 horas (fines de semana, vacaciones, etc.), el TST no esté realmente aumentado y por tanto, a pesar de que el tiempo en cama sea superior, el sueño esté fragmentado con valores de eficiencia bajos, dato que se ve reflejado en la opinión de los pacientes cuando referían dichos períodos de 214 sueño como no realmente reparadores? Sin embargo, este dato no ha sido suficientemente estudiado en la literatura hasta el momento. También se puede observar cómo el SWS no se encuentra influido por el ritmo circadiano, ya que ninguno de nuestros pacientes refirió problemas en cuanto a adelanto o retraso de fase. En este modelo de los dos procesos, ambos se interrelacionan pero son independientes, no hay más que observar el diferente comportamiento entre ambos procesos [37]. El proceso circadiano nunca se ve influido por la vigilia previa y se relaciona con otras variables como la temperatura corporal o determinadas hormonas como la melatonina o el cortisol, que están sujetas a una ritmicidad circadiana. Incluso se reconoce el núcleo supraquiasmático como el encargado de su regulación. Por el contrario, en el proceso S, no se da ninguna de estas circunstancias, y aunque se han llevado a cabo numerosos estudios para conocer la estructura encargada de la regulación de proceso S, hasta el momento sólo existen datos aislados [30,35,39]. Resulta interesante comprobar en distintos trabajos cómo, mediante la luminoterapia, es posible modificar el ritmo circadiano mientras que la proporción de SWS no varía [24]. Además, el parámetro poligráfico que parece afectarse principalmente en los trastornos del ritmo circadiano es el sueño REM. En nuestros pacientes no hemos encontrado tampoco un rebote REM. La posible explicación a este hecho se puede encontrar en el hecho de que mientras el SWS muestra un incremento inmediato (con más intensidad en los tres primeros ciclos de sueño) [29], el incremento en la proporción de sueño REM se suele producir en las siguientes noches o incluso a veces no llega a producirse [27]. Se ha estudiado la presión de REM mediante privaciones selectivas y se ha comprobado que la respuesta del mismo en la noche de recuperación es inconsistente [1,2], por lo tanto se puede concluir que la regulación del sueño REM no muestra un control tan fino como la del SWS. Sin embargo, el grupo con PCS mostraba diferencias estadísticamente significativas con respecto al de los controles en la latencia de REM, aunque la media no se encuentra dentro de los valores patológicos referidos en la literatura. La latencia REM varía con la edad; se ha comprobado que en sujetos de más de 65 años la latencia puede estar acortada mientras que en sujetos de menor edad las cifras suelen encontrase dentro de los límites normales tras una privación de sueño [18]. La razón de esta diferencia se puede encontrar en la mutua interacción inhibitoria que ejercen entre sí el sueño REM y el SWS. De este modo, una elevada presión de REM inhibe el SWS, y viceversa. En los sujetos de mayor edad podría existir una menor presión de SWS y, en consecuencia, un menor efecto inhibitorio sobre el REM [18]. El sueño está controlado por dos sistemas estrechamente interrelacionados pero a la vez independientes. Por una parte, el ritmo circadiano, que se manifiesta más en el sueño REM, y por otra, la homeostasis del sueño que regula de manera más precisa al SWS. El análisis de la SWA refleja el estado del proceso S. Muchas de las hipersomnolencias, en especial aquellas de causa no aclarada, pueden tener su origen en un trastorno de la regulación homeostática. Es el caso de la hipersomnia idiopática atribuida últimamente a una disfunción del proceso S [26]. Cuando falla el control circadiano tenemos una serie de marcadores biológicos que reflejan el estado de dicho control. Sin embargo, los trastornos de la homeostasis del sueño hasta el momento no eran demasiado contemplados en la literatura, precisamente por la falta de un marcador biológico. El análisis de la actividad delta como índice de la proporción del sueño lento es una herramienta muy valiosa para establecer un diagnóstico del estado de la regulación homeostática del sueño. REV NEUROL 2002; 34 (3): 211-215 SUEÑO DE ONDAS LENTAS BIBLIOGRAFÍA 1. Borbély AA. A two process model of sleep regulation. Hum Neurobiol 1982; 1: 195-204. 2. Borbély AA, Achermann P. Sleep homeostasis and models of sleep regulation. In Kyger M, Roth T, Dement W, eds. Principles and practice of sleep medicine. Philadelphia: Saunders; 2000. p. 377-90. 3. Dijk DJ, Brunner DP, Borbély AA. Time course of EEG power density during long sleep in humans. Am J Physiol 1990; 258: R650-61. 4. Aguirre-Berrocal A. Ritmos biológicos y sueño. In Ramos-Platón MJ, ed. Sueño y procesos cognitivos. Madrid: Editorial Síntesis: 1996. p. 103-30. 5. Achermann P, Dijk DJ, Brunner DP, Borbély AA. A model of human sleep homeostasis based on EEG slow-wave activity: quantitative comparison of data and simulations. Brain Res Bull 1993; 3: 97-113. 6. Guilleminault C. Le sommeil normal de l’homme. In Billiard M, ed. Le sommeil normal et pathologique. Troubles du sommeil et de l’eveil. 2 ed. Paris: Masson; 1999. p. 3-11. 7. Feinberg I, March JD, Floyd TC, Jimison R, Bossom-Demitrack L, Katz PH. Homeostatic changes during post-nap sleep maintain baseline level of delta EEG. Electroencephalogr Clin Neurophysiol 1985; 61: 134-7. 8. Lavie P. Ultrashort sleep-waking schedule III: ‘Gates’ and ‘forbidden zones’ for sleep. Electroencephalogr Clin Neurophysiol 1986; 63: 414-25. 9. Borbély AA, Baumann F, Brandeis D, Struch I, Lehmann D. Sleep deprivation: effect on sleep stages and EEG power density in man. Electroencephalogr Clin Neurophysiol 1981; 51: 483-93. 10. Brunet D, Nish AW, MacLean M, Coulter M, Knowles JB. The time course of ‘process S’: comparison of visually scored slow wave sleep and power spectral analysis. Electroencephalogr Clin Neurophysiol 1988; 70: 278-80. 11. Borbély AA, Achermann P. Sleep homeostasis and models of sleep regulation. J Biol Rhythms 1999; 14: 557-68. 12. Johns MW. A new method for measuring daytime sleepiness: the Epworth sleepiness scale. Sleep 1991; 14: 540-5. 13. Johns MW. Daytime sleepiness, snoring, and obstructive sleep apnea. The Epworth Sleepiness Scale. Chest 1993; 103: 30-6. 14. Zung WW. The differentiation of anxiety and depressive disorders: a biometric approach. Psychosomatics 1971; 12: 380-4. 15. Zung WW. A rating instrument for anxiety disorders. Psychosomatics 1971; 12: 371-9. 16. Rechtschaffen A, Kales A, eds. A manual of standardised terminology techniques and scoring system, for sleep stages of human subjects. Los Angeles: Brain Information Service/Brain Research Institute. University of California; 1968. 17. Carskadon MA, Dement WC. Normal human sleep. In Kyger M, Roth T, Dement W, eds. Principles and practice of sleep medicine. Philadelphia: Saunders; 2000. p. 15-25. 18. Reinoso-Suárez F. The neurobiology of slow-wave sleep. An R Acad Nac Med 1999; 116: 209-26. 19. ASDA. EEG arousal’s: scoring rules and examples: a preliminary report from the Sleep Disorders Atlas Task Force of the American Sleep Disorders Association. Sleep 1992; 15: 173-84. 20. Coleman RM. Periodic movements in sleep (nocturnal myoclonus) and restless legs syndrome. In Guilleminault C, ed. Sleeping and Waking disor- EL PAPEL DEL SUEÑO DE ONDAS LENTAS EN LA REGULACIÓN HOMEOSTÁTICA DEL SUEÑO Resumen. Objetivos. La regulación homeostática del sueño se fundamenta en el modelo de los procesos formulado por Borbély en 1982. Durante el ciclo sueño-vigilia se produce una interacción entre la tendencia natural al sueño, que se incrementa a medida que la vigilia se prolonga (proceso S), y la variación circadiana (proceso C). En este estudio se pretende comprobar cómo la actividad lenta (0,5-4,5 Hz) durante el sueño (SWA), registrada fundamentalmente en las fases 3 y 4, puede ser un índice del proceso S. Pacientes y métodos. Se comparan dos grupos de individuos: 10 con privación crónica de sueño (PCS) (menos de 6 horas de sueño/día), frente a 10 con más de 6 horas de sueño/día, mediante un análisis espectral de su actividad delta durante el sueño. Resultados. Se ha comprobado un predominio de la actividad delta en el grupo de individuos con PCS frente al grupo control. Conclusiones. El aumento de la SWA se acompaña de un aumento de la tendencia al sueño, por lo que podría considerarse como un marcador de la misma. Este marcador permite identificar aquellas patologías que cursan con hipersomnolencia ocasionada por una alteración del proceso S. [REV NEUROL 2002; 34: 211-5] Palabras clave. Actividad lenta. Homeostasis del sueño. Privación de sueño. Sueño de ondas lentas. REV NEUROL 2002; 34 (3): 211-215 21. 22. 23. 24. 25. 26. 27. 28. 29. 30. 31. 32. 33. 34. 35. 36. 37. 38. 39. ders: Indications and techniques. Menlo Park, CA: Addison-Wesley; 1982. p. 200-4. Achermann P, Borbély AA. Simulation of human sleep: ultradian dynamics of electroencephalographic slow-wave activity. J Biol Rhythms 1990; 5: 141-57. Beersma D, Daan S, Dijk DJ. Sleep intensity and timing: a model for their circadian control. In Carpenter GA, ed. Some mathematical question in biology. Circadian rhythms. Lectures on mathematics in the life sciences. Providence, RI: The American Mathematical Society; 1987. p. 39-62. Dijk DJ, Beersa D, Daan S. EEG power density during nap sleep: reflection of an hourglass measuring the duration of prior wakefulness. J Biol Rhythms 1987; 2: 207-19. Dijk DJ, Beersma D, Daan S, Lewy AJ. Bright morning light advances the human circadian system without affecting NREM sleep homeostasis. Am J Physiol 1989; 256: R106-11. Bonnet MH. Sleep deprivation. In Kyger M, Roth T, Dement W, eds. Principles and practice of sleep medicine. Philadelphia: Saunders; 2000. p. 53-71. Sforza E, Gaudreau H, Petit D, Montplaisir J. Homeostatic sleep regulation in patients with idiopathic hypersomnia. Clin Neurophysiol 2000; 111: 277-82. Dijk D, Brunner D, Borbély AA. EEG power density during recovery sleep in the morning. Electroencephalogr Clin Neurophysiol 1991; 78: 203-14. Knowles JB, Coulter M, Wahnon S. Variations in process S: effects on sleep continuity and architecture. Sleep 1990; 13: 97-107. Dijk DJ, Beersma D. Effects of SWS deprivation on subsequent EEG power density and spontaneous sleep duration. Electroencephalogr Clin Neurophysiol 1989; 72: 312-20. Borbély AA. From slow waves to sleep homeostasis: new perspectives. Arch Ital Biol 2001; 139: 53-61. Deboer T, Tobler I. Slow waves in the sleep electroencephalogram after daily torpor are homeostatically regulated. Neuroreport 2000; 11: 881-5. Dijk DJ. EEG slow waves and sleep spindles: windows on the sleeping brain. Behav Brain Res 1995; 69: 109-16. Franken P, Chollet D, Tafti M. The homeostatic regulation of sleep need is under genetic control. J Neurosci 2001; 21: 2610-21. Dijk DJ, Czeisler CA. Contribution of the circadian pacemaker and the sleep homeostat to sleep propensity, sleep structure, electroencephalographic slow waves, and sleep spindle activity in humans. J Neurosci 1995; 15: 3526-38. Aeschbach D, Dijk DJ, Borbély AA. Dynamics of EEG spindle frequency activity during extended sleep in humans: relationship to slow-wave activity and time of day. Brain Res 1997; 748: 131-6. Aeschbach D, Borbély AA. All-night dynamics of the human sleep EEG. J Sleep Res 1993; 2: 70-81. Dijk DJ, Cajochen C, Tobler I, Borbély AA. Sleep extension in humans: sleep stages, EEG power spectra and body temperature. Sleep 1991; 14: 294-306. Dijk DJ, Kronauer RE. Commentary: models of sleep regulation: successes and continuing challenges. J Biol Rhythms 1999; 14: 569-73 De Koninck GC, Hebert M, Carrier J, Lamarche C, Dufour S. Body temperature and the return of slow wave activity in extended sleep. Electroencephalogr Clin Neurophysiol 1996; 98: 42-50. O PAPEL DO SONO DE ONDAS LENTAS NA REGULAÇÃO HOMEOSTÁTICA DO SONO Resumo. Objectivos. A regulação homeostática do sono fundamenta-se no modelo dos processos formulados por Bobérly em 1982. Durante o ciclo sono-vigília, produz-se uma interacção entre a tendência natural do sono, que aumenta à medida em que a vigília se prolonga (processo S) e a variação circadiana (processo C). Neste estudo, pretende-se comprovar de que forma a actividade lenta (0,54,5 Hz) durante o sono (SWA), registada fundamentalmente nas fases 3 e 4, pode ser um índice do processo S. Doentes e métodos. São comparados dois grupos de indivíduos: 10 com privação crónica do sono (PCS) (menos de 6 horas de sono/dia), face a 10 com mais de 6 horas de sono/dia, por análise espectral da sua actividade delta durante o sono. Resultados. Foi comprovado um predomínio da actividade delta no grupo de indivíduos com PCS face ao grupo de controlo. Conclusões. O aumento da SWA é acompanhada por um aumento da tendência para o sono, portanto, poderá considerar-se como um marcador da mesma. Este marcador permite identificar aquelas patologias que cursam com hiper-sonolência ocasionada por uma alteração do processo S. [REV NEUROL 2002; 34: 211-5] Palavras chave. Actividade lenta. Homeostase do sono. Privação do sono. Sono de ondas lentas. 215