Procedimiento Control de Calidad Interno Cuantitativo
Anuncio

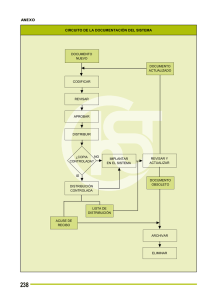
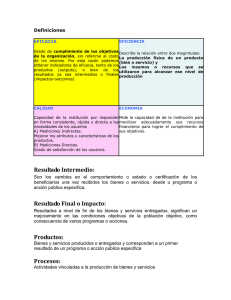
Fecha emisión: Marzo 2009 PROCEDIMIENTO CONTROL DE CALIDAD INTERNO DE LAS Revisión: 0 MEDICIONES DE ANALITOS CUANTITATIVOS. Fecha revisión: Marzo 2009 Subdepto Inmunología Sección Inmunodiagnóstico Página 1 de 10 PR-222.06-001 COPIA NO CONTROLADA. 1. OBJETIVO Establecer las condiciones y acciones necesarias para monitorear la precisión de las mediciones de analitos cuantitativos y detectar errores aleatorios y sistemáticos. 2. ALCANCE/CAMPO DE APLICACIÓN Aplica a todos las mediciones de los analitos cuantitativos que están sujetos a control de calidad interno, por lo tanto es un documento transversal a todas las áreas que realizan mediciones de analitos cuantitativos. 3. FUNDAMENTO El control de calidad interno en el laboratorio clínico se basa en el análisis estadístico de los resultados obtenidos de los controles al incorporarlos en las corridas analíticas, permitiendo conocer y verificar la imprecisión de cada medición del analito correspondiente. 4. REFERENCIAS 4.1. 4.2. 4.3. 4.4. 4.5. Barry P. The Levey-Jennings Control Chart. Serie Westgard QC, disponible online http://www.westgard.com/lesson12.htm Westgard. Multirules and “Westgard Rules”, Serie Westgard QC, disponible online http://www.westgard.com/lesson73.htm Fernández Espina C., Mazziotta D. Gestión de la Calidad en el Laboratorio Clínico. Editorial Médica Panamericana, 2005, Argentina. Armitage P., Berry G. Estadística para la Investigación Biomédica. Doyma, Barcelona, 1992. International vocabulary of basic and general terms in metrology (VIM), BIMP, IEC, IFCC, ISO, IUPAC, IUPAP y OIML. Elaborado por Revisado por Aprobado por TM. Marcelo Yáñez Vera Profesional Sección Inmunodiagnóstico. BQ. Hugo Moscoso Espinoza Encargado Calidad Sección Inmunodiagnóstico. QF. Darwins Castillo A. Jefe Sección Inmunodiagnóstico. ESTE DOCUMENTO AL SER IMPRESO O ESTAR UBICADO FUERA DE LA INTRANET DEL INSTITUTO DE SALUD PUBLICA SE CONSIDERA UNA “COPIA NO CONTROLADA” Fecha emisión: Marzo 2009 PROCEDIMIENTO CONTROL DE CALIDAD INTERNO DE LAS Revisión: 0 MEDICIONES DE ANALITOS CUANTITATIVOS. Fecha revisión: Marzo 2009 Subdepto Inmunología Sección Inmunodiagnóstico PR-222.06-001 Página 2 de 10 COPIA NO CONTROLADA. 5. TERMINOLOGIA. • Material de control: sustancia que tiene una o varias de sus propiedades establecidas para permitir su uso en una serie analítica cuantitativa que permita conocer la imprecisión de las mediciones. • Material de Referencia: material o sustancia en que uno o varios valores de la(s) propiedad(es) es (son) suficientemente homogéneo(s) y bien definido(s) para permitir su uso para calibrar un aparato, evaluar un método de medición o asignar valores a materiales. • Media (x): La media aritmética de una variable estadística es la suma de todos sus posibles valores (∑xn), ponderada por las frecuencias de los mismos (n). x= ∑ xn n • Desviación estándar (s): es la raíz cuadrada (√) de la media de las diferencias cuadráticas de n puntuaciones con respecto a su media aritmética (imprecisión o error aleatorio). s= • ∑ (x i − x )2 n −1 Coeficiente de variación (%CV): corresponde a la desviación estándar (s) como porcentaje de la media (x). %CV= (s x 100) / x • Carta control de Levey-Jennings (gráfica n20): método gráfico para mostrar los resultados de los controles. Los resultados se grafican secuencialmente en el tiempo (eje X), de acuerdo a su concentración (eje Y). • Corrida analítica: se define como un intervalo (período de tiempo menor a 24 hrs. o número de muestras) para el cual se espera que la precisión y la exactitud del método sean estables. • Variación biológica interindividual: fenómeno por el que los valores de una misma magnitud biológica de los individuos pueden variar en el curso del tiempo, en más de un individuo. ESTE DOCUMENTO AL SER IMPRESO O ESTAR UBICADO FUERA DE LA INTRANET DEL INSTITUTO DE SALUD PUBLICA SE CONSIDERA UNA “COPIA NO CONTROLADA” Fecha emisión: Marzo 2009 PROCEDIMIENTO CONTROL DE CALIDAD INTERNO DE LAS Revisión: 0 MEDICIONES DE ANALITOS CUANTITATIVOS. Fecha revisión: Marzo 2009 Subdepto Inmunología Sección Inmunodiagnóstico PR-222.06-001 Página 3 de 10 COPIA NO CONTROLADA. • Variación biológica intraindividual: fenómeno por el que los valores de las magnitudes biológicas de un individuo pueden variar en el curso del tiempo. • Medición: conjunto de operaciones que tienen por finalidad determinar un valor de una magnitud. • Veracidad (exactitud de la medición): grado de concordancia entre el valor promedio obtenido de una gran serie de resultados de mediciones y un valor verdadero. • Exactitud de la medida: grado de concordancia entre el resultado de una medición y un valor verdadero del mensurando. • Inexactitud: grado de dispersión entre el resultado de una medición y un valor verdadero del mensurando. • Sesgo, medida (error): diferencia del valor de una medida y el valor verdadero del mensurado. • Precisión: grado de concordancia entre resultados de ensayo independientes obtenidos bajo condiciones prescritas (estipuladas). • Imprecisión: grado de dispersión entre mediciones repetidas de la misma muestra estable. El parámetro estadístico que la caracteriza es el % de CV (%de imprecisión). • Incertidumbre: parámetro, asociado a los resultados de una medición, que caracteriza la dispersión de los valores que podrían ser razonablemente atribuidos al mensurando. • Repetibilidad: precisión de los resultados de una medición obtenidos con el mismo método, el mismo operador, el mismo instrumento de medida y durante un tiempo corto. • Reproducibilidad: precisión de los resultados de una medición obtenidos con el mismo método, sobre el mismo mensurado pero en distintas condiciones (diferentes operadores, lote de reactivos, equipos de medida, laboratorios, etc.) • Verificación: confirmación mediante examen y obtención de evidencia objetiva de que se cumplen unos requisitos específicos. ESTE DOCUMENTO AL SER IMPRESO O ESTAR UBICADO FUERA DE LA INTRANET DEL INSTITUTO DE SALUD PUBLICA SE CONSIDERA UNA “COPIA NO CONTROLADA” Fecha emisión: Marzo 2009 PROCEDIMIENTO CONTROL DE CALIDAD INTERNO DE LAS Revisión: 0 MEDICIONES DE ANALITOS CUANTITATIVOS. Fecha revisión: Marzo 2009 Subdepto Inmunología Sección Inmunodiagnóstico Página 4 de 10 PR-222.06-001 COPIA NO CONTROLADA. 6. MATERIALES, REACTIVOS Y EQUIPOS 6.1. MATERIALES • No aplica. 6.2. REACTIVOS • Material Control Interno Normal y Patológico (2 niveles de control). 6.3. EQUIPOS • Depende del analito a medir. 7. DESARROLLO 7.1. MATERIAL DE CONTROL A USAR Utilizar a lo menos dos niveles de material control valorados o no valorados, cuya matriz sea similar al líquido biológico utilizado y que el nivel de concentración del analito esté comprendido en el intervalo de referencia biológico, bajo y/o sobre el intervalo. 7.2. FRECUENCIA DE USO Debe incorporarse dos materiales de control previo a la corrida analítica de las muestras, sin embargo debe aplicarse a lo menos un suero control después de cada 50 muestras. 7.3. ASIGNACIÓN DE VALORES AL MATERIAL DE CONTROL 7.3.1. Para establecer los valores de media (x), s, CV y límites aceptables de un nuevo lote de control se analiza el material del lote en paralelo con el material de control en uso actual. 7.3.2. Se deben obtener 20 datos en a lo menos 20 días, cuyos resultados serán procesados según el IT-222.26-001. 7.3.3. Los valores entregados por el fabricante sólo se utilizarán de referencia y en pruebas de bajo volumen se puede utilizar como valores provisorios, en forma excepcional. 7.3.4. Una vez obtenidos los valores definitivos, estos reemplazarán a los provisorios. 7.3.5. En el caso de Hematología, los valores de media y límites aceptables serán aquellos definidos por el fabricante, debido al que el corto tiempo de estabilidad de estos controles impide el establecimiento de valores propios. ESTE DOCUMENTO AL SER IMPRESO O ESTAR UBICADO FUERA DE LA INTRANET DEL INSTITUTO DE SALUD PUBLICA SE CONSIDERA UNA “COPIA NO CONTROLADA” Fecha emisión: Marzo 2009 PROCEDIMIENTO CONTROL DE CALIDAD INTERNO DE LAS Revisión: 0 MEDICIONES DE ANALITOS CUANTITATIVOS. Fecha revisión: Marzo 2009 Subdepto Inmunología Sección Inmunodiagnóstico PR-222.06-001 Página 5 de 10 COPIA NO CONTROLADA. 7.4. SELECCIÓN DE LAS REGLAS DE CONTROL O MULTIRREGLAS DE WESTGARD 7.4.1. Inicialmente los resultados de controles de todos los procedimientos de medida serán evaluados con las reglas o multirreglas de Westgard. Se han adoptado abreviaturas para cada criterio de decisión o regla de control ej. 13s para indicar que una medición de control excede el límite de control en 3 desviaciones estándar. La combinación de multirreglas se indica generalmente por el uso de un slash (/) entre las reglas de control, ej. 13s/22s/R4s. 7.4.2. Los criterios usados para la aceptación o rechazo de una corrida analítica serán de acuerdo a Westgard y los antecedentes importantes en el uso de las reglas de Westgard para aceptar o rechazar una corrida analítica se describen en el IT-222.26-002. 7.4.3. Para saber exactamente cuando usar una regla individual es necesario revisar el requisito de calidad requerido para la medición del analito de acuerdo al método en uso, y su competencia y desempeño, tomando en cuenta la imprecisión e inexactitud de la medición del analito. 7.4.4. De esta forma se seleccionará una regla que tenga una probabilidad de falso rechazo (Pfr) de 5% o menos y capacidad de detección del error (Ped) de 90% o más. (http://www.westgard.com/mltirule.html) 7.4.5. Cada laboratorio debe analizar correctamente las reglas de Westgard, pero en general las más utilizadas por los laboratorios clínicos, son las que utilizan 2 ó 4 mediciones de control (Fig. 1) y/o 3 ó 6 mediciones de control (Fig. 2) y que corresponden a las que se muestran en los anexos 1 y 2 respectivamente, usando a lo menos dos niveles de control. 7.5. ACCIONES CORRECTIVAS DERIVADAS DEL CONTROL DE CALIDAD INTERNO Cuando los resultados del control no son aceptables (no conformes) las acciones a seguir son: 7.5.1. Se debe revisar la ejecución del procedimiento y las instrucciones de trabajo. 7.5.2. Se debe revisar la carta control y regla de rechazo para determinar el tipo de error. 7.5.3. Se debe relacionar el tipo de error con las potenciales causas (calibrador con nuevo lote, reactivos con nuevos lotes, fecha de vencimiento de los controles, temperatura de almacenamiento, etc.) ESTE DOCUMENTO AL SER IMPRESO O ESTAR UBICADO FUERA DE LA INTRANET DEL INSTITUTO DE SALUD PUBLICA SE CONSIDERA UNA “COPIA NO CONTROLADA” Fecha emisión: Marzo 2009 PROCEDIMIENTO CONTROL DE CALIDAD INTERNO DE LAS Revisión: 0 MEDICIONES DE ANALITOS CUANTITATIVOS. Fecha revisión: Marzo 2009 Subdepto Inmunología Sección Inmunodiagnóstico Página 6 de 10 PR-222.06-001 COPIA NO CONTROLADA. 7.5.4. Se debe revisar el registro de problemas y soluciones. 7.5.5. Si todo está correcto se debe repetir la prueba. Si se aceptan los resultados registrar los datos. 7.5.6. Si se mantiene la no conformidad: 7.5.7. Recalibrar el método manteniendo el número de lote del calibrador. 7.5.8. Cambiar los reactivos manteniendo el lote. 7.5.9. Incorporar en la corrida un suero control alternativo. 7.5.10. Repetir la prueba, si se aceptan los resultados. Registrar los datos. 7.5.11. Si el valor no mejora, solicitar la revisión por el servicio técnico especializado. 7.5.12. Documentar la acción correctiva. 7.5.13. Revisar si corresponde aplicar una acción preventiva. 7.5.14. Mantener y documentar los registros. Se debe realizar análisis de la causa del error de acuerdo al diagrama Nº 1 (Anexo 3) y aplicar un “Procedimiento de Identificación y Control de No Conformidades”. 7.6. CONSIDERACIONES A TENER PRESENTE EN EL CONTROL DE CALIDAD INTERNO 7.6.1. Determinar si el error afecta todos los niveles de control o alguno en particular (alto, normal o bajo). 7.6.2. Revisar los datos históricos de los pacientes relacionados con el o los niveles de control con error. Si el resultado es consistente, liberar resultados, si no es consistente reprocesar muestras. 7.6.3. Repetir muestras aleatoriamente para verificar resultados anteriores. 7.6.4. Muestreo específico, re-analizar muestras con resultados relacionados con el nivel de control que presenta problemas. ESTE DOCUMENTO AL SER IMPRESO O ESTAR UBICADO FUERA DE LA INTRANET DEL INSTITUTO DE SALUD PUBLICA SE CONSIDERA UNA “COPIA NO CONTROLADA” Fecha emisión: Marzo 2009 PROCEDIMIENTO CONTROL DE CALIDAD INTERNO DE LAS Revisión: 0 MEDICIONES DE ANALITOS CUANTITATIVOS. Fecha revisión: Marzo 2009 Subdepto Inmunología Sección Inmunodiagnóstico Página 7 de 10 PR-222.06-001 COPIA NO CONTROLADA. 8. REGISTROS Identificación del registro Registro de identificación del material de control interno. Registro de resultados, análisis e imprecisión del control interno. Almacenamiento Sección Laboratorio respectivo. de Sección Laboratorio respectivo. de Registro de uso del Sección equipo Laboratorio correspondiente. respectivo. de Registro de Mantención y/o reparación del equipo correspondiente. Registro de Calibración del instrumento correspondiente. Sección Laboratorio respectivo. de Sección Laboratorio respectivo. de Registro de Porcentaje Sección de Imprecisión Control Laboratorio de Calidad Interno. respectivo. de Protección Recuperación Tiempo de retención y disposición. Acceso Director y/o Encargado 5 años y se destruye. restringido, sólo de Calidad Laboratorio. personal autorizado. Acceso Director y/o Encargado 5 años y se destruye. restringido, sólo de Calidad Laboratorio. personal autorizado. Acceso Director y/o Encargado 5 años y se destruye. restringido, sólo de Calidad Laboratorio. personal autorizado. Acceso Director y/o Encargado 5 años y se destruye. restringido, sólo de Calidad Laboratorio. personal autorizado. Acceso Director y/o Encargado 5 años y se destruye. restringido, sólo de Calidad Laboratorio. personal autorizado. Acceso Director y/o Encargado 5 años y se destruye. restringido, sólo de Calidad Laboratorio. personal autorizado. ESTE DOCUMENTO AL SER IMPRESO O ESTAR UBICADO FUERA DE LA INTRANET DEL INSTITUTO DE SALUD PUBLICA SE CONSIDERA UNA “COPIA NO CONTROLADA” Fecha emisión: Marzo 2009 PROCEDIMIENTO CONTROL DE CALIDAD INTERNO DE LAS Revisión: 0 MEDICIONES DE ANALITOS CUANTITATIVOS. Fecha revisión: Marzo 2009 Subdepto Inmunología Sección Inmunodiagnóstico PR-222.06-001 Página 8 de 10 COPIA NO CONTROLADA. 9. TABLA DE MODIFICACIONES Revisión Nº Pág. Modificada Motivo del cambio Fecha Aprobación 10. ANEXOS Anexo Nº 1. Figura Nº 1: Reglas de Westgard para 2 ó 4 controles. Anexo Nº 2. Figura Nº 2: Reglas de Westgard para 3 ó 6 controles. Anexo Nº 3. Diagrama Nº 2: Análisis de la causa del error. ESTE DOCUMENTO AL SER IMPRESO O ESTAR UBICADO FUERA DE LA INTRANET DEL INSTITUTO DE SALUD PUBLICA SE CONSIDERA UNA “COPIA NO CONTROLADA” Fecha emisión: Marzo 2009 PROCEDIMIENTO CONTROL DE CALIDAD INTERNO DE LAS Revisión: 0 MEDICIONES DE ANALITOS CUANTITATIVOS. Fecha revisión: Marzo 2009 Subdepto Inmunología Sección Inmunodiagnóstico PR-222.06-001 Página 9 de 10 COPIA NO CONTROLADA. ANEXO Nº 1: Figura 1: Reglas de Westgard para 2 ó 4 controles. ANEXO Nº 2: Figura 2: Reglas de Westgard para 3 ó 6 controles. ESTE DOCUMENTO AL SER IMPRESO O ESTAR UBICADO FUERA DE LA INTRANET DEL INSTITUTO DE SALUD PUBLICA SE CONSIDERA UNA “COPIA NO CONTROLADA” Fecha emisión: Marzo 2009 PROCEDIMIENTO CONTROL DE CALIDAD INTERNO DE LAS Revisión: 0 MEDICIONES DE ANALITOS CUANTITATIVOS. Fecha revisión: Marzo 2009 Subdepto Inmunología Sección Inmunodiagnóstico PR-222.06-001 Página 10 de 10 COPIA NO CONTROLADA. ANEXO Nº 3: Inspeccionar cartas de control y reglas de rechazo para determinar el tipo de error Considerar factores comunes de los equipos analizadores Relacionar el tipo de error con causas posibles Relacionar causas con cambios recientes Identificar la causa Error sistemático: •Cambio lote reactivo o de calibrador, •Valores de calibrador incorrectos •Preparación inadecuada de reactivos, •Deterioro de reactivos o calibradores, •Almacenamiento inadecuado de reactivos y controles • Cambio de accesorios en los inst. Error aleatorio: •Burbujas en los reactivos y en las líneas de reactivos, •Mezcla inadecuada de reactivos, •Temperatura e incubación inestables, •Inestabilidad de la corriente eléctrica, •Variaciones individuales del operador en pipeteo o tiempos, etc. Corregir el problema Documentar las acciones correctivas y/o preventivas si corresponde. Diagrama Nº 1. Análisis de la causa del error. ESTE DOCUMENTO AL SER IMPRESO O ESTAR UBICADO FUERA DE LA INTRANET DEL INSTITUTO DE SALUD PUBLICA SE CONSIDERA UNA “COPIA NO CONTROLADA”