Doc. Mecanismo del proceso Hiperplásico y Neoplásico
Anuncio

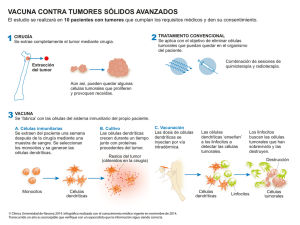
1 UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE ODONTOLOGÍA AREA DE PATOLOGÍA TEMA: MECANISMOS DEL PROCESO HIPERPLÁSICO Y NEOPLÁSICO CURSO: PATOLOGÍA I NIVEL: TERCER AÑO BIBLIOGRAFIA: PATOLOGÍA ESTRUCTURAL Y FUNCIONAL DE ROBBINS Y COTRAN. Kumar, Vinar, Abul Cavas, Nelson Fausto. 7ª edición, editorial Saunders, Elsevier, España, 2005. 1517 pp Documento Mecanismos del Proceso Hiperplásico y Neoplásico, (resumen elaborado por Dra. Diana Annabella Corzo M.) Complicaciones orales del cáncer y de su terapia. [email protected] Documento Terminología utilizada en Patología (elaborado por Dra. Diana Annabella Corzo M.) I. OBJETIVOS: Al finalizar el tema, el estudiante debe ser capaz de: 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. 14. Definir y describir las distintas proliferaciones neoplásicas y no neoplásicas: hiperplasia, displasia, metaplasia y neoplasia. Se incluirán los procesos no proliferativos: atrofia e hipertrofia. Establecer diferencias entre las distintas proliferaciones neoplásicas, no neoplásicas, atrofia e hipertrofia. Describir el mecanismo de formación de las distintas proliferaciones neoplásicas, no neoplásicas, atrofia e hipertrofia y las características específicas de cada una de ellas Conocer e identificar la nomenclatura utilizada para las neoplasias benignas y malignas y para algunos trastornos no neoplásicos (teratoma, coristoma, hamartoma.) Describir las características generales y específicas de las neoplasias benignas y malignas (diferenciación y anaplasia, ritmo de crecimiento, etc.), así como los componentes de las neoplasias (estroma y parénquima). Explicar generalidades acerca de la etiología y proceso de formación del cáncer (carcinógenos químicos, físicos y microbiológicos, iniciación, promoción, protooncogenes, oncogenes, genes reguladores oncogenes, etc.). Conocer la epidemiología de las neoplasias. Describir las características clínicas de las neoplasias y las etapas del cáncer. Describir cómo se defiende el organismo contra los tumores, qué mecanismos y células intervienen en dicho proceso y la efectividad del mismo. Conocer, utilizar e interpretar la nomenclatura TNM y por grados para neoplasias malignas de cabeza y cuello. Conocer los distintos medios diagnósticos para neoplasias, cuál es el principio básico por medio del cual actúan y su empleo en lesiones de cabeza y cuello. Conocer y describir las manifestaciones bucales producidas por la quimioterapia y por la radioterapia de cabeza y cuello y su tratamiento. Resolver casos clínicos que se les presentan. Describir y aplicar la terminología utilizada en Patología. 2 II. METODOLOGÍA: 1. Estudiar con anterioridad los temas que correspondan a cada período de clase. 2. Exposición oral dinamizada de cada tema, discusión y resolución de dudas. III. CONTENIDOS: 1. Formación de hiperplasia, hipertrofia, atrofia, metaplasia, displasia epitelial, carcinoma in situ, carcinoma invasivo y neoplasia. 2. Formación de neoplasias, nomenclatura de las neoplasias. 3. Características generales de las neoplasias benignas y malignas. 4. Epidemiología y etiología. 5. Formación del cáncer (iniciación, promoción, progresión tumoral), protooncogenes, oncogenes y genes normales reguladores del crecimiento neoplásico. 6. Defensa del huésped contra tumores y defensa del tumor contra la vigilancia inmunitaria y genética. 7. Características clínicas de las neoplasias y nomenclatura TNM y por grados para neoplasias malignas de cabeza y cuello. 8. Etapas del cáncer: Fase prediagnóstica, fase diagnóstica (métodos diagnósticos: biopsia incisional, escisional, por aspiración, citología exfoliativa, radiografías,(periapicales, panorámicas, etc.), ultasonido, tomografía axial computarizada, resonancia magnética), fase de tratamiento (Cirugía, radioterapia, quimioterapia e inmunoterapia), fase de seguimiento, fase de retratamiento, fase final o paliativa. 9. Etapas del cáncer (continuación). 10. Efectos de la quimioterapia y radioterapia en la región de cabeza y cuello. IV. EVALUACIÓN: V. El presente tema será evaluado de la siguiente forma: Evaluación final de tema la cual puede incluir preguntas de Selección Múltiple, preguntas de completación, resolución de casos clínicos hipotéticos, falso y verdadero, apareamiento, etc. Valor del examen: 100 puntos. Se realizarán pruebas iniciales de conocimiento y, por grupos, visitarán el INCAN, tomarán fotografías de pacientes y presentarán un informe de la actividad (utilizando material multimedia). Valor total: 2.5 puntos de zona. Se evaluará en base a la bibliografía descrita en la primera página y a lo impartido en clase. TIEMPO: El presente tema consta de 10 períodos de clase de 1.5 horas cada uno y la evaluación final de tema. Total: 16.5 horas. 3 UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE ODONTOLOGÍA AREA DE PATOLOGÍA CURSO: Patología I. NIVEL: Tercer año. MECANISMOS DEL PROCESO HIPERPLÁSICO Y NEOPLÁSICO Resumen elaborado por: Dra. Diana Annabella Corzo M. CRECIMIENTOS NO NEOPLÁSICOS CRECIMIENTOS NEOPLÁSICOS A) CRECIMIENTOS NO NEOPLÁSICOS Son crecimientos controlados. Disminuyen cuando cesa el estímulo que los provocó. Generalmente son respuestas adaptativas del órgano o tejido ante la presencia de estímulos persistentes (traumatismos, hormonales, hábitos, microbiológicos, etc.) 1) HIPERTROFIA: Es el incremento en el tamaño de las células por incremento de la demanda funcional o por estimulación hormonal, produciendo AUMENTO EN EL TAMAÑO DE UN ÓRGANO O TEJIDO POR AUMENTO EN EL TAMAÑO DE LAS CÉLULAS. La célula crece por aumento en el número de sus organelos. Es una respuesta adaptativa. La hipertrofia ocurre en dos situaciones: Fisiológicas Patológicas Se produce por: 1) Aumento de la carga de trabajo 2) Estimulación hormonal 3) Disminución en la degradación o eliminación de proteínas (esteroides anabólicos). Cualquier tipo de células puede experimentar hipertrofia. Lábiles Estables Permanentes 2) HIPERPLASIA: Es una reacción adaptativa del organismo que produce el aumento en el tamaño de un órgano o tejido por AUMENTO EN EL NÚMERO DE CÉLULAS. Ocurre únicamente en células que tienen capacidad mitótica. Lábiles Estables Pueden ocurrir juntas Hipertrofia e Hiperplasia. Las Hiperplasias pueden ser: a) Fisiológicas: Hormonales (mama femenina) Compensadora (nefrectomía) 4 b) Patológicas Endometrio, tiroides, epidérmicas, etc. Infección viral (virus oncógenos) Ocurre también en: Curación de heridas (reparación) Importancia clínica: Pueden producir enfermedad clínica (hemorragia o hiperfunción). Algunas pueden tener transformación neoplásica. 3) METAPLASIA: Es el cambio reversible en el cual un tipo celular adulto (epitelial o mesenquimático), se substituye por otro tipo celular adulto que normalmente no se localiza en ese lugar. ES UNA RESPUESTA ADAPTATIVA. Tipos de Metaplasia: Metaplasia Normal : es benigna y ordenada Metaplasia Atípica: se da en el epitelio y es premaligna, es desordenada y da lugar a una displasia epitelial. Inconveniente de la metaplasia: Hay pérdida de las funciones especializadas 4) DISPLASIA EPITELIAL: Comprende pérdida en la uniformidad de células individuales así como de su orientación estructural. Se observa: Pleomorfismo celular y nuclear Núcleos hipercromáticos y anormalmente grandes Mitosis aumentadas normales y atípicas y fuera de lugar Queratinizaciones individuales (perlas de queratina) Falta de maduración celular Tipos de Displasia epitelial: LEVE MODERADA SEVERA Las displasias epiteliales pueden ser Reversibles o Irreversibles, SE CONSIDERAN PREMALIGNAS Clínicamente se observan como: Leucoplasias Eritroplasias Eritroleucoplasias Toda displasia epitelial en cavidad bucal debe eliminarse por completo porque la cavidad bucal es un lugar de constante irritación lo que puede aumentar el potencial de malignidad de la displasia epitelial B) Crecimientos neoplásicos: NEOPLASIA Griego Neo = nuevo Plasia = formar 5 Masa anormal de tejido cuyo crecimiento es excesivo e incoordinado con el crecimiento de los tejidos normales y persiste en la misma forma excesiva después del cese de los estímulos que produjeron el cambio. Se pierde la reacción a los controles de crecimiento normales. Son parásitos. Compiten con las células y tejidos normales. Para su crecimiento no dependen totalmente del ambiente local ni del estado nutricional del huésped. Algunas requieren de apoyo endócrino. ONCOLOGÍA Griego Onco = masa, tumor Logos = ciencia o tratado Es el estudio científico de los tumores. DIVISIÓN DE LAS NEOPLASIAS a) BENIGNAS b) MALIGNAS (Cáncer) a) NEOPLASIA BENIGNA: Sus características histológicas y macroscópicas no son peligrosas. No produce invasión (localizada). No produce metástasis (diseminación). Fácil eliminación quirúrgica. b) NEOPLASIA MALIGNA Sus características histológicas y macroscópicas son peligrosas. Producen invasión y destrucción. Producen metástasis. Difícil eliminación quirúrgica. COMPONENTES DE LAS NEOPLASIAS 1) PARÉNQUIMA Elemento esencial específico o funcional de un órgano. Formado de células neoplásicas en proliferación. Determina la actividad biológica de la neoplasia (naturaleza, crecimiento, evolución). Componente que le da el nombre a las neoplasias. 2) ESTROMA Tejido conjuntivo que forma la armazón, substancia fundamental o matriz de un órgano, con vasos sanguíneos, linfáticos y nervios. Lleva la irrigación sanguínea por lo que es importante para el crecimiento de los tumores. Determina la consistencia de las neoplasias. Desmoplasia (formación y desarrollo de tejido fibroso = dura). Cuando la neoplasia es blanda o carnosa es porque hay un estroma escaso. La formación de tejido de sostén es estimulada por las células parenquimatosas. 6 NOMENCLATURA DE LAS NEOPLASIAS A) BENIGNAS: 1) Neoplasias derivadas del mesénquima: Nombre de la célula parenquimatosa + Sufijo OMA * * * * * * Hueso Músculo Cartílago Grasa Colágeno Nervioso Osteocitos Osteoblastos Miocitos Leio = Liso, Rabdo = Estriado Condrocitos Lipocitos o Adipocitos Fibroblastos Neurona- Células de Schwann 2) Neoplasias epiteliales: El nombre depende de: Células de origen Arquitectura microscópica Patrones macroscópicos a) ADENOMA: patrón histológico glandular o derivados de glándulas con o sin patrón histológico glandular. c) PAPILOMA: prolongaciones digitiformes o verrucosas visibles micro o macroscópicamente. Ocurren en piel o mucosas. d) CISTOADENOMAS: forman masas quísticas voluminosas. Son frecuentes en el ovario. e) PÓLIPO: Excrecencia macroscópicamente visible, por encima de una superficie mucosa. Son frecuentes en el intestino. Pueden ser Benignos y malignos. B) MALIGNAS: 1) Derivadas de epitelio: Toda neoplasia maligna derivada de epitelio recibe el nombre de CARCINOMA. El término puede ser utilizado antecediendo al nombre del epitelio que se encuentre neoplásico. Ej: Carcinoma de células basales, o puede estar como sufijo. Ej: Hepatocarcinoma. Cuando es una glándula se puede nombrar como ADENOCARCINOMA. Ej. Adenocarcinoma Hepático o gástrico. En el caso de glándulas salivales algunos de los adenocarcinomas más comunes se nombran como: Carcinoma adenoquístíco, carcinoma mucoepidermoide, etc. 2) Derivadas del mesénquima: Nombre de la célula parenquimatosa + Sufijo SARCOMA. Ejemplo: Osteosarcoma, fibrosarcoma. En otras ocasiones se puede usar antecediendo al nombre del tejido o de la neoplasia. Ej: Sarcoma osteógeno o Sarcoma de Kaposi. OTROS TÉRMINOS: TERATOMA: Teras = Prodigio, monstruo Oma = Tumor Tumor complejo formado por tejidos múltiples que contienen a veces restos fetales, dientes, cabellos, etc. Constituido por diversos tipos de células parenquimatosas que representan más de un estrato germinativo. Surgen de células Pluripotenciales o totipotenciales. Teratoma Benigno: componentes bien diferenciados. Teratoma Maligno, inmaduro o potencialmente maligno: componentes poco diferenciados. 7 HAMARTOMA: Crecimiento desorganizado, pero localizado, de células maduras nativas del sitio particular donde se encuentran. Masa de tejido desorganizado, natural al sitio específico. No es una neoplasia. Es una anomalía de desarrollo. Características: Células maduras y normales Desorganización Propias del lugar Tienden a dejar de crecer, incluso algunas pueden tener regresión espontánea. CORISTOMA: Neoplasia o Anomalía congénita (¿?) que se desarrolla a partir de un área embrionaria desplazada. Resto ectópico o heterotópico de tejido normal. Se observa en lengua, sistema gastrointestinal, etc. CARACTERÍSTICAS GENERALES DE LAS NEOPLASIAS 1) DIFERENCIACIÓN Y ANAPLASIA: Diferenciación es el grado en que las células parenquimatosas se asemejan a las células normales que le dieron origen, tanto en el aspecto morfológico como funcional. Tumores bien diferenciados Tumores medianamente o moderadamente diferenciados Tumores poco diferenciados o Indiferenciados En general: Todos los tumores benignos están bien diferenciados, tienen aspecto normal y poca actividad mitótica. Los tumores malignos van desde bien diferenciados hasta Indiferenciados. Anaplasia ana = atrás plasia = formar Regresión de las células a una forma muy primitiva e indiferenciada. Es la desdiferenciación o pérdida de la diferenciación estructural y funcional de las células normales. Es característica de las células cancerosas. Es un rasgo que marca la malignidad de un tumor. Cambios morfológicos y funcionales Anaplásicos: Pleomorfismo: variación en tamaño y forma. Puede darse en las células o en los núcleos (pleomorfismo nuclear). Núcleos Hipercromáticos: por abundante DNA. Núcleos grandes. Núcleos con formas variadas (pleomorfismo nuclear). Acumulaciones de cromatina en grumos. Nucleolos grandes: actividad sintetizadora. Abundantes Mitosis atípicas: actividad proliferativa. Célula tumorales gigantes multinucleadas o mononucleadas. Pérdida de orientación. Pérdida de sus capacidades funcionales específicas. 8 2) RITMO DE CRECIMIENTO: Generalización: La mayoría de los tumores benignos crecen lentamente a lo largo de un período de años, mientras que la mayoría de tumores malignos crecen rápidamente, a veces a ritmo caprichoso y finalmente se diseminan y matan al organismo que los alberga. En general el índice de crecimiento de los tumores corresponde a su nivel de diferenciación, por lo que los tumores malignos crecen más rápidamente que las lesiones benignas. El aporte sanguíneo, la nutrición del individuo, la respuesta inmunológica y el ambiente endócrino, influyen en el crecimiento de las neoplasias. 3) INVASIÓN LOCAL – CÁPSULA Casi todos los tumores benignos crecen como masas localizadas que se expanden, rodeadas de una cápsula fibrosa. Cápsula: membrana de envoltura fibrosa que deriva en parte del estroma fibroso de los tejidos normales adyacentes al tumor y en parte es elaborada por el mismo tumor. Algunas neoplasias benignas no están encapsuladas y algunas neoplasias malignas tienen cápsula pero está invadida por el tumor. Los cánceres casi nunca están encapsulados y crecen mediante: Infiltración Invasión Destrucción Penetración progresiva de los tejidos circundantes. 4) METÁSTASIS: Son siembras tumorales separadas del tumor primario. Característica de los tumores malignos. Casi todos los cánceres son susceptibles de metastatizar. Se presentan más en cánceres agresivos, de crecimiento rápido y voluminosos. La diseminación metastásica puede ser: Siembra dentro de cavidades corporales. Diseminación linfática (Carcinomas) a Ganglios linfáticos. Diseminación Hematógena (Sarcomas): Pulmón e Hígado son los sitios anatómicos más frecuentes. ETIOLOGÍA DEL CÁNCER Etiología es la parte de la Medicina que tiene por objeto el estudio de las CAUSAS de las enfermedades. El cáncer puede ser producido por: 1. Carcinógenos Químicos 2. Carcinógenos Físicos (energía radiante) 3. Carcinógenos microbiológicos como Virus, hongos, etc. 1. CARCINÓGENOS QUÍMICOS Son de estructura diversa y pueden ser: Naturales o Sintéticos. Pueden reaccionar de forma directa o de forma indirecta cuando necesitan ser transformados (procarcinógenos que se convierten en Carcinógenos esenciales o Carcinógenos últimos). 9 Tienen átomos muy reactivos eléctricamente porque tienen átomos deficientes de electrones, que reaccionan contra átomos ricos en electrones: RNA, DNA, proteínas celulares. Agentes promotores: son agentes que poseen poca o ninguna actividad carcinógena, pero que al unirse con carcinógenos potentes, hacen que se incremente su acción. Cocarcinógenos: son carcinógenos que interactúan con los otros tipos de carcinógenos: microorganismos –radiaciones –químicos. Carcinógenos de acción directa: Son sustancias netamente carcinógenas que no requieren ninguna conversión metabólica. Su acción es débil Tienen poco riesgo de cáncer pero deben ser empleados con cuidado. Ejemplos: Agentes terapéuticos efectivos contra algunas enfermedades crónicas y diversos tipos de cáncer: ciclofosfamida, clorambucil, etc. Tienden a producir Leucemia. La forma de actuar es lesionando el ADN para eliminar a las células cancerosas. Carcinógenos de acción indirecta (Procarcinógenos): Son sustancias químicas que requieren conversión metabólica para hacerse activas, el resultado de esta conversión se denomina: Carcinógeno último o esencial. Son carcinógenos fuertes. Ejemplos: Hidrocarburos Aromáticos policíclicos: son los más potentes carcinógenos, se producen en la combustión del tabaco, principalmente cigarrillos, se encuentran en los llamados combustibles fósiles, proveniente de grasas animales (res, pollo, pescado) al asar o ahumar. Aminas aromáticas y colorantes azóicos (N): Añilina, colorantes de alimentos, etc. No producen cáncer en la zona de aplicación sino en la zona de liberación metabólica (hígado). Nitrosaminas y amidas: Se forman en el estómago por acción de los ácidos. Ej: Preservantes de alimentos. Humo de tabaco. Producen Ca. Gástrico, Intestino y otros sitios. Aflatoxina B (Aspergillus): granos y semillas mal almacenadas (Ca.. Hepático) Sacarina – ciclamatos: usados como edulcorantes. Asbesto: Ca. Broncógeno, gastrointestinal, mesotelioma. Se potencializa con el tabaco. Cloruro de vinilo: (Plásticos). Hemangiosarcma Hepático. Cromo, níquel y otros volátiles: Ca. Pulmonar. Insecticidas Medicamentos: Arsénico. 1. 2. MECANISMOS DE ACCIÓN DE LOS CARCINÓGENOS QUÍMICOS INICIACIÓN: Es la alteración genética (mutación) que se produce en las células o tejidos como resultado de la acción de los carcinógenos. La célula iniciada puede alterarse continuamente lo que aumenta la probabilidad de que evolucione el tumor. Es necesaria la presencia de un agente promotor para inducir proliferación celular. PROMOCIÓN: Un agente promotor es aquel que incrementa la respuesta carcinogénica al ser aplicado, en cantidades superiores a lo normal, sobre una célula iniciada. Ejemplos: fenoles, (alquitrán del tabaco) fenobarbital, sacarina, ciclamatos, hormonas, alcohol, etc. CÓMO ACTUAN: Casi todos los carcinógenos químicos son MUTÁGENOS, actuando sobre el DNA, RNA T Proteínas citoplásmicas, produciendo errores en la codificación de algunos genes (ONCOGENES), durante la transcripción y repilación. La carcinogenicidad depende de la dosis. La carcinogenicidad puede aumentarse en forma importante mediante la administración subsecuente de agentes promotores. Para que sea eficaz el promotor, debe ir después del iniciador. 10 La carcinogénesis comprende dos etapas: Iniciación – Promoción Pueden actuar juntos dos o más iniciadores (químicos, físicos, microbianos), para inducir transformación maligna. (Cocarcinogenia) 2. CARCINOGENESIS POR RADIACIÓN Energía Radiante: Rayos ultravioleta solares (UV). Radiación electromagnética (Rayos X, Gamma). Radiación de partículas (partículas alfa, beta, protones, neutrones). COMO ACTUAN: Mutación: Las radiaciones pueden causar muerte celular, las células sobrevivientes se estimulan para proliferar, pero con vulnerabilidad a influencias oncógenas. Los tumores aparecen luego de un período latente prolongado durante el cual se han desarrollado generaciones sucesivas de clonas. La iniciación por radiación generalmente es irreversible, pero a dosis bajas es reparable. Aún la radiación terapéutica (radioterapia) es carcinógena. (riesgo). 3. CARCINÓGENOS MICROBIOLÓGICOS: ONCOGÉNESIS VIRAL 1. Virus RNA Oncógenos: Virus Tipo I de la Leucemia Humana de Células T (HTLV-1): Leucemia, Linfoma de Células T. 2. Virus DNA Oncógenos: PAPILOMAVIRUS (Papilomas escamosos benignos (verrugas), Carcinoma de células escamosas del cuello uterino (Cérvix) y anogenital). VIRUS DEL EPSTEIN – BARR (Carcinoma Nasofaringeo, linfoma de Burkitt, Linfoma de células B, enfermedad de Hodgkin) VIRUS DE LA HEPATITIS B (Carcinoma Hepatocelular) EPIDEMIOLOGÍA DEL CÁNCER Ha contribuido al conocimiento de la etiología de algunos cánceres y de su distribución. MORTALIDAD Neoplasias Malignas Enfermedades Infecciosas GUATEMALA U.S.A. En Estados Unidos el Carcinoma Broncógeno, Prostático, Mamario y del Colon y Recto son los que causan mayor mortalidad. En Guatemala el carcinoma de pulmón, de estómago y de cérvix (cuello uterino), van en aumento. Factores Geográficos y Raciales: Capital de Guatemala y departamentos del Oriente y Sur: Hepatocarcinoma en Zacapa. Influencias ambientales, ocupacionales y culturales: Radiación ultravioleta: (Ca. de piel y labio) Asbesto: (Ca. de pulmón) Fabricación de plásticos: (Angiosarcoma Hepático) Cromo – Níquel: (Ca. Nasal, pulmonar, etc.) Nutrición: (25% de sobrepeso alta tasa de mortalidad por Ca. De Colon, etc.) Alcoholismo: (aumentan probabilidades de Ca. de orofaringe, laringe, esófago, hígado) Tabaquismo: (Ca. de Boca, faringe, laringe, esófago, páncreas, vejiga, pulmón) 11 Conducta sexual: (Ca. de cérvix) Edad: Frecuencia aumentada con la edad: 55 a 75 años. Niños y jóvenes: Leucemia, neoplasias del sistema nervioso central, Linfomas, etc. Herencia: Solo en pocos casos se han identificado influencias genéticas bien definidas de cáncer. Los cánceres asociados a herencia son: mamario, colon, ovario, próstata, útero y melanoma. Cuando hay antecedentes familiares el riesgo es 3 veces mayor que la población general. TRASTORNOS PRENEOPLÁSICOS ADQUIRIDOS Sinónimo: Trastornos precancerosos, trastornos premalignos o potencialmente malignos. Son enfermedades o trastornos clínicos que predisponen al desarrollo de una neoplasia maligna o que tienen probabilidades de desarrollar una neoplasia maligna. Se puede observar baja, mediana o alta probabilidad de desarrollar cáncer. Principales padecimientos preneoplásicos: Replicación celular regenerativa persistente: Ca. de células escamosas (heridas sin cicatrizar o irritación constante) Proliferaciones Hiperplásicas, displásicas y metaplasias atípicas (Ca. Broncógeno y Endometrial) Otros: Gastritis crónica atrófica: (Ca. Gástrico) Colitis ulcerativa crónica (Ca. Colon o recto) Leucoplasias, eritroplasias, eritro-leucoplasias en cavidad bucal, vulva o pene (Ca. Cel. Escamosas) Trastornos Neoplásicos: Adenomas del colon (Cáncer de colon y recto). LA GENÉTICA Y EL CÁNCER: Los genes son instrucciones heredadas que forman regiones dentro de las moléculas de ADN. Cada gen permite que la célula produzca un producto específico (proteínas). Los genes se pueden alterar o "mutar" de varias formas. Los genes residen dentro de moléculas grandes de ADN, las cuales están compuestas por dos cadenas químicas enrolladas alrededor de sí mismas para formar una "doble hélice". Cada cadena está formada por millones de bloques químicos de construcción llamados "bases". El ADN solamente contiene cuatro bases diferentes (abreviadas A, T, G y C), pero pueden estar arregladas en cualquier secuencia. El orden secuencial de las bases en cualquier gen dado determina el mensaje que el gen contiene. Las mutaciones en los genes que controlan la proliferación de células normales pueden conducir al cáncer. Estas mutaciones pueden ser producidas por los carcinógenos dañinos del ADN Algunas mutaciones que causan el cáncer son simplemente errores espontáneos que aparecen en las moléculas normales de ADN cuando las células duplican su ADN antes de que se dividan. PROTOONCOGENES: Son Genes promotores del crecimiento. Los protooncogenes son una familia de genes normales que codifican principalmente a las proteínas involucradas en el mecanismo de control del crecimiento normal de las células. ONCOGENES Cuando los protooncogenes se transforman por acción de los carcinógenos se forman los ONCOGENES los cuales darán lugar a las células cancerosas. Los oncogenes contribuyen al desarrollo del cáncer dando instrucciones a las células para que produzcan proteínas que estimulen la división y el crecimiento excesivo de células. Cuando aparecen oncogenes en las células normales, éstos pueden causar que las células se conviertan en malignas. Los oncogenes 12 codifican versiones alteradas (o cantidades excesivas) de las proteínas de control de crecimiento, alterando de esta manera el mecanismo de señalamiento de crecimiento de las células. GENES REGULADORES NORMALES Genes supresores del tumor (Antioncogenes): Genes que regulan la muerte celular programada (Apoptosis) Genes reparadores del DNA dañado. a) GENES SUPRESORES DEL TUMOR (ANTIONCOGENES): Son una familia de genes normales que ordenan a las células a producir proteínas que restringen el crecimiento y la división de células. Evitan que se formen tumores, eliminando los Oncogenes. Pueden heredarse. Los cancerígenos y algunos tumores inhiben a estos genes. La pérdida de estas proteínas permite que las células crezcan y se dividan de forma incontrolada. b) GENES QUE REGULAN LA MUERTE CELULAR PROGRAMADA: Un tipo de gen supresor del tumor codifica la proteína llamada “p53" la cual puede provocar el suicidio de células (apoptosis). La proteína p53 detiene el crecimiento y la división de las células que han sufrido daño en su ADN. Si no se puede reparar el daño, la proteína p53, con el tiempo, iniciará el suicidio celular (APOPTOSIS), previniendo así el crecimiento descontrolado de las células genéticamente dañadas. c) GENES REPARADORES DEL DNA DAÑADO: Estos genes codifican proteínas cuya función normal es corregir errores que surgen cuando las células duplican su ADN antes de dividirse. Las mutaciones en los genes reparadores de ADN pueden conducir a: Fracaso en la reparación del ADN. Permite mutaciones subsecuentes en los genes supresores del tumor. Y por lo tanto: Acumulación de protooncogenes y oncogenes. DEFENSA DEL HUESPED CONTRA TUMORES (INMUNIDAD TUMORAL) Sistema Inmune Transformación maligna ----------Alteración genética ----------- Proteína extrañas Ag. TIPOS DE ANTÍGENOS: 1. Antígenos Específicos del tumor: Son aquellos que están presentes únicamente sobre las células tumorales. Son pocos, pero muy potentes. Detectados por Linfocitos T citotóxicos (CD4 – CD8). 2. Antígenos Relacionados con Tumor: (Antígenos específicos de diferenciación). Son aquellos que están presentes tanto en las células tumorales como en las células normales y transformadas a partir de las cuales se originó el tumor. Son débiles y abundantes. MARCADORES TUMORALES Los marcadores tumorales son sustancias antigénicas, generalmente protéicas, que se encuentran en el cuerpo cuando hay presencia de cáncer. Éstos se encuentran más comúnmente en la sangre y a veces en la orina, aunque también pueden estar en los tumores y otros tejidos. Pueden ser productos de las mismas células cancerosas, o ser producidos por el cuerpo en respuesta al cáncer por lo que pueden ser antígenos específicos del tumor o relacionados con el tumor, aunque la mayoría pertenecen al segundo grupo. Existen muchos diferentes marcadores tumorales. Algunos son vistos en un solo tipo de cáncer, mientras que otros pueden encontrarse en varias neoplasias malignas. Para probar la presencia de un marcador tumoral se envía una muestra de sangre u orina del 13 paciente a un laboratorio. El marcador normalmente es identificado al combinar la sangre u orina con anticuerpos sintéticos que reaccionan con la proteína del marcador tumoral. En ocasiones se somete a prueba una muestra del tumor en sí para verificar la presencia de los marcadores tumorales. Por muchas razones, los marcadores tumorales por sí solos no son suficientes para el diagnóstico de cáncer. La mayoría de los marcadores tumorales pueden ser producidos por las células normales, al igual que las cancerosas. En ocasiones, las enfermedades no cancerosas también pueden causar que los niveles de ciertos marcadores tumorales se incrementen más de lo normal. Y puede ser que no todas las personas con cáncer presenten niveles elevados de algún marcador tumoral en particular. Por estas razones, sólo unos cuantos marcadores tumorales se usan comúnmente por la mayoría de los médicos. Cuando un médico observa el nivel de algún marcador tumoral, lo considerará junto con el historial del paciente y su revisión física general, así como con los otros análisis de laboratorio y estudios de imágenes para poder emitir un diagnóstico certero. Uno de los usos más importantes de los marcadores tumorales es para el seguimiento de pacientes que están siendo tratados contra el cáncer, especialmente en la etapa avanzada de la enfermedad. Si un marcador tumoral está disponible para un tipo específico de cáncer, es mucho más fácil medir y llevar un seguimiento del marcador para ver si el tratamiento está funcionando en lugar de tener que repetir a menudo las otras pruebas diagnósticas. Los marcadores tumorales también son usados para observar la posible recurrencia de cáncer tras el tratamiento inicial. Desventajas: a) La mayoría no son efectivos para el diagnóstico inicial del cáncer, son solo auxiliares para el diagnóstico, debiéndose utilizar otras pruebas, principalmente la biopsia. Uno de los marcadores tumorales más confiables es el antígeno prostático específico (PSA) para cáncer prostático. b) Se presentan con cierta frecuencia los resultados falsos positivos y falsos negativos. C) No todos los cánceres tienen marcadores tumorales. INMUNIDAD HUMORAL Y MEDIADA POR CELULAS Inmunidad Celular: Participa en la destrucción de células tumorales mediante dos mecanismos: Activación del complemento y la inducción de Citotoxicidad celular dependiente de anticuerpos. 1. LINFOCITOS T CITOTÓXICOS: Se sensibilizan y actúan principalmente contra tumores producidos por virus. 2. CÉLULAS ASESINAS NATURALES: Son células que pueden actuar sin sesibilización previa. Constituyen la primera línea de defensa contra tumores. Pueden participar en la citotoxicidad celular dependiente de anticuerpos. 3. MACRÓFAGOS: Activados por Linfocitos T y Células asesinas naturales. Produce lisis y citotoxicidad contra algunas células tumorales. VIGILANCIA INMUNOLOGICA Es el reconocimiento y destrucción de células tumorales extrañas en el momento de su aparición. Poco efectiva. Se ha observado que un buen porcentaje de las personas con inmunodeficiencias congénitas, adquiridas (SIDA o pacientes con transplantes) desarrollan cáncer (Linfomas). ACCIÓN DE LOS TUMORES SOBRE LA VIGILANCIA INMUNOLÓGICA: Las células tumorales tienen la capacidad de deprimir el sistema inmunológico (inmunosupresión) 14 No permite la activación o sensibilización e incluso puede causar necrosis a los linfocitos T citotóxicos Crecimiento selectivo de variantes antígeno-negativas. Crecen tanto (numéricamente) que el sistema inmunológico no es capaz de destruirlas. INMUNOTERAPIA (ver anexo) Tiene como fin restituir los componentes suprimidos del sistema inmunológico o estimular respuestas endógenas. Se usan: linfocitos activados, citocinas y anticuerpos. FORMACIÓN DEL CÁNCER La formación de una célula cancerosa requiere que: •Se inhiban los genes supresores de tumor para permitir CRECIMIENTO CELULAR. Y •Que se activen los aceleradores para el crecimiento celular neoplásico (oncogenes). PROGRESIÓN TUMORAL Periodo en el que un tumor inicia un crecimiento mayor que el normal y se disemina con más facilidad. CARACTERÍSTICAS CLÍNICAS DE LAS NEOPLASIAS 1. Efectos del tumor sobre el huésped: Obstrucción o destrucción de estructuras importantes por su LOCALIZACION. Actividad funcional: producción de hormonas. Ulceración: puede producir hemorragias, infecciones secundarias. 2. Caquexia: Síndrome de desgaste que con frecuencia aparecen en las etapas terminales del cáncer o en enfermedades crónicas debilitantes que consiste en: Pérdida progresiva de la grasa y de la masa corporal magra Debilidad progresiva Anorexia con aumento en el gasto de calorías y de la tasa metabólica basal Malestar general Anemia grave 3. Síndromes Paraneoplásicos: Síntomas complejos que se presentan en 10 a 15% de pacientes con cáncer. En algunos casos se deben a que el tumor tiene la capacidad de producir hormonas ectópicamente o substancias que simulan hormonas. Los síndromes mas comunes son: hipercalcemia, Síndrome de Cushing, hipercoagulabilidad que da lugar a endocarditis trombótica no bacteriana. Y en su mayoría son producidos en cáncer broncógeno y mamario y procesos hematológicos malignos. Importancia de los Síndromes Paraneoplásicos: Importante para el Diagnóstico: Pueden ser la manifestación inicial de una neoplasia oculta. Pueden producir problemas clínicos importantes que pueden causar hasta la muerte. Pueden simular que son otras enfermedades o lesiones metastásicas por lo que confunden y retrasan el tratamiento para la verdadera neoplasia. FASES DEL CÁNCER: 1. Fase prediagnóstica 2. Fase diagnóstica 3. Fase inicial de tratamiento: cirugía, radioterapia, quimioterapia, inmunoterapia 15 4. Fase de seguimiento 5. Recurrencia y fase de retratamiento 6. Fase paliativa o terminal a) b) CLASIFICACIÓN DEL CÁNCER El pronóstico de pacientes con carcinoma bucal de células escamosas depende de: Sub-tipo histológico (grado) Extensión clínica del tumor (etapa) CLASIFICACIÓN POR GRADOS: El grado del tumor se determina mediante examen microscópico según sea la diferenciación de las células tumorales. Un tumor mientras mejor diferenciado sea tiene mejor pronóstico. Establece una aproximación de la agresividad del cáncer o el grado de malignidad según la diferenciación citológica de las células tumorales y el número de mitosis dentro del tumor. Grado I, II, III, IV con anaplasia progresiva. CLASIFICACIÓN TNM Y POR ETAPAS Sistema numérico que se basa en: El Tamaño de la lesión primaria “T” El grado de propagación de ésta a ganglios (nódulos) linfáticos “N” La presencia o ausencia de metástasis distantes. “M” Se realiza haciendo examen clínico, radiográfico y a veces exploración quirúrgica. T = Tamaño del tumor T1: Tumor menor de 2 cms. de diámetro T2: Tumor de 2 – 4 cms. de diámetro. T3: Tumor mayor de 4 cms. de diámetro T4: Tumor que invade estructuras adyacentes N = Ganglios linfáticos N0: Ganglios no palpables N1: Ganglios palpables ipsilaterales (homolaterales) N2: Ganglios palpables contralaterales o bilaterales N3: Ganglios palpables fijos M = Metástasis M0: Sin metástasis a distancia M1: evidencia clínica o radiográfica de metástasis ETAPAS: (AJC) Etapa I: T1, N0, M0 Etapa II: T2, N0, M0 Etapa III: T3, N0, M0 T1, N1, M0 T2, N1, M0 T3, N1, M0 Etapa IV: T1, N2, M0 T2, N2, M0 T3, N2, M0 T1, N3, M0 T2, N3, M0 T3, N3, M0 T4, N0, M0 Todo paciente con M1 Las clasificaciones sirven para: ESTABLECER EL PRONÓSTICO SELECCIÓN DEL TRATAMIENTO MAS ADECUADO 16 BIBLIOGRAFÍA: 1) 2) 3) PATOLOGIA ESTRUCTURAL Y FUNCIONAL DE ROBBINS Y COTRAN. Kumar, Vinar, Abul Cavas, Nelson Fausto. 7ª edición, editorial Saunders, Elsevier, España, 2005. 1517 pp PATOLOGÍA BUCAL. W. SHAFER., B.M LEVY. 4TA EDICIÓN, INTERAMERICANA, MÉXICO 1988. http://www.cancer.org/docroot/ESP/content/ESP_2_1x_Marcadores_tumorales.asp ANEXO INMUNOTERAPIA La inmunoterapia es un método de tratamiento del cáncer que utiliza sustancias que estimulan al sistema inmunitario del cuerpo. El objetivo fundamental que persigue la inmunoterapia es superar los mecanismos de escape, restituir la disponibilidad de los antígenos a los linfocitos T citotóxicos y células presentadoras de antígeno y restaurar la función de estas células y los linfocitos T. En los últimos años se han desarrollado diferentes clasificaciones de inmunoterapia en el tratamiento del cáncer: Inmunoterapia pasiva: Inespecífica: Transferencia de células mononucleares activadas con citocinas (células LAK) Específica: Anticuerpos monoclonales Transferencia de linfocitos infiltrantes de tumor (TIL) Inmunoterapia activa Inespecífica: Inducción de respuesta inmune de manera inespecífica. Específica: Inducción de respuesta inmune contra uno o más antígenos tumor específicos (Vacunas). Otros agentes inmunoterapéuticos son: Transferencia de células preestimuladas in vitro con antígenos tumorales y citocinas; Anticuerpos monoclonales; Citocinas recombinantes (solas o en combinación con otros agentes); Hormonas tímicas; Terapia génica y Vacunas. Transferencia de células preestimuladas in vitro con antígenos tumorales y citocinas Aunque existen diferentes tipos de células inmunes que pueden ser consideradas para su uso en este tipo de inmunoterapia, los linfocitos autólogos infiltrantes de tumor han sido el foco de la mayoría de las investigaciones clínicas. Anticuerpos monoclonales La inmunoterapia pasiva implica, como se menciona anteriormente, la administración de anticuerpos monoclonales capaces de mediar citotoxicidad. Los anticuerpos monoclonales tienen dos formas fundamentales de aplicación: (1) inyección de anticuerpos monoclonales humanos directamente en el tumor, o sea, administración intralesión; o (2) administración sistémica de anticuerpos murinos o quiméricos. Actualmente se combinan los anticuerpos monoclonales, en bajas dosis, con quimioterapia o radioterapia resultando potenciadores de estos tratamientos. También se están ensayando toxinas de origen animal o vegetal, fármacos antineoplásicos o isótopos radioactivos asociados a anticuerpos monoclonales, bien directamente o en forma de liposomas; estos inmunoconjugados pueden concentrar el agente citotóxico selectivamente sobre las células tumorales. Citocinas Las citocinas deben ser administradas sistemáticamente en grandes cantidades para que puedan alcanzar, a nivel del entorno celular local, las concentraciones adecuadas que le permitan llevar a 17 cabo su acción efectora. Estas dosis tan elevadas producen efectos tóxicos y marcan los límites de su utilización terapéutica. Gracias a la ingeniería genética se dispone de la mayoría de las citocinas en forma recombinante, lo que ha facilitado en gran medida su utilización terapéutica, por dos motivos principales, su disponibilidad en forma pura y la posibilidad de fabricarla en cantidades ilimitadas. Los principales efectos secundarios de la terapia son: mielosupresión (64% de neutropenia febril y 48% de bacteriemia), náuseas, vómitos, anorexia, retención de fluidos e hipotensión. Debido a estas razones, en la actualidad se evalúan drogas que disminuyan los efectos tóxicos de estas citocinas sin afectar sus efectos terapéuticos y que permitan utilizar dosis incluso superiores a las máximas establecidas. Terapia génica La respuesta antitumoral del sistema inmune del huésped puede ser mejorada mediante la introducción de genes en los efectores de la inmunidad celular o en las células tumorales. Hormonas tímicas Los ensayos clínicos con hormonas y factores tímicos en cáncer, inmunodeficiencias y enfermedades autoinmunes, han revelado su efecto inmunomodulador. Estos factores no solo, potencian la acción de las citocinas y de las drogas utilizadas en los tratamientos quimioterapéuticos, sino que reducen la toxicidad hematológica asociada a estos tratamientos. Vacunas antitumorales A diferencia de las vacunas contra enfermedades infecciosas, que son administradas profilácticamente, las vacunas de cáncer son generalmente administradas después de la aparición de la enfermedad. Ambos tipos de vacunas utilizan células completas atenuadas, paredes celulares o antígenos específicos para estimular al sistema inmune del paciente a luchar contra la enfermedad. Aunque todavía están en fase experimental las vacunas han demostrado ser la estrategia inmunoterapéutica más efectiva con un mayor aumento de la supervivencia media de los pacientes(desde los 6-9 meses a los 23 meses), sin efectos tóxicos notables. Entre las vacunas que han mostrado mayor efectividad están: Canvaxin, Melacine, GMK y M-Vax