Energía calorífica 3
Anuncio

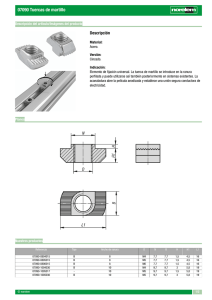
FICHA nº CURSO: 4º ESO MATERIA: Calorimetría. Aprovechamiento de la E.Calorífica FECHA: ALUMNO/A: NOTA: 1. Calorimetría Es la parte de la física que estudia la forma de medir el calor transferido entre los sistemas. Esta medida se hace con un calorímetro(fig.1) que es un instrumento que permite la transferencia de calor entre sistema y alrededores tomado como un entorno único aislado del exterior. Se basa en que dos sustancias (sistema y alrededores) con diferentes temperaturas, alcanzan al cabo de determinado tiempo el equilibrio térmico. De tal forma que el calor transferido por el cuerpo a mayor temperatura (Qc) es recibido por la sustancia a menor temperatura (Qa), si se impide cualquier pérdida o se evalúan éstas conociendo la capacidad calorífica del calorímetro. Si la temperatura de equilibrio es tf, y la del sistema t2 y alrededores t1, tal que t2>t1 como se aprecia en la afig1, se cumplirá que: Qc=m2Ce2(t2-tf) = Qa = m1Ce1(tf-t1) Así, si se conocen las masas y se miden las temperaturas, se podrá determinar un calor específico de una de ellas si se conoce el de la otra. Un tipo de calorímetro, especialmente hermético se denomina bomba calorimétrica. Fig.1 2. Determinación del calor específico de una tuerca (para hacer en el laboratorio) El objetivo de la práctica será la determinación del calor específico de una tuerca formada por una aleación de hierro y carbono, por el método de las mezclas puesto en práctica por Fig.2 Lavoisier y Laplace a finales del XVIII. De esa forma a partir del calor que puede ceder, cuando está a t2 (tª elevada, hasta el punto de ebullición del agua), a una determinada masa de agua a la temperatura ambiente ( t1), hasta alcanzar la temperatura final tf. Q absorbido por el agua = m(agua). Ce agua (tf-t1), con el Q cedido por la tuerca, Qc=m(tuerca). Ce(tuerca). (t2-tf) relacionando el calor absorbido por el agua, con la masa de las tuercas y su diferencia de temperaturas; dicha relación será el calor específico de las tuercas. C específico de tuerca = m (agua). C específico del agua.(tf-t1) / m (tuerca). (t2-tf) Tomando datos con diferentes masas de tuercas, se puede realizar la gráfica, disponiendo en el eje Y los valores del calor absorbido por el agua, y en el eje X los de masa (tuercas). (t2-tf). La pendiente será el calor específico pedido. Realización Un alumno(A) medirá en la probeta 100/200ml de agua,(m1 = 0,100/0,200kg) disponiéndolos en el vaso de precipitados interior, introducirá la sonda midiendo y apuntando la temperatura t1 ,después otro (B) irá por orden (1,2,3 ....14), hasta la mesa del profesor, donde se encuentra el sistema a mayor temperatura t2 (que indicará el profesor), tomando las tuercas por el cordelito, introduciéndolas rápidamente en el vaso interior del calorímetro, agitando con la varilla , y tomando la temperatura final ( tf ) en un tiempo entre medio y minuto y medio según el número de tuercas. Se tabulan los datos, teniendo en cuenta que ce=4180 J/kg Tuercas 2 6 8 10 12 14 16 18 20 22 1 2 m/kg t1/ºC 0,0094 0,0283 0,0374 0,0471 0,0563 0,0652 0,0751 0,0851 0,0931 0,102 3 tF/ºC 4 tF-t1/ºC 5 6 m1ce(tF-t1) t2-tF/ºC 7 m2(t2-tF) Se representa la columna 5 frente a la 7. La pendiente de la recta será el calor específico 3. Aplicación del método de las mezclas. Fórmulas y método: Si un sistema aumenta o disminuye su temperatura: Q= m ce )t Si un sistema toma o desprende energía para cambiar de estado Q=m8- El calor absorbido o desprendido tomará ambas fórmulas si lo precisa. En el equilibrio Qa=Qd conviene marcar todos los pasos y emplear las gráficas q/t. Así si se mezcla m1 de hielo a -15ºC, con m2 de agua a 80ºC, la temperatura de la mezcla será gráficamente tf, y su plateo gráfico el de la fig. 3 FICHA nº CURSO: 4º ESO MATERIA: Calorimetría. Aprovechamiento de la E.Calorífica FECHA: ALUMNO/A: NOTA: Ejemplo Dispones de 100g de agua (ce=4180 J/ºC.kg) a 35ºC, y le echas un cubito de hielo (ce=2060J/ºC.kg) de 10 g, recién sacado del congelador a -10ºC. Si 8F=330.000J/kg ¿Cuál será la temperatura final de la mezcla? Sistema a temperatura alta = 100g de agua a 35º Cede Qc= 0,1 kg. 4180 J/ºC kg (35- tf)ºC=14630J – 418tf Sistema a temperatura baja= 10g de hielo a -10ºC Absorbe calor para subir hasta hielo a 0ºC = 0,010kg. 2060J/ºCkg. 10ºC=206J Absorbe calor para fundirse = 0,010kg. 330.000 J/kg=3300J Absorbe calor para calentarse hasta la tf = 0,010kg.4180J/kgºC(tf-0)=41,8tf. Al igualar Qc = Qa , 14630J – 418tf J/ºC= 206J+3300J+41,8tf J/ºC ; tf = 11124/459,8 =24,2ºC ACTIVIDAD 1 Determina la temperatura final de la mezcla: 100g de hielo a -5ºC y 200g de agua a 50ºC toma los datos del ejemplo ACTIVIDAD 2 Si a 100g de café con leche a 20ºC, en una cafetería se le agrega 5g de vapor de agua a 100ºC, ¿Cuál será la temperatura final de la mezcla?. Toma el café con leche como si fuera agua. Calor de vaporización del agua = 2250 kJ/kg. ACTIVIDAD 3 Cuántos gramos e vapor de agua, habrá que introducir en 80g de café a 15ºC, para la mezcla alcance los 30ºC ACTIVIDAD 4 Pides en una cafetería un café cortado. Primero sirven 50cc de una taza de café sólo a 20ºC, la pasan por el vaporizador de agua a 100ºC, echando 1g de vapor, y luego le echas un chorrito de leche (10g) caliente a 50º .Identifica el sistema a mayor temperatura, y el sistema a menor temperatura. Identifica el calor cedido y el calor absorbido. Cuál será la temperatura final del café cortado?. Densidad de la disolución de café= 1g/cm3. Calor específico de las disoluciones=4180 J/kg ºC. Calor de vaporización del agua 2250 kJ/kg.