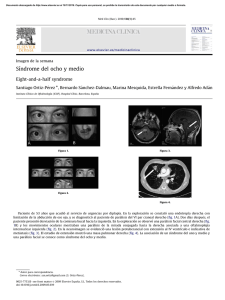
Aunque la patogenia del SGB permanece desconocida, hay
Anuncio

Documento descargado de http://www.elsevier.es el 21/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. 420 Cartas cientı´ficas / Med Clin (Barc). 2014;142(9):418–421 Aunque la patogenia del SGB permanece desconocida, hay evidencias que favorecen una base inmunológica, implicando tanto la respuesta humoral como celular7. Modelos animales de colitis han sugerido el papel crucial de la flora entérica, que activa el sistema inmunitario asociado al intestino contra antı́genos bacterianos, y consecuentemente contra la mucosa del colon por similitud molecular. Algunos de estos antı́genos colónicos son compartidos por otros órganos, aportando una base patogénica inmunomediada de las manifestaciones extraintestinales en individuos genéticamente predispuestos. La expresión de moléculas de adhesión endotelial, usualmente restringidas al intestino, permite el reclutamiento de células T hacia otros órganos, donde promueven el desarrollo de una inflamación crónica, pudiendo contribuir a la base patofisiológica de dichas manifestaciones extraintestinales3,9,10. La presencia de las 2 entidades simultáneamente en nuestro paciente evidencia un mecanismo patogénico común. Con este caso queremos significar una manifestación extraintestinal poco frecuente, que se puede producir en fase de exacerbación de la CU y cuyo reconocimiento y tratamiento precoz puede condicionar la evolución del paciente, evitando las complicaciones que la enfermedad neurológica podrı́a ocasionar. Bibliografı́a 1. Su CG, Judge TA, Lichtenstein GR. Extraintestinal manifestations of inflammatory bowel disease. Gastroenterol Clin North Am. 2002;31:307–27. 2. Bermejo PE, Burgos A. Complicaciones neurológicas de la enfermedad inflamatoria intestinal. Med Clin (Barc). 2008;130:666–75. 3. Lossos A, River Y, Eliakim A, Steiner I. Neurologic aspects of inflammatory bowel disease. Neurology. 1995;45:416–21. 4. Elsehety A, Bertorini TE. Neurologic and neuropsychiatric complications of Crohn’s disease. South Med J. 1997;90:606–10. 5. Bernstein CN, Wajda A, Blanchard JF. The clustering of other chronic inflammatory diseases in inflammatory bowel disease: A population-based study. Gastroenterology. 2005;129:827–36. 6. Gondim FA, Brannagan TH, Sander HW, Chin RL, Latov N. Peripheral neuropathy in patients with inflammatory bowel disease. Brain. 2005;128:867–79. 7. Van Doorn PA, Ruts L, Jacobs BC. Clinical features, pathogenesis and treatment of Guillain-Barré syndrome. Lancet Neurol. 2008;7:939–50. 8. Krystallis CS, Kamberoglou DK, Cheilakos GB, Maltezou MN, Tzias VD. GuillainBarré syndrome during a relapse of ulcerative colitis: A case report. Inflamm Bowel Dis. 2010;16:555–6. 9. Adams DH, Eksteen B. Aberrant homing of mucosal T cells and extraintestinal manifestations of inflammatory bowel disease. Nat Rev Immunol. 2006;6:244– 51. 10. Singh S, Kumar N, Loftus E, Kane SV. Neurologic complications in patients with inflammatory bowel disease: Increasing relevance in the era of biologics. Inflamm Bowel Dis. 2013;19:864–72. Eduardo Rubio-Nazábala,*, Purificación Álvarez-Pérezb, Teresa Lema-Facala y Antonio Brage-Varelac a Servicio de Neurologı´a, Complejo Hospitalario Universitario de A Coruña (CHUAC), A Coruña, España b Medicina de Familia, Centro de Salud del Ventorrillo, A Coruña, España c Servicio de Digestivo, Complejo Hospitalario Universitario de A Coruña (CHUAC), A Coruña, España * Autor para correspondencia. Correo electrónico: [email protected] (E. Rubio-Nazábal). http://dx.doi.org/10.1016/j.medcli.2013.04.009 Sı́ndrome opercular anterior epiléptico en un adulto Epileptic opercular syndrome in an adult patient Sr. Editor: El sı́ndrome opercular anterior (SOA) o sı́ndrome de FoixChavany-Marie constituye la forma cortical de la parálisis seudobulbar. Se debe a la afectación de la región anterior de ambos opérculos rolándicos. Clı́nicamente se manifiesta con disartria grave y diplejı́a faciofaringoglosomasticatoria por la interrupción bilateral de las vı́as que conectan las áreas de la corteza motora con los núcleos de los pares craneales V, VII, IX, X y XII del troncoencéfalo. Es caracterı́stica la disociación automáticovoluntaria, con abolición de los movimientos voluntarios y preservación de la mı́mica emocional o automática1. El SOA epiléptico es muy infrecuente y casi exclusivamente se describe en niños2,3. Se presenta el caso de un paciente adulto con SOA transitorio tras un estado epiléptico convulsivo generalizado. Se trata de un varón de 45 años con antecedente de diabetes dependiente de insulina. Diez meses antes ingresó en otro centro por estado epiléptico generalizado, siguiendo desde entonces tratamiento con levetiracetam 2 g/dı́a, permaneciendo libre de crisis. Ingresó en nuestro centro tras ser encontrado inconsciente en su domicilio, con Glasgow 4 y convulsiones generalizadas, sin poder precisar el tiempo de inicio. Se procedió a intubación orotraqueal y ventilación mecánica, ingresando en la Unidad de Cuidados Intensivos. A su ingreso presentaba Glasgow 3 bajo efecto de sedación, PA 90/50 mmHg, Ta 39 8C y úlcera por presión en pómulo derecho y ambas rodillas, siendo el resto de la exploración neurológica y general normal. Tras tratamiento con benzodiacepinas y fenitoı́na sin respuesta, se indujo coma barbitúrico con tiopental sódico durante 48 h. Los recuentos hematológicos, valores bioquı́micos, VSG, coagulación, orina elemental y sedimento, ECG, Rx tórax, TAC cerebral con contraste y punción lumbar fueron normales, salvo ácido láctico de 5,0 mmol/l y creatinfosfocinasa de 1.075 UI/l. El EEG mostró actividad de fondo muy artefactada, con lentificación generalizada y ondas agudas intercaladas de predominio izquierdo. Extubado 48 h después, despertó progresivamente hasta la recuperación completa, con nivel de consciencia normal, correcta comunicación, hemodinámicamente estable, sin crisis epilépticas y con exploración general y neurológica normal, manteniéndose tratamiento con levetiracetam 2,5 g/dı́a. Tres dı́as después comenzó con un cuadro rápidamente progresivo de disfagia, que precisó nutrición enteral, y alteración del habla, sin crisis epilépticas clı́nicas ni cambios en el EEG, por lo que se solicitó valoración neurológica. En la exploración estaba alerta, con comprensión del lenguaje normal, marcada sialorrea, paresia facial inferior bilateral y anartria, sin otra focalidad. Era incapaz de ejecutar actos motores a la orden o por imitación, como protruir la lengua, soplar, mostrar los dientes o abrir y cerrar la boca, manteniendo intactos movimientos automáticos como bostezar o sonreı́r al ver a sus familiares. Se realizó nueva punción lumbar, TAC cerebral, RMN cerebral con gadolinio, determinación de analı́tica general, vitamina B12, ácido fólico, hormonas tiroideas, autoinmunidad, anticuerpos antineuronales, cortisol basal, serologı́a para lúes, VIH, Borrelia, hepatitis B y C, y PCR de virus neurotropos, sin alteraciones. En los dı́as siguientes presentó mioclonı́as aisladas y posteriormente movimientos clónicos continuos en las extremidades derechas, sin cambios en la exploración. El EEG evidenció nuevamente actividad de fondo lentificada con grafoelementos agudos en la región frontotemporal izquierda. Se aumentó la dosis de levetiracetam a 3 g/dı́a y se inició perfusión intravenosa de valproato sódico, con Documento descargado de http://www.elsevier.es el 21/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. Cartas cientı´ficas / Med Clin (Barc). 2014;142(9):418–421 desaparición de las crisis y recuperación progresiva del cuadro neurológico, permaneciendo asintomático y con exploración normal a las 72 h del inicio de tratamiento con valproato. Actualmente sigue tratamiento con levetiracetam 3 g/dı́a y lamotrigina 300 mg/dı́a, tras retirar valproato por intolerancia, permaneciendo asintomático. Las lesiones isquémicas que afectan ambos opérculos rolándicos son la causa más frecuente del SOA en adultos4. También puede ser consecuencia de procesos degenerativos5 o infecciosos6, sin embargo, como manifestación de una epilepsia es extremadamente infrecuente7–9. El mecanismo subyacente no está plenamente establecido, ya que no existe una clara correlación electroclı́nica. El patrón electroencefalográfico es inespecı́fico; se han comunicado casos de SOA epiléptico con anomalı́as epileptiformes exclusivamente unilaterales8, con descargas continuas compatibles con estado epiléptico generalizado7, o incluso sin evidencia de actividad epiléptica cortical, como en el caso de SOA asociado a un estado mioclónico descrito por Thomas et al.9. Clı́nicamente puede aparecer de forma aislada o asociado a crisis parciales o generalizadas. En ausencia de crisis clı́nicas, el diagnóstico de SOA epiléptico puede ser difı́cil. En el caso que se presenta, no se consideró la epilepsia como etiologı́a del sı́ndrome, dada la ausencia de crisis epilépticas aparentes y de cambios significativos en el EEG, mostrando descargas epileptiformes unilaterales, por lo que los estudios diagnósticos se dirigieron a descartar otras causas más comunes. La resolución del cuadro neurológico tras instaurar tratamiento con valproato por la aparición de crisis parciales motoras continuas fue lo que llevó al diagnóstico de SOA de origen epiléptico. El SOA secundario a una actividad epiléptica no controlada responde favorablemente al tratamiento, por ello, a pesar de su escasa frecuencia, deberı́a considerarse esta posibilidad etiológica http://dx.doi.org/10.1016/j.medcli.2013.04.016 421 en aquellos pacientes adultos con SOA en los que los estudios diagnósticos no muestran alteraciones. Bibliografı́a 1. Mao CC, Coull BM, Golper L, Rau MT. Anterior operculum syndrome. Neurology. 1989;39:1169–72. 2. Shuper A, Stahl B, Mimouni M. Transient opercular syndrome: A manifestation of uncontrolled epileptic activity. Acta Neurol Scand. 2000;101:335–8. 3. López Pisón J, Bajo Delgado AF, Lalaguna Mallada P, Calvo Romero MR, Cabrerizo de Diago R, Peña Segura JL. Sı́ndrome opercular anterior como manifestación de estado epiléptico no convulsivo. Rev Neurol. 2004;38:934–7. 4. Santos S, Casadevall T, Rı́os C, López Garcı́a E, Tejero C, Garcés Redondo M, et al. Sı́ndrome opercular de etiologı́a vascular. Rev Neurol. 2002;34:1129–32. 5. Broussolle E, Barchine S, Tommasi M, Laurent B, Bazin B, Cinotti L, et al. Slowly progressive anarthria with late anterior opercular syndrome: A variant form of frontal cortical atrophy syndromes. J Neurol Sci. 1996;144:44–58. 6. McGrath NM, Anderson NE, Hope JK, Croxon MC, Powell KF. Anterior opercular syndrome caused by herpes simplex encephalitis. Neurology. 1997;49:494–7. 7. Steiner-Birmanns B, Munter G, Benasouli Y, Perl B, Itzchaki M, Korn-Lubetzki I. Opercular syndrome due to non-convulsive status epilepticus in an adult. J Neurol Neurosurg Psychiatry. 2006;77:1198–9. 8. Benninger DH, Mueller SG, Treyer V, Kollias S, Buck A, Wieser HG. Transient epileptic opercular syndrome. Seizure. 2007;16:276–82. 9. Thomas P, Borg M, Suisse G, Chatel M. Opercular myoclonic-anarthric status epilepticus. Epilepsia. 1995;36:281–9. Isabel Campello-Morera,*, Álvaro Giménez-Muñoza, Irene Beltrán-Marı́na y Gabriel Tirado-Anglésb a Sección de Neurologı´a, Hospital Royo Villanova, Zaragoza, España Servicio de Medicina Intensiva, Hospital Royo Villanova, Zaragoza, España b * Autor para correspondencia. Correo electrónico: [email protected] (I. Campello-Morer).