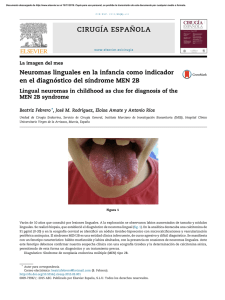
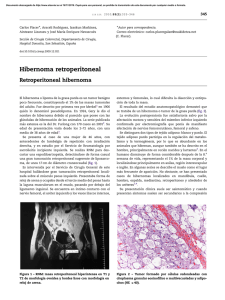
Análisis del valor del misoprostol en el tratamiento del aborto
Anuncio

Prog Obstet Ginecol. 2012;55(3):101—107 PROGRESOS de OBSTETRICIA Y GINECOLOG ÍA w w w. e l s e v i e r. e s / p o g ORIGINAL Análisis del valor del misoprostol en el tratamiento del aborto diferido Isabel Gippini a,*, Elisa Dı́az de Terán a, Ignacio Cristóbal a y Pluvio Coronado b a b Servicio de Ginecologı́a y Obstetricia, Hospital La Zarzuela, Madrid, España Departamento de Ginecologı́a y Obstetricia, Hospital Clı́nico San Carlos, Universidad Complutense de Madrid, Madrid, España Recibido el 12 de septiembre de 2011; aceptado el 16 de septiembre de 2011 Accesible en lı́nea el 2 de diciembre de 2011 PALABRAS CLAVE Aborto; Legrado; Misoprostol Resumen Objetivo: Estudiar el misoprostol como alternativa en el tratamiento del aborto diferido precoz. Material y métodos: Se analiza a 109 pacientes diagnosticadas de aborto precoz en el Hospital La Zarzuela de Madrid, de diciembre de 2009 a diciembre de 2010, a las que se ofertó tratamiento médico (600 mg de misoprostol por vı́a intravaginal) o tratamiento quirúrgico mediante legrado. Resultados: Noventa y dos pacientes recibieron tratamiento médico y 17 fueron tratadas quirúrgicamente. El tratamiento médico se demostró eficaz en 78 casos (84,8%); tuvo mayor dolor (6,29 [2,46) vs 4,24 [3,35): p = 0,026), menos dı́as de baja, (3,0 [1,3-7,0] vs 6,5 [4,0-14,8]; p = 0,007); mayor necesidad de analgesia (p = 0,014) y una satisfacción global más baja (9,33 [1,32] vs 8,26 [1,64); p = 0,024] que el tratamiento quirúrgico. Se obtuvo un ahorro significativo (p = 0,000) de 123,04 euros por procedimiento. Conclusión: El tratamiento con misoprostol del aborto diferido presenta una tasa de éxitos cercana al 90%, con escasos efectos secundarios, con un buen grado de satisfacción y escaso coste sanitario, por lo que es una alternativa válida al legrado. ß 2011 SEGO. Publicado por Elsevier España, S.L. Todos los derechos reservados. KEYWORDS Analysis of the use of misoprostol in the management of early pregnancy loss Abortion; Curettage; Misoprostol Abstract Objective: To study the use of misoprostol as an alternative management for early pregnancy loss. Materials and methods: Patients (n = 109) diagnosed with early pregnancy loss between December 2009 and December 2010 were offered medical treatment with 600 mg intravaginal misoprostol or surgical curettage. Results: Ninety-two patients (84.40%) received medical treatment and 17 (15.60%) were treated surgically. Medical treatment was successful in 78 patients (84.8%). Compared with surgery, medical treatment was more painful (visual analog scale 1-10) (6.29 [2.46] * Autor para correspondencia. Correo electrónico: [email protected] (I. Gippini). 0304-5013/$ — see front matter ß 2011 SEGO. Publicado por Elsevier España, S.L. Todos los derechos reservados. doi:10.1016/j.pog.2011.09.007 102 I. Gippini et al vs. 4.24 [3.35]; P = .026), required fewer days of absence from work (3.0 [1.3-7.0) vs. 6.5 [4.0-14.8]; P = .007), and increased the need for painkillers (P = .014). Overall satisfaction (scale 1-10) was higher with surgery 9.33 (1.32) vs. 8.26 (1.64) P = .024. The cost of medical treatment was 123,04 euros lower per procedure. Conclusion: Medical treatment with misoprostol was successful in almost 90% of patients, with few adverse effects, a good satisfaction rate and lower cost than surgical curettage. ß 2011 SEGO. Published by Elsevier España, S.L. All rights reserved. Introducción El aborto espontáneo precoz es el que ocurre antes de las 12 semanas de gestación, y supone entre un 10 y un 20% de los embarazos. La Sociedad Española de Ginecologı́a y Obstetricia (SEGO) considera aborto a la expulsión o extracción de su madre de un embrión o de un feto de menos de 500 g de peso (aproximadamente 22 semanas completas de embarazo) o de otro producto de gestación de cualquier peso o edad gestacional absolutamente no viable (p. ej., huevo no embrionado, mola hidatiforme, etc.), independientemente de si hay o no evidencia de vida o si el aborto fue espontáneo o provocado1. Hasta hace poco tiempo, la mayorı́a de las mujeres con aborto espontáneo recibı́an tratamiento quirúrgico, porque se asumı́a que el tejido retenido aumentaba el riesgo de infección y hemorragia. No obstante, hay estudios que sugieren que estas complicaciones sólo afectan a menos del 10% de las mujeres que abortan, por lo que el tratamiento quirúrgico debe ser indicado ante circunstancias especı́ficas2: mujeres que prefieren esta opción, en casos de hemorragia intensa y persistente, cuando se presente inestabilidad hemodinámica, evidencia de tejidos retenidos infectados, contraindicación para el tratamiento médico o sospecha de enfermedad trofoblástica gestacional1. En los últimos años, estamos asistiendo a un cambio en la práctica médica, sobre todo en nuestra especialidad. Las pacientes demandan técnicas menos intervencionistas y, por ello, está en auge la práctica del aborto médico o farmacológico, que es aquél en el que se produce la completa expulsión del producto de la concepción sin instrumentación quirúrgica. Puede ser de elección en los siguientes casos: si la paciente desea evitar una intervención quirúrgica, cuando el ı́ndice de masa corporal de la mujer es > 30 o ante la presencia de malformaciones, miomas uterinos o intervenciones a nivel de cérvix uterino que dificulten el tratamiento quirúrgico1. En la actualidad los fármacos que se utilizan para el aborto farmacológico son la mifepristona y las prostaglandinas. La mifepristona o RU486 es un derivado 19-noresteroide sintético que bloquea especı́ficamente los receptores de la progesterona y de los glucocorticoides. La FDA ha aceptado su utilización para la finalización de las gestaciones menores de 49 dı́as, con tasas de éxito del 60-80%, que aumenta al 95% si se combina con una prostaglandina3. Las prostaglandinas, entre las que se encuentran gemeprost (análogo PGE1), dinoprostona (PGE2 natural), carboprost (PGE2 sintética) y misoprostol, son usadas para maduración cervical y como estimulantes de la contracción uterina. De ellas, la más usada en la inducción del aborto es el misoprostol (15-desoxi-16hidroxi-16-metil PGE1), que se desarrolló en los años setenta para la prevención de las ulceras pépticas provocadas por antiinflamatorios no esteroideos (AINE)4. La tasa de absorción varı́a considerablemente en función de la vı́a (oral, rectal o vaginal) y por ello se debe tener especial cuidado en la dosificación5. La biodisponibilidad del misoprostol por vı́a vaginal o rectal es tres veces mayor que la vı́a oral o sublingual. Las pastillas son termoestables y tienen una larga durabilidad mientras estén en su blı́ster de aluminio, a temperatura ambiente. Además, se administran con gran facilidad por personal no entrenado o por las propias pacientes. Por ello, es considerado por la Organización Mundial de la Salud como «medicamento esencial» para la inducción del parto, el aborto inducido y el aborto incompleto, y posiblemente como uno de los fármacos que más vidas puede salvar evitando la mortalidad materna. Además, en ginecologı́a y obstetricia se utiliza en una gran variedad de procedimientos tales como: el aborto diferido, interrupción de gestación en el segundo trimestre, muerte fetal anteparto, prevención de la hemorragia postparto, tratamiento de la hemorragia puerperal y la preparación cervical para procedimientos ginecológicos5. La falta de una indicación en ficha técnica para su uso en ginecologı́a ha ocasionado una serie de problemas, como la desconfianza por parte de las autoridades sanitarias, la falta de una estrategia coordinada de marketing y, quizás, la más importante, la confusión acerca de la correcta dosificación. La falta de esta indicación se debe a que la obtención de la misma por parte de la compañı́a farmacéutica no es costeefectiva5. El objetivo del presente trabajo es demostrar que el misoprostol es una alternativa al tratamiento quirúrgico en los casos de aborto diferido precoz. Material y métodos Se presenta un estudio prospectivo comparativo de dos brazos, que incluyó a 109 pacientes diagnosticadas de aborto en el Hospital Sanitas La Zarzuela de Madrid, desde diciembre de 2009 hasta diciembre de 2010. A las pacientes diagnosticadas de aborto (diferido, completo e incompleto) que cumplı́an los criterios de inclusión (tabla 1), se les ofertó tratamiento quirúrgico convencional o tratamiento médico con misoprostol, facilitando los correspondientes consentimientos informados, y previa extracción de analı́tica de sangre (hemograma, coagulación y grupo sanguı́neo). En caso de elección de tratamiento médico, se les facilitó hoja de instrucciones con la pauta de tratamiento: 600 mg de misoprostol en dosis única, a las 7 h (a.m.) en su domicilio, por vı́a vaginal, asociando analgesia desde el Análisis del valor del misoprostol en el tratamiento del aborto diferido Tabla 1 Criterios de inclusión Vesı́cula gestacional intrauterina menor de 30 mm (CRL < 20 mm) Gestación interrumpida confirmada Paciente autónoma, acompañada preferiblemente Aceptación procedimiento y firma consentimiento informado Ausencia de criterios de exclusión: Contraindicación para el uso de misoprostol Anemia con hemoglobina < 10 mg/dl, alergia a misoprostol Gestaciones con dispositivos intrauterinos u obstrucción del canal cervical Gestaciones ectópicas Insuficiencia suprarrenal Asma severa Glaucoma Estenosis mitral Porfirias congénitas Corticoterapia de larga duración Alteraciones hemorrágicas o uso de anticoagulantes Inhabilitación por ausencia de plenas facultades mentales Dificultad a la hora de acceder a un centro médico de emergencia Estado clı́nico de la paciente (metrorragia abundante o hemodinámicamente inestable, analı́tica alterada) primer momento. La dosis se debı́a repetir a las 24 h si no presentaban sangrado tras esa primera dosis. En los casos en los que las pacientes desearan realizar estudio anatomopatológico de los restos abortivos, se les facilitó un envase para la recogida de la muestra, con el fin de confirmar embarazo y excluir gestaciones ectópicas y enfermedad trofoblástica. El primer control se realizó a las 48 h, en el servicio de urgencias, con valoración de la cuantı́a del sangrado y realización de ecografı́a transvaginal. Se administró gammaglobulina anti-D, en caso de precisarse (pacientes Rh negativo). Se procedió a la recogida de material para anatomı́a patológica, en su caso. Como dato que se debe tener en cuenta, para catalogar el tratamiento médico como exitoso, se tuvo en cuenta la expulsión completa de la vesı́cula gestacional. En función de la clı́nica y la persistencia de vesı́cula gestacional en la ecografı́a, se valoró y consensuó con la paciente la administración de una nueva dosis frente a la realización de un legrado o bien el alta, en el caso de haber expulsado al vesı́cula gestacional. Las pacientes que se decantaron por la realización de legrado, en primer término, fueron programadas para la cirugı́a al dı́a siguiente del diagnóstico con tratamiento de 400 mg de misoprostol como preparación cervical 4 h previo a la realización de este. A los 15 dı́as se llevó a cabo un control en consulta, tanto de las pacientes tratadas quirúrgicamente, como de las tratadas con misoprostol, con ecografı́a transvaginal para valoración endometrial. Se completó un formulario diseñado para el estudio y, en caso de persistencia de sangrado e imagen intrauterina compatible con restos, se realizó un test 103 de gestación. También se solicitó hemograma de control a todas las pacientes. A los 2 meses, se procedió al control telefónico (por parte de departamento de calidad del hospital) para valorar el grado de satisfacción de la paciente, mediante la aplicación de una encuesta de satisfacción. Se realizó un análisis de costes, teniendo en cuenta el precio de la asistencia que ambos procedimientos requirieron, paciente por paciente. Se incluyeron en esta valoración el número de visitas a urgencias o de consultas extras, los gastos de la analı́tica y de la hospitalización (gastos de quirófano, honorarios de anestesista y ginecólogo) y el precio del estudio por parte de anatomı́a patológica. Los datos se recogieron en una base de datos Access Office 2007W MicrosoftW y se analizaron con el programa SPSS para Windows versión 19.0. Se realizó la prueba de la x2 para variables cualitativas y la prueba de la t de Student o U de Mann Whitney para las variables cuantitativas según su distribución fuera o no paramétrica (prueba de Kogomorov-Smirnoff). Se consideró que las diferencias encontradas fueron estadı́sticamente significativas si el valor de la p era < 0,05. Resultados Los datos generales de la muestra se muestran en la tabla 2. La media de edad fue de 35,28 años (desviación estándar [DE] 4,3), con un ı́ndice de masa corporal medio de 22,71 2,9 kg/m2. El 56% de las pacientes habı́an tenido gestaciones anteriores, de las cuales 33 (30,3%) tuvieron algún aborto previo que fue tratado con legrado en el 72,7% de los casos. La edad gestacional media fue de 8,81 2,05 semanas y el CRL medio de 9,07 5,75 mm. El 96% de los casos fueron abortos diferidos. Cuando se comparan los datos en función del tratamiento recibido, se observa que los grupos fueron homogéneos y no se evidencian diferencias estadı́sticamente significativas en cuanto a: edad, IMC, gestaciones previas, edad gestacional, tipo de aborto, dolor o sangrado al diagnóstico, dı́as de dolor, dı́as de sangrado, pérdidas sanguı́neas, infección post tratamiento (tabla 3). Sin embargo, los fetos de las mujeres sometidos a legrado evacuador tuvieron un CRL significativamente mayor (12,25 mm [6,4]) que las que optaron por misoprostol (8,8 mm [5,5]; p = 0,037). El dolor durante el tratamiento, en una escala del 0-10, fue significativamente mayor en el caso del tratamiento médico (6,29 [2,46] vs 4,24 [3,35]; p = 0,026). Los dı́as de baja laboral fueron menos en el caso de tratamiento con misoprostol (3,0 [1,3-7,0] vs 6,5 [4,0-14,8]: p = 0,007), aunque en estas se precisó más analgesia y de una potencia mayor que las tratadas con legrado evacuador (p = 0,014) (tabla 4). La satisfacción global (medida con escala del 1 al 10) fue significativamente mayor en el caso del legrado 9,33 (1,32) vs 8,26 (1,64) en las pacientes tratadas con misoprostol (p = 0,024) (tabla 5). En cuanto a la efectividad del tratamiento médico, se logró evacuación uterina completa en 78 casos (84,8%): el 70,7% con la primera dosis, el 26,1% con la segunda dosis y 3,3% con 3 o más dosis. Precisaron realización de legrado 14 pacientes (15,2% de la muestra). 104 Tabla 2 I. Gippini et al Datos generales de la muestra Variables N.8 (%) Media DE Mediana (rango intercuartı́lico) Edad (años) IMC (kg/m2) Gestación previaa, n.8 (%) Abortos previos, n.8 (%) 35,28 4,3 22,71 2,9 61 (56) 33 (30,3) 36,0 (32-39) 22,42 (20,50-24,06) — — Tratamiento en aborto previo (n = 33) Legrados Tratamiento médico Tratamiento expectante Desconocido 24 (72,7) 3 4 2 Edad gestacional (semanas) CRL (n = 81), mm Tamaño vesı́cula (n = 62), mm 8,81 2,05 9,07 5,75 22,90 14,93 Tipo aborto Diferido Huevo huero (n = 105) Incompleto Completo 105 (96,30) 27 (25,7) 2 (1,80) 2 (1,80) Tipo de tratamiento aplicado Médico Legrado 92 (84,40) 17 (15,60) 9 8-10 7 4-14 20,00 14-27,50 DE: desviación estándar. Las variables cuantitativas se expresan con su valor absoluto y porcentaje. Las variables cuantitativas con la media y la mediana. a Pacientes con gestaciones anteriores a la actual. Los efectos secundarios que se observaron fueron similares en ambos grupos. Ası́, en el grupo al que se practicó legrado evacuador, el 76,46% no tuvo ningún efecto adverso, el 17% diarrea; 17% vómitos y 5,88% sensación de cansancio. En el caso de las pacientes tratadas con misoprostol: 72,88% ninguno; 14,13% diarrea; 8,06% vómitos; 7,60% febrı́cula y 5,43% otros (náuseas, sensación de cansancio, etc.). Tabla 3 En cuanto al análisis de coste-efectividad, el coste medio de la realización de un legrado como primera opción fue de 309,95 37,97 euros, frente a lo que supuso el uso de misoprostol, que fue de 186,55 107,33 euros (p = 0,000). Esto supone un ahorro de 123,04 euros por procedimiento, que en el total de las pacientes del estudio asciende a 11.346,176 euros. Comparación de resultados: homogeneidad de grupos de tratamiento médico vs tratamiento quirúrgico Variables Misoprostol n = 92 (%)/ media DE/ mediana (rango intercuartı́lico) Legrado n = 17 (%)/ media DE p Total Edad (años) a IMC (Kg/m2) a Gestaciones previas Abortos previos Edad gestacional (semanas) a CRL (N = 81) a Huevo Huero a Tamaño vesı́cula (n = 62) a 92 (84,4) 35,3 4,1 22,6 3,0 50 (50,3) 27 (29,3) 8,75 2,1 8,52 5,5 22 24,2 23,24 15,4 17 (15,6) 35,0 5,0 23,3 2,1 11 (64,7) 6 (35,3) 9,1 1,9 12,25 6,4 5 29,4 20,63 11,8 — 0,769 0,390 0,586 0,774 0,500 0,037 0,761 0,648 Tipo aborto Diferido Incompleto Completo 88 (95,7) 2 (2,2) 2 (2,2) 17 (100) 0 0 0,681 Se utiliza la prueba de la x2 o la prueba de Fisher bilateral. a Datos expresado en media desviación estándar. Análisis del valor del misoprostol en el tratamiento del aborto diferido Tabla 4 105 Comparación de resultados: tratamiento médico vs tratamiento quirúrgico Variables Misoprostol n (%)/media DE/ mediana (rango intercuartı́lico) Legrado n (%)/ media(DE) p Dolor al diagnósticoa (EVA) Dolor en tratamiento a Dı́as de dolorb Dı́as de sangrado a 0,73 1,8 6,29 2,46 2(1-4) 12,36 5,88 1,18 2,3 4,24 3,35 2(1-6) 10,29 5,05 0,373 0,026 0,950 0,268 Parámetros sanguı́neos Variación hemoglobina Variación hematocrito Variación leucocitos —0,23 0,79 —0,64 2,22 —1.308,1 3.219,7 —0,13 0,67 —0,79 2,27 —741,0 2.294,8 0,706 0,851 0,595 Signos de infección Endometrio al control 15 dı́as a Dı́as de baja b Dı́as hasta actividad habitual 0 0,00 7,53 3,25 3,0 (1,3-7,0) 2 (1,6) 0 0,0 6,47 3,60 6,5 (4,0-14,8) 3 (2-7) — 0,139 0,007 0,055 11 (12,0) 76 (82,6) 5 (5,4) 7 (41,2) 10 (58,8) 0 (0,0) 22 (27,2) 55 (67,9) 4 (4,9) 5 (50,0) 5 (50,0) 0 (0,0) Analgesia Tipo No analgesia Baja potencia Alta potencia Pautada/ocasional (n = 91) Ocasional Pautada Mayor que pautada 0,014 0,256 Se utiliza la prueba de la x2 o la prueba de Fisher bilateral. a Datos expresado en media DE. b Datos expresados en mediana (RIQ). Tabla 5 Comparación de resultados de satisfacción con el tratamiento recibido Variables Satisfacción (N = 55)46/9 Global a Repetición tratamiento Seguro que si Probablemente si Quizás Probablemente no Seguro que no Recomendación tratamiento Seguro que si Probablemente si Quizás Probablemente no Seguro que no Misoprostol n (%)/ media DE/mediana (rango intercuartı́lico) Legrado n (%)/ Media DE p 8,26 1,64 9,33 (1,32) 0,024 0,151 25 (54,3) 4 (8,7) 2 (4,3) 6 (13,0) 9 (19,6) 8 (88,9) 23 (50,0) 6 (13,0) 6 (13,0) 3 (6,5) 8 (17,4) 7 (77,8) 1 0 1 (11,1) 0 1 (11,1) 0,186 Se utiliza la prueba de la x2 o prueba de Fisher bilateral. a Datos expresado en media DE. Discusión Según lo expuesto anteriormente, el misoprostol se postula como un tratamiento eficaz, efectivo y eficiente en los casos de aborto diferido, además de seguro y con escasos efectos secundarios. Hay diversos estudios que evalúan la efectividad del misoprostol para el tratamiento del aborto diferido, pero varı́an en cuanto a la dosis, la vı́a de administración y la pauta de seguimiento. Una dosis oral de 400 mg de misoprostol obtiene una tasa de expulsión del 13%5, mientras que esa misma dosis administrada de forma repetida tiene una 106 tasa de expulsión del 50-70%6—9. La OMS sugiere, para el aborto diferido, utilizar dosis de 800 mg vı́a vaginal o 600 mg sublinguales, repitiéndola cada 2-3 h si se precisa10. También recomiendan dosis menores (600 mg orales en dosis única o una dosis de 400 mg sublingual) en casos de abortos incompletos11. La tasa de expulsión es mayor con dosis de 600-800 mg por vı́a vaginal (70-90%)12,13. Es posible que se deba al efecto local del misoprostol sobre el cérvix, el aumento de la concentración obtenida en el tejido uterino y al ya comentado aumento de biodisponibilidad por vı́a vaginal14,15. La SEGO recomienda 800 mg por vı́a vaginal o 200 mg vı́a vaginal cada 4 h hasta un total de 800 mg. Con ello refiere tasa de éxito de 72% con la primera dosis, segunda dosis de 85-87% con 3 dosis de 90-93%1. Dado que el estudio se llevó a cabo en el ámbito de la medicina privada, se optó por un manejo más conservador eligiéndose una dosis única de 600 mg por vı́a vaginal, para mayor confort de las pacientes. La tasa acumulada de evacuación uterina obtenida fue del 84,8%: el 70,7% con la primera dosis, el 26,1% con la segunda dosis y 3,3% con 3 o más dosis), similar a la tasa referida con las dosis aconsejadas por la SEGO. Aun ası́, es posible que si se aumentara a 7 dı́as el intervalo hasta el primer control postratamiento probablemente se incrementarı́a la tasa de éxito, o al menos, se reducirı́a el número de dosis precisas. Un estudio aleatorizado demuestra que las pacientes tratadas con misoprostol tienen mayor duración del sangrado y bajada de hemoglobina que las que se sometieron a legrado16. Sin embargo, el riesgo de infección es inferior al que ocurre cuando se opta inicialmente por el tratamiento quirúrgico17. En nuestro estudio, no se han observado diferencias significativas en la variación de hemoglobina ni en los dı́as de sangrado, y tampoco se ha dado ningún caso de infección, probablemente debido a lo escaso de la muestra del grupo de pacientes sometidas a legrado evacuador. Todos los métodos de evacuación del aborto del primer trimestre, conllevan un riesgo de fallo que requiere otro procedimiento adicional. Para el aborto quirúrgico, ese riesgo es de alrededor del 2,3 por mil y en el aborto médico oscila entre el 1-4%18. En el estudio que presentamos surgió un caso en el grupo de pacientes sometidas a tratamiento quirúrgico, en el que hubo que realizar un segundo legrado, lo que supone un 5,9%, y una tasa de legrados tras tratamiento de aborto diferido del 15,2%. Probablemente, se podrı́an achacar estas diferencias al escaso tamaño de la muestra y al corto intervalo de control del éxito del tratamiento. Los beneficios del tratamiento quirúrgico del aborto espontáneo incluyen la posibilidad de programación, que el procedimiento se completa habitualmente en un periodo más corto de tiempo (lo que conlleva menor sangrado), que la expulsión de los restos abortivos ocurre siempre en un centro sanitario y que la tasa de éxito es alta (93-100%), siendo en la mayorı́a de los estudios > 98%19. La tasa de éxito del legrado evacuador en el estudio entra dentro de lo esperado al ser del 94,1%. Pero el legrado también conlleva una serie de riesgos por la técnica quirúrgica como: la posibilidad de desgarros cervicales (< 1%), que es menor en gestaciones más precoces19 y con el uso de preparados para la maduración cervical, la posibilidad de perforación uterina (1-4 por 1.000), hematometra, infección genital (10%)1, el sı́ndrome de Asherman20 I. Gippini et al y una tasa de mortalidad de 0,5/100.000 (que aumenta con la edad gestacional21 y lo invasivo del procedimeinto1). En nuestro estudio no se dio ningún caso de complicaciones intraoperatorias o en el postoperatorio inmediato. Los efectos secundarios asociados al uso de misoprostol son: febrı́cula y escalofrı́os (que suelen ser transitorios); efectos gastrointestinales (náuseas, vómitos y diarrea), que se dan en el 35% de las pacientes (en nuestro estudio en el 22,19%) y suelen ser más frecuentes tras la administración oral o sublingual; dolor abdominal, que suelen ceder con AINE; hiperestimulación uterina y rotura uterina (asociada a su uso para inducción de abortos de segundo trimestre o inducción del parto); malformaciones fetales (< 1%), en los casos en que ha fracaso su uso para inducción de aborto, la más común, el sı́ndrome de Mobius (parálisis facial congénita con o sin alteraciones en los miembros), ausencia de dedos, pie equinovaro y alteraciones de los pares craneales (V, VI, VII y XII)5. Cuando se valora la eficacia del tratamiento en función del grosor endometrial, hay que tener en cuenta que una medida de 16 mm (intervalo de confianza del 95%, 15,1-16,6) entre las inferfases miometriales en pacientes asintomáticas, no requiere una intervención quirúrgica ya que no se suele asociar a retención de restos abortivos22. En cuanto al análisis de costes, en el estudio MIST, que incluyó a 1.200 mujeres diagnosticadas de aborto diferido o incompleto con menos de 13 semanas de gestación, fueron asignadas de forma aleatorizada a los grupos de tratamiento médico, quirúrgico o expectante23. El coste neto por paciente fue estimado en 1.086 £ (1.231,01 s), 1.410 £ (1.598,27 s) y 1.585 £ (1.796,64 s), respectivamente. En nuestro medio los costes son menores y la diferencia también es menor: 123,04 euros frente a 324 libras en el estudio MIST, probablemente por control más cercano de las pacientes por tratarse de un entorno de medicina privada. Como conclusión, hay que destacar los beneficios del tratamiento médico, frente al quirúrgico, sobre todo en esta época en que muchas pacientes requieren y exigen tratamientos menos agresivos. Se trata de procedimiento con una tasa de éxitos cercana al 90%, con escasos efectos secundarios, siendo la mayorı́a leves y de corta duración, con un alto grado de satisfacción y más económico que el legrado quirúrgico. Conflicto de intereses Los autores declaran no tener ningún conflicto de intereses. Bibliografı́a 1. Aborto espontáneo. Protocolo asistencial en obstetricia de la SEGO [consultado Mar 2011]. Actualizado en julio de 2010. Disponible en: http://www.prosego.com. Acceso en marzo de 2011. 2. Royal College of Obstetricians and Gynaecologists (RCOG). The management of early pregnancy loss. Green-top guideline n.8 25, octubre de 2006. 3. Say L, Kulier R, Gülmezoglu M, Campana A. Métodos médicos versus métodos quirúrgicos para la interrupción del embarazo en el primer trimestre (Revisión Cochrane traducida). En la Biblioteca Cochrane Plus, 2008 Número 4. Oxford: Update Software Ltd. Disponible en: http://www.update-software.com Análisis del valor del misoprostol en el tratamiento del aborto diferido 4. 5. 6. 7. 8. 9. 10. 11. 12. (Traducida de The Cochrane Library, 2008 Issue 3. Chichester, UK: John Wiley & Sons, Ltd.). Silverstein FE. Improving the gastrointestinal safety of NSAIDs: the development of misoprostol- from hypothesis to clinical practice. Dig Dis Sci. 1998;43:447—58. Elati A, Weeks A. The use of misoprostol in obstetrics and gynaecology. BJOG. 2009;116 Suppl 1:61—9. De Jonge ET, Makin JD, Manefeldt E, De Wet GH, Pattinson RC. Randomised clinical trial of medical evacuation and surgical curettage for incomplete miscarriage. BMJ. 1995;311:662. Chung T, Leung P, Cheung LP, Haines C, Chang AM. A medical approach to management of spontaneous abortion using misoprostol. Extending misoprostol treatment to a maximum of 48 hours can further improve evacuation of retained products of conception in spontaneous abortion. Acta Obstet Gynecol Scand. 1997;76:248—51. Chung TK, Cheung LP, Lau WC, Haines CJ, Chang AM. Spontaneous abortion: a medical approach to management. Aust NZJ Obstet Gynaecol. 1994;34:432—6. Chung TK, Lee DT, Cheung LP, Haines CJ, Chang AM. Spontaneous abortion: a randomized, controlled trial comparing surgical evacuation with conservative management using misoprostol. Fertil Steril. 1999;71:1054—9. Gemzell-Danielson K, Ho PC, Gómez Ponce de León R, Weeks A, Winikoff B. Misoprostol to treat missed abortion in the first trimester. Int J Gynaecol Obstet. 2007;99 Suppl 2:S182—5. Blum J, Winikoff B, Gemzell-Danielson K, Ho PC, Schiavon R, Weeks A. Treatment of incomplete abortion and miscarriage with misoprostol. Int J Gynaecol Obstet. 2007;99 Suppl 2: S186—9. Demetroulis C, Saridogan E, Kunde D, Naftalin AA. A prospective randomized control trial comparing medical and surgical treatment of early pregnancy failure. Hum Reprod. 2001;16:365—9. 107 13. Zahng J, Gilles JM, Barnhart K, Creinin MD, Westhoff C, Frederick MM. A comparison of medical management with misoprostol and surgical management for early pregnancy failure. N Engl J Med. 2005;353:761—9. 14. Zieman M, Fong SK, Benowitz NL, Banskter D, Darney PD. Absorption kinetics of misoprostol with oral or vaginal administration. Obstet Gynecol. 1997;90:88—92. 15. Kahn RU, El-Refaey H, Sharma S, Sooranna D, Stafford M. Oral, rectal and vaginal pharmacokinetics of misoprostol. Obstet Gynecol. 2004;103(5 Pt 1):866—70. 16. Davis AR, Hendlish SK, Westhoff C, Frederick MM, Zhang J, Gilles JM, et al. Bleeding patterns after misoprostol vs surgical treatment of early pregnancy failure: results from a randomized trial. Am J Obstet Gynecol. 2007;196. 31.el—31.el7. 17. Surgical evacuation of retained products of conception for early pregnancy loss. RCOG (Royal College of Obstetricians and Gynaecologists). Consent Advise n.8 10, diciembre de 2009. 18. The care of women requesting induced abortion. Evidence-based Clinical Guideline n.8 7. RCOG (Royal College of Obstetricians and Gynaecologists), septiembre de 2004. 19. Chen BA, Creinin MD. Contemporary management of early pregnancy failure. Clin Obstet Gynecol. 2007; 50:67-88. 20. Devesa R, Ruiz J, López-Rodó V, Carrera JM. Evacuación uterina en el aborto espontáneo y provocado. En: Carrera JM, Kurjak A, editors. Medicina del embrión. Barcelona: Masson; 1997. p. 559—79. 21. Maureen P. Office management of early induced abortion. Clin Obstet Gynecol. 1999;42:290—305. 22. Van Bogaert LJ, Misra A. Sonograhy of uterine cavity contents after medical abortion. Int J Gynaecol Obstet. 2009;104:150—1. 23. Petrou S, Trinder J, Brocklehust P, Smith L. Economic evaluation of alternative methods of first-trimester miscarriage based on results from the MIST trial. BJOG. 2006;113:879—89. Prog Obstet Ginecol. 2012;55(3):108—113 PROGRESOS de OBSTETRICIA Y GINECOLOG ÍA w w w. e l s e v i e r. e s / p o g ORIGINAL Cribado combinado de sı́ndrome de Down en primer trimestre: comparación de resultados de 4 años de aplicación con los 4 años precedentes Javier Arenas Ramı́rez *, Elisa Para Margüello, Laura Fernandez Fernandez, M Teresa Otero Chouza, Beatriz Duplá Parugues, Montserrat Noriega Garcı́a, Elena Couso Perez, Rebeca Pérez Fernández y Guillermo Garcı́a Galarraga Servicio de Obstetricia y Ginecologı́a, Hospital de Cabueñes, Gijón, España Recibido el 1 de agosto de 2011; aceptado el 10 de octubre de 2011 Accesible en lı́nea el 15 de diciembre de 2011 PALABRAS CLAVE Amniocentesis; Cribado combinado del primer trimestre; Diagnóstico prenatal; Sı́ndrome de Down Resumen Objetivo: Analizar los resultados de 4 años de aplicación del programa de cribado combinado del primer trimestre y su impacto sobre las tasas de detección de sı́ndrome de Down, cobertura poblacional y procedimientos invasivos. Sujetos y métodos: Estudio retrospectivo poblacional de 8 años consecutivos (17.564 gestaciones que contienen 51 sı́ndromes de Down), en 2 periodos: 31 de enero de 2002 a 30 de enero de 2006, sin cribado (8.182 gestaciones y 24 sı́ndromes de Down) y 31 de enero de 2006 a 30 de enero de 2010, con cribado (8.382 gestaciones y 27 sı́ndromes de Down). El cribado se aplicó en 2 fases: bioquı́mica a la 10 semana y ecografı́a a la 12 semana. Se comparan los resultados del cribado con los del periodo precedente basado en la edad materna y la medida de la translucencia nucal. Resultados: La cobertura poblacional fue de 93%. La tasa de detección de sı́ndrome de Down por aplicación del cribado combinado ha sido del 89% (91% para feto único) para un 3,5% de falsos positivos y se realizaron 824 procedimientos invasivos (34,3 para 1 diagnóstico). En los 4 años previos a la aplicación del cribado, la tasa de detección era del 71% y se realizaron 1.406 procedimientos invasivos (87,8 para un diagnóstico). Conclusión: El cribado combinado ha mejorado las tasas de detección para sı́ndrome de Down en un 18%, al tiempo que ha permitido reducir en un 41% los procedimientos invasivos. ß 2011 SEGO. Publicado por Elsevier España, S.L. Todos los derechos reservados. * Autor para correspondencia. Correo electrónico: [email protected] (J. Arenas Ramı́rez). 0304-5013/$ — see front matter ß 2011 SEGO. Publicado por Elsevier España, S.L. Todos los derechos reservados. doi:10.1016/j.pog.2011.10.003 Cribado combinado de sı́ndrome de Down en primer trimestre KEYWORDS Amniocentesis; Down syndrome; First-trimester combined screening; Prenatal diagnosis 109 First-trimester combined screening for Down syndrome: comparison of the 4-year results with the previous 4 years Abstract Objective: To analyze the 4-year results of first-trimester combined screening and its impact on rates of Down syndrome detection, population coverage and invasive procedures. Subjects and methods: We performed a retrospective population-based study over 8 consecutive years (17,564 gestations with 51 cases of Down syndrome) divided in two periods: from January 31, 2002 to January 30, 2006 without combined screening (8,182 gestations and 24 cases of Down syndrome) and from January 31, 2006 to January 30, 2010 with combined screening (8,382 gestations and 27 cases of Down syndrome). Combined screening was applied in two phases: biochemical analysis was performed in the 10th week of pregnancy and ultrasound examination in the 12th week. We compared the results of screening with the previous period based on maternal age and fetal nuchal translucency measurement. Results: Population coverage was 93%. The rate of Down syndrome detection due to the application of combined screening was 89% (91% for a single fetus) with a false-positive rate of 3.5%. There were 824 invasive procedures (34.1 to diagnose one episode). During the 4 years prior to the application of combined screening, the detection rate was 71% with 1,406 invasive procedures (87.8 to diagnose one episode). Conclusion: Combined screening has improved the Down syndrome detection rate by 18% and has reduced the use of invasive procedures by 41%. ß 2011 SEGO. Published by Elsevier España, S.L. All rights reserved. Introducción El Sı́ndrome de Down (SD) es la cromosomopatı́a más frecuente y en ausencia de cribado prenatal cabe esperar 1-2 casos por cada 1.000 nacimientos. Además de ser una de las principales causas de discapacidad, estos niños tienen un incremento en la incidencia de malformaciones congénitas, particularmente cardiacas y gastrointestinales y su esperanza de vida está entre los 50-60 años1. En puridad, todas las gestantes pueden tener un feto afectado y es precisamente la detección de un aumento en el riesgo la principal indicación para efectuar procedimientos invasivos (PI) durante la gestación (amniocentesis, biopsia corial), única manera de efectuar el diagnóstico. Es evidente que no procede someter a PI a toda la población gestante pues los costes económicos, de infraestructura sanitaria y de pérdidas de fetos sanos serı́an inaceptables. Tras la aplicación de diferentes estrategias de selección de riesgo, se ha impuesto el cribado combinado de I trimestre entre la 11-13+6 semanas (s.), que aplica una combinación de edad materna, medida ecográfica de la translucencia nucal fetal (TN) y cuantificación en suero materno de la proteı́na plasmática A asociada a la gestación (PAPP-A) y de la fracción libre de la gonadotrofina coriónica humana (fb-HGC). De trabajar en un solo tiempo haciendo la bioquı́mica y TN en el mismo dı́a (OSCAR: one-stop clinics for assessment of risk)2 se tiende a trabajar en las edades gestacionales que se han mostrado más discriminatorias, alrededor de la 10 s. para la bioquı́mica y de la 12 s. para la TN3. Ha pasado más de una década de las primeras publicaciones4 y las tasas de detección (TD) se mantienen entre 80-90% para 5% de falsos positivos (FP), con pequeñas variaciones. En este trabajo se expondrán los resultados globales tras 4 años de aplicación del programa de cribado combinado del primer trimestre en comparación con el periodo de 4 años precedente y se analizará su impacto sobre la cobertura poblacional, TD y procedimientos invasivos. Material y métodos Se realiza un estudio retrospectivo poblacional de los 4 primeros años de aplicación del cribado combinado del primer trimestre en el Hospital de Cabueñes de Gijón, del 31 de enero de 2006 al 30 de enero de 2010. En este periodo hubo un total de 9.032 partos, se realizaron 8.382 cribados y hubo 27 SD. Para evaluar el impacto sobre los PI se estableció la comparación con otro periodo consecutivo de 4 años previo a la aplicación del cribado, en los que la indicación para PI eran la edad materna y la medida de la TN: 31 de enero de 2002 al 30 de enero de 2006, con 8.182 partos y 24 SD, abarcando por tanto el estudio 17.564 gestaciones y 51 casos de SD. Cabe resaltar, por su influencia sobre la tasa de cribados, que la edad materna era de 35 o más años en el 27% de nuestras gestantes. Se precisó de consentimiento informado. Se trabajó en 2 fases, lo que requiere una logı́stica de programación más compleja y una buena coordinación con atención primaria para una adecuada captación y cumplimiento de los tiempos para cada fase. Fijamos la 10 s. para la determinación de la bioquı́mica (PAPP-A y fb-HGC) y la 12 s. para la ecografı́a, midiendo la TN de acuerdo con los criterios de la Fetal Medicine Foundation5,6. Para la determinación de los marcadores bioquı́micos se utilizó el analizador Inmulite 2000. La exploración ecográfica se realizó por ecografistas experimentados; se inició vı́a vaginal y se concluyó en la mayorı́a de los casos por vı́a abdominal utilizando un ecógrafo Voluson 730 expert (GE Medical Systems) o un Thosiba Xario (Thosiba Medical Systems). El cálculo de riesgo se hizo con el programa PRISCA Software 4.0, Typolog Software Ltd & Co. KG (Contractor SIEMENS Medical Solutions Diagnostics, Germany) y el nivel 110 J. Arenas Ramı́rez et al de corte utilizado para ofrecer obtención de cariotipo fetal fue un riesgo estimado igual o inferior a 1/270. Los resultados se comunicaron a las gestantes al finalizar la ecografı́a. La obtención del cariotipo fue por biopsia corial en el 2,8% y por amniocentesis en el resto. El seguimiento de los recién nacidos se hizo a través de la sección de neonatologı́a y de la comisión de perinatologı́a del hospital y de la Comisión de Defectos Congénitos del Principado de Asturias, abarcando ası́ todos los nacidos en nuestra comunidad. Resultados Sobre 9.032 partos en el periodo de estudio se realizaron 8382 cribados, representando una cobertura poblacional del 93%. La edad gestacional media en la realización de la bioquı́mica fue de 9,9 s. (objetivo: 10 s.) y de 12,3 s. para la ecografı́a (objetivo: 12 s.). La tasa de cribados positivos para T-21 fue del 3,8% (318/8382). Si añadimos los positivos para T-18 y negativos para T-21 (358/8382), la tasa de cribados positivos totales fue de 4,3%. Descontando los 22 verdaderos positivos para T-21, tendremos una tasa de FP para T-21 del 3,5% y descontando los verdaderos positivos para T-18, habrá una tasa del 3,8% de FP para ambas trisomı́as. La media de la edad materna y la mediana son en nuestra población de 32,1 y 32,4 años respectivamente, con un 27% de gestantes de 35 o más años, lo que debe tenerse muy en cuenta a la hora de establecer las comparaciones en términos de total de cribados positivos y FP, pues ambos aumentan a medida que lo hace la edad materna (tabla 1). Debe considerarse que el grupo de gestantes de 38 o más años representa el 9,6% del total de nuestra serie y aportan el 45% del total de cribados positivos para SD. La misma proporción se encuentra para los FP, 2% hasta 38 años y 16% a partir de 38 años. La TD de SD por cribado fue de 91% para feto único con un 3,5% de FP (tabla 2). Si se incluyen gestaciones gemelares, la TD fue del 88% (tabla 3). En los 4 años de estudio hubo 27 casos de SD: 25 tienen cribado (22 positivo y 3 negativo) y 2 casos no tienen cribado. Tuvimos 23 interrupciones legales del embarazo: 22 cribados positivos y 1 caso no cribado tras hallazgo ecográfico de ventriculomegalia en la primera visita a la 17 s. Hubo 4 recién nacidos: 1 cribado negativo con feto sin malformaciones, 1 cribado negativo gemelar con feto sin malformaciones, 1 cribado negativo con malformaciones en eco del tercer trimestre y diagnóstico prenatal por amniocentesis que resultó en muerte intrauterina a la 38 s. y 1 caso no cribado con feto sin malformaciones. Tabla 1 Edad materna (en el momento del cribado) y cribados + para T-21 Edad materna Cribados 8.382 Positivos 318 VP 22 FP % < 25 25-29 30-34 35-37 > 37 717 1787 3601 1471 806 9 25 89 53 142 0 1 5 2 14 1,2 1,3 2,3 3,5 16 FP: falsos positivos; VP: verdaderos positivos. Tabla 2 Feto único. Tasa de detección del cribado para las diferentes cromosomopatı́as T-21 T-18 T-13 45XO 21/23 13/14 5/5 3/3 91% 93% 100% 100% La edad materna media fue de 32,1 años (mı́n. 15, máx. 47). En los casos de SD que participaron en el cribado, la edad materna era de 38 o más años en el 64% de las gestantes. En los 4 años previos a la aplicación del cribado habı́amos efectuado 1.406 PI, en tanto que en los 4 años tras su aplicación se hicieron 824, lo que supone un descenso del 41%. La obtención del cariotipo fue por biopsia corial en el 2,8% y por amniocentesis en el resto. El primer año de funcionamiento del cribado combinado supuso una reducción de un 22% y este impacto debe ser atribuido exclusivamente al programa. A partir del segundo año (enero de 2007) se produjo el cambio de criterio de edad materna de 35 a 38 años como indicación de PI en nuestra comunidad (fig. 1). Ası́, en los 4 años precribado tenı́amos una media de 17,1 PI por cada 100 partos, pasando en los 4 años poscribado a 9,2 y siendo de 7 por cada 100 partos en el último año (fig. 2). Para el diagnóstico de 1 caso de SD se precisaban 87,8 PI antes de la introducción del cribado, pasando a 34,3 tras su aplicación. El cambio de escenario queda reflejado en la tabla 3. Se estudian 17.564 gestaciones que contienen 51 casos de SD y observamos que en los últimos años se produce un aumento en el número de partos y en la edad materna, lo que deberı́a generar una mayor cantidad de PI; sin embargo, estos disminuyen y lo que es más importante, la TD prenatal de SD aumenta, pasando del 71 al 89%. En nuestro medio, las mujeres de 38 o más años pueden acogerse a PI libremente, solo con solicitarlo e independientemente de los resultados del cribado. Cuando la única indicación de PI es la edad materna avanzada, hemos comparado los 2 años previos con los 2 últimos años de la aplicación del cribado, que consideramos ya consolidado y es precisamente en este grupo donde ha sido mayor el impacto del programa: previo al cribado, el 62% de las Tabla 3 Número de amniocentesis y detección de SD (incluye gestaciones gemelares) N.8 de partos Edad 35 años al parto N.8 de AMN N.8 AMN/100 partos N.8 AMN/Dx 1 SD N.8 de Dx Pren de SD RN con SD sin Dx Pren Tasa de detección SD 31 de enero de 202 a 30 de enero de 2006 Precribado 31 de enero de 2006 a 30 de enero de 2010 Poscribado 8.182 25% 1.406 17,2 87,8 17 7 71% 9.032 27% 824 9,2 34,3 24 3 89% AMN: amniocentesis; Dx: diagnóstico. Dx Pren: diagnóstico prenatal.;RN: recién nacidos; SD: sı́ndrome de Down. Cribado combinado de sı́ndrome de Down en primer trimestre Amniocentesis 450 400 350 300 250 200 150 100 Amniocentesis -1 31 -1 4/ 30 -0 -1 31 -1 31 -0 5/ 5 30 -1 -0 06 1/ 30 31 -1 -1 -0 -0 7 7/ 30 31 -1 -1 -0 -0 8 8/ 30 31 -1 -1 -0 -0 9 9/ 30 -1 -1 0 4 -0 -0 -1 -1 3/ 30 2/ 30 -0 -1 -1 -0 31 31 -0 3 50 0 Figura 1 Número de amniocentesis en el periodo de estudio. Flecha sin relleno: inicio del programa. Flecha con relleno: indicación para prueba invasiva a partir de los 38 años. N.° AMC/100 partos 20 19,7 16,1 16 16,8 15 12,7 10 N.° AMC/100 partos 9,15 7,89 7,08 5 0 2002 2003 2004 2005 2006 2007 2008 2009 Figura 2 Número de amniocentesis por cada 100 partos. Flecha: inicio del cribado. gestantes de 38 o más años nos solicitaban obtención del cariotipo fetal solo en razón de su edad, pasando a un 24% tras conocer los resultados del cribado (tabla 4). Discusión La medida de la TN debe realizarse entre la 11-13+6 s. Sabemos que se pierde sensibilidad cuanto más la retrasemos, pero no debemos olvidar que la ecografı́a de I trimestre tiene otros objetivos, como es la búsqueda de malformaciones de expresión precoz y es precisamente la 12 s. la que Tabla 4 Gestantes con edad 38 años y amniocentesis N.8 gestantes 38 años N.8 de cribados AMN por EM 38 años AMN otras indicaciones N.8 total de AMN 31 de enero de -2004 a 30 de enero de 2006 Precribado 31 de enero de 2008 a 30 de enero de 2010 Poscribado 390 — 240 (62%) 28 268 (69%) 572 517 140 (24%) 71 212 (37%) AMN: amniocentesis; EM: edad materna. 111 concilia mejor ambos propósitos7. Es posible el análisis de la bioquı́mica entre la 9-13+6 s. Las diferencias en los valores de PAPP-A entre fetos trisómicos y euploides son mayores en la gestación precoz; sin embargo, para la fb-HGC la diferencia se incrementa con la edad gestacional, aunque la importancia de esta diferencia es menor que para la PAPP-A y por ello se considera óptima la extracción de la bioquı́mica entre la 9-10 s. La mayorı́a de los grupos publican TD para SD entre el 81 y el 90% para un 5% de FP8-10 y parece que trabajando en 2 fases óptimas podrı́an elevarse hasta un 93-94%3,8,11. Ello concordarı́a con nuestros resultados, en los que obtuvimos una TD de SD del 91% para 3,5% de FP (feto único) trabajando en 2 fases, con edad gestacional media de 9,9 s. y 12,3 s. para la bioquı́mica y la ecografı́a respectivamente. La TD para T-18 ha sido del 93% para 0,5% de FP, de acuerdo con el 91-100% reseñadas por diferentes autores12-14 para una tasa similar de FP, aunque llama la atención que en otras series se consiguen peores resultados, del 67% de TD para 0,4% de FP15. Nuestra tasa de cribados positivos para SD es del 3,8%, peor que la publicada en nuestro medio por Quiroga, que es del 2,9%; sin embargo, su población de 35 o más años es del 11%16. Nuestros resultados son muy parecidos a los publicados por otros autores15,17-19, con medias de edad materna de 30,7 a 33 años y con TD de 80-89% para FP de 2,7-5%. Rozenberg19 encuentra una prevalencia de SD de 3,4/ 1.000 gestaciones y Sood20 de 2,6/1.000, muy similar a la encontrada por nosotros de 2,9/1.000 (17.564 gestaciones que contienen 51 casos de SD) y en concordancia con la del FASTER Trial de 3 casos por cada 1.000 gestaciones21. El cribado combinado del primer trimestre ha sido bien acogido por médicos y gestantes, propiciando un cambio de mentalidad sobre el concepto de riesgo por edad materna como criterio único para obtener el cariotipo fetal. Esto se pone de manifiesto en la comparación de 8 años que hemos establecido (4 años previos y 4 años con cribado), reduciéndose en un 41% los PI y lo que es más importante, aumentando la TD de SD desde un 71% hasta un 89%. Pasamos de 17,1 a 9,2 PI por cada 100 partos. Müller22 en un estudio de 10 años evalúa el impacto del cribado del segundo y primer trimestre sobre los PI, pasando del 43% en 1995 al 25% en 2005. Wray23 compara dos periodos de 1 año (con y sin cribado del primer trimestre) en gestantes de 35 o más años referidas para consejo genético y comunica una reducción del 45% en la elección de técnicas invasivas (71% vs 26%). Parece además, que esta tendencia se consolida a la baja, pues en el último año hemos pasado a 7% de PI, más cercano al 5,5% de la serie de Rozenberg19. Queda demostrado que el cribado combinado del primer trimestre contribuye a un uso más racional de los PI al tiempo que mejora la TD de SD: en los 4 años previos al cribado precisábamos de 87,8 PI para diagnosticar 1 caso de SD, en tanto que a raı́z del cribado precisamos 34,3, en consonancia con la serie de Müller22, que pasaron de 86 a 40. Como habı́amos publicado previamente24, el impacto del cribado es más manifiesto en el grupo de edad de 38 o más años, que pudieron acogerse libremente a PI, independientemente de los resultados del cribado. En este grupo, las amniocentesis por indicación exclusiva de edad avanzada pasaron de 62% en la época precribado a 24% tras su aplicación. Clásicamente, la ecografı́a de la 20 s. es considerada un filtro, una segunda oportunidad para cribado de cromosomopatı́as, pero la introducción del cribado del primer trimestre 112 J. Arenas Ramı́rez et al ha modificado el escenario. Si alcanzamos TD de 90% por cribado, significa que llegan muy pocos fetos con SD a la ecografı́a (10%), lo que obliga a replantearnos su papel y nos abre un nuevo interrogante: los fetos con SD que se escapan del cribado, serán los que tendrán marcadores o malformaciones en la ecografı́a?, o serán aquellos que se escaparán casi siempre? En este momento no hay respuesta clara. En nuestra serie, los 3 recién nacidos vivos con SD no presentaban malformaciones al igual que los 5 casos que se «escaparon» del cribado y de la ecografı́a en la serie de Rozenberg19. Al someter a la población a un buen método de cribado, como es el combinado, el papel del sonograma genético queda cuestionado25,26 y serán necesarias nuevas investigaciones en grandes series para redefinir su papel. Incluso algunos autores desaconsejan explı́citamente su aplicación20 por no encontrar mejorı́as en la TD y proponen limitarse solo al edema nucal y a la presencia de malformaciones27. En este mismo sentido se ha manifestado la guı́a NICE1. No debe olvidarse que los PI conllevan riesgos. Una revisión efectuada en mi hospital sobre 1.681 amniocentesis con seguimiento hasta la 22 semana de gestación arrojaba un 0,6% de pérdidas gestacionales relacionadas con el procedimiento. Para muchos autores el beneficio del sonograma genético no solo es incierto, sino que contribuye a aumentar la ansiedad y la tasa de anmiocentesis19,28. Recientemente, Benacerraf29 se expresaba en estos términos: «Los marcadores menores aportan solo un 4% de incremento en la TD de SD y contribuyen a aumentar en 12 veces la tasa de FP», con los procedimientos invasivos que ello conlleva. Tampoco se acaban de incorporar con el suficiente peso los marcadores «clásicos» del primer trimestre, pese a que ya tienen cierto recorrido: ductus venoso30 desde el año 1998, Hueso nasal31 desde el 2001 y regurgitación tricuspı́dea32 desde 2003. Parecı́a promisoria su incorporación al cribado del primer trimestre33. En algunos casos, como el hueso nasal, la controversia es muy amplia, y hay autores que no le encuentran ninguna utilidad34. Quizás las dificultades técnicas de obtención o de interpretación en el caso del ductus venoso y la regurgitación tricuspı́dea influyan en su falta de generalización35. En una revisión reciente de Borrell36, apunta que la asociación del cribado combinado con hueso nasal, ductus venoso o regurgitación tricuspı́dea puede alcanzar TD para SD del 93% para un 2,5% de FP y en el mismo sentido se pronuncia Nicolaides, señalando una TD del 96% para 2,5% de FP11. Continúan las aportaciones para intentar mejorar la sensibilidad y optimizar los PI y en este sentido es interesante el trabajo de Kagan37, en el que se aplican diferentes estrategias de cribado en el primer trimestre, en una polı́tica de test contingente en la que la primera evaluación está basada en diferentes marcadores ecográficos y una segunda evaluación con test bioquı́micos, a la que llegarı́an un 20% de gestantes. Modificarı́a el nivel de corte de 1/300 a 1/100 según recomendaciones del National Screening Committee de Inglaterra y postula que no solo pueden incrementarse las TD hasta un 96% para un 2,6% de FP, sino que además redundarı́a en una racionalización de costes y una disminución de pruebas invasivas innecesarias. ? ? Conflicto de intereses Los autores declaran no tener ningún conflicto de intereses. Bibliografı́a 1. ‘‘http://www.ncbi.nlm.nih.gov/books/n/nicecollect/’’ National Institute for Health and Clinical Excellence: Guidance. Antenatal care: routine care for the healthy pregnant woman. National Collaborating Centre for Women’s and Children’s Health (UK). London: RCOG Press; 2008. 2. Bindra R, Heath V, Liao A, Spencer K, Nicolaides K. One-stop clinic for assessment of risk for trisomy 21 at 10-14 weeks: a prospective study of 15030 pregnancies. Ultrasound Obstet Ginecol. 2002;20:219—25. 3. Borrell A, Casals E, Fortuny A, Farre MT, Gonce A, Sanchez A, et al. First-trimester screening for trisomy 21 combining biochemistry and ultrasound at individually optimal gestation al ages. An interventional study. Prenat Diagn. 2004;24:541—5. 4. Spencer K, Souter V, Tul N, Snijders R, Nicolaides K. A screening program for trisomy 21 at 10-14 weeks using fetal nuchal translucency, maternal serum free B human chorionic gonadotropin and pregnancy-associated plasma protein-A. Ultrasound Obstet Ginecol. 1999;13:231—7. 5. Nicolaides K, Sibire N, Snijders R. The 11-14 week scan. London: The Parthenon Publishing Group; 1999. 6. Nicolaides K. The 11-13 + 6 weeks scan. London: The Fetal Medicine Foundation; 2004. 7. Souka A, Pilalis A, Kavalakis Y, Kosmas Y, Antsaklis P, Antsaklis A. Assessment of fetal anatomy at the 11—13 week ultrasound examination. Ultrasound Obstet Gynecol. 2004;24:730—4. 8. Kagan K, Wright D, Baker A, Sahota D, Nicolaides K. Screening for trisomy 21 by maternal age, fetal nuchal translucency thickness, free beta-human chorionic gonadotropin and pregnancy-associated plasma protein-A. Ultrasound Obstet Gynecol. 2008; 31:618—24. 9. Aagaard-Tillery K, Malon F, Nyberg D, PorterF, Cuckle H, Fuchs K, et al. for the First and Second Trimester Evaluation of Risk (FASTER) Research Consortium. Role of Second-Trimester Genetic Sonography After Down Syndrome Screening Obstet Gynecol. 2009;114:1189—96. 10. Borrell A, Robinson J, Santolaya-Forgas J. Report on the 11- to 13+6 week ultrasound evaluation as a screening test for trisomy 21 in singleton pregnancies. Am J Perinatol. 2009;26:703—10. 11. Nicolaides K. Screening for fetal aneuploidies at 11 to 13 weeks. Prenat Diagn. 2011;31:7—15. 12. Spencer K, Spencer C, Power M, Moakes A, Nicolaides K. One stop clinic for assessment of risk for fetal anomalies: a report of the first year of prospective screening for chromosomal anomalies in the first trimester. BJOG. 2000;107:1271—5. 13. Krantz D, Hallahan T, Orlandi F, Buchanan P, Larsen J, Macri J. First trimester Down syndrome screening using dried blood biochemistry and nuchal translucency. Obstet Gynecol. 2000; 96:207—13. 14. Wapner R, Thom E, Simpson JL, Pergament E, Silver R, Filkins K, et al. First-trimester screening for trisomies 21 and 18. N Engl J Med. 2003;349:1405—13. 15. Jaques A, Halliday J, Francis I, Bonacquisto L, Forbes R, Cronin A, et al. Follow up and evaluation of the Victorian first-trimester combined screening programme for Down syndrome and trisomy 18. BJOG. 2007;114:812—8. 16. Quiroga R, Perales A, Oriola A, Orellana C, Roselló M. Cribado de trisomı́a 21 en el primer trimestre mediante el test combinado. Valoración de su efectividad. Progr Diag Trat Prenat. 2007;19:54—8. 17. Sahota D, Leung T, Chan L, Law L, Fung T, Chen M, et al. Comparison of first-trimester contingent screening strategies for Down syndrome. Ultrasound Obstet Gynecol. 2010;35:286—91. 18. Sabriá J, Barceló-Vidal C, Arigita M, Jimenez JM, Puerto B, Borrell A. The CUSUM test applied in prospective nuchal translucency quality review. Ultrasound Obstet Gynecol. 2011;37: 582—7. Cribado combinado de sı́ndrome de Down en primer trimestre 19. Rozenberg P, Bussières L, Chevret S, Bernard JP, Malagrida L, Cuckle H. Screening for Down syndrome using first-trimester combined screening followed by second-trimester ultrasound examination in an unselected population. Am J Obstet Gynecol. 2006;195:1379—87. 20. Sood M, Rochelson B, Krantz D, Ravens R, Tam Tam H, Vohra N, et al. Are second-trimester minor sonographic markers for Down syndrome useful in patients who have undergone first-trimester combined screening? Am J Obstet Gynecol. 2010;203:408e1—4e. 21. Malone FD, Canick JA, Ball RH, Nyberg DA, Comstock CH, Bukowski R, et al. First- and Second-Trimester Evaluation of Risk (FASTER) Research Consortium. First-trimester or second trimester screening, or both, for Down’s syndrome. N Engl J Med. 2005;353:2001—11. 22. Muller PR, Cocciolone R, Haan EA, Wilkinson C, Sage L, Bird R, et al. Trends in state/population-based Down syndrome screening and invasive prenatal testing with the introduction of first trimester combined Down syndrome screening, South Australia, 1995-2005. Am J Obstet Gynecol. 2007;196:315e1—7e. 23. Wray AM, Ghidini A, Alvis C, Hodor J, Landy HL, Poggi SH. The impact of first-trimester screening on AMA patients’ uptake of invasive testing. Prenat Diagn. 2005;25:350—3. 24. Arenas Ramı́rez J, Fernandez Castro C, Duplá Parugues B, Otero Chouza MT, Castillo Nuñez M, López Cañal P, et al. Impacto de la Introducción en el primer trimestre del cribado combinado de trisomı́a 21 en la tasa de procedimientos invasivos. Prog Obstet Ginecol. 2009;52:320—6. 25. Lau ST, Evans MI. Second-trimester sonographic soft markers: what can we learn from the experience of first-trimester nuchal translucency screening? Ultrasound Obstet Gynecol. 2008;32: 123—5. 26. Benacerraf B. The history of the second-trimester sonographic markers for detecting fetal Down syndrome, and their current role in obstetric practice. Prenat Diagn. 2010;30:644—52. 113 27. Smith-Bindman R. Second trimester prenatal ultrasound for the detection of pregnancies at increased risk of Down syndrome. Prenat Diagn. 2007;27:535—44. 28. Lauria M, Branch MD, LaCroix VH, Harris RD, Baker ER. J Clinical Impact of systematic genetic sonogram screening in a low risk population. Reprod Med. 2007;52:359—64. 29. Benacerraf B. What Does the Patient Really Have to Know About the Presence of Minor Markers on the Second-Trimester Sonogram? J Ultrasound Med. 2010;29:509—12. 30. Matias A, Gomes C, Flack N, Montenegro N, Nicolaides K. Screening for chromosomal abnormalities at 10—14 weeks: the role of ductus venosus blood flow. Ultrasound Obstet Gynecol. 1998;12:380—4. 31. Cicero S, Curcio P, Papageorghiou A, Sonek J, Nicolaides K. Absence of nasal bone in fetuses with trisomy 21 at 11—14 weeks of gestation: an observational study. Lancet. 2001;358:1665—7. 32. Huggon IC, De Figueiredo DB, Allan LD. Tricuspid regurgitation in the diagnosis of chromosomal anomalies in the fetus at 11—14 weeks of gestation. Heart. 2003;89:1071—3. 33. Nicolaides K. Screening for chromosomal defects. Ultrasound Obstet Ginecol. 2003;21:313—21. 34. Ramos-Corpas D, Santiago JC, Montoya F. Ultrasonographic evaluation of fetal nasal bone in a low-risk population at 11—13 + 6 gestational weeks. Prenat Diagn. 2006;26:112—7. 35. Borrell A. Promises and pitfalls of first trimester sonographic markers in the detection of fetal aneuploidy. Prenat Diagn. 2009;29:62—8. 36. Borrell A, Robinson J, Santolaya-Forgas J. Report on the 11 to 13+6 week ultrasound evaluation as a screening test for trisomy 21 in singleton pregnancies. Am J Perinatol. 2009;26:703—10. 37. Kagan K, Staboulidou I, Cruz J, Wright D, Nicolaides K. Two-stage first-trimester screening for trisomy 21 by ultrasound assessment and biochemical testing. Ultrasound Obstet Gynecol. 2010; 36:542—7. Prog Obstet Ginecol. 2012;55(3):114—120 PROGRESOS de OBSTETRICIA Y GINECOLOG ÍA w w w. e l s e v i e r. e s / p o g ORIGINAL Inducción de endometriosis en rata Wistar, mediante autotransplante de fragmento uterino, sobre cicatriz previamente producida en el cuerno uterino izquierdo Pedro González Ramos a,*, Cristina Pastor Oliver b, Cristina González Pastor b, Francisco Javier Manero Ruiz c, Ángela Pecondón Español c, Pedro Royo Manero d, Juan Luis Alcázar Zambrano e y Ernesto Fabre González a a Servicio de Ginecologı́a, Hospital Clı́nico Universitario Lozano Blesa, Zaragoza, España Instituto Aragonés de Ciencias de la Salud, Zaragoza, España c Servicio de Reumatologı́a, Hospital Universitario Miguel Servet, Zaragoza, España d Servicio de Ginecologı́a y Obstetricia, Clı́nica San Miguel, Pamplona, Navarra, España e Departamento de Ginecologı́a y Obstetricia, Clı́nica Universitaria de Navarra, Pamplona, Navarra, España b Recibido el 16 de julio de 2011; aceptado el 16 de agosto de 2011 Accesible en lı́nea el 2 de diciembre de 2011 PALABRAS CLAVE Endometriosis; Microcirugı́a ginecológica; Rata Wistar KEYWORDS Endometriosis; Gynecological microsurgery; Wistar rat Resumen Objetivo: Estudiar la posibilidad de inducir endometriosis interna/externa en rata wistar, a través de un nuevo modelo microquirúrgico, que denominamos PGR 1. Sujetos y métodos: Se han utilizado 11 ratas Wistar, a las que se ha realizado un autotransplante de fragmento uterino, sobre la cicatriz resultante de la cirugı́a necesaria para su obtención. Después de 8 semanas se les practicó una nueva intervención, para la inspección de la cavidad abdominal y la toma de muestras relevantes para su estudio anatomopatológico. Resultados: Macroscópicos: adherencias que afectaban fundamentalmente a la zona del implante; vesı́culas amarillentas. Microscópicos: vesı́culas/quistes; fenómenos inflamatorios; neovascularización; endometriosis interna en un animal. Conclusiones: Este nuevo modelo de implante nos puede ayudar a comprender mejor los mecanismos involucrados en la aparición de endometriosis, tanto interna como externa. ß 2011 SEGO. Publicado por Elsevier España, S.L. Todos los derechos reservados. Induction of endometriosis in Wistar rats through autologous transplantation of a uterine fragment over a previous scar in the left uterine horn Abstract Objective: To study the possibility of inducing internal or external endometriosis in Wistar rats through a new microsurgical model known as PGR 1. * Autor para correspondencia. Correo electrónico: [email protected] (P. González Ramos). 0304-5013/$ — see front matter ß 2011 SEGO. Publicado por Elsevier España, S.L. Todos los derechos reservados. doi:10.1016/j.pog.2011.08.016 Inducción de endometriosis en rata Wistar, mediante autotransplante de fragmento uterino, sobre anastomosis uterina previa 115 Subjects and methods: Eleven Wistar rats underwent autologous transplantation of a uterine fragment over a deliberately created scar. After 8 weeks, a further intervention was carried out to inspect the abdominal cavity and take samples for pathological analysis. Results: Macroscopic results consisted of adhesions mainly affecting the implant and yellow vesicles. Microscopic findings consisted of vesicles/cysts, inflammatory phenomena, neovascularization, and internal endometriosis in one animal Conclusions: This new implant model could enhance our understanding of the mechanisms involved in the development of endometriosis, both internal and external. ß 2011 SEGO. Published by Elsevier España, S.L. All rights reserved. Introducción Material quirúrgico La endometriosis es una enfermedad ginecológica que afecta fundamentalmente a las mujeres en edad reproductiva. Se define por la presencia de tejido endometrial, funcional, fuera de la cavidad uterina y puede provocar dolor pélvico e infertilidad en la mujer que la padece. Todavı́a no se conocen con exactitud los mecanismos subyacentes al establecimiento y el desarrollo de esta patologı́a. Los modelos animales1 permiten estudiar la secuencia temporal de los eventos involucrados en la génesis y en la progresión de la enfermedad. Además, esta enfermedad se produce de forma espontánea sólo en los seres humanos y los primates no humanos, por lo que hay problemas prácticos relacionados con los modelos utilizados para su estudio. Las lı́neas actuales de investigación, basadas principalmente en la teorı́a de la menstruación retrógrada, descrita por Sampson en 1927, han ido estableciendo los múltiples factores bioquı́micos, inmunológicos y moleculares implicados en la fisiopatologı́a de la endometriosis2. Si se tiene en cuenta que el implante endometriósico requiere cinco pasos fundamentales –—adhesión, invasión, reclutamiento, angiogénesis y proliferación–— para desarrollarse, serán los dos primeros procesos, los que deberı́amos estudiar, con la perspectiva de encontrar algún factor que facilite su diagnóstico o tratamiento2-4. Dentro de esta lı́nea de investigación hemos querido estudiar el comportamiento de un autotransplante de fragmento uterino en la rata Wistar, sobre una cicatriz creada para conseguirlo. Todos los procedimientos quirúrgicos fueron realizados bajo condiciones de esterilidad. Para la realización de los procedimientos microquirúrgicos utilizamos un microscopio operatorio binocular de la marca Leica. Instrumental quirúrgico convencional para la realización de la laparatomı́a: Material y métodos Para la realización del presente trabajo, empleamos once ratas Wistar hembra con un peso aproximado de 200 g y una edad de 10 semanas. Los animales fueron proporcionados y estabulados por el servicio de biomedicina y biomateriales, de los Servicios de Apoyo a la Investigación, de la Universidad de Zaragoza. Todos los procedimientos fueron llevados a cabo siguiendo un protocolo de actuación autorizado por la comisión de ética para la experimentación animal de la Universidad de Zaragoza (número de registro PD 12/10). Los animales fueron identificados en el momento de la estabulación con las siglas CPC y el número desde 01 al 11, correlativamente. Todos los animales fueron pesados en una báscula de precisión para animal vivo marca Mettler Toledo. — — — — — Bisturı́ estéril desechable del n.8 11. Porta agujas macroquirúrgico. Pinzas de disección de Adson. Tijeras de corte de Mayo. Tijeras de disección de Metzenbaum. Instrumental microquirúrgico empleado para la inducción experimental de endometriosis: — — — — Porta agujas microquirúrgico. Pinzas de disección microquirúrgicas. Tijeras de Westcott. Bisturı́ eléctrico bipolar marca Martin. Procedimientos quirúrgicos Procedimiento anestésico Todos los animales fueron sometidos a anestesia general inhalatoria, empleando un aparato de anestesia para pequeños animales marca Abbott, con vaporizador de anestesia marca Draguer, usando como gas anestésico el sevoflurano vehiculizado con oxı́geno. Para la inducción anestésica de estos animales, se utilizó una cámara de inducción de anestesia de animal de laboratorio de metacrilato, conectada al aparato de anestesia con un 5% de concentración del gas anestésico sevoflurano. El mantenimiento de la anestesia se realizó mediante mascarilla rostral para rata, conectada al aparato de anestesia, con la misma concentración de gas anestésico que la utilizada en la cámara de inducción. Primera laparotomı́a Con el animal anestesiado, se procede al rasurado y desinfección del abdomen, para realizar una laparotomı́a media infraumbilical, mediante una incisión de aproximadamente unos 3 cm de longitud (fig. 1). 116 P. González Ramos et al Figura 3 Autotrasplante del fragmento uterino, envolviendo parcialmente la cicatriz resultante de la anastomosis términoterminal, de donde procede el fragmento. Tras conseguir una adecuada exposición y observación de los cuernos uterinos (fig. 1), tomamos el cuerno izquierdo y medimos, por medio de una regla estéril milimetrada, 15 mm, desde el cuello uterino hacia el infundı́bulo, donde realizamos una incisión transversal de las tres capas histológicas (serosa, muscular y mucosa endometrial) del cuerno, pero manteniendo la vascularización mesometrial. A 5 mm de dicha incisión, practicamos otra de las mismas caracterı́sticas, para obtener el segmento que nos servirá de implante (fig. 1). La superficie antimesentérica del segmento ası́ obtenido es seccionada longitudinalmente en todo su espesor (fig. 2), consiguiendo una exposición total de la mucosa endometrial. Seguidamente, los extremos resultantes del cuerno uterino izquierdo, son anastomosadas término-terminalmente, mediante una sutura seromuscular de acido poliglicólico 8/0, necesitando 5-6 puntos. Dicha anastomosis, es cubierta a su vez por la mucosa endometrial del segmento («del mismo modo que una salchicha es envuelta por el pan en un perrito caliente», por este motivo denominamos al implante «PGR-1 hot dog»). Los bordes antimesentéricos del implante se suturan, con 4 puntos seromusculares (dos en cada lado), con sutura de ácido poliglicólico de 8/0, al cuerno anastomosado, de manera que quede implantado el segmento cubriendo parcialmente la anastomosis término-terminal, evitando una compresión excesiva que pudiera dañar el contenido envuelto (fig. 3). Una vez realizado el implante, se procede a la desvascularización del mismo mediante una electrocoagulación bipolar (figs. 4 y 5). Figura 2 Sección completa antimesentérica del segmento uterino, aislado para el autotrasplante. Figura 4 Desvascularización del fragmento uterino con coagulación bipolar tras finalizar el autotrasplante. Figura 1 Campo operatorio microquirúrgico y preparación del segmento uterino para el autotrasplante. Inducción de endometriosis en rata Wistar, mediante autotransplante de fragmento uterino, sobre anastomosis uterina previa 117 — Anestesia local en bordes de la herida con 1 cc de bupivacaı́na. Una sola infiltración después de haber realizado la intervención microquirúrgica. Segunda laparotomı́a Figura 5 Aspecto final del autotransplante PGR-1 hot-dog alrededor del cuerno uterino izquierdo. Finalmente, se cierra la laparotomı́a sutura continua de ácido poliglicólico de 4/0 para la fascia y 5-6 puntos de seda de 3/0 para la piel. Tras las intervenciones todos los animales recibieron el siguiente tratamiento: — Profilaxis antibiótica con cefazolina 1 mg/rata. Durante tres dı́as consecutivos. — Analgesia con meloxicam 0,08 mg/rata. Durante tres dı́as consecutivos. Ocho semanas después del procedimiento de inducción de endometriosis, se procede a realizar la segunda laparatomı́a en todos los animales. Una vez identificado el implante, se comprueba su aspecto macroscópico observando su coloración, presencia de adherencias o necrosis. Se revisa toda la cavidad abdominal y finalmente se realiza una histerectomı́a y anexectomı́a bilateral, para estudio anatomopatológico. Por último, se procede al sacrificio del animal anestesiado, con sobredosis de pentobarbital sódico vı́a intracardiaca. Material para estudio anatomo-patológico Aparato reproductor de 11 ratas hembra con inducción microquirúrgica experimental de endometriosis. Las muestras fueron fijadas en formaldehı́do al 10% neutro durante 24 h y transferidas posteriormente a etanol 708. De este material se obtuvieron secciones longitudinales del cuerno derecho, del cuerno uterino izquierdo y de zona de vagina y unión de ambos cuernos uterinos. Estas muestras fueron procesadas por métodos histológicos ruti- a b Figura 6 A) Vesı́culas amarillentas. B) Adherencias en la zona próxima al implante. 118 P. González Ramos et al narios, obteniéndose secciones a 3 mm que fueron teñidas con el método de hematoxilina-eosina (HE). Resultados Hallazgos macroscópicos En los 11 animales, a las ocho semanas del autotrasplante uterino, al inspeccionar la cavidad peritoneal nos encontramos, en mayor o menor grado, en todos los animales: — Vesı́culas amarillentas (fig. 6A). — Adherencias sobre el intestino y la grasa mesometrial (fig. 6B). Estas lesiones afectaban principalmente al cuerno uterino sometido al implante. Hallazgos microscópicos En los 11 animales, comparando los hallazgos microscópicos con el cuerno uterino normal, donde distinguimos las capas histológicas: mucosa, muscular y serosa (fig. 7A), apreciamos en la zona del implante del cuerno autotrasplantado, una vesı́cula/quiste de paredes aplanadas, con todas o algunas de las capas histológicas (fig. 7B). También encontramos una intensa vascularización que no solo afectaba a la zona del implante (fig. 8A), sino también a la bolsa ovárica y al cuerno uterino y bolsa ovárica contralaterales. Otro de los hallazgos microscópicos que nos llamó la atención fue la observación de una dilatación de la bolsa ovárica, sin existir obstrucción del cuerno uterino, tanto en el lado intervenido como en el contralateral, con una marcada angiogénesis (fig. 8B). También apreciamos una reacción inflamatoria peritoneal, con aumento de la vascularización y aparición de micromineralizaciones, localizada fundamentalmente en la zona de grasa mesometrial próxima al implante. La zona de unión de ambos cuernos uterinos, ası́ como la vagina presentaban aspecto normal y no hemos encontrado células endometriales recubriendo las vesı́culas amarillas más lejanas al implante. En 1 de los 11 animales, distinguimos glándulas y estroma endometriales entre los haces musculares desorganizados, en la zona de cuerno uterino donde asentaba el autotransplante (fig. 9). Discusión Ası́ como la endometriosis es una enfermedad relativamente frecuente en mujeres en edad reproductiva, en animales es rara. Quizá sea también más difı́cil de diagnosticar, como explica Ortega5,6. Teniendo en cuenta la teorı́a de la menstruación retrógrada, como causa de la endometriosis, en animales este fenómeno es más difı́cil de producirse, ya que en muchos de ellos existe una bolsa ovárica que facilita la captación ovular y aı́sla el peritoneo pélvico de los fluidos uterinos. Además, la menstruación como tal fenómeno solo se produce en las monas. Por este motivo los primates son los modelos animales ideales para el estudio y la investigación de endometriosis en humana, pero debido a su alto coste, problemas éticos y difı́cil manejo se han propuesto otros modelos animales, de los que la rata Wistar es uno de los más utilizados. Desde que Vernon y Wilson1 describieran la técnica microquirúrgica para inducir la endometriosis en rata Wistar, otros autores6,7 han introducido variantes de la misma como: — Localización anatómica del implante. — Composición del mismo: serosa, muscular, mucosa; o solo mucosa. En nuestro trabajo, la variación ha consistido en el lugar de colocación del implante. Este lo situamos alrededor de una cicatriz uterina del cuerno izquierdo, producida por la obtención del implante (fragmento uterino que contenı́a serosa, muscular y mucosa uterina). El motivo era intentar averiguar si, además de una endometriosis externa, se podrı́a producir además una endometriosis interna. b a S M MU Vesícula / Quiste - IMPLANTE - Figura 7 A) Cuerno uterino normal. B) Implante que ha formado una vesı́cula/quiste. MC: muscular; MU: mucosa; S: serosa. Inducción de endometriosis en rata Wistar, mediante autotransplante de fragmento uterino, sobre anastomosis uterina previa 119 b a Dialatación Bolsa ovárica Figura 8 A) Autotrasplante (vesı́cula/quiste) con neovascularización en su periferia. B) Dilatación de la bolsa ovárica con marcada hiperemia. en las zonas anexiales que además presentaban una dilatación de la bolsa ovárica, sin existir obstrucción del cuerno uterino. Este hecho habları́a a favor de la existencia de substancias proinflamatorias, en respuesta a la presencia de un elemento extraño por su localización, el implante uterino, con probable implicación de los macrófagos peritoneales8 y las citocinas9 por ellos liberadas, fundamentalmente el factor de necrosis tumoral y el factor de crecimiento endotelial vascular10. Alcázar11 también describe este fenómeno de la angiogénesis en humana, al observar un incremento de la vascularización durante la exploración ecográfica de los ovarios de mujeres con endometriomas, con una relación directa con la presencia de dolor pélvico, en relación a las que no presentaban endometriomas ováricos. Figura 9 Haces musculares desorganizados entre los que se ven glándulas endometriales. La endometriosis inducida en rata Wistar viene definida: — Macroscópicamente, por la aparición de vesı́culas amarillentas, además de presencia de procesos adherenciales. En nuestro modelo se cumple este precepto. Ası́, como Quereda7 hemos hallado, además del proceso adherencial, vesı́culas conteniendo lı́quido estral amarillento, rodeadas o no de las capas uterinas que constituı́an el fragmento autotrasplantado. — Microscópicamente, se encuentran vesı́culas/quistes, fenómenos inflamatorios y marcada neoangiogénesis. Estos procesos están localizados fundamentalmente en la zona del implante o próximos a él. En nuestro caso, hemos hallado estos fenómenos y además una neoangiogénesis en localizaciones más distales al implante, como Otra diferencia en nuestro trabajo, en relación con otras técnicas de inducción de endometriosis en rata Wistar es: la posibilidad de estudiar la endometriosis interna o adenomiosis. Pensamos que este hecho diferencial pueda estar motivado por el tipo de implante, que abrazado a la cicatriz puede desarrollar una endometriosis interna. En nuestro estudio, solo ha ocurrido en uno de los animales, mientras que la aparición de vesı́culas y la angiogénesis se han producido en todos los modelos descritos. Serı́an necesarios por tanto más estudios y aplicar métodos estadı́sticos para confirmar el implante PGR-1 hot dog como método válido, para producir endometriosis interna en rata Wistar. La intención final de este trabajo, tras validar el implante, como ası́ parece al compararlo con los resultados de inducción de endometriosis en rata wistar, obtenidos por otros autores1,6,7, serı́a ver cómo responde a las nuevas terapias desarrolladas para curar la enfermedad endometriósica en humana, aliviar el dolor que produce o mejorar las posibilidades de fertilidad en la mujer que la padece, tanto de forma natural, como utilizando técnicas de reproducción asistida12. 120 P. González Ramos et al Conclusiones Agradecimientos Por tanto, en cuanto a nuestro trabajo con este modelo de inducción de endometriosis: interna y externa, que denominamos PGR- 1 hot dog creemos más que posible la siguiente secuencia de hechos. Al Instituto Aragonés de Ciencias de la Salud. Al equipo de microcirugı́a: Dra. González Pastor, Dra. Pastor Oliver y al Dr. Gómez-Arrue Azpiazu. Al personal del Servicio de Biomedicina y Biomateriales de los Servicios de Apoyo a la Investigación de la Universidad de Zaragoza: Alicia Arnal Ortiz, Aurora Garcı́a Encina, Luı́s Mógica Lozano, Carmen Navarro Lapeña y Marı́a Pérez Palomero. A la Unidad de Apoyo a la Investigación, Anatomı́a Patológica: Dra. Alba de Martino Rodrı́guez. A la Unidad de Apoyo a la Investigación y Separación Celular: Dr. J .Godino. 1. El implante PGR-1 permanece viable y responde a las hormonas ováricas. Es decir, se revasculariza y no se necrosa. 2. El lı́quido estral generado por la mucosa uterina del implante se vierte al peritoneo y a la sutura terminoterminal, ocasionando una reacción inflamatoria. 3. La reacción inflamatoria producida por el vertido de lı́quido endometrial en peritoneo entre otros, provocarı́a una peritonitis local, una neoangiogénesis local y a distancia, desencadenando un aislamiento del implante por la grasa miometrial, vejiga e intestino, que impedirá finalmente la salida de más lı́quido estral. 4. El lı́quido estral a distancia forma las vesı́culas más amarillentas, más densas, hipotéticamente el lı́quido más antiguo. 5. El lı́quido estral acumulado en el implante va adelgazando el mismo, ya que se ha taponado su salida por el mecanismo anteriormente descrito, ocasionando un adelgazamiento de la pared de implante que formarı́a una vesı́cula que contendrı́a un lı́quido más seroso, menos amarillento y que alcanzada una presión determinada impedirı́a finalmente el funcionamiento de la mucosa uterina o producirı́a su fragmentación, liberando el contenido. Por este motivo, a veces no visualizamos el implante completo. 6. El lı́quido estral proveniente de los cuernos uterinos, incluido el cuerno uterino izquierdo abrazado por el implante, drenarı́a por su espacio natural, sin ocasionar dilatación intraluminal. Por tanto, creemos que la hiperemia y la dilatación de los ovarios en algunas ratas y dado que se producen también a veces en el ovario contralateral al lado del implante, se producirı́a por el lı́quido estral del implante y no como consecuencia de la obstrucción del cuerno uterino. Este hecho nos parece relevante por el especial tropismo que muestran las células endometriales sobre el ovario y trompa, lugares de frecuente localización de endometriosis en humana. Este nuevo tipo de autotransplante uterino en rata Wistar nos puede ayudar a entender mejor los mecanismos fisiopatológicos implicados en la aparición de la endometriosis: interna y externa. Conflicto de intereses Los autores declaran no tener ningún conflicto de intereses. Bibliografı́a 1. Vernon MW, Wilson EA. Studies on the surgical induction of endometriosis in the rat. Fertil Steril. 1985;44:684—94. 2. Ayala Yánez R, Mota González M. Endometriosis: fisiopatologı́a y lı́neas de investigación (primera parte). Ginecol Obstet Mex. 2007;75:477—83. 3. Oktem M, Esinler I, Eroglu D, Haberal N, Bairaktar N, Zeineloglu H. High-dose atorvastatin causes regression of endometriotic implants: a rat model. Hum Reprod. 2007;22:1474—80. 4. Triantafillidis JK, Papalois AE, Parasi A, Anagnostakis E, Burnazos S, Giteas A, et al. Favorable response to subcutaneous administration of infliximab in rats with experimental colitis. World J Gastroentelol. 2005;11:6843—7. 5. Ortega J. Receptor concentrations for estradiol and progesterone in surgically induced endometriosis in the rat. Eur J Obst Gynecol Reprod Biol. 1994;54:123—6. 6. Ortega J. Comparación de dos técnicas para inducir la endometriosis experimental en la rata. Clin Inv Gin Obst. 1994;21:54—9. 7. Quereda F, Barroso J, Acién P. Endometriosis inducida en rata Wistar: avances en la caracterización del modelo experimental. Prog Obst Gin. 1995;38:111—7. 8. Lin YJ, Lai MD, Lei HY, Wing LY. Neutrophils and macrophages promote angiogenesis in he early stage of endometriosis in a mouse model. Endocrinology. 2005;147:1278—86. 9. Umezawa M, Sakata C, Tanaka N, Kudo S, Tabata M, Takada K, et al. Cytokine and Chemokine expression in a rat endometriosis similar to that in human endometriosis. Cytokine. 2008;43: 105—9. 10. Garcı́a-Manero M, Alcazar JL, Toledo G. Vascular endotelial growth factor (VEGF) and ovarian endometriosis: correlation between VEGF serum levels, VEGF cellular expression, and pelvic pain. Fertil Steril. 2007;88:513—5. 11. Alcázar JL, Garcı́a-Manero M. Ovarian endometrioma vascularization in women with pelvic pain. Fertil Steril. 2007;87: 1271—6. 12. Landazabal A, Villasante A, Scheffer B, Arbués J, Requena A, Giles J, et al. Endometriosis y técnicas de reproducción asistida. En: Remohı́ J, Simón C, Pellicer A, editors. Reproducción Humana. Aravaca: Mc GrawHill; 2002. p. 221—5. Prog Obstet Ginecol. 2012;55(3):121—124 PROGRESOS de OBSTETRICIA Y GINECOLOG ÍA w w w. e l s e v i e r. e s / p o g CASO CLÍNICO Tumor de Krukenberg secundario a carcinoma de colon durante el embarazo Silvia Pérez López a,*, Ana Belén Partal Lorente a, Marı́a José Campos Pinel a, Carmen Pallarés Ayuso a, Diego Alcalde Pérez b, Teresa Mena Ramı́rez a y Juan Manuel Torres Martı́ a a b Servicio de Obstetricia y Ginecologı́a, Complejo Hospitalario Ciudad de Jaén, Jaén, España Servicio de Anestesiologı́a y Reanimación, Complejo Hospitalario Ciudad de Jaén, Jaén, España Recibido el 28 de diciembre de 2010; aceptado el 4 de mayo de 2011 Accesible en lı́nea el 4 de febrero de 2012 PALABRAS CLAVE Carcinoma de ovario; Embarazo; Tumor de Krukenberg Resumen El tumor de Krukenberg se define como aquel tumor metastásico en ovario uni o bilateral que contiene cantidades importantes de células en anillo de sello y cuyo origen es principalmente digestivo. La incidencia de tumores metastásicos en ovario es muy pequeña (1-5%); asimismo la coincidencia de una masa ovárica de caracterı́sticas malignas metastásicas con una gestación es ı́nfima. Presentamos el caso de una mujer de 19 años que tras el diagnóstico de un adenocarcinoma mucinoso de colon, a los 18 meses presenta un tumor de Krukenberg en la semana 29 de gestación. En un primer momento se le realizó cesárea junto a cirugı́a resectiva del tumor. En un segundo tiempo se le practicó cirugı́a citorreductora asociada a quimioterapia intraperitoneal intraoperatoria hipertérmica, encontrándose actualmente en remisión clı́nica y en seguimiento por el servicio de oncologı́a. ß 2010 SEGO. Publicado por Elsevier España, S.L. Todos los derechos reservados. KEYWORDS Krukenberg tumor secondary to carcinoma of the colon during pregnancy Ovarian carcinoma; Pregnancy; Krukenberg tumor Abstract Krukenberg tumor is defined as a metastatic uni- or bilateral ovarian tumor that contains significant amounts of signet ring cells and whose origin is mainly gastrointestinal. The incidence of metastatic tumors of the ovary is very small (1-5%), and that of the concurrence of an ovarian mass with metastatic malignant features and pregnancy is negligible. We report the case of a 19-year-old woman who, 18 months after diagnosis of a mucinous adenocarcinoma of the colon, was diagnosed with a Krukenberg tumor in the 29th week of pregnancy. Initially, cesarean section together with tumoral resection was performed. In a second stage, cytoreductive surgery was performed with hyperthermic intraoperative intraperitoneal * Autor para correspondencia. Correo electrónico: [email protected] (S. Pérez López). 0304-5013/$ — see front matter ß 2010 SEGO. Publicado por Elsevier España, S.L. Todos los derechos reservados. doi:10.1016/j.pog.2011.08.009 122 S. Pérez López et al chemotherapy. The patient is currently in clinical remission and is monitored by the oncology service. ß 2010 SEGO. Published by Elsevier España, S.L. All rights reserved. Introducción La aparición de una masa ovárica durante la gestación presenta para el ginecólogo un reto en cuanto al diagnóstico diferencial, las posibilidades de tratamiento y el momento de su extirpación en caso de malignidad. La aparición de un cáncer ovario durante el embarazo es infrecuente; la incidencia de esta enfermedad oscila entre 1/10.000 a 1/50.000)1,2. La mayorı́a de las masas ováricas presentan caracterı́sticas histológicas benignas del tipo cistoadenoma o fibromas. Tan solo un 2-5% del total de tumores ováricos diagnosticados durante el embarazo son malignos; solo el 5-10% de estas masas ováricas malignas son metastásicas y en muchos de los casos se desconoce la localización del tumor primario3. Nuestro caso clı́nico está entre esta escasa proporción de tumores ováricos malignos metastásicos, concretamente un tumor de Krukenberg4. Se presenta el caso singular de una joven de 19 años que, tras ser diagnosticada y tratada de un adenocarcinoma mucinoso de colon descendente, aparece en el segundo trimestre de embarazo un tumor de ovario metastásico con células en anillo de sello. Caso clı́nico Paciente de 19 años de edad, primigesta de 29 semanas, que acude a urgencias por malestar general, decaimiento, disnea y dolor abdominal. Como antecedentes personales de interés destaca una intervención quirúrgica 18 meses antes por un adenocarcinoma mucinoso de colon descendente ulcerado y perforado en estadio T4N0M0, habiendo recibido posteriormente 6 meses de quimioterapia sistémica adyuvante según esquema Folfox, que finalizó 3 meses antes de quedar embarazada. Se trataba de una gestación no controlada hasta la semana 19 de gestación, ya que la paciente se encontraba en amenorrea tras la aplicación de la quimioterapia, que transcurre con normalidad hasta el momento del ingreso, salvo un episodio de cólico renoureteral derecho que fue resuelto con analgesia en 48 h. En la ecografı́a realizada al ingreso se detecta la presencia de lı́quido libre intraabdominal en ambos flancos, en la región subhepática y subesplénica, ası́ como una formación en el hemiabdomen derecho que se extiende desde la pelvis hasta la región subhepática (fig. 1). Al segundo dı́a de ingreso se realiza una ecografı́a Doppler que confirma la existencia de dicha masa con vascularización interna de baja resistencia, indicativa de recidiva tumoral dados los antecedentes personales de la paciente. También se observa la presencia de ascitis hasta el nivel hepático y en ambas gotieras parietocólicas hasta el nivel diafragmático. La ecografı́a obstétrica muestra un feto único hembra en posición cefálica con biometrı́a acorde a edad gestacional, con Doppler umbilical normal y notch protodiastólico en arteria uterina izquierda (fig. 2). Se decide iniciar maduración pulmonar y se solicita una RM que confirma el diagnóstico de posible neoformación ovárica derecha sospechosa de malignidad. Tras estudiar el caso decidimos, por interés fetal, esperar hasta la semana 31 para programar una cesárea electiva y laparotomı́a exploradora en el mismo acto quirúrgico. El dı́a previo a la intervención, se realiza una paracentesis evacuadora para mejorar la función respiratoria de la paciente, extrayendo 3.800 cc de lı́quido ascı́tico. La intervención quirúrgica consistió en una laparotomı́a supra e infraumbilical: en un primer tiempo se realiza la cesárea programada, con nacimiento de feto mujer con Apgar de 7/8 y 1.630 g de peso, que ingresa en la UCI pediátrica. En un segundo tiempo se practica la exploración de la cavidad abdominal y la toma del lı́quido ascı́tico para citologı́a, donde observamos una tumoración ovárica de aproximadamente 17 cm de longitud que presenta adherencias laxas al peritoneo posterior y lacara inferior hepática. Posteriormente, se le practicó una ooforectomı́a derecha y cuña de ovario izquierdo. El informe anatomopatológico determinó que se trataba de «metástasis de carcinoma de células en anillo de sello con áreas de necrosis y hemorragia con perfil inmunohistoquı́mico compatible con metástasis de adenocarcinoma de colon. Cuña de ovario izquierdo sin alteraciones y citologı́a de lı́quido ascı́tico positivo para células malignas. Fragmento de epiplón sin infiltración y escasas células tumorales aisladas en un ganglio extirpado de ı́leon terminal». El postoperatorio cursó con normalidad hasta el octavo dı́a post-intervención, cuando la paciente precisó ingreso en la UCI debido a una trombosis de la vena cava superior izquierda, tronco braquiocefálico y yugular del mismo lado, secundaria a una infección del catéter de la vı́a central. Figura 1 Visión laparoscópica del útero doble. Tumor de Krukenberg secundario a carcinoma de colon durante el embarazo Figura 2 123 Urografı́a intravenosa donde se evidencia la ausencia del sistema nefrourológico derecho. Además, durante su estancia en la UCI debutó con un cuadro de insuficiencia respiratoria severa, con derrame pleural y pericárdico, y fue diagnosticada de gripe A. La paciente presentó una evolución satisfactoria y fue dada de alta una semana más tarde. En seguimiento en servicio de oncologı́a, se decide, tras la presentación en sesión clı́nica, su remisión a centro de referencia para completar la cirugı́a de posible enfermedad abdominal más quimioterapia intraperitoneal hipertérmica tras el estudio de extensión extraabdominal negativo. Se completan la omentectomı́a y la peritonectomı́a, y se realiza una ooforectomı́a izquierda por quiste de ovario sospechoso durante la intervención; asimismo se administra quimioterapia intraperitoneal hipertérmica según protocolo Sugerbaker durante 60 min a 42 8C. En la anatomı́a patológica remitida se confirma la metástasis de carcinoma mucinoso con componente de células en anillo de sello en el ovario izquierdo, el resto de las piezas fueron negativas. Un año después de la última cirugı́a, la paciente continúa en seguimiento en la consulta de oncologı́a en estado de remisión clı́nica. Discusión La asociación de cáncer de ovario y embarazo es muy infrecuente, ya que tan solo el 2-5% del total de los tumores ováricos son malignos. El ovario es una localización frecuente de metástasis de determinados carcinomas primarios, siendo alrededor del 510% de los tumores ováricos de origen no primario5. Durante el embarazo, la aparición de una masa ovárica puede en muchas ocasiones llevarnos a pensar que estamos ante un luteoma o una reacción luteı́nica exagerada6; es excepcional la presencia de una masa maligna y más aún de un tumor de Krukenberg. En la bibliografı́a nacional solo hemos encontrado 2 casos publicados en los que el primario era gástrico y se diagnosticó primero la masa en el ovario4,7. El tumor de Krukenberg fue descrito por primera vez por Friedrich Krukenberg en 1896 y se define por dos caracterı́sticas: en primer lugar, por la existencia de células en anillo de sello en más o menos cantidad, acompañadas de material mucógeno y proliferación sarcomatosa sobre un estroma celular5. Por otro lado, es una variedad especial de carcinoma metastásico cuyo origen más frecuente es digestivo, preferentemente gástrico (40-70%), seguido de intestino grueso (aproximadamente un 14%), aunque también puede originarse en otros órganos que contengan glándulas mucosas, como puede ser el páncreas (5%) o la vesı́cula biliar; en muy raras ocasiones proviene de órganos extradigestivos, como el tiroides, la mama o la vejiga8. La edad promedio de presentación suele rondar los 40 años, siendo generalmente más jóvenes aquellas pacientes cuyo primario es gástrico o de mama que si proviene de otro origen. La clı́nica de estos tumores suele ser larvada y generalmente cuando son diagnosticados suelen estar en un estadio avanzado. La coincidencia con la gestación puede adelantar su diagnóstico, ya que el seguimiento ecográfico de las pacientes gestantes puede diagnosticar una masa ovárica de forma fortuita. El hecho de que la masa no fuera detectada en la ecografı́a de la semana 20 nos habla de la agresividad y la rápida evolución de dicha tumoración. Durante la gestación, los sı́ntomas que pueden presentar estas pacientes pueden ser enmascarados por los propios de su estado. Ası́ la disnea, la sensación de plenitud o el dolor abdominal pueden ser atribuidos a molestias propias del embarazo. El hecho que nuestra paciente presentaba un antecedente de cáncer tan reciente nos hace sospechar la posibilidad de que dicha masa sea metastásica. En numerosos casos las metástasis ováricas se diagnostican antes de que el tumor primario7,9; incluso puede ocurrir que la extensión de la enfermedad nos impida determinar su origen4. Las vı́as de diseminación metastásica al ovario de la tumoración primaria del intestino pueden ser varias: por continuidad, por vı́a linfática, hematógena o a través del peritoneo4. En general, el pronóstico es muy malo, con una supervivencia media de 3 a 10 meses. Clásicamente, solo un 10% sobrevivı́a 2 años tras el diagnóstico. Los tumores primarios 124 de colon parecen tener mejor pronóstico que los de estómago, páncreas o mama7. Con la puesta en funcionamiento de los programas de cirugı́a citorreductora y quimioterapia intraperitoneal parece que la supervivencia ha aumentado, aunque no existen aún datos tras estos procedimientos9—12. La aplicación de quimioterapia intraperitoneal mejora la supervivencia y el intervalo libre de progresión para el cáncer de ovario avanzado. Sus limitaciones están relacionadas con el uso del catéter y la toxicidad del tratamiento13. En 1989, Sugerbaker, basado en el conocimiento de los mecanismos de implantación y desarrollo de células tumorales en el peritoneo, propuso un tratamiento de intensificación terapéutico regional y la utilización de quimioterapia regional intraperitoneal. Asociando hipertermia, se potencia el efecto terapéutico regional induciendo un shock tóxico directo sobre las células tumorales. Su aplicación requiere la ausencia de enfermedad extraperitoneal previo a su realización. La aplicación de este procedimiento en nuestra paciente parece fundamental para explicar la ausencia de clı́nica en el momento actual y su supervivencia tras el primer diagnóstico (2 años y medio). Conflicto de intereses Los autores declaran no tener ningún conflicto de intereses. Bibliografı́a 1. Xiao Li, Xiufou Y. Ovarian malignancies incidentally diagnosed during cesarean section: Analysis of 13 cases. Am J Med Sci. 2011;34:181—4. S. Pérez López et al 2. Aggarwal P, Kehoe S. Ovarian tumours in pregnancy: a literature review. Eur J Obstetrics Reprod Biology. 2011;155:119—24. 3. Prat J. Metastatic tumors to the ovary. En: IV Curso de Patologı́a Oncológica. Avances en patologı́a ginecológica y mamaria correlación clı́nica. Barcelona, 6-8 noviembre. 2000; p. 171—5. 4. Szajnert C. Tumores anexiales en pacientes embarazadas. Prog Obst Ginecol. 2002;45:185—91. 5. Bernek JS, Fu YS, Hanker NF. Cáncer ovárico. En: Berek JS, editor. Ginecologı́a de Novak. 12.a ed. México: Mc Graw -Hill. Interamericana; 1997. p. 1155—230. 6. Cabot R, Lee Harris N. Case 8-20120. A 22- year- old woman with hypercalcemia and a pelvic mass. N Engl J Med. 2010;362: 1031—40. 7. Martı́nez de la Ossa R, Jiménez Rı́os JA, Gallo JL, Muñoz C, Zorrilla F, Hermoso JC. Tumores ováricos metastásicos de origen gastrointestinal. Tumor de Krukenberg. Clin Invest Gin Obst. 1996;23:412—4. 8. Sandmeir D, Lobrinios JA, Vial Y. Bilateral Krukenberg tumors of the ovary during pregnancy. Eur J Ginecol J Oncol. 2000;21: 58—60. 9. Martı́n AM, Gorostidi S, Montero JJ. Gestacion y tumor de Krukenberg secundario a carcinoma gástrico. Prog Obst Ginecol. 2004;47:344—8. 10. Chu DZ, Lang NP, Thompson C, Osteen PK, Westbrook KC. Peritoneal carcinomatosis in non gynecologic malignancies: a prospective study of prognosis factors. Cancer. 1989;2:364—7. 11. Francois Y, Grandclement E, Sayag-Beaujard AC, Glenem O, Sadeghi- Looyen B. Chimiohyperthermie intraperitoneale avec mytomicine C dans les cancers de l’estomac avec carcinose peritonéale. J Chir. 1997;134:237—42. 12. Miron L, Marinca M. Intraperitoneal chemotherapy: the example of the ovarian cancer. J Chirurg. 2009;5:1584—9341. 13. Jaaback K, Johnson N. Quimioterapia intraperitoneal para el tratamiento inicial del cáncer de ovario epitelial primario (Revisión Cochrane traducida). En: La Biblioteca Cochrane Plus. 2008, n.8 4. Prog Obstet Ginecol. 2012;55(3):125—129 PROGRESOS de OBSTETRICIA Y GINECOLOG ÍA w w w. e l s e v i e r. e s / p o g CASO CLÍNICO Luteoma estromal ovárico como causa de virilización en la mujer posmenopáusica Daniel Abehsera Davó a,*, Mario Prieto Pozuelo b, David Hardisson Hernáez b, Alicia Hernández Gutiérrez a, Ana López Carrasco a y Javier Riveiro Villanueva c a Servicio de Obstetricia y Ginecologı́a, Hospital Universitario La Paz, Madrid, España Servicio de Anatomı́a Patológica, Hospital Universitario La Paz, Madrid, España c Servicio de Endocrinologı́a, Hospital Universitario La Paz, Madrid, España b Recibido el 23 de marzo de 2011; aceptado el 19 de julio de 2011 Accesible en lı́nea el 27 de octubre de 2011 PALABRAS CLAVE Enfermedades del ovario; Hiperandrogenismo; Hirsutismo; Luteoma; Virilización KEYWORDS Hirsutism; Hyperandrogenism; Luteoma; Ovarian diseases; Virilization Resumen Objetivo: Se presenta el caso de una paciente diagnosticada luteoma estromal de ovario con efecto virilizante. Material y métodos: Mujer de 67 años que presenta cuadro de virilización. A pesar de que no fue posible detectar mediante pruebas de imagen ningún tumor productor de andrógenos, se decidió someter a la paciente a una histerectomı́a y doble anexectomı́a debido a la fuerte sospecha clı́nica y analı́tica de un tumor productor de andrógenos de origen ovárico. Resultados: El estudio anatomopatológico de la pieza quirúrgica demostró la presencia de un luteoma estromal de ovario como causa del cuadro de virilización que presentaba la paciente. Conclusiones: El luteoma estromal de ovario es una rara neoplasia ovárica que se presenta habitualmente en mujeres posmenopáusicas y puede comenzar con sı́ntomas virilizantes o derivados de un ambiente hiperestrogénico. En un 20% de los casos, se diagnostica como un hallazgo incidental. ß 2011 SEGO. Publicado por Elsevier España, S.L. Todos los derechos reservados. Ovarian stromal luteoma as a cause of postmenopausal virilization Abstract Objective: We report the case of a patient diagnosed with a stromal luteoma of the ovary with a virilizing effect. Material and methods: A 67-year-old woman presented with symptoms of virilization. Although no androgen-producing tumor was detected on imaging tests, the patient underwent hysterectomy and double oophorectomy due to strong clinical and laboratory suspicion of an androgenproducing tumor of the ovary. * Autor para correspondencia. Correo electrónico: [email protected] (D. Abehsera Davó). 0304-5013/$ — see front matter ß 2011 SEGO. Publicado por Elsevier España, S.L. Todos los derechos reservados. doi:10.1016/j.pog.2011.09.004 126 D. Abehsera Davó et al Results: Pathologic study of the surgical specimen showed the presence of an ovarian stromal luteoma causing the patient’s virilization. Conclusions: Ovarian stromal luteoma is a rare ovarian neoplasm that usually occurs in postmenopausal women and may present as virilization or hyperestrogenism. In 20% of cases, the diagnosis is incidental. ß 2011 SEGO. Published by Elsevier España, S.L. All rights reserved. Introducción El luteoma estromal de ovario es una rara neoplasia ovárica que se presenta habitualmente en mujeres posmenopáusicas y puede comenzar con sı́ntomas virilizantes o derivados de un ambiente hiperestrogénico. En un 20% de los casos, se diagnostica como un hallazgo incidental1. Debido al pequeño tamaño que suelen tener estos tumores, el diagnóstico suele ser de exclusión, tras descartar otros tumores productores de hormonas sexuales en otras localizaciones. La escasa incidencia de estos tumores junto con la dificultad que plantea el diagnóstico por imagen de los mismos convierten al luteoma del estroma ovárico en un reto diagnóstico. Se presenta el caso de una paciente posmenopáusica que acudió al servicio de ginecologı́a funcional remitida desde la consulta de endocrinologı́a por un hiperandrogenismo clı́nico y analı́tico de causa desconocida. Caso clı́nico Paciente de 67 años que acude a la consulta de ginecologı́a funcional, remitida desde el servicio de endocrinologı́a, en donde se encuentra en seguimiento por un carcinoma papilar de tiroides, por la presencia de hirsutismo y virilización de aparición en los últimos 6 meses, que hace sospechar la presencia de un tumor de células de Sertoli-Leydig. La paciente no presenta antecedentes familiares de interés y como antecedentes personales destaca un carcinoma papilar de tiroides tratado con yodo 131 en remisión completa e hipertensión arterial controlada con tratamiento médico. Como antecedentes ginecológico-obstétricos presenta una edad de la menopausia a los 57 años y dos embarazos con partos eutócicos. Realiza sus revisiones ginecológicas de forma periódica. En la inspección de la paciente destaca hirsutismo de grado 12 según la escala de Ferriman-Galwey y obesidad con un ı́ndice de masa corporal (IMC) de 32. Presenta una exploración ginecológica normal, pero dificultosa por un importante panı́culo adiposo. Como pruebas de imagen se realizaron una tomografı́a computarizada (TC) abdomino-pélvica y una ecografı́a ginecológica. En la TC se descarta patologı́a de origen suprarrenal. La ecografı́a mediante sonda abdominal/vaginal muestra un útero en anteflexión irregular y no homogéneo, de 92 mm (diámetro longitudinal) 60 mm (diámetro anteroposterior) 75 mm (diámetro transversal), con un endometrio ecogénico y microquı́stico de 13 mm de espesor. Destacan 2 miomas intramurales de 32 mm en cara posterior y de 28 mm en el borde derecho uterino. Los anejos no se visualizan y el fondo de saco de Douglas aparece libre. Dentro de las pruebas de laboratorio, destaca una testosterona de 4,39 ng/ml (valores normales de 0-1) y una testosterona libre de 7,5 pg/ml (valores normales de 0-3,2); ACTH, cortisol basal, dehidroepiandrosterona sulfato, androstendiona y cortisol en orina dentro de valores normales. Ante la sospecha de un tumor productor de andrógenos de origen ovárico se decide programar una histerectomı́a y una doble anexectomı́a por vı́a laparoscópica. En la laparoscopia se observa un útero hipertrófico miomatoso y ambos ovarios de aspecto atrófico, sin evidencia de patologı́a. Destaca la presencia de una masa en el paraovario izquierdo de aproximadamente 2 cm. El resto de la cavidad abdominal presentaba un aspecto normal. Se realizó una histerectomı́a con doble anexectomı́a laparoscópica. El post-operatorio de la paciente cursó sin incidencias. En la revisión en consulta un mes después de la cirugı́a, la paciente presenta una recuperación completa de la intervención. Refiere que la cantidad de vello ha disminuido ostensiblemente y un aclaramiento notable en su voz. En la inspección se objetiva una disminución del hirsutismo según la escala de Ferriman-Galwey que ahora refleja un ı́ndice de 6. La exploración fı́sica es normal con una vagina ciega y en la ecografı́a no se objetiva patologı́a. Con respecto a las pruebas de laboratorio destaca un gran descenso de la testosterona que ahora se sitúa en valores normales (0, 65 ng/ml). Hallazgos macroscópicos: la pieza de histerectomı́a más doble anexectomı́a pesaba 168 g y el útero medı́a 100 60 40 mm. A la apertura de la pieza, el canal endocervical se encontraba parcialmente ocupado por una formación polipoide de 6 5 mm, y en la cavidad endometrial se identificaron otras dos formaciones polipoides, una de 23 11 mm y otra de 19 13 mm. En los cortes seriados, el miometrio presentaba un espesor de 17 mm y el endometrio medı́a 1 mm. En el espesor del miometrio se observaron dos miomas intramurales. El anejo izquierdo estaba compuesto por un ovario de 27 22 mm, en el que al corte presentaba una tumoración de bordes nı́tidos, no encapsulada, y que mostraba una coloración pardo-amarillenta y una consistencia firme (fig. 1). La trompa medı́a 50 10 mm y en el paraovario se identificó un nódulo calcificado de 22 13 mm. El anejo derecho estaba compuesto por un ovario de 25 10 mm y una trompa de 50 10 mm, ambos sin alteraciones macroscópicas. Hallazgos microscópicos: el nódulo descrito a nivel del ovario izquierdo se corresponde con una proliferación neoplásica compuesta por células que se disponen de una forma difusa, aunque también en pequeños cordones e islotes, separados por delgados septos de tejido fibroconectivo con abundantes vasos de pequeño calibre en su espesor (fig. 2). Las células muestran un citoplasma amplio, eosinófilo y ligeramente granular. Los núcleos son grandes, con una Luteoma estromal ovárico como causa de virilización en la mujer posmenopáusica Figura 1 El ovario izquierdo presentaba al corte una tumoración de 16 13 mm, bien circunscrita, de coloración pardoamarillenta. Figura 2 Las células neoplásicas se disponı́an en sábana, o formando cordones finos y pequeños nidos (HE 10). 127 Figura 3 Las células presentaban un citoplasma amplio, eosinófilo, ligeramente granular. Los núcleos eran grandes, de carioteca lisa, con un único nucléolo prominente. (HE 60). Figura 4 Se identificaron células espumosas de citoplasma claro adyacentes a finos tabiques fibroconjuntivos (Masson 20). carioteca lisa y una cromatina en grumos finos, con un prominente nucléolo (fig. 3). Alrededor de los tabiques fibroconectivos, las células muestran un citoplasma microvacuolado y de aspecto claro, con un núcleo similar al anteriormente descrito (fig. 4). En todos los cortes estudiados, no se observaron zonas de hemorragia o necrosis, actividad mitótica, pleomorfismo ni atipia citológica. Con técnicas de Oil-Red-O se demostró el contenido graso de las microvacuolas en las células de citoplasma espumoso. No se observaron cristales de Reinke. Con técnicas de inmunohistoquı́mica, las células tumorales fueron negativas para citoqueratinas y mostraron una tinción intensa y difusa para alfa-inhibina (fig. 5), calretinina y vimentina. Discusión Los tumores de células esteroideas son neoplasias infrecuentes que representan 0,1% del total de los tumores ováricos. Estos se dividen en 3 subtipos: luteoma estromal, tumor de células de Leydig y tumor de células esteroideas Figura 5 Con técnicas de inmunohistoquı́mica, las células presentaban una tinción citoplasmática frente a inhibina (inhibina 40). 128 sin otra especificación, que representa el 60% de estas neoplasias2,3. Los luteomas del estroma son tumores poco frecuentes que se desarrollan en mujeres posmenopáusicas4. Se cree que estas células neoplásicas esteroideas derivan del estroma, originándose desde células luteinizadas, o sus precursores, las células indiferenciadas fusiformes del estroma ovárico. En un principio, se prefirió designar estos tumores simplemente como parte del grupo de los tumores de células esteroideas, evitando su subclasificación, y sobre la base de la morfologı́a y no en relaciones histogenéticas. Esta controversia en la terminologı́a hace que una evaluación precisa de la incidencia sea difı́cil. Sin embargo, más de un autor ha coincidido en que un tumor pequeño, unilateral y bien circunscrito, compuesto de células luteinizadas sin cristaloides de Reinke, que se encuentra dentro del estroma ovárico, especialmente cuando se asocia a hipertecosis ovárica, indica un luteoma estromal4,5. El caso presentado se adaptaba a estas caracterı́sticas. Desde el punto de vista clı́nico, el sangrado vaginal anormal es el sı́ntoma inicial más común, presente en el 60% de las pacientes. Un 12% las pacientes presentarán virilización. Diversas series de casos clı́nicos (serie de Hayes y Scully6, serie Taylor y Norris7) muestran asociación entre estos tumores y el desarrollo de patologı́a endometrial, cambios que fueron atribuidos a la estimulación estrogénica prolongada y constante. Cabe destacar la presencia en el caso presentado de dos pólipos endometriales hallados tras la histerectomı́a. Hasta en un 20% de los casos, el luteoma estromal puede ser un hallazgo quirúrgico inesperado1. En pacientes con virilización, niveles séricos de testosterona de más de 2,0 ng/ml con dehidroepiandrosterona sulfato normales y sin evidencia de déficit de 21-hidroxilasa son muy sugestivos de un tumor ovárico virilizante8. En las imágenes ecográficas y de TC, estos tumores se manifiestan como masas sólidas. El contenido de lı́pidos produce abundantes áreas de baja atenuación en la TC, alta intensidad de señal en las imágenes de resonancia magnética nuclear (RM) potenciadas en T2 y T1 y el aumento intenso en las imágenes de RM obtenidas tras la administración de contrastes basados en gadolinio9. Sin embargo, la intensidad de la señal en las imágenes de RM potenciadas en T2 varı́a de acuerdo con el grado de estroma fibroso dentro de los tumores10. Aunque los tumores de células esteroides del ovario pueden ser sospechados por la historia clı́nica y el análisis hormonal, la RM es un método eficaz para la estadificación preoperatoria y puede ser apropiada para el diagnóstico de estos tumores8. Los luteomas son, en la mayorı́a de los casos, tumores de pequeño tamaño, inferiores a los 3 cm de diámetro, y unilaterales. Son masas sólidas, bien circunscritas, pero no encapsuladas y que presentan una coloración pardo-amarillenta, aunque en algunos casos muestran una coloración rojiza1. Microscópicamente, están compuestos por células ligeramente poligonales, de citoplasma amplio, eosinófilo y ligeramente granular. El núcleo es grande, muestra una cromatina en grumos finos y destaca la presencia de un nucléolo prominente y central. Las células se disponen de una forma difusa, aunque se pueden disponer formando pequeños cordones o nidos11. En un 20% de los casos, se D. Abehsera Davó et al pueden observar zonas de degeneración focal, con la formación de espacios irregulares similares a vasos o glándulas, y que contienen células cargadas de lı́pidos o infiltrado inflamatorio crónico1. El principal diagnóstico diferencial que se debe tener en cuenta son las otras dos entidades de los tumores de células esteroideas. El tumor de células de Leydig es también un tumor benigno, unilateral, que se da en mujeres postmenopáusicas y que cursa con sı́ntomas virilizantes en un 75% de los casos y que raramente se asocia con manifestaciones estrogénicas3. El diagnóstico definitivo se establece con la identificación de cristales de Reinke, que son unas estructuras aciculares eosinófilas, que en los cortes transversales tienen una morfologı́a hexagonal. Además, y a diferencia del luteoma estromal, el tumor de células de Leydig se acompaña de una hiperplasia hiliar de células de Leydig más que de una hipertecosis estromal. El tumor de células esteroideas sin otra especificación constituye el resto de los casos (60%) y se da en mujeres ligeramente más jóvenes (43 años de media). Esta neoplasia cursa en un 50% de los casos con androgenismo y en un 10% con sı́ntomas estrogénicos. Se trata habitualmente de masas sólidas, bien circunscritas, y de mayor tamaño que las dos entidades anteriores (8,4 cm de media) y de color pardo-anaranjado, dependiendo de la concentración de lı́pidos intracitoplasmáticos1,6. La importancia del diagnóstico de esta entidad es que en un 20% de los casos hay afectación extraovárica en el momento del diagnóstico y cursan con un comportamiento maligno entre un 25-43% de los casos6. El tratamiento de estos tumores consiste en su extirpación quirúrgica, ya que aunque el comportamiento maligno de los mismos es excepcional6, la sintomatologı́a derivada de la producción hormonal hace necesario el abordaje quirúrgico. En el caso que nos ocupa, se decidió la realización de una histerectomı́a con doble anexectomı́a dada la alta sospecha clı́nica y analı́tica de este tipo de tumores. El reducido tamaño del luteoma estromal (16 13 mm) y las caracterı́sticas ecográficas de estos tumores (aparecen como masas sólidas de ecogenicidad moderada9,10) favorecieron la no visualización ecográfica del tumor. Además, la obesidad de la paciente, con un IMC de 32, disminuye la sensibilidad en la exploración ecográfica. Conclusión El luteoma estromal de ovario es una neoplasia muy rara, que por su pequeño tamaño puede pasar inadvertida en las técnicas de imagen. Los sı́ntomas derivados de un hiperestrogenismo, tales como una hiperplasia o un adenocarcinoma de endometrio, o signos de virilización y una analı́tica compatible con estos trastornos, deben llamar nuestra atención. Los datos clave para llegar a un diagnóstico certero son la búsqueda exhaustiva de cristales de Reinke, cuya ausencia apoya el diagnóstico, y la presencia de una hipertecosis estromal bilateral. Otro hecho relevante, por su importancia pronóstica, es no encuadrar esta entidad en los tumores de células esteroideas sin otra especificación, puesto que algunos cursan con un comportamiento maligno. Luteoma estromal ovárico como causa de virilización en la mujer posmenopáusica Conflicto de intereses Los autores declaran no tener ningún conflicto de intereses. Bibliografı́a 1. Chico A, Garcia JL, Matias-Guiu X, Webb SM, Rodriguez J, Prat J, et al. A gonadotrophin dependent stromal luteoma: A rare cause of post-menopausal virilization. Clin Endocrinol. 1995;43:645— 9. 2. Ramı́rez JA, Suescún O, Palomino MC. Tumor de células esteroideas: reporte de un caso y revisión de la literatura. Rev Colomb Obstet Ginecol. 2010;61:61—6. 3. Yébenes L, Sánchez JI, De Santiago FJ, Santiago M, Gilsanz F, Suárez A, et al. Tumor de células de Leydig de ovario: una causa infrecuente de virilización en la mujer posmenopáusica. Prog Obstet Ginecol. 2005;48:448—52. 4. Roth LM. Recent advances in the pathology and classification of ovarian sex cord-stromal tumors. Int J Gynecol Pathol. 2006;25:199—215. 129 5. Dhingra KK, Sharma P, Khurana N, Chaturvedi KU. Ovarian stromal luteoma in a patient with endometrial carcinoma. J Obstet Gynaecol Res. 2008;34:283—5. 6. Hayes MC, Scully RE. Stromal luteoma of the ovary: A clinicopathological analysis of 25 cases. Int J Gynecol Pathol. 1987;6:313—21. 7. Taylor HB, Norris HJ. Lipid cell tumours of the ovary. Cancer. 1967;20:1953—62. 8. Wang PH, Chao HT, Lee RC, Lai CR, Lee WL, Kwok CF, et al. Steroid cell tumors of the ovary: clinical, ultrasonic, and MRI diagnosis–a case report. Eur J Radiol. 1998;26:269—73. 9. Outwater EK, Wagner BJ, Mannion C, McLarney JK, Kim B. Sex cord-stromal and steroid cell tumors of the ovary. RadioGraphics. 1998;18:1523—46. 10. Shanbhogue AK, Shanbhogue DK, Prasad SR, Surabhi VR, Fasih N, Menias CO. Clinical syndromes associated with ovarian neoplasms: a comprehensive review. Radiographics. 2010;30:903—19. 11. Yamada S, Tanimoto A, Wang KY, Shimajiri S, Sasaguri Y. Stromal luteoma and nodular hyperthecosis of the bilateral ovaries associated with atypical endometrial hyperplasia of the uterus. Pathol Int. 2009;59:831—3. Prog Obstet Ginecol. 2012;55(3):130—133 PROGRESOS de OBSTETRICIA Y GINECOLOG ÍA w w w. e l s e v i e r. e s / p o g CASO CLÍNICO Leiomioma vaginal Carlos Javier Valdera Simbron a,*, Matilde Nievas Soriano b, Miguel Ángel Marti Romero a, Francisco Pulido Fernandez b y Gabriel Fiol Ruiz a a b Servicio de Ginecologı́a y Obstetricia, Hospital Torrecárdenas, Almerı́a, España Servicio de Anatomı́a Patológica, Hospital Torrecárdenas, Almerı́a, España Recibido el 24 de junio de 2011; aceptado el 25 de julio de 2011 Accesible en lı́nea el 21 de noviembre de 2011 PALABRAS CLAVE Mioma; Leiomioma; Vagina Resumen Los leiomiomas son los tumores pélvicos más frecuentes en la mujer. Habitualmente se localizan en el útero siendo inusual encontrarlos en otras localizaciones como la vagina. Se presenta el caso de una paciente de 42 años que acude a consulta por una tumoración de 2 años de evolución en zona vulvovaginal izquierda sin otra sintomatologı́a. Al examen se palpa una tumoración en el labio mayor izquierdo que se extiende hacia fosa isquiorectal de unos 4 cm y que impronta hacia el recto pero sin infiltrarlo. La RMN de pelvis muestra una tumoración de naturaleza sólida-quı́stica vulvar y/o vaginal probablemente de naturaleza neoplásica que no involucra suelo pélvico y que llega hasta periné. Se realiza la extirpación del tumor por vı́a vaginal sin complicaciones. El estudio anatomopatológico confirmó el diagnóstico de leiomioma benigno. Se hace una revisión sobre el tema. ß 2011 SEGO. Publicado por Elsevier España, S.L. Todos los derechos reservados. KEYWORDS Vaginal leiomyoma Myoma; Leiomyoma; Vagina Abstract Uterine leiomyomas are the most common pelvic tumors in women. These neoplasms are usually found in the uterus and their development in other locations, such as the vagina, is unusual. We report the case of a 42-year-old woman who presented with a 2-year history of a tumor in the left vulvovaginal area with no other symptomatology. On examination, a tumor of approximately 4 cm could be palpated inside the left labia majora. The tumor extended to the ischiorectal fossa with an impression in the rectum but without infiltration. Pelvic magnetic resonance imaging showed a solid-cystic vulvar and/or vaginal tumor of likely neoplastic origin which did not involve the pelvic diaphragm and which reached the perineal area. Tumoral enucleation was performed through the vaginal route, with no complications. Pathological study confirmed a benign leiomyoma. A review of the topic is provided. ß 2011 SEGO. Published by Elsevier España, S.L. All rights reserved. Introducción * Autor para correspondencia. Correo electrónico: [email protected] (C.J. Valdera Simbron). Los leiomiomas vaginales son tumoraciones poco frecuentes en comparación con los de origen uterino. Algunas revisiones, 0304-5013/$ — see front matter ß 2011 SEGO. Publicado por Elsevier España, S.L. Todos los derechos reservados. doi:10.1016/j.pog.2011.07.007 Leiomioma vaginal como las realizadas por Ruggieri et al1 y Smitha et al2, permiten estimar en unos 300 los casos publicados en la literatura médica. Estas tumoraciones de origen benigno pueden aparecer en el ligamento ancho, ligamento úteroovárico, ligamento útero-sacro, vagina y vulva3, pudiendo llegar a alcanzar grandes tamaños. Habitualmente, son asintomáticas y su diagnóstico suele establecerse a partir de hallazgos accidentales en el examen ginecológico, aunque en ocasiones es la propia paciente quien las detecta4. Los sı́ntomas más frecuentes son por compresión del tracto urinario o dispareunia. Caso clı́nico Paciente de 42 años de edad, que acude a consulta por tumoración en zona vulvovaginal izquierda de 2 años de evolución. No refiere sintomatologı́a urinaria ni trastornos menstruales. Sin antecedentes de interés, salvo tres gestaciones, dos cesáreas y un aborto. La última citologı́a fue tomada 3 meses antes de la consulta y muestra cambios inflamatorios y metaplasia escamosa. Al examen ginecológico se observan genitales externos de apariencia normal. A la palpación encontramos una tumoración de unos 4 cm que abarca el labio mayor izquierdo y la zona isquiorrectal del mismo lado, no fija a planos profundos, bien encapsulada e indurada. Dicha tumoración era palpable al tacto rectal y no daba la impresión de compromiso de la mucosa rectal. Se intenta punción con aguja intramuscular obteniéndose escaso material serosanguinolento que se remite para estudio a anatomı́a patológica. Figuras 1 y 2 RM de pelvis que en secuencia sagital muestra en la zona vulvovaginal izquierda una imagen sólida, bien definida, hipointensa en T1 e hiperintensa en T2. 131 Se solicita una RM, que muestra una imagen adyacente a la región vulvovaginal izquierda, de apariencia sólida, bien definida que involucraba el músculo y el tendón del obturador interno, hipointensa en T1 e hiperintensa en T2, que medı́a 3,73 4,87 cm en la secuencia sagital y 7,10 3,65 cm en la secuencia coronal (figs. 1 y 2). La imagen involucraba la región vaginal, los labios menor y mayor izquierdos y se extendı́a hasta el suelo del periné. Dicha imagen poseı́a áreas de degeneración quı́stica y compromiso vaginal contralateral. No habı́a evidencia de compromiso del suelo pélvico, ni se identificaron imágenes lı́ticas o erosivas del plano óseo. La vejiga urinaria no mostró anomalı́as (fig. 3). Se diagnostica como tumoración vaginal de probable etiologı́a benigna y se propone su extirpación quirúrgica. Se realiza la extirpación del tumor por vı́a vaginal mediante una incisión longitudinal en la cara lateral izquierda cerca del introito. Se disecó la cápsula y se concluyó la extracción tumoral por enucleación (fig. 4). Se realizó el cierre primario con afrontación por planos del defecto utilizando sutura reabsorbible. No hubo complicaciones durante la cirugı́a y la evolución postoperatoria fue favorable siendo dada de alta al segundo dı́a de la intervención. El examen macroscópico mostró una tumoración de 7 4 3 cm de color blanco-grisáceo, multilobulada, de consistencia firme y superficie algo irregular (figs. 5 y 6). El estudio microscópico fue compatible con el diagnóstico de leiomioma (figs. 7 y 8). Discusión Aunque en la mayorı́a de casos los miomas son de origen uterino, su presencia ha sido descrita en diferentes tejidos, entre ellos el vaginal. Sabemos que tanto la mucosa como la submucosa vaginal están rodeadas por una capa muscular compuesta por fibras circulares y longitudinales a partir de las cuales pueden formarse los leiomiomas5; otros autores proponen que podrı́an originarse de restos embrionarios musculares de alguna arteria local5,6. El papel de los estrógenos y del factor de crecimiento epidérmico en su evolución y crecimiento ha sido estudiado y demostrado, ası́ como su posible relación con anormalidades citogéneticas, siendo la eliminación parcial del cromosoma 7 la que se halla con mayor frecuencia7. Los leiomiomas vaginales han sido descritos en pacientes de diferentes edades, siendo la edad media de presentación los 40 años, con un tamaño que varı́a desde los 3cm hasta los Figura 3 Corte coronal de la lesión. 132 C.J. Valdera Simbron et al Figura 4 Exéresis del tumor vı́a vaginal. Figura 5 Tumor extirpado. Figura 6 Sección transversal que muestra el patrón fasciculado y tonalidad blanco-nacarada del leiomioma, con un aspecto uniforme, sin focos de necrosis y buena delimitación de la tumoración. Figura 7 Sección histológica (HE 20) que nos muestra una neoformación de alta densidad celular, con un patrón fascicular, y elementos celulares dispuestos en remolinos. Figura 8 Sección histológica (HE 40) que nos muestra a mayor aumento los detalles celulares de leiomiocitos con núcleos fusiformes caracterı́sticos de puntas romas, sin rasgos de atipia, de gran isomorfismo, sin mitosis y citoplasmas amplios eosinófilos. 15 cm, siendo la media 5cm. Pueden aparecer en cualquier capa vaginal pero son más frecuentes los de la submucosa8, encontrándose la mayorı́a en la pared anterior y solo un 1020% en las paredes laterales. Generalmente, son de consistencia fibrosa y firme pero pueden presentar cambios degenerativos y llegar a ser de consistencia blanda o mixta9. Su procedencia no sólo se limita al músculo vaginal; también puede ser de origen vesical, uretral, vascular, cervical, rectal o anal. Si son de origen uretral o vesical suelen ubicarse en la lı́nea media de la pared vaginal anterior y pueden ser endovesicales, intramurales o extravesicales, siendo los primeros los más frecuentes. Estos miomas de origen urológico se diferencian de los vaginales por estar adheridos a la vejiga o a la uretra10. Aunque los leiomiomas vaginales suelen aparecer de forma aislada, Brown et al. describieron en 1975 el caso de una paciente en el que además de un leiomioma vaginal presentaba otros en el labio, el esófago, el estómago y el útero11. Por lo general, son asintomáticos y su hallazgo suele ser fortuito en los exámenes ginecoobstétricos rutinarios o en Leiomioma vaginal procedimientos diagnósticos o quirúrgicos. Cuando presentan sintomatologı́a, esta se relaciona frecuentemente con el tracto urinario e incluye: dificultad para orinar, disuria y poliaquiuria. El sı́ntoma ginecológico más frecuente es la dispareunia; sin embargo, muchas pacientes solo describen una masa que protruye hacia la vagina12. Otras manifestaciones inusuales suelen ser la menometrorragia, la aparición de un divertı́culo uretral o un cistocele3. Aunque la clı́nica y el examen ginecológico nos pueden guiar hacia el diagnóstico, a veces es necesario el apoyo de algún estudio de imagen6,8. Las caracterı́sticas de la imagen obtenidas por ultrasonido, tomografı́a o por RM se asemejan a la de un mioma cervical5 y en caso de duda se recomienda realizar biopsia mediante punción por vı́a vaginal, ya que el diagnóstico de certeza se hace mediante examen histológico13. Dentro del diagnóstico diferencial están los quistes de Gartner, de Bartolino o de las glándulas de Skene; también debemos pensar en los divertı́culos uretrales, el uretrocele, el cistocele, el rectocele y los neurofibromas, entre otros6,8. La degeneración sarcomatosa es poco frecuente, aunque más común en los leiomiomas localizados en la pared vaginal posterior14, por lo que una vez diagnosticado se aconseja su extirpación quirúrgica por vı́a vaginal o abdominal. La mayorı́a de los autores prefieren la exéresis mediante enucleación por vı́a vaginal, a menos que sea muy grande y esté localizado en el fondo del saco anterior, en cuyo caso se prefiere el abordaje abdominal6,10,13. Aunque la recurrencia de estos tumores es muy rara, algunos autores recomiendan su extirpación «en bloque» para evitar cualquier posibilidad9. Conclusiones Los leiomiomas vaginales son tumores benignos muy raros, de crecimiento lento, generalmente únicos, más comunes en la pared anterior y casi siempre asintomáticos. Aunque no se conoce bien su etiologı́a, parece que la exposición a estrógenos tiene un papel importante. Los sı́ntomas están en relación con el tamaño y *L localización. La clı́nica y la exploración fı́sica suelen ser suficientes para el diagnóstico, aunque a veces es necesario el apoyo con pruebas de imagen como la ecografı́a o la RM. Una vez diagnosticados, se prefiere 133 extirparlos para evitar cambios sarcomatosos. La enucleación vı́a vaginal parece ser la mejor opción. Conflicto de intereses Los autores declaran no tener ningún conflicto de intereses. Bibliografı́a 1. Ruggieri AM, Brody JM, Curhan RP. Vaginal leiomyoma. A case report with imaging findings. J Reprod Med. 1996;41:875—7. 2. Smitha V, Sachchidananda M, Dillshad S, Nigel H. An unusual presentation of a vaginal leiomyoma in a postmenopausal hysterectomised woman: a case report. Cases Journal. 2009;2:6461. 3. Savita M, Rajiv M, Surender S. Vaginal leiomyoma presenting as dysfunctional uterine bleeding. Taiwan J Obstet Gynecol. 2010;49:531—2. 4. Hillard P. Benign diseases of the female reproductive tract. En: Berek J, Adashi E, Hillard P, editors. Novak’s gynecology. 12th ed. Baltimore: Williams & Wilkins; 1996. p. 331—97. 5. Hameed N. Case report. Leiomyoma of the vagina. J Ayub Med Coll Abbottabad. 2003;15:63—4. 6. Núñez Troconis J, Delgado de Fox M, Mavo C, Ávila de Paz C. Leiomioma vaginal. Comunicación de un caso. Rev Obstet Ginecol Venez. 1992;52:173—4. 7. Ozisik Y, Meloni A, Powell M, Surti U, Sandberg A. Chromosome7 biclonality in uterine leiomioma. Cancer Genet Cytogenet. 1993;67:59—64. 8. Zighelboim I, Reuman W, Álvarez J, Dı́az-Bolaños J, Colmenares P. Fibromioma de vagina. Rev Obstet Ginecol Venez. 1977;37: 93—9. 9. Gowri R, Soundararaghavan S, Oumachigui A, Sistla SC, Iyengar KR. Leiomyoma of the vagina: An unusual presentation. J Obstet Gynaecol Res 200;29:395—8. 10. Cattolica E, Klein R, Knigge W. Paraurethral leiomyoma-an imitador. Urology. 1976;8:605—7. 11. Brown R, Hawtrey C, Rose E. Leiomyoma of vesico-vaginal septum causing urinary retention. Urology. 1975;6:379—81. 12. Pulfus E, Newcomer J. Vaginal wall mass: Guest editorial. Obstetrical and gynaecological survey. 1999;54:149—50. 13. Nel C, Tiltman A. Leiomyoma of the vagina. S Afr Med J. 1978;54:816—7. 14. Briceño Pérez C, Briceño Sanabria L, Briceño Sanabria J, Briceño Sanabria C. Leiomioma vaginal. Ginecol Obstet Mex. 2006;74: 277—81. Prog Obstet Ginecol. 2012;55(3):134—136 PROGRESOS de OBSTETRICIA Y GINECOLOG ÍA w w w. e l s e v i e r. e s / p o g CASO CLÍNICO Hidroadenoma papilı́fero vulvar. Presentación de un caso Natalia Fischer Suárez a,*, Miguel Aragón Albillos a, Bélgica Márquez Lobo b, Elia Marı́a Dionis Sánchez a y Marı́a Angustias Torres Rodrı́guez a a b Unidad Clı́nica de Gestión de Obstetricia y Ginecologı́a, Hospital Torrecárdenas, Almerı́a, España Servicio de Anatomı́a Patológica, Hospital Torrecárdenas, Almerı́a, España Recibido el 15 de abril de 2011; aceptado el 25 de mayo de 2011 Accesible en lı́nea el 8 de noviembre de 2011 PALABRAS CLAVE Glándulas análogas a las mamarias; Hidroadenoma papilı́fero; Neoplasias vulvares KEYWORDS Hidradenoma papilliferum; Mammary-like glands; Vulvar neoplasms Resumen El hidroadenoma papilı́fero (HP) es un tumor benigno de la vulva infrecuente que crece principalmente en la piel de la región anogenital de mujeres adultas. Puede plantear problemas de diagnóstico diferencial con los quistes y abscesos de la glándula de Bartolino, con el lipoma y con lesiones vulvares premalignas/y malignas. Se ha sugerido que pudiera derivar de glándulas análogas a las mamarias dispuestas a lo largo de la región vulvar y perineal femenina. Presentamos un caso de HP que se extirpó en una mujer de 32 años que tenı́a el antecedente de un parto por cesárea 5 meses atrás. ß 2011 SEGO. Publicado por Elsevier España, S.L. Todos los derechos reservados. Hidroadenoma papilliferum: a case report Abstract Hidroadenoma papilliferum (HP) is a rare benign tumor of the vulva that grows mainly in the skin of the anogenital region of adult women. The differential diagnosis between this neoplasm and Bartholin cysts and abscesses, lipoma and some premalignant and malignant vulvar lesions can be difficult. HP may arise from mammary-like glands located in the vulvar and perineal region of women. We report a case of HP that was removed in a 32-year-old woman who had undergone a cesarean delivery 5 months previously. ß 2011 SEGO. Published by Elsevier España, S.L. All rights reserved. Introducción * Autor para correspondencia. Correo electrónico: [email protected] (N. Fischer Suárez). El hidroadenoma papilar es un tumor benigno poco frecuente que aparece fundamentalmente en la región anogenital de mujeres en edad fértil. Normalmente el tumor tiene un 0304-5013/$ — see front matter ß 2011 SEGO. Publicado por Elsevier España, S.L. Todos los derechos reservados. doi:10.1016/j.pog.2011.05.010 Hidroadenoma papilı́fero vulvar. Presentación de un caso 135 crecimiento lento, es asintomático y suele localizarse en el labio mayor vulvar seguido del menor. Su diagnóstico clı́nico puede resultar dificultoso, confundiéndose en ocasiones con quiste de Bartolino o incluso lesiones vulvares malignas. Caso clı́nico Paciente mujer, de 32 años, de origen eslavo, que acude al servicio de urgencias de ginecologı́a por la presencia de una tumoración en el clı́toris, sin sı́ntomas acompañantes y que ha crecido de forma rápida en los últimos meses. Se trata de una paciente obesa, de 125 kg de peso, con el antecedente de una quistectomı́a laterocervical derecha que fue realizada en su paı́s de origen (desconociéndose el resultado del estudio anatomo-patológico) y 2 partos por cesárea (la primera hace 4 años y la última 5 meses antes de su consulta). En la exploración, destaca una tumoración de unos 3 cm de tamaño, en la zona vulvar, que presenta un aspecto quı́stico, con un punto en el extremo distal por donde destila una secreción serosanguinolenta (fig. 1). Tras realizar los estudios preoperatorios pertinentes, la paciente se interviene quirúrgicamente, encontrando una formación pedunculada unida al clı́toris mediante un tallo fibroelástico, en la que se aprecian dos porciones claramente diferenciadas: una con aspecto quı́stico y otra con aspecto granuloso. El estudio anatomo-patológico ofreció el siguiente resultado: «fragmentos de lesión exofı́tica, de arquitectura papilı́fera, cuyo epitelio está constituido por una hilera de células cúbicas, de citoplasma claro, con núcleos vesiculosos sin nucleolo visible, de contornos lisos, apoyados sobre una capa de células mioepiteliales (fig. 2), con un estroma de tejido conectivo fibroso compatible con hidroadenoma papilı́fero vulvar». Dicha celularidad resultó positiva para citoqueratina 7 (fig. 3), marcador de tejido mamario y P63, marcador de Figura 2 Células columnares con citoplasma claro y núcleo vesiculoso apoyada sobre una capa de células mioepiteliales. Figura 3 Inmunotinción de la muestra con citoqueratina 7, marcador de epitelio mamario. célula mioepitelial, con un ı́ndice de proliferación celular (ki 67) < al 10%. Cuatro meses después de la intervención la paciente no ha presentado nueva sintomatologı́a. Discusión Figura 1 Tumoración dependiente de clı́toris de unos 3 cm de tamaño no dolorosa a la palpación y en la que se aprecia punto sangrante por el que destila secreción serosanguinolenta. El hidroadenoma papilar se ha considerado tradicionalmente como un tumor derivado de las glándulas apocrinas presentes en la zona anogenital femenina. Fue en 1991, al describirse las glándulas mamarias anogenitales (MLG), cuando se descubrió su verdadera histiogénesis como consecuencia de sus similitudes tanto histológicas como de localización. Estas glándulas se localizan en el estroma subepidérmico y se disponen formando una elipse constituida por la región clitoridea, el surco interlabial, la horquilla vulvar, el periné y la región perianal1. La presencia de glándulas análogas a las mamarias en la región anogenital explicarı́a el desarrollo de lesiones propias de la mama en la zona vulvar, tales como 136 cambios en la lactancia, adenoma, fibroadenoma e incluso enfermedad de Paget vulvar. En un principio se pensó que las MLG derivaban de tejido mamario supernumerario procedente de las llamadas «lı́neas de leche»; posteriormente se comprobó que esto no podı́a ser cierto por distintas razones2: — Las MLG presentan diferencias con el tejido mamario con una configuración más sencilla y un epitelio acinar diferente. — El número de glándulas es mucho mayor del que cabrı́a esperar en caso de que se tratara de tejido mamario rudimentario. — En los distintos estudios realizados con embriones humanos no se han encontrado estructuras comparables con la mama más allá de la región pectoral y axilar. — Durante el desarrollo embrionario existe una importante diferencia, tanto de tiempo como de espacio, entre el desarrollo mamario (más precozmente) y el desarrollo de la zona labioescrotal. En cuanto a su estructura, las MLG varı́an desde simples glándulas tubulares con un suave contorno a formas más complicadas ramificadas y lobuladas. Las MLG se diferencian claramente de las glándulas ecrinas y apocrinas en el tipo de epitelio, columnar alto y con hocicos en la zona apical, la formación de divertı́culos, las ramas y los lobulillos, además estas glándulas pueden presentar receptores de estrógenos y progesterona, no apareciendo esta posibilidad en las ecrinas y apocrinas. A pesar de ello las MLG están estrechamente relacionadas con las glándulas ecrinas y pueden presentar un segmento metaplásico apocrino, al igual que las glándulas mamarias2. A continuación, se expone un listado de las distintas lesiones que pueden aparecer en la zona anogenital y que se consideran derivadas de las MLG: — Glándula mamaria lactante: se caracteriza por la presencia de una inflamación durante el embarazo o inmediatamente después de este; es raro que aparezca tras el primer embarazo (normalmente comienza en el segundo). El tejido lactante puede involucionar espontáneamente pero habitualmente persiste tras la lactancia o recurre en los siguientes embarazos. La edad de la paciente se encuentra entre 23 a 39 años. El tumor mide entre 1 y 7 cm y suele ser pedunculado. Su localización suele ser el labio mayor seguido del menor y el clı́toris. En algunas ocasiones la lesión puede excretar leche confirmándonos el diagnóstico, en el resto de casos el diagnóstico será histológico. — Fibroadenoma: rara vez relacionado con la gestación. La edad de las pacientes se encuentra entre 14 y 50 años. El tamaño varı́a de 1,7 a 16 cm y suelen ser quı́sticos. — Hidroadenoma papilar: tumor que aparece casi exclusivamente en la región anogenital de mujeres en edad reproductiva, especialmente en la cuarta década de la vida3. Suele aparecer en el labio mayor seguido del labio menor, derivados de las MLG acumuladas en el surco interlabial1. Suele ser asintomático aunque en ocasiones puede aparecer purito, sangrado o molestias por un crecimiento N. Fischer Suárez et al excesivo1. El tamaño no supera los 3 cm1. Histológicamente, presentan una combinación de dos o más patrones arquitecturales. Las asociaciones más frecuentes son: papilar y quı́stico, o sólido y tubular1. En casos infrecuentes se ha relacionado con enfermedad de Paget o adenocarcinoma invasivo4,5. — Enfermedad de Paget extramamaria. — Adenocarcinoma invasivo. El tratamiento de elección del hidroadenoma papilar es la escisión local, siendo su pronóstico excelente y sin posibili6 dades de recurrencia . Si existe alguna duda sobre la benignidad del tumor, se realizará una escisión con amplios márgenes7. Kazakov et al. demostraron la presencia del virus del papiloma humano en 4 de 15 casos de hidroadenoma papilar con metaplasia y en 3 de 16 hidroadenomas papilares convencionales. Esto sugiere una relación causal entre el virus del papiloma humano y el hidroadenoma papilar, especialmente con el subtipo 53, aunque esta teorı́a no está confirmada aún8. Sólo hay descritos 17 casos de hidroadenoma papilar extragenital9,10, siendo la localización más frecuente la piel de la cabeza y del cuello seguida de las extremidades. Conflicto de intereses Los autores declaran no tener ningún conflicto de intereses. Bibliografı́a 1. Scurry J, Van der Putte SCJ, Pyman J, Chetty N, Azabo R. Mamary-like gland adenoma of the vulva: review of 46 cases. Pathology. 2009;44:372—8. 2. Van der Putte SCJ. Mamary-like glands of the vulva and their disorders. Int J Gynecol Pathol. 1994;13:150—60. 3. Maya S, Manisha BK, Dulhan A, Sumeet G. Diagnosis of Hidradenoma Papilliferum of the vulva on Cytologic Smears. Acta Cytologica. 2009;54:907—10. 4. Simpson WA, Burke M, Frappell J, Cook MG. Paget́s disease, melanocytic neoplasia and hidradenoma papilliferum of the vulva. Histopatology. 1988;12:675—9. 5. Petosi G, Martignoni G, Bonetti F. Intraductal carcinoma mamary-type apocrine epithelium arising with a papillary hidradenoma of the vulva. Arch Pathol Lab Med. 1991;115:1249—54. 6. Daniel F, Mahmoudi A, De Parades V, Flejor JF, Atienza P. An uncommon perineal nodule: Hidradenoma papilliferum. Gastroenterol Clin Biol. 2007;31:166—8. 7. Schormm G. Diagnosis of hidradenoma of the vulva by simultaneous cytology and colposcopy. Acta Cytol. 2003;23:57—60. 8. Duhan N, Kalra R, Singh S, Rajotia N. Hidradenoma papilliferum of the vulva: case report and reviw of literature. Arch Gynecol Obstet. 2010;10:1784—7. 9. Vang R, Cohen PR. Ectopic hidroadenoma papilliferum: a case report and reviw of the literature. J Am Acad Dermatol. 1999;41:115—8. 10. Netland PA, Townsend D, Albert DM. Hidradenoma papilliferum of the upper eyelid from the apocrine gland of Moll. Opthalmology. 1990;97:1593—8. Prog Obstet Ginecol. 2012;55(3):137—140 PROGRESOS de OBSTETRICIA Y GINECOLOG ÍA w w w. e l s e v i e r. e s / p o g CASO CLÍNICO Rotura de vasa previa: comunicación de un caso y revisión de la literatura Edurne Mazarico Gallego *, Esther Valladares Pérez, Isabel Garcı́a-Penche Santillán, Marı́a Dolores Gómez Roig y Josep Maria Lailla Vicens Servicio de Obstetricia y Ginecologı́a, Hospital Sant Joan de Déu, Esplugues de Llobregat, Barcelona, España Recibido el 19 de julio de 2011; aceptado el 26 de agosto de 2011 Accesible en lı́nea el 30 de noviembre de 2011 PALABRAS CLAVE Cordón umbilical; Hemorragia perinatal; Inserción velamentosa; Placenta; Vasa previa KEYWORDS Placenta; Perinatal hemorrhage; Umbilical cord; Vasa previa; Velamentous cord insertion Resumen La vasa previa es una situación que se produce cuando vasos fetales intramembranosos aberrantes, procedentes de la placenta o del cordón umbilical, atraviesan el orificio cervical interno y se sitúan por delante de la presentación fetal. Su incidencia es de 1/2.000-1/3.000 embarazos, y la mortalidad perinatal asociada es del 52-66%, aproximadamente. La reducción de esta elevada mortalidad se basa en su diagnóstico prenatal. Exponemos a continuación el caso clı́nico de una gestante, con controles obstétricos correctos, que acude a urgencias a las 34,5 semanas por rotura prematura de membranas, objetivándose un lı́quido amniótico hemático y bradicardia fetal severa, por lo que se realiza una cesárea urgente, naciendo una niña con anemia severa, que ingresa en la unidad de neonatologı́a, presentando buena evolución posterior. Presentamos también una revisión de la literatura de los años 1980 al 2008, a través de Medline, usando las palabras «vasa previa». ß 2011 SEGO. Publicado por Elsevier España, S.L. Todos los derechos reservados. Rupture of vasa previa: case report and review of the literature Abstract Vasa previa is a condition in which the intramembranous fetal blood vessels within the placenta or umbilical cord cross the internal os and become trapped between the fetus and the opening of the birth canal. The incidence of this entity varies from 1/2000 to 1/3000 pregnancies and the associated perinatal mortality rate has been reported to be as high as 52-66%. Reduction of this high perinatal mortality depends on prenatal diagnosis. We report the case of a pregnant woman with no abnormalities in antenatal visits who presented to the emergency service at 34.5 weeks of pregnancy due to premature rupture of membranes, at which time blood-stained amniotic fluid and severe fetal bradycardia were noted. An emergency cesarean section was performed. A female neonate was delivered with * Autor para correspondencia. Correo electrónico: [email protected] (E. Mazarico Gallego). 0304-5013/$ — see front matter ß 2011 SEGO. Publicado por Elsevier España, S.L. Todos los derechos reservados. doi:10.1016/j.pog.2011.08.014 138 E. Mazarico Gallego et al severe anemia. The neonate was admitted into the neonatology unit and subsequent outcome was favorable. We also provide a review of the literature published between 1980 and 2008 using Medline, with the key words ‘‘vasa previa’’. ß 2011 SEGO. Published by Elsevier España, S.L. All rights reserved. Introducción La vasa previa es el término que describe la situación en que vasos fetales intramembranosos aberrantes cruzan el segmento inferior uterino, por delante de la presentación fetal. Se puede asociar a una inserción velamentosa del cordón umbilical (inserción fuera de la placa corial) o a placenta bipartita o lóbulo succenturiato (cotiledones accesorios), por lo que debe descartarse sistemáticamente en estos casos. Su incidencia es de 1/2.000-1/3.000 embarazos y se asocia a una elevada mortalidad perinatal (52-66%). Entre los principales factores de riesgo se encuentran la inserción velamentosa del cordón umbilical, placenta de inserción baja o con alteraciones anatómicas, gestaciones múltiples y fecundación in vitro. El diagnóstico prenatal es muy difı́cil, y se debe realizar por ecografı́a (mejor transvaginal), al visualizar el segmento uterino inferior y el OCI, por detrás del cual se encontrará una estructura econegativa indicativa de cordón umbilical que se confirmará con Doppler color. El riesgo de esta situación radica en la falta de protección de los vasos umbilicales por la gelatina de Wharton y en que la gran adherencia de éstos a las membranas hace que, en caso de rotura artificial o espontánea de estas se produzca una hemorragia masiva, riesgo de pérdida del bienestar fetal y una alta mortalidad. La reducción de esta alta mortalidad perinatal se basa en el diagnóstico prenatal. El seguimiento de la gestación es el habitual si no hay complicaciones. Si el diagnóstico es prenatal se debe realizar una cesárea electiva a las 37-38 semanas, y si se produce una rotura de la vasa previa se debe realizar una cesárea urgente. Los controles analı́ticos trimestrales fueron normales, con serologı́as infecciosas negativas e inmunidad para rubéola y grupo sanguı́neo 0 Rh positivo. En la ecografı́a morfológica de las 20 semanas y la ecografı́a del tercer trimestre sólo cabe destacar un mioma en cara anterior uterina de 36 20 mm; crecimiento fetal dentro de la normalidad (percentil 50) y placenta en cara posterior. La paciente acude al servicio de urgencias a las 34,5 semanas por rotura prematura de membranas y metrorragia moderada coincidiendo con esta, desde donde se procede a su ingreso. A la exploración fı́sica, se objetiva lı́quido amniótico hemático, cérvix posterior, de consistencia dura, formado y permeable a un dedo en todo su canal. Se realiza registro cardiotocográfico externo (RCTG) (fig. 1), donde se constata dinámica uterina irregular y bradicardia severa a los 20 min de colocar RCTG, por lo que se practica una cesárea urgente por riesgo de pérdida de bienestar fetal, con anestesia raquı́dea. Se obtiene un recién nacido de sexo femenino, de 2.235 g de peso, con un Apgar 5-6-7 y palidez mucocutánea severa, que ingresa en el servicio de neonatologı́a con hemoglobina de 10 g/dl y hematocrito del 32%. En el momento de la histerotomı́a segmentaria baja y de la extracción fetal, se observa la rotura de vasa previa y tras el alumbramiento se objetiva inserción velamentosa del cordón (figs. 2A y 2B). Se envı́a la placenta al servicio de anatomı́a patológica. Durante la estancia en hospitalización (puerperio inmediato), la paciente presenta anemia moderada (hemoglobina de 9,2 g/dl y hematocrito del 26%) que requiere de ferroterapia por vı́a oral, con evolución posterior favorable, dándose el alta a los 4 dı́as poscesárea. El neonato es dado de alta a los 10 dı́as de vida presentando buena evolución y ausencia de complicaciones tras transfusión y fototerapia. Caso clı́nico Paciente de 32 años de edad, gestante de 34,5 semanas, que ingresa en nuestro centro vı́a servicio de urgencias con el diagnóstico de rotura prematura de membranas pretérmino y metrorragia del tercer trimestre. Como antecedentes personales de interés cabe destacar apendicectomı́a en la infancia y hábito tabáquico de 5 cigarrillos dı́a. De entre los antecedentes ginecoobstétricos cabe mencionar menarquia a los 12 años, con ciclo menstrual 4/28 y fórmula obstétrica 0.0.2.0, con una interrupción voluntaria del embarazo y un aborto espontáneo de 8 semanas por amenorrea. El curso del embarazo actual es estrictamente normal hasta la semana 14, momento en el que es derivada desde su centro de atención primaria al Hospital Sant Joan de Déu por resultados del cribado del primer trimestre alterados. Riesgo de trisomı́a 21 de 1/240 y riesgo de trisomı́a 18 de 1/9.400. Se realiza una amniocentesis, que revela una dotación cromosómica normal, 46XX. Figura 1 Registro cardiotocográfico al ingreso. Rotura de vasa previa: comunicación de un caso y revisión de la literatura Figura 2 A y B Placenta, donde puede observarse inserción velamentosa del cordón. los 5 min < 7, un 18% necesidad de transfusión y un 9% de mortalidad neonatal, asociada a un caso de gestación gemelar en que se tuvo que practicar una cesárea a las 27 semanas de gestación por hipertensión gestacional, amenaza de parto pretérmino y coagulopatı́a, en que uno de los 2 fetos resultó muerto a los 3 dı́as de vida, como causa directa de shock hipovolémico y hemorragia intraventricular como consecuencia de la vasa previa. En el 46% de los casos (39 de los 83 casos), el diagnóstico fue durante el trabajo de parto o después del nacimiento y del alumbramiento, al realizar la inspección de la placenta y del cordón umbilical. De estos casos, el 29% no tuvo sangrado vaginal, de los cuales solo el 16% presentó un Apgar a los 5 min < 7 y solo el 16% de los recién nacidos requirieron transfusión. Sin embargo, la mortalidad en este grupo fue del 41%. En cambio, de los casos con diagnóstico intraparto o posparto, el 71% presentó sangrado vaginal, el 48% tuvo un Apgar a los 5 min < 7 y el 59% de los recién nacidos requirieron transfusión sanguı́nea por anemia severa. En contraposición, en este grupo la tasa de mortalidad fue de un 14%, muy inferior al grupo que no habı́a presentado sangrado intraparto. Con el análisis de todos estos casos revisados, se evidencia que el diagnóstico prenatal de la vasa previa sigue siendo aún hoy en dı́a, un reto difı́cil ya que en casi la mitad de los casos el diagnóstico fue intraparto o posparto, y la mortalidad en este grupo no deja de ser despreciable. Entre todos los métodos diagnósticos, la ecografı́a es el menos invasivo y es, por tanto, el de elección, pero lo más importante es determinar en qué casos debe realizarse esa ecografı́a para excluir la existencia de vasa previa. El estudio anatomopatológico de la placenta informa de placenta de 410 g y 17 cm, con longitud de cordón umbilical de 16 cm que presenta al corte 3 estructuras vasculares con inserción velamentosa de 9 cm. Discusión Revisando la literatura desde 1980 a través de Medline usando las palabras «vasa previa», hemos encontrado 83 casos publicados de vasa previa: 53 casos de una serie revisada por Fung y Lau, 3 casos publicados por Fung y Lau1, 19 casos de Lee et al.2, 1 caso de Kashiwagi et al.3, 3 casos de Hasegawa et al.4, 1 caso de Jantarasaengaram et al.5, 2 casos de Regis et al.6 y otro de Carbonnel et al.7 (tabla 1). Hemos analizado conjuntamente todos los casos, diferenciando en primer lugar, si el diagnóstico habı́a sido prenatalmente, intraparto o después del parto. De cada grupo hemos estudiado si habı́an tenido historia de sangrado vaginal, el Apgar del recién nacido a los 5 min, si hubo anemia fetal o necesidad de transfusión fetal y la tasa de supervivencia. De todos los casos analizados, en el 54% se habı́a realizado un diagnóstico prenatal de vasa previa. De estos casos, el 75% no presentaron clı́nica de sangrado vaginal anteparto ni intraparto, y en cambio, el 25% tuvo sangrado anteparto. Del primer grupo, con diagnóstico prenatal de vasa previa y sin presentar ningún tipo de clı́nica asociada, no ha habido ningún caso de Apgar inferior a 7, ni necesidad de transfusión o reanimación neonatal y la mortalidad ha sido del 0%. En relación con el segundo grupo, con sangrado vaginal a pesar del diagnóstico y control prenatal, un 0,09% tuvo un Apgar a Tabla 1 139 Casos revisados de vasa previa Momento de diagnóstico Casos Prenatal Sin sangrado vaginal Sangrado vaginal Intraparto o después parto Sin sangrado vaginal Sangrado vaginal 44 33 11 38 12 27 Apgar 5 min < 7 Anemia o transfusión Mortalidad 0 1 0 2 0 1 2 13 2 16 5 4 140 Oyelese et al.8 recomiendan la realización de ecografı́a transvaginal y/o amnioscopia antes de la rotura de membranas en todas aquellas pacientes clasificadas como de alto riesgo. En este grupo se incluirı́an aquellas pacientes con placentas bilobuladas y succenturiatas, gestaciones múltiples, gestaciones conseguidas por FIV, inserciones bajas del cordón y aquellas en las que mediante exploración digital se palpa un vaso o banda amniótica. Daly-Jones at al.9, añaden a este grupo de riesgo a las pacientes con placenta de inserción baja y recomiendan realizar el cribado también en ellas. El diagnóstico diferencial ecográfico de placenta previa incluye asa libre de cordón, sinus vascular placentario marginal, banda amniótica y despegamiento de membranas, aunque el uso del Doppler color ayuda a establecer el diagnóstico en estos casos. Catanzarite et al.10 en su estudio reportan una especificidad del 91% en el diagnóstico ecográfico de vasa previa. No pudieron especificar la sensibilidad, ya que no se pudieron seguir todas las gestaciones hasta su término. Los autores sugieren hacer el cribado de vasa previa al final del primer trimestre o al principio del segundo en aquellas pacientes que presentan placenta bilobulada de inserción baja o en aquellos que presentan placenta previa con resolución posterior. Nomiyama et al.11 establece en su estudio que la inserción del cordón pudo ser identificada en el 99,8% de las pacientes en las que se realizó la ecografı́a entre las 18 y las 20 semanas. La sensibilidad para identificar la inserción del cordón fue del 100%, la especificidad fue del 99,8%, el valor predictivo positivo del 83% y el valor predictivo negativo fue del 100%. Oyelese et al. sugieren la necesidad de documentar, en la ecografı́a de las 20 semanas, la localización de la placenta y del cordón umbilical, dada la asociación entre inserción marginal o velamentosa del cordón y vasa previa. La cesárea electiva es el tratamiento de elección cuando se realiza el diagnóstico de vasa previa anteparto, generalmente a las 37 o 38 semanas. En aquellos casos en los que se observa regresión de un vaso que previamente estaba cercano al orificio cervical interno, algunos autores consideran adecuado realizar un parto vaginal pero con quirófano preparado por si hubiese necesidad de realizar una cesárea urgente. La sensibilidad del Doppler color para el diagnóstico de vasa previa no se conoce con exactitud. Serı́an necesarios E. Mazarico Gallego et al estudios prospectivos para resolver estas preguntas y para corroborar los beneficios del diagnóstico prenatal de esta entidad, disminuyendo la morbimortalidad perinatal. Conflicto de intereses Los autores declaran no tener ningún conflicto de intereses. Bibliografı́a 1. Fung TY, Lau TK. Poor perinatal outcome associated with vasa previa: is it preventable?. A report of three cases and review of the literature. Ultrasound Obstet Gynecol. 1998;12:430—3. 2. Lee W, Lee VL, Kirk JS, Sloan CT, Smith RS, Comstock CH. Vasa previa: prenatal diagnosis, natural evolution and clinical outcome. Obstet Gynecol. 2000;95:575—6. 3. Kashiwagi S, Miyakoshi K, Ishimoto H, Tanaka M, Yoshimura Y. Chekmark fetal heart rate pattern associated with severe fetal hypoxia. A case report. Fetal Diagn Ther. 2003;18:237—9. 4. Hasegawa J, Matsuoka R, Ichizuka K, Fujikawa H, Sekizawa A, Okai T. Umbilical cord insertion to the lower uterine segment is a risk factor for vasa previa. Fetal Diagn Ther. 2007;22:358—60. 5. Jantarasaengaram S, Suthipintawong C, Kanchanawat S, Thanagumtorn K. Ruptured vasa previa in velamentous cord insertion placenta. J Perinatol. 2007;27:457—9. 6. Régis C, Mubiayi ND, Devisme L, Subtil D. Benckiseŕs hemorrhage: severe and inevitable? J Gyneol Obstet Biol Reprod. 2006; 35:517—21. 7. Carbonnel M, Tiagaizin A, Carbillon L, Seince N, Benchimol M, Uzan M. Vase previa: one case. Gynecol Obstet Fertil. 2007;35: 327—9. 8. Oyelese KO, Turner M, Lees C, Campbell S. Vasa previa: an avoidable obstetric tragedy. Obstet Gynecol Surv. 1999;54: 138—45. 9. Daly-Jones E, Hollingsworth J, Sepulveda W. Vasa praevia: second trimester diagnosis using colour flow imaging. Br J Obstet Gynaecol. 1996;103:284—6. 10. Catanzarite V, Maida C, Thomas W, Mendoza A, Stanco L, Piacquadio KM. Prenatal sonographic diagnosis of vasa previa: ultrasound findings and obstetric outcome in ten cases. Ultrasound Obstet Gynecol. 2001;18:109—15. 11. Nomiyama M, Toyota Y, Kawano H. Antenatal diagnosis of velamentous umbilical cord insertion and vasa previa with color Doppler imaging. Ultrasound Obstet Gynecol. 1998;12:426—9. Prog Obstet Ginecol. 2012;55(3):141—145 PROGRESOS de OBSTETRICIA Y GINECOLOG ÍA w w w. e l s e v i e r. e s / p o g CASO CLÍNICO Embarazo heterotópico espontáneo en pacientes con antecedente de embarazo gemelar familiar: 2 casos Gilberto Luna Lugo * Servicio de Ginecologı́a y Obstetricia, Hospital General de Pachuca, Servicios de Salud de Hidalgo, Hidalgo, México Recibido el 10 de julio de 2011; aceptado el 8 de septiembre de 2011 Accesible en lı́nea el 12 de diciembre de 2011 PALABRAS CLAVE Gemelaridad; Embarazo; Heterotópico; Antecedente KEYWORDS Twinning; Pregnancy; Heterotopic; Antecedent Resumen El embarazo heterotópico es la coexistencia de un embarazo intrauterino y de otro extrauterino. Puede presentarse de 2 maneras: inducida (relacionado con técnicas de fertilización in vitro, incidencia de 1:1.000 hasta 1:1.500 embarazos) o espontánea (frecuencia de 1:20.000 hasta 1:80.000 embarazos, sus factores causales son: enfermedad pélvica inflamatoria, uso de dispositivo intrauterino o de hormonales, cirugı́a pélvica previa o embarazo ectópico anterior). Observamos antecedentes de gemelaridad en la familia de 2 casos espontáneos que se presentan. ß 2011 SEGO. Publicado por Elsevier España, S.L. Todos los derechos reservados. Spontaneous heterotopic pregnancy in patients with a family history of twin pregnancy. Report of two cases Abstract Heterotopic pregnancy is the coexistence of an intrauterine pregnancy with an extrauterine pregnancy. There are two types: induced (associated with in vitro fertilization techniques, representing 1:1000 to 1:1,500 pregnancies) or spontaneous (1: 20,000 to 1: 80.000 pregnancies). Causal factors for spontaneous heterotopic pregnancies include pelvic inflammatory disease, use of hormonal or intrauterine devices, previous pelvic surgery and ectopic pregnancy. We report two cases of spontaneous heterotopic pregnancy in patients with a family history of twins. ß 2011 SEGO. Published by Elsevier España, S.L. All rights reserved. Introducción Se reportan 2 casos de embarazo heterotópico espontáneo, identificándose el antecedente familiar de embarazo * Autor para correspondencia. Correo electrónico: [email protected] gemelar. El embarazo heterotópico es la existencia de un embarazo intrauterino que coexiste con otro extrauterino1—3. El primer caso en la literatura fue reportado por Dauverney en 1740 al realizar la autopsia de una mujer1,4. La incidencia es variable, desde 1:1.000 hasta 1:1.5001, y está relacionada con métodos de fertilización asistida. La incidencia en el embarazo heterotópico espontáneo (sin la ayuda de algún método de inseminación artificial) varı́a desde 1 en 30.000 hasta 1 en 50.000 recién nacidos vivos1—3. 0304-5013/$ — see front matter ß 2011 SEGO. Publicado por Elsevier España, S.L. Todos los derechos reservados. doi:10.1016/j.pog.2011.09.008 142 En Venezuela se reporta 1 en 86.000 embarazos, posiblemente por desconocimiento del mismo y/o subregistro de los casos5. No existe un registro confiable y preciso de este tipo de embarazos en América Latina y solamente hay un número muy pequeño de reportes de casos aislados. En la bibliograı́a médica de México desde 1990 hasta la fecha están publicados 7 casos previos al presente6—11, la mayorı́a relacionados con técnicas de inseminación asistida6—9. Berger y Taymor, en una serie pequeña de 204 embarazos con manejo previo de citrato de clomifeno, notan que la incidencia es de 1:10012. Los factores de riesgo son: uso de anticonceptivos, de dispositivo intrauterino; enfermedad pélvica inflamatoria previa; administración de inductores de ovulación en casos de esterilidad o infertilidad. Cirugı́a pélvica previa o un embarazo ectópico anterior o endometriosis1,2,4,6,7. Existen reportes de pacientes sin factores de riesgo1,3 con una incidencia de 1:30.0003. El antecedente de embarazo gemelar familiar de la paciente o en el padre del producto puede estar relacionados con el embarazo heterotópico. Las causas del embarazo heterotópico espontáneo posiblemente son relacionadas a una superfecundación, alteraciones anatómicas y de posición de las tubas. En cuanto a reproducción asistida se relacionan a hiperestimulación ovárica asociada a alteraciones estructurales y funcionales de las salpinges secundaria a desarrollo anormal de ambos ovarios; en el número de embriones transferidos; la técnica de transferencia; por la fuerza excesiva de la transferencia; por la transferencia en el fondo uterino y no en la parte media de la cavidad uterina, o por migración retrograda de los embriones hacia las salpinges. En el estudio ultrasonográfico de rutina sólo pueden diagnosticar la mitad de los embarazos heterotópicos11. Cuando la paciente se ha sometido a procedimientos de fertilización asistida existe la ventaja del seguimiento ultrasonográfico en prevención de complicaciones y el diagnóstico puede ser precoz. Por lo tanto, este estudio debe ser realizado por manos expertas y con énfasis en los detalles, sobre todo en las pacientes que tengan el antecedente familiar o personal de embarazo gemelar o múltiple El reporte incorrecto o incompleto pone en riesgo la vida de la paciente y los problemas médico legales son de importancia. En la mayor parte de los casos de embarazo heterotópico espontáneo el diagnóstico se realiza después de que se ha complicado el embarazo extrauterino2—4,10, inclusive después de haberse realizado un estudio de ultrasonografı́a que visualizaba sólo una gestación intrauterina. Generalmente, se presenta como una urgencia quirúrgica después de la ruptura del embarazo extrauterino, porque no siempre se piensa en este tipo de gestación2,8,10,11,13. Clı́nicamente, se observa palidez de tegumentos progresiva, datos de choque hipovolémico de diverso grado sin la pérdida objetiva de sangre. El dolor abdominal tiene grado variable. El descenso en la hemoglobina seriada orienta al diagnóstico. La sospecha clı́nica es vital y debe tenerse en cuenta la existencia de este tipo de embarazo sobre todo cuando hay antecedentes de reproducción asistida; persistencia de dolor abdominal después de un legrado uterino o aspiración endouterina; la persistencia de tı́tulos elevados de hormona gonadotropina coriónica después del legrado o aspiración uterina; ante la presencia de dolor abdominal asociado a masa palpable intrapélvica y embarazo intrauterino4. G. Luna Lugo El cuadro clı́nico es variable. La sintomatologı́a que presenta el embarazo extrauterino generalmente es la misma que el embarazo ectópico. Las complicaciones que presenta el embarazo intrauterino se relacionan con las de variantes clı́nicas del aborto. Pueden superponerse ambos cuadros por lo que se dificulta su diagnóstico clı́nico. El tiempo de evolución y el manejo previo influyen de manera importante en el cuadro clı́nico14. Como diagnóstico diferencial se encuentra el quiste hemorrágico roto asociado a embarazo intrauterino o la torsión de quiste de ovario. La reacción de Arias Stella que se presenta en el embarazo ectópico debe tomarse en cuenta para diferenciarlo con el embarazo heterotópico5. El manejo actual del embarazo heterotópico varı́a de acuerdo con el momento del diagnóstico, al estado de gravedad presente en la paciente y a la viabilidad de los productos. El estándar de oro en el diagnóstico y tratamiento es la laparoscopı́a. También depende de la infraestructura intrahospitalaria con que se cuente y de la experiencia del médico tratante. Cuando se observa a un producto ectópico menor de 10 semanas de gestación, puede aplicarse manejo conservador, como la salpingocentesis (punción transvaginal con guı́a ultrasonográfica para la administración de glucosa hiperosmolar15 o la aplicación de cloruro de potasio dentro del saco gestacional16). El uso de metotrexato o prostaglandinas están indicadas solamente en caso de no existir viabilidad de la gestación intrauterina1. Si la ubicación del embarazo extrauterino (similar al embarazo ectópico, generalmente ubicado en alguna de las salpinges u ovarios) es sobre un órgano no importante (trompa o epiplón), deberá de extirparse en su totalidad sin pretender desprenderla, de lo contrario se presentara una hemorragia que puede ser difı́cil de controlar. En caso de localizarse sobre un órgano importante, deberá de dejarse el cordón umbilical lo más corto posible junto con la placenta en su sitio de implante4. El manejo médico continúa con la administración de antimetabolitos como el metotrexato y la vigilancia médica deberá ser estrecha. Afortunadamente, los casos de embarazo heterotópico abdominal son raros y se asocia a una mortalidad del 6%4,14. Cuando el producto intrauterino tiene posibilidades de viabilidad, se prefiere el uso de cloruro de potasio en la gestación ectópica y no el uso de otros fármacos como prostaglandinas ya que puede provocar contracciones uterinas con riesgo de producir un aborto de la gestación intrauterina. El uso metotrexato puede resultar teratogénico para la gestación bien implantada por lo que no se utiliza en estos casos. En algunos casos la gestación extrauterina se puede resolver de manera espontánea, pero el seguimiento de la paciente se hace difı́cil, ya que los valores de gonadotropina coriónica humana beta persisten y no son de utilidad7. El manejo quirúrgico no conservador es generalmente la pauta de acción para resolver este embarazo1—3. La laparotomı́a1—3 es el método de elección para los casos en que se ha presentado hemorragia intraabdominal. La laparoscopia puede considerarse cuando se desee preservar la gestación intrauterina. Después del evento quirúrgico de la gestación extrauterina, la viabilidad del producto intrauterino va del 45 al 70%1—4, aunque puede fallecer a pesar del manejo preventivo que se realice4. La mortalidad materna se asocia a menos del 1% de los casos4. Embarazo heterotópico espontáneo y antecedente familiar de embarazo gemelar 143 Casos clı́nicos Caso 1 Paciente femenino de 20 años. Primigesta. Fecha de última menstruación: 24 de febrero de 2010. Fecha probable de parto: 31 de noviembre de 2010. Hija de enfermera. Antecedente de varios embarazos gemelares por la rama materna. La paciente tiene 2 hermanos gemelos. El 4 de abril de 2010 se realizó un ultrasonograma pélvico, que evidenció un útero de 79 49 46 mm, saco gestacional con 10 mm de diámetro, saco vitelino de 3,5 mm; no se observa producto. Diagnóstico de embarazo único de 5,3 semanas de gestación. El 19 de abril de 2010 se realizó un ultrasonograma transvaginal que informó: útero de 99 64 69 mm, 2 sacos gestacionales: un producto vivo intrauterino de 8,2 semanas por longitud céfalo-caudal de 18 mm; frecuencia cardiaca de 174 latidos/min (fig. 1) y el segundo saco gestacional en el anejo izquierdo, con un embrión vivo, Longitud céfalo-caudal de 10 mm, frecuencia cardiaca de 157 latidos/min y 7,1 semanas de gestación (fig. 2). El 23 de abril de 2010 a las 15:00 h la paciente presenta dolor abdominal quirúrgico urgente. Por no contar en el servicio con equipo de laparoscopı́a se decide su ingreso a quirófano y se efectúa salpingectomı́a izquierda por embarazo ectópico no roto (fig. 3). Evolución posquirúrgica adecuada y 2 dı́as después egresa. Producto intrauterino vivo. Acude a control prenatal. A la semana 38 se obtiene por cesárea producto vivo masculino sano17. Figura 2 uterino. Caso 1. Imagen ultrasonográfica con embarazo extra- Caso 2 Paciente mujer de 32 años de edad. Gestaciones: 5, partos: 3, cesárea: 1 (el 15 de septiembre de 2009). Método de planificación familiar: oclusión tubaria bilateral hace 1 año. Fecha de última menstruación: 18 de agosto de 2010. El esposo de la paciente tiene una sobrina directa con embarazo gemelar en 2 ocasiones, su cónyuge sin antecedente de embarazo múltiple. Figura 1 Caso 1. Imagen ultrasonográfica con embarazo intrauterino vivo. Figura 3 Caso 1. Pieza quirúrgica posterior a laparotomı́a. El 1 de octubre de 2010 ingresa por dolor abdominal de 24 h de evolución, intenso, constante, irradiación hacia la fosa ilı́aca derecha. Ultrasonograma endovaginal con transductor de 7,5 MHz. Reporta una imagen intrauterina de 38 28 18 mm, con halo hiperecoico de contenido lı́quido sin evidencia de producto en su interior y que corresponde a un embarazo de 6,2 semanas de gestación por medición de saco gestacional. Ovario derecho de 32 20 18 mm de caracterı́sticas normales, no se observa ovario izquierdo (figs. 4 y 5). Hueco pélvico con lı́quido y la presencia de una masa redonda de ecos mixtos que mide 93 61 84 mm ubicado entre útero y vejiga. Analı́ticas de control: Hb 9,7, leucocitos 7.900, plaquetas 177.000. TP 12,1 TPT 25,90. INR 1,02. A1 positivo. Gl 135 mg/dl, prueba de embarazo en sangre positiva. En la exploración fı́sica se constató: presión arterial 100-70, peso de 80 kg, alerta, palidez leve de tegumentos, datos de irritación peritoneal. Tacto vaginal: fondo de saco abombado y dolor intenso, cérvix cerrado, sin evidencia de sangrado vaginal. Ingresa a cirugı́a urgente como probable embarazo heterotópico para realizar: a) aspiración manual 144 Figura 4 Caso 2. Imagen ultrasonográfica, embarazo intrauterino anembriónico y embarazo extrauterino. G. Luna Lugo instancia por complicaciones asociadas a la pérdida del producto intrauterino, pasando desapercibida la gestación extrauterina. Posteriormente, existen complicaciones similares a las del embarazo ectópico como son: dolor abdominal intenso y/o hemorragia (por rotura), lo que pone en peligro de muerte a la paciente. Generalmente, el diagnóstico se establece después de realizar el segundo procedimiento quirúrgico (legrado-laparotomı́a o ameu-laparotomı́a). El manejo quirúrgico deberá ser realizado con el máximo cuidado y la vigilancia posoperatoria de manera estrecha para aquellos casos que tengan posibilidad de sobrevivir la gestación intrauterina. El embarazo heterotópico espontáneo puede ser más frecuente de lo referido en la bibliografı́a. Como se ha establecido en este reporte, puede existir una correlación en pacientes con antecedentes de embarazo gemelar por ambas ramas familiares. Debe de realizarse una valoración inicial adecuada en toda paciente embarazada y sobre todo en aquellas con antecedentes familiares de embarazos gemelares, incluida una historia clı́nica con un adecuado interrogatorio ası́ como la búsqueda ultrasonográfica intencionada para descartar la gestación extrauterina. La preparación de la persona que realiza el ultrasonido obstétrico deberá ser de un nivel adecuado para evitar pasar por alto la gestación extrauterina. Es meritoria una clasificación del embarazo heterotópico a fin de correlacionar: los diagnósticos con los procedimientos quirúrgicos que se realizan; los diferentes tiempos quirúrgicos; los hallazgos en este tipo de embarazo y la viabilidad del producto. Conflicto de intereses Los autores declaran no tener ningún conflicto de intereses. Agradecimientos Figura 5 Caso 2. Imagen ultrasonográfica, embarazo intrauterino anembriónico y embarazo extrauterino. endouterina (hallazgos: restos ovulares no fétidos y sangrado de 10 cc), y b) laparotomı́a exploradora (hallazgos: salpinge izquierda con embarazo ectópico en fase abortiva, sangrado activo a través de la fimbria. Se observa salpinge derecha con oclusión tubaria. Hemoperitoneo de 700 ml). Evoluciona satisfactoriamente y egresa el 4 de septiembre de 2010. Discusión La presentación clı́nica de un embarazo heterotópico es variable, su manejo depende del momento en que se realiza el diagnóstico (antes o después de que presente complicaciones), de la gestación comprometida (intrauterina o la extrauterina) y de la viabilidad del producto intrauterino. El diagnóstico temprano implica cierta dificultad porque se piensa poco en este tipo de embarazo. La variabilidad de presentación clı́nica provoca controversia al realizar el diagnóstico sobre todo en aquellas pacientes que acuden a recibir atención médica en primera Al personal de archivo del Hospital General de Pachuca, Servicio de Salud de Hidalgo, México. A la Dra. Analeni Orozco Martinez por la traducción y la corrección. Bibliografı́a 1. Martı́nez CR, Cerrillo MM, Argüello GA, Ángel PC, Dı́az SM, González MG. Gestación heterotópica espontánea, diagnóstico y tratamiento laparoscópico. Prog Obstet Ginecol. 2008;51: 567—70. 2. Corraliza V, Vicandi F, Granados MA, Chiva L. Embarazo heterotópico espontáneo presentado como un abdomen agudo. Clin Invest Gin Obst. 2002;29:349—50. 3. Padilla CM, Machado RY, Cazorla BM, Acebes TR, Medina CM, Rodrı́guez-Mano R. Gestación heterotópica espontánea. Prog Obstet Ginecol. 2006;49:722—4. 4. Garcı́a MR, Gallego RJ, Prado GJ, Trelles AE. Embarazo heterotópico, presentación de un caso. Rev Cubana Obstet Ginecol. 2001;27:34—8. 5. Rada TL, Rivero FA, Briones J, Fernández S. Embarazo heterotópico vs embarazo ectópico roto con reacción decidual. Rev Soc Med Quir Hosp Emerg Pérez de León. 2007;38:67-72. 6. Barrón VJ, Ortega DR, Kably AA. Embarazo heterotópico con gestación intrauterina dicigótica después de transferencia de Embarazo heterotópico espontáneo y antecedente familiar de embarazo gemelar embriones en etapa de blastocisto. Ginecol Obstet Mex. 1999; 67:169—72. 7. Barrón VJ, Góngora RA, Kuttothara J, Kably AA. Embarazo heterotópico espontáneo con reproducción asistida. Caracterı́sticas clı́nicas. Ginecol Obstet Mex. 1999;67:291—4. 8. Kably AA, Garza RP, Serviere ZC, Delgado UJ. Embarazo heterotópico con inseminación intrauterina: presentación de un caso. Ginecol Obstet Mex. 1992;60:110—1. 9. Velasco ST, Vital RV, Rosales dRD, Hinojosa CJ, Reyes FA. Embarazo heterotópico, después de inducción de ovulación con citrato de clomifeno y prednisona. Informe de un caso. Ginecol Obstet Mex. 1999;67:1—3. 10. Gutiérrez CO, Romero SG, Velasco PL. Embarazo heterotópico. Ginecol Obstet Mex. 2006;74:389—93. 11. Domı́nguez MK, Sastré GH, Higuera HF, Vargas DA, Zaldı́var RF. zo heterotópico un ciclo de concepción natural presentado como embarazo ectópico roto. Informe de un caso. Cirug Ciruj Acad Mex Cir. 2008;76:519—22. 12. Berger MJ, Taymor ML. Simultaneus intrauterine and tubal pregnancies following ovulation induction. Am J Obstet Ginecol. 1972;113:812—3. 145 13. Strohmer H, Obruca A, Lehner R, Egarter Ch, Husslein P, Feichtinger W. Successful treatment of a heterotopic pregnancy by sonografhically guiaded instillation of hiperosmolar glucose. Fertil Steril. 1998;69:149—51. 14. Medina C, Prieto M, Acero Y, Salazar G, Delgado G, Martı́nez J. Embarazo heterotópico, a propósito de un caso. Resumen de trabajos libres. V Congreso Mundial de Perinatologı́a y XXVI Congreso Colombiano de Obstetricia y Ginecologı́a, mayo de 2008, Cartagena, Colombia. 15. Characoto A, Osorio F, Prieto M. Embarazo abdominal a propósito de un caso. Resumen de trabajos libres. V Congreso Mundial de Perinatologı́a y XXVI Congreso Colombiano de Obstetricia y Ginecologı́a, mayo de 2008, Cartagena, Colombia. 16. Solomon LJ, Fernández H, Chauveaud A, Doumerc S, Frydman R. Successful management of heterotopic caesarean scar pregnancy: potassium chloride injection with preservation of the intrauterine gestation: case report. Hum Reprod. 2003;18:189—91. 17. Luna-Lugo G, Rangel-Ruiz I, Gutiérrez-Laiza NS, Martı́nez-Guerrero ME, Méndez-Oceguera JR, Suarez-López NM. Embarazo heterotópico y supervivencia del producto intrauterino. Ginecol Obstet Mex. 2011;79:508—15. Prog Obstet Ginecol. 2012;55(3):146—149 PROGRESOS de OBSTETRICIA Y GINECOLOG ÍA w w w. e l s e v i e r. e s / p o g CASO CLÍNICO Útero unicorne con cuerno rudimentario no comunicante en la adolescencia Marı́a Fernández Rial *, Marı́a Isabel Pardo Pumar, Elisa Leal Gómez, Marı́a Eugenia Garcı́a Giménez y José Eloy Moral Santamarina Servicio de Obstetricia y Ginecologı́a, Complejo Hospitalario de Pontevedra, Pontevedra, España Recibido el 26 de julio de 2011; aceptado el 19 de septiembre de 2011 Accesible en lı́nea el 3 de diciembre de 2011 PALABRAS CLAVE Cuerno rudimentario no comunicante; Dolor abdominal; Hematómetra; Hematosálpinx; Útero unicorne KEYWORDS Abdominal pain; Hematometra; Hematosalpinx; Noncommunicating rudimentary horn; Unicornuate uterus Resumen El útero unicorne es una rara malformación uterina que resulta del desarrollo anormal de uno de los conductos de Müller. Se manifiesta habitualmente con dismenorrea, dispareunia y dolor pélvico que aparece pocos meses después de la menarquia, aunque existen casos de presentación tardı́a o asintomática. Los médicos deben tener en cuenta la importancia de esta rara anomalı́a congénita del aparato genital femenino, especialmente poco después de la menarquia porque sin un diagnóstico y tratamiento precoz, las pacientes pueden desarrollar endometriosis, infertilidad, y complicaciones graves. Presentamos el caso de una paciente de 15 años con dolor pélvico crónico originado por un útero unicorne con un cuerno rudimentario no comunicante. ß 2011 SEGO. Publicado por Elsevier España, S.L. Todos los derechos reservados. Unicornuate uterus with noncommunicating rudimentary horn in adolescence Abstract Unicornuate uterus is a rare uterine anomaly resulting from the abnormal development of one of the Müllerian ducts. This abnormality usually manifests with dysmenorrhea, dyspareunia and pelvic pain appearing a few months after menarche, although there are late or even asymptomatic presentations. Clinicians should be aware of the importance of this rare congenital anomaly of the female genital tract, especially when symptoms occur shortly after menarche, because without early diagnosis and treatment, patients carrying this anomaly may develop endometriosis, infertility, and severe complications. We report the case of a 15-year-old girl with chronic pelvic pain caused by a unicornuate uterus with a noncommunicating rudimentary horn. ß 2011 SEGO. Published by Elsevier España, S.L. All rights reserved. Introducción * Autor para correspondencia. Correo electrónico: [email protected] (M. Fernández Rial). El útero unicorne con cuerno rudimentario es la alteración anatómica congénita del aparato genital femenino más infrecuente1,2 producida por la detención prematura del 0304-5013/$ — see front matter ß 2011 SEGO. Publicado por Elsevier España, S.L. Todos los derechos reservados. doi:10.1016/j.pog.2011.09.010 Útero unicorne con cuerno rudimentario no comunicante en la adolescencia desarrollo de uno de los dos conductos mullerianos3-6. La asociación de útero unicorne con anomalı́as del tracto urinario es frecuente1,2,4-8. Se estima que el 0,5% de la población general es portadora de una anomalı́a uterina congénita y el útero unicorne constituye aproximadamente el 5% de las malformaciones uterinas. Esta anomalı́a es significativamente más frecuente en mujeres infértiles y mujeres con resultados reproductivos adversos6. La trı́ada de dismenorrea tras la menarquia, incremento de la severidad de la dismenorrea con cada menstruación y la existencia de una masa pélvica unilateral es una fuerte evidencia de la presencia de una disgenesia mulleriana congénita4,5,9. El diagnóstico precoz es esencial porque los casos no tratados pueden desarrollar multitud de complicaciones obstétricas y ginecológicas tales como endometriosis, esterilidad, hematómetra o piometra, torsión de la porción anormal o de la trompa de Falopio, malpresentación fetal, aborto habitual, embarazo ectópico, gestación en el cuerno rudimentario, parto prematuro o retraso de crecimiento intrauterino1-12. Descripción del caso Mujer de 15 años que acude a nuestro servicio de urgencias por dolor abdominal recurrente de un año de evolución con exacerbaciones coincidentes con la menstruación e incremento gradual del mismo, sin otra sintomatologı́a acompañante. Habı́a acudido en varias ocasiones a urgencias generales por este motivo, la última tres meses atrás. No presentaba otros datos médicos relevantes. La menarquia se habı́a presentado a los 13 años y sus ciclos menstruales eran regulares, con sangrado durante 5 dı́as. Habı́a mantenido relaciones sexuales con preservativo como método anticonceptivo. A la exploración fı́sica se objetiva leve dolor a la palpación profunda en zona suprapúbica derecha sin signos de irritación peritoneal. El examen ginecológico mostró normalidad en genitales externos, la existencia de un septo vaginal longitudinal y cérvix de nulı́para ligeramente desviado a la izquierda, útero Figura 1 Útero unicorne con cuerno rudimentario derecho. 147 de tamaño normal y la existencia de una masa levemente dolorosa a la palpación en la zona anexial derecha. Tras la ecografı́a transvaginal se sospecha la existencia de un útero didelfo con hematómetra en hemicavidad derecha y masa anexial derecha de 43 42 mm sugestiva de hematopiosálpinx. El anejo izquierdo muestra normalidad ecográfica con unas dimensiones de 24 24 mm. Se ingresa a la paciente para estudio y se solicita analı́tica sanguı́nea (dentro de lı́mites normales) y marcadores (Ca 125: 176,1) junto con pruebas de imagen (RM y pielografı́a intravenosa) para caracterizar y tipificar la anomalı́a uterina. Las imágenes de RM se realizan en secuencias T1 y T2, con cortes coronales y axiales del cuerpo uterino antes y después de la administración de contraste gadolinio. Las imágenes muestran un útero unicorne izquierdo con un cuerno rudimentario no comunicante derecho (fig. 1), con hematómetra y hematosálpinx y septo vaginal longitudinal. La pielografı́a por vı́a intravenosa no revela alteraciones en el sistema urinario, siendo ambos riñones normales macroscópicamente, lo cual apoya el diagnóstico de útero unicorne. Una vez hecho el diagnóstico, se lleva a cabo la extirpación del cuerno rudimentario y la trompa derecha por laparotomı́a bajo anestesia epidural sin incidencias (fig. 2), conservando el ovario derecho y el anejo izquierdo. La anatomı́a patológica de la pieza es informada como un cuerno rudimentario funcional con hematómetra y hematosálpinx. Discusión El útero, las trompas de Falopio, el cérvix y los 2/3 superiores de la vagina se desarrollan a partir de los conductos mullerianos que se forman aproximadamente a las 6 semanas de gestación por invaginación del epitelio celómico. Estas estructuras tubulares se fusionan en la lı́nea media aproximadamente a las 20 semanas de gestación y posteriormente se produce la resorción del septo de separación en la lı́nea media del útero, cérvix y trompas de Falopio5,6. El útero unicorne con cuerno rudimentario resulta del desarrollo parcial de uno de los conductos mullerianos5,6, Figura 2 derecha. Pieza de resección de cuerno rudimentario y trompa 148 y el fallo de resorción del septo justifica la falta de comunicación entre ambas cavidades. Existen diferentes clasificaciones de las malformaciones del aparato genital femenino según su anatomı́a o su origen embriológico. La más ampliamente utilizada (aunque recientemente su utilidad ha sido cuestionada)13 es la clasificación de la AFS (American Fertility Society) basada fundamentalmente en la anatomı́a del útero, en la cual el útero unicorne con cuerno rudimentario no comunicante se corresponderı́a con el grupo IIb2,3,13. En particular, esta alteración es más frecuente en el lado derecho2. En nuestro caso, se observa un cuerno rudimentario derecho unido a un útero unicorne izquierdo. Aunque conocemos la incidencia estimada de esta malformación, la incidencia verdadera del útero unicorne no está bien definida3,5,6,8 porque, entre otras cosas, muchas pacientes con esta malformación permanecen asintomáticas. Una revisión reciente de este tema indica que el 78% los casos se presentan en la tercera década de la vida, con una media de edad de presentación en pacientes no obstétricas de 22,9 años4 mientras que nuestra paciente actualmente cuenta con 15 años. Los sı́ntomas de presentación aparecen habitualmente pocos meses después de la menarquı́a4,5,9, siendo el dolor pélvico el sı́ntoma de presentación más frecuente6,12 acompañado por dismenorrea. Pero la sintomatologı́a puede retrasarse, como en nuestro caso, casi dos años. Esto se debe probablemente a la progresiva distensión de la trompa de Falopio por el flujo retrógrado de la sangre acumulada en la cavidad del cuerno rudimentario no comunicante, o debido a torsión o piometra1,2. Dado el origen embriológico común de los riñones y el sistema genital, un defecto en el desarrollo de los conductos mesonéfricos puede llevar a un defecto no solo en las estructuras mullerianas sino también de la anatomı́a renal y de las gónadas5,6,12. La incidencia publicada de alteraciones renales asociadas con duplicación uterina incompleta con útero rudimentario no comunicante se sitúa entre el 31 al 100%4,6,12. Las anomalı́as más frecuente es la agenesia renal ipsolateral al cuerno rudimentario no comunicante5,6, con riñón pélvico ipsolateral como segunda anomalı́a más frecuentemente publicada5. Otras alteraciones menos frecuentes incluyen el riñón ectópico y el riñón en herradura, la duplicidad pélvica renal6,8,12 y la espongiosis medular renal unilateral6. Por todo esto, se explica que la pielografı́a intravenosa se deba realizar a todos los pacientes con alteraciones uterinas9. En nuestro caso mostró normalidad de la totalidad del sistema urinario. Las técnicas de imagen utilizadas en el diagnóstico incluyen la ecografı́a, la histerosalpingografı́a (HSG) y la resonancia magnética nuclear (RM); esta última es la técnica de referencia. La ecografı́a ha sido propuesta como la exploración diagnóstica inicial en pacientes con sospecha de alteraciones mullerianas por su bajo coste comparado con la RM pero en casos de obstrucción vaginal o septo vaginal puede presentar dificultades para su realización. El valor de la HSG se ve limitado por su incapacidad para mostrar el contorno uterino externo y visualizar segmentos rudimentarios ası́ como por requerir la exposición a radiación y no aportar ninguna información sobre la composición del tejido. Por todas estas razones, la RM es el patrón oro ya que aporta información sobre la anatomı́a uterina externa e interna, la M. Fernández Rial et al composición del tejido y la relación endometrio/miometrio de tal forma que aporta información adecuada para decidir el tratamiento a realizar7. Entre las secuelas obstétrico ginecológicas derivadas de esta malformación podemos encontrar endometriosis, por la existencia de flujo retrógrado debido a la obstrucción1,2,5,6,8,9,12 y gestación en el cuerno rudimentario resultante de la migración transperitoneal del esperma1,5,9,10,12 asociada a un riesgo del 70% de rotura uterina en el segundo trimestre con el consecuente riesgo para la vida de la madre y del feto5. La tasa de nacidos vivos, prematuros, abortos, gestación ectópica, parto pretérmino, crecimiento intrauterino restringido, muerte perinatal y cesárea son del 29,2, el 44, el 29, el 43, el 10, el 36,9 y el 33,8%, respectivamente6. La extirpación del cuerno rudimentario es la técnica quirúrgica de elección, en especial si existe endometrio funcional en la cavidad para prevenir la endometriosis y las complicaciones durante la gestación1,2,4-6,8,9,11,12, tanto en pacientes sintomáticas como asintomáticas. La laparoscopia ofrece resultados anatómicos y reproductivos similares a los ofrecidos en la cirugı́a laparotómica, pero con la ventaja adicional de la cirugı́a mı́nimamente invasiva, con menos adherencias y postoperatorio más corto1,2,4,5,8. Con un diagnóstico preciso y el tratamiento correcto del útero unicorne con cuerno rudimentario no comunicante, podemos mejorar la calidad de vida de la paciente y las futuras implicaciones en su vida reproductiva. En nuestro caso, se realizó extirpación laparotómica del cuerno rudimentario y salpingectomı́a para minimizar los riesgos y las complicaciones por nuestra limitada experiencia con laparoscopia en este procedimiento en nuestro hospital. El útero unicorne con cuerno rudimentario no comunicante y funcional es una anomalı́a en el desarrollo de los conductos mullerianos con sus propias implicaciones pronósticas, en términos de tratamiento, reproducción y complicaciones, de ahı́ la importancia del diagnóstico precoz y la extirpación quirúrgica del cuerno rudimentario para evitar las complicaciones posteriores. Conflicto de intereses Los autores declaran no tener ningún conflicto de intereses. Bibliografı́a 1. Atmaca R, Germen AT, Burak F, Kafkasli A. Acute abdomen in a case with noncommunicating rudimentary horn and unicornuate uterus. JSLS. 2005;9:235—7. 2. Zapardiel I, Alvarez P, Perez-Medina T, Bajo-Arenas JM. Laparoscopic management of a cavitated noncommunicating rudimentary uterine horn of a unicornuate uterus: a case report. J Med Case Reports. 2010;4:215. 3. Perrotin F, Bertrand J, Body G. Laparoscopic surgery of unicornuate uterus with rudimentary uterine horn. Hum Reprod. 1999;14—20. 4. Spitzer RF, Kives S, Allen LM. Case series of laparoscopically resected noncommunicating functional uterine horns. J Pedriatr Adolesc Gynecol. 2009;22—30. 5. Nezhat CR, Smith KS. Laparoscopic management of a unicornuate uterus with two cavitated, non-communicating rudimentary horns: case report. Hum Reprod. 1999;14:1965—8. Útero unicorne con cuerno rudimentario no comunicante en la adolescencia 6. Reichman D, Laufer MR, Robinson BK. Pregnancy outcomes in unicornuate uteri: a review. Fertil Steril. 2009;91: 1886—94. 7. Marten K, Vosshenrich R, Funke M, Obenauer S, Baum F, Grabbe E. MRI in the evaluation of müllerian duct anomalies. Clin Imaging. 2003;27:346—50. 8. Goel P, Aggarwal A, Devi K, Takkar N, Saha PK, Huria A. Unicornuate uterus with non-communicating rudimentary horn—different clinical presentations. J Obstet Gynecol India. 2005; 55:155—8. 9. Chakravarti S, Chin K. Rudimentary uterine horn: management of a diagnostic enigma. Acta Obstet Gynecol Scand. 2003; 82:1153—4. 149 10. Okonta PI, Abedi H, Ajuyah C, Omo-Aghoja L. Pregnancy in a noncommunicating rudimentary horn of a unicornuate uterus: a case report. Cases J. 2009;2:6624. 11. Fujimoto VY, Klein NA, Miller PB. Late-onset hematometra and hematosalpinx in a woman with a noncommunicating uterine horn. A case report. J Reprod Med. 1998;43:465—7. 12. Brody JM, Koelliker SL, Frishman GN. Unicornuate uterus: imaging appearance, associated anomalies, and clinical implications. AJR Am J Roentgenol. 1998;171:1341—7. 13. Grimbizis GF, Campo R. Congenital malformations of the female genital tract: the need for a new classification system. Fertility and Sterility, In Press, Corrrected Proof. Fertility Steril. 2010; 94:401—7. Prog Obstet Ginecol. 2012;55(3):150—152 PROGRESOS de OBSTETRICIA Y GINECOLOG ÍA w w w. e l s e v i e r. e s / p o g CARTAS AL DIRECTOR Respuesta a Hallazgos histeroscópicos en mujeres asintomáticas con ecografía sugestiva de patología Response to Hysteroscopic findings in asymptomatic women with abnormalities on gynecologic ultrasound Sr. Director: Querı́amos agradecer al Dr. Alcázar la exhaustiva lectura de nuestro artı́culo y abrir la discusión del cribado del cáncer de endometrio con ecografı́a transvaginal. Es una satisfacción el que acepte como buenos los datos referidos por nosotros en cuanto a la prevalencia de la hiperplasia con atipias y del adenocarcinoma de endometrio en mujeres asintomáticas con ecografı́a vaginal indicativa de patologı́a endometrial, ası́ como del valor de la histeroscopia para el diagnóstico de estas patologı́as, ya que parece que, aunque con matices, el diseño metodológico de nuestro artı́culo es correcto. Sentimos que nuestro artı́culo no sea original, porque ya ha sido tratado por otros autores1—5, pero nunca se ha publicado nada parecido en español ni en Progresos en Obstetricia y Ginecologı́a. Nuestro artı́culo fue enviado para publicar en marzo de 20106 y se publicó en diciembre del mismo año. Todavı́a no conocı́amos el artı́culo de Jacobs et al.7, que fue publicado on line en diciembre de 2010 y, por lo tanto, no hemos podido referirnos a él. Lo hemos leı́do posteriormente y nos hemos recreado con él, por las múltiples consideraciones que hace, a algunas de las cuales nos vamos a referir: Durante mucho tiempo se ha pensado que la ecografı́a vaginal podı́a ser una prueba para la detección precoz del cáncer de endometrio. Sin embargo, hasta el trabajo de Jacobs et al.7 pocos datos habı́a a su favor. El mayor estudio hasta entonces incluyó 2.000 mujeres y solo un cáncer de endometrio8. En el ensayo de Jacobs et al.7, 26 mujeres (19,5%) con una lı́nea endometrial (LE) menor de 5 mm desarrollaron un cáncer de endometrio al año tras la ecografı́a vaginal; sensibilidad del 77,1% (67,8-84,3). Sin embargo, los autores afirman que hay una fuerte correlación entre la LE y el posterior Véase contenido relacionado en DOI: 10.1016/j.pog.2011.06.001. diagnóstico de cáncer de endometrio. El riesgo relativo (RR) para una LE de 5,15 es de 25,2, y para una LE de 6,75 de 43,737. Señalan, además, que un tema importante y difı́cil de valorar, lo mismo que para el cribado de cualquier otra enfermedad, es el efecto que tiene en la mujer la detección temprana del cáncer de endometrio sobre la supervivencia y la mortalidad, incluso aunque la prueba diagnóstica tuviera una sensibilidad del 100%. Esto depende de una serie de caracterı́sticas de la enfermedad7. Nosotros, en nuestro artı́culo, apuntamos algunos datos que pueden ser de interés. El grupo más numeroso de las mujeres con cáncer de endometrio se encuentra en la década de los 70 años, en total, 7 de 14 (50%); todos estos fueron endometrioides, en estadio IA de la actual clasificación FIGO, es decir, con un pronóstico excelente, como la mayorı́a de los adenocarcinomas diagnosticados en mujeres con metrorragia posmenopáusica. La edad de presentación tiene su importancia para calcular la eficiencia del cribado. El tiempo de supervivencia, el gasto del cribado y el producto interior bruto per cápita (PIB-p) del paı́s en el que se va a poner en práctica el cribado son variables importantes para determinar la eficiencia de un cribado determinado9,10. Por otro lado, hubo 5 adenocarcinomas no endometrioides, 4 de ellos serosos papilares y sabemos que el carcinoma seroso papilar tiene un pronóstico malo a pesar de que se haya diagnosticado en un estadio precoz11. Pero para tener datos con valor cientı́fico que nos permitan conocer la supervivencia, Jacobs et al.7 señalan que serı́a necesario un estudio aleatorizado con 500.000 participantes para calcular una reducción en la mortalidad de 50% por cáncer de endometrio, algo casi seguro que no sea posible de hacer, en su opinión. Otros datos muy importantes antes de plantear un cribado serı́a conocer, por un lado, la carga económica y laboral que supone el cribado y, por otro, las consecuencias de los falsos positivos que, como vemos en nuestro artı́culo, son muchos. Es cierto que la ecografı́a transvaginal diagnostica patologı́a endometrial en casi un 80%, pero no es menos cierto que solo encontramos 20 adenocarcinomas y 16 hiperplasias con atipias, lo que supone un VPP del 2% para cáncer de endometrio e hiperplasia con atipias; la mayorı́a del resto de patologı́as son pólipos, que poco o nada tienen que ver con el cáncer de endometrio. En el trabajo de Jacobs et al.7 el VPP es del 1,5%, cifra muy parecida a la nuestra. Esto supone una carga económica importante para el erario público. Este es hoy un tema de suma importancia por la situación económica en que nos encontramos. Los 0304-5013/$ — see front matter ß 2011 SEGO. Publicado por Elsevier España, S.L. Todos los derechos reservados. CARTAS AL DIRECTOR autores del ensayo mencionado aseguran que los factores de riesgo podrı́a modificar el VPP, pero todavı́a hoy esto no está demostrado. Además, redundando en lo mismo señalan que para detectar un adenocarcinoma por una LE de 5 mm o más habrı́a que hacer un procedimiento, una histeroscopia o una biopsia de endometrio, por cada 50 ecografı́as para detectar un adenocarcinoma. En nuestro artı́culo detectamos 20 adenocarcinomas sobre 1.237 histeroscopias, por lo tanto hemos tenido que practicar 1 histeroscopia por cada 61,85 ecografı́as, cifra parecida a la de Jacobs et al.7. Cuestiones como la morbilidad por las pruebas complementarias, la aceptación del cribado por parte de la mujer y la economı́a de la salud deberán decidir si el cribado del cáncer de endometrio es posible. Hasta entonces, cualquier comentario sobre el posible beneficio de la detección precoz del cáncer de endometrio con ecografı́a transvaginal es una conjetura7. Por último, querı́a aclarar que nosotros no hemos escrito en ningún sitio que la LE no sea reproductible. Ni lo hemos escrito ni lo creemos1—5; lo que sı́ hemos dicho es que una LE mayor de 5 mm es poco especı́fica para el diagnóstico del cáncer de endometrio y de hiperplasia con atipias, y que la biopsia de endometrio es poco reproductible para hacer el diagnóstico de hiperplasia con atipias12,13. El diagnóstico de hiperplasia con atipias nos obliga muchas veces al tratamiento con histerectomı́a. En nuestro artı́culo se describe el número de adenocarcinomas e hiperplasias con atipias que nos encontramos en la pieza de histerectomia, resultando este porcentaje mucho menor que el que presentan otros autores14,15. Bibliografı́a 1. Alcázar JL, Zornoza A. Transvaginal ultrasonographic measurement of endometrial thickness: An intra-observer and interobserver reproducibility study. Radiography. 2001;7:101—4. 2. Fleischer AC, Wheeler JE, Lindsay I, Hendrix SL, Grabill S, Kravitz B, et al. An assessment of the value of ultrasonographic screening for endometrial disease in postmenopausal women without symptoms. Am J Obstet Gynecol. 2001;184:70—5. 3. Goldstein SR. The endometrial echo revisited: Have we created a monster? Am J Obstet Gynecol. 2004;191:1092—6. 4. Schmidt T, Breidenbach M, Nawroth F, Mallmann P, Beyer IM, Fleisch MC, et al. Hysteroscopy for asymptomatic postmenopausal women with sonographically thickened endometrium. Maturitas. 2009;62:176—8. doi:10.1016/j.pog.2011.11.003 151 5. Epstein E, Valentin L. Intraobserver and interobserver reproducibility of ultrasound measurements of endometrial thickness in postmenopausal women. Ultrasound Obstet Gynecol. 2002;20: 486—91. 6. Rivero, Gorostidi. Hysteroscopic results in asymptomatic women with ultrasonographic findings suggestive of endometrial disease. Prog Obstet Ginecol. 2010;495—501. 7. Jacobs I, Gentry-Maharaj A, Burnell M, Manchanda R, Singh N, Sharma A, et al. Sensitivity of transvaginal ultrasound screening for endometrial cancer in postmenopausal women: A case-control study within the UKCTOCS cohort. Lancet Oncol. 2011; 12:38—48. 8. Fleischer AC, Wheeler JE, Lindsay I, Hendrix SL, Grabill S, Kravitz B, MacDonald B. An assessment of the value of ultrasonographic screening for endometrial disease in postmenopausal women without symptoms. Am J Obstet Gynecol. 2001;184:70—75. 9. Cortés J, Martinón-Torres F, Ramón y Cajal JM, Gil A, Velasco J, Abizanda M, et al. Prevención primaria y secundaria de los cánceres de cuello de útero y vulva: Recomendaciones para la práctica clı́nica. Prog Obstet Ginecolog. 2010;53 Suppl 1: 1—19. 10. Macroeconomics WHOCO Health. Macroeconomics and health: Investing in health for economic development. Report of the Commission on Macroeconomics and Health 2001. 11. Elvira Urdampilleta A, Oyarzabal Urkiola A, Cortaberria Ibarluzea JR, Aizpitarte Gorrotxategi I, Rivero Torrejón B. Adenocarcinoma seroso papilar sobre pólipo endometrial. Prog Obstet Ginecol. 2009;52:299—302. 12. Norris HJ, Tavassoli FA, Kurman RJ. Endometrial hyperplasia and carcinoma. Diagnostic considerations. Am J Surg Pathol. 1983; 7:839—47. 13. Kendall BS, Ronnett BM, Isacson C, Cho KR, Hedrick L, DienerWest M, et al. Reproducibility of the diagnosis of endometrial hyperplasia, atypical hyperplasia, and well-differentiated carcinoma. Am J Surg Pathol. 1998;22:1012—9. 14. Trimble CL, Kauderer J, Zaino R, Silverberg S, Lim PC, Burke JJ, et al. Concurrent endometrial carcinoma in women with a biopsy diagnosis of atypical endometrial hyperplasia: A gynecologic oncology group study. Cancer. 2006;106:812—9. 15. Janicek MF, Rosenshein NB. Invasive endometrial cancer in uteri resected for atypical endometrial hyperplasia. Gynecol Oncol. 1994;52:373—8. Borja Rivero de Torrejón* y Mikel Gorostidi Pulgar Departamento de Obstetricia y Ginecologı́a, Hospital de Donostia, San Sebastián, España *Autor para correspondencia. Correo electrónico: [email protected] (B. Rivero de Torrejón). 152 Tratamiento laparoscópico del quiste dermoide de ovario. Factores asociados a la rotura intraoperatoria, trascendencia clínica y resultados Laparoscopic treatment of an ovarian dermoid cyst. Factors associated with intraoperative rupture, clinical relevance and results Sr. Director: Hemos leı́do con interés el trabajo de Rodrı́guez-Oliver et al.1 que aborda una situación clı́nica frecuente en la cirugı́a ginecológica, como son los quistes dermoides ováricos. Presentan su experiencia de 9 años en el tratamiento de este tipo de quistes, con 131 intervenciones realizadas en 119 pacientes. Refieren que en 53 pacientes (44,5%) se produjo derrame de contenido intraquı́stico, pero en ningún caso se produjo una peritonitis quı́mica. Los autores concluyen que si se produce la rotura intraoperatoria del quiste no suele tener trascendencia clı́nica alguna. Estando de acuerdo en la mayor parte del artı́culo y coincidiendo, sustancialmente, en el abordaje laparoscópico de este tipo de tumoraciones ováricas, diferimos de los autores en la afirmación realizada sobre la ausencia de trascendencia de la rotura intraoperatoria del quiste. Se sabe que la rotura del teratoma puede ocurrir con mayor frecuencia cuando se realiza un abordaje laparoscópico que cuando se realiza una laparotomı́a2 y por ello el riesgo de presentar una peritonitis quı́mica es mayor. Una revisión de la literatura puso de manifiesto que esta complicación aparece en el 0,2% de las roturas quı́sticas intraoperatorias3. Si bien esta incidencia es muy baja, las potenciales complicaciones de una peritonitis quı́mica4 deben de hacernos estar vigilantes cuando durante la intervención quirúrgica se ha producido la rotura del quiste dermoide. De hecho, se han publicado estrategias quirúrgicas, como la laparoscopia sin gas, para disminuir el riesgo de rotura intraoperatoria2. Nosotros, en una serie de 89 quistectomı́as ováricas laparoscópicas realizadas por teratoma ovárico, tuvimos un caso de peritonitis quı́mica que requirió re intervención. Se doi:10.1016/j.pog.2011.11.004 Véase contenido relacionado en DOI: 10.1016/j.pog.2011.03.013. CARTAS AL DIRECTOR trató de una mujer de 38 años que presentaba un teratoma dependiente del ovario derecho de 120 100 mm de diámetro. Durante la cirugı́a laparoscópica se produjo la rotura del quiste con salida de su contenido, especialmente pelo. Se realizaron lavados profusos con 5.000 cc de suero fisiológico. La paciente fue dada de alta a las 24 h de la intervención y reingresó, con un cuadro de suboclusión intestinal, 9 dı́as después. Se realizó un abordaje laparoscópico en el que encontramos con un abdomen «congelado» por adherencias de epiplón y asas intestinales a la pared abdominal y, posteriormente, realizamos una laparotomı́a para liberar las asas atrapadas en el proceso inflamatorio. Dada la posible gravedad del cuadro, pensamos que, tras una cirugı́a por teratoma ovárico en la que se produce la rotura de este, debemos de estar vigilantes ante la posibilidad de aparición de una peritonitis quı́mica. Bibliografı́a 1. Rodrı́guez-Oliver AJ, Aguilar MT, Carrillo MP, Fernández J, Montoya F. Tratamiento laparoscópico del quiste dermoide de ovario, Factores asociados a la rotura intraoperatoria, trascendencia clı́nica y resultados. Prog Obstet Ginecol. 2011;54:358—62. 2. Kruschinski D, Homburg S, Landge SKapur A. Dermoid tumors of the ovary: evaluation of the gasless lift-laparoscopy approach. Surg Tech Int. 2008;17:203—7. 3. Nezhat CR, Kalyoncu S, Nezhat CH, Johnson E, Berlanada N, Nezhat F. Laparoscopic management of ovarian dermois cysts: ten year’s experience. J Society Lapar Surgeons. 1999;3:179—84. 4. Da Silva BB, Dos Santos AR, Lopes-Costa PV, Sousa-Junior EC, Correa-Lima MV, Pires CG. Ovarian dermoid cyst with malignant transformation and rupture of the capsule associated with chemical peritonitis: a case report and literature review. Eur J Gynecol Oncol. 2009;30:226—8. Iñaki Lete*, Juan Manuel Marı́n y Sandra Guerra Servicio de Ginecologı́a, Hospital Santiago, Vitoria-Gasteiz, Álava, España *Autor para correspondencia Correo electrónico: [email protected] (I. Lete).