Enzimas Transaminasas
Anuncio

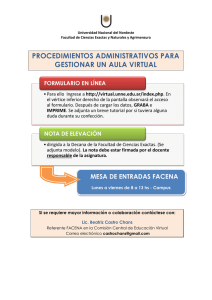
Q QU UIIM MIIC CA AB BIIO OLLO OG GIIC CA A IIII Laboratorio Nº 2 Tema: CATABOLISMO DE LOS AMINOÁCIDOS: TRANSAMINACIONES. Contenidos conceptuales: Digestión de proteínas y absorción de aminoácidos. Catabolismo aminoacídico: Desaminaciones oxidativa y no oxidativa. Transaminaciones. Contenidos procedimentales: Desarrollo del método colorimétrico para el dosaje de la enzima glutámico-oxalacético-transaminasa (GOT, AST, ASAT) humana. Determinación de la actividad de la glutámico-oxalacético-transaminasa en sueros humanos normales controles, sueros de pacientes con hepatopatías y cardiopatías. Contenidos actitudinales: Integración en trabajo grupal. Predisposición para la resolución de problemas con espíritu crítico y rigor científico. Bioseguridad en el laboratorio. Autoconfianza. Precisión, sistematización y coherencia en los planteamientos. Responsabilidad para con las tareas encomendadas. Objetivos: Comprobar la actividad biológica de la enzima glutámico-oxalacético-transaminasa en sueros humanos normales controles, y en sueros de pacientes con hepatopatías y cardiopatías. Química Biológica II FACENA, UNNE Laboratorio Nº 2 2013 Fundamentos Teóricos Los aminoácidos tienen un rol fundamental en los seres vivientes, ya que constituyen las proteínas y son precursores de algunas hormonas y otros compuestos de interés biológico (neurotransmisores, histamina, anillos porfirínicos, nucleótidos, etc.). El organismo puede sintetizar una parte de los -aminoácidos necesarios para el suplemento proteico y otra parte proviene de la dieta (aminoácidos esenciales). Las transaminaciones son reacciones de intercambio de un radical NH2 entre dos grupos carbonados, siendo reemplazado el radical amino por una función cetona. El papel de las reacciones de transaminación es doble: 1. Permiten realizar la interconversión de los aminoácidos. 2. Posibilitan la separación de la parte nitrogenada de los aminoácidos aportados en exceso, constituyendo el primer paso del catabolismo de muchos aminoácidos. Las dos transaminasas más activas son la glutámico-oxalacético-transaminasa (GOT) (aspartato-aminotransferasa (ASAT, AST)) y la glutámico-pirúvico-transaminasa (GPT) (alanín-aminotransferasa (ALAT, ALT)). Se presentan en muchos órganos, principalmente en hígado y músculo cardíaco. Existen isoenzimas en citosol y mitocondria con K Michaelis= 1. Son de gran interés clínico, ya que aumentan anormalmente sus niveles plasmáticos en patologías hepáticas (GOT y GPT), como también en cardiopatías (GOT). Método colorimétrico de determinación cuantitativa de la actividad biológica (dosaje) de la GOT Fundamento Químico del Método Las transaminasas o aminotransferasas implican la interconversión de un par de aminoácidos y un par de cetoácidos. Las reacciones son de carácter reversible y poseen como cofactor el fosfato de piridoxal (derivado activo de la vitamina B6). La reacción íntima implica la formación de aldiminas y cetiminas (bases de Schiff) con los grupos amino transportados desde el aminoácido reaccionante al cetoácido aceptor. La transaminasa glutamato-oxalacética cataliza la siguiente reacción: COONa COONa CO CH2 + CH2 HCNH2 HCNH2 CH2 CH2 COONa CH2 COONa -cetoglutarato de sodio COONa COONa CO + CH2 COONa COONa L-aspartato de sodio L-glutamato de sodio oxalacetato de sodio El oxalacetato formado se determina fotocolorimétricamente mediante la formación de la 2,4-dinitrofenilhidrazona, que en medio alcalino posee color rojo, y se mide entre 500 y 550 nm. 2 Química Biológica II FACENA, UNNE Laboratorio Nº 2 2013 El oxalacetato se descarboxila en parte a piruvato, y cuando se trata la mezcla de reactantes y productos con 2,4-dinitrofenilhidrazina se forman, además de la 2,4dinitrofenilhidrazona del oxalacetato, las correspondientes al -cetoglutarato y piruvato, que en solución alcalina también poseen color rojo. Para reducir la contribución de la 2,4-dinitrofenilhidrazona del -cetoglutarato al color total de la mezcla, la cantidad del mismo en el sustrato es subóptima (L-aspartato/cetoglutarato = 50/1) y se mide a una longitud de onda comprendida entre 500 y 550 nm, donde las absortividades molares de las 2,4-dinitrofenilhidrazonas del oxalacetato o del piruvato son mayores que las del -cetoglutarato. Debido a esa inestabilidad del oxalacetato, que se descarboxila en parte a piruvato, es la 2,4-dinitrofenilhidrazona de este último (que en solución alcalina posee el mismo color que la del oxalacetato) la que se utilizará para la realización de la curva de calibración. Materiales y Reactivos Equipamiento necesario: Espectrofotómetro Baño termostatizado Muestras de sueros humanos normales y con patologías hepáticas y cardíacas Cada alumno debe traer papel milimetrado. Bibliografía: - Bioquímica de Harper. Murray R. B. 12da. Edición. Editorial El Manual Moderno. 2001. - Bioquímica. Lehninger A. L. 2da.edición. Editorial Omega. 1995. - Bioquímica. Rawn J. D. Tomos I y II. 1ra. Edición. Ed. Interamericana - McGraw-Hill. 1989. - Química Biológica. Blanco A. 7ma. Edición. Editorial El Ateneo. 2000. - Clinical Chemistry. Richterich R. Academic Press, 1969 - Actas de Bioquímica Clínica Argentina. Vol. VI Nº 1, 1972 - American Journal of Clinical Pathology. Reitman S., Frankel F. 28:56, 1957 3 Química Biológica II FACENA, UNNE Laboratorio Nº 2 2013 Técnica: 4 Química Biológica II FACENA, UNNE Laboratorio Nº 2 2013 5 Química Biológica II FACENA, UNNE Laboratorio Nº 2 2013 Informe: Absorbancia blanco: .............................. Absorbancia desconocido: ..................... Valor obtenido de la curva: .................... Valor obtenido de la tabla de conversión: Alumno: ............................................................ Comisión Nº: ...... Grupo: ...... Fecha: ........... 6