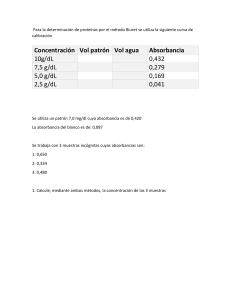
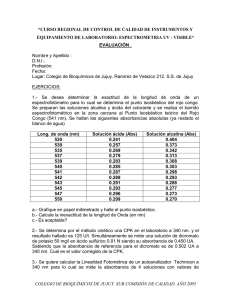
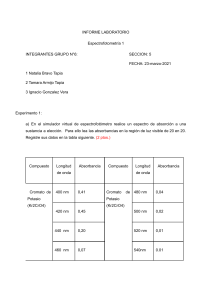
Fundamentos de Espectrofotometría
Anuncio

CINÉTICA QUÍMICA Fundamentos de Espectrofotometría Laboratorio de Equilibiro y Cinética Sem 2010-1 Introducción 2ª parte del curso • Cinética Química: Estudio de la velocidad (rapidéz) de las reaciones ¿cómo se puede medir la velocidad de una reación? • Cinética Química: Estudio de los factores que afectan la velocidad de las reaciones ¿Cómo se puede modificar la velocidad de una reacción? ¿cómo se puede medir la velocidad de una reación? Cambio de color Cambio en la presión del O2 Cambio en la conductividad RP Velocidad = P =t R t CAMBIO EN LA CONCENTRACIóN respecto al tiempo Espectroscopía Es el método de análisis óptico más usado en el área de investigación Estudio de la interacción de la RADIACIÓN con la MATERIA como una función de la longitud de onda ( ). Radiación Energía=h =hc/ h, cte. Planck C, vel luz , frecuencia longitud de onda Espectroscopía de Absorción hv Absorbancia UV-Vis Una TRANSICIÓN desde un nivel bajo a un nivel alto de energía acompañado de una transferencia de energía se llama absorción. Se hacen determinaciones - Cualitativas -Cuantitativas Espectrometría Es la técnica espectroscópica utilizada para determinar la concentración de una sustancia. Es la CUANTIFICACIÓN de la cantidad de energía radiante absorbida por las moléculas de una muestra en función de las longitudes de onda específicas. Espectrofotómetro Instrumentación típica de un espectrofotómetro Fotodetector, que mide cuantitativamente la radiación que pasa por la muestra Monocromador que separa la banda de longitud de onda deseada Transmitancia y Absorbancia I0 I Transmitancia = I/I0 (valores entre 0 - 1) Absorbancia = -log (I/I0) 100 I 80 Absorbancia Transmitancia % I en el detector 0 60 40 20 0 0 0.2 0.4 0.6 0.8 I 1 2.5 2 1.5 1 0.5 0 0 0.2 0.4 0.6 0.8 I 1 Absorbancia aceptable entre 0.1 – 1.0 Valores altos y bajos de absorbancia son poco confiables Ley de Lambert-Beer Establece que hay una relación lineal entre la absorción de luz a través de una sustancia y la concentración de la sustancia. A = ε· l · c Donde: A = absorbancia = Coeficiente de extinción molar (M-1 cm-1) l = longitud de la celda (cm). …concentración es absorbancia 1.2 Curva Patrón Absorbancia 1 0.8 0.6 ε· l 0.4 0.2 0 0 20 40 60 80 100 [concentración] 120 Determinación de la concentración de yodo en una solución acuosa KI I+ I2 + K I3- + 2 x 10-4 M Muy poco soluble en agua Soluble en agua Absorbancia Longitud de onda Seleccionar una longitud de onda y hacer curva patrón 1.2 Curva Patrón Absorbancia 1 0.8 0.6 ε· l 0.4 0.2 0 0 20 40 60 80 100 [concentración] 120