Constantes de disociación de ácidos y bases débiles
Anuncio
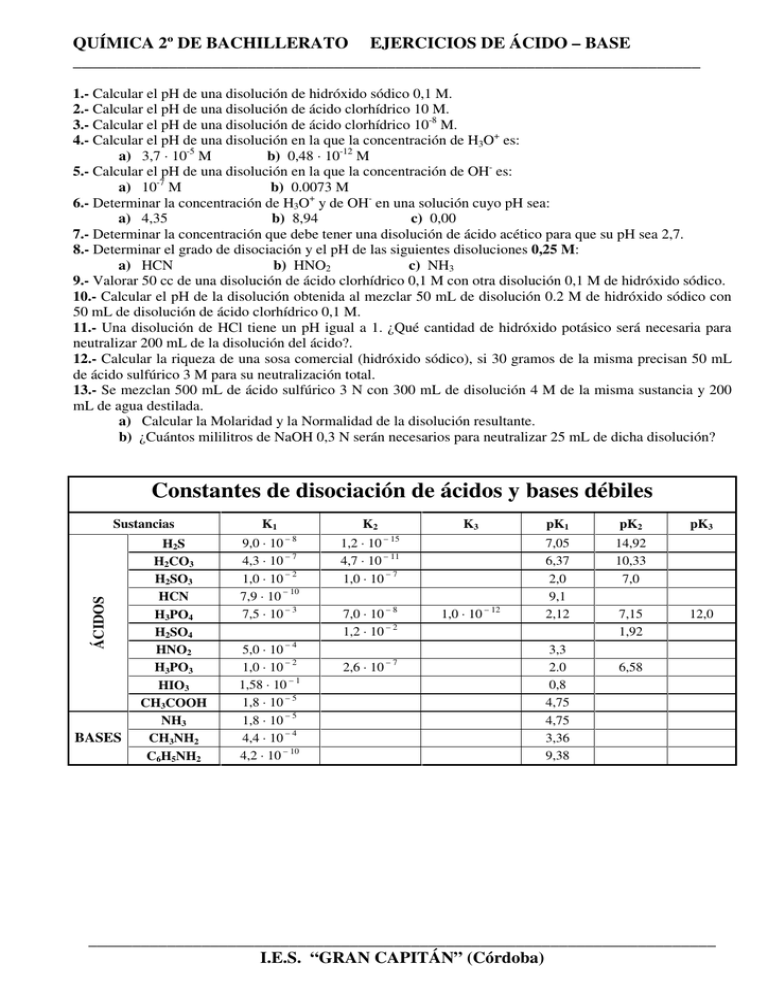
QUÍMICA 2º DE BACHILLERATO EJERCICIOS DE ÁCIDO – BASE ________________________________________________________________________ 1.- Calcular el pH de una disolución de hidróxido sódico 0,1 M. 2.- Calcular el pH de una disolución de ácido clorhídrico 10 M. 3.- Calcular el pH de una disolución de ácido clorhídrico 10-8 M. 4.- Calcular el pH de una disolución en la que la concentración de H3O+ es: a) 3,7 · 10-5 M b) 0,48 · 10-12 M 5.- Calcular el pH de una disolución en la que la concentración de OH- es: b) 0.0073 M a) 10-7 M 6.- Determinar la concentración de H3O+ y de OH- en una solución cuyo pH sea: a) 4,35 b) 8,94 c) 0,00 7.- Determinar la concentración que debe tener una disolución de ácido acético para que su pH sea 2,7. 8.- Determinar el grado de disociación y el pH de las siguientes disoluciones 0,25 M: a) HCN b) HNO2 c) NH3 9.- Valorar 50 cc de una disolución de ácido clorhídrico 0,1 M con otra disolución 0,1 M de hidróxido sódico. 10.- Calcular el pH de la disolución obtenida al mezclar 50 mL de disolución 0.2 M de hidróxido sódico con 50 mL de disolución de ácido clorhídrico 0,1 M. 11.- Una disolución de HCl tiene un pH igual a 1. ¿Qué cantidad de hidróxido potásico será necesaria para neutralizar 200 mL de la disolución del ácido?. 12.- Calcular la riqueza de una sosa comercial (hidróxido sódico), si 30 gramos de la misma precisan 50 mL de ácido sulfúrico 3 M para su neutralización total. 13.- Se mezclan 500 mL de ácido sulfúrico 3 N con 300 mL de disolución 4 M de la misma sustancia y 200 mL de agua destilada. a) Calcular la Molaridad y la Normalidad de la disolución resultante. b) ¿Cuántos mililitros de NaOH 0,3 N serán necesarios para neutralizar 25 mL de dicha disolución? Constantes de disociación de ácidos y bases débiles ÁCIDOS Sustancias BASES H2S H2CO3 H2SO3 HCN H3PO4 H2SO4 HNO2 H3PO3 HIO3 CH3COOH NH3 CH3NH2 C6H5NH2 K1 K2 –8 9,0 · 10 4,3 · 10 – 7 1,0 · 10 – 2 7,9 · 10 – 10 7,5 · 10 – 3 5,0 · 10 – 4 1,0 · 10 – 2 1,58 · 10 – 1 1,8 · 10 – 5 1,8 · 10 – 5 4,4 · 10 – 4 4,2 · 10 – 10 K3 pK1 pK2 14,92 10,33 7,0 1,0 · 10 – 12 7,05 6,37 2,0 9,1 2,12 – 15 1,2 · 10 4,7 · 10 – 11 1,0 · 10 – 7 7,0 · 10 – 8 1,2 · 10 – 2 2,6 · 10 –7 3,3 2.0 0,8 4,75 4,75 3,36 9,38 7,15 1,92 pK3 12,0 6,58 ________________________________________________________________________ I.E.S. “GRAN CAPITÁN” (Córdoba)





