OPERACIONES BÁSICAS EN INGENIERÍA QUÍMICA: Ejercicios
Anuncio
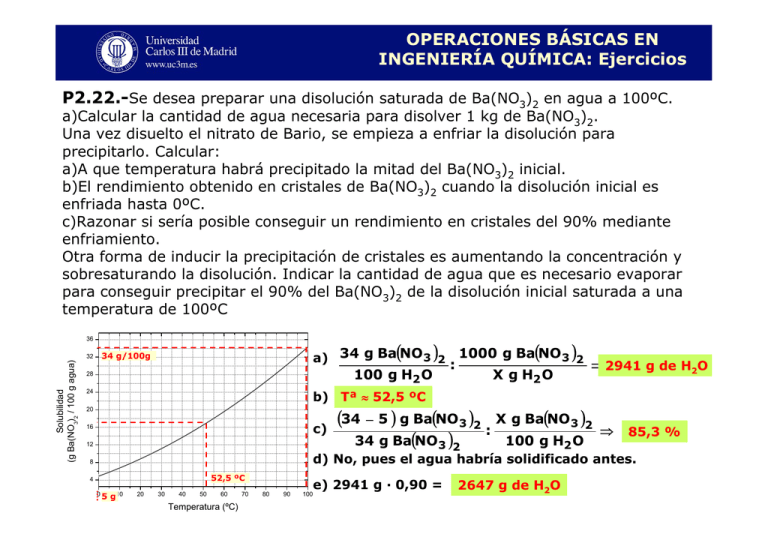
OPERACIONES BÁSICAS EN INGENIERÍA QUÍMICA: Ejercicios P2.22.-Se desea preparar una disolución saturada de Ba(NO3)2 en agua a 100ºC. a)Calcular la cantidad de agua necesaria para disolver 1 kg de Ba(NO3)2. Una vez disuelto el nitrato de Bario, se empieza a enfriar la disolución para precipitarlo. Calcular: a)A que temperatura habrá precipitado la mitad del Ba(NO3)2 inicial. b)El rendimiento obtenido en cristales de Ba(NO3)2 cuando la disolución inicial es enfriada hasta 0ºC. c)Razonar si sería posible conseguir un rendimiento en cristales del 90% mediante enfriamiento. Otra forma de inducir la precipitación de cristales es aumentando la concentración y sobresaturando la disolución. Indicar la cantidad de agua que es necesario evaporar para conseguir precipitar el 90% del Ba(NO3)2 de la disolución inicial saturada a una temperatura de 100ºC 36 Solubilidad (g Ba(NO3)2 / 100 g agua) 32 a) 34 g Ba(NO 3 )2 34 g/100g 100 g H2 O 28 : 1000 g Ba(NO 3 )2 X g H2 O ⇒ 2941 g de H2O b) Tª ≈ 52,5 ºC 24 20 c) 16 12 (34 − 5 ) g Ba(NO 3 )2 X g Ba(NO 3 )2 : 34 g Ba(NO 3 )2 100 g H2 O ⇒ 85,3 % d) No, pues el agua habría solidificado antes. 8 52,5 ºC 4 05 g10 20 30 40 50 60 Temperatura (ºC) 70 80 90 100 e) 2941 g · 0,90 = 2647 g de H2O