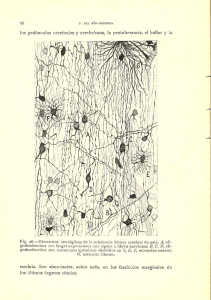
Tesis - Universidad de Colima
Anuncio

Universidad de Colima Facultad de Medicina Centro Universitario de Investigaciones Biomédicas ESTRUCTURA Y FUNCIÓN DEL MÚSCULO ESQUELÉTICO: PROPIEDADES MECÁNICAS PASIVAS Y CONTRACTILIDAD Tesis Que para obtener el grado de Maestro en Ciencias Fisiológicas con especialidad en Fisiología Presenta MVZ: Adrián Larios Escalante Asesor Dr. J. Jesús Muñiz Murguía Colima, Col., Julio de 1998 CONTENIDO Capitulo Página INTRODUCCION I.- EL SISTEMA MUSCULAR ESQUELETICO................................................. - Los músculos, al igual que los movimientos, son marcadamente diversos. 1 II.-ESTRUCTURA DEL MUSCULO ESQUELETICO........................................ NIVELES DE ORGANIZACIÓN - Composición química del músculo. - Aporte sanguíneo. - Capilarización del músculo. 4 III- ULTRAESTRUCTURA DEL MUSCULO ESQUELETICO ................................ - La fibra muscular. - Plasmalema. - Diferentes tipos de proteínas están incrustadas en el plasmalema. 7 IV.-ORGANIZACION INTRACELULAR .............................................................. - Miofibrillas. - El Sarcómero. - Los filamentos de actina y miosina corresponden a las bandas claras y oscuras. - Sistemas tubulares. - El retículo sarcoplásmico (RS) circunda las miofibrillas. - El sistema de túbulos transversos conecta la superficie de la fibra con el interior celular. - Núcleo y mitocondrias. - Las mitocondrias proporcionan el ATP a la fibra muscular. 12 V.- PROTEINAS ESTRUCTURALES DEL MÚSCULO ......................................... 18 PROTEINAS DEL SARCOMERO. PROTEINAS DEL FILAMENTO GRUESO ........................................................ - Los filamentos de miosina - Cadenas pesadas de la miosina. - Los puentes cruzados son las cabezas globulares de las moléculas de miosina. - Las cadenas ligeras de miosina regulan las cabezas de miosina. - Otras proteínas del filamento grueso. - Los filamentos de miosina se mantienen juntos en la región M. - La titina también ayuda a estabilizar los filamentos de miosina. 18 PROTEINAS DEL FILAMENTO DELGADO ......................................................... - Los filamentos de actina. - Los filamentos de activa tienen polaridad. - Los filamentos de actina están asociados con dos proteínas accesorias reguladoras, la tropomiosina y la troponina. 24 VI.- EL CITOESQUELETO y LA MATRIZ EXTRASARCOMERICA - Estudios bioquímicos sobre las proteínas del citoesqueleto. - Filamentos intermedios. - Estructura de los filamentos intermedios. - Los microtúbulos. - Los microtúbulos son responsables del citoesqueleto. - El citoesqueleto fortalece el sarcolema y mantiene las estructuras intracelulares en su lugar. - El citoesqueleto y otras proteínas miofibrilares. - Los filamentos de actina están atados a los discos Z. 27 VII: LA MATRIZ EXTRACELULAR EN LAS FIBRAS MUSCULARES ESQUELETICAS ............................................................. 34 - Composición y diversidad estructural. - Las proteínas fibrosas. - La sustancia basal y los complejos de proteoglicano. - Diversidad de la matriz extracelular. - Adhesiones focales: asociaciones especializadas del citoesqueleto y la matriz extracelular. - Glicoproteínas estructurales - Receptores de membrana para macromoléculas de la matriz extracelular. VIII.- MEMBRANA BASAL ............................................................................... - La membrana basal tiene varias capas. - La membrana basal contiene varios tipos de proteínas y carbohidratos. - La membrana basal tiene funciones importantes. 40 IX.- EL TEJIDO CONECTIVO DEL MUSCULO ESQUELETICO ...................... - El tejido conectivo muscular está organizado en tres niveles. - El tejido conectivo muscular tiene múltiples funciones. 43 X.- LA COLAGENA EN LA FUNCION MUSCULAR ..................................... - Propiedades estructurales de la colágena. - La familia de proteínas y genes de colágena. - Tipos de colágena. 45 BIOSÍNTESIS ........................................................................................................ - Rasgos generales. - Procesamiento intracelular. - Eventos extracelulares. - Funciones de la colágena en el músculo esquelético. 52 XL- INTERACCION MUSCULO-TENDON ..................................................... - Estructura del músculo esquelético completo. - Los extremos de las fibras musculares están especializados para transmitir la fuerza al tendón. - Propiedades mecánicas del tendón. - Significado fisiológico de la flexibilidad del tendón. 57 XII.- ARQUITECTURA MUSCULAR ................................................................ - Determinación experimental de la arquitectura del músculo esquelético. - Área fisiológica de corte transversal. - Los músculos delgados largos están divididos en compartimientos. - Alineación de los sarcómeros en una fibra muscular. - La plumación produce más fuerza. - Longitud de la fibras en proporción a la longitud del músculo. 61 XIII.- DESARROLLO DEL MÚSCULO Y FIBRAS MUSCULARES ............... 68 - Proyección axónica -el nervio se reúne con el músculo -. - Miogénesis -nacimiento de la fibra muscular -. - Sinaptogénesis -el nacimiento de la unión neuromuscular -. - Eliminación sináptica - el toque final -. - Desarrollo de tipos de fibras musculares específicas. - Células satélite: reservas para la reparación en la lesión de las fibras musculares. XIV.- TIPOS DE FIBRAS MUSCULARES............................................................. - Estructura y propiedades de los tipos de fibras musculares. - Fibras de sacudida rápida (Tipo II). - Fibras de sacudida lenta (Tipo I). PROPIEDADES FISIOLOGICAS DE LOS TIPOS DE FIBRAS MUSCULARES ...................................................................................................... - Velocidad máxima de contracción de diferentes tipos de fibras musculares. - Tensión máxima generada por diferentes tipos de fibras musculares. - Tolerancia de diferentes tipos de fibras musculares al ejercicio prolongado. PROPIEDADES MORFOLOGICAS DE DIFERENTES TIPOS DE FIBRAS MUSCULARES ....................................................................................................... - Diferencias en las proteínas contráctiles entre los tipos de fibras. - Diferencias metabólicas entre tipos de fibras. - Diferencias membranales entre tipos de fibras. - Otras diferencias estructurales entre tipos de fibras. TRANSFORMACION DE LAS FIBRAS MUSCULARES EXPERIMENTALMENTE E INDUCIDA POR ENTRENAMIENTO ..................... - Diferencias entre grupos de atletas. - Puede cambiar el tipo de fibra muscular en el humano? - Las adaptaciones metabólicas son reales y significativas. XV.- EVENTOS QUIMICOS Y MECANICOS DURANTE LA CONTRACCION Y RELAJACION MUSCULAR ........................................ PROPIEDADES CONTRACTILES ACTIVAS - Estudios microscópicos indican un mecanismo de filamentos deslizantes. - Mecanismo de los filamentos deslizantes. - El mecanismo deslizante se produce por puentes cruzados. - Los puentes cruzados aislados se pueden hacer trabajar in vitro. - Acción mecánica de los puentes cruzados. - La fuerza contráctil depende del número de interacciones de los puentes cruzados. - Curva tensión isométrica-longitud sarcomérica de fibras aisladas. - Las cabezas de miosina hidrolizan el ATP y se doblan para producir el impulso motor. - Los filamentos de actina contienen dos proteínas reguladoras, la tropomiosina y troponina. - Unión entre actina, miosina y ATP. 74 77 79 81 85 XVI.- ACOPLE EXCITACION-CONTRACCION ..................................................... - El mecanismo de acople excitación-contracción ocurre en dos pasos. - Los túbulos T conducen la señal eléctrica hacia el interior de la fibra. - Los túbulos T conducen los impulsos al interior de la fibra. - Los iones de Ca++ son necesarios para que ocurra la contracción. - El Ca++ es liberado hacia el citosol desde el retículo sarcoplásmico. - En el mecanismo de la liberación de Ca++ intervienen dos tipos de canales de Ca++. - Los canales DHP y rianodina pueden estar conectados mecánicamente. - Las señales químicas entre los canales DHP y rianodina no deben ser excluidas. - Los iones de Ca++ son bombeados desde el citosol hacia el RS. - Relajación. - Secuencia de eventos en la contracción muscular. 95 XVII.- ESTADO ACTIVO.......................................................................................... - La duración del estado activo es más corta que la de la sacudida. - El estado activo puede ser prolongado por estimulación repetitiva. - Efectos de la longitud muscular y carga. - La velocidad y el grado de acortamiento muscular dependen de la carga. - La fuerza muscular está determinada por la velocidad de acortamiento y la carga. 103 XVIII.- PROPIEDADES MECANICAS PASIVAS.................................................... - La molécula de Titina (Conectina) - Un papel fisiológico para la titina en el músculo esquelético. - La titina tiene dos funciones dentro del músculo. - Titinas: proteínas gigantes encargadas de la elasticidad y de la ultraestructura del músculo. - Generación de fuerza pasiva e isoformas de la tinina en músculo esquelético de mamífero. - Composición proteica miofibrilar de fibras desnudas aisladas. - Bases moleculares de las diferencias específicas de isoforma en la elasticidad de la titina. - La titina como resorte molecular. - Implicaciones fisiológicas de la molécula de titina. - Estiramiento de moléculas de titina. 107 XIX.- EQUIVALENTE MECANICO DEL MUSCULO ......................................... 125 - Propiedades mecánicas y contráctiles del músculo entero. - Longitud del sarcómero y propiedades contráctiles. Periodo de latencia Componentes elásticos del músculo esquelético Tensiones en contracción y tétanos INTRODUCCION El cuerpo humano tiene tres tipos funcionalmente diferentes de músculo: músculo esquelético, músculo cardiaco y músculo liso. Los músculos esquelético y cardiaco son estriados, y tienen mecanismos contráctiles semejantes. Todas las funciones físicas del cuerpo entrañan actividad muscular, llevadas a cabo por esos tres tipos musculares, todos con algunas características en común. Por ejemplo, el proceso de contracción prácticamente es el mismo en todos ellos, pero por otra parte, la potencia de la contracción, la Duración de la misma y otras características difieren en gran medida y se encuentran adaptadas especialmente en cada tipo de músculo para la tarea que debe efectuar. El esqueleto es una armazón de huesos que puede acomodarse en muchas formas distintas y los ligamentos limitan de manera específica el ángulo al que puede llegar cada articulación; en general, por lo menos se dispone de dos músculos oponentes entre sí para cada uno de los movimientos que permiten los ligamentos en una articulación. El tamaño y el aspecto de los músculos no son exactamente iguales entre uno y otro, pero todos están compuestos por fibras musculares. En cada extremo del músculo se fusionan las fibras del mismo con fibras tendinosas resistentes que forman el tendón muscular. Los tendones musculares, a su vez, penetran en los huesos y se fusionan con ellos en los lados de las articulaciones respectivas, de modo que cualquier tracción ejercida producirá el movimiento adecuado. En los mamíferos, los músculos comprenden conjuntos de células altamente especializadas que transforman la energía química en mecánica como respuesta como respuesta a acontecimientos excitadores que ocurren en la membrana celular. Esta característica básica determina que los músculos se contraigan generando tensión y produciendo movimiento. El músculo esquelético está inervado por motoneuronas que establecen conexiones con él a través de uniones neuromusculares, lo que permite su control por el sistema nervioso central. La contracción del músculo esquelético es un proceso complejo que se inicia con la producción de un potencial de acción en la motoneurona, que determina la liberación de un neurotransmisor, acetilcolina, en la unión neuromuscular. La acetilcolina, a su vez, provoca un potencial de acción en la fibra muscular que es, en último termino, el determinante de la contracción. El tejido conectivo de un músculo es casi tan importante como las fibras musculares, sin él no se podría organizar la estructura del los músculos y no habría manera de transmitir al tendón la fuerza producida ni sería posible el movimiento. Se ha visto que el tejido conectivo en anatómicas, asociadas con el diferente tamaño y orientación de las fibras de colágena. Por otra parte, una forma simple de fuerza muscular es la tensión "pasiva" que se desarrolla cuando los músculos son estirados. La suma de las tensiones pasiva y activa es la fuerza total desarrollada por un músculo. I.- EL SISTEMA MUSCULAR ESQUELETICO Los músculos, al igual que los movimientos, son marcadamente diversos. I.EL SISTEMA ESQUELETICO. MUSCULAR Tanto para el hombre como para otros animales, el movimiento se requiere para sobrevivir. Cada actividad humana requiere de la contracción muscular, para caminar, correr, aventar, ver, escuchar y aún para mantener la postura. Esta enorme diversidad de la función muscular se refleja en los tamaños y formas de los músculos. El movimiento humano depende de la conversión de la energía química del adenosín trifosfato (ATP) en energía mecánica para la acción del músculo esquelético. Las fuerzas de los músculos actúan sobre sistemas de palanca óseos y ocasionan que uno o más huesos se muevan sobre el eje de unión; esto hace posible que una persona mueva un objeto, su propio cuerpo a ambas cosas simultáneamente. Cada músculo esquelético del cuerpo humano ( 660 músculos aproximadamente) contiene varias cubiertas fibrosas de tejido conectivo (Fig. 1). En un corte transversal de un músculo esquelético (Fig. 2B) se observan miles de células musculares denominadas fibras. Esas largas y delgadas fibras multinucleadas (cuyo número es probablemente determinado en el segundo trimestre del desarrollo fetal) se acomodan paralelamente. La fuerza de la contracción es dirigida a lo largo del eje longitudinal de la fibra. La longitud individual de las fibras varía desde unos pocos milímetros en los músculos extraoculares a más de 100 mm en los músculos largos de la pierna (MeArdle, et al. 1996). Los músculos, al igual que los movimientos, son marcadamente diversos. El tamaño de los músculos. El tensor del tímpano, un pequeño músculo responsable Figura 1.- Miles de miofibrillas se encuentran dentro de la fibra muscular, las cuales están cubiertas y separadas de las fibras adyacentes por una fina capa de tejido conectivo llamada endomisio. Otra capa de tejido conectivo, el perimisio, circunda un paquete de fibras constituyendo un fascículo. El epimisio es una fascia de tejido conectivo que rodea al músculo completo. El epimisio se mezcla y une internamente con las otras cubiertas del tejido muscular, en los extremos del músculo forman el tejido fuerte y denso de los tendones. Los tendones conectan ambos extremos del músculo al periostio. Tomado de: Gartner & Hiatt.: Color Atlas of Histology. Williams & Wilkins; 1994. p. 103. de ajustar la tensión sobre el tímpano, contiene sólo unos pocos cientos de fibras musculares, mientras que el grastrocnemio medial, uno de los principales músculos de la pantorrilla empleado para caminar y correr, tiene aproximadamente un millón de fibras. El número aproximado de fibras de diferentes músculos se presenta en la tabla 1. Los largos tendones de los flexores de los dedos, corren por debajo de bandas fibrosas (retinácula), similares a poleas insertadas en las bases de las falanges. Este arreglo restringe el movimiento de los tendones, traduciéndose en una efectiva flexión de los dedos que sirve para asir (McComas, 1996). Las formas de los músculos. Algunos Músculos son relativamente gruesos -por ejemplo, los músculos vastos de los cuadríceps, o los músculos glúteos, que Extienden la cadera. Otros músculos, sin embargo, forman tiras largas y delgadas tales como el gracilis y el sartorio. Otros músculos, como los flexores y extensores de los dedos, se caracterizan por sus tendones demasiado largos. Esta variación corresponde con la realización de diferentes tareas. Mientras más largo sea un músculo, más Valores promedios. El valor del sartorius tomado de puede acortarse, y más elevada su velocidad de MacCallum (1898); todos los demás tomados de acortamiento; en contraste, mientras más et al. (1955). Citado por McComas (1996). grueso es un músculo, más fuerza (tensión) puede desarrollar. Figura 2A.- Músculo esquelético (800x). Se presenta una micrografía que muestra varias de las características del músculo esquelético en una sección longitudinal. Se observa que las fibras musculares son largas y tienen un diámetro uniforme, sus numerosos núcleos (N) están localizados en la periferia. El espacio entre las fibras musculares está ocupado por el endomisio, con ocasionales células de tejido conectivo (CT). Son evidentes dos tipos de estriaciones, longitudinales y transversas. Las estriaciones longitudinales corresponden a las miofibrillas (M) acomodadas casi en registro, unas con otras. Este arreglo ordenado es el responsable de las bandas claras y oscuras que dan a este tipo de músculo su nombre. Las bandas claras (I) están divididas por una estrecha línea oscura, las líneas Z (Z). Las bandas oscuras (A), también están divididas por la clara zona H (H). El centro de la zona H está ocupada por la región M. La unidad contráctil básica del músculo esquelético es el sarcómero (S) que se extiende entre dos líneas Z contiguas. Las bandas claras y obscuras transversales de las miofibrillas vecinas están alineadas. La alineación de las bandas se conserva entre las fibras musculares adyacentes, dando el aspecto estriado característico del músculo esquelético. Figura 2B.- Músculo esquelético (132x). Se presentan porciones de unos pocos fascículos en sección transversal. Cada fascículo (F) está rodeado por el tejido conectivo del perimisio, que aloja los vasos sanguíneos y nervios que abastecen a los fascículos. Los núcleos (N) de las fibras musculares aparecen en la periferia como puntos negros; sin embargo todos están localizados dentro de las fibras musculares. El área señalada en el cuadro se presenta a mayor ampliación en la figura 2C. Figura 2C.- Músculo esquelético (540x). El corte transversal de varias fibras musculares demuestra su forma poliédrica, tienen núcleos (N) periféricos, el endomisio aloja numerosos capilares (C). El sarcoplasma aparece pálido y regularmente aparece granular, debido a las miofibrillas (M) cortadas transversalmente. Ocasionalmente pueden observarse los núcleos que pertenecen a las células satélite (SC), su identificación definitiva sólo se logra con el microscopio electrónico. El marcado límite entre cada fibra muscular se debe a la presencia de la lámina basal y al endomisio. Tomado de: Gartner & Hiatt.: Color Atlas of Histology. Williams & Wilkins; 1994. p. 105. II.-ESTRUCT URA DEL MUSCULO E SQUELE TICO NIVELES DE ORGANIZACION Composición química del músculo. Aporte sanguíneo. Capilarización del músculo. II.- ESTRUCTURA DEL MUSCULO ESQUELETICO NIVELES DE ORGANIZACIÓN Como se observa en la figura 1, cada fibra muscular está cubierta y separada de las fibras adyacentes por una fina capa de tejido conectivo llamada endomisio. Otra capa de tejido conectivo, el perimisio, circunda un paquete de 20 a 150 fibras constituyendo un fascículo. Rodeando al músculo completo se encuentra una fascia de tejido conectivo conocida como epimisio. Esta vaina protectora se mezcla y une internamente con las cubiertas del tejido muscular, en sus extremos para formar el tejido conectivo fuerte y denso de los tendones. Los tendones conectan ambos extremos del músculo a la cubierta más externa del hueso (el periostio). Los tejidos del tendón están entremezclados con las fibras de colágena del hueso. Esto forma una unión difícil de separar excepto durante el estiramiento severo. Cerca del 70% de la masa seca del tendón está formada por colágena (McArdle, et al. 1996). Cuando el tendón está unido en el extremo de un hueso largo, el hueso se desarrolla adaptándose en ese extremo para producir una unión más estable. Dependiendo del tamaño del hueso, a este ensanchamiento se le denomina como tubérculo, tuberosidad o trocánter. La fuerza de la acción muscular es transmitida directamente desde el tejido conectivo interno del músculo al tendón, entonces este jala a los huesos en sus puntos de unión. La fuerza ejercida en la unión tendinosa bajo varias condiciones de esfuerzo muscular varía entre 20 a 50 newtons por cm2 de área de corte transversal (MeArdle, et al. 1996). El origen del músculo es la región en donde el tendón se une a una parte relativamente estable del esqueleto, generalmente es el extremo proximal del hueso, el extremo fijo del sistema de palancas o lo más cerca de la línea media corporal; el punto de unión distal al hueso que se mueve es la inserción. Debajo del endomisio y rodeando a cada fibra muscular está el sarcolema, que está compuesta de una membrana plasmática (plasmalema) y de la membrana basal. La membrana basal contiene proteínas y fibras colágena que le permiten a la fibra muscular fusionarse con las fibras de colágena contenidas en el tendón. Entre la membrana basal y la membrana plasmática se encuentran las células satélite (Fig. 2C), las cuales cumplen una importante función en la regeneración celular y en su recuperación después del daño. El protoplasma de la fibra o sarcoplasma, contiene enzimas, lípidos y partículas de glucógeno, aloja a los núcleos (aproximadamente 250 por mm de longitud de la fibra), las mitocondrias, y otros organelos especializados. Inmersa en el sarcoplasma está una red extensa de túbulos interconectado y vesículas conocida como retículo sarcoplásmico (Fig. 3) que proporciona a la célula integridad funcional. El sarcolema se introduce mediante túbulos transversales (túbulos T) al eje longitudinal de la fibra, formando otra red interconectada de túbulos relacionada funcionalmente con el retículo sarcoplásmico. A través de esta red de túbulos T la onda depolarizante (potencial de acción) se propaga rápidamente desde la superficie externa de la fibra hacia las partes más internas para iniciar la contracción muscular (McArdle, et al. 1996). Independientemente de su forma y tamaño, todos los músculos están hechos fibras individuales de aproximadamente 50 µm de diámetro. En la infancia, las fibras son más pequeñas. El entrenamiento intenso o las labores físicas en el adulto pueden causar que el diámetro se duplique. Cuando se observan longitudinalmente bajo el microscopio (Fig. 2A), cada fibra presenta una serie de estriaciones alternantes claras y obscuras. Las tiras claras son las bandas I (isotrópicas), y las tiras oscuras, con su elevado índice de valores para algunos de los otros músculos refracción, son las bandas A (Anisotrópicas). (soleo, gastrocnemio medial, tibial posterior). Una línea densa corre por toda la mitad de las bandas I; esta es la línea Z o Discos Z. La parte central de la banda A, la zona H, está Composición química del músculo. dividida por una estructura oscura, la región M. La porción de una fibra comprendida entre Aproximadamente el 75% del músculo dos líneas Z sucesivas es denominada es agua, y el 20% son proteínas. El restante sarcómero y en una fibra relajada tienen una 5% está constituido de sales inorgánicas y longitud de aproximadamente 2.2 µm. En la algunas otras sustancias, incluyendo al fosfato figura 3 se muestran esquemáticamente las de alta energía; urea; ácido láctico; los estriaciones, en la tabla 2 aparece el número minerales calcio, magnesio, y fósforo; varias de sarcómeros, alineados extremo con enzimas; iones de sodio, potasio, y cloruro; extremo, en fibras aisladas de varios músculos aminoácidos; lípidos; y carbohidratos. Las de humano; se notan los elevados valores en más abundante de las proteínas musculares los músculos delgados del muslo (sartorio, son la miosina (aproximadamente el 60% de gracilis, semitendinoso) y los muy bajos la proteína muscular), la actina, y la tropomiosina. También, cerca de 700 mg de mioglobina (proteína conjugada) están incorporados dentro de cada 100 g de tejido muscular (McArdle, et al. 1996). Aporte sanguíneo. En actividades rítmicas tales como correr, nadar, o el ciclismo, el flujo sanguíneo fluctúa; disminuyendo durante la fase de contracción muscular y aumentando durante la fase de relajación. Esto proporciona una acción de bombeo que facilita el flujo sanguíneo hacia los músculos y ayuda a la vez, a impulsar la sangre de regreso al corazón. Este flujo pulsátil es complementado por la rápida dilatación de los capilares que habían permanecido inactivos. Entre 200 y 500 capilares pueden estar aportando sangre para cada mm' de sección transversal del músculo activo, con aproximadamente cuatro capilares en contacto directo con cada fibra (McArdle, et al. 1996). Las actividades con esfuerzo muscular presentan un aspecto diferente en cuanto al flujo sanguíneo muscular. Cuando un músculo genera aproximadamente el 60% de su capacidad de fuerza, el flujo sanguíneo local se ocluye debido a la elevada presión intramuscular. Cuando esto ocurre, la energía para continuar el esfuerzo hasta la producción de fuerza cercana al máximo es generada por el fosfato de alta energía contenido dentro del músculo generadas a través de las reacciones anaeróbicas de la glucólisis. Capilarización del músculo. Un factor que con frecuencia es propuesto para mejorar la capacidad de ejercicio en el entrenamiento de resistencia, es el incremento en la densidad capilar de los músculos entrenados. Aparte de su papel en la capacidad de liberar oxígeno, nutrientes, y hormonas, la microcirculación capilar también proporciona el medio para retirar desde los tejidos activos, el calor y los subproductos metabólicos. Esas funciones se optimizan con una mayor densidad capilar (McArdle, et al. 1996). "a" Se refiere a los miembros individuales analizados. Para los valores de los tres músculos del muslo en la parte baja de la tabla no se tomaron en cuenta las bandas fibrosas transversales del vientre muscular (porción carnosa más prominente del músculo), y los tres valores podrían ser más bajos que los establecidos. Nota. Datos obtenidos de "Muscle Architecture of de Human Lower Limb" por T.L. Wickiewicz, R.R. Roy, P.L. Powell y V.R. Edgerton, 1983, Clinical Orthopaedics and Related Research, 179, p.277. Citado por McComas, 1996. III.- ULTRAESTRUCTURA DEL MUSCULO ESQUELETICO. La fibra muscular: Plasmalema. Diferentes tipos de proteínas están incrustadas en el plasmalema. 1111.ULTRAESTRUCTURA MUSCULO ESQUELETICO. DEL La anatomía microscópica o ultraestructura del músculo esquelético ha sido revelada con la ayuda del microscopio electrónico, la cristalografía de rayos X, la tinción histoquímica y por técnicas de difracción con láser de helio-neón. Cada fibra está compuesta de pequeñas unidades funcionales que se encuentran paralelas al eje longitudinal de la fibra, estas son las fibrillas o miofibrillas, que tienen aproximadamente 1 µm de diámetro y están compuestas de unidades aún más pequeñas ( los filamentos p miofilamentos) que se encuentran paralelos al eje de la miofibrilla. Los miofilamentos están formados por varias proteínas; la actina y la miosina constituyen cerca del 85% del complejo miofibrilar. Se han identificado otras proteínas que tienen una función estructural o que pueden afectar la interacción de los filamentos de proteína durante la acción del músculo (fig. 4). Los porcentajes reportados por diferentes autores difieren para cada proteína dependiendo de la técnica utilizada para su aislamiento. Ellas son (a) tropomiosina, localizada a lo largo de los filamentos de actina (5%); (b) troponina, localizada en los filamentos de actina (3%); (c) a-actinina, distribuida en la región de la banda Z (7%); (d) -actinina, encontrada en los filamentos de actina (1%); (e) proteína M, identificada en la región de las líneas M dentro del sarcómero (menos del 1%); (f) proteína C (menos del 1%), la cual se cree que contribuye a la integridad estructural del sarcómero (McArdle, et al. 1996); (g) nebulina, localizada en los filamentos de actina, regula el tamaño del filamento delgado (5%); (h) titina, regula el tamaño del filamento grueso y se extiende desde la línea M a los discos Z (10%) (Robson, 1983). En la tabla 3 aparecen las principales proteínas miofibrilares y la función que desempeñan en el sarcómero. La fibra muscular. Todas las partes de la fibra muscular están relacionadas de algún modo con la producción de movimiento o fuerza, pero es la miofibrilla quien finalmente produce esos efectos, y en conjunto son las miofibrillas las que constituyen la mayoría de la fibra. La operación de las miofibrillas depende de las propiedades químicas y eléctricas de los sistemas tubulares que las circundan y de la disponibilidad del compuesto liberador de energía, el ATP. Las mitocondrias del interior de la fibra son la principal fuente de ATP. El núcleo de las fibras musculares, proporciona las instrucciones para sintetizar las diferentes proteínas de la fibra contenidas en las miofibrillas, sistema tubular y organelos. Plasmalema. El contenido de todas las células vivas esta rodeado por una membrana plasmática, el plasmalema, con un grosor de algunos 7.5 nm; el contenido por sí mismo comprende una solución acuosa de iones inorgánicos, azúcares, aminoácidos, péptidos y proteínas todo lo cual es denominado el citosol. El citosol, los filamentos y organelos dentro de él constituyen el citoplasma; en el caso de las fibras musculares esqueléticas, al citoplasma se le refiere como sarcoplasma. La principal función del plasmalema es permitir al citosol tener una composición química marcadamente diferente a la de los fluidos que rodean a la célula. El plasmalema ejecuta esta última función a través de poblaciones de canales proteicos y bombas, los cuales están incrustadas en las dos capas lipídicas de la membrana (Fig. 5). En los nervios y fibras musculares, tan diferentes de la mayoría de las otras células, el plasmalema tiene la propiedad adicional de la excitabilidad, permitiendo que los impulsos eléctricos sean transmitidos a todo lo largo de la célula. El sarcolema no es una estructura lisa en toda la longitud de la fibra muscular. Más bien, en la región de la zona de inervación (placa motora terminal) presenta plegamientos. En otras partes a lo largo de la superficie de la fibra, la membrana presenta muchos pliegues poco profundos cuando la fibra está en los estados de reposo o de contracción, y desaparecen si la fibra es pasivamente estirada. Existen también numerosas pequeñas invaginaciones de membrana, las caveolae, los cuales están conectados con la superficie de la membrana por cuellos estrechos; su función es incierta, aunque pueden actuar como fuentes de reserva de membrana durante el estiramiento de la fibra. Investigaciones bioquímicas y ultraestructurales indican que el plasmalema está en su mayoría compuesto de moléculas de lípidos en arreglo perpendicular a la superficie de la fibra y formando dos capas. Las cabezas hidrofílicas de las moléculas lipídicas forman las superficies interna y externa de la membrana, mientras que las colas hidrofóbicas constituyen el interior de la membrana. Las cabezas están compuestas de colina, fosfato y glicerol; las colas consisten de cadenas de ácidos grasos, y están dos de éstos asociados con cada cabeza. El plasmalema también contiene relativamente grandes cantidades de colesterol, tales moléculas están interpuestas entre los fosfolípidos y sirven para endurecer la membrana. Puesto que gran parte de la membrana lipídica tiene un punto de fusión por debajo de la temperatura corporal, se podría esperar que el plasmalema tuviera propiedades de fluido. Marcando un punto de Tabla 3.- Principales proteínas miofibrilares y su localización en el sarcómero, peso molecular, porcentaje y la función que desempeñan. Estas proteínas tienen una función estructural o afectan la interacción de los filamentos de proteína durante la acción muscular. Los porcentajes reportados por diferentes autores difieren para cada proteína dependiendo de la técnica utilizada para su aislamiento. PROTEINAS MIOFIBRILARES ESTRUCTURA Filamento Delgado PROTEINA PM (KDa) CONTENIDO FUNCION Actina Tropomiosina 42 70 20 5 Interacciona con la miosina durante la contracción activa. Traduce los cambios conformacionales del complejo Complejo de Troponina 69 3 troponina a la actina. Une Ca 2+ y es el interruptor que transforma las Nebulina 500 5 señales de Ca 2+ a señales moleculares que provocan y gradúan la contracción muscular. Regula el tamaño del filamento delgado y controla la Miosina 520 45 unión de un número definido de monómeros de actina en cada filamento. Junto con la actina, realiza la traducción quimiomecánica, hidrolizando el ATP para efectuar el Proteína C 150 <1 proceso mecánico. Une tanto a la miosina como a la proteína H del Miomesina (Proteína M) 165 <1 filamento grueso adyacente. Ayuda a mantener el arreglo de los filamentos gruesos. a - actinina Desmina 180 55 Filamento Grueso Disco Z Filamento Conector Titina 3 000 7 <1 10 Proporciona el punto de anclaje para la titina en la zona H. Mantiene la distancia interdigitando los filamentos gruesos, delgados y conectores. Conecta los discos Z adyacentes de diferentes miofibrillas y ayuda a mantener los espacios intersacoméricos. Regula el tamaño del filamento grueso, mantiene centrado al filamento grueso tanto en el reposo como membrana con un colorante fluorescente y observando su expansión bajo el microscopio, Fambrough, Hartzell, Rash y Ritchie (1974) fueron capaces de mostrar que esta situación es verdadera. La fluidez es debido a que las moléculas de lípidos son capaces de intercambiar lugares una con otra dentro de las capas de la membrana. Diferentes tipos de proteínas incrustadas en el plasmalema. están La membrana también contiene proteínas, las cuales están reconocidas generalmente dentro de dos tipos; intrínsecas y extrínsecas. Las proteínas extrínsecas (periféricas) están solamente unidas en la superficie interna o externa de la membrana y pueden fácilmente desprenderse por medios químicos. En contraste, las proteínas intrínsecas (transmembranales) penetran totalmente el grosor de la membrana y son difíciles de remover. Muchas de las proteínas están glucosiladas, esto es, tienen residuos de azúcar que se pueden extender hasta la lámina lucida de la membrana basal. Los residuos terminales libres de azúcar pueden atrapar moléculas del líquido extracelular y directamente por las proteínas de la membrana. Entre las proteínas especiales conocidas que se localizan en el plasmalema están las siguientes: a) Sistemas de transporte para iones, azúcares, lípidos y aminoácidos. Las proteínas de transporte caen dentro de varias clases. Uniportadoras, que acarrean solamente un soluto a través de la membrana. Simportadoras funcionan moviendo dos solutos en la misma dirección, por ejemplo moléculas de azúcar y H + . Antiportadoras que actúan transfiriendo dos solutos en direcciones opuestas; el mejor ejemplo conocido es la bomba Na + -K, la cual extrae Na+ desde la célula en intercambio por K+. Otras proteínas de transporte son las que forman los canales fónicos, los cuales permiten a un ion específico atravesar la membrana siguiendo su gradiente electroquímico, una vez que ese canal ha sido abierto por un cambio de voltaje a través de la membrana. El receptor de acetilcolina es un tipo diferente de canal iónico (activado por ligando), en el cual su apertura es llevada a cabo por la combinación con la acetilcolina. b) Adenilato ciclasa, es la responsable de la síntesis de un segundo mensajero, el AMP cíclico. Una proteína (proteína G) ligante de GTP sobre la superficie citoplásmica del plasmalema esta relacionada en la activación de la adenilatociclasa. c) Cinasas para la fosforilación de varias proteínas de la membrana. d) Receptores de hormonas. La habilidad de las fibras musculares para responder a una variedad de hormonas tales como la insulina, epinefrina y hormonas esteroides, depende de la presencia en el plasmalema de receptores específicos para cada hormona. e) Integrinas. Esas proteínas unen al endomisio y membrana basal con el plasmalema y estructuras del citoesqueleto. Dos de las integrinas son el receptor de la fibronectina y las glucoproteínas asociadas con distrofina. En comparación con las moléculas de lípidos, la habilidad de las proteínas para moverse dentro de la membrana está restringida, porque están ancladas en los filamentos intracelulares o extracelulares por medio de proteínas fijadoras tales como la ankirina y la desmina (McComas, 1996). IV.-ORGANIZACION INTRACELULAR. Miofibrillas. El Sarcómero. Los filamentos de actina y miosina corresponden a las bandas claras y oscuras. Sistemas tubulares. El retículo sarcoplásmico (RS) circunda las miofibrillas. El sistema de túbulos transversos conecta la superficie de la fibra con el interior celular. Núcleo y mitocondrias. Las mitocondrias proporcionan el ATP a la fibra muscular. IV.-ORGANIZACION INTRACELULAR. Miofibrillas. El Sarcómero. En la figura 6 se resumen todos los elementos que forman una fibra muscular. Se puede apreciar que las estructuras más obvias dentro de la fibra muscular son las miofibrillas, que son las unidades responsables de la contracción y relajación de las fibras. Cada miofibrilla tiene de 1 a 2 µm de diámetro y está separada de sus vecinas por las mitocondrias y por los sistemas tubulares (sarcoplásmico y de túbulos transversos); en una fibra de 50 µm de diámetro existen arriba de 8 000 miofibrillas. Las miofibrillas contienen dos tipos de filamentos proteicos, los de actina y miosina, y que es la disposición regular de esos filamentos a lo largo de la miofibrilla lo que le da su apariencia en bandas bajo el microscopio. Los dos tipos de filamentos se soportan uno al otro por medio de los puentes cruzados y están a la vez soportados por otras estructuras especializadas. Finalmente los filamentos, a través de estructuras de soporte, están conectados con el tejido conectivo del endomisio y de allí al tendón del músculo (McComas, 1996). A menor amplificación, las bandas alternantes claras y obscuras a lo largo del su longitud le dan una apariencia estriada característica a la fibra muscular. El área clara se denomina como banda I, y la zona oscura se le da el nombre de banda A. La línea Z divide la banda I y se adhiere al sarcolema para dar estabilidad a toda la estructura. La unidad que se repite entre dos líneas Z es llamada sarcómero (Recuadro). Esta entidad estructural es la unidad funcional de la fibra muscular. Los filamentos de actina y miosina dentro del sarcómero son los primeros implicados en el proceso mecánico de la contracción muscular. Los sarcómeros, adyacentes uno de otro están alineados en serie; los miofilamentos están alineados en una configuración en paralelo dentro de una fibra dada. En el estado de reposo, la longitud de cada sarcómero es de aproximadamente 2.5 µm. Así, para una miofibrilla con una longitud de 15 mm, pueden existir cerca de 6000 sarcómeros unidos extremo con extremo (McArdle, et al. 1996). Figura 6.- Las estriaciones del músculo esquelético se deben a las bandas A y a las bandas I. Las bandas I están divididas en dos mitades iguales por la línea Z, y cada banda A tiene una zona clara, la zona H. El centro de cada zona H es la oscura región M. Las miofibrillas adyacentes se mantienen una junto a la otra por los filamentos intermedios de desmina y vimentina. La unidad contráctil básica de la fibra muscular esquelética es el sarcómero, que contiene un conjunto altamente ordenado de miofilamentos (gruesos y delgados). Las invaginaciones tubulares, (túbulos T) de la membrana de la fibra muscular penetran profundamente dentro del sarcoplasma y rodean a las miofibrillas a nivel de la unión de la banda A con la banda I, esos túbulos se asocian con las cisternas terminales dilatadas del retículo sarcoplásmico, formando triadas. En el recuadro aparece un sarcómero que muestra el arreglo de los miofilamentos gruesos y delgados. En la parte inferior (izquierda) se observa el detalle de la composición de los filamentos, a la derecha se presenta en un corte transversal la distribución de los miofilamentos en diferentes niveles sarcoméricos. Tomado de: Gartner & Hiatt.: Color Atlas of Histology. Williams & Wilkins; 1994. p. 102. Los filamentos de actina y miosina corresponden a las bandas claras y oscuras. En los sarcómeros de una fibra muscular en reposo, los filamentos delgados de actina y los gruesos de miosina presentan un traslape interdigitado. Miles de filamentos de miosina se encuentran junto con los filamentos de actina en una fibra muscular. Un filamento grueso de miosina (150 Å de diámetro y 1.5 µm de largo) está rodeado por seis filamentos delgados, cada uno de 50 Å de diámetro y 1 µm de longitud (Fig. 7). Esta subestructura del músculo es impresionante. Por ejemplo, una miofibrilla de 1 µm de diámetro contiene aproximadamente 450 filamentos gruesos en el centro del sarcómero y 900 filamentos delgados en los extremos del mismo. Una sola fibra muscular de 100 µm de diámetro y 1 cm de longitud contiene aproximadamente 8 000 miofibrillas; cada miofibrilla consiste de 4500 sarcómeros. Esto da un resultado total de 16 billones de filamentos gruesos y 64 billones de filamentos delgados en una sola fibra (McArdle, et al. 1996). En la parte central de la banda A se localiza la banda H, una región de baja densidad óptica causada por la ausencia de filamentos de actina en esta área. En la mitad de la zona H, existe una región oscura, la "línea M", la cual marca el centro del sarcómero (Recuadro de la Fig. 6). La región M está formada por estructuras proteicas filamentosas que conectan de forma cruzada a los filamentos de miosina, manteniendo su arreglo y dando un espaciamiento regular entre ellos. Las bandas son nombradas por sus propiedades ópticas. Cuando la luz polarizada pasa a través de las bandas I, su velocidad es la misma en todas las direcciones (isotrópica). Cuando la luz pasa a través de las bandas A no se dispersa uniformemente (anisotrópica). La letra Z proviene del vocablo Alemán "zwischenscheibe", que significa "en medio de"; la letra M ("mittelscheibe") significa mitad; y la letra H ("hellerscheibe") significa zona clara (McArdle, et al. 1996). Existe otro arreglo de filamentos finos compuestos de titina, que estabilizan a los filamentos de miosina en el eje longitudinal. Durante la contracción, los filamentos de miosina contactan con los filamentos de actina por puentes cruzados moleculares e intentan deslizar los filamentos opuestos de actina uno hacia otro, disminuyendo el ancho de la zona H y de las bandas I. Los filamentos de actina contienen además de la actina, dos proteínas reguladoras, la troponina y la tropomiosina, y también una proteína de soporte, la nebulina (McComas, 1996). Sistemas tubulares. A principios del presente siglo, Veratti (1902) fue capaz de teñir una red fina entretejida dentro de la fibra muscular. Fue sólo algunos años después, con la ayuda del microscopio electrónico, que los detalles de esta estructura pudo determinarse como un sistema tubular comprendiendo dos partes, el retículo sarcoplásmico y el sistema tubular transverso (túbulos T). El retículo miofibrillas. sarcoplásmico (RS) circunda las Un elaborado y extenso sistema de canales tubulares interconectantes, el retículo sarcoplásmico (RS), se localiza paralelamente a las miofibrillas y corre a lo largo de las fibras musculares y circunda ampliamente a las miofibrillas individuales. Por medio de brazos laterales, los canales longitudinales envuelven a una miofibrilla y la conectan una con otra, luego, rodean otras miofibrillas. El extremo lateral de cada túbulo termina en una vesícula en forma de saco que almacena Ca++. Cuando la fibra muscular se contrae, los canales longitudinales se acortan y se hacen más anchos. La función del retículo sarcoplásmico es liberar Ca++ dentro del citosol alrededor de las miofibrillas, donde se combina con la troponina C y permite que ocurra la contracción. Cuando el Ca++ es bombeado de regreso al interior de RS, la contracción termina. Para mantener su papel en la "activación" de la fibra, la membrana del RS contiene canales liberadores de calcio (receptores de rianodina) y bombas ATPasa para calcio que recapturan el Ca++ liberado (McComas, 1996). El sistema de túbulos transversos conecta la superficie de la fibra con el interior celular. Otra red de túbulos, conocida como sistema de túbulos transversos o sistema de túbulos T, se localiza perpendicularmente al eje longitudinal de la fibra muscular en forma de canales estrechos que rodean a las miofibrillas a intervalos regulares. En las fibras musculares de mamífero, incluyendo las de humano, por cada sarcómero existen dos zonas de túbulos transversos; que se localizan en las uniones de las bandas A con las bandas I. En fibras de músculo cardiaco y en las fibras de rana, existe sólo un sistema de túbulos T por cada sarcómero, situándose en la línea Z. Los túbulos T rodean las miofibrillas, por lo tanto, interrumpen los canales longitudinales del retículo sarcoplásmico. En esos puntos de contacto, el RS se dilata para formar las cisternas terminales (o sacos laterales); los sacos vecinos están conectados entre sí. Cada uno de los estrechos túbulos T está limitado por ambos lados por una cisterna; a estos tres elementos que rodean la miofibrilla, en un patrón repetido de dos vesículas y túbulos T se les conoce como triada. Existen dos triadas en cada sarcómero, y el patrón se repite regularmente a todo lo largo de la miofibrilla. La microscopía electrónica reveló que las membranas de los túbulos T y del retículo sarcoplásmico de la triada permanecen integras, aún cuando se localizan muy cercanas unas de otras. De acuerdo con Peachey (1965), aproximadamente el 80% del sistema de túbulos transversos en una fibra muscular de rana está rodeado por el retículo sarcoplásmico. En la superficie de la fibra muscular, los túbulos T forman pequeñas aberturas. Examinando fibras musculares bañadas en soluciones que contiene material electrodenso o colorantes fluorescentes, se ha observado que los túbulos T contienen fluido extracelular. La triada y el sistema de túbulos T funcionan como una red de microtransportación para propagar el potencial de acción desde la membrana externa de la fibra hacia las regiones internas más profundas de la célula. Durante este proceso los iones Ca ++ son liberados desde el retículo sarcoplásmico y difunden una corta distancia, para "activar" los filamentos de actina. La contracción muscular se inicia cuando los puentes cruzados de los filamentos de miosina son atraídos a los sitios activos de los filamentos de actina. Cuando la excitación eléctrica cesa, los iones de Ca++ son recapturados por el retículo sarcoplásmico; lo cual está asociado con la relajación del músculo (MeArdle, et al. 1996; McComas, 1996). Núcleo y mitocondrias. La fibra muscular contiene numeroso núcleos (mionúcleos) los cuales están dispersos a lo largo de la superficie interna del sarcolema, particularmente en la región de la placa motora; cada núcleo esta limitado por dos membranas. La función del núcleo es preparar y mandar las instrucciones para la síntesis de proteínas en el citoplasma. Las instrucciones están dadas por los genes contenidos en los cromosomas. En el humano existen 23 pares de cromosomas, y se piensa que en conjunto pueden contener 100 000 o más genes. Cuando el DNA de un gen se expresa, el mensaje se transcribe primero en el RNA. Dentro de una parte especial del núcleo denominado nucleólo, el RNA mensajero es empacado con proteínas para formar ribosomas; estos se hacen más pequeños y se exportan por medio de poros localizados en la membrana nuclear hacia el citosol de la fibra muscular. Los ribosomas, ayudados por el RNA de transferencia, inician el ensamble de la secuencia de aminoácidos característica de una proteína particular; para cada uno de los aminoácidos hay un código genético en la forma de un triplete de nucleótidos o codón. En el citoplasma, particularmente durante el desarrollo o regeneración de las fibras musculares, los ribosomas están unidos al retículo endoplásmico, constituido por vainas de membrana que encierran amplias cavidades. Con el microscopio de luz, los mionúcleos no se distinguen de los núcleos de las células satélite. Los últimas, probablemente constituyen menos del 1% de los núcleos de las fibras musculares en el adulto. Los núcleos de estas células sólo pueden ser diferenciados de los mionúcleos por el microscopio electrónico, el cual revela la presencia de dobles membranas que separan el citoplasma de las células satélite del citoplasma de las fibras musculares. Las células satélite son de particular importancia para la regeneración del músculo seguida de enfermedad o lesión (McComas, 1996). Las mitocondrias proporcionan el ATP a la fibra muscular. Las mitocondrias (sarcosomas) son estructuras ovoides que miden desde 1 a 2 µm en sus diámetros más grandes. Cada mitocondria tiene una doble membrana, de las cuales las más interna está repetidamente plegada formando crestas; esos pliegues abultan dentro del compartimiento central de la mitocondria. La matriz entre las crestas contiene los sistemas enzimáticos necesarios para el ciclo de ácidos tricarboxílicos de Krebs, el cual desdobla el piruvato hasta bióxido de carbono y agua. Una gran cantidad de la energía liberada por la reacciones sucesivas es capturada por una cadena de citocromos, los cuales permiten que se forme el ATP. Existe ahora evidencia de que la cadena de citocromos está localizada sobre la membrana interna de las crestas, junto con la enzima formadora de ATP (ATPsintetasa). La matriz también contiene varias copias del propio DNA mitocondrial. La membrana externa de las crestas contiene las enzimas necesarias para la síntesis de lípidos. Las mitocondrias se localizan entre las miofibrillas, especialmente en la región de la línea Z y también están en relación con el núcleo y la placa neuromotriz. Aunque las mitocondrias aparecen ovales en las secciones longitudinales de fibras musculares, algunas no son ovoides sino mucho más complejas, formas extremadamente raras pueden presentarse en estados de enfermedad (McComas, 1996). Aunque la mayoría de las enzimas celulares relacionadas con la síntesis de ATP están contenidas en las mitocondrias, otras permanecen libres en el citosol. Además, el citoplasma contiene dos de los combustibles químicos que la mitocondria puede degradar para producir ATP; ellos son los gránulos de glucógeno y las gotitas de lípidos. Antes de terminar la descripción de los componentes citoplásmicos, se debe hacer mención de los gránulos de glucógeno. Los gránulos, de alguno 25 a 40 nm de diámetro, están distribuidos por todo el citosol y constituyen la principal fuente de energía de la fibra muscular. Las gotitas de lípidos se encuentran a menudo cerca de las mitocondrias y contienen ácidos grasos y triglicéridos, forman una importante fuente complementaria de energía. V.- PROTEINAS ESTRUCTURALES DEL MUSCULO. PROTEINAS DEL SARCOMERO. PROTEINAS DEL FILAMENTO GRUESO. Los filamentos de miosina Cadenas pesadas de la miosina. Los puentes cruzados son las cabezas globulares de las moléculas de miosina. Las cadenas ligeras de miosina regulan las cabezas de miosina. Otras proteínas del filamento grueso. Los filamentos de miosina se mantienen juntos en la región M. La titina también ayuda a estabilizar los filamentos de miosina. PROTEINAS DEL FILAMENTO DELGADO. Los filamentos de actina. Los filamentos de actina tienen polaridad. Los filamentos de actina están asociados con dos proteínas accesorias reguladoras, la tropomiosina y la troponina. V.- PROTEINAS ESTRUCTURALES DEL MUSCULO. Las proteínas de la fibra del músculo estriado pueden subdividirse en las que se asocian con la miofibrillas, que comprenden alrededor del 60% del total, las de los organelos como las mitocondrias y el RS, y las enzimas y proteínas solubles del citosol asociadas con la actividad metabólica general (Smith y Wood, 1997). Las proteínas miofibrilares son principalmente las que constituyen los filamentos gruesos y delgados, y participan directamente en la actividad contráctil. Recientemente se han descubierto varias proteínas accesorias y citoesqueléticas, y la identificación de su localización y función precisa es una emocionante área de la investigación sobre el músculo. PROTEINAS PROTEINAS GRUESO. DEL DEL SARCOMERO. FILAMENTO Los filamentos de Miosina. Los filamentos gruesos contienen principalmente miosina. Las miosinas del músculo estriado y cardiaco se disuelven fácilmente a una fuerza iónica de -3 aproximadamente 0.5 mol dm , especialmente en la presencia de ATP. Esto permite su fácil extracción de los tejidos. Si se disminuye la fuerza fónica a 0.1 mol dm 3 se consigue la reasociación de la proteína para formar agregados que se asemejan a los filamentos nativos. Los ciclos repetidos de solubilización y precipitación producen preparaciones bastante puras de miosina (Bagshaw, 1982). Las moléculas de miosina completas, aparecen como estructuras de algunos 150 nm de largo, cada una consiste de dos cabezas globulares y una sola cola (Fig. 8). Las cabezas pueden separarse de la cola por la enzima proteolítica papaína (Fig. 9A). La cola relativamente larga está formada por dos hélices a que se enrollan una alrededor de la otra, así que varios cientos de moléculas pueden formar un sólo filamento de miosina, como se ve en la figura 9B. Esta agregación ocurre espontáneamente y puede ser demostrada a partir de soluciones de miosina precipitadas (McComas, 1996). La unión de las hélices a gemelas de la varilla de miosina están estabilizadas por interacciones hidrofóbicas y zonas cargadas en la superficie de la varilla (Squire, 1981; Pollack, 1990). En el músculo estriado, cada filamento grueso está formado por unos 300 monómeros de miosina, resultando una estructura de 15 nm de diámetro y 1 500 nm de longitud. Como cada monómero de miosina tiene 150 nm de largo y 2 nm de grueso, el empaquetamiento de 300 monómeros es muy denso. Actualmente se ha propuesto que tres subfilamentos de miosina se enredan uno alrededor del otro de manera que las cabezas apuntan hacia el exterior del filamento, formando un patrón regular repetido, como se observa en la figura 9C (Squire, 1981; Pollack, 1990). El filamento consta de dos mitades, con las moléculas de miosina dispuestas en direcciones o polaridades opuestas en cada mitad. Esto crea una zona central que no tiene puentes cruzados. Las moléculas de miosina se asocian en forma antiparalela (cola con cola) en la zona central, pero en un sentido paralelo (cabeza con cola) en el resto del filamento (Fig. 9B). La evidencia de los estudios de difracción de rayos X ha establecido que las miosinas individuales se unen escalonadamente, cada 14.3 nm (alrededor del 10% de su longitud) a las moléculas adyacentes, y esto produce el ordenamiento helicoidal de los puentes cruzados alrededor de la superficie del filamento. A lo largo de un "borde" del filamento, los puentes cruzados se repiten cada 43 nm (Fig. 9C). Las cabezas de la miosina que forman los puentes cruzados tienen 20 nm de largo, longitud suficiente para cubrir la distancia hasta el filamento delgado. El ensamblaje de los filamentos depende del pH y la fuerza iónica. Las fuerzas que intervienen en la unión de los monómeros de miosina gradualmente se debilitan hacia el final del proceso de ensamblaje, lo cual lleva a la formación de los extremos afilados. El número de miosinas en un filamento es notablemente constante (Squire, 1981). La organización de varios tipos de monómeros de miosina para formar filamentos es un interesante problema estructural. Además de sus papeles estructural y contráctil, la miosina es también una enzima que cataliza la hidrólisis del ATP, aunque con una eficiencia bastante baja in vitro. Estos dos aspectos de la molécula de miosina, su capacidad para autoasociarse y su actividad enzimática, reflejan la presencia de dos distintos dominios en las proteínas. La autoasociación implica interacciones entre las largas colas helicoidales (o varillas), mientras que la actividad ATPasa reside en las cabezas globulares (Smith y Wood, 1997). Todos los tipos de miosina que se han estudiado tienen una masa molecular relativa (M,) de alrededor de 520 000 y están compuestos por seis subunidades. Hay dos cadenas pesadas (cada una con una Mr de 220 000) y cuatro cadenas ligeras, con Mr que van de 17 000 a 25 000, dependiendo del tipo de miosina. Dos cadenas ligeras diferentes se encuentran asociadas con la región aminoterminal de cada cadena pesada, para formar una cabeza de la molécula bicéfala de miosina (Bagshaw, 1982). Cadenas pesadas de la miosina. Moviéndose hacia "arriba" de la cadena pesada, y alejándose del extremo carboxilo, las estrictas reglas de periodicidad comienzan a relajarse aproximadamente a una tercera parte de la distancia, de modo que hay un punto débil en el superenrollamiento, formándose una región de bisagra que permite que se doble la rígida estructura semejante a una varilla. Moviéndose aún más adelante, desaparecen primero el superhelicoide y luego las hélices a, ya que las cadenas pesadas se asocian estrechamente con las cadenas ligeras de la región de la cabeza (Fig. 10). Los datos relativamente nuevos sobre la estructura primaria de la cadena pesada explican a los estudios anteriores, que utilizaban enzimas proteolíticas para "disecar" la molécula de miosina. El corte de ambas cadenas en la región más débil y relativamente más abierta de la bisagra, mediante el uso de tripsina o quimotripsina, genera meromiosina ligera (LMM), que es insoluble a baja fuerza fónica, y meromiosina pesada (HMM) bicéfala que mantiene la actividad ATPasa. Otra posibilidad es que la papaína corte en la región del cuello para formar una varilla de miosina y el subfragmento-1 (S-1), con una sola cabeza. Estos procedimientos han demostrado que las regiones superhelicoidales confieren insolubilidad a la molécula de miosina, y por tanto, participan en la autoasociación. La disección proteolítica todavía es valiosa para investigar la molécula de miosina. Cerca del extremo carboxilo de la cadena pesada, por ejemplo, el corte de un segmento peptídico (Mr 5 000) destruye la naturaleza autoasociativa de la LMM. Es interesante especular que esta "cola", posiblemente la última parte de la cadena pesada que se fabrica durante la traducción, regula la formación del filamento de la miosina in vivo (Smith y Wood, 1997). El polipéptido de la cadena pesada que une a la LMM y a las cabezas de la miosina se denomina subfragmento-2 (S-2). Así, la varilla de miosina contiene tanto los dominios de LMM como de S-2. El dominio S-2 es menos rígido que la LMM, y algunos estudios han sugerido que sufre una transición hélicesuperhélice como parte del proceso de contracción (Smith y Wood, 1997). Los puentes cruzados son las cabezas globulares de las moléculas de miosina. A las dos cabezas globulares de cada molécula de miosina se les conoce comúnmente como los fragmentos SI. Cada cabeza consiste de un cadena pesada de cerca de 2 000 aminoácidos y tiene dos cadenas ligeras unidas a ella. Las cabezas globulares, y los cuellos a los cuales están unidos, forman los puentes cruzados. Estudios bioquímicos han identificado tres dominios de las cabezas globulares con pesos moleculares de 50 kD, 25 kD y 20 kD respectivamente (Fig. 10). Las dos cadenas ligeras están unidas a la porción de 20 kD, mientras que el segmento 50 kD contiene un bolsillo para unir e hidrolizar el ATP, así como los sitios para unirse a la actina (Vibert y Cohen, 1988). Un avance reciente, por Rayment el al. (1993), ha sido el uso del análisis computarizado de imágenes para estudiar los resultados de la cristalografia de rayos X y la microscopía electrónica de la miosina. El principal descubrimiento fue una hendidura en el segmento 50 kD, dividiendo esta última región en los dominios superior e inferior. El ancho de la hendidura es controlado por las interacciones del ATP con el bolsillo; la apertura de la hendidura debilita la unión del segmento 50 kD con la actina, mientras el cierre de la hendidura hace más fuerte la unión. El bolsillo para el ATP también puede abrirse, inclinando las cabezas de miosina y por lo tanto alterando el ángulo del puente cruzado. (Se discutirá posteriormente). Las cadenas ligeras de miosina regulan las cabezas de miosina. Como se señaló anteriormente, cada cabeza de miosina contiene dos cadenas ligeras y cada una tiene un peso molecular de aproximadamente 20 kD. Las dos cadenas ligeras parecen estar unidas a la región del cuello de la cabeza de miosina y son denominadas reguladora y esencial. Se piensa que en algún modo las cadenas ligeras afectan las acciones de las cabezas de miosina, posiblemente modificando la velocidad del movimiento en cada impulso motor (Lowey, Waller y Trybus, 1993). La fosforilación de las cadenas ligeras ha sido propuesta como el mecanismo responsable para la potenciación isométrica de la tensión de sacudida (Moore y Stull, 1984). Otras proteínas del filamento grueso. En cada medio filamento se localizan siete bandas de proteína C, que tiene una Mr 150 000, las cuales pueden visualizarse mediante técnicas inmunoquímicas. La proteína C tiene forma de V, y se estima que hay tres moléculas por cada complejo. Se ha propuesto que las tres V forman un anillo, rodeando al filamento grueso y actúan como una pinza molecular. Otra posibilidad es que, como los brazos de la V son de igual longitud (20 nm), podrían proyectarse desde el filamento grueso hacia el delgado, en forma similar a la de los puentes cruzados. Pueden detectarse otras proteínas como estrías definidas después del marcaje inmunológico de la banda A. Estas incluyen a las proteínas H y X, con funciones desconocidas (Fig. 4). Es posible que actúen como reguladores de la longitud de los filamentos (Smith y Wood, 1997). Los filamentos de miosina se mantienen juntos en la región M. Las zonas centrales de los filamentos gruesos están estrechamente alineadas en la miofibrilla para formar la línea M. Aquí, los tres subfilamentos de miosina cambian de una unión cabeza con cola a un empaquetamiento antiparalelo cola con cola. Tres filamentos de proteína M (M r 165 000) se unen a las cadenas de miosina mediante entrecruzamientos proteicos, incluyendo a la enzima creatina cinasa. Esta enzima reabastece las reservas de ATP utilizadas por la actividad contráctil utilizando creatina fosfato como su sustrato (Smith y Wood, 1997). La línea M consiste de proteínas orientadas longitudinal y transversalmente que contribuyen para mantener la orientación adecuada de los filamentos de miosina dentro del sarcómero (McArdle, et al. 1996). Aún en los primeros estudios con el microscopio de luz, se podía distinguir una línea oscura en el centro de la banda A. Con el microscopio electrónico, sin embargo, se hizo aparente que existen varias líneas M, y por lo tanto es más apropiado referirnos a la región M que a la línea M. Una complicación más de la región M, fue el hallazgo de filamentos delgados (filamentos M), de aproximadamente 5 nm de diámetro, que corren paralelos a los filamentos de miosina y parecen estar conectados con estos últimos; así como también entre ellos. Son estas uniones cruzadas entre los dos tipos de filamentos las responsables de la apariencia de múltiples líneas M en cada banda A (McComas, 1996). Los puentes M orientados perpendicularmente se conectan con seis filamentos gruesos de miosina en un patrón hexagonal (McArdle, et al. 1996). Estudios con anticuerpos marcados y de extracción han identificado dos de las proteínas en la región M, además de la miosina. Una de esas proteínas es la proteína M, o miomesina; de peso molecular de 165 kD y se piensa que es la que corresponde a los filamentos M. La otra proteína es la creatina cinasa, y es probable que esas moléculas formen los soportes que sostienen los filamentos de miosina en una armazón ordenada correspondiendo unos con otros. Otras proteínas, aun por identificarse, evidentemente refuerzan los filamentos y producen líneas M adicionales (McComas, 1996). La titina también ayuda a estabilizar los filamentos de miosina. Ha generado mucho interés el descubrimiento de dos enormes proteínas, la titina (a veces llamada conectina) y la nebulina (con Mr de 3 000 000 y 500 000, respectivamente). La titina es una de las proteínas más grandes que se conocen, y es una molécula elástica, semejante a un resorte (Fig. 11). Las micrografías electrónicas de la proteína purificada sugieren una estructura de dominios globulares repetidos, lo que le da una apariencia de collar de perlas. La molécula de titina tiene un diámetro de 4 nm y unen los extremos de los filamentos gruesos de miosina a las líneas Z. Esta red evitaría la sobreextensión del sarcómero y mantendría a los filamentos gruesos en la posición adecuada. Se cree que la titina está ausente en las células de músculo liso y de las no musculares (Fulton e Isaacs, 1991). Si un solvente tal como la gelsolina se usa para disolver los filamentos de actina en una fibra muscular, se puede ver que los filamentos de miosina están conectados a los discos Z por finos hilos. Esos hilos, los cuales son de aproximadamente 5 nm de diámetro y 1 m de largo, consisten de una proteína extremadamente grande, la titina; y es probable que 6, o posiblemente 12 moléculas de titina formen cada uno de los hilos (Trinick, 1991). Parte de este hilo de titina traslapa con los filamentos de miosina y está firmemente unido a él, mientras que el resto se extiende por toda la banda I y tiene propiedades elásticas. Por su estructura y posición, se piensa que cada par de hilos de titina funciona como un estabilizador longitudinal para los filamentos de miosina, manteniéndolos en el centro del sarcómero durante la contracción y la relajación. Es posible que los hilos de titina, contribuyan en gran parte a la elasticidad de las fibras musculares cuando éstas son estiradas, ya sea pasivamente por fuerzas aplicadas en los extremos del músculo, o activamente por el desigual acortamiento del sarcómero en el eje a lo largo de la fibra (McComas, 1996). PROTEINAS DELGADO. DEL FILAMENTO Los filamentos de actina. La actina forma filamentos del citoesqueleto de los músculos y de las motoneuronas. Los filamentos delgados también están formados por actina. Ahora aprenderemos un poco más acerca de su estructura y acerca de unas proteínas especiales, la troponina y tropomiosina, las cuales están asociadas con ella en los filamentos delgados de la fibra muscular (McComas, 1996). Con el microscopio electrónico, un filamento de actina se ve como un hilo de cerca de 1 m de largo y 8 nm de ancho. El filamento contiene entre 300 y 400 moléculas de actina, y cada una de éstas, a sus vez, está hecha de 375 aminoácidos (McComas, 1996). La principal proteína del filamento delgado es la actina (M r 42 000). La secuencia primaria de la proteína se ha conservado notablemente a través de la evolución. Esto sugiere que incluso variaciones leves interferirían con una o más de las funciones de esta proteína versátil. Esta unión de las moléculas de actina G monomérica se logra por polimerización, un proceso que requiere la presencia de un nucleótido (ya sea ADP o ATP) hidrolizable por monómero (Smith y Wood, 1997; McComas, 1996). La transformación reversible de actina G a actina F (polimerizada) es regulada por una lista siempre creciente de proteínas de unión, agrupamiento, entrecruzamiento y encasquetamiento de la actina. Los filamentos de actina formados de modo transitorio probablemente intervienen en las corrientes citoplásmicas (Smith y Wood, 1997). Los filamentos de actina tienen polaridad. La actina de los sarcómeros forma filamentos delgados permanentes de 8 nm de ancho, anclados en la línea Z. El filamento delgado consta de dos cadenas de monómeros de actina unidos extremo con extremo, enrollados uno alrededor del otro para formar una doble hélice dando la apariencia de un collar de cuentas torcido sobre su propio eje (Fig. 12). Los monómeros no son esféricos, como normalmente se representan, sino que tienen forma de campana, de modo que los polímeros lineales tienen una direccionalidad, o polaridad, lo cual crea extremos puntiagudos y punzantes. Esto puede demostrarse decorando los filamentos de actina F con cabezas S-1 de miosina, los cuales aparecen entonces como estructuras parecidas a puntas de flecha a lo largo del filamento (Smith y Wood, 1997). Puesto que las moléculas de actina en cada filamento muestran la misma dirección, las cabezas de flecha se comportan similarmente, apuntando hacia el mismo extremo (McComas, 1996). La polaridad de los filamentos de actina se invierte en cada una de las bandas I del sarcómero, característica esencial para el mecanismo del filamento deslizante. Una vuelta completa de doble hélice de actina corresponde a unos 76 nm, el doble del espacio entre los puentes cruzados de la miosina, de 43 nm (Smith y Wood, 1997). Los filamentos de actina están asociados con dos proteínas accesorias reguladoras, la tropomiosina y la troponina. En el surco entre las dos cadenas de la hélice de la actina F se encuentra una larga proteína en forma de varilla, la tropomiosina, un dímero (el monómero tiene una Mr de 3 5 000) que interactúa con siete monómeros de actina. La tropomiosina tiene una estructura de hélices enrolladas semejante a la porción en varilla de la cadena pesada de miosina. En el extremo de la molécula de tropomiosina hay una molécula de varias subunidades, la troponina (Fig. 12). Los tres componentes de este complejo tienen la capacidad de responder a fluctuaciones en la concentración de Ca++ con un ligero reposicionamiento de la tropomiosina, lo cual permite que los monómeros de la actina F interactúen con los puentes cruzados de la miosina e inicien el proceso contráctil (Smith y Wood, 1997). La tropomiosina y la troponina son otros dos componentes importantes de la estructura de los filamentos delgados. Esas proteínas regulan que se formen o se rompan los contactos entre los miofilamentos durante la contracción. La tropomiosina es más bien similar a la cola de la molécula de miosina. Consiste de una doble hélice que se distribuye a lo largo del filamento de actina en una hendidura formada por la doble hélice de actina F y la hace rígida; cada molécula de tropomiosina se extiende a lo largo de siete moléculas de actina. Se cree que la tropomiosina inhibe la interacción de la actina con la miosina. La troponina está alojada a intervalos regulares a lo largo de los filamentos de actina, tiene una alta afinidad por los iones Ca++. La troponina es un complejo de tres polipéptidos, uno de los cuales (la troponina T) permite su unión a la tropomiosina. La troponina I, en contraste, se une a la actina e indirectamente evita a ésta interactuar con la cabeza de miosina. Durante una contracción muscular, este efecto inhibitorio de la troponina I es vencido por la unión del Ca++ a la troponina C; este mineral juega un papel crucial en la contracción y en la fatiga muscular. Por ejemplo, es la acción del Ca++ y la troponina los que inician la interacción de los filamentos para que se deslicen uno sobre el otro. Cuando la fibra es estimulada, se libera Ca++ del RS, cada molécula de troponina C captura cuatro iones de Ca++ y sufre un cambio conformacional que en algún modo "remolca" a la tropomiosina y la desplaza profundamente dentro de la hendidura de los dos hilos de actina. Este movimiento de la tropomiosina expone los sitios activos en el filamento de actina en los cuales pueden unirse las cabezas globulares de miosina, permitiendo que ocurra la contracción (McComas, 1996; McArdle, et al. 1996). VI.- EL CITOESQUELETO y LA MATRIZ EXTRASARCOMERICA. Estudios bioquímicos sobre las proteínas del citoesqueleto. Filamentos intermedios. Estructura de los filamentos intermedios. Los microtúbulos. Los microtúbulos son responsables del citoesqueleto. El citoesqueleto fortalece el sarcolema y mantiene las estructuras intracelulares en su lugar. El citoesqueleto y otras proteínas miofibrilares. Los filamentos de actina están atados a los discos Z. VI.- EL CITOESQUELETO y MATRIZ EXTRASARCOMERICA. LA El citosol de las células eucariontes está sostenido por un citoesqueleto formado por tres redes muy organizadas de proteínas filamentosas. Estas redes están compuestas de microfilamentos, filamentos intermedios y microtúbulos. Estos se distinguen por su apariencia y dimensiones al ser examinados con microscopio electrónico, y por sus diferencias en su naturaleza química, incluyendo sus reacciones frente a anticuerpos específicos. Estas tres redes filamentosas llevan a cabo funciones de un esqueleto para la célula, que son permitir el movimiento y proporcionar sostén (Fig. 13). El movimiento celular incluye cambios en las posiciones de los orgánulos dentro del citosol, cambios en la forma de las células como un todo, y la migración de la célula. Los elementos filamentosos del citoesqueleto son largos, y muchas veces se extienden a todo lo largo de la célula, de modo que pueden distribuir las fuerzas de tensión a través del citoplasma (Smith y Wood, 1997). Estudios bioquímicos sobre las proteínas del citoesqueleto. Aunque es relativamente fácil identificar enzimas y otras proteínas con actividad biológica, es difícil identificar proteínas estructurales si no tienen una actividad biológica medible. Las proteínas del citoesqueleto se han extraído de las células utilizando detergentes de varios tipos, algunas veces seguidos de otros procedimientos como la solubilización con cloruro de guanidinio 6 mol dm-3. Una vez solubilizadas, se suelen identificar mediante su Mr aparente o sus puntos isoeléctricos, medidos por electroforesis en gel y pueden investigarse más profundamente utilizando anticuerpos. Los anticuerpos pueden utilizarse para identificar y luego localizar los antígenos proteicos contra los que fueron obtenidos. No obstante, algunas moléculas que no son anticuerpos (por ejemplo la citocalasina B, la faloidina, la colchicina y el taxol) se unen específicamente a las proteínas del citoesqueleto. Estas moléculas pueden utilizarse para estudiar el movimiento in vivo mediante el seguimiento de cambios en sus distribuciones intracelulares (Taylor y Wang, 1980). Filamentos intermedios. Previamente ya se han descrito las estructuras de los microfilamentos de actina y miosina que integran, respectivamente, los filamentos delgados y gruesos del sarcómero. Ahora nos enfocaremos a describir la estructura de los filamentos intermedios y su relación con la estructura de las fibras musculares. Los filamentos intermedios se llaman así debido a que son más delgados que los microtúbulos, pero más gruesos que los miofilamentos. Normalmente tienen de 10 a 11 nm de diámetro, pero pueden variar desde 7 a 15 nm. Son los elementos menos solubles del citoesqueleto de la célula. Un detergente no fónico solubiliza y elimina la mayoría de las proteínas celulares, dejando actina, miosina y filamentos intermedios. La actina y la miosina pueden extraerse después utilizando un amortiguador con alta concentración de sales, dejando sólo filamentos intermedios que pueden solubilizarse con dodecilsulfato de sodio (SDS) o pH 2.6. Los filamentos intermedios parecen ser los elementos más estables del citoesqueleto, ya que a un pH y fuerza iónica fisiológicos, siempre parecen existir en la forma de polímeros insolubles (filamentos). En cambio, los microfilamentos y los microtúbulos existen como polímeros insolubles (filamentos) y monómeros solubles (moléculas globulares separadas) y sufren ciclos de degradación de polímero a monómero y de estructuración de monómeros a polímeros (Smith y Wood, 1997). Estructura de los filamentos intermedios. Las proteínas que constituyen los microfilamentos y los microtúbulos son las moléculas de actina y tubulina muy bien conservadas en la evolución. En contraste, parece haber familias de cadenas polipeptídicas de los filamentos intermedios que tienen tamaños variables. Las pruebas más recientes indican que los filamentos intermedios están compuestos por dos dobles hélices a polipeptídicas trenzadas una alrededor de la otra, para formar un cable con giro hacia la izquierda. Hay tres regiones en donde las cadenas polipeptídicas están enrolladas al azar. Estas regiones pueden permitir la proyección de brazos laterales desde los filamentos intermedios para interactuar con otros elementos del citoesqueleto o con organelos celulares. Como no hay un requerimiento estricto para el enrollamiento de estas regiones, pueden también ser sitios de variación en la secuencia de aminoácidos de los filamentos intermedios. Las regiones carboxilo y amino-terminales de cada polipéptido también están enrolladas al azar y tienen secuencias variables de aminoácidos; probablemente son los responsables de la agregación de las moléculas extremo con extremo (cabeza o cola) o lado con lado para formar filamentos (Osborn, 1982; Steinert, 1985). Los filamentos intermedios están ampliamente distribuidos en las células eucariontes y se encuentran tanto en invertebrados como en vertebrados. polimerizan cabeza-cola, lo que imparte una polaridad al microtúbulo (Gull, 1990). Los microtúbulos citoesqueleto. son responsables del Los microtúbulos se unen a los microfilamentos de actina y a los filamentos intermedios y pueden controlar la distribución de estos últimos. Participan junto con los filamentos de actina en la invaginación de vesículas revestidas y vesículas sinápticas del plasmalema hacia el interior de la célula. Los microtúbulos también se unen a organelos celulares, y probablemente actúan como guías y como translocadores para los organelos en movimiento dentro de la célula. Se ha sugerido que los microtúbulos controlan al citoesqueleto (Smith y Wood, 1997). El citoesqueleto de la mayoría de las células es complicado y las interacciones entre todos sus constituyentes aún no se entienden bien. Los microtúbulos. Los microtúbulos, utilizando la microscopía electrónica, se identificaron inicialmente como tubos huecos de 25 nm de diámetro,. En la década de los sesenta, se observó que en las células de meristemo de enebro aparecían secciones transversales de microtúbulo aparentemente compuestas por subunidades circulares. La técnica de rotación de fotografías una en relación con la otra demostraron una periodicidad de 13 subunidades en una vuelta completa. Los fragmentos aislados de microtúbulos, teñidos negativamente y examinados de lado, tienen subunidades acomodadas en hileras llamadas protofilamentos. Los estudios bioquímicos han demostrado que los microtúbulos se forman mediante la polimerización de dímeros de tubulina. Cada dímero consiste en un polipéptido de tubulina a con una Mr de 50 000 y un polipéptido de tubulina ß, con una Mr también de 50 000. Los dímeros se El citoesqueleto fortalece el sarcolema y mantiene las estructuras intracelulares en su lugar. Al igual que otras células del cuerpo, la fibra muscular tiene un citoesqueleto que mantiene las diferentes estructuras intracelulares en su lugar. En la periferia de la fibra el citoesqueleto refuerza el plasmalema, impidiendo su ruptura durante la contracción y la relajación. La actina y la espectrina son especialmente importantes en este papel, como también la proteína distrofina (Fig. 14). Otros filamentos intermedios, compuestos de desmina, sinemina y vimentina, están alrededor, envolviendo a las miofibrillas a nivel de los discos Z y mantienen las miofibrillas juntas (Fig. 15). Los mismos tipos de filamentos sirven para posicionar algunos de los organelos intracelulares, tales como los núcleos y las mitocondrias (McComas, 1996). El citoesqueleto miofibrilares. y otras proteínas Filamentos Intermedios: La vimentina se expresa en los tejidos mesenquimatosos, y es típica de las células primitivas. La desmina es una proteína que se expresa en las fibras musculares esqueléticas, aumentando en las últimas etapas de la diferenciación, conforme decrece la expresión inicial de la vimentina. La desmina y la vimentina parecen ayudar a los microfilamentos a alinearse en el sentido de las fibras del músculo esquelético, y ambas permanecen como componentes menores del músculo esquelético maduro. La desmina se presenta en el músculo liso y también en células no musculares como las células endoteliales que recubren los vasos sanguíneos. Así, no es totalmente específica del músculo (Smith y Wood, 1997). La desmina (Mr de 55 000) forma filamentos de 10 nm de diámetro, es decir, de tamaño intermedio entre los filamentos gruesos de miosina y los delgados. La proteína tiene una porción de varilla central esencialmente en forma de hélice a, con regiones de cabeza y cola. La formación de los filamentos intermedios parece incluir la asociación de varillas de desmina en forma de superhelicoide. No obstante, la conformación de la desmina en la línea Z puede no ser filamentosa, y la proteína parece encargarse de mantener ordenados a los sarcómeros, por medio del alineamiento de las líneas Z. Más recientemente se ha propuesto que las cadenas longitudinales de desmina fibrosa unen líneas Z en la misma miofibrilla; estas cadenas probablemente se hallan por debajo de las membranas del RS que envuelven a cada miofibrilla. Si esto es cierto, estos filamentos deben ser elásticos para permitir la extensión del sarcómero, y no deben penetrar en las zonas de filamentos gruesos y delgados, donde podrían interferir con el mecanismo del filamento deslizante (Maruyama, 1985). Como muchas proteínas del citoesqueleto, la desmina puede ser fosforilada. También es sustrato para la proteólisis limitada por la proteinasa neutra dependiente de Ca++, que tiene la notable propiedad de eliminar selectivamente las líneas Z de las preparaciones de miofibrillas. Cualquiera que sea su papel, la desmina del músculo esquelético puede considerarse un componente miofibrilar poco abundante. En cambio, en las células de músculo liso la desmina es extremadamente abundante, y los filamentos de 10 nm son muy notorios. Los filamentos de desmina y actina probablemente conectan a los cuerpos densos de la célula de músculo liso, los cuales se cree son análogos a las líneas Z miofibrilares y son igualmente ricos en actinina a. Ciertos filamentos se unen a la membrana plasmática mediante placas de anclaje (Fig. 16B), que contienen proteínas tales como la vinculina (M, 117 000). En las fibras de músculo estriado también se encuentra la vinculina a nivel de la línea Z, probablemente actuando como un puente entre la línea Z y el sarcolema (Smith y Wood, 1997). Los filamentos de actina están atados a los discos Z. Proteínas De La Línea Z: La principal proteína de la línea Z es la actinina a, un dímero semejante a una varilla de 4 nm de grosor y 40 nm de longitud. En esta proteína la región varilla está formada por un plegamiento del polipéptido en hélice a sobre sí mismo, para producir tres dominios en triple hélice. La actinina a es una proteína de unión a la actina que establece enlaces cruzados con los filamentos delgados de los sarcómeros adyacentes formando una distribución regular, que da origen a la característica línea Z en el centro de la banda I (Smith y Wood, 1997). Recientemente ha sido posible preparar in vitro láminas de línea Z, en forma de agregados lado con lado de discos Z de miofibrillas adyacentes, libres de proteínas contráctiles. Al teñir con anticuerpos marcados estas estructuras que son análogas a las secciones transversales de la fibra al nivel de la línea Z, se ve que la porción central del disco es actinina a, rodeada por un collar de la proteína citoesquelética desmina (Smith y Wood, 1997). Los filamentos de actina, al igual que los de miosina, requieren soporte posicional; ellos logran esto parcialmente con los puentes cruzados y en parte por sus inserciones en los discos Z en el centro de cada Banda I. Los discos Z están compuestos principalmente de las proteínas a actinina, desmina, vimentina y sinemina. La a actinina, una proteína dímero de 180 kD, se piensa que une los extremos de los filamentos de actina de un lado de los discos Z con los filamentos de actina del otro lado. Los filamentos de actina, los cuales no se extienden a través de los discos Z, son convertidos desde un arreglo hexagonal alrededor de los filamentos de miosina a un arreglo rectangular en sus inserciones en los discos Z. Otro rasgo de los discos Z es que el punto en el cual un filamento de actina se une sobre un lado, es la parte media entre dos puntos de unión de filamentos de actina sobre el lado opuesto del disco. La desmina, vimentina y la sinemina, las otras proteínas principales que componen los discos Z, forman filamentos intermedios que están alrededor del disco y también unen los discos adyacentes manteniéndolos juntos en los ejes longitudinal y transverso. Son estos filamentos intermedios los cuales, por medio de sus conexiones transversas desde un disco Z a otro, mantienen ordenadamente a todas las miofibrillas dentro de cada fibra muscular. Los discos Z, también están unidos por medio de los filamentos intermedios al citoesqueleto por debajo del plasmalema y en el plasmalema en sí. Por medio de proteínas de unión del plasmalema, los discos Z están finalmente conectados a la membrana basal y al endomisio formando una vaina en la fibra muscular. Como se observa en la figura 15, cada arreglo transverso de filamentos intermedios constituye un costámero (McComas, 1996). LA MATRIZ EXTRACELULAR EN LAS FIBRAS MUSCULARES ESQUELETICAS. Composición y diversidad estructural. Las proteínas fibrosas. La sustancia basal y los complejos de proteoglicano. Diversidad de la matriz extracelular. Adhesiones focales: asociaciones especializada del citoesqueleto y la matriz extracelular. Glicoproteínas estructurales Receptores de membrana para macromoléculas de la matriz extracelular. VII.- LA MATRIZ EXTRACELULAR EN LAS FIBRAS MUSCULARES ESQUELETICAS. En algún periodo de su existencia, todas las células de los animales entran en contacto con una intrincada red de proteínas fibrosas, proteoglicanos y glicoproteínas estructurales que interactúan entre sí y constituyen la matriz extracelular de la mayoría de los tejidos (ver Fig. 14). Esta matriz no sólo sirve para mantener la estructura de los tejidos, sino que también influye en la diferenciación, migración, proliferación y forma de la célula con la que está en contacto. Las propiedades estructurales o mecánicas de los componentes de la matriz extracelular son esenciales para el funcionamiento normal de los tejidos conectivos, como el cartílago, los tendones, el hueso, los discos intervertebrales, los dientes y las láminas basales. Muchos de los componentes de la matriz extracelular, si no es que todos, parecen ser capaces de interactuar con las células, ya sea indirectamente, a través de proteínas como la fibronectina (Fig. 16), o por medio de receptores de superficie (Hay, 1991). Composición y diversidad estructural. Las macromoléculas que constituyen la matriz extracelular son secretadas localmente por todas las células, con excepción de las células sanguíneas maduras. La composición exacta de la matriz secretada depende del tipo de célula, su estado de diferenciación y su estado metabólico. Los componentes básicos de todas las matrices son: las proteínas fibrosas, colágenas y elastina; los glicosaminoglicanos y proteoglicanos, y las proteínas estructurales o de adhesión, como la fibronectina y la laminina. Los glicosaminoglicanos, proteoglicanos y proteínas estructurales atrapan moléculas de agua para formar una "sustancia basal", altamente hidratada y semejante a un gel. En ella se encuentran las proteínas fibrosas, que son insolubles y proporcionan a la matriz sus propiedades mecánicas características (Hay, 1991). Las proteínas fibrosas. Los tejidos conectivos de los mamíferos contienen dos proteínas esencialmente hidrofóbicas que se agregan para formar un andamiaje fibroso para el tejido, estas son la colágena y la elastina. Las colágenas (ver Fig. 21) son una familia heterogénea de proteínas que se hallan en todos los animales y forman el principal componente de la matriz extracelular (Smith y Wood, 1997). La superfamilia de la colágena incluye al menos 19 proteínas definidas como colágenas y diez proteínas adicionales que tienen dominios parecidos a la colágena (Prockop y Kivirikko, 1995). Todas las moléculas de colágena están compuestas por tres cadenas polipeptídicas, cada una de las cuales contiene tramos considerables de la secuencia tripeptídica GlyX-Y, que permite la formación de triples hélices. Las colágenas tipo I, II, III, V y XI contienen una larga región ininterrumpida de triple hélice, y se ensamblan para formar polímeros ordenados llamados fibrillas (de 10 a 300 nm de diámetro) o fibras de varios µm de diámetro. Cuando se observan mediante microscopía electrónica, las fibrillas de colágena muestran un característico patrón en bandas, debido a la distribución escalonada de las moléculas de tropocolágena. Las fibrillas son reforzadas y estabilizadas mediante enlaces cruzados, tanto intramolecular como intermoleculares entre residuos de lisina (Smith y Wood, 1997). C La elastina y las fibras elásticas cubren en el cuerpo de los vertebrados el requerimiento de tejidos que pueden doblarse, torcerse y estirarse reversiblemente durante el movimiento normal. La elastina es una proteína que se encuentra en la mayoría de los tejidos conectivos junto con la colágena. La elastina se encuentra presente en altos niveles en los ligamentos y en cantidades menores en la piel, los tendones y otros tejidos conjuntivos. La composición aminoacídica de la elastina se asemeja a la de la colágena. La elastina se sintetiza como un monómero con Mr de 72 000, llamado tropoelastina. La formación de fibras tiene lugar cerca de la superficie celular, lo que puede permitir que la célula controle la orientación de las fibras. La apariencia amorfa de la elastina en los tejidos y la estructura enrollada al azar de la tropoelastina sugieren una estructura entrecruzada enrollada al azar para las fibras, que permite que la red se estire y se contraiga, como una liga (Fig. 17). La atracción hidrofóbica entre moléculas de elastina parece tener una función en el proceso de recuperación de la forma. Las fibrillas de colágena asociadas pueden también servir para limitar el estiramiento (Smith y Wood, 1997). La sustancia basal y los complejos de proteoglicano. Los glicosaminoglicanos son un importante componente de la matriz extracelular. La intensa carga negativa de estos polisacáridos debida a la presencia de grupos sulfato y carboxilo asegura que puedan atraer grandes cantidades de agua y de cationes. Con la excepción del hialuronano, (ácido hialurónico) los glicosaminoglicanos no se encuentran como cadenas de polisacáridos libres, y son sintetizados directamente sobre una base proteica. La alta densidad de carga negativa de las cadenas agregadas de glicosaminoglicano ocasiona que éstas se repelan mutuamente, dando lugar a una estructura muy expandida en disolución, que ocupa un volumen mucho mayor que el que debería esperarse de sus pesos moleculares, es decir, 30 a 50 veces su peso seco. Esta capacidad para unirse y controlar grandes cantidades de agua es esencial para el funcionamiento normal de tejidos tales como el tendón, que deben actuar como colchones para cargas de compresión repetitivas y variables. Las moléculas son compresibles reversiblemente. Cuando se someten a una tensión de compresión, el agua es desplazada de las moléculas, disminuyendo el dominio ocupado por el agregado de proteoglicano, pero aumentando la densidad de carga y por tanto la repulsión entre las cadenas de glicosaminoglicano. Cuando se retira la tensión, las moléculas de proteoglicano se expanden, embebiéndose de moléculas de agua. Son análogas a resortes parcialmente comprimidos, que pueden resistir la carga con menos deformación que un resorte sin comprimir (Gallager, 1986; Poole, 1986). Se han propuesto varias funciones para estos proteoglicanos de la superficie celular. Se sabe que pueden unirse a las colágenas de los tipos I, III, IV y V, pero no al tipo II. Se ha descrito cierta especificidad celular hacia colágenas individuales. Además, se piensa que su capacidad para unirse a la fibronectina y a las moléculas de adhesión célula-célula, y para autoasociarse, ayuda a regular la comunicación célula-matriz extracelular y célula-célula. Diversidad de la matriz extracelular. El término matriz extracelular abarca la capa pericelular microscópicamente amorfa cercana a la superficie de la mayoría de las células; la matriz intersticial, más fibrosa, de la mayor parte de los tejidos, la matriz calcificada del hueso y los dientes, y las membranas basales. Las funciones mecánicas de la matriz extracelular, son bien conocidas gracias al estudio de los tejidos conectivos "clásicos" como el cartílago maduro, el tendón, el hueso y los discos intervertebrales. Estos tejidos comparativamente acelulares tienen una matriz extracelular con una estructura y una composición molecular adaptadas para llevar a cabo un papel eminentemente mecánico. La matriz del tendón está compuesta por haces de colágena orientados longitudinalmente, que son resistentes y relativamente inelásticos. Otra forma especializada de la matriz extracelular es la membrana basal. Microscópicamente, éstas pueden verse como estructuras delgadas y amorfas en la superficie basal o abluminal de las células epiteliales y endoteliales, tales membranas indudablemente proporcionan resistencia mecánica a la capa de células a las que están unidas. Los primeros estudios resaltaban las funciones y propiedades mecánicas de la matriz extracelular, y ocasionaron que esta se considerase como una materia de soporte inerte sintetizado por las células como un simple andamiaje. Dos importantes observaciones contradicen este enfoque: 1.- La pérdida de las funciones diferenciales normales, que tienen lugar cuando las células se colocan en cultivo, puede ser revertida si se cultivan en la matriz natural o en componentes aislados de la matriz. 2.- La eliminación de ciertos componentes de la matriz tienen profundos efectos en el desarrollo de los órganos (Smith y Wood, 1997). Las interacciones célula-matriz extracelular, como se ha descubierto son importantes en procesos como la embriogénesis, la diferenciación, el crecimiento, la migración celular y la reparación de tejidos. Hoy está claro que la mayoría de las células poseen receptores de superficie celular específicos para muchos componentes de la matriz extracelular, pero la manera en que estos controlan las respuestas celulares no se ha comprendido bien. Adhesiones focales: asociaciones especializadas del citoesqueleto y la matriz extracelular. Muchos componentes de la matriz extracelular promueven la adhesión, la agregación y la extensión de las células en cultivos de tejidos. En el microscopio electrónico, los puntos de interacción célulamatriz aparecen como áreas discretas de superficie celular engrosada, adyacentes a la matriz extracelular. El examen ultraestructural muestra que en estos centros de unión con mucha frecuencia están presentes microfilamentos y filamentos intermedios. Los microfilamentos a menudo están presentes como haces, conocidos como fibras de tensión, que se extienden desde la adhesión focal hasta el núcleo. Los estudios con técnicas especializadas de microscopía electrónica han revelado una estrecha asociación entre los haces de actina (fibras de tensión) y los puntos de contacto. Esta asociación estrecha entre el citoesqueleto y la matriz extracelular bien puede mediar el control metabólico ejercido sobre la célula por su matriz extracelular. Una proteína, la talina, parece estar asociada únicamente con las adhesiones focales y no está presente en las uniones adherentes célula-célula. Glicoproteínas estructurales. En la adhesión célula-matriz intervienen dos diferentes clases de moléculas: los receptores membranales y las glucoproteínas de la superficie celular o de la matriz extracelular. Estas ultimas también se llaman glucoproteínas adhesivas o estructurales. Las glucoproteínas estructurales son moléculas multifuncionales. Normalmente interactúan con varios componentes de la matriz extracelular y con las superficies celulares, a través de dominios de unión específicos y parecen tener un papel importante en las interacciones célula-matriz como proteínas de anclaje celular. Su capacidad para autoasociarse y unirse a otros componentes de la matriz sugiere que también podrían mediar la organización celular de la matriz circundante. Como se puede observar en la figura 14 y 16, la fibronectina y la laminina son los ejemplos mejor caracterizados de este grupo de proteínas. Las fibronectinas son glucoproteínas grandes (Mr 450 000 ) presentes en la mayor parte de los fluidos corporales y tejidos conectivos, y son sintetizadas por la mayoría de los tipos de células animales en cultivo. La fibronectina se descubrió a principios de los años 70 como una proteína de la superficie celular, y se ha descubierto que promueve la unión celular. A las fibronectinas se les han atribuido diversas actividades biológicas, la mayoría de las cuales incluyen funciones adhesivas o de unión a ligantes. Estas moléculas multifuncionales consisten en varios dominios discretos, cada uno de los cuales lleva a cabo una función especifica. La fibronectina puede interactuar con la superficie celular mediante su dominio de unión a células y también uniéndose a los proteoglicanos de la superficie celular. La capacidad de la fibronectina para unirse a proteoglicanos y a células sugiere que puede tener un papel importante en el ordenamiento del deposito de la matriz, una opinión que es apoyada por su formación de fibrillas multiméricas que se extienden desde la superficie celular hacia la matriz extracelular. Se cree que otra glucoproteína extracelular, la laminina, tiene un papel similar (Smith y Wood, 1997) La laminina es una glucoproteína de Mr de 900 000. En los tejidos es la principal glucoproteína no colagenosa de las membranas basales, y se localiza en la región de la lamina rara (ver Fig. 19). Los estudios inmunohistológicos indican que la laminina es un componente principal de las membranas basales en los tejidos y órganos adultos, como el riñón, los vasos sanguíneos, la piel, el músculo, los dientes y otros. Originalmente se creyó que la lámina fomentaba específicamente la adhesión de células epiteliales, y la fibronectina la de las células mesenquimatosas, pero no es así. Los hepatocitos, los fibroblastos, los mioblastos y varios tipos de células tumorales se adhieren a ambas. Sin embargo, la laminina sí parece ser más activa para promover el crecimiento de neuritas y la formación de miotubos que la fibronectina. El receptor de la superficie celular no es el mismo que para la fibronectina (Smith y Wood, 1997) Receptores de membrana para macromoléculas de la matriz extracelular. Las glicoproteínas estructurales extracelulares descritas interactúan directamente con receptores en la superficie celular, y a través de estos receptores, con el citoesqueleto. Uno de los primeros grupos de receptores para moléculas de la matriz extracelular en ser identificados fue un complejo llamado integrina (Fig. 16B) de aves, antígeno de unión célula-sustrato (CSAT) o complejo 140 000. Este complejo se aisló utilizando dos anticuerpos monoclonales que bloqueaban la adhesión, los cuales permitieron localizar el complejo en los centros de adhesión de miocitos, fibroblastos, neurona y muchos otros tipos de células. Se ha demostrado que el complejo de la integrina puede unirse a la fibronectina y a la laminina. También se ha demostrado que la integrina interactúa con la talina, pero no con los componentes de vinculina o de actinina a de los filamentos intermedios (Smith y Wood, 1997). Parece que no todas las interacciones célula-matriz están mediadas por la familia de receptores de las integrinas. Se han aislado y caracterizado parcialmente proteínas de membrana de unión a colágena. La ancorina es una proteína con Mr de 31 000 hallada en la superficie de los condrocitos cultivados. Puede unirse a la colágena tipo II (y en menor medida a los tipos I y V) nativo, pero no al desnaturalizado (Smith y Wood, 1997). Parece que la mayoría de las células tienen receptores membranales capaces de unirse a todos los principales componentes de la matriz extracelular. Se ha demostrado que la mayor parte de estos receptores se unen a componentes del citoesqueleto. Así, estos receptores probablemente intervienen en la regulación matriz extracelular-célula y en el ordenamiento de la matriz misma. En resumen: todas las matrices extracelulares están compuestas por los mismos tres grupos de moléculas: (1) las proteínas fibrosas elastina y colágena; (2) los glicosaminoglicanos y proteoglicanos, predominantemente formados por carbohidrato, y (3) las glucoproteínas de adhesión/estructurales. Hasta hace poco se creía que la matriz extracelular era un andamiaje inerte, compuesto por proteínas fibrosas embebidas en una "sustancia basal" amorfa muy hidratada. Esté punto de vista se basaba en la estructura de los tejidos conectivos "clásicos de carga, como el cartílago, los cuales contienen colágenas fibrosas y grandes proteoglicanos que se agregan entre sí. Un análisis más profundo de esos tejidos y de otras matrices extracelulares, como las membranas basales, han sacado a la luz las colágenas no fibrosas, los proteoglicanos de superficie celular y los que no se agregan, y un número cada vez mayor de proteínas estructurales. La función de las colágenas no fibrosas parece ser menos mecánica y más relacionada con estructurar y guiar la formación de la matriz, y se cree que las formas más recientemente descubiertas de proteoglicanos regulan procesos metabólicos en la superficie celular y controlan el depósito de colágena de la matriz. Además, los proteoglicanos de heparano sulfato son esenciales para las propiedades filtrantes de las membranas basales. Las proteínas estructurales, gracias a su capacidad de unirse tanto a células como a componentes de la matriz extracelular y de formar agregados fibrilares, parecen ser un componente esencial de la maquinaria de la célula para interactuar con la matriz extracelular y controlarla. Las proteínas se unen a la célula por medio de una familia de receptores de superficie (las integrinas), que también interactúan con el citoesqueleto, y a través de ellos, posiblemente con los núcleos. De este modo, parece existir una conexión directa entre el núcleo celular y la matriz extracelular, lo que permite a la célula organizar la matriz y a la matriz regular el metabolismo celular. VIII.- MEMBRANA BASAL. La membrana basal tiene varias capas. La membrana basal contiene varios tipos de proteínas y carbohidratos. La membrana basal tiene funciones importantes. VIII.- MEMBRANA BASAL. La membrana basal es una cubierta flexible delgada (40-120 nm de grosor) de matriz extracelular especializada, que incluye un complejo de glucoproteínas que rodean la fibra muscular, localizándose entre el endomisio y el plasmalema. Aunque delgada, la membrana basal consiste de diferentes capas, cada una con distinta estructura. Además, existe un número de proteínas especializadas asociadas con la membrana basal. Así, además de proporcionar, junto con el endomisio, un soporte para las fibra muscular, la membrana basal tiene acciones enzimáticas y funciones tróficas durante el desarrollo y en la inervación. Es capaz de determinar la polaridad de la célula, influye en su metabolismo, organiza las proteínas de las membranas plasmáticas adyacentes e induce la diferenciación celular (Alberts, et al. 1994). La membrana basal tiene varias capas. Con el microscopio electrónico, se puede apreciar que la membrana basal consiste de dos partes, una lamina basal y una lámina reticular (Fig. 18). La lamina reticular está compuesta de colágena y otras fibras dentro de una sustancia de soporte amorfa; los extremos de los músculos, están conectados por medio de las fibras de colágena al tendón del músculo. Como se puede observar en la figura 18, la lámina basal . propiamente esta hecha de dos capas, la más delgada que mide 2.5 nm de grueso, y a causa de su translucidez electrónica, es denominada lámina lúcida; la otra lámina, la lámina densa, es de 10 a 15 nm de gruesa y es más fácilmente visible con el microscopio electrónico. Aunque su composición precisa varia de tejido a tejido y aún de región a región en la misma lámina, la lámina madura contiene Colágena tipo IV (Fig. 19), el proteoglicano heparano sulfato perlecan, y las glicoproteínas laminina y entactina. El plasmalema y las varias capas de la membrana basal son colectivamente llamadas sarcolema. Algunos autores sin embargo, prefieren usar el término sarcolema para describir el plasmalema solo (Alberts, et al. 1994, McComas 1996). La membrana basal contiene varios tipos de proteínas y carbohidratos. La composición de la membrana basal se ha investigado con técnicas inmunohistoquímicas. Entre las proteínas identificadas están las siguientes: - Acetilcolinesterasa (AChE). Esta es la única enzima encontrada en la membrana basal, divide la acetilcolina liberada desde las terminales de las motoneuronas. - Colágena. Varios tipos de colágena están presentes, incluyendo las fibras de colágena tipo I relativamente gruesas. Las fibras de colágena y las fibras más delgadas dan resistencia a la membrana basal y también ayudan a conectar la fibra muscular con el endomisio. - fibronectina y laminina. Ambas proteínas unen las moléculas de integrinas del plasmalema con las fibras de colágeno de la membrana basa¡. - Agrina. Esta proteína está relacionada con formación de la unión neuromuscular. Algunos de los carbohidratos en la lámina lúcida consisten de residuos de azúcar de varias glucoproteínas incrustadas en el plasmalema. Sin embargo, la mayoría de los carbohidratos están en la forma de glucosaminoglicanos. Estas moléculas son largos polímeros de disacáridos no ramificados e incluyen al ácido hialurónico, sulfato de condroitina y sulfato de heparina. Esos compuestos cubren las proteínas de membrana basal y también forman la sustancia amorfa. La membrana basal tiene funciones importantes. Lejos de ser una cubierta inerte para la fibra muscular, como alguna vez se pensó, la membrana basal tiene un número importante y variado de funciones. 1.- Terminación de la transmisión sinóptica, por medio de la hidrólisis del transmisor acetilcolina, por la enzima acetilcolinesterasa. 2.- Fijación de la fibra muscular al endomisio, al nervio motor terminal, y , en los extremos de la fibra, a los tendones musculares. 3.- Soporte para la regeneración de la fibra muscular, asegurando que las células satélite se multipliquen dentro de los confines de la fibra dañada. 4.- Regulación de la unión neuromuscular. No sólo la membrana basal guía al axón que se regenera hacia el sitio de la formación de la unión neuromuscular, sino también proporciona una señal para el cono de crecimiento y desarrollar las estructuras especializadas características de una terminal nerviosa motora. Similarmente, la membrana basal, aún en ausencia de la terminal nerviosa motora, es capaz de estimular la fibra muscular para desarrollar pliegues sinápticos e incorporar receptores de acetilcolina en el plasmalema. IX.- EL TEJIDO CONECTIVO DEL MUSCULO ESQUELETICO. El tejido conectivo muscular está organizado en tres niveles. El tejido conectivo muscular tiene múltiples funciones. IX.- EL TEJIDO CONECTIVO DEL MUSCULO ESQUELETICO. El tejido conectivo intramuscular, al igual que los otros tejidos conectivos indefinidos, se construyen a partir de los fibroblastos y sus productos de secreción, proteínas fibrosas y de adhesión, proteoglucanos y otras glicoproteínas (Kovanen, 1989). El tejido conectivo de un músculo es casi tan importante como las fibras musculares, sin él no se podría organizar la estructura del los músculos y no habría manera de transmitir al tendón la fuerza producida ni sería posible el movimiento. Se ha visto que el tejido conectivo en los músculos voluminosos tiene varias partes anatómicas, asociadas con el diferente tamaño y orientación de las fibras de colágena. El tejido conectivo muscular organizado en tres niveles. está El epimisio (Fig. 1) es una cubierta particularmente fuerte que cubre completamente la superficie de los vientres (porción carnosa más prominente) de los músculos y los separa de los otros músculos. Contiene apretados paquetes entretejidos de fibras de colágena, que miden de 600 a 1 800 nm de diámetro, los cuales tienen apariencia ondulada y están conectados con el perimisio. El perimisio es también fuerte y relativamente grueso; divide las fibras musculares en paquetes, o fascículos, y también proporciona la ruta para que corran los principales vasos sanguíneos y nervios a través del músculo. Algunos de los paquetes grandes de colágena se localizan en los fascículos, a todo lo largo de la fibras musculares más exteriores; otros corren alrededor de los fascículos para formar un patrón entrecruzado. Por debajo de las gruesas hojas de tejido conectivo perimisiales está una red más laxa y más delicada en la cual las fibras de colágena corren en todas las direcciones, algunas están conectadas en el endomisio. En estas regiones se encuentran las arteriolas y vénulas, a menudo con las ramas nerviosas intramusculares. Un corte transversal a través de un fascículo muestra que las fibras musculares son poligonales más que circulares; la configuración poligonal posibilita el acomodo de un mayor número de fibras dentro de un fascículo. Los espacios intersticiales que separan las fibras, normalmente, no son más anchos de 1 µ m. El endomisio cubre cada fibra muscular y está compuesto de una red densa de fibras de colágena, de 60 a 120 nm de diámetro, algunas de las cuales se continúan con la fina malla fibrilar del perimisio. Como se mencionó anteriormente, es probable que el endomisio también haga conexiones con la membrana basal, una capa de glucoproteínas que yace sobre el exterior de la membrana de la fibra muscular. El tejido conectivo muscular tiene múltiples funciones. 1.- Durante el desarrollo, el tejido conectivo sirve como un soporte sobre el cual se forman las fibras musculares. Cuando se completa el desarrollo muscular, el tejido conectivo continúa manteniendo juntas la fibras musculares y en gran medida determina la estructura de los músculos. 2.- El tejido conectivo laxo del perimisio proporciona un conducto para los vasos sanguíneos y nervios que abastecen las fibras musculares. 3.- El tejido conectivo tiende a resistir el estiramiento pasivo de los músculos y asegura que las fuerzas sean distribuidas de tal forma que disminuye el daño de las fibras musculares. Además, la elasticidad asociada con las fibras de elastina y los paquetes de colágena entretejidas contribuyen a que los músculos recuperen su forma cuando las fuerzas pasivas son retiradas. 4.- El endomisio, por medio de conexiones laterales de la fibra muscular, ,transmite parte de la fuerza contráctil al tendón. Por ejemplo, Street y Ramsey (1965) aplastaron fibras musculares aisladas, causando la retracción de la miofibrillas; cuando la porción intacta de la fibra fue estimulada, la fuerza completa se transmitió aún a través de este "tubo" vacío hacia el extremo de la fibra. Aunque algo de la fuerza podría haber sido transferida a través de los elementos del citoesqueleto (espectrina, distrofina, etc.) por debajo del plasmalema (Fig. 14); el endomisio y la membrana basal podían estar involucrados también a través de estructuras (costámeros) localizadas a nivel de los discos Z (fig. 15). Los costámeros conectan las miofibrillas con el plasmalema y membrana basal y probablemente también al endomisio (McComas, 1996). X.- LA COLAGENA EN LA FUNCION MUSCULAR. Propiedades estructurales de la colágena. La familia de proteínas y genes de colágena. Tipos de colágena. BIOSÍNTESIS Rasgos generales. Procesamiento intracelular. Eventos extracelulares. Funciones de la colágena en el músculo esquelético. X.- LA COLAGENA EN LA FUNCION MUSCULAR. Los tejidos conectivos del músculo tiene efectos sobre el funcionamiento del músculo esquelético en diferentes formas. Clásicamente, se ha visto que la colágena tiene un papel estructural y transmisor de fuerza. Se han sugerido roles en la disipación y almacenamiento de energía de la colágena en las membranas basales (Tidball y Daniel, 1986). El papel esencial de la colágena en los varios tipos de locomoción y en los músculos con diferentes demandas funcionales sugieren variabilidad en las características del tejido conectivo muscular. Sin embargo, pocos estudios se han enfocado sobre las colágenas en los músculos con diferentes propiedades contráctiles. Un estudio realizado por Fernand en 1949 sugiere que los músculos con altas cantidades de tejido conectivo son capaces de realizar movimientos finamente regulados y se ha mostrado que los músculos lentos contienen más colágenas que los músculos rápidos (Garcia-Bunuel y Garcia-Bunuel, 1967; Laurent, el al. 1978; Kovanen, el al. 1980, 1984b). Esto también se mantiene en el nivel de fibras musculares individuales rápidas y lentas (Kovanen, el al. 1984b). Las colágenas son las proteínas fibrosas extracelulares más abundantes y forman del 1 al 9% de la masa seca libre de grasa del músculo esquelético (Lawrie, 1979). Comúnmente existen al menos treinta tipos de colágena genéticamente diferentes (Vuorio, 1986; Pihlajaniemi y Tamminen, 1988), entre los cuales los tipos I, III, IV y V se han detectado en el tejido conectivo muscular (Duance, et al. 1977; Light y Champion, 1984). La elastina es una proteína fibrosa secundaria del tejido conectivo muscular. Se ha visto que es un compuesto del endomisio que cubre las fibras musculares individuales, y puede contribuir al funcionamiento del músculo esquelético como una unidad contráctil. El ácido hialurónico y el sulfato de condroitina son los glucosaminoglicanos del músculo (Gilbreath, el al. 1971). La fibronectina y la laminina, dos glucoproteínas de adhesión, están localizadas en el sarcolema (Stenman y Vaheri, 1978). La laminina, es el más abundante componente no colagenoso de las membranas basales (ver fig. 19), tiene la forma de un entrecruzamiento asimétrico (Rohde, el al. 1979, Timpl, el al. 1979). Es un componente estructural y biológicamente activo (Martin y Timpl, 1987) que se ha propuesto que esté involucrado en el desarrollo y regeneración del músculo esquelético. Sobre bases anatómicas e histológicas el tejido conectivo del músculo esquelético está dividido en epimisio, perimisio y endomisio. Cada músculo intacto esta envuelto por una gruesa capa de tejido conectivo epimisial. Estudios inmunohistoquímicos (Foidart, el al. 1981) y bioquímicos (Light y Champion, 1984) han mostrado que la colágena tipo I es el principal componente y la colágena tipo III un componente menor del epimisio. Un fascículo de varias fibras musculares está rodeado por una capa densa de tejido conectivo perimisial a través del cual pasan los vasos sanguíneos grandes, los pequeños linfáticos y nervios. El perimisio contiene ambos tipos de colágena (tipo I y III) el tipo III forma cerca del 30% del contenido total de colágena (Light y Champion, 1984). El endomisio es la delgada capa de matriz extracelular que rodea cada fibra muscular individual y contiene los capilares y los fibroblastos. El endomisio forma el ambiente íntimo de las fibras musculares individuales permitiendo el intercambio de metabolitos entre las células y los capilares. Ultraestructuralmente, el endomisio incluye al sarcolema y a las fibras de colágena de varias formas y tamaños alrededor de las fibras musculares individuales. Como se describió anteriormente, el sarcolema comprende a la membrana plasmática, lámina basal y lámina reticular. La lámina basal y la lámina reticular juntas forman la membrana basal. Se ha demostrado por métodos químicos (Light y Champion, 1984) e inmunohistoquímicos (Foidart, et al. 1981) que las colágenas tipo I, III, IV y V existen en el endomisio. Las colágenas tipo I y III pueden existir como copolímeros (Keene, et al. 1987), y la mayoría probablemente forman las fibras principales conocidas como fibras reticulares del endomisio. La microscopía electrónica de barrido revela que esas fibras de colágena forman conexiones miocitomiocito y miocito-capilar. Además, una onda densa interconectante de fibras de colágena yacen sobre la superficie de, y en ciertos puntos aparecen incrustadas dentro de la membrana basal (Borg y Caulfield, 1980). La colágena tipo IV y la laminina han sido localizadas por microscopía inmunoelectrónica en las membranas basales del sarcolema. Son por lo tanto componentes de la lámina basal y están distribuidas por toda la lámina densa y lámina rara (Kovanen, 1989). Estudios posteriores por García Bunuel & Garcia Bunuel (1967) y Laurent et al. (1978) mostraron en experimentos utilizando ratas y aves de corral que algunos músculos lentos contenían más colágena que algunos músculos rápidos. Estudios realizados por Kovanen et al. (1980, 1984b) apoyan este hallazgo en ratas. Además, la concentración de colágena endomisial es superior alrededor de las fibras musculares lentas que alrededor de las fibras rápidas en los músculos de rata. (Kovanen, et al. 1984a). Estudios con microscopio electrónico de barrido (Borg y Caulfield, 1980, Borg, et al. 1982) han demostrado diferencias obvias entre músculos rápidos y lentos en el arreglo del tejido conectivo intramuscular. El músculo lento soleo tiene un perimisio mejor desarrollado que el músculo rápido extensor digital largo o plantaris. La colágena aparece como paquetes gruesos ondulados en el perimisio del músculo lento. Paquetes de menor diámetro que indican una red más flexible puede ser observada en los músculos rápidos. Así, además de las características moleculares únicas de la colágena, el arreglo de las estructuras supramoleculares también contribuyen al funcionamiento del tejido conectivo en el músculo esquelético. Propiedades estructurales de la colágena. Las colágenas forman una familia compleja de proteínas que representan la expresión de una mezcla de genes relativamente grande (Vuorio, 1986; Pihlajaniemi y Tamminen, 1988). Sobre las bases de su apariencia morfológica fenotípica en los tejidos, las colágenas pueden ser divididas en colágenas fibrilares y no fibrilares. Todas las colágenas comparten ciertas características, pero difieren principalmente en su tamaño molecular, las interrupciones del dominio de triple hélice y en la formación de estructuras supramoleculares (Martin, et al. 1985). También el grado de modificaciones coy post-translacionales varían entre los tipos de colágenas. La diversidad y características de la familia de las proteínas de colágena han sido revisadas en detalle por varios autores incluidos Bornstein y Sage (1980), Miller y Gay (1982, 1987) y Prockop y Kivirikko (1995). Algunas de las propiedades estructurales características de las colágenas, relevantes para evaluar la significancia de la colágena en el funcionamiento del músculo son descritas brevemente a continuación. La unidad básica estructural de las colágenas fibrilares es una molécula similar a una varilla de cerca de 300 nm de largo que consiste de tres cadenas polipeptídicas largas de cerca de 1 000 residuos de aminoácidos cada una, conocidas como cadenas a. Cada una de las tres cadenas a están enrolladas en torcidas una alrededor de la otra para formar una triple hélice que gira hacia la derecha (Piez, 1984). Por fuera de la porción principal helicoidal, todas las moléculas de colágena contienen cortos telopéptidos no helicoidales. Las moléculas de colágena son agregadas dentro de las microfibrillas que consisten de cinco hileras de moléculas, cada molécula traslapando a las moléculas vecinas por cerca de un cuarto de su longitud. Un número mayor de microfibrillas son empacadas juntas para formar las fibras de colágena (Fig. 20). En el microscopio electrónico las fibrillas de colágena y las fibras aparecen en bandas longitudinales características debido al traslape. El requisito previo para la formación de la triple hélice homo- o heterotrimérica es la secuencia repetida de aminoácidos (-Gli-XY-)n en cada cadena a. La glicina en cada tercera posición hace posible que las tres cadenas a se enrollen firmemente una alrededor de la otra. La presencia de prolina y 4-hidroxiprolina en las posiciones X- y Y-, respectivamente, promueve la estabilidad de la triple hélice por puentes de hidrógeno o por puentes hidrógeno-agua entre las cadenas. Las estructuras intra e intermoleculares son estabilizadas además, por la formación de uniones covalentes reducidas derivadas de lisina. Esas características únicas de la molécula de colágena la hacen firme y la proveen de una elevada resistencia mecánica (Kovanen, 1989; Prockop y Kivirikko, 1995). La superfamilia de proteínas de colágena ahora contiene al menos 19 proteínas formalmente definidas como colágenas y unas diez proteínas que tienen dominios similares a la colágena. Las colágenas más abundantes forman fibrillas extracelulares o estructuras similares a redes, pero las otras cumplen una variedad de funciones biológicas. Algunas de las 8 enzimas post-translacionales altamente específicas relacionadas en la biosíntesis de la una hélice que gira hacia la izquierda y están colágena han sido donadas recientemente (Prockop y Kivirikko, 1995). La familia de proteínas y genes de colágena. El examen de las secuencias del cDNA y DNA genómico con pruebas para colágenas revelaron un gran número de proteínas relacionadas con secuencias repetidas de -GliX-Y- de varias longitudes. Porque fueron descubiertas en estudios para colágenas, las proteínas codificadas fueron definidas como colágenas, aún cuando en algunos casos los dominios triples helicoidales fueron pequeños y la mayoría de la estructura de las proteínas fue globular. También, unas pocas proteínas estudiadas en otros contextos se encontraron conteniendo dominios triples helicoidales pero no fueron definidas como colágenas. La variedad en la estructura de las diferentes colágenas y proteínas relacionadas implica que tienen varias funciones biológicas diferentes. Tipos de colágena. Recientemente Prockop y Kivirikko (1995) han realizado, con detalle, una revisión sobre los tipos de colágena que se describe a continuación. Por simplicidad, la superfamilia de las colágenas sobre la base de su estructura polimérica que forman o por sus rasgos estructurales relacionados puede ser dividida en varias clases: (a) colágenas que forman fibrillas (tipos I, II, III, V y XI), (b) colágenas que forman estructuras parecidas a redes (la familia del tipo IV y los tipos VIII y X), (c) colágenas que se localizan sobre la superficie de las fibrillas de colágena y son conocidas como colágenas asociadas a fibrillas con triples hélices interrumpidas (FACITs que incluyen los tipos IX, XII, XIV, XVI y XIX), (d) la colágena que forman filamentos de cuentas (tipo VI), (e) la colágena que forma fibrillas de anclaje para las membranas basales tipo VII), (f) colágenas con dominios transmembranales (tipos XIII y XVII, y (g) las recién descubiertas colágenas tipos XV y XVII que sólo están parcialmente caracterizadas. Un grupo adicional (h) que consiste de proteínas que contienen dominios triple helicoidales que no han sido definidas como colágenas. Colágenas que forman fibrillas: Todas esas colágenas (tipos I-III, V y XI) son similares en tamaño y en que contienen dominios grandes de triple hélice con cerca de 1 000 aminoácidos o 330 repeticiones -GIi-X-Y- por cadena. Además, también son sintetizadas primero como precursores de gran tamaño, y los precursores necesitan ser procesados para formar colágenas por ruptura de los Npropéptidos y C-propéptidos por proteinasas específicas. Finalmente, son similares en que todas se juntan como fibrillas de estrias cruzadas, en donde cada molécula está desplazada cerca de un cuarto de su longitud relativa con respecto de la molécula vecina más cercana, a lo largo del eje de la fibrilla (Fig. 2 l). El tipo I es la colágena más abundante y se encuentra en una variedad de tejidos. Muchas de las otras colágenas que forman fibrillas tienen una distribución más selectiva en los tejidos. La colágena de tipo I preferentemente forma largas fibras paralelas, el ancho de las mismas varia y usualmente es mayor de 40 nm. La disposición de las fibras depende de su localización y de las demandas funcionales hechas sobre ellas con el resultado de que un alineamiento paralelo es encontrado en tendones, mientras que en la piel y en las cápsulas de órganos las fibras se cruzan unas con otras. Las fibras de colágena tipo I juegan un papel clave como estructuras de soporte con elevada resistencia a la deformación y muy limitada elasticidad, estando así especialmente colocadas para transmitir fuerza. Las fibras formadas por la colágena tipo III normalmente no exceden de un diámetro de 40 nm (Fleischmajer, et al. 1980). Esas fibras prevalecen en tejidos conectivos como los de piel, donde forman estructuras de malla flexibles. Otro nuevo hallazgo con respecto a las colágenas formadoras de fibrillas es que muchas fibrillas in vivo están compuestas de dos o más tipos de colágena. Las estructuras de los genes de las colágenas que forman fibrillas muestran gran similitud. Colágenas que forman redes: incluyen la familia de las colágenas tipo IV encontradas en las membranas basales y las colágenas tipos VIII y X. El dominio colagenoso de la molécula de colágena tipo IV es mayor comparada con la de las colágenas que forman fibrillas y está formado de aproximadamente 1 400 residuos aminoácido en las repeticiones -GIi-X-Y- que están frecuentemente interrumpidas por cortas secuencias no colagenosas. Las secuencias no helicoidales parecen ser un rasgo estructural importante de la triple hélice, necesaria para la regulación no sólo de la flexibilidad de las moléculas sino también de las propiedades elásticas de la red macromolecular de la colágena de tipo IV (Kovanen, 1989). El Nterminal de la molécula contiene un corto dominio no colagenoso y el C-terminal un dominio no colagenoso principal de cerca de 230 aminoácidos. Las moléculas se ensamblan para formar estructuras semejantes a redes en las cuales los monómeros se asocian al Cterminal para formar dímeros y en el Nterminal para formar tetrámeros. Además de esas interacciones extremo-extremo, los dominios triple helicoidales se entrelazan para formar estructuras superenrolladas. La secuencia de las repeticiones del triplete Gli-X-Y- de la colágena tipo IV es frecuentemente interrumpida por dominios que no son triple hélice (Kovanen, 1989). Las otras dos colágenas formadoras de redes similares entre, sí, los tipos VIII y X, difieren en estructura con respecto al tipo IV. Colágenas FACIT (Colágenas asociadas a fibrillas con triples hélices interrumpidas): Estas colágenas (tipos IX, XII, XIV, XVI y XIX) no forman fibrillas por sí mismas pero se encuentran adheridas a las superficies de fibrillas preexistentes de las colágenas que sí las forman. Todas esas colágenas están caracterizadas por dominios cortos de triple hélice interrumpidos por secuencias cortas no colagenosas. La molécula de la colágena tipo IX consiste de tres dominios triple hélice y cuatro dominios no colagenosos. La proteína se encuentra comúnmente sobre la superficie de fibrillas de colágena tipo II unida covalentemente a moléculas de colágena tipo II en orientación antiparalela. Las colágenas de los tipos XII y XIV presentan varias similitudes estructurales con la colágena del tipo IX, particularmente en el dominio colagenoso C-terminal. La colágena tipo XVI y la recién descubierta colágena tipo XIX también muestran similitudes en estructura a las colágenas FACIT y están por lo tanto clasificadas dentro de este subgrupo. Colágena que forma filamentos con cuentas: la única colágena conocida que forma filamentos con cuentas es el tipo VI. Cada una de las tres diferentes cadenas de la proteína contienen un dominio triple hélice muy corto, y el resto consiste de dominios largos globulares N-terminal y C-terminal. Los dominios globulares N-terminal y Cterminal de las tres cadenas contienen repeticiones de 200 residuos. Colágena de fibrillas de anclaje: La colágena tipo VII forma fibrillas de anclaje que unen las membranas basales a placas de anclaje de colágena tipo IV y laminina en la matriz extracelular fundamental. El dominio triple hélice de la colágena tipo VII, el cual es mucho más largo que la triple hélice de cualquier otra colágena, contiene 1 530 aminoácidos en las repeticiones -GIi-X-Y- que son interrumpidas en 19 sitios. Colágenas ____con ____ un ____ dominio transmembranal: dos colágenas recientemente descubiertas contienen un dominio transmembranal y por lo tanto, probablemente no son secretadas dentro de la matriz extracelular. La colágena tipo XIII se encuentra en muchos tejidos. En contraste, la colágena tipo XVII se encuentra principalmente en los hemidesmosomas de la piel. Esas dos colágenas no son homólogas en estructura, pero ambas contienen un solo dominio N-terminal transmembranal que es aparentemente citoplásmico. El resto de la molécula es extracelular. Familia de los tipos xv v xviii: Las colágenas tipo XV y XVIII recientemente descubiertas tienen un dominio globular N-terminal largo, una triple hélice grandemente interrumpida, y un dominio globular C-terminal grande. Ambas colágenas también contienen varios sitios de unión potencial para glucosaminoglicanos unidos a serina y oligosacáridos unidos a asparagina, observaciones que sugieren que esas colágenas pueden estar extensamente glucosiladas. Las colágenas tipo XV y XVIII, se encuentran en muchos tejidos, pero el tipo XVIII está expresado en muy alto nivel en el hígado. Colágenas "no colagenosas": El grupo de proteínas que contienen secuencias colagenosas pero que no son definidas como colágenas incluyen el subcomponente C1q del complemento, la estructura de la cola de la acetilcolinesterasa, las proteínas SP-A y SP-D del surfactante pulmonar, conglutinina, colectina-43, las enzima bacteriana pulanasa, y los receptores de los macrófagos barredores tipo I y II. Los receptores de los macrófagos barredores tipo I y II se asemejan a las colágenas tipo XIII y XVII en que contienen un solo dominio transmembranal precedido por un corto dominio N-terminal citoplásmico. El resto de la molécula es extracelular. BIOSÍNTESIS Rasgos generales. En su revisión, Prockop y Kivirikko (1995) mencionan que las colágenas que forman fibrillas son primeramente sintetizadas como grandes moléculas precursoras conocidas como procolágenas. Los pasos intracelulares para el ensamble de una procolágena (Fig. 22) son, separación de los péptidos de señal, la hidroxilación de los residuos de prolina y lisina en la posición Y en 4hidroxiprolina e hidroxilisina; hidroxilación de unos pocos residuos de prolina en la posición X en 3-hidroxiprolina, adición de galactosa o galactosa y glucosa en algunos de los residuos de hidroxilisina, adición de un oligosacárido rico en manosa en uno o ambos de los propéptidos, asociación del propéptido C-terminal mediante un proceso dirigido por la estructura de ese dominio, y formación tanto de uniones disulfuro intracadenas o intercadenas. Después de que los propéptidos C se han asociado y cada cadena adquiere cerca de 100 residuos de 4-hidroxiprolina, se forma un núcleo de triple hélice en la región Cterminal, y la conformación triple helicoidal se propaga entonces en el N-terminal de manera semejante a un cierre. Después de la secreción de la procolágena desde los fibroblastos, los N-propéptidos son divididos por una procolágena N-proteinasa y los Cpropéptidos por una procolágena C proteinasa separada. La colágena entonces se ensambla por sí misma en fibrillas. Finalmente, la lisiloxidasa transforma algunos residuos de lisina e hidroxilisina en derivados aldehídos para formar series complejas de uniones cruzadas. El ensamble y el proceso en pasos de muchas colágenas no fibrilares es el mismo, pero existen notables excepciones. Muchas colágenas contienen dominios no colagenosos N- y/o C-terminales que no son removidos y por lo tanto no son denominados propéptidos. Varias colágenas sufren N-glucosilación. Tres tipos de colágenas (IX, XII y XIV) son modificadas por adición de cadenas laterales de glucosaminoglicanos, y dos colágenas adicionales (los tipos XV y XVIII) tienen sitios de unión potencial para tales cadenas. Las triple hélices de unas pocas colágenas que pierden los dominios globulares grandes C-terminales (por ejemplo el tipo XII) pueden plegarse por medio de un mecanismo que no incluye la formación de un núcleo en el C-terminal. Procesamiento intracelular. La biosíntesis de las colágenas ocurre al igual que otras proteínas secretadas, de la transcripción genética por medio del procesamiento de los pre-mRNAs en sus respectivos mRNAs para la translación ribosomal del mensaje para las respectivas prepro cadenas a. La excepción es que las cadenas polipeptídicas son modificadas co- y post-translacionalmente en el proceso de muchas reacciones catalizadas por enzimas que pueden ser divididas en eventos intracelulares y extracelulares. De acuerdo con esto, la regulación de la biosíntesis de colágena con respecto a la cantidad, tipo y calidad de los productos finales requiere de procesos de transcripción, translación así como post-translacionales (Kovanen, 1989). Los eventos intracelulares en la biosíntesis de colágena incluyen la hidroxilación de ciertos residuos de prolil y lisil por tres enzimas diferentes, dando como resultado la formación de 4-hidroxiprolina, 3hidroxiprolina e hidroxilisina. La hidroxilación de prolina en la posición 4 influye de manera crítica en la estabilidad de la estructura de triple hélice de la colágena a temperaturas fisiológicas (Berg y Prockop, 1973), mientras que la función de la 3-hidroxiprolina no se conoce. La hidroxilación de residuos de lisina es necesaria para la glucosilación de la colágena en la regional helicoidal y para la formación de ciertos enlaces covalentes intermoleculares. Las enzimas prolil 4-hidroxilasa, prolil 3-hidroxilasa y lisil hidroxilasa son específicas para el dominio helicoidal de la molécula de colágena (Kivirikko y Myllylä, 1982). La formación de triple hélice de las pro-cadenas a previene cualquier hidroxilación posterior. La glucosilación de ciertos residuos de hidroxilisina es catalizada por dos enzimas específicas simultáneamente con la hidroxilación de los residuos de lisina. La adición de galactosa a la hidroxilisina es catalizada por la hidroxilisil galactosiltransferasa. Además, la actividad de las enzimas glucosilantes termina cuando se ha logrado la conformación de triple hélice (Kovanen, 1989). Con la excepción de la prolil 4hidroxilación, grandes variaciones ocurren en el grado de las modificaciones prosttranslacionales en los diferentes tipos de colágena, tanto dentro del mismo tipo en diferentes tejidos y dentro del mismo tejido en diferentes condiciones fisiológicas y patológicas. La actividad de la prolil 4hidroxilasa y la velocidad de biosíntesis de colágena ha mostrado correlación en las diferentes células y tejidos en un gran número de situaciones fisiológicas y patológicas. De acuerdo con lo anterior, las mediciones de la actividad de la prolil 4-hidroxilasa se ha usado para estimar la velocidad de biosíntesis de colágena en diferentes situaciones experimentales y clínicas (Kovanen, 1989). Eventos extracelulares. Después de ser secretadas al espacio extracelular como moléculas de procolágena, los péptidos de los extremos amino y carboxilo son cortados por procolágena peptidasas (Fig. 22), con la consiguiente formación de agregados extracelulares insolubles y entrecruzados, que funcionan principalmente como elementos de soporte dentro del tejido (Smith y Wood, 1997). En el espacio extracelular las moléculas de colágena procesadas se agregan lado a lado, extremo con extremo con un modo de espaciamiento de cuartas partes para formar las fibrillas bandeadas y fibras vistas al microscopio electrónico. La resistencia a la deformación (tensión pasiva) y la insolubilidad de esas fibras se debe a los enlaces cruzados. La reacción oxidativa de desaminación catalizada por la lisil oxidasa inicia los enlaces formando aldehídos reactivos a partir de residuos lisil e hidroxilisil específicos en los telopéptidos COOH- y NH2 terminal. La reacción de los aldehídos con los grupos amino sobre residuos específicos de lisil e hidroxilisil en la región helicoidal de la molécula adyacente resulta en la formación de enlaces intermoleculares. Tales bifuncionales enlaces covalentes aparecen en tejidos como bases de Schiff, que pueden ser aislados en su forma reducida como por ejemplo hidroxilisinonorleucina y dihidroxilisinonorleucina. El tipo de enlace es dependiente del grado de hidroxilación del residuo de lisina en la región telopeptídica. Los enlaces reducidos son intermediarios que parecen convertirse en compuestos estables no reducidos durante la maduración del tejido (Bailey, et al. 1974) uno de esos componentes estables es el 3-hidroxipiridinium el cual es considerado como un enlace estable y trifuncional de la colágena madura (Robins, 1983). Las fibrillas de colágena extracelular son formadas por secreción de una procolágena soluble que es entonces enzimáticamente procesada en una colágena insoluble. Los mecanismos por los cuales otras colágenas son incorporadas dentro de una matriz extracelular insoluble son más inciertos, puesto que presumiblemente ellas deberían ser solubles durante el ensamble intracelular. Un posible mecanismo es que tales colágenas son secretadas como proteínas solubles que une otras macromoléculas después de ser secretadas para formar heteromoléculas insolubles (Prockop y Kivirikko, 1995). Los N- y C-propéptidos de las procolágenas, ambos, deberían ser fraccionados por proteinasas específicas para que las proteínas por ensamble propio formaran fibrillas bajo condiciones fisiológicas. Los Npropéptidos de las colágenas tipo I y II son divididos por la misma procolágena N-proteinasa específica. El N-propéptido de la procolágena tipo III es probablemente dividida por una N-proteinasa diferente. Si otras N-proteinasas específicas se necesitan para dividir otras procolágenas tales como los tipos V y XI no está claro (Prockop y Kivirikko, 1995). La significancia de los enlaces para la estabilidad y para las propiedades físicas y mecánicas de la colágena es obvia a partir de los estudios de varias enfermedades hereditarias del tejido conectivo y de condiciones experimentales en donde se sabe que el defecto afecta los enlaces de la colágena (Eyre, et al. 1984). Funciones de la colágena en el músculo esquelético. La colágena juega un papel vital en todo el cuerpo. En el músculo esquelético desempeña también una función estructural al mantener las células unidas y asegurar una adecuada alineación de las fibras musculares. La matriz de colágena permite la penetración de los nervios y los vasos sanguíneos a todas las partes del músculo. La colágena da la fuerza mecánica y coherencia al músculo y forma parte de un sistema elástico tolerante al esfuerzo que cumple los requisitos para absorber impactos y esfuerzos (Rowe, 1981). La resistencia a la tensión proporcionada por la colágena es debida a la estructura de sus moléculas, fibrillas y fibras. En particular, los enlaces intermoleculares, la orientación y densidad de las fibrillas, las fuerzas de fricción entre las fibrillas y las fibras y por las interacciones físicas y químicas de la colágena con otros componentes estructurales de la matriz extracelular, determinan la resistencia a la tensión de los tejidos conectivos (Kovanen, 1989). La elasticidad muscular es parcialmente proporcionada por la colágena. Para este propósito la organización de las fibrillas y fibras es crítica, ya que las moléculas individuales de colágena, de fibrillas y de fibras por sí mismas son inextensibles. La extensibilidad de la colágena resulta del enderezamiento de las curveadas fibrillas y fibras. Así, cualquier tejido puede ser extendido sin ruptura hasta el punto donde todas las fibras de colágena curveadas están completamente extendidas en dirección de las líneas de esfuerzo (Kovanen, 1989). Debido a su inextensibilidad, las fibras de colágena transmiten la fuerza generada por la contracción muscular activa. La transmisión de la fuerza es posible debido a la continuidad que forman las fibrillas de colágena y las fibras de la lámina basa] muscular a través del endomisio y perimisio hasta el tendón (McArdle, et al. 1996). Está generalmente aceptado que el tejido conectivo contribuye al funcionamiento muscular por medio de componentes elásticos colocados en serie y en paralelo (Huxley, 1974), los determinantes clásicos de las propiedades mecánicas del músculo. El arreglo anatómico de esos elementos no se ha determinado completamente. Sin embargo, se piensa que los componentes elásticos en paralelo los constituyen el epimisio, perimisio y endomisio, mientras que los componentes elásticos en serie los constituyen primeramente los puentes cruzados entre la actina y la miosina, pero también el tendón y parte del endomisio (Huxley y Simmons, 1971; Huxley, 1974; Borg y Caulfield, 1980). Durante la locomoción normal donde el estiramiento precede al acortamiento, puede ser almacenada energía elástica en el músculo (Cavagna y Citterio, 1974). Esta energía almacenada puede ser utilizada durante la subsecuente contracción sumada a la generación de fuerza del músculo (Tidball y Daniel, 1986). Los puentes cruzados son considerados como las estructuras responsables para el almacenamiento de la elasticidad activa (Huxley y Simmons, 1971). Sin embargo, estudios recientes sugieren que las subunidades de la meromiosina pesada no son los sitios primarios del almacén de energía elástica, sino que pueden estar implicadas las fibrillas de colágena sobre la superficie celular o sobre la membrana basal (Tidball y Daniel, 1986). Además de su participación en la biomecánica del músculo estriado, la colágena también ha mostrado tener un papel en el proceso del desarrollo muscular (Bailey, el al. 1979). La regeneración del tejido muscular después de la degeneración postraumática también incluye a la colágena como un componente necesario (Allbrook, 1973). Hoy sabemos que otras estructuras moleculares contribuyen importantemente en las propiedades mecánicas del músculo esquelético, como son la titina, la nebulina, las proteínas de los discos Z y de la región M, de los filamentos intermedios y del citoesqueleto (ver capítulo V y VI). XL- INTERACCION MUSCULO-TENDON. Estructura del músculo esquelético completo. Los extremos de las fibras musculares están especializados para transmitir la fuerza al tendón. Propiedades mecánicas del tendón. Significado fisiológico de la flexibilidad del tendón. XI.INTERACCION TENDON. Estructura completo. del músculo MUSCULO- esquelético La inspección de los músculos esqueléticos revela un conjunto de rasgos comunes. Los músculos esqueléticos se unen a los huesos por medio de estructuras de tejido conectivo conocidas como tendones. Los tendones conectan ambos extremos del músculo a la cubierta más externa del hueso, el periostio. Algunas veces la cantidad de tendón es tan pequeña que las fibras musculares parecen surgir del propio hueso. Sin embargo, el análisis microscópico del extremo de estas fibras musculares muestra tejido conectivo similar al del tendón, interpuesto entre las fibras y los huesos. Al origen o la inserción tendinosa, que es muy amplia y escasa se le denomina aponeurosis. En el nivel anatómico burdo, cada músculo tiene un origen (el extremo proximal del músculo) y una inserción (el extremo distal del músculo). Con frecuencia el origen del músculo es más ancho que la inserción, en esta última las fibras convergen en un tendón (por ejemplo el músculo soleo). Sin embargo, a pesar del conocimiento del origen y la inserción de un músculo, no es posible describir simplemente que un movimiento resulta de la contracción muscular basándonos sólo en esta información, porque los músculos con frecuencia cruzan más de una articulación y por lo tanto ejercen su influencia en lugares variados. Los tejidos del tendón están entremezclados con las fibras de colágena en el hueso. Lo que forma una unión poderosa músculo-hueso que es difícil de separar excepto durante el estiramiento severo, pudiendo ser literalmente desprendido de este último. Cerca del 70% de la masa seca del tendón está formada por colágena. La fuerza muscular es transmitida directamente desde el tejido conectivo interno del músculo al tendón, entonces este jala a. los huesos en sus puntos de unión. La fuerza ejercida en la unión tendinosa bajo varias condiciones de esfuerzo muscular varía desde aproximadamente 20 a 50 Newtons por cm2 de área de corte transversal (McArdle, et al. 1996). La mayoría de los textos de anatomía enseñan que los tendones funcionan para conectar los músculos esqueléticos a los huesos. Sin embargo, los tendones no deberían ser considerados como simples estructuras de unión rígidas. Es bien conocido que los tendones son tejidos relativamente flexibles (elásticos) (Lieber, 1992). Los extremos de las fibras musculares están especializados para transmitir la fuerza al tendón. Conforme se acercan al tendón de inserción, las fibras musculares se adelgazan considerablemente disminuyendo su diámetro cerca de un 90%; el adelgazamiento de la fibras da al músculo voluminoso su forma fusiforme típica. En los extremos finales de cada fibra existe un plegamiento extensivo del plasmalema. Los pliegues se interdigitan con los procesos del tejido conectivo. Este plegamiento asegura que la fuerza contráctil sea distribuida sobre una amplia área, reduciendo el stress sobre la superficie de la fibra. También, a causa de que la fuerza es transmitida en ángulo, ocasiona que el esfuerzo sea dividido y las estructuras divididas, tales como las diferentes capas en los extremos de las fibras, son más resistentes para esfuerzos cortantes que cuando se aplican fuerzas ortogonales. Con el microscopio electrónico, se puede ver que las miofibrillas no se extienden por todo el plasmalema: en lugar de eso, los filamentos delgados (actina) están insertados inmediatamente por debajo del plasmalema dentro de una capa densa de material el cual contiene las proteínas de unión vinculina, talina, paxillina y tensina (Fig. 16). En el modelo hipotético, se piensa que la talina está unida al receptor de fibronectina; este receptor atraviesa el plasmalema y , en el interior celular, se conecta con paquetes de fribonectina. El receptor de fibronectina pertenece a una clase de proteínas, las integrinas, que se extienden en la superficie de la membrana (McComas, 1996). En la superficie externa de la membrana se localiza una desarrollada membrana basal, la cual consiste de varias capas. Tal como existen proteínas de conexión sobre la cara interna del plamalema, también existen en la cara externa; entre las cuales se incluyen la fibronectina y tenascina, que unen las moléculas de intergrinas del plamalema con las fibras de colágena tipo I del tendón (McComas, 1996). Propiedades mecánicas del tendón. Si un tendón se conecta físicamente a un transductor de fuerza y es estirado bajo una carga, es posible medir el alargamiento del tendón. El cambio en la longitud del tendón puede ser medida en unidades absolutas (por ejemplo, mm) y puede ser expresada, con respecto a la longitud inicial del tendón, como deformación: 1 -1o ε =-----------------1º donde 1 es la longitud del tendón, lo es la longitud inicial del tendón, y c es la deformación. La deformación es, por lo tanto, el cambio en la longitud del tendón con relación a su longitud inicial y es un método conveniente para expresar el estiramiento de los materiales. (Cuando un tendón es tensado y se mide la deformación, se obtiene una curva como la que se muestra en la figura 23B. Si, en lugar de la tensión del tendón, se normaliza la tensión con respecto al área de corte transversal del tendón, se puede calcular el esfuerzo del tendón como: F σ = -------------------A donde F es la carga del tendón (en Newton de carga o fuerza), A es el área de corte transversal del tendón (en unidades de área tales como m2), y a es el esfuerzo (en unidades de Nlm2, las cuales se abrevian como Pascales o Pa). Expresando la carga en términos de esfuerzo y la deformación, es posible comparar las propiedades de materiales de diferente formas y tamaños. Un parámetro interesante de comparar es la dureza relativa (módulo de Young) de los materiales, el cual es simplemente el cambio en esfuerzo para un cambio dado de deformación. En otras palabras, el módulo de Young (E) puede ser calculado como: σ E = -------------ε Puesto que la deformación no tiene unidades, las unidades para el módulo son las mismas que las de esfuerzo, es decir, Pascales. Los valores típicos de los módulos del músculo, tendón y hueso son 200 kPa, 1 GPa, y 20 GPa respectivamente (Lieber, 1992), Como se observa en la figura 23B, el tendón es muy flexible en la región de baja carga de la curva esfuerzo-deformación y se le conoce como región "del dedo pulgar" (Butler, et al. 1978). Mientras se han hecho numerosas mediciones de las propiedades cargadeformación del tejido conectivo, se han realizado muy pocas bajo condiciones fisiológicas, es decir, bajo condiciones de carga que podrían ser supuestas basadas sobre la resistencia de los músculos unidos. Estimaciones de la deformación del tendón durante la contracción muscular se han realizado por Zajac (1989) basadas sobre valores de la literatura y recientemente se ha medido directamente durante la contracción muscular por Lieber et al. (1991 a y 1991 b). Los dos estudios concuerdan que los tendones se deforman aproximadamente 3% en músculos con tensión tetánica máxima. Así, podríamos considerar que los músculos están conectados a los huesos por medio de conectores que se deforman durante la contracción muscular. De hecho, el nivel de sofisticación va más allá en las mediciones experimentales que han demostrado que diferentes regiones del tendón (Fig. 24) tienen diferentes propiedades- el tendón más próximo al hueso es cerca de cinco veces más duro que el tendón que está conectado a las fibras musculares (Lieber, 1992). Significado fisiológico de la flexibilidad del tendón. Cual es la significancia fisiológica de la flexibilidad del tendón? Cuando un músculo desarrolla fuerza, los tendones se deformarían, permitiendo el acortamiento del músculo. Esta es una razón de que la activación muscular en un ángulo fijo de unión nunca produciría una verdadera contracción isométrica. Sin embargo, a causa de la flexibilidad del tendón, una unidad músculo-tendón tendría un elevado rango operativo en relación al rango atribuido a las fibras musculares solas. Esto es porque algo del cambio de longitud que podría requerirse que lo tomarán las fibras musculares, en realidad es tomado por lo tendones. Así, uniendo los músculos a los huesos por medio de tendones flexibles, se aumenta el rango operativo de la unidad músculo-tendón. Por supuesto, el inconveniente de este arreglo es que existiría algo de retardo desde el tiempo cuando el músculo desarrolla tensión a cuando el hueso comienza a moverse. Así tenemos un trueque entre el aumento de rango y el aumento de control. Recientemente, el morfologista funcional británico Alexander R. McNeil (1988) presentó varios ejemplos biológicos de sistemas flexibles y su influencia en la función normal. Aquí basta con decir que la cantidad relativa de tendón comparada con la de las fibras musculares determinará la magnitud del incremento en el rango operativo de la unidad músculo-tendón. De hecho, si se aumenta la longitud del tendón, el rango operativo y la longitud correspondiente al pico de fuerza cambia aún más. De alguna manera, entonces, la longitud del tendón es un parámetro de diseño en gran parte del mismo modo que lo es la arquitectura del músculo (Lieber, 1992). XII.- ARQUITECTURA MUSCULAR. Determinación experimental de la arquitectura del músculo esquelético. Área fisiológica de corte transversal. Los músculos delgados largos están divididos en compartimientos. Alineación de los sarcómeros en una fibra muscular. La plumación produce más fuerza. Longitud de la fibras en proporción a la longitud del músculo. XII.- ARQUITECTURA MUSCULAR. El músculo esquelético no está altamente organizado sólo a nivel microscópico; en el arreglo de las fibras musculares en el nivel macroscópico también se observa un elevado nivel de organización. Haciendo comparaciones entre varios músculos, se observa que la distribución del tipo de fibras tiene importancia, pero no hay duda de que un factor también importante en la determinación de las propiedades contráctiles del músculo es la arquitectura muscular. La arquitectura del músculo esquelético se define como "el arreglo de las fibras musculares con respecto al eje de la generación de fuerza". Mientras que las fibras musculares entre músculos de diferentes tamaños tienen un diámetro relativamente uniforme , el arreglo de esas fibras puede ser diferente (Lieber, 1992). Determinación experimental de arquitectura del músculo esquelético. la El pionero de los estudios de la arquitectura muscular fue el anatomista Carl Gans (1982). Gans y sus colegas desarrollaron métodos para la determinación de la arquitectura del músculo basándose en la microdisección de músculos completos. Los músculos se fijaron químicamente para mantener su integridad durante la disección. Los músculos fueron fijados en su posición unida al esqueleto para conservar su longitud fisiológica. Después de la fijación, se desprendieron los músculos del esqueleto, se determinó la masa, y se midieron el ángulo de plumación y la longitud de los músculos. El ángulo de plumación se determina a partir del ángulo de plumación promedio de las fibras superficiales del músculo. En las mediciones de la longitud muscular, es importante notar que la longitud muscular se define como la distancia que hay desde el origen de las fibras más proximales hasta la inserción de las fibras más dístales. Como se mencionó previamente, la longitud de las fibras musculares nunca es la misma que la del músculo completo. La longitud de las fibras musculares puede ser determinada en tejidos fijados, sólo por la microdisección de las fibras individuales. En general, al menos que los investigadores sean explícitos, cuando se refieren a la longitud de las fibras musculares, se están refiriendo a la longitud del fascículo de fibras musculares (Lieber, 1992). Es difícil aislar fibras intactas, las cuales corren desde el origen hasta la inserción, especialmente en los tejidos de mamífero (Sacks y Roy, 1982). El paso experimental final para realizar el análisis estructural es determinar la longitud sarcomérica dentro de un fascículo aislado. Esto es necesario con el fin de compensar las diferencias en las longitudes musculares que ocurre durante la fijación. En otras palabras, si nosotros concluimos que un músculo es "largo" debemos estar seguro que es verdaderamente "largo" y que no fue fijado en una posición en la que los sarcómeros están estirados. Por otro lado, en las mediciones de los músculos que son "cortos" debemos estar seguros que no fueron fijados en longitudes sarcoméricas cortas. Para permitir tales conclusiones las mediciones de la arquitectura son siempre normalizadas o "ajustadas" a una longitud sarcomérica constante. Habiendo obtenido la masa muscular, la longitud de las fibras, la longitud sarcomérica, la longitud muscular y el ángulo de plumación, pueden ser calculados un gran número de parámetros que resumen la arquitectura muscular. Esos parámetros tienen una relación directa con las propiedades contráctiles del músculo completo. Áreapes yo comen fisiológica de corte transversal. Después de medir los parámetros típicos de la arquitectura muscular, se puede calcular el área fisiológica de corte transversal (PCSA). Este valor casi nunca es el área de corte transversal del músculo en cualquiera de los planos anatómicos tradicionales, medida con métodos convencionales. Teóricamente, la PCSA representa la suma de las áreas de corte transversal de todas las fibras musculares contenidas en un músculo. Se puede calcular usando la ecuación propuesta por Gans y verificada experimentalmente por Roland Roy y Reggie Edgerton (Lieber, 1992): Masa Muscular (g) • cos θ PCSA (cm )= ________________________ ρ (g/cm3) - long. de la fibra (cm) 2 En la ecuación, p representa la densidad muscular (1.056 g/cm3 para los músculos de mamífero) y 0 representa el ángulo de plumación de la superficie. Si separamos la ecuación en dos componentes, la razón de ser de esta expresión se vuelve clara. Primero, la masa muscular dividida entre la densidad es igual al volumen muscular: Masa Muscular (g) 3 Volumen (cm ) _ ___________________ ρ (g/cm3) Si el músculo fuera de forma cilíndrica; dividiendo el volumen entre la longitud (longitud de la fibra) se podría representar el área de corte transversal de un cilindro: Volumen (cm3) CSA (cm2) = ____________________ long. de la fibra (cm) Puesto que, en el ejemplo, la longitud de la fibra no es igual a la longitud de un cilindro, el área no es una área real; más bien, es una área teórica que podría ser ocupada por un cilindro con una longitud igual a la de las fibras. Ahora, puesto que las fibras pueden estar orientadas en algún ángulo con relación al eje de la generación de fuerza, deberá ser incluido el término del coseno: PCSA (cm2) = CSA (cm2) - cos θ A causa de que este concepto será útil en la siguiente etapa, considere la situación mostrada en la figura 25 (panel superior). Supongamos que una fibra muscular jala con F unidades de fuerza en un ángulo 0 relativo al eje de generación de la fuerza. Una cierta cantidad de la fuerza de la fibra no sería transmitida a lo largo del eje. Sólo un componente de la fuerza de la fibra muscular podría ser transmitida realmente a lo largo del eje del músculo. En el triángulo de la figura 25 se puede ver que el componente de la fuerza muscular transmitida sería F-cos , puesto que: F´ cosθ = ________________ F donde F es igual a la fuerza generada por la fibra muscular y F sería igual a la fuerza transmitida en el eje longitudinal del músculo, y siempre sería menor que F puesto que coso siempre es menor que 1. En otra palabras, la plumación por sí misma resulta en un pérdida de fuerza muscular en relación a un músculo con la misma masa y longitud fibrilar pero con cero ángulo de plumación. ¿Porqué el sistema está diseñado de este modo, de tal forma que se pierda la fuerza? Considere la alternativa. Si el ángulo de plumación fuera cero, el tamaño absoluto del músculo podría impedir su colocación en muchas partes del cuerpo debido al gran número de fibras que podrían tener un PCSA igual a un CSA anatómico. Así, parece que la plumación es una estrategia de ahorro de espacio aún cuando esto tiene un costo en la generación de fuerza. El ángulo de plumación no parece tener una influencia desventajosa sobre el PCSA a pesar de este argumento. Esto es porque, como ya se conoce, el coseno de 0° es 1 y el coseno de 30° (que puede ser un gran ángulo de plumación y se encuentra raramente) es 0.87 lo que representa sólo una pérdida de fuerza del 13%, pero un incremento en la habilidad de empaquetar fibras. (Lieber, 1992). Los músculos delgados largos divididos en compartimientos. están Se ha establecido que las fibras en los largos músculos delgados corren desde un extremo del músculo hasta el otro, y verdaderamente los números dados en la tabla No. 1 están basados sobre esta premisa. Bajo el microscopio, sin embargo, los músculos voluminosos se observan divididos en compartimientos por una o más bandas fibrosas transversales,-, el sartorio tiene cuatro de tales componentes, el semitendinoso tiene tres, y el bíceps femoral y gracilis tienen dos cada uno. A causa de esos compartimientos, las fibras musculares más largas son de aproximadamente 12 cm, lo cual corresponde a 5.5x104 sarcómeros. Cada compartimiento podría tener su propio aporte nervioso, y a menudo fibras nerviosas individuales inervan a las fibras musculares en compartimientos adyacentes. Para asegurar que ocurra la contracción sincronizada a lo largo del músculo, la enervación compartimentalizada hace posible que el músculo voluminoso se acorte rápidamente. Podría ser también que los compartimientos permitieran una mejor distribución efectiva de factores neurotróficos desde la motoneurona a las fibras musculares (McComas, 1996). Alineación de los sarcómeros en una fibra muscular. El acomodo de las fibras musculares varia en relación al eje longitudinal del músculo (este eje se determina trazando una línea imaginaria a lo largo del origen e inserción del músculo, o relacionando el ángulo de la fibra con respecto al eje en el cual se genera la fuerza). Esta diferencia en la alineación de los sarcómeros juega un importante papel en la capacidad total del músculo para generar fuerza (McArdle, et al. 1996). Los tipos de arreglos son tan numerosos como los propios músculos, pero por conveniencia podemos discutir tres tipos de arquitectura. Los músculos con fibras que se extienden paralelamente al eje longitudinal en el cual se genera la fuerza del músculo (por ejemplo el bíceps braquial) son denominados músculos con arreglo paralelo ó longitudinal, también son llamados músculos fusiformes o en forma de huso, porque ellos se adelgazan en la unión tendinosa (Fig. 25 abajo, izquierda). Las fibras que se proyectan paralelamente al eje nunca abarcan la longitud completa del músculo. En contraste, en algunos de los músculos más largos, las fibras están insertadas oblicuamente en el tendón y, a causa de su semejanza con una pluma, este arreglo es denominado plumación. Un músculo puede ser plumado o en forma de abanico porque los fascículos (paquetes de fibras) se dirigen en un ángulo de plumación, el ángulo entre la fibra y el eje varía desde 0° a 30° (Lieber, 1992). En el músculo soleo, por ejemplo el ángulo de plumación es de aproximadamente 25°, mientras que en el vasto medial, el ángulo de plumación es de 5°, y no existe ángulo de plumación para el músculo sartorio (McArdle, et al. 1996). A los músculos con fibras que están orientadas en un sólo ángulo con relación al eje de generación de fuerza, se les denomina músculos uniplumados (Fig. 25 abajo). Es obvio que cuando se preparan disecciones musculares la mayoría de los músculos cae dentro de la categoría más general, los músculos multiplumados -que son músculos compuestos de fibras que están orientadas en varios ángulos con respecto al eje de generación de fuerza (Fig. 25 abajo, derecha). La arquitectura muscular es crítica para el entendimiento de las propiedades funcionales de los músculos con diferente tamaño (Lieber, 1992). Las fibras en un músculo fusiforme están orientadas paralelamente al eje longitudinal del músculo. Este arreglo facilita una velocidad rápida de acortamiento muscular. Un arreglo de fibras uniplumadas, en el cual las fibras musculares están en ángulo oblicuo con respecto al tendón, generan una área de corte transversal efectiva mayor que la de los músculos fusiformes. También, los músculos con mayor plumación, aunque lentos en la velocidad contráctil, son capaces de producir mayor fuerza en comparación de los músculos fusiformes (otros piensan que es igual) a causa del mayor número de sarcómeros que contribuyen a la contracción muscular. Un músculo biplumado tiene dos grupos de fibras, que se localizan oblicuamente sobre ambos lados de un tendón común (por ejemplo, los músculos gastrocnemio y el recto femoral), mientras que un músculo multiplumado tiene más de dos grupos de fibras que convergen en diferentes ángulos sobre un tendón común (por ejemplo el deltoides). Las fibras de un músculo plumado son generalmente más cortas que la de los músculos fusiformes, pero poseen un mayor número de fibras individuales. A causa de sus cortas longitudes individuales, los músculos plumados no son capaces de producir un rango amplio de movimientos como lo hacen los músculos fusiformes (McArdle, et al. 1996). La plumación produce más fuerza. Es notable cómo el grado de plumación afecta directamente la cantidad de sarcómeros que están presentes por área de corte transversal en una fibra particular. En una fibra fusiforme (sin plumación), el área de corte transversal de la fibra representa la sección transversal anatómica verdadera (McArdle, et al. 1996), ya que en la mayoría de los músculos del humano, las fibras en este tipo de músculos se localizan en un eje longitudinal. En un músculo plumado, por otra parte, el área de corte transversal es mayor porque incluye más sarcómeros dentro de un volumen muscular dado. El término área fisiológica de corte transversal (PCSA) se refiere a la suma de las áreas de corte transversal de todas las fibras dentro de un músculo particular. En un ángulo inusual de plumación tan grande como 30°, existiría sólo una pérdida del 13% de la capacidad de fuerza en una fibra individual, pero aumentaría la habilidad de empaquetamiento total de la fibra (Lieber, 1992). Así, la plumación per se permite empacar un gran número de fibras dentro de una pequeña área de corte transversal. Las fibras musculares en un músculo plumado son obviamente más cortas que las de los fusiformes voluminosos y, como ellos tiran del tendón en ángulo, no toda su fuerza alcanza el tendón; es el coseno del ángulo de inserción dentro del tendón lo que determina la fracción de la fuerza transmitida. La ventaja de la plumación es que el área de sección transversal efectiva del músculo se incrementa, puesto que así existen muchas más fibras musculares que en uno fusiforme del mismo tamaño. La fuerza desarrollada por el músculo, la cual depende del área de sección transversal del conjunto de fibras, está aumentada proporcionalmente. Una consecuencia menos obvia de la plumación es que la distancia movida por un tendón central durante la contracción es realmente mayor que la cantidad de acortamiento de las fibras musculares. Este efecto puede ser también una ventaja, con esto se permite a las fibras musculares funcionar sobre la parte óptima de sus curvas tensión-longitud (McComas 1996). Longitud de la fibras en proporción a la longitud del músculo. La proporción de la longitud de una fibra individual con respecto a la longitud total del músculo generalmente varía entre 0.2 y 0.6. Esto indica que en los músculos más largos (por ejemplo, los músculos de los miembros superiores e inferiores), las fibras individuales son aún más cortas que la longitud total del músculo (Lieber, 1992). Esto se ilustra en la figura 26 para cuatro músculos del miembro inferior. Sobre promedios, los músculos cuadriceps tienen ángulos de plumación de 4.6°, PCSAs de aproximadamente 21.7 cm2, y longitud de las fibras de 68 mm. Esto contrasta con los valores promedio del músculo bíceps femoral, el cual tiene fibras relativamente largas (111 mm) y PCSAs intermedios (1.7 cm 2). En términos de generación de fuerza, los músculos cuadriceps tienen aproximadamente 50% más capacidad que el bíceps femoral, el cual está diseñado para una rápida velocidad de acortamiento. Esto sugiere que el bíceps femoral puede ser susceptible de rasgarse si existe un desbalance rápido entre la fuerza ejercida por el cuadriceps y por el bíceps femoral, como cuando se corre velozmente hacia adelante (McArdle, et al. 1996). La curva muscular fuerza-longitud para un músculo fusiforme muestra que éste tiene un mayor rango de trabajo y el más bajo esfuerzo máximo debido a sus largas fibras individuales y a sus pequeños PCSAs. Lo opuesto ocurre para un músculo plumado, de fibras más cortas y grandes PCSAs. En este caso, la capacidad de fuerza ejercida es cerca de dos veces mayor. Para la curva muscular fuerza-velocidad, el músculo fusiforme con fibras más largas puede tener una elevada velocidad contráctil pero muy baja fuerza máxima (McArdle, et al. 1996). Figura 26.- Propiedades de la arquitectura muscular en el miembro inferior. En la parte superior de la figura se observa diferentes grupos de músculos; los músculos con fibras cortas están diseñados para una elevada producción de fuerza debido a su baja proporción de longitud de la fibra (FL)-longitud muscular (ML) y a su relativamente gran área de corte transversal. Los músculos con fibras largas, por otro lado, están diseñados para una elevada fuerza contráctil a causa de proporción relativamente elevada de longitud de la fibra-longitud muscular. En la parte inferior se muestran dos músculos hipotéticos, el plumado (de fibras cortas) y el fusiforme (de fibras largas) de la misma longitud y misma cantidad de maquinaria contráctil. Las curvas musculares fuerza-longitud (A) muestran que los músculos fusiformes tienen un rango de trabajo mayor y una menor generación de fuerza máxima comparada con el grupo de músculos plumados. Esto es debido a lo siguiente: para un cambio dado en la longitud muscular los sarcómeros individuales se alargan menos con un cambio de longitud muscular a ser distribuida sobre más sarcómeros. La mayor generación de fuerza se debe a su mayor área fisiológica de corte transversal (PCSA) (se observa en el inserto de la parte inferior, lado izquierdo). La curva muscular fuerza -velocidad (B) muestra que los músculos fusiformes con fibras más largas (inserto de la parte inferior, derecha) tienen una alta velocidad contráctil pero una menor generación de fuerza máxima. Tomado de: McArdle el al.: Exercise Physiology. 4th. ed.: Williams & Wilkins; 1996. p. 322. XIII.- DESARROLLO DEL MUSCULO Y FIBRAS MUSCULARES. Proyección axónica -el nervio se reúne con el músculo -. Miogénesis -nacimiento de la fibra muscular -. Sinaptogénesis -el nacimiento de la unión neuromuscular -. Eliminación sinóptica - el toque final -. Desarrollo de tipos de fibras musculares específicas. Células satélite: reservas para la reparación en la lesión de las fibras musculares. XIII.- DESARROLLO DEL MUSCULO Y FIBRAS MUSCULARES. El desarrollo del músculo ha sido dividido en cuatro fases, algunas de las cuales ocurren simultáneamente. Los cuatro procesos son (a) proyección axónica (el proceso por el cual los axones se desplazan en la periferia hasta llegar a los músculos), (b) miogénesis (formación de células musculares), (c) sinaptogénesis (formación de uniones neuromusculares entre el nervio motor y la fibra muscular), y (d) eliminación sináptica (el proceso que elimina las conexiones musculares "extra"). Los estudios de cada paso en el proceso de desarrollo han usado varios modelos experimentales. Entre los que se incluyen preparaciones de cultivo de células in vitro (para estudiar la diferenciación de células musculares) y denervación y reinervación de músculos maduros (para estudiar las interacciones nervio-músculo). Tomados juntos, esos estudios proporcionan una base sobre la cual se apoya el entendimiento del desarrollo muscular (Lieber, 1992). completamente de los nervios espinales apropiados. Esta proyección neural ocurre antes de que cualquier masa muscular primitiva contenga fibras musculares. Así la especificidad comienza desde que los nervios crecen y se alejan del cuerno ventral de la médula espinal. El nervio lleva a cabo esta proyección virtualmente sin ningún error; todos los nervios encuentran los músculos correctos. En un experimento realizado por Landmesser y colaboradores enfatizaron la interacción entre el músculo y el nervio (Lance-Jones y Landmesser, 1978). Quirúrgicamente cambiaron la localización topográfica de dos masas musculares antes de la proyección para ver si los axones podrían simplemente inervar cualquiera de las masas, o, si en lugar de eso, podría alcanzar la masa muscular correcta. En efecto, los axones en crecimiento se desviaron e inervaron los músculos correctos. Algunas señales existen entre los nervios y músculos, las ideas más comunes sugieren que algo de la especificidad resulta de la dirección de los axones en respuesta a moléculas extracelulares específicas. Proyección axónica -el nervio se reúne con el músculo -. Es importante establecer desde el principio que las conexiones entre los músculos y los nervios son bastante específicas. Los nervios motores que salen de la raíz ventral (anterior) de la médula espinal son procesos largos que se extienden desde los cuerpos celulares de las motoneurona localizadas a lo largo de la columna motora lateral del cuerno ventral. La información más detallada con respecto a la proyección axónica se ha obtenido de los estudios realizados en el miembro posterior de pollo. Landmesser et al. (1980) demostraron que muy temprano en el desarrollo, los nervios que se proyectan en las masas musculares están compuestas casi Miogénesis muscular -. -nacimiento de la fibra El músculo esquelético proviene de los somitos del embrión (los somitos son las masas de tejido muscular primordial que están presentes a intervalos a lo largo de la longitud del embrión). Conforme ocurre el desarrollo dentro de los somitos, aparecen las células mononucleadas individuales precursoras de las fibras musculares (Fig. 27), los mioblastos. Estos son un tipo celular primitivo, muy semejante a los fibroblastos más genéricos. Uno de los primeros pasos en la miogénesis es la agregación de los mioblastos en grupos. Grupos de mioblastos comienzan a fusionarse para formar pequeñas células multinucleadas conocidas como miotubos, que miden cerca de 100 a 300 µm de longitud. El incremento en longitud ocurre por fusión de más mioblastos sobre los extremos del miotubo. Los primeros miotubos formados son conocidos como miotubos primarios. Los miotubos primarios, junto con algunas células asociadas menos diferenciadas, se separan en grupos que están rodeados por una cubierta conocida como membrana basal o lámina basal. En este momento, más mioblastos comienzan a agregarse por debajo de la lámina basal de miotubos primarios, utilizando a éstos como un andamio estructural. Esos mioblastos subsecuentes también se fusionan en miotubos, conocidos como miotubos secundarios. Ahora los grupos de células están compuestos en su mayoría de los miotubos primarios, sus miotubos secundarios asociados y de mioblastos no fusionados conocidos como células satélite. Avanzando en el desarrollo, los miotubos primarios comienzan a verse más parecidos a una fibra muscular madura, el núcleo ha sido desplazado desde el centro de la fibra a la periferia, como consecuencia del "llenado" progresivo de la fibra con las proteínas contráctiles. Si una fibra muscular es teñida en esta etapa con colorantes para la proteína contráctil miosina (la proteína más abundante del músculo), la fibra se asemeja en forma, a una dona puesto que las proteínas cóntráctiles primero llenan la periferia, dejando la zona central desprovista de proteínas contráctiles. Los miotubos secundarios también comienzan a madurar como fibras en esta etapa, así que las células satélite y los miotubos primarios y secundarios están contenidos dentro de una sola membrana basal. En esta etapa, el nervio motor está listo para formar la unión neuromuscular (Lieber, 1992). Sinaptogénesis -el nacimiento de la unión neuromuscular -. La unión neuromuscular (o placa motora terminal) es una sinápsis cuyo neurotransmisor químico es la acetilcolina (ACh) que se usa para llevar la información desde el nervio hasta el músculo a través de la hendidura sináptica. La unión neuromuscular (UNM) es un ejemplo de una sinápsis colinérgica. En las etapas tempranas del desarrollo, los receptores de ACh se localizan difusamente en toda la fibra muscular. Los receptores son proteínas integrales específicas de la membrana celular (sarcolema). Cuando el nervio contacta con la fibra muscular, los receptores de ACh comienzan a agruparse alrededor del sitio del contacto nervioso y son "entrampadas" por el nervio. El mecanismo del proceso de entrampe no es conocido, pero dos interesantes observaciones se han hecho que podrían poner en claro tal mecanismo. Primero, Poo Mu-Ming demostró que los receptores de ACh migran en un modo específico cuando se exponen a campos eléctricos externos (Poo, 1982). El investigador sugiere que por sí mismo el proceso de excitación nervioso, el cual genera pequeños campos eléctricos en la placa terminal (el llamado potencial de placa terminal), podría "atraer" y entrampar los receptores de ACh en una manera de retroalimentación positiva: conforme los receptores de ACh son atrapados, son generados potenciales de placa terminal más grandes, entrampando más receptores, originando potenciales de placa terminal más grandes, etc. Otra interesante observación fue que, en seguida del contacto nervio-músculo, los núcleos por debajo del receptor de ACh (se recuerda que las células musculares son multinucleadas y, por lo tanto, tienen cientos de núcleos a lo largo de su total longitud) comienzan a dirigir la síntesis de RNAm del receptor de ACh. El efecto completo del contacto nervioso con la fibra, por lo tanto, quizás por esos dos mecanismos es disminuir el número de receptores que no están en la UNM e incrementar el número de receptores de ACh en la UNM. En el sistema neuromuscular maduro, la denervación da como resultado la inversión de ese proceso -un incremento de receptores de ACh lejos de la UNM-. Es interesante que el aumento de los receptores en estas condiciones experimentales, puede ser evitado por la estimulación eléctrica directa de las fibras musculares (Lieber, 1992). Después de que se forma la UNM, la fibra muscular pierde su receptividad para la formación de UNM en otros sitios. Así, siempre y cuando un músculo esté normalmente inervado, éste ya no será receptivo para que otros axones lo inerven. La actividad de la fibra muscular por sí misma parece ser un factor crucial en esta pérdida de receptividad, porque si un músculo que está inervado normalmente es paralizado por medios químicos, una sinápsis ectópica (sinápsis en lugares distintos al de la UNM) se forma fácilmente (Bennett, 1983). Después de la formación inicial de la UNM, varias motoneuronas forman sinápsis en ese punto. El número real de motoneuronas por sinápsis varía desde dos a seis, dependiendo del músculo, y comienza a decaer justo después del nacimiento, de tal manera que en la madurez todas las fibras de mamífero tienen sólo una motoneurona por fibra muscular. Esta disminución es muy específica y se acompaña por el proceso de eliminación sináptica (Jansen y Fladby, 1990). Eliminación sinóptica - el toque final -. La razón por la cual las fibras musculares están hiperinervadas inicialmente no está clara. Lo primero que se pensó fue que la hiperinervación seguida de eliminación sináptica funcionaba como un mecanismo para corregir los errores que ocurrían durante la proyección axónica. Sin embargo, ya vimos que la proyección axónica es un proceso bien definido en el cual se realizan pocas equivocaciones. (Se conoce que la eliminación sináptica ocurre en otras partes del SNC para corregir "errores de cableado", y esta es una hipótesis posible). Está claro, que existe la competencia entre las neuronas hiperinervantes, porque cuando quirúrgicamente se remueven motoneuronas que compiten por un músculo particular, las motoneuronas que permanecen inervan un mayor número de fibras de las usuales. Sin embargo, esas motoneuronas sobrevivientes no inervan simplemente todas las fibras disponibles. Existen algunos otros factores (quizás la capacidad metabólica de la célula) que limita la proporción de la inervación final (número de fibras musculares por axón) (Lieber, 1992). Además de los cambios internos programados que están fijados para ocurrir durante el desarrollo, está claro que las señales del medio ambiente también juegan un papel. Una señal importante del medio ambiente es la tensión experimentada por el músculo en fusión y en desarrollo. Vandenburg (1982) desarrolló un método para estirar mecánicamente células musculares cultivadas in vitro. Encontró que las células sometidas al estiramiento aumentaron sus velocidades de síntesis de proteínas, ocasionando un aumento en el tamaño celular, y cambiaron su orientación volviéndose paralelas al eje de estiramiento. No está claro cómo este evento mecánico fue traducido por la célula, pero es un hecho que los eventos mecánicos influyen fuertemente la maquinaria celular y en su desarrollo (Lieber, 1992). Desarrollo de tipos de fibras musculares específicas. Generalmente, los músculos completos de los mamíferos contienen una mezcla heterogénea de fibras de contracción rápida y de contracción lenta. ¿En que etapa se determina el tipo de fibra? Cual es la influencia, si es que la hay, del nervio para determinar el tipo de fibra? Buller et al. (1960a, 196%) demostraron la influencia de los nervios motores sobre los tipos de fibras musculares maduras, volviendo a unir quirúrgicamente un nervio motor de un músculo de contracción rápida a un músculo de contracción lenta y viceversa. Encontraron que, en seguida de la reinervación cruzada, el músculo de contracción rápida se volvió lento y el músculo de contracción lenta se volvió rápido. Este experimento formó las bases para la idea de que los nervios influyen en el destino de las fibras musculares. Sin embargo, utilizando técnicas de biología molecular (Miller y Stockdale, 1986, 1987) se demostró que aún en la etapa de mioblasto, éstos ya existen como tipos diferentes. En músculos de ave, utilizando técnicas histoquímicas e inmunohistoquímicas para tipificar fibras, Stockdale demostró que aún los miotubos primarios y secundarios existen como tipos "rápidos" y "lentos". El mostró que los mioblastos existen en tres tipos clonales distintos. Aislando un sólo tipo de mioblasto y permitiendo su proliferación para que formara miotubos, confirmó que los miotubos resultantes fueron todos de un solo tipo. La inervación no fue necesaria en esta preparación de ave para que surgieran las tres poblaciones de mioblastos de origen embrionario, proliferaran y formaran distintas poblaciones de miotubos, aunque para la diferenciación completa se requiere la inervación. Esto sugiere que durante el desarrollo, el nervio que llega encuentra ya una población de fibras musculares heterogénea. Puesto que conocemos que en mamíferos maduros todas las fibras dentro de una unidad motora son de un tipo particular, los axones podrían hacer cualquiera de los siguientes procesos, inicialmente inervar las fibras correctas, inervar el tipo de fibra muscular incorrecto y entonces cambiar el tipo de fibra, o inervar al azar y entonces utilizar la eliminación de sinápsis para corregir las conexiones defectuosas. De nuevo, parece que la inervación inicial es regularmente específica (Lieber, 1992). Thompson et al. (1984) probaron experimentalmente esta cuestión. Se investigó la composición de tipos de fibras de las unidades motoras de soleo de ratas en desarrollo en dos diferentes edades postnatales 8 y 16 días. A los 8 días después del nacimiento, todas las fibras del soleo de rata están inervadas por al menos dos motoneuronas_ En los siguientes 8 días, ocurrió la eliminación sinóptica dando por resultado la inervación individual para cada fibra. Si la inervación inicial de la fibra ha ocurrido de manera azarosa, Thompson esperaría que las fibras musculares perteneciendo a una sola unidad motora de 8 días podrían ser 50% fibras rápidas y 50% fibras lentas, puesto que un número igual de fibras rápidas y lentas estuvieron presentes en este momento. Entonces, seguiría la eliminación sináptica, las unidades motoras podrían volverse predominantemente rápidas o lentas cuando las conexiones "incorrectas" fueron suprimidas. Sin embargo, este no fue el caso. Thompson et al. encontraron que la composición del tipo de fibra de las unidades motoras en ambas edades fue de un solo tipo. De hecho, aunque la proporción de inervación bajó desde cerca de 250-100 durante el periodo de la eliminación sináptica, la preponderancia de un tipo de fibra particular en una unidad motora dada no cambió. Esto implica inervación inicial selectiva de las fibras musculares por axones específicos. El mecanismo preciso para tal proceso no es aún claro, y muchos detalles de la especificidad neuromuscular esperan los resultados de estudios futuros. Células satélite: reservas para la reparación en la lesión de las fibras musculares. Un componente escaso pero relativamente importante observado en las células musculares esqueléticas son las células satélites. Esas pequeñas células (Fig. 28) están localizadas por debajo de la lámina basa¡ de la fibra muscular y tienen aproximadamente el mismo tamaño del núcleo de una célula muscular. Mientras que las células satélite no desempeñan un rol conocido en la función celular normal, sí tienen un papel central en la recuperación de las fibras musculares dañadas. Las células satélite tienen la habilidad para diferenciarse en mioblastos y formar nuevas fibras musculares, tal habilidad es importante en la formación de nuevas fibras musculares una vez que ocurre una lesión muscular (Lieber, 1992). XIV.- TIPOS DE FIBRAS MUSCULARES. Estructura y propiedades de los tipos de fibras musculares. Fibras de sacudida rápida (Tipo II). Fibras de sacudida lenta (Tipo l). PROPIEDADES FISIOLOGICAS DE LOS TIPOS DE MUSCULARES. Velocidad máxima de contracción de diferentes tipos de fibras musculares. Tensión máxima generada por diferentes tipos de fibras musculares. Tolerancia de diferentes tipos de fibras musculares al ejercicio prolongado. FIBRAS PROPIEDADES MORFOLOGICAS DE DIFERENTES TIPOS DE FIBRAS MUSCULARES. Diferencias en las proteínas contráctiles entre los tipos de fibras. Diferencias metabólicas entre tipos de fibras. Diferencias membranales entre tipos de fibras. Otras diferencias estructurales entre tipos de fibras. TRANSFORMACION DE LAS FIBRAS MUSCULARES EXPERIMENTALMENTE E INDUCIDA POR ENTRENAMIENTO. Diferencias entre grupos de atletas. Puede cambiar el tipo de fibra muscular en el humano? Las adaptaciones metabólicas son reales y significativas. XIV.TIPOS MUSCULARES. DE FIBRAS El movimiento es organizado en el sistema nervioso central (SNC) y el resultado de todo el proceso dentro del SNC es enviado a los músculos esqueléticos por vía de las motoneuronas. Cada motoneurona inerva a un cierto número de fibras musculares, las cuales, juntas, forman una unidad motora. Los primeros experimentos de la fisiología de unidades motoras revelaron que las unidades motoras desarrollan tensión elevada, baja o intermedia en respuesta a un estímulo eléctrico. Además, las unidades motoras con baja capacidad de fuerza mostraron lentos tiempos de acortamiento, pero fueron resistentes a la fatiga; mientras aquellas con elevada capacidad de fuerza, se acortaron rápidamente pero fueron propensas a la fatiga temprana. Las características para las tres categorías de unidades motoras se ilustran en la figura 29. De acuerdo con estudios de inervación cruzada, la función de una motoneurona a en gran medida determina el tamaño, tiempo de contracción, resistencia a la fatiga y la actividad enzimática de las fibras musculares que inerva (Romanul y Van der Meulen, 1967), tomando en cuenta lo anterior es posible clasificar las fibras musculares. El músculo esquelético no es un simple grupo homogéneo de fibras con propiedades contráctiles y metabólicas similares. Aunque ha existido una considerable discusión acerca del método, terminología y criterio para clasificar las fibras musculares, se han identificado y clasificado dos tipos de fibras con base a sus características metabólicas y contráctiles (Armstrong, 1988), las fibras de sacudida rápida y las fibras de sacudida lenta. Estructura y propiedades de los tipos de fibras musculares. Una técnica común para establecer el tipo específico de fibra se basa en la sensibilidad diferencial a los cambios de pH de la enzima miosina ATPasa (una medida del fenotipo de la miosina) en los tipos de fibras (Klug y Tibbits, 1988; Pette y Staron, 1990; Kraus, et al. 1994). Se ha propuesto que, tanto las dos cadenas pesadas (Wagner, 1981, Edman, et al. 1988) y las cuatro cadenas ligeras (Zaager y Burke, 1988) contribuyen a la actividad enzimática. Son las diferentes características de esta enzima las que determinan en gran medida la velocidad del acortamiento del sarcómero. Estudios de músculos completos y de fibras musculares solas (Edman, et al. 1988) han mostrado que la velocidad del acortamiento muscular es proporcional a la actividad ATPasa de la miosina. Las fibras musculares con diferentes propiedades contráctiles contienen diferentes isoenzimas de miosina debido a la variabilidad en la composición de las cadenas pesadas y ligeras. Las fibras musculares pueden ser identificadas como fibras tipo I, IIa, IIb y He sobre las bases de la tinción histoquímica de la ATPasa (Brooke y Kaiser, 1970, 1974). La separación está en función de la diferente labilidad en álcalis o ácidos de las cadenas ligeras de miosina. La tinción de la ATPasa permite así monitorear indirectamente los cambios en las propiedades moleculares del aparato contráctil. La actividad de la miosina ATPasa específica de las fibras de sacudida rápida es inactivada con un pH ácido pero es regularmente estable en un rango de pH alcalino; la presencia de la enzima tiñe de oscuro las fibras. En las fibras se sacudida lenta, la actividad de su miosina ATPasa específica se mantiene alta en un pH ácido pero es inactivada en medio alcalino (McArdle, el al. 1996). Las diferentes propiedades fisiológicas y bioquímicas de los tipos de fibras clasificadas histoquímicamente pueden ser resumidas como sigue: Fibras de sacudida rápida (Tipo II). Las fibras musculares de sacudida rápida (tipo II) están inervadas por motoneuronas que pueden disparar a altas frecuencias y tienen rápidas velocidades de conducción, desarrollan tensión rápidamente pero pueden mantenerla sólo por cortos periodos de tiempo. Además poseen un rápido nivel de liberación de Ca++ y de almacenamiento del mismo debido a su retículo sarcoplásmico altamente desarrollado y una alta velocidad de rotación de los puentes cruzados originada en la actividad de ATPasa de la miosina. Estas actividades se conjugan para la ejecución de acciones potentes y rápidas. El desarrollo de tensión y la velocidad de acortamiento intrínseco de las fibras de sacudida rápida, es tres a cinco veces más rápida que la de las fibras clasificadas como de sacudida lenta (Kovanen, 1989; McArdle, el al. 1996). Las fibras tipo II tienen una elevada actividad ATPasa miofibrilar pero se pueden reconocer dos subclases de acuerdo a la ruta metabólica de energía predominante. Las fibras tipo Ha son consideradas intermedias, en las que su rápida velocidad de acortamiento se combina con una moderada capacidad bien desarrollada de los dos modos de transferencia de energía, aerobio (alto nivel de la enzima aeróbica succinil deshidrogenasa o SDH) y anaeróbico (alto nivel de la enzima anaeróbica fosfofructoquinasa o PFK). Estas son las fibras glucolíticas oxidativas rápidas o FOG. La otra subdivisión incluye a las fibras del tipo IIb, que poseen el mayor potencial anaeróbico y son las verdaderas fibras glucolíticas rápidas o FG. Las fibras tipo IIc son fibras con propiedades intermedias que pueden estar implicadas en la reinervación o en la transformación de la unidad motora (Komi y Karlsson, 1978). Estas fibras son reclutadas en corto tiempo en actividades que requieren velocidad, como también para otras actividades musculares enérgicas que dependen casi completamente de el metabolismo anaeróbico para la obtención de energía. La activación de las fibras rápidas es importante en los deportes como el basketbol, fútbol soccer y hockey, en los cuales se requieren acciones de cambio de paso y variaciones rápidas de avanzar y parar. Esas actividades en ocasiones requieren aporte rápido de energía que solamente es proporcionado por la ruta metabólica anaerobia (McArdle, el al. 1996). Fibras de sacudida lenta (Tipo I). A diferencia de las fibras de sacudida rápida, las fibras musculares de sacudida lenta (tipo I) están inervadas por motoneuronas que disparan a bajas frecuencias y tienen una velocidad de conducción más lenta. Pueden generar tensión por largos periodos de tiempo. Se distinguen por tener una baja actividad específica de la ATPasa de la miosina y están adaptadas para la producción aerobia de energía por medio de la actividad de las enzimas oxidativas, (Kovanen, 1989) además tienen una menor habilidad para "manejar" el Ca++ y la velocidad de acortamiento, y una capacidad glucolítica menos desarrollada que la de las fibras rápidas. Las fibras lentas también contienen, relativamente, mitocondrias más grandes y numerosas, es esta concentración de mitocondrias (junto con los citocromos que contienen hierro) combinada con los altos niveles de mioglobina lo que da a las fibras lentas su pigmentación roja. Aunado a esta desarrollada maquinaria metabólica se encuentra una alta concentración de enzimas mitocondriales que se necesitan para mantener el metabolismo aeróbico (Gollnick, 1973; Essen, et al. 1975; Jansson y Kaijser, 1977; Faulker, 1979). Así, las fibras lentas son resistentes a la fatiga y aptas para el ejercicio aeróbico prolongado. Esas fibras han sido etiquetadas como fibras SO para describir su lenta velocidad de acortamiento y su gran importancia sobre el metabolismo oxidativo. A diferencia de las fibras rápidas, las cuales se fatigan fácilmente, las fibras SO (más precisamente, unidades motoras) están adaptadas para el trabajo prolongado y son reclutadas selectivamente en actividades aeróbicas. Estudios de patrones de depleción del glucógeno muscular indican que en el ejercicio prolongado la responsabilidad es casi exclusiva de las fibras musculares lentas. Aún después de 12 horas de ejercicio, el limitado glucógeno que permanece en el músculo se encuentra principalmente en las fibras rápidas "no usadas" (Saltin, et al. 1977), Es también aparente que la capacidad del flujo sanguíneo a través del músculo está determinado por la diferencia en la capacidad oxidativa de los dos tipos de fibras; las fibras lentas reciben la mayor porción de sangre (Laughlin, et al. 1987; Terjung y Engbretson, 1988). Muchos investigadores clasifican las fibras lentas como tipo I, mientras que las fibras rápidas (y subdivisiones propuestas) son categorizadas como tipo II. Ambos tipos de fibras musculares son activadas cuando una persona ejercita hasta cerca del máximo los niveles aerobio y anaerobio, como en un corredor de distancia media, en la natación o en deportes tales como el basketbol, hockey ó fútbol soccer, actividades que requieren de una mezcla de transferencia de energía aeróbica y anaeróbica (Gollnick, et al. 1983). Podría también ser enfatizado, sobre las bases de estudios más recientes con fibras aisladas, que los diferentes tipos de fibras no están estrictamente limitados, sino que forman una continuidad entre los extremos lentos y rápidos generando un amplio rango de propiedades fisiológicas y bioquímicas entre unidades motoras individuales. PROPIEDADES FISIOLOGICAS DE LOS TIPOS DE FIBRAS MUSCULARES. La principal información al respecto proviene de los experimentos fisiológicos realizados en músculos compuestos principalmente por un solo tipo de fibras. Muchos músculos de animales cumplen este criterio, mientras que sólo lo hacen muy pocos músculos en el humano. El problema con este planteamiento es que se asume que las propiedades de un músculo son simplemente la suma de todas las fibras disponibles en el músculo y que cada fibra ejerce la misma influencia relativa. También se asume que, por ejemplo, una fibra SO de un músculo que contiene varios tipos de fibras (heterogéneo en composición) es igual a una fibra SO de un músculo compuesto completamente de fibras SO (homogéneo en composición). La siguiente discusión sobre las propiedades específicas del tipo de fibra se basa sobre estudios realizados en músculo completo, ya que técnicamente es difícil llevar a cabo todas las mediciones fisiológicas en fibras musculares esqueléticas individuales intactas de mamífero, debido a la gran cantidad de tejido conectivo que impide aislar fibras individuales (Lieber, 1992). Velocidad máxima de contracción diferentes tipos de fibras musculares, de La relación fuerza-velocidad descrita previamente proporciona una herramienta para la caracterización de la "velocidad" específica del tipo de fibra. El parámetro Vmax puede ser comparado entre músculos que tienen diferencias en la composición del tipo de fibras. Como ya se ha dicho, la arquitectura muscular tiene una marcada influencia sobre la velocidad absoluta de contracción, y por lo tanto, todas las velocidades medidas experimentalmente deberían ser expresadas en términos de velocidad normalizada, como puede ser longitud de la fibra por segundo o longitud sarcomérica por segundo para determinar el valor intrínseco de Vmax para una fibra. En este punto se establece de nuevo que la comparación entre músculos con diferentes tipos de fibras, sin hacer las correcciones en las diferencias de arquitectura puede llevar (y ha llevado) a conclusiones erróneas (Lieber, 1992). Asumiendo que se realiza el tipo de experimento correcto, encontramos que las fibras musculares de contracción rápida se acortan aproximadamente dos a tres veces más rápido que las fibras de contracción lenta en Vmax(Close, 1972). Esto en realidad no es una gran diferencia, y, probablemente tiene poca influencia sobre el rendimiento en los deportes o en la rehabilitación. A pesar de la discusión popular de la distribución de los tipos de fibras, es probable que esto tenga que ver muy poco con el rendimiento. Tensión máxima generada por diferentes tipos de fibras musculares. De manera similar a la que se usa para las mediciones de Vmax , la tensión tetánica máxima (Po) puede ser medida en músculos con diferente composición de tipos de fibras. De nuevo, se podría tomar en cuenta las diferencias en arquitectura para atribuir las diferencias en fuerza a las diferencias del tipo de fibra y no a las diferencias en arquitectura (es decir, PCSA). Este valor es normalizado con el PCSA del músculo estudiado, para generar el valor conocido como "tensión específica", o fuerza de contracción por unidad de área del músculo (Lieber, 1992). Esta es una área controversial de la fisiología del músculo, y por lo tanto es probable que esta discusión requiera de modificaciones cuando más datos se obtengan. Sin embargo, en las mediciones de la tensión específica de músculos esqueléticos completos, la mayoría de los investigadores encontraron que los músculos compuestos principalmente de fibras rápidas tienen una mayor tensión específica que los músculos compuestos principalmente de fibras lentas. Los valores típicos para las tensiones específicas de los músculos rápidos son de 2 aproximadamente 22 N/cm mientras que para los músculos lentos es de 10-15 N/cm2 (Lieber, 1992). La interpretación común de esos experimentos de músculo completo ha sido que las fibras musculares rápidas tienen una mayor tensión específica que las fibras musculares lentas. El problema con esta interpretación es que se asume que las fibras musculares de un músculo heterogéneo tiene las mismas propiedades de las fibras musculares del mismo tipo que están en un músculo homogéneo. Es afirmación probablemente no sea verdadera. Las mejores estimaciones de tensión específica provienen de experimentos de contracción isométrica de unidades motoras aisladas. Las fibras musculares de una unidad motora pueden ser clasificadas histoquímicamente; y se puede comprobar que todas son generalmente del mismo tipo. Así, si se mide la fuerza generada por una unidad motora y se determina la PCSA, puede ser calculada la tensión específica de diferentes tipos de unidades motoras (y por lo tanto de tipos de fibras musculares). La ventaja de este método es que todas las propiedades contráctiles son medidas en un mismo tipo de fibras. El problema con este tipo de experimentos es que las mediciones de la PCSA de la unidad motora es técnicamente muy difícil. Generalmente, los métodos utilizados para determinar la PCSA de la unidad motora son indirectos, llevando a una serie de suposiciones cuestionables. En sólo un experimento en el cual se identificó que todas las fibras pertenecían a una unidad motora se obtuvo la PCSA. Esos experimentos realizados por Sue Bodine el al. (1987), mostraron que las fibras musculares rápidas desarrollaron justo ligeramente más tensión que las fibras musculares lentas; esta es la mejor información de datos de que se dispone. Tolerancia de diferentes tipos de fibras musculares al ejercicio prolongado. La tolerancia (o su parte opuesta, la fatiga) de las fibras musculares es más difícil de ser definida que la velocidad o la fuerza. Esto es porque la tolerancia depende del tipo de trabajo que se requiere que rinda el músculo. Por ejemplo, si la carga de trabajo es ligera, casi no hay diferencia entre los tipos de fibras. Si la carga de trabajo es muy pesada, las fibras musculares por sí mismas no se fatigan; mas bien, se fatigan las uniones neuromusculares, y de nuevo, no hay diferencia entre los tipos. A causa de que el acople excitación-contracción requiere de una cadena de eventos, es posible producir fatiga interrumpiendo cualquier punto en la cadena. De esa manera existe peligro al simplemente atribuir la caída en fuerza a la fatiga de la fibra muscular sin entender las bases de esa caída. El método más comúnmente utilizado para medir la fatiga fue desarrollado para clasificar las unidades motoras individuales y así sería diferido a la unidad motora. Basta con decir que la resistencia de varias unidades motoras (y tipos de fibras musculares) difiere considerablemente. Sin embargo, es difícil dar una diferencia cuantitativa a menos que las condiciones de trabajo sean conocidas. Generalmente, las fibras SO tienen las mayor tolerancia, seguidas de las fibras FOG, y finalmente las fibras rápidas glucolíticas (FG). Lo cual no es sorprendente ya que se ha visto que las fibras FG tienen una baja capacidad oxidativa (Lieber, 1992). PROPIEDADES MORFOLOGICAS DE DIFERENTES TIPOS DE FIBRAS MUSCULARES. Diferencias en las proteínas contráctiles entre los tipos de fibras. Se ha mencionado que la miosina difiere considerablemente entre las fibras musculares rápidas y lentas. Aunque esta diferencia es importante funcionalmente, no existen realmente grandes diferencias estructurales entre las diferentes miosinas, como se ha determinado por la microscopía electrónica y por la difracción de rayos X. De hecho, en términos de los componentes generadores de fuerza del sarcómero, mientras que las proteínas tienen diferentes propiedades funcionales, estructuralmente son similares. Las miosinas lentas y rápidas tienen aproximadamente la misma forma y masa. Los músculos compuestos de sarcómeros lentos o rápidos tienen aproximadamente el mismo espaciamiento entre los filamentos y la misma densidad de puentes cruzados (Lieber, 1992). Diferencias metabólicas entre tipos de fibras. Diferencias membranales entre tipos de fibras. La diferencia en la capacidad oxidativa y glucolítica entre las fibras musculares está representada por las diferencias en la concentración relativa de las enzimas metabólicas. En las fibras rápidas, el citoplasma tiene una mayor concentración enzimas glucolíticas. Las fibras oxidativas (FOG y SO) tienen una mayor concentración de enzimas oxidativas. La fosforilación oxidativa ocurre en las mitocondrias, por lo que las fibras oxidativas tienen una densidad mitocondrial mayor que las fibras no oxidativas. Las fibras musculares altamente oxidativas pueden llegar a tener hasta un 25% de su volumen ocupado por mitocondrias (Eisenberg, 1983). Como ya se mencionó, las membranas de las fibras musculares poseen importantes mecanismos moleculares para el intercambio de sustancias entre el sarcoplasma y el líquido extracelular. Las fibras musculares rápidas y tónicas de rana, poseen el mecanismo intercambiador sodio/calcio (Donozo e Hidalgo 1989; Huerta et al. 1991). Este mecanismo intercambia el Ca ++ del citoplasma por Na + extracelular. En el caso de las fibras tónicas juega un papel más importante que en las fibras rápidas, como lo demuestra el hecho de que la sustitución del Na + extracelular por otro catión monovalente induce la acumulación intracelular de Ca++, generando desarrollo de tensión (Huerta, et al. 1991). En el sarcolema se encuentra el receptor 0 a catecolaminas (Huerta, et al. 1991; Arreola, et al. 1987; Bowman y Nott, 1969) y los mecanismos comunes a la mayoría de las células como son, la bomba K+ y la bomba de Ca +. Na+/ El sistema T y el RS están relacionados con el acople excitación-contracción. Tiene sentido que los músculos que son requeridos para responder rápidamente (fibras rápidas) tengan un sistema de activación membranal desarrollado, como se observa bioquímicamente. El sistema T y el RS de las fibras rápidas podrían ocupar de dos a tres veces más volumen en las fibras rápidas que en las fibras lentas. Así, las diferencias en la velocidad entre las fibras rápidas y lentas resultan de las diferencias en las velocidades de los ciclos de los puentes cruzados y de las diferencias en la velocidad de propagación de la activación (González-Serratos, 1983). Otras diferencias estructurales entre tipos de fibras. Otra diferencia estructural entre los tipos de fibras que es útil pero poco entendida, es la diferencia del grosor de los discos Z entre los tipos de fibras musculares. Eisenberg (1983) mostró que las fibras FG tienen discos Z de 60 nm de ancho, mientras que las fibras SO tienen discos más anchos de X150 nm. El grosor de los discos Z en las fibras FOG es intermedio (80 nm). La razón de esta diferencia no es clara, pero es interesante notar que en la contracción excéntrica, los discos Z parecen ser las uniones débiles más susceptibles de lesionar (Lieber, 1992). Se han demostrado diferencias en la estructura de la banda M entre los tipos de fibras. La banda M de las fibras tipo I tienen cinco puentes distintos, mientras que las fibras IIb tienen sólo tres puentes. Las bandas M de las fibras IIa tienen tres puentes centrales prominentes y dos puentes externos tenues. Mientras que esas dos diferencias ultraestructurales sean tomadas como verdades generales, existen amplitudes continuas de los discos Z y patrones de puentes en las bandas M, así que no es una tarea simple medir el ancho de los discos Z u observar la banda M y entonces inequívocamente tipificar las fibras. Parece que en cerca del 80% de las fibras, el ancho de la banda M proporciona una buena indicación del tipo de fibra (Lieber, 1992). TRANSFORMACION DE LAS FIBRAS MUSCULARES EXPERIMENTALMENTE E INDUCIDA POR ENTRENAMIENTO. La transformación de un tipo de fibra muscular en otro puede ser llevado a cabo experimentalmente por reinervación cruzada (Buller et al. 1960), por estimulación nerviosa apropiada (Salmons y Vrbova, 1969) o por la estimulación directa de músculos denervados. De acuerdo al conocimiento actual, la transformación del tipo de fibra comprende cambios cuantitativos y cualitativos en varias características fisiológicas, metabólicas y morfológicas. Esos cambios ocurren en una secuencia ordenada en varios niveles de organización. En particular, están involucrados los sistemas de membrana, el metabolismo energético y las proteínas contráctiles y reguladoras. En la fase temprana de la transformación de fibras rápidas a lentas ocurre una rápida decadencia en la extensión del sistema de los túbulos T y del retículo sarcoplásmico (Eisenberg y Salmons, 1981), la actividad de la bomba ATPasa de Ca++ y de las proteínas fijadoras de Ca++, calsequestrina y parvalbúmina, disminuye. Las consecuencias fisiológicas de esos cambios se manifiestan con una disminución en la velocidad y en la capacidad máxima de la captura de Ca++, lo cual puede ser la razón para el incremento inicial en el tiempo transcurrido para alcanzar los picos de tensión durante contracciones isométricas y en el tiempo medio de relajación (Kovanen, 1989). Simultáneamente con esos cambios, en el retículo sarcoplásmico, ocurre una transformación metabólica junto con un incremento en el contenido de mioglobina y la densidad capilar conduciendo a la transformación de "blanco a rojo". La actividad enzimática aumentada para la oxidación aeróbica del sustrato junto con la disminución de la actividad de las enzimas glucolíticas puede ser la causa de la tolerancia aumentada a la fatiga (Pette, 1984). Con suficiente estimulación prolongada, es decir más de 3 semanas (Streter, et al. 1973, Salmons y Streter, 1976) la transformación del tipo de fibra se completa por la aparición de la miosina del tipo lento y por cambios en la actividad de la ATPasa de la miosina activada por Ca++. Los cambios en la miosina incluyen composiciones secuenciales en las cadenas pesadas y ligeras, la tinción histoquímica de la ATPasa miofibrilar muestra la conversión de las fibras desde el tipo II al tipo I. El reemplazo secuencial de las isoformas resulta en unas propiedades de tinción inusuales, caracterizado por la presencia de fibras intermedias (IM), es decir, fibras que se tiñen después de la preincubación ácida y alcalina en tinciones para ATPasa miofibrilar. Los cambios relacionados con la miosina han sido propuestos como responsables, en la última fase, para la prolongación del tiempo transcurrido para alcanzar los picos de tensión y el tiempo medio de relajación, así como para la disminución en la proporción del desarrollo de tensión (Pette 1984; Pette y Vrbova 1985). Una cuestión fascinante es, si la transformación de los tipos de fibras descritos arriba pueden ocurrir en humanos como resultado del uso intensivo del músculo esquelético. Los primeros estudios en humanos por Gollnick el al. (1972) y Costill el al. (1976) mostraron que individuos con entrenamiento atlético para adquirir resistencia tuvieron elevados porcentajes de fibras de tipo I cuando se comparó con los de velocidad o con los de la gente sedentaria. Desde entonces numerosos estudios de entrenamiento (Gollnick, el al. 1973, Thorstensson, el al. 1976, Saltin, el al. 1976, Andersen y Henrikson, 1977) han fallado para mostrar cualquier transformación de fibras rápidas a lentas inducidas por el entrenamiento y Komi el al. (1977) concluyeron que factores hereditarios determinan la composición de las fibras musculares, una afirmación que ha sido desde entonces severamente contradicha por Bouchard el al (1986). Algunas interconversiones dentro de las fibras del tipo II (IIB IIA) debidas a entrenamiento de resistencia se reportó por Andersen y Henriksson (1977), Ingjer (1979) y Schantz el al (1982). Posteriores evidencias para la transformación de rápidas a lentas en músculo de humano debidas a actividad física han sido proporcionadas desde entonces por Howald el al. (1985), Simoneau et al. (1985), Schantz (1986) y Schantz y Dhoot (1987). Todos esos estudios apoyan el papel de las fibras IM como una etapa de transición en la conversión del tipo II al tipo I. Es también importante recordar que en los estudios realizados en humanos usando biopsias siempre se incluye cierta incertidumbre debido a la tendencia de variabilidad inherente a la técnica de la aguja para biopsias de músculo (Kovanen, 1989). Los experimentos con animales, por otro lado, permiten estudios con muestras representativas y en circunstancias más controladas. Se han realizado un gran número de experimentos con animales sobre la transformación de las fibras musculares (Müller, 1974; Green, el al. 1983, 1984). Se han descrito en varias preparaciones los efectos de la estimulación crónica en la transformación de las fibras II a Fibras I; por ejemplo en gatos (Al-Amood, Buller & Pope, 1973); en perro y cabra (Glatz, el al. 1992); en conejo (Jarvis, 1993, Kirschbaum, el al. 1987). Esos estudios han aportado apoyo adicional a la hipótesis de que las transformaciones de rápidas a lentas ocurren como un resultado del entrenamiento físico. Recientemente Jarvis el al. (1996) han reportado la transformación de las fibras IIa a I en músculo extensor digitorum longus de rata, por estimulación crónica a 10 ó 20 Hz. Diferencias entre grupos de atletas. Varias observaciones se han hecho con respecto a los tipos de fibras musculares y la posible influencia del entrenamiento específico sobre la composición de las fibras y su capacidad metabólica. Con respecto a este tópico, McArdle el al (1996) han realizado una revisión detallada que se resume de la siguiente manera: Hombres, mujeres y niños en promedio poseen un 45 a 55 % de fibras lentas en los músculos de los brazos y de las piernas. De fibras rápidas, existen probablemente los mismos porcentajes de las subdivisiones tipo IIa y IIb. Aunque no existe diferencia en la distribución de las fibras por sexo, la variación puede ser muy grande entre los individuos. Generalmente, la tendencia en la distribución de un tipo de fibra muscular es consistente entre los principales grupos de músculos del cuerpo. Ciertos patrones de distribución de las fibras son apreciados fácilmente entre atletas altamente experimentados. Los mejores atletas de resistencia mostraron una predominancia de fibras de sacudida lenta en los músculos activados por su deporte específico. En los mejores atletas de velocidad predominaron las fibras de sacudida rápida. Los grupos de atletas con las más altas capacidades aeróbicas y de resistencia, tales como los corredores de distancia y los esquiadores de campo-travieza, que tienen los más altos porcentajes de fibras lentas en los músculos gastrocnemius de las piernas, a menudo tan altas como del 90 al 95%. Los levantadores de pesas, los jugadores de hockey sobre hielo, y los corredores de velocidad, por otro lado, tienden a tener más fibras rápidas y una baja capacidad aeróbica relativa. Como podría ser esperado, hombres y mujeres que realizan carreras de distancia media tienen aproximadamente porcentajes iguales de los dos tipos de fibras musculares. Tal distribución también ocurre en potentes atletas que practican el salto, salto de altura y lanzamiento. Esas distinciones relativas marcadas claramente entre el tipo de ejercicio y la composición de los músculos en fibras musculares son para atletas seleccionados, los cuales han sobresalido en una categoría específica del deporte. La composición de las fibras en una persona, sin embargo, no es determinante exclusivo de la función. Varios investigadores han mostrado que para un grupo particular, entrenados o no entrenados, el conocimiento del tipo de fibras musculares predominante en una persona, es de valor limitado para predecir el tipo de ejercicio de mayor rendimiento. Esto no es sorprendente, porque la capacidad de funcionamiento es el resultado final de la mezcla de "sistemas de soporte" fisiológicos, bioquímicos, neurológicos y biomecánicos y no es determinado por un solo factor tal como el tipo de fibra muscular. En términos de tamaño muscular, los atletas de resistencia presentan fibras lentas de tamaño relativamente normal. Los levantadores de pesas y otros atletas de fuerza, por otra parte, muestran un definitivo ensanchamiento, especialmente en las fibras rápidas. Esas fibras pueden ser 45% más grandes que aquellas de los atletas de resistencia o de personas sedentarias de la misma edad. Esto es porque el entrenamiento de fuerza y potencia induce un ensanchamiento definitivo del aparato contráctil de la fibra específicamente de los filamentos de actina y miosina y del contenido total de glucógeno. La principal diferencia en la composición muscular por sexo es la presencia, generalmente, de fibras más largas en los atletas masculinos. Puede cambiar el tipo de fibra muscular en el humano? Para determinar si la composición de las fibras características de grupos específicos de atletas son el resultado del entrenamiento o son naturales del medio interno (esto es, para asegurar si la composición de las fibras de un individuo puede ser cambiado), seis hombres participaron en un programa de entrenamiento ciclista aeróbico de 5 meses. Las biopsias de la porción lateral del cuadriceps antes y después del entrenamiento indicaron que no hubo cambio en la composición de las fibras, aunque todos los hombres mejoraron considerablemente en su capacidad de ejercicio y poder aeróbico. Observaciones similares se reportaron para la composición de las fibras de sujetos después de programas de entrenamiento para resistencia o velocidad. Esos datos son usados con frecuencia para apoyar el argumento de que una fibra rápida antes del entrenamiento será una fibra rápida después del entrenamiento, manteniendo la misma afirmación para las fibras lentas. Estudios adicionales con humanos y animales, sin embargo, sugieren la posibilidad de cambios en las propiedades fisiológicas y bioquímicas de las fibras musculares con una transformación progresiva en el tipo de fibra durante el entrenamiento. En un estudio de 18 semanas de entrenamiento "aeróbico" seguido de 11 semanas de entrenamiento "anaeróbico" en 4 atletas, el entrenamiento anaeróbico ocasionó un incremento en el porcentaje de fibras tipo IIc y una disminución en el porcentaje de las fibras de tipo I; lo opuesto fue observado en la fase aeróbica de la secuencia del entrenamiento. Similarmente, un aumento del 23% de fibras rápidas y una disminución proporcional en el porcentaje en las fibras lentas se observó después de sólo 6 semanas en el entrenamiento de velocidad. Esos hallazgos sugieren que el entrenamiento específico (y quizás la inactividad) puede inducir una conversión real de las fibras de tipo I en fibras de tipo II (o viceversa). Se requiere de mayor investigación antes de establecer de manera definitiva la naturaleza fija de la composición de las fibras musculares. Las características de la distribución de los tipos de fibras son determinadas en gran medida por el código genético; la principal determinación de la composición de las fibras musculares es fijada probablemente antes del nacimiento o en las etapas tempranas de la vida. Parece, sin embargo, que es posible alguna transformación en el tipo de fibras musculares con actividades físicas de tipos específicos y crónicas. Las adaptaciones metabólicas son reales y significativas. Es probable que una distribución particular de fibras sea "requerida" para destacar en niveles óptimos en la ejecución de un deporte. Aunque la naturaleza relativamente fija del tipo de fibras sugiere un obvia predisposición genética para la ejecución excepcional, está bien documentado que el entrenamiento específico aumenta significativamente el poder metabólico de ambos tipos de fibras en mujeres y hombres a pesar de la edad. El aumento de la capacidad oxidativa de las fibras rápidas con entrenamiento de resistencia lleva a éstas a un nivel en el cual están casi tan bien equipadas para el metabolismo oxidativo como las fibras lentas de individuos no entrenados. La edad no es barrera para las adaptaciones por entrenamiento de las fibras musculares. Si el estímulo de entrenamiento es adecuado, los músculos de hombres y mujeres de edad avanzada se adaptan (tamaño de la fibra, capilarización, enzimas glucolíticas y respiratoria) para el ejercicio de velocidad y resistencia de manera similar como ocurre en la gente joven. Hombres y mujeres entrenados para resistencia muestran alguna conversión de las fibras tipo IIb a fibras más aeróbicas tipo IIa. Esto se acompaña de un incremento del tamaño y número de mitocondrias y el correspondiente aumento en la cantidad total de las enzimas del ciclo de Krebs y del transporte de electrones. Sólo los músculos específicamente entrenados (más precisamente, fibras musculares) se adaptan para el ejercicio; esto explica por qué los atletas altamente entrenados que cambian a un deporte que requiere de la acción de grupos diferentes de músculos, se sienten "desentrenados" para la nueva actividad. Dentro del esquema, los nadadores o canotistas (con musculatura superior bien desarrollada) no necesariamente transfieren su aptitud de la parte superior del cuerpo para un deporte de carrera que necesita predominantemente masas musculares bien desarrolladas en la parte inferior del cuerpo. Generalmente ambos tipos de fibras son reclutados en la actividad física; sin embargo, ciertas actividades requieren la activación de una mayor proporción de un tipo de fibras sobre otro. XV.- EVENTOS QUIMICOS Y MECANICOS DURANTE LA CONTRACCION Y RELAJACION MUSCULAR. PROPIEDADES CONTRACTILES ACTIVAS. Estudios microscópicos indican un mecanismo de filamentos deslizantes. Mecanismo de los filamentos deslizantes. El mecanismo deslizante se produce por puentes cruzados. Los puentes cruzados aislados se pueden hacer trabajar in vitro. Acción mecánica de los puentes cruzados. La fuerza contráctil depende del número de interacciones de los puentes cruzados. Curva tensión isométrica-longitud sarcomérica de fibras aisladas. Las cabezas de miosina hidrolizan el ATP y se doblan para producir el impulso motor. Los filamentos de actina contienen dos proteínas reguladoras, la tropomiosina y troponina. Unión entre actina, miosina y ATP. XV.EVENTOS QUIMICOS Y MECANICOS DURANTE LA CONTRACCION Y RELAJACION MUSCULAR PROPIEDADES ACTIVAS. CONTRACTILES Aún los más simples organismos unicelulares se desplazan. Además, en los organismos multicelulares las células individuales pueden cambiar su forma y tamaño, dependiendo de sus funciones y etapas de crecimiento. Esos movimientos requieren de diferentes tipos de filamentos proteicos -de actina, miosina, filamentos intermedios y microtúbulos (ver fig. 13). Sin embargo, los tipos de movimientos más especializados, y los mejor estudiados, son los de la contracción y relajación de las fibras del músculo esquelético. Los movimientos musculares son llevados a cabo por motores moleculares que interactúan con filamentos; es este caso, los motores son las moléculas de miosina y los filamentos los constituye la actina. El microscopio electrónico y la difracción de rayos X han ayudado a descifrar muchos secretos de la estructura celular, conduciendo a hipótesis razonables referentes a los eventos químicos y mecánicos de la contracción y relajación muscular. Existen considerables evidencias para apoyar la teoría de los filamentos deslizantes en la función muscular. Aunque esta teoría para explicar los movimientos moleculares en la contracción muscular fue propuesta hace cerca de 50 años, el modelo aún es compatible con los detalles de la ultraestructura y función que continuamente se han estado descubriendo. Estudios microscópicos indican mecanismo de filamentos deslizantes. un La forma de cómo se contraen las fibras de músculo esquelético se dedujo por dos tipos de estudios microscópicos bastante diferentes realizados a principios de 1950 y en cada caso un Huxley estuvo implicado. Andrew Huxley, el de los experimentos de fijación de voltaje, hizo sus observaciones con un microscopio de interferencia de diseño propio, mientras que Hugh Huxley usó un microscopio electrónico para examinar lo que, en aquellos tiempos, fueron unas secciones de músculo muy delgadas. En el mismo tiempo que Hugh Huxley realizó esos importantes estudios, Andrew Huxley haciendo uso de un microscopio de interferencia examinó las estriaciones presentes en las fibras musculares simples aisladas de rana durante la contracción y relajación. Observó que durante la contracción la banda I se acortaba, mientras que la banda A permanecía con la misma longitud; dentro de la banda A, sin embargo, la zona H se hacia angosta y podía desaparecer completamente. De forma bastante independiente, ambos investigadores propusieron que sus respectivos hallazgos podrían ser explicados por un movimiento deslizante de los filamentos de activa y miosina pasando unos sobre los otros (A. F. Huxley y Niedergerke, 1954; H.E. Huxley y Hanson, 1954). Mecanismo de los filamentos deslizantes. Con el microscopio electrónico, se ha visto que, dentro de una fibra muscular, cada miofibrilla está compuesta de muchos miofilamentos y estos son de dos tipos, gruesos y delgados. En secciones transversales de fibras musculares, cada filamento grueso se ve rodeado por un arreglo hexagonal (ver fig. 7) de filamentos delgados; en cortes longitudinales los filamentos gruesos de una miofibrilla se encuentran alineados. Desde hace algunos años se reconoció que las proteínas contráctiles del músculo eran la miosina y la actina, posteriormente se mostró que esas proteínas corresponden a los filamentos gruesos y delgados respectivamente. La banda I es la región de la fibra donde sólo los filamentos de actina están presentes; la banda A corresponde a la posición de los filamentos de miosina. Por otra parte, en el estado relajado, aunque existe un poco de traslape entre los filamentos de actina y miosina, los extremos centrales de los filamentos de actina opuestos están separados, esta separación explica la pálida región (zona H) presente en el centro de la banda A (Fig. 9D). Cuando el músculo se contrae (Fig. 9E), los filamentos de actina opuestos son impulsados uno hacia el otro en dirección del centro del sarcómero y se deslizan a lo largo con la intervención de los filamentos de miosina. Conforme se acercan uno al otro, la cercanía entre ambos genera que la zona H se estreche; similarmente, mientras más avancen los filamentos de actina dentro del espacio entre los filamentos de miosina, la banda I se vuelve más corta. Puesto que los filamentos de miosina no alteran su forma, la longitud de la banda A permanece sin cambio. La función de la línea Z ó discos Z, es sujetar los filamentos de actina para mantenerlos juntos, mientras que a la línea M (en el centro de la banda A) le corresponden las uniones entre los filamentos de miosina; ambos tipos de estructuras mantienen a los filamentos respecto unos con otros en una relación geométricamente ordenada. La teoría de los filamentos deslizantes, por lo tanto, propone que un músculo se acorta o se alarga porque los filamento gruesos y delgados se deslizan unos sobre otros sin cambiar su longitud. El motor molecular que mueve este proceso de acortamiento es la acción de los puentes cruzados de miosina, los cuales cíclicamente se unen , giran, y se separan de los filamentos de actina con la energía proporcionada por la hidrólisis del ATP. Esto causa un cambio en el tamaño relativo de las diferentes zonas dentro del sarcómero, produciendo fuerza en los discos Z. Los filamentos delgados de actina se deslizan sobre los filamentos de miosina, moviéndose dentro de la región de la banda A durante el acortamiento (moviéndose fuera de ella durante la relajación). Por lo tanto el principal reordenamiento estructural durante el acortamiento, ocurre en la región de la banda I, la cual marcadamente disminuye cuando los discos Z son jalados hacia el centro de cada sarcómero. En una acción estática, la fuerza es generada mientras la longitud de la fibra permanece sin cambio, y el espacio relativo de las bandas A e I permanece constante; en esta situación, los mismos grupos moleculares reaccionan repetidamente. En una acción excéntrica en la cual la fuerza es generada mientras que la fibra muscular está alargada, las bandas I se amplían (McArdle, et al. 1996). El mecanismo deslizante se produce por puentes cruzados. El siguiente paso para el entendimiento del mecanismo de los filamentos deslizantes fue la demostración, usando micrografías electrónicas de elevada amplificación (Fig. 30), de pequeñas proyecciones que emergían desde los filamentos de miosina (H.E. Huxley, 1958). Esas proyecciones fueron denominadas puentes cruzados , y se propuso que estos podrían unirse momentáneamente a los filamentos de actina e impulsar a estos últimos a nuevas posiciones. Los puentes cruzados miden aproximadamente 13 nm de largo y se disponen en seis filas a lo largo del filamento de miosina; cada fila puede trabar uno de los filamentos de actina del arreglo hexagonal que rodea al filamento de miosina. Los puentes cruzados está acomodados en parejas (Fig. 9C) y separados por 180°, el siguiente par está siempre a 14.3 nm de retirado, y con respecto al eje ese par presenta una rotación de 60° (McComas, 1996). Los puentes cruzados aislados se pueden hacer trabajar in vitro. Los mayores descubrimientos dentro del mecanismo de acción de los puentes cruzados provienen de los estudios realizados en el alga Nitella; la ventaja de usar esta preparación es que las células son relativamente largas y contienen paquetes paralelos de filamentos de actina. Si la células se cortan y se extienden, el citoplasma puede ser lavado, dejando los paquetes de filamentos de actina en su lugar. Sheetz y Spudich (1983) pusieron pequeñas cuentas de plástico cubiertas con miosina en las células de Nitella tratadas y observaron que, en la presencia de ATP, las cuentas se movían a lo largo de los filamentos de actina, por medio de la acción de los puentes cruzados de la miosina. Una extensión de este tipo de experimento fue reemplazar a Nitella con una membrana artificial a la cual se le adhirieron filamentos de actina orientados longitudinalmente (Spudich, Kron y Sheetz, 1985). En experimentos posteriores del mismo laboratorio, las cuentas se eliminaron al cubrir una superficie de vidrio con filamentos de miosina, aplicando ATP, y observando al microscopio el movimiento de los filamentos de actina marcados con fluorescencia. Estos experimentos indican que el movimiento de los puentes cruzados ocurren con una velocidad constante y que la dirección del movimiento está determinado por la polaridad geométrica de los filamentos de actina. En un ciclo de trabajo de un puente cruzado, se mueve el filamento de actina cerca de 10 nm en 2 ms, con la hidrólisis de una molécula de ATP (H.E. Huxley, 1990). Acción mecánica de los puentes cruzados. La miosina juega en la acción muscular ambos papeles, enzimático y estructural. Las cabezas globulares de los puentes cruzados de la miosina contienen una ATPasa activada por actina en el sitio donde se une con la actina y es la que proporciona la fuerza mecánica para que los filamentos de actina y miosina se deslicen unos sobre otros por medio de la hidrólisis del ATP (Hochachka, 1994; Rayment, et al. 1993). La oscilación es de naturaleza cíclica para y desde de los puentes cruzados, los cuales se mueven de manera similar a la acción de remos en el agua. A diferencia de los remos, no todos los puentes cruzados se mueven de manera sincrónica. Si así lo hicieran, la acción resultante del músculo podría ser una serie de movimientos espasmódicos en lugar de fuerza y movimientos finamente graduados. Durante el acortamiento muscular, cada puente cruzado sufre repetidos pero independientes ciclos de movimiento asincrónico (McArdle, et al. 1996). Durante la actividad contráctil en una fibra, en cualquier tiempo, solo cerca del 50% de los puentes cruzados están en contacto con los filamentos de actina para formar el complejo proteico actomiosina, los otros puentes cruzados están en alguna otra posición de su ciclo. Cada acción de un puente cruzado contribuye a un pequeño desplazamiento longitudinal en términos del deslizamiento total de los filamentos (McArdle, et al. 1996). Este proceso se ha comparado a la acción de una persona escalando con una soga. Las piernas y los brazos representan los puentes cruzados. El escalamiento da inicio, primero, al alcanzar la soga con los brazos, entonces se agarra, se jala y se deja la soga, al repetir este proceso una y otra vez durante todo el escalamiento la persona logra trasladarse desde el punto A al punto B y así sucesivamente. La fuerza contráctil depende del número de interacciones de los puentes cruzados. Una de las predicciones de la hipótesis de los filamentos deslizantes fue que cada puente cruzado podría actuar como un generador de fuerza independiente, y que la fuerza desarrollada en una contracción podría por lo tanto depender del número de interacciones simultáneas entre los puentes cruzados y los filamentos de actina. Experimentalmente, el número de interacciones de puentes cruzados-actina puede variarse por el estiramiento de la fibra muscular y así alterar la cantidad de traslape entre los filamentos de actina y miosina. Este tipo de experimentos es llevado a cabo fácilmente en humanos, por ejemplo, al registrar las sacudidas isométricas desarrolladas por los músculos de la pantorrilla después que han sido estirados por dorsiflexión del tobillo. Puede verse que la fuerza aumenta con el alargamiento muscular hasta un máximo y entonces, con mayor estiramiento, empieza a disminuir (McComas, 1996). Aunque los resultados son consistentes con la hipótesis de los filamentos deslizantes, el grado de traslape entre los filamentos de miosina y actina no puede conocerse de manera precisa, porque el estiramiento de una fibra muscular elonga más los sarcómeros centrales que los localizados en los extremos. Por esta razón Gordon, Huxley y Julian (19664) realizaron un experimento en el cual examinaron longitudes cortas de fibras musculares aisladas de rana. Gordon, Huxley y Julian (1966b) observaron que, sobre ciertos rangos, la tensión desarrollada es proporcional al grado de traslape entre los filamentos de actina y miosina y por lo tanto al número de puentes cruzados activos en estos últimos. Si un mayor acortamiento es permitido, de manera que los filamentos de actina opuestos ahora se traslapen uno sobre otro, así como también los filamentos de miosina implícitos, la tensión isométrica declina. Es probable que en algún modo los filamentos de actina traslapados interfieren con el mecanismo de los puentes cruzados en esas longitudes cortas del sarcómero. En otros experimentos, Gordon y sus colegas estiraron la fibra muscular tanto, que ya no fue posible el traslape entre los filamentos de actina y miosina. En este caso, como los puentes cruzados de miosina fueron incapaces de alcanzar los filamentos de actina, no se pudo desarrollar tensión (mas allá de 3,65 µm). Esta es exactamente la situación que se piensa ocurre en la falla cardiaca asociada con la distensión ventricular. En el caso de los músculos esqueléticos, dados lo pequeños rangos de movimiento articular, es dudoso que ocurra un alargamiento que desenterdigice a los filamentos gruesos y delgados. En músculos enfermos, sin embargo, la posibilidad de hiperextensión parece más probable, puesto que el reemplazo parcial de las fibras musculares por tejido fibroso relativamente inelástico bien podría permitir a los segmentos de fibras sobrevivientes ser estiradas excesivamente (McComas, 1996). Curva tensión isométrica-longitud sarcomérica de fibras aisladas. La curva de tensión-longitud fue obtenida hace aproximadamente 40 años por investigadores británicos y suizos los cuales estimularon eléctricamente una sola fibra de músculo de rana (8 mm de largo y 75 µm de diámetro) y graficaron la máxima tensión desarrollada por el sarcómero en las longitudes seleccionadas (Edman, 1966; Gordon et al. 1966b). Como se observa en la figura 31, la longitud del sarcómero varió desde 1.6 µm en el traslape máximo de los filamentos de actina (aproximadamente 70% de tensión máxima) hasta 3.6 µm; longitud a la cual ya no se desarrolló tensión. El pico de tensión en la curva se alcanzó en la longitud del sarcómero entre 2.0 y 2.2 µm; esta longitud para la tensión máxima es la región de la máxima interacción entre los filamentos de actina y miosina. Es interesante que la diferencia de 0.2 µm en esta parte de la curva es precisamente el ancho de la región en la cual no existe cambio en la interacción actinamiosina. Cuando el sarcómero es estirado más allá de 2.2 µm de longitud, la curva cambia y se dirige hacia abajo y la tensión desarrollada disminuye. Esto ocurre por el menor traslape entre los filamentos de actina y miosina. Con menor traslape existe menor interacción de los puentes cruzados y, por lo tanto, menor tensión activa desarrollada. La capacidad del sarcómero para desarrollar tensión se pierde en el punto máximo de estiramiento siendo este de 3.65 µm (la longitud máxima de los filamentos de actina es de 2.0 µm, y la máxima longitud de los filamentos de miosina es de 1.65 µm). A la longitud sarcomérica de 3.65 µm, no puede haber ninguna interacción de puentes cruzados. Las cabezas de miosina hidrolizan el ATP y se doblan para producir el impulso motor. Como se mencionó previamente, los puentes cruzados son en realidad las cabezas globulares de las moléculas de miosina. Las dos cabezas globulares (ver fig. l0A) de cada molécula de miosina constituyen los fragmentos SI. Cada cabeza tiene una cadena pesada y dos cadenas ligeras unidas a ella. Las cabezas globulares, y los cuellos a los cuales están unidos, forman los puentes cruzados. Se mencionó también, que se han identificado tres componentes de las cabezas globulares y sus pesos moleculares son de 50 kD, 25 kD y 20 kD respectivamente. Las dos cadenas ligeras están unidas a la porción de 20 kD, mientras que el segmento 50 kD contiene un bolsillo para unir e hidrolizar el ATP, así como los sitios para unirse a la actina (Vibert y Cohen, 1988). El descubrimiento más reciente, por Rayment et al. (1993), en relación a la miosina, fue la presencia de una hendidura (Fig. 1013) en el segmento 50 kD, que divide esta región en los dominios superior e inferior. El ancho de la hendidura es controlado por las interacciones del ATP con el bolsillo; la apertura de la hendidura debilita la unión del segmento 50 kD con la actina, mientras el cierre de la hendidura hace más fuerte la unión. El bolsillo para el ATP también puede abrirse, inclinando las cabezas de miosina y por lo tanto alterando el ángulo del puente cruzado. Desde la descripción del mecanismo de los filamentos deslizantes hace ya 50 años, se han acumulado evidencias gradualmente para mostrar cómo los puentes cruzados de miosina podrían alterar su ángulo, y dar un impulso motor al filamento de actina, y cómo este movimiento podría estar relacionado con la hidrólisis del ATP. Se ha conocido por mucho tiempo que la combinación del ATP con la cabeza de miosina era necesaria para librar a esta última del filamento de actina. Así, si el ATP no está disponible o es incapaz de ser hidrolizado en la fibra, los dos tipos de filamentos permanecen trabados juntos en el estado de rigor, como después de la muerte. Lymn y Taylor (1971) propusieron que la hidrólisis del ATP, en ADP y Pi, llevaba a la formación de un complejo intermedio con la miosina (el complejo de productos de la miosina). Otro aspecto de este modelo fue que la unión de la actina con la miosina ocurre en dos etapas, siendo débil el inicio y fuerte posteriormente. Otros conceptos, sugeridos por varios autores (A. F. Huxley y Simmons, 1971), fueron que el movimiento de los puentes cruzados podría surgir de la rotación de las cabezas globulares de la miosina. Con el perfeccionamiento de la definición de la cabeza de miosina por Rayment et al. (1993), ha sido posible proporcionar un informe más completo de la probable estructura y función de la cabeza de miosina. Este informe, que incorpora varias de las ideas previas, tiene como rasgo principal la apertura y el cierre de la hendidura recién descubierta en el segmento de 50 kD de la cabeza de miosina. En este esquema, la primer etapa es el complejo de rigor, formado por la fuerte unión de la actina con la miosina en ausencia de ATP (Fig. 32A). Luego, el ATP entra primero en el bolsillo del segmento 50 kD de la miosina fosfato pero con el anillo izquierdo de adenina protruyendo. Esta entrada incompleta es insuficiente para abrir la estrecha hendidura entre los dominios superior e inferior del segmento 50 kD de la miosina, debilitando su unión con la actina (Fig. 32B). El resto de la molécula de ATP entonces es encerrada en el bolsillo, y esto causa que se despegue el segmento 50 kD del filamento de actina y se mueva 5 nm más adelante (Fig. 32C). El ATP es entonces hidrolizado, pero los productos (ADP y P; ) permanecen dentro de la cabeza de miosina, para formar así un complejo intermedio. Posteriormente, el segmento 50 kD se vuelve a unir a la actina (5 nm más adelante en el filamento que en la figura 32A)). La nueva unión se hace inicialmente en el dominio inferior del segmento 50 kD y es débil, pero se vuelve fuerte cuando el dominio superior participa. La nueva unión permite el cierre de la hendidura entre los dominios superior e inferior, y esto permite la expulsión del P; del bolsillo. A su vez, la pérdida de P; ocasiona que se abra el bolsillo para el ATP y, cuando está así, hace que la parte inferior de la cabeza de miosina gire (Fig. 32E); este es el impulso motor, durante el cual se produce la fuerza y el filamento de actina es movido 5 nm hacia adelante. Además, el ADP se libera al abrirse el bolsillo del ATP. Las moléculas de actina y miosina permanecen estrechamente unidas hasta que otra molécula de ATP entra al bolsillo y el ciclo de los puentes cruzados se repite. Cada cabeza de miosina contiene dos cadenas ligeras (reguladora y esencial), las dos están unidas a la región del cuello de la cabeza de miosina. Se cree que en algún modo las cadenas ligeras afectan las acciones de las cabezas de miosina, probablemente modificando la velocidad del movimiento en cada impulso motor (Lowey, Waller y Trybus, 1993). Ha sido propuesta la fosforilación de las cadenas ligeras, como el mecanismo responsable para la potenciación isométrica de la tensión de sacudida (Moore y Stull, 1984). Un ciclo completo de puentes cruzados dura aproximadamente 50 ms; en este tiempo, la cabeza de miosina se une al filamento de actina por sólo 2 ms, y el impulso motor es por lo tanto un evento breve. En experimentos extraordinariamente delicados, en los cuales se permitió interactuar a moléculas de miosina solas con filamentos de actina, fue posible estimar las fuerzas y movimientos desarrollados por puentes cruzados individuales (Finer, Simmons y Spudich, 1994). Los movimientos, medidos sin ninguna fuerza opuesta, promediaron 11 nm, y fueron más grandes que los predichos 94 por Rayment et al. (1993). Cuando se aplicó retroalimentación con un sistema de láser para evitar el movimiento del filamento de actina, una sola cabeza de miosina generó una fuerza de 3 a 4 pN. Los filamentos de actina contienen dos proteínas reguladoras, la tropomiosina y troponina. La tropomiosina es más bien similar a la cola de la molécula de miosina. Consiste de una doble hélice que se localiza sobre la superficie del filamento de actina y lo hace rígido; cada molécula de tropomiosina se extiende a lo largo de siete moléculas de actina. La troponina es un complejo de tres polipéptidos (ver fig. 12), uno de los cuales (la troponina T) permite su unión a la tropomiosina. La troponina I , se une a la actina y evita a ésta ultima de manera indirecta interactuar con la cabeza de miosina. Durante la excitación muscular se libera Ca++ desde el retículo sarcoplásmico hacia el citosol, al unirse el Ca++ a la troponina C se vence el efecto inhibitorio de la troponina I; cuando ocurre esto, sufre un cambio conformacional que retira la molécula de tropomiosina del filamento de actina. Al moverse la tropomiosina, se exponen los sitios en el filamento de actina, donde se unen las cabezas de miosina, al interactuar ambos elementos se inicia la contracción (McComas, A. J. 1996). Unión entre actina, miosina y ATP. Para la interacción y el movimiento de los filamentos de proteína durante la acción del músculo se necesita que los puentes cruzados de la miosina continuamente sufran movimientos oscilatorios para combinarse, desprenderse y recombinarse a nuevos sitios (o a los mismo sitios en una contracción isométrica) a lo largo de los filamentos de actina. El desprendimiento de los puentes cruzados de miosina de los filamentos de actina es llevado a cabo cuando la molécula de ATP se une al complejo de actomiosina. Esta reacción química posibilita que los puentes cruzados de miosina regresen a su estado original y hacerlos disponibles para unirse a nuevos sitios sobre la actina. La disociación de la actomiosina ocurre como sigue: Actomiosina + ATP → Actina + Miosina-ATP La conversión de la energía por la hidrólisis de ATP en fuerza mecánica ocurre durante la formación de productos finales, ADP y fosfato inorgánico. Uno de los sitios reactantes en la cabeza globular del puente cruzado de la miosina se une al sitio reactante de la actina. Otro sitio activo de la miosina actúa como enzima activada por actina, la adenosintrifosfatasa miofibrilar (miosina ATPasa). Esta enzima divide al ATP y su energía puede ser utilizada para la actividad muscular. La velocidad de la hidrólisis del ATP es relativamente lenta si la miosina y la actina se encuentran separadas; cuando se unen, la velocidad reactiva de la miosina ATPasa aumenta considerablemente. Se cree que la energía liberada de la división del ATP de algún modo activa los puentes cruzados, causando que oscilen. Este proceso de transferencia de energía causa un cambio conformacional de la cabeza globular del puente de miosina para así interactuar con la molécula de actina apropiada (McArdle, e t a l . 1996) La cabeza alargada de la miosina no es rígida. Antes de la actividad muscular, la cabeza de miosina literalmente se inclina hacia la molécula de ATP transportadora de energía y es flexible, casi como un resorte. La miosina entonces interactúa con el filamento adyacente de actina, desprende un fosfato del ATP y libera su energía mecánica almacenada y su rigidez. Esto inicia el movimiento 94 deslizante que hace que el músculo genere tensión. Los filamentos de actina y miosina pueden deslizarse, pasando uno sobre otro, a una velocidad de 15 µm/s (Billeter y Hoppeler, 1992). XVI.- ACOPLE EXCITACION-CONTRACCION El mecanismo de acople excitación-contracción ocurre en dos pasos. Los túbulos T conducen la señal eléctrica hacia el interior de la fibra. Los túbulos T conducen los impulsos al interior de la fibra. Los iones de Ca++ son necesarios para que ocurra la contracción. El Ca++ es liberado hacia el citosol desde el retículo sarcoplásmico. En el mecanismo de la liberación de Ca++ intervienen dos tipos de canales de Ca++. Los canales DHP y rianodina pueden estar conectados mecánicamente. Las señales químicas entre los canales DHP y rianodina no deben ser excluidas. Los iones de Ca++ son bombeados desde el citosol hacia el RS. Relajación. Secuencia de eventos en la contracción muscular. XVI.ACOPLE CONTRACCION EXCITACION- El acople excitación-contracción es el mecanismo fisiológico por medio del cual un potencial de acción en el músculo inicia los eventos químicos en la superficie celular que llevan a la liberación del calcio intracelular y causan la actividad muscular, como se explicó en la sección anterior. El Ca++ intracelular está involucrado íntimamente en la regulación de la actividad contráctil y metabólica celular. En la fibra muscular inactiva la concentración de Ca ++ es relativamente baja comparada con la concentración existente en el fluido que baña a la célula. Cuando la fibra es estimulada, existe un pequeño incremento inmediato de Ca++ intracelular, el cual antecede la iniciación de la contracción muscular. Este incremento de Ca++ es iniciado por el potencial de acción que llega por los túbulos transversos (Fig. 33) provocando la liberación de Ca++ desde los sacos laterales del retículo sarcoplásmico. En preparaciones de músculo aislado, existe evidencia de que enseguida de una sacudida muscular generada por estimulación, aumenta hasta tres veces la velocidad de la liberación de Ca++ y de la fase depolarizante del potencial de acción en las fibras musculares tipo II (de sacudida rápida) comparadas con las de tipo I (de sacudida lenta) (Rugg, 1986). Esto podría ser posible por el rápido transporte de Ca++ desde el retículo sarcoplásmico y finalmente por las proteínas contráctiles de la Actomiosina en las fibras de tipo II. Durante este acople de excitación-contracción , ocurre una serie de eventos electroquímicos en el sitio de excitación de las membranas celulares. La ruta común para liberar las señales químicas hacia las proteínas contráctiles depende en alto grado de canales iónicos reguladores. Esas estructuras actúan como compuertas selectivas o "sensores" para modular el paso de los iones entre los fluidos intracelular y extracelular antes de la activación de los filamentos. El mecanismo de acople excitacióncontracción ocurre en dos pasos. Como se notó previamente, la señal para que se inicie una contracción es la elevación repentina de la concentración de los iones de Ca++ en la cercanía de los filamentos de miosina y actina. En esta forma el Ca ++ actúa como segundo mensajero, actuando como un intermediario entre el potencial de acción y el aparato contráctil. El acople excitación-contracción es el mecanismo celular por el cual la concentración de Ca ++ aumenta y toma lugar en dos pasos: (1) depolarización de los túbulos T, y (2) la difusión de los iones de Ca++ desde el retículo sarcoplásmico hacia los miofilamentos. Los túbulos T conducen la señal eléctrica hacia el interior de la fibra. El papel clave del sistema T en el acople excitación-contracción se demostró por dos planteamientos experimentales contrastantes. Primero, A. F. Huxley y Taylor (1958) aplicaron débiles corrientes de estimulación en diferentes puntos a lo largo de la superficie de fibras musculares de rana. Encontraron que la contracción local de las miofibrillas sólo ocurrió cuando la punta del electrodo estaba sobre la banda I, en el centro de la cual están situados los túbulos T. En el segundo tipo de experimentos, Gage y Eisenberg (1969) demostraron que los potenciales de acción fueron incapaces de generar sacudidas en las fibras musculares tratadas con glicerol. En esos experimentos, el glicerol fue adicionado al fluido de baño fisiológico y difundido a las fibras musculares. Cuando las fibras fueron regresadas a una solución libre de glicerol, los túbulos T se separaron de la superficie del plasmalema. La velocidad con la cual la señal para la contracción viaja dentro de la fibra, fue medida por Gonzalez-Serratos (1971). La técnica usada fue la de fijar fibras aisladas del semitendinoso de rana en Ringer-gelatina y las comprimió longitudinalmente; las miofibrillas fueron fotografiadas con una cámara de cine de alta velocidad; en el acortamiento, se enderezaron en lugar de ondularse. Esto demostró que potencial de acción evocado ocasionó que se contrajeran primero las miofibrillas superficiales y las del centro después. A 20° C la velocidad de propagación activa hacia el interior fue de 7 cm/s. Los túbulos T conducen los impulsos al interior de la fibra. Por sí mismas, las mediciones de la velocidad de activación de entrada y de su cambio con la temperatura no permiten determinar la naturaleza de la propagación al interior. En teoría dos mecanismos son posibles. Uno de ellos consiste en la propagación pasiva electrotónica de depolarización a lo largo del sistema T, y el otro, es que los túbulos propagan los potenciales de acción hacia el centro de la fibra. Una forma de decidir entre esas dos posibilidades fue suprimir, con tetrodotoxina, cualquier potencial de acción propagado y depolarizando la superficie del plasmalema utilizando un electrodo de estimulación intracelular. De este modo, sólo fueron observados los efectos de la propagación electrotónica. Adrian, Costantin y Peachey (1969) encontraron que cuando se usaban estímulos breves, sólo podían contraerse las miofibrillas superficiales cuando la membrana de la fibra había sido depolarizada a 0 mV; siendo necesarias mayores depolarizaciones de la membrana para hacer que las fibrillas centrales se acortaran. En una ingeniosa extensión de su trabajo, los mismos autores aplicaron un potencial de acción artificial sobre la membrana usando un circuito de fijación de voltaje basado en un potencial de acción de otra fibra. Parece que la inversión de la polaridad de la membrana durante el pico es suficiente para activar las fibrillas centrales por propagación electrotónica a lo largo del sistema T. Sí, sin embargo, el mismo tipo de experimento es realizado sobre músculo de sapo a 20°C se observa que el potencial de acción de superficie sólo produce cerca del 30% de la tensión normal , el restante 70% presumiblemente requiere un impulso propagado en los túbulos T (Bastian & Nakajima, 1974). Otra evidencia indirecta para el impulso T proviene del trabajo de Costantin (1970), que investigó las respuestas de fibras musculares aisladas de rana por estimulación focal por medio de un microelectrodo. Por la reducción de la concentración de Na + en la solución de baño de la fibra, se evitó la iniciación del potencial de acción en la superficie del plasmalema. Costantin encontró que las miofibrillas centrales y superficiales tienen umbrales muy similares para la contracción, sugiriendo que un mecanismo activo estaba presente y sería efectivo en el sistema T aún cuando estuviera ausente en la superficie de la fibra. Esta conclusión fue reforzada por los resultados de experimentos utilizando tetrodotoxina, en los cuales las miofibrillas superficiales ahora presentaban umbrales más bajos que las centrales y fueron las primeras en acortarse. Bajo esas últimas condiciones, sólo podían haber tomado lugar depolarizaciones pasivas electrotónicas en el interior de la fibra. La evidencia más convincente de los potenciales de acción internamente propagados podría ser registrarlos. Aunque se han hecho varios esfuerzos para hacer esto (Strickholm, 1974; Natori, 1975), existe duda de la significancia de los potenciales registrados. Los iones de Ca++ son necesarios para que ocurra la contracción. Se conoce que los iones de Ca ++ juegan un papel importante en la contracción muscular desde que Ringer (1883) demostró que el corazón de rana dejaba de latir si este elemento se omite de la solución de baño. Mines (1913) fue capaz de demostrar que el corazón en reposo genera potenciales de acción, indicando que los iones de Ca++ eran requeridos para algún paso más allá de la excitación de las fibras. De manera similar, en el caso del músculo esquelético, Frank (1958) mostró que las fibras musculares de rana no desarrollaban contracturas cuando se colocaron en soluciones ricas en K+ a menos que el Ca++ también estuviera presente. Posteriores evidencias del importante papel del Ca++ es que las inyecciones de este ion dentro de una fibra muscular por medio de una pipeta evoca contracciones locales; los iones de Na +, el K + y el Mg ++ no son efectivos (Heilbrunn y Wiercinski, 1947). Otros experimentos se han realizado en fibras musculares desnudas, por remoción del plasmalema, y entonces se les induce la contracción por la aplicación directa, con una micropipeta, de iones de calcio a las miofibrillas (la preparación de Natori; ver Podolsky, 1964). El Ca++ es liberado hacia el citosol desde el retículo sarcoplásmico. Los iones de Ca ++ , los cuales son necesarios para que ocurra la contracción, son liberados desde el retículo sarcoplásmico; el inicio y la duración del eflujo puede ser medido con colorantes sensibles a Ca++. En el primero de tales estudios, Ashley y Ridgway (1968, 1970) inyectaron fibras musculares grandes, aisladas de percebes con aqueorin, una proteína que luminesce en la presencia de iones Ca++. Enseguida se estimularon directamente, la luz emitida por la fibra se detectó por un tubo fotomultiplicador, y la salida eléctrica de este último se amplificó y se mostró en un osciloscopio; la depolarización de la membrana y la fuerza generada por la fibra también se registraron. Ashley y Ridgway fueron capaces de mostrar que los iones de Ca++ son liberados entre el inicio de la respuesta de la membrana y el inicio de la contracción muscular, como se esperaría para un mecanismo acoplado. La concentración de iones Ca++ aumenta rápidamente durante la respuesta de la membrana y empieza a caer cuando ésta termina. El cambio en la tensión muscular transcurre mucho más lento. La relajación inicia cuando la concentración de iones Ca++ ha regresado a su valor de reposo. Esta última observación es de considerable interés, podría indicar que la relajación no resulta simplemente de la remoción del Ca++ sino, al menos en músculos de percebe, también podría intervenir un paso intermedio. Otros experimentos, que mostraron oscilaciones transitorias de Ca++ que ocurren entre la excitación y contracción, fueron reportadas subsecuentemente para músculo de rana (Rüdel y Taylor, 1973) y músculo de ratón (Westerblad y Allen, 1991). Las oscilaciones transitorias de ++ Ca han sido medidas también cuando, en lugar de un sólo estímulo, se aplican a la fibra muscular una serie de estímulos. Se observa que la concentración de Ca++ se eleva a un nivel más alto y entonces se estabiliza. El aumento en la concentración de Ca++ en el citosol después de la excitación es impresionante; la concentración en reposo es de sólo 10-7 M, pero después de estímulos sucesivos, se eleva hasta 10-5 M, un cambio de 100 veces (McComas, 1996). En el mecanismo de la liberación de Ca ++ intervienen dos tipos de canales de Ca++. La señal eléctrica que se propaga por los túbulos T usa dos tipos de canales de Ca++ para liberar Ca++ desde el retículo sarcoplásmico (RS). El primer tipo (Fig. 34) es llamado canal DHP porque puede ser bloqueado por dihidropiridina; es un ejemplo de un canal L (large o long-lasting) de Ca ++. Este tipo de canal se encuentra en alta densidad en la membrana de los túbulos T. De acuerdo con Fosset, Jaimovich, Delpont y Lazdunski (1983), la densidad de receptores DHP encontrados en los túbulos T del músculo esquelético es cerca de 50 a 100 veces mayor que los de cualquier otro tejido. A diferencia de los canales L en otras membranas, la función de los canales DHP no es permear los iones de Ca++ porque las fibras musculares de vertebrados pueden contraerse aún si este ion se omite del fluido de baño (Armstrong, Bezanilla y Horowics, 1972). Más bien, el canal DHP parece actuar primariamente como un sensor de voltaje que transmite una señal a un segundo tipo de canal de Ca++, encontrado en la membrana del RS. Este segundo tipo de canal es el receptor de rianodina (RYR) que es una proteína enorme, que consiste de cuatro subunidades, cada una tiene un peso molecular de 564 kD (McComas, 1996). Las micrografías electrónicas de bajo poder de fibras musculares muestran que los túbulos T y el RS tienen una relación especial; un túbulo T y las cisternas terminales del RS de ambos lados forman una triada. Con las micrografías electrónicas de alto poder se pueden identificar los canales DHP en los túbulos T y los canales de rianodina en el RS. Se ha visto que los dos tipos de canales tienen una relación precisa de unos con otros; así los canales DHP están presentes en grupos de cuatro (Fig. 34) y cada una de esas tetradas coincide con uno de cada dos de los canales de rianodina. Aún en algunos de los primeros estudios de microscopía electrónica de las triadas, fue posible identificar estructuras adicionales (Fig. 33B), los pies (FranziniArmstrong, 1970), que se extienden entre el espacio de 15 nm que está separando el sistema tubular T y las membranas de RS, se conoce ahora que forman parte del canal de rianodina. La reconstrucción tridimensional de múltiples micrografías electrónicas ha revelado más detalles del canal de rianodina (Wagenknecht, e t a l . 1989), Este canal al parecer, tiene un poro central el cual corre por la parte de la molécula que yace en la membrana del RS. Este poro esta conectado a cuatro salidas radiales en la parte del pie de la molécula, y esos, a su vez, abren en el espacio entre el RS y el túbulo T. El poro central y los 4 orificios radiales presumiblemente proporcionan la ruta para que los iones de Ca++ salgan desde RS hacia el citosol. Los canales DHP y rianodina pueden estar conectados mecánicamente. ¿Como puede una señal alcanzar desde el canal DHP al canal de rianodina? Antes de que las estructuras de los dos canales fueran conocidas Chandler, Rakowski, y Schneider (1976) sugirieron que ambos canales estaban acoplados físicamente uno al otro. En este modelo el canal DHP, después de la activación, podría ser capaz de desconectar el canal de rianodina por medio de una varilla conectora. La nueva información con respecto al receptor de rianodina, descrito previamente, podría ser bastante consistente con tal modelo. Por ejemplo, la parte superior del pie del canal de rianodina podría estar unido al canal DHP; el cambio conformacional del canal DHP, generado con una señal de voltaje en el túbulo T, podría entonces jalar la parte superior del canal de rianodina y permitir al Ca++ fluir desde el RS a través de los cuatro orificios radiales (Ríos, Ma, y González, 1991). Las señales químicas entre los canales DHP y rianodina no deben ser excluidas. El mecanismo "de pistón" propuesto por Chandler et al. (1976) no puede ser el único medio por el cual el canal DHP puede activar el canal de rianodina. Mecanismos adicionales pueden incluir a los iones de Ca++ y el inositol trifosfato (IP3). El papel para el Ca++ podría ser consistente con las oscilaciones transitorias de Ca++ registradas en el citosol después de la excitación; también, la liberación de Ca++ desde el RS parece estar afectado positivamente por el nivel de Ca++ en el citosol (McComas, 1996). La evidencia que favorece el IP3 es que este mensajero aumenta rápidamente en el citosol después de la estimulación de la fibra muscular (Nosek, Guo, Ginsburg y Kolbeck, 1990) y que, aún en muy bajas concentraciones éste puede liberar los iones de Ca++ desde el RS. Un papel obvio para el Ca ++ o para el IP 3 podría ser abrir los canales de rianodina alternados que no están opuestos a las tetradas de DHP. Los iones de Ca++ son bombeados desde el citosol hacia el RS. Las contracciones musculares deben terminar en el momento apropiado, y las fibras musculares lo consiguen por el bombeo de los iones Ca++ de regreso, desde el citosol hacia el RS. Puesto que la bomba tiene que mover los iones Ca++ contra un elevado gradiente de concentración, requiere de ATP para obtener la energía necesaria. Con cada ciclo de la bomba, dos iones de Ca++ son transportados al interior del RS a cambio de dos iones de K+; este intercambio desigual de cargas positivas ocasiona que el citosol cerca del RS se vuelva cada vez más negativo. Conforme los iones de Ca++ entran al RS, son separados de la bomba y tomados por proteínas ligantes de Ca++, tales como la enzima ATPasa de alta afinidad así como también por la calsequestrina de baja afinidad. Puesto que las bombas individuales tienen una baja capacidad para transportar iones (20/s), es necesario que el RS tenga una alta densidad de bombas en su membrana de tal manera que baje rápidamente la concentración de Ca++ en el citosol. Las micrografías electrónicas de fractura por congelación revelan partículas redondeadas, casi indudablemente son las bombas de Ca++, que están empacadas estrechamente una contra otra en la membrana del RS (McComas, 1996). Relajación. Cuando un músculo deja de ser estimulado, el flujo de Ca++ cesa y la troponina se encuentra libre de nuevo para inhibir la interacción actina-miosina. Durante la recuperación, el calcio es bombeado activamente hacia dentro del retículo sarcoplásmico, concentrándose en las ++ vesículas laterales. Al retirarse el Ca de las proteínas troponina-tropomiosina, se "apagan" los sitios activos en el filamento de actina. Esta inactivación genera dos cosas: (a) evita cualquier unión mecánica entre los puentes cruzados de la miosina y los filamentos de actina, y (b) inhibe la actividad de la miosina ATPasa para restringir la hidrólisis del ATP. La relajación muscular ocurre por el regreso de los filamentos de actina y miosina a su posición original. Secuencia de eventos en la contracción muscular. En la figura 35 se muestra esquemáticamente la serie de eventos que ocurren durante la contracción y relajación muscular. Paso 1: La acetilcolina (ACh) es liberada por las pequeñas vesículas localizadas dentro de las terminales del axón. La ACh difunde a la hendidura sináptica y se une a receptores especializados en el sarcolema. Existe una simetría casi perfecta entre el "impreso" de las vesículas presinápticas que contienen la ACh y el "impreso" de los receptores postsinápticos que ligan la ACh. Paso 2: El potencial de acción del músculo depolariza los túbulos T en la unión de las bandas A-I del sarcómero. Paso 3: La depolarización del sistema de túbulos T ocasiona que el Ca + se libere desde los sacos laterales (cisternas terminales) del retículo sarcoplásmico. Paso 4: Los iones de Ca++ se unen al complejo troponina-tropomiosina en los filamentos de actina, lo cual elimina la inhibición que evita que la actina se combine con la miosina. Paso 5: Durante la actividad muscular, la actina se combina con la miosina ATP. La actina también activa la enzima miosina ATPasa, la cual hidroliza al ATP. La tensión es creada porque la energía de esta reacción produce el movimiento de los puentes cruzados de la miosina. Paso 6: El ATP se une al puente de la miosina. Esto rompe la unión actinamiosina y permite al puente cruzado disociarse de la actina. Esto lleva a un movimiento relativo o deslizamiento de los filamentos delgados y gruesos pasando uno sobre el otro, como consecuencia el músculo se acorta. Paso 7: La activación de los puentes cruzados continúa mientras la concentración de Ca++ permanezca lo suficientemente elevada (debido a la depolarización de la membrana) para inhibir la acción del sistema troponina-tropomiosina. Paso 8: Cuando el músculo ya no es estimulado, la concentración de Ca ++ disminuye rápidamente ya que el Ca++ es regresado hacia el retículo sarcoplásmico por medio de un proceso activo que requiere de hidrólisis de ATP. Paso 9: La remoción del Ca++ restablece la acción inhibitoria de la troponina-tropomiosina. En presencia de ATP, la actina y la miosina permanecen disociadas y por lo tanto en un estado relajado. XVII.- ESTADO ACTIVO. La duración del estado activo es más corta que la de la sacudida. El estado activo puede ser prolongado por la estimulación repetitiva. Efectos de la longitud muscular y carga. La velocidad y el grado de acortamiento muscular dependen de la carga. La fuerza muscular está determinada por la velocidad de acortamiento y la carga. XVII.- ESTADO ACTIVO. El estado activo corresponde a la formación de complejos de actomiosina por unión de los puentes cruzados de miosina a los filamentos de actina y la ulterior actividad de acortamiento por los puentes cruzados. Como esta actividad de los puentes cruzados está controlada por la concentración de calcio libre en el sarcoplasma, la duración y la intensidad del estado activo depende de la concentración de Ca++ que rodea a los filamentos contráctiles, la variación en el tiempo del estado activo se cree que se aproxima a la que experimenta el aumento en la concentración de calcio en el sarcoplasma (Eckert, 1990). La duración del estado activo es más corta que la de la sacudida. Los registros isométricos de las sacudidas musculares dan una pobre indicación de la intensidad y duración del estado activo a causa de los componentes elásticos que se encuentran en serie con los elementos contráctiles. Una vez que los componentes elásticos en serie han sido estirados la tensión puede ser registrada, el estado activo inicia, antes del comienzo de la sacudida isométrica y tiene una duración que es menor que el tiempo de contracción (Fig. 36); la tensión generada por los puentes cruzados será mayor que la registrada (McComas, 1996). El estado activo puede ser prolongado por la estimulación repetitiva. Un modo simple de prolongar el estado activo es dar a la fibra una secuencia rápida de estímulos. El estado activo que sigue a cada excitación entonces se une al siguiente, y como hay suficiente tiempo para que todas las componentes elásticas en serie sean reclutadas por los elementos contráctiles, la tensión registrada es considerablemente mayor que la de una sola sacudida (Fig. 36). Conforme la frecuencia de estimulación se aumenta, la tensión (fuerza) se eleva gradualmente; finalmente se alcanza una frecuencia más allá de la cual ya no se genera una tensión mayor. Esta última frecuencia es el valor óptimo y es mayor en los músculos de sacudida rápida que en los músculos de sacudida lenta (McComas, 1996) En ese momento el músculo ha alcanzado entonces una tensión tetánica completa. (La prolongación del estado activo por potenciales de acción próximos repetidos se denomina tétanos.). Como se observa en la figura 36, dependiendo de la tasa de repetición de los potenciales de acción musculares, se producen varios grados de fusión de las contracciones aisladas y de tensión tetánica (Eckert, 1990). Otra propiedad de los músculos contraídos es que después de que se ha detenido el tétanos, la respuesta de sacudida a estímulos individuales, aplicados durante los pocos segundos siguientes, permanecen agrandadas; el mismo fenómeno puede ser demostrado enseguida de una contracción voluntaria, particularmente en los músculos de sacudida rápida. Este comportamiento ha sido llamado potenciación postetánica y es debido probablemente a una alteración temporal en la intensidad o duración del estado activo. Tal potenciación se ha atribuido a la fosforilación de las cadenas ligeras de la cabeza de la miosina (Moore y Stull, 1984), pero otro mecanismo posible es la elevación del Ca++ en el citosol por un lapso corto después de terminar el tétanos o la activación voluntaria (Allen, Lee y Westerblad, 1989). La misma explicación se ha dado al fenómeno de la escalera positiva que fue observado originalmente en el músculo gastrocnemio de rana pero también ha sido demostrado en el músculo adductor pollicis del humano (Slomic, Rosenfalck y Buchthal, 1968). Consiste de un crecimiento progresivo de las sacudidas isométricas cuando los estímulos son aplicados a bajas frecuencias, tal como 2 Hz. Efectos de la longitud muscular y carga En situaciones experimentales, es común estudiar el comportamiento contráctil de las fibras musculares bajo condiciones isotónicas o isométricas, porque el análisis de los resultados es considerablemente fácil. En una contracción isotópica, el músculo se acorta y levanta alguna carga que esté unida a su tendón. Bajo esas circunstancias, se realiza trabajo externo que es igual al producto de la carga y la distancia recorrida (es decir trabajo = carga x distancia). En una contracción isométrica, al músculo fijado por sus dos extremos se le impide acortarse. En lugar de realizar trabajo externo el músculo desarrolla tensión en sus puntos de unión; la energía generada en la contracción es liberada como calor. En la vida diaria existen muchos ejemplos de contracciones que son por completo isotónicas ó isométricas. Las contracciones isotónicas incluyen, por ejemplo, andar en bicicleta, peinarse, colocar objetos en anaqueles o cargar un carro en el supermercado. Una contracción isométrica podría ser el intento sin resultado de levantar un objeto demasiado pesado, hacer una fuerza contraria para evitar que un objeto se nos caiga encima o simplemente mantener nuestra postura en contra de la gravedad. Otras actividades son mas complejas, por ejemplo, al caminar hacia adelante el balanceo de las piernas es ejecutado por la acción de los músculos de los glúteos, los cuales desarrollan tensión mientras se alargan. En el hombre, a las contracciones en las cuales se les permite acortarse a los músculos (Fig. 37) normalmente se les refiere como concéntricas, y a las contracciones llevadas a cabo durante el alargamiento muscular se les denomina excéntricas (McComas, 1996). La velocidad y el grado de acortamiento muscular dependen de la carga. Es una experiencia bien conocida que el levantamiento se vuelve cada vez más lento al hacerse más grande la carga. En el laboratorio, este fenómeno puede ser investigado al estimular de forma repetida al músculo (tetánicamente) y medir la velocidad del acortamiento muscular para diferentes cargas. Se puede ver que, no solo se reduce la velocidad de acortamiento cuando es aplicada una carga relativamente grande, sino que hay un periodo latente antes de que el objeto sea movido del todo. Durante este periodo latente, el músculo se contrae isométricamente hasta que se produce la suficiente tensión que iguale a la carga. No solo se reduce la velocidad de acortamiento por cargas pesadas, sino que también disminuye la cantidad de acortamiento. Un punto a ser remarcado es que, independientemente de las circunstancias de la contracción - isotónica, isométrica, o alargamiento- las interacciones entre los puentes cruzados y los filamentos de actina son las mismas, en donde los puentes cruzados se enlazan y se esfuerzan para deslizar a estos últimos a todo lo largo. En una contracción isotónica (concéntrica) con una carga pequeña, el movimiento deslizante permite a los filamentos de miosina traslaparse completamente por los de actina. En una contracción isométrica, la cantidad de traslape de los filamentos depende de la longitud en la cual, previa a la activación, se haya mantenido al músculo. Durante la activación los puentes cruzados repentinamente hacen y deshacen conexiones con los filamentos de actina, produciendo una tensión igual a la de la carga externa pero no hay movimiento de los filamentos de actina. En una contracción de alargamiento (excéntrica), los puentes cruzados generan menos tensión que la fuerza externa de estiramiento aplicada al músculo, por lo consiguiente, en los sarcómeros los filamentos de actina opuestos son retirados uno del otro (McComas, 1996). La fuerza muscular está determinada por la velocidad de acortamiento y la carga. Por definición, la fuerza desarrollada por un músculo en una contracción es igual al producto de la carga y la velocidad con la cual ésta es movida. Así, Fuerza = Carga x Velocidad La inspección de la curva de fuerza velocidad indica que la fuerza será cero cuando no existe carga sobre el músculo y también cuando la carga es tan pesada que no puede ser movida del todo; en algunas cargas intermedias, la fuerza sería mayor. Para muchas actividades, tales como correr, saltar, remar y andar en bicicleta, el resultado sería gobernado por la fuerza que pueda ser desarrollada. Como un ejemplo de la investigación en este campo, se analizó por Sargeant, Dolan y Young (1984) la relación entre la velocidad del pedaleo y la fuerza generada durante el ciclismo de velocidad. La composición de los tipos de fibras musculares sería también importante para decidir cuanta fuerza puede ser desarrollada. Por ejemplo, mientras un músculo de sacudida lenta no puede ser capaz de acortarse los suficientemente rápido para generar una fuerza dada, un músculo de sacudida rápida sí puede hacerlo. XVIII.- PROPIEDADES MECANICAS PASIVAS. La molécula de Titina (Conectina) Un papel fisiológico para la titina en el músculo esquelético. La titina tiene dos funciones dentro del músculo. Titinas: proteínas gigantes encargadas de la elasticidad y de la ultraestructura del músculo. Generación de fuerza pasiva e isoformas de la tinina en músculo esquelético de mamífero. Composición proteica miofibrilar de fibras desnudas aisladas. Bases moleculares de las diferencias específicas de isoforma en la elasticidad de la titina. La titina como resorte molecular. Implicaciones fisiológicas de la molécula de titina. Estiramiento de moléculas de titina. XVIII.- PROPIEDADES PASIVAS. MECANICAS Una forma simple de fuerza muscular es la tensión "pasiva" que se desarrolla cuando los músculos son estirados. La suma de las tensiones pasiva y activa es la fuerza total desarrollada por un músculo. La tensión pasiva es comúnmente atribuida a fuerzas elásticas del tejido conectivo y no a la elasticidad miofibrilar (Banus y Zetlin, 1938; Hill, 1950). Estos primeros puntos de vista contrastan con la más reciente demostración de que la tensión pasiva de fibras individuales tienen su origen por mucho en las miofibrillas, con una pequeña contribución, en longitudes extremas, de las fibrillas de colágena del sarcolema (Rapaport, 1972). Se ha demostrado que la tensión pasiva de las fibras musculares esqueléticas intactas es equivalente a la de las fibras musculares esqueléticas desnudas (Magid, 1985). En músculos semitendinosos intactos de rana en longitudes sarcoméricas cerca de 3.8 µm, la tensión de reposo surge, no en el tejido conectivo como comúnmente se ha pensado, sino en la resistencia elástica de las miofibrillas (Magid, 1985). Se cree que el tejido conectivo se vuelve importante en la contribución de tensión de reposo en los músculos semitendinosos completos de rana sólo en longitudes sarcoméricas mayores a 3.8 m. Cuatro observaciones apoyan esta idea. (i) Rapaport (1972, 1973) mostró esa situación en fibras aisladas intactas. (ii) La tensión pasiva cayó substancialmente por debajo del incremento exponencial cerca de esa longitud en fibras desnudadas mecánicamente, mientras que en los músculos completos no lo hizo. (iii) Schmalbruch (1974) reportó que las fibrillas de colágena del sarcolema estuvieron elongadas inicialmente, pero se alinearon con el eje de la fibra en la longitud donde la tensión de reposo aumentó marcadamente. (iv) Miocitos cardiacos de rata mecánicamente desnudos, aunque mostraron una tensión de reposo apreciable, pudieron ser estirados aún más que las células intactas (Fabiato y Fabiato, 1978). Sobre las base de esas consideraciones se concluye que, sobre el rango de longitudes sarcoméricas involucradas en los movimientos naturales, la resistencia pasiva para el estiramiento surge en su mayor parte de las miofibrillas. ¿Que componente del sarcómero incluye esta elasticidad de reposo? En el músculo del vuelo de los insectos, las conexiones filamentosas entre los filamentos gruesos y las líneas Z cumplen esta función (White, 1967). Un arreglo similar ha sido propuesto para los músculos estriados de los vertebrados. La producción de fuerza activa en el músculo esquelético resulta de la interacción de los filamentos gruesos que contienen miosina con los filamentos delgados que contienen actina. Además, los músculos son también pasivamente elásticos, producen fuerzas pasivas que resisten el estiramiento independientemente de la hidrólisis del ATP o de la interacción entre los filamentos. Actualmente se piensa que la mayoría de esta fuerza pasiva, o tensión de reposo, surge del estiramiento de largos filamentos elásticos compuestos de titina (Horowits, et al. 1986; Yoshioka, et al. 1986; Horowits y Podolsky, 1987; Funatsu, et al. 1990; Horowits, 1992). Los primeros estudios fisiológicos sobre la elasticidad del músculo generalmente se han modelado a partir de elementos elásticos acomodados ya sea en serie o en paralelo con una unidad contráctil, sin especificar su origen anatómico. Estudios recientes indican que dentro del rango fisiológico, en los cambios de longitud del músculo, las estructuras miofibrilares son la principal fuente de elasticidad y que el sarcolema y los tejidos conectivos extracelulares contribuyen significativamente sólo en músculos esqueléticos bastante extendidos. Puesto que ni los filamentos de actina ni de miosina poseen elasticidad de largo alcance, el citoesqueleto asociado al sarcómero podría desempeñar un papel predominante. Los primeros candidatos son dos armazones bioquímicamente distintas pero estructuralmente interconectadas. Una es una red exosarcomérica de filamentos intermedios que envuelven e interconectan a los sarcómeros (costámero) con el esqueleto asociado a la membrana y organelos. A causa de que los sarcómeros están unidos radialmente en paralelo con otras miofibrillas (Fig. 15) y longitudinalmente con los sarcómeros adyacentes de la misma miofibrilla (Fig. 4 ) en las líneas Z y M, esta red de filamentos intermedios es potencialmente productora de fuerza en las células musculares. El segundo candidato es una matriz endosarcomérica recién reconocida que consiste de un grupo de filamentos extensibles de titina, que se extienden desde la línea Z hasta la región de la línea M. En el sarcómero intacto, un solo polipéptido de titina abarca la mitad de un sarcómero y está formado por dos segmentos mecánicos: el segmento entre la línea Z y el borde de la banda A es extensible, mientras que el segmento dentro de la banda A está anclado (Fig. 11) y no se puede estirar presumiblemente por su interacción con los filamentos gruesos o proteínas asociadas. Así los filamentos compuestos de titina-miosina podrían desempeñar extensibilidad segmentaria (Wang, et al. 1993). La molécula de Titina (Conectina) Con una subunidad de peso molecular de 2.5-3 millones de daltones (Maruyama, et al. 1984; Kurzban y Wang, 1988), la molécula de titina o conectina es inusualmente larga. La titina migra en dos bandas química e inmunológicamente similares sobre gel de poliacrilamida SDS. La banda que migra más lentamente es más prominente, y las estimaciones de la masa molecular relativa (M,) del componente más pesado indican que varía desde 1 400 a 2 800 Kd (Wang, 1985; Maruyama et al. 1984). En cada mitad de los miles de unidades contráctiles -sarcómeros- que forman un músculo, se ha demostrado por medio de anticuerpos monoclonales marcados, que las moléculas de titina individuales (Fig. 38) se extienden en la distancia >1 µm desde los discos Z hasta el centro del sarcómero en las líneas M (Keller, 1997); y están divididas en una región no elástica que está rígidamente unida a lo largo de la longitud del filamento grueso y en una región elástica que está uniendo el extremo del filamento grueso con los discos Z (Wang, el al. 1985; Furst, el al. 1988; Itoh, el al. 1988; Horowits, el al. 1989; Whiting, el al. 1989). Es decir, la titina está localizada tanto en la banda A como en la banda I, pero sólo el dominio de la banda I exhibe dependencia elástica al estiramiento (Maruyama, el al. 1981; Wang et al. 1979) Las claves para el entendimiento de las propiedades mecánicas de la titina surgieron de la donación que reveló la secuencia completa de la titina del músculo estriado de humano (Granzier, el al. 1996), y de una mini-titina de invertebrados. La titina es principalmente un resorte de 300 repeticiones de inmunoglobulina (Ig) C2 y de fibronectina tipo III (Labeit y Kolmerer 1995). La mayoría de los ≈ 30 000 aminoácidos de la molécula de titina de los vertebrados se pliegan en arreglos uno tras otro. En las repeticiones, cada uno de los dominios estructurales de inmunoglobulina y fibronectina III contiene X100 aminoácidos. Ambos dominios son estructuras parecidas a un emparedado que contiene siete bandas (3 (Fig. 39), y están estabilizados por puentes de hidrógeno localizados entre las bandas que forman cada hoja, y por interacciones de cadenas laterales entre las dos caras del emparedado (Keller, 1997). Cada repetición de inmunoglobulina se pliega en un dominio globular de cerca de 2.5 nm de diámetro y 4 nm de largo, produciendo un filamento de 12 µm de longitud. Fue propuesto anteriormente que el estiramiento de la titina podría desdoblar los dominios de inmunoglobulina, cada dominio extendiéndose desde 4 a 30 nm conforme se desenrollaba, sin embargo, la secuencia completa reveló un nuevo dominio (Fig. 38) llamado PEVK (porque es rico en prolina (P), ácido glutámico (E), valina (V) y (K) lisina en la mitad del segmento de la titina localizado en la banda I (Erickson, 1997; Keller, 1997). Usando unión de anticuerpos para monitorear regiones específicas de la molécula de titina, se ha mostrado claramente que el segmento PEVK se extiende reversiblemente (Linke, el al 1996). El mayor punto en discusión ha sido la parte de la resistencia al estiramiento que desempeña el desdoblamiento de los dominios de inmunoglobulina y de fibronectina III (Erickson, 1994). Los nuevos estudios sobre las propiedades viscoelásticas de las moléculas de titina aisladas (Tskhovrebova, el al. 1997; Rief, el al. 1997) confirman que los dominios de inmunoglobulina se desdoblan bajo condiciones extremas de estiramiento, y también revelan diferencias considerables en elasticidad entre el segmento PEVK y los dominios de inmunoglobulina. Un papel fisiológico para la titina en el músculo esquelético. En el estudio de Horowits el al. (1986) irradiaron tiras musculares desnudas del psoas de conejo. Al examinar la ultraestructura de fibras desnudas normales e irradiadas, observaron que las fibras relajadas irradiadas, fijadas después del estiramiento exhibieron zonas H bien definidas. La longitud de la zona H aumentó conforme la longitud del sarcómero fue incrementada desde 2.6 a 3.0 pm, indicando que la radiación dejó los filamentos delgados intactos y mecánicamente acoplados a los discos Z. Sin embargo, después de la radiación, los bordes de las bandas A no estaban exactamente definidos, y esto se acompañó por el desorden de la banda M en el centro del sarcómero, indicando desarreglo de los filamentos gruesos. Las fibras musculares fijadas durante la activación con Ca++, mostraron más desorden que las fibras en reposo, pero las líneas M y las bandas I fueron aún claramente visibles en las muestras no irradiadas. En contraste, la activación con Ca++ de las muestras irradiadas amplificaron el desarreglo de los filamentos gruesos, presente ya en el estado de reposo. En algunos sarcómeros esto lleva a una desaparición casi completa de la banda I conforme los filamentos gruesos individuales son activamente llevados hacia el disco Z más cercano. Aunque aún presentes, las regiones M están también más desordenadas que en los músculos activos no irradiados, pero las bandas A están más desordenadas que las líneas M. El aislamiento de las bandas A intactas ha indicado que las regiones M pueden jugar en parte un papel para mantener juntos a grupos de filamentos gruesos (Hanson, O'Brien y Bennett, 1971), pero los resultados de este estudio sugieren que la línea M es una estructura a través de la cual los filamentos gruesos individuales pueden deslizarse, como previamente se observó en estudios de músculo de vaca sobreestirados (Locker y Leet, 1975). Esos hallazgos indican que la radiación destruye a una estructura responsable para el centrado de los filamentos gruesos dentro del sarcómero durante la generación tanto de fuerza pasiva como activa. El modelo de los filamentos deslizantes predice que la posición de los filamentos gruesos en el centro de cada sarcómero es inherentemente inestable. Los filamentos de titina al estar colocados entre los discos Z y los filamentos gruesos, proporcionan una fuerza que mantiene la posición de los filamentos gruesos en el centro del sarcómero (Horowits, el al. 1989; Horowits y Podolsky, 1 9 8 7 , 1988). La influencia de la titina sobre la posición de los filamentos gruesos es crítica para la adecuada función del sarcómero, porque un sarcómero compuesto sólo de filamentos de actina y miosina es inestable cuando es activado. Esto es porque durante la contracción, la magnitud de la fuerza sobre cada mitad del filamento grueso es proporcional a la fracción de puentes cruzados que interactúan con los filamentos delgados (Gordon, el al. 1 9 6 6 b ). Por lo tanto, cualquier desequilibrio inicial en fuerza (lo cual podría ser causado por el centrado impreciso de los filamentos gruesos o por la desincronizada producción de fuerza por muchos puentes cruzados independientes) podría ser amplificado conforme el filamento grueso es jalado hacia un extremo del sarcómero (Horowits, 1992). Esos filamentos elásticos estirados podrían, en efecto, transmitir la fuerza activa hacia los discos Z, fuerza que de otra manera no podría alcanzar nunca los extremos del sarcómero. Finalmente, durante la relajación los filamentos elásticos podrían recentrar los filamentos gruesos en el sarcómero y así optimizar las condiciones para el inicio de otra contracción. Muchos autores han propuesto modelos sarcoméricos similares sobre las bases de evidencias estructurales (Maruyama, et al. 1994; Wang, 1985; Higuchi y Umazume, 1985). Esos modelos ahora están sustentados por la evidencia fisiológica de que la titina es esencial para mantener la alineación de los filamentos gruesos y para la eficiente producción de fuerzas pasiva y activa. Esas conexiones elásticas de titina proporcionan poca resistencia a la extensión, que es necesaria para restablecer los sarcómeros después de la contracción activa. Las moléculas se ponen cada vez más rígidas conforme los sarcómeros se alargan, y por lo tanto, más efectivas en mantener a los filamentos gruesos en el centro del sarcómero durante la activación (Horowits, 1992; Keller, 1997). Si los sarcómeros son estirados más allá de lo que se conoce como el límite elástico -un grado de estiramiento que raramente se produce in vivo- la titina se disocia de los filamentos de miosina (Fig. 40A), y se puede extender más de cuatro veces de su longitud normal sin perder el anclaje de las líneas M y Z (Wang, et al. 1993). Este mecanismo autoprotector (factor de seguridad) mantiene la integridad estructural del músculo como un todo, aunque esos sarcómeros podrían estar incapacitados para contraerse temporalmente. Durante la contracción normal, la elasticidad de la titina también ayuda al equilibrio de las fuerzas contráctiles que son producidas por la miosina, así que esos filamentos permanecen centrados en el sarcómero (Horowits y Podolsky, 1987). La efectividad de los filamentos de titina en prevenir esta inestabilidad puede ser fácilmente observable con el microscopio electrónico en fibras musculares desnudas fijadas después de activación prolongada (Horowits, 1992). A longitudes sarcoméricas hasta de ≈ 3.5 µm la tensión de reposo en el músculo semitendinoso de rana se origina en la miofibrillas (Magid y Law, 1985; Podolsky, 1964). Esto también es probablemente cierto para el músculo psoas de conejo, así que la magnitud de la tensión pasiva en la preparación de fibra desnuda de conejo es similar a la que reflejaría el músculo intacto (Horowits, et al. 1986). Se ha reportado por Wang et al. (1993) al realizar el estiramiento de fibras divididas de psoas de conejo que la tensión al principio aumenta exponencialmente (Fig. 40B) alcanzando el límite elástico y entonces se nivela desde 4.5 µm a ≥5.5 µm. Esas curvas indican que la matriz del sarcómero es responsable solamente para la primera elevación de la tensión exponencial antes del límite elástico y contribuye casi en una cantidad constante de tensión en todos los grados de extensión del sarcómero en los puntos más allá del límite elástico (SLy). Tal respuesta de la matriz sarcomérica al estiramiento puede ser entendida cualitativa y cuantitativamente sobre las bases de la extensión reversible de un segmento de titina que está anclada entre la línea Z y el extremo de los filamentos gruesos: en sarcómeros que no han alcanzado el límite elástico, la extensión lineal de este segmento da origen a una elevación exponencial de la tensión de reposo que ha sido descrita previamente. Más allá del límite elástico, la longitud relajada del segmento extensible se vuelve más grande por la Figura 40.- Curvas de tensión-longitud y deformación segmentaria de la titina. (A) Interpretación del comportamiento estructural del sarcómero durante el estiramiento. (B) Curva de tensión pasiva-longitud sarcomérica caracterizada por cuatro zonas (I a IV). Con el límite elástico como frontera, la tensión de reposo-longitud sarcomérica puede ser dividida en cuatro zonas, cada una con distinta interpretación estructural. ZONA I.- Desde la longitud de reposo (SLo) al inicio del incremento exponencial de tensión (SLe). No se genera tensión significativa, esto podría ocurrir como resultado del enderezamiento de los filamentos fláccidos de titina sin un cambio neto en la longitud del contorno. ZONA IL- Del inicio de la tensión exponencial (SLe) al límite elástico. La tensión aumenta de manera exponencial y subsecuentemente se desvía desde la exponencial hasta alcanzar un máximo local cerca de la extensión de 4.0 µm. En esta zona, la titina extiende su longitud de contorno linealmente, quizás por cadenas de proteínas no plegadas, en un modo generador de fuerza. ZONA III.- Del límite elástico y más allá (>SLy). La tensión alcanza un máximo y entonces comienza a declinar ligeramente. Esta reducción puede ser causada por un incremento neto en la longitud del segmento extensible de la titina nuevamente reclutado desde la región de la banda A. Posteriores estiramientos más allá del límite elástico, pueden causar que cada vez más, una mayor cantidad de titina sea convertida en segmento extensible, restringiendo así la máxima tensión del filamento de titina que en el nivel del límite elástico. ZONA N- Desde 4.5 mm y más allá. La segunda elevación de tensión refleja la contribución adicional de la red de filamentos intermedios que rodean cada miofibrilla. (C).-Interpretación de la participación de los filamentos intermedios durante el estiramiento, antes y después de la extracción de los miofilamentos con yoduro de potasio. Tomado de: Wang et al.: Viscoelasticity of the sarcomere matrix of skeletal muscle. The titin-miosin composite filament is a dual-stage molecular spring. Biophysical Journal. 1993; 64: 1161-1177. incorporación de una sección del segmento anteriormente anclado de la titina, que se libera cerca de los extremos de los filamentos gruesos. Para evaluar la contribución mecánica de los filamentos intermedios, las fibras divididas fueron sometidas a la extracción con yoduro de potasio (KI). El tratamiento con KI, desarma los filamentos gruesos y delgados, suelta los filamentos de titina en el extremo cercano a la línea M y causando a la titina trasladarse y acumularse cerca de la línea Z. Como resultado, el único entramado mecánicamente competente en el residuo son los filamentos intermedios asociados al sarcómero que han resistido al efecto destructor del KI, como resultado, sólo los filamentos intermedios resistentes al KI mantienen su conexión estructural y su capacidad productora de fuerza en el residuo de KI. El residuo de la extracción fue más extensible y la tensión fue detectada sólo más allá de 4.5 µm (Fig. 40C). Una pequeña histéresis fue observada durante la liberación de las fibras. Esto sugiere que la extensión de la red de filamentos intermedios es responsable del incremento en tensión más allá de 4.5 µm. Así, la red exosarcomérica de filamentos intermedios es una estructura viscoelástica generadora de fuerza que es laxa abajo de 4.5 µm y contribuyen en la tensión de reposo sólo en longitudes arriba de 4.5 µm. Los datos obtenidos indican así que la red de filamentos intermedios de la miofibrilla que conectan longitudinal y transversalmente las líneas Z con las líneas M de sarcómeros adyacentes, pueden no ser forzados dentro de los rangos fisiológicos de la extensión muscular y contribuyen poco en la transmisión de tensión de reposo. Es concebible, sin embargo, que en los casos donde los sarcómeros son dañados e incapaces de transmitir tensión de reposo ya sea activa o pasiva, los filamentos intermedios asociados pueden ser estirados por sarcómeros adyacentes funcionales hasta una longitud en la cual produzcan fuerza y así proporcionar continuidad mecánica. En las preparaciones de fibra dividida, es notorio que después de que fueron removidos el sarcolemma y los filamentos intermedios asociados a la membrana (costámero), no se expresaron sus propiedades mecánicas (Wang, et al. 1993). La titina tiene dos funciones dentro del músculo. Como elementos elásticos que unen cada extremo de los filamentos gruesos con los discos Z, los filamentos de titina están en una posición que les permite producir tensión de reposo así como también para proporcionar una fuerza que tiende a mantener en el centro del sarcómero a los filamentos gruesos. Varias líneas de evidencia independientes indican que la titina ejecuta ambas funciones. Primero, la degradación de la titina y la nebulina por radiación ionizante (Horowits, et al. 1986) o por digestión enzimática (Yoshioka, et al. 1986; Funatsu, et al. 1990) disminuye la tensión de reposo, y también conduce al desarreglo axial de los filamentos gruesos (Horowits, et al. 1986). En el caso de la digestión enzimática, la disminución de la tensión de reposo acompaña a la degradación de la titina, pero no de la nebulina (Funatsu, et al. 1990). Segundo, se ha mostrado recientemente que los filamentos gruesos se mueven del centro del sarcómero durante la contracción isométrica en una manera que depende de la longitud sarcomérica (Horowits y Podolsky, 1987). La dependencia experimental del grado de movimiento del filamento grueso sobre la longitud del sarcómero, el curso temporal observado del movimiento, y la tensión generada durante el movimiento, se encontraron todas en acuerdo cuantitativo con un modelo mecánico en el cual todas las tensiones de reposo medidas se originan en elementos elásticos que unen los extremos de los filamentos gruesos a los discos Z; esas observaciones no fueron consistentes con el modelo donde esas estructuras fueron omitidas (Horowits y Podolsky, 1988). Finalmente, la titina es la única proteína sarcomérica que está organizada a manera de unión elástica entre los filamentos gruesos y los discos Z. Aunque la nebulina fue alguna vez un componente putativo de tal estructura, evidencias recientes sugieren que la nebulina forma una estructura no elástica en paralelo con los filamentos delgados (Wang y Wright, 1988), y por lo tanto no puede contribuir para las propiedades mecánicas de las fibras musculares relajadas. Trabajos previos que han utilizado anticuerpos marcados indican que los filamentos de titina están acomodados en forma de uniones elásticas que se extienden desde los discos Z hacia el centro del sarcómero (Wang, el al. 1985; Furst, et al. 1988; Itoh, et al 1988; Whiting, et al. 1989). Esos estudios mostraron que cuando el sarcómero se estira, la región de la molécula de titina encontrada en la banda A, se comporta como si estuviera unida rígidamente al filamento grueso. En contraste, la región de la molécula de titina que une al filamento grueso con los discos Z se comporta elásticamente (Wang, et al. 1985; Furst, et al. 1988; Itoh, et al. 1988; Horowits, et al. 1989; Whiting, et al. 1989). Titinas: proteínas gigantes encargadas de la elasticidad y de la ultraestructura del músculo. El papel critico del filamento de titina para la estructura y función musculares no puede ser aclarada sin el conocimiento de su estructura primaria. Se ha determinado la secuencia completa de DNA complementario (cDNA) de la titina cardiaca de humano, las 82 kilobases del cDNA predicen que es una proteína de 3 megadaltones compuesta de 244 copias de inmunoglobulina y fibronectina tipo III (Fig. 41 a). Se sugiere que la titina especifica un plan de construcción sarcomérica, dentro del cual, características específicas de los tejidos tales como las diferentes tensiones pasivas son proporcionadas por empalme diferencial (Labeit y Kolmerer, 1995). Algunos anticuerpos monoclonales específicos para la titina de la banda I han permitido la distinción entre las titinas esquelética y cardiaca (Hill y Weber, 1988), y las movilidades electroforéticas indican que las titinas de diferentes tejidos tienen diferentes tamaños (Wang, et al. 1991). Al compararse el mRNA de titinas de humano y conejo de diferentes tejidos se encontró que en la parte central de la banda I las titinas cardiaca y esquelética tienen composiciones distintas. Primero, la titina cardiaca comprende 37 tandem de repeticiones Ig, mientras que 90 tandem de dominios Ig están presentes en la secuencia esquelética de humano. Segundo, una secuencia de elementos ricos en residuos de prolina (P), ácido glutámico (E), lisina ( K), y valina (V), tiene diferente longitud en el músculo cardiaco y esquelético. Los 4 aminoácidos P, E, V y K, constituyen el 70% de este elemento, y por lo tanto nos referimos a el como el dominio PEVK de titina. Este dominio comprende 163 o mas residuos en la secuencia de titina cardiaca y 2 174 residuos en la secuencia de titina esquelética. Diferentes isoformas de la banda I de la titina fueron detectadas dentro del mismo tejido (Labeit y Kolmerer, 1995). Del trabajo realizado por Labeit y Kolmerer (1995) se concluye que un rango de isoformas de la titina de la banda I se genera por empalme diferencial, el cual afecta la longitud del grupo Ig y de la región PEVK de la titina. También que la arquitectura de super-repeticiones de la titina en la banda A puede explicar la estructura global presente en los filamentos gruesos de los vertebrados. En Figura 41.- Diagrama esquemático del mecanismo de la elasticidad y extensibilidad de la titina in situ (a-e) y en moléculas aisladas (f-j). (a) Estructura y localización de la titina. Los óvalos representan dominios de fibronectina e inmunoglobulina; existen en total cerca de 280. Las flechas verticales indican las posiciones de los anticuerpos utilizados. (b) Sin estiramiento, la configuración de la titina en la banda I es una espiral enrollada al azar y la fuerza es cero. (c) El estiramiento inicial endereza la molécula y la fuerza aumenta. (d) Con estiramiento moderado, la región PEVK se extiende. (e) Con estiramiento extremo, la titina se suelta del filamento grueso, los dominios de inmunoglobulina y fibronectina pueden también desplegarse. (1) Procedimiento experimental para estirar moléculas individuales de titina. ( g-j) Mecanismos de elasticidad en experimentos con moléculas individuales que corresponden a b-e. Tomado de: Tskhovrebova et al.: Elasticity and unfolding of single molecules of the giant muscle protein titin. Nature 1997-,387: 308-312. contraste con la arquitectura conservada de la titina en la banda A, la estructura de la banda I de la titina depende del tipo de tejido. También, en la región M, se expresan dos isoformas distintas de titina en correlación con la fina estructura de la región M. Por lo tanto, se sugiere que donde los sarcómeros tienen una ultraestructura conservada, la arquitectura de los dominios es constante, mientras que los aspectos específicos de un tejido son introducidos en el plan de construcción del mRNA de la titina por empalme diferencial en las regiones donde la ultraestructura del sarcómero es variable. Por comparación de las secuencias de la titina de la banda I del músculo de corazón, de psoas y soleo cada uno de los cuales tiene diferentes tensiones pasivas y expresan diferentes tamaños de titina (Wang, el al. 1991), se han identificado ya las regiones que están involucradas en la elasticidad. La secuencia de la banda I tiene diferentes contenidos tanto de tandem Ig como del segmento PEVK. Trabajos previos sobre las bases moleculares de la elasticidad en la titina asumen que la banda I de la titina está compuesta sólo de dominios Ig y fibronectina III. Por lo tanto, fue propuesto que las estructuras R de la Ig de las repeticiones de titina se desdoblan para ganar un incremento en longitud de varias veces. Sin embargo, la estabilidad de los dominios I expresados no apoyan tales teorías de desdoblamiento. La región PEVK podría ser más fácilmente estirado que los dominios Ig porque la reducida complejidad de la secuencia junto con los paquetes de cargas negativas podrían evitar la formación de estructuras terciarias estables (Labeit y Kolmerer, 1995). En un estado extendido, la versión de 2 200 residuos del segmento PEVK podría extenderse 0.8 µm in vivo y explicar la extensión inicial de ≈ 0.8 µm por cada mitad del sarcómero, durante la cual la mayoría de los músculos esqueléticos desarrollan sólo poca tensión pasiva (Wang, el al. 1991). Por lo tanto, el dominio PEVK puede explicar la extensibilidad del filamento de titina en fuerzas bajas. Después de que esta extensibilidad se ha completado, los plegamientos estables de los dominios Ig de la banda I de la titina podrían resistir más la extensión. Esto podría explicar la rápida elevación en tensión hacia el final de la longitud laxa de los sarcómeros. Los niveles moderados de mayor extensión (más allá de 0.8 .m por mitad de filamento) que ocurren in vivo en el músculo esquelético podrían ser explicados por cambios conformacionales en el tandem de segmentos Ig, tales como la flexión y el estiramiento de las uniones interdominios (Labeit y Kolmerer, 1995). En conclusión, se propone que la región PEVK y el grupo Ig de la titina son dos elementos de dureza diferencial que funcionan en paralelo como un sistema de dos resortes. Esto esta en acuerdo con estudios mecánicos en músculo que proponen un modelo de dos resortes (Wang, el al. 1991; Wang, el al. 1993), y con los estudios inmunohistoquímicos que muestran una extensibilidad no uniforme dentro de la banda I de la titina (Funatsu, el al. 1993; Trombitas y Pollack, 1993). Generación de fuerza pasiva e isoformas de la tinina en músculo esquelético de mamífero. Sobre bases de variación en movilidad electroforética (Hu, et al. 1986; Wang y Wright, 1988) y reactividad a anticuerpos (Hill y Weber, 1986), varios investigadores han demostrado que diferentes músculos estriados de un mismo animal pueden contener diferentes isoformas de titina. También se han observado variaciones en las isoformas de titina durante el desarrollo (Yoshidomi, et al. 1985) Estudios previos han indicado que las fibras del bíceps o del cuadriceps de humano (Horowits, el al. 1990) presentan más baja tensión de reposo que las fibras del psoas del conejo (Horowits, el al. 1986; Horowits y Podolsky, 1987), y que las fibras del soleo de conejo producen aún más baja tensión de reposo que el músculo psoas del mismo animal, existe evidencia de que esta diferencia en la tensión de reposo está acompañada por una diferencia en la forma, pero no en la cantidad de titina encontrada en las fibras del psoas y del soleo. Aunque ambas fibras, de psoas y soleo, exhibieron una longitud sarcomérica de 2.2 µm sin estar sometidas a tensión, las fibras de psoas produjeron niveles de tensión de reposo varias veces mayores, a longitudes de sarcómero entre 3 y 4 µm. Las fibras de sacudida rápida y lenta de humanos exhiben niveles de tensión de reposo más bajas que las encontradas en las fibras de sacudida rápida del psoas de conejo, y similares a las encontradas en las fibras de sacudida lenta del soleo de conejo (Horowits, 1992). actina encontradas en fibras aisladas del psoas y de soleo. Esto claramente muestra que las diferencias observadas en la tensión de reposo no son debidas a la diferencia en el número de filamentos de titina. Con electroforesis prolongada, se vuelve aparente una leve diferencia en la movilidad entre la titina del psoas y del soleo. La inspección cuidadosa revela que la titina del soleo migra ligeramente más lento que la titina del psoas. Las fibras del soleo también parecen tener una forma más pesada de nebulina que las del psoas. Esos resultados reproducen la pequeña pero detectable diferencia en movilidad entre la titina del psoas y del soleo de conejo que fue demostrada por Wang y Wright (1988) usando un sistema de gel similar. El hallazgo de que las fibras musculares de psoas y soleo difieren en la forma, pero no en la cantidad de titina que ellas contienen, sugiere que las grandes diferencias en la tensión de reposo entre las fibras de psoas y soleo podrían ser debidas a diferencias dentro de cada molécula de titina. Sin embargo, se tiene que esperar un estudio comparativo de las propiedades elásticas de titina aislada para dar pruebas definitivas de esta hipótesis (Horowits, 1992). Composición proteica miofibrilar de fibras desnudas aisladas. Las células musculares de soleo y psoas de conejo pueden producir diferentes niveles de tensión de reposo cuando los filamentos de titina son estirados, al variar el número de filamentos de titina arreglados en paralelo entre los extremos de cada filamento grueso y los discos Z. Alternativamente, la fuerza producida por cada filamento de titina puede diferir en los dos músculos. Las principales proteínas miofibrilares están presentes en concentraciones similares en fibras únicas de psoas y soleo. La cuantificación por escaneo de densitometría de geles de poliacrilamida reveló que no existen diferencias significativas en la concentración de titina, nebulina, miosina, y Bases moleculares de las diferencias especificas de isoforma en la elasticidad de la titina. Puesto que un sarcómero en reposo mide 2.2 µm de largo y que los filamentos gruesos son de 1.6 µm de largo, la fracción de la masa de titina en la región elástica de la molécula puede ser calculada si son hechas las siguientes consideraciones: primero, que en un sarcómero en reposo la región elástica de la titina no está deformada; segundo, que la porción de la titina unida a lo largo de la longitud de los filamentos gruesos está relajada; y tercero, que la molécula de titina relajada tiene una densidad de masa uniforme a lo largo de toda su longitud. Esas consideraciones son razonables tomando en cuenta las observaciones recientes de que, excepto por una pequeña cabeza globular en uno de los extremos, los filamentos aislados de titina orientados tienen la apariencia de varillas largas micrométricas de diámetro uniforme (Nave, el al. 1989). Partiendo de esas consideraciones, ≈ 25% de la molécula de titina puede encontrarse en la región elástica localizada entre los filamentos gruesos y los discos Z. En niveles similares de tensión de reposo, la región elástica de titina entre los filamentos gruesos y los discos Z es ≈ 40% mayor en las fibras del soleo que en las fibras del psoas. Por lo tanto, la diferencia en tensión de reposo entre los dos tipos de fibras es compatible con un 40 % más grande y por lo tanto 40% más masa, de la región elástica de la titina en las fibras del soleo. Tal cambio podría llevar a un mayor peso molecular en un 10% para la titina del soleo respecto a la titina del psoas. La diferencia en movilidad electroforética indica que la titina del soleo es al menos 5% más larga que la titina del psoas. Por lo tanto, la diferencia observada en la movilidad electroforética de la molécula completa de titina es compatible con la diferencia de masa estimada de la región elástica de la titina del psoas y del soleo derivada de datos fisiológicos (Horowits, 1992). Esto sugiere un modelo simple en el cual las fibras musculares regulan sus tensión de reposo, eligiendo entre las isoformas de titina que difieren en el número de dominios elásticos que están unidos extremo con extremo, para formar las conexiones entre los filamentos gruesos y los discos Z. Otra posibilidad es que la isoforma de titina menos rígida, encontrada en las fibras del soleo, está formada por dominios más elásticos que los dominios encontrados en la titina del psoas. Los dos tipos de dominios repetidos deducidos de la secuencia del cDNA de la titina podrían jugar un papel en tal mecanismo. Más estudios usando anticuerpos monoclonales para explorar las diferencias estructurales entre las isoformas de titina, también como la elucidación de la organización y función de los genes de titina, podrían poner en claro los mecanismos por los cuales se regula la tensión de reposo; en particular, tales estudios podrían proporcionar pruebas críticas de la hipótesis de que el polimorfismo de la titina es importante para las variaciones observadas en la tensión de reposo. La titina como resorte molecular. Las moléculas de titina (o conectina) del músculo son extraordinariamente largas y elásticas, trabajan de manera que asemejan resortes elásticos moleculares, para resistir pasivamente el estiramiento del músculo estriado (esquelético o cardiaco) inactivo. Para estudiar las bases moleculares de las propiedades mecánicas de la titina se están utilizando nuevos métodos para sujetar y estirar moléculas individuales. La proteína titina cuya longitud de reposo es de 1 µm, puede estirarse hasta cuatro veces esa longitud. Tres laboratorios reportan con relación a este tema, las mediciones de las fuerzas elásticas generadas durante el estiramiento y relajación de moléculas de titina individuales (Tskhovrebova, el al. 1997; Kellermayer, el al. 1997; Rief, el al. 1997). Encontraron una mezcla de resortes entrópicos, la tensión crece y disminuye en forma de dientes de sierra y presenta el fenómeno de histéresis, propiedades que son diferentes a las de cualquier material elástico convencional. En altas fuerzas, se vio por primera vez qué sucede cuando los dominios proteicos son desenredados por la fuerza aplicada. Tskhovrebova el al. (1997) y Kellermayer el al. (1997) fijaron moléculas de titina entre un sustrato movible y una cuenta sujetada en una trampa óptica (ver Fig. 41), y procedieron a estirarla. Ambos estudios indican que la titina se extiende en dos fases distintas. Cuando la molécula de titina se estira, la primer fase de extensión desarrolla poca tensión pasiva, corresponde al cambio de forma completamente plegada a una enderezada. Con poco estiramiento la fuerza es generada por un mecanismo caracterizado como resorte entrópico (figura 42, panel superior). El resorte entrópico trabaja porque una cadena enrollada azarosamente tendría el efecto de maximizar su configuración conforme ocurren fluctuaciones térmicas. Se requiere una fuerza para contrarrestar esas fuerzas térmicas y extender la cadena. Tskhovrebova et al (1997) proponen un arreglo de dos resortes entrópicos en serie, uno correspondiendo al dominio de inmunoglobulina un poco flexible y el otro al segmento más flexible PEVK desnaturalizado. Kellermayer et al. (1997) asentó sus datos en un solo elemento flexible. El resorte entrópico proporcionó una fuerza no lineal. La fuerza es pequeña, de 1 a 2 pN, hasta, 80% de la máxima extensión pero entonces aumenta de forma empinada conforme la cadena se extiende más allá del 80 a 90% de su máxima longitud. El resorte entrópico se parece a una correa, transmitiendo fuerza sólo cuando está máximamente extendida. El altas fuerzas, Tskhovrebova et al. observaron el desenrollamiento de los dominios de inmunoglobulina. Dieron rápidamente un tirón repentino de 250 nm a la cuenta, generando una fuerza de más de 100 pN en la titina extendida. Entonces observaron que la fuerza se relajó en pasos discretos, cada paso extendiendo la cadena cerca de 20 nm, cercana a la predicción para un dominio de inmunoglobulina desenrollado (Erickson, 1994). Estiramientos adicionales generan incrementos exponenciales de tensión, conforme el segmento PEVK se desdobla dando una cadena polipeptídica extendida de cerca de 0.4-0.8 µm de largo -mayor de diez veces su longitud plegada-. Este segmento PEVK se repliega cuando se libera la molécula de titina. Cuando el primer componente está completamente extendido, el estiramiento extremo adicional trae consigo al segundo componente: los dominios individuales de inmunoglobulina (o fibronectina III) que son desdoblados a manera de todo o nada, por medio de la ruptura de las uniones estabilizantes de las bandas (i. El replegamiento de esos dominios es relativamente lento, y sólo ocurre cuando los dominios están expuestos a pequeña, o ninguna fuerza de estiramiento (Keller, 1997). Usando microscopía de fuerza atómica, Rief et al. (1997) caracterizaron el comportamiento individual al estiramiento de dominios de inmunoglobulina, utilizaron segmentos cortos de cuatro u ocho dominios de inmunoglobulina de titina expresados en bacterias. El perfil de fuerza mostró prominentes ondas de tensión en forma de dientes de sierra, espaciadas precisamente a 25 nm de distancia, conforme se desenrolló un dominio de inmunoglobulina después de otro (ver figura 42, inserto en la parte inferior). Encontraron que cada dominio de desdobla del mismo modo que la titina intacta (esto es, todo o nada) pero, al igual que la extensión de un amortiguador, la fuerza necesaria para el desdoblamiento del dominio depende de la velocidad de extensión - mientras más rápida es la extensión, mayor la resistencia para desdoblarse. Este estudio también muestra que existe una clara y persistente jerarquía en el desdoblamiento, en el cual, algunos dominios se desdoblan con menor fuerza de estiramiento que otros. Una mínima diferencia en la secuencia de aminoácidos -especialmente en la identidad de los aminoácidos específicos que mantienen juntas las caras de un determinado dominio podría determinar el papel específico de ese dominio en la elasticidad de la titina (Keller, 1997). Esta posibilidad es particularmente curiosa cuando se acopla con la observación hecha por Kellermayer et al. (1997). Ellos Figura 42.- ,Estiramiento de la titina. En la figura superior se muestra que en un sarcómero relajado, sin estirar, los 100 dominios de inmunoglobulina y el dominio PEVK del segmento I de la titina pueden ocupar la banda I sin desplegarse. La titina nativa es flexible y ejerce una débil fuerza como resorte entrópico. En grandes estiramientos (dentro de rangos fisiológicos) se desenreda el dominio PEVK y existen entonces dos resortes entrópicos en serie: los segmentos de inmunoglobulina, aún nativos, y los segmentos polipeptídicos más flexibles de la cadena del PEVK. En la figura inferior, se muestra que con el estiramiento extremo y con elevada fuerza, los dominios de inmunoglobulina se desenredan, uno a un tiempo, (A) muestra un segmento de cinco dominios de inmunoglobulina plegados y alternados de color verde y azul, sus límites están indicados por líneas. Desde C a F, dos dominios son desplegados sucesivamente al extender el polipéptído, que está indicado en rojo. En G la molécula es retraída, ejerciendo una débil fuerza como resorte entrópico. Los dominios de inmunoglobulina no se repliegan hasta que la molécula está excesivamente retraída (H). El inserto muestra la gráfica de la fuerza durante la extensión (línea roja) y durante la retracción (línea azul). Tomado de: Erickson, H. P. Stretching single protein molecules: titin is a weird spring. Science 1997, 276: 1090-1092. Figura 43.- Curva de tensión pasiva por sección de área transversal del músculo esquelético contra longitud sarcomérica. Curvas escaladas a partir de los datos de una sola molécula de titina comparados con los obtenidos en una fibra de m. psoas de conejo, considerando que la densidad de titina por sección de área transversal muscular debe ser 2.8 x 1015/M 2 . Tomado de Kellermayer et al. Folding-unfolding transitions in single titin molecules characterized with laser tweezers. Science 1997; 276: 1112-1116. encontraron que ciclos repetitivos de estiramiento conducen a niveles progresivos de desnaturalización en donde dominios individuales fallan para replegarse después de su liberación. Ellos lo atribuyen a la isomerización de la prolina, que puede ocurrir en la etapa de desdoblamiento. Si tales dominios permanecen desdoblados en el músculo, ellos podrían aumentar el rango de estiramiento sobre el cual la resistencia es baja, y tal condicionamiento fisiológico a nivel molecular podría permitir a los músculos adaptarse a condiciones cambiantes. La fuerza medida para una sola molécula de titina puede ser escalada con respecto al número de moléculas de titina de un sarcómero para probar la hipótesis de que la titina es la única responsable de la respuesta pasiva elástica del músculo. Al asumir que existen seis moléculas de titina por filamento grueso por medio sarcómero; se puede obtener la curva calculada de la fuerza pasiva por área de sección transversal del músculo como función de la longitud sarcomérica. La curva calculada es similar en forma y magnitud a la obtenida experimentalmente en una fibra muscular única de conejo, en la cual se utilizó caldesmon para bloquear la débil interacción acto-miosina (Fig. 43). Los tres nuevos estudios (Tskhovrebova, el al. 1997; Kellermayer, el al 1997; Rief, el al. 1997) profundizan en la propiedades mecánicas de una molécula estructural y predicen que hay más por aprender, no sólo acerca de la estructura y función de la titina en el músculo estriado, sino en las estructuras del citoesqueleto de células no musculares, donde se ha encontrado una versión de la titina (Eilertsen, Kazmierski y Keller, 1994). Estos estudios también proporcionan información para el entendimiento en general del desdoblamiento y del replegamiento -los dominios de inmunoglobulina y fibronectina III se encuentran en una variedad de proteínas. En las proteínas extracelulares, muchos de los dominios son además estabilizados por uniones disulfuro (que evitan el desdoblamiento) entre residuos de cisteína de diferentes caras de hojas β del emparedado. Dominios similares en proteínas intracelulares tales como la titina pierden esas cisteínas, así que pueden ser, estructuralmente, menos estables, A causa de que esos dominios con frecuencia median las interacciones entre proteínas -como en el caso de la titina y la miosina- sus propiedades mecánicas formulan la posibilidad de que el desdoblamiento inducido por el estiramiento puede también regular las interacciones proteína-proteína (Keller, 1997). Los tres reportes revelan el desenrollamiento de los dominios a estiramientos grandes, pero cada uno describe una fuerza marcadamente diferente que se requiere para iniciar el desenrollamiento, desde 20 a 40 pN (Kellermayer el al. 1997), a 100 pN (Tskhovrebova el al. 1997), y a 250 pN (Rief, el al. 1997). Esta discrepancia necesita ser aclarada y cuando sean obtenidos valores convincentes, esos datos de moléculas individuales de titina deberán correlacionarse con las mediciones del estiramiento de fibras musculares. El bosquejo convencional de la titina es que ésta opera como un par de resortes sobre cualquier lado de la banda de miosina, manteniéndola centrada en el sarcómero. Este bosquejo ahora necesita volverse a pensar a la luz de la enorme histéresis revelada en los nuevos estudios, especialmente cuando los dominios de inmunoglobulina son desdoblados. Esta propiedad es completamente similar a un verdadero resorte, el cual es altamente reversible. En la titina, los dominios de inmunoglobulina desdoblados pueden proporcionar una reserva de longitud extra en caso de que ocurra estiramiento extremo. Sin embargo, no hay manera obvia para recobrar este estiramiento y replegamiento de dominio a menos que la fuerza esté completamente abolida y se haya retirado el estiramiento. Podrían los chaperones estar involucrados en replegar los dominios de inmunoglobulina? En resumen, el segmento en la banda I de la titina se adapta al estiramiento fisiológico, primero por el enderezamiento (pero no desdoblamiento) de los segmentos de inmunoglobulina y desdoblamiento del dominio PEVK. El dominio PEVK desdoblado podría actuar como una correa más que como un resorte, ejerciendo fuerzas mayores que 5 pN (la fuerza generada por una molécula individual de miosina) sólo en cerca del 80% de su máxima extensión. Se requiere fuerza extrema para desdoblar los dominios de inmunoglobulina. Una ves desdoblado, esos dominios no pueden ejercer fuerza significante, y podrían ser renaturalizados por otros medios (Erickson, 1997). Implicaciones fisiológicas de la molécula de titina. Como previamente se ha señalado, la tensión de reposo originada en los filamentos de titina podría, en principio, variar sobre un amplio rango sin riesgo de imposibilitar la habilidad de los filamentos de titina para reacomodar en el centro del sarcómero los filamentos gruesos entre contracciones activas sucesivas in vivo (Horowits y Podolsky, 1988). Sin embargo, la ventaja fisiológica de tener fibras musculares con niveles variables de tensión de reposo no es claro. Los músculos psoas y soleo del conejo son relativamente homogéneos, conteniendo casi exclusivamente fibras de sacudida rápida y fibras de sacudida lenta, respectivamente (Julian, el al. 1981). Sin embargo, las fibras de sacudida rápida y lenta en el humano, las cuales coexisten en los mismos músculos producen niveles similares de tensión de reposo. Por lo tanto, el nivel de tensión de reposo observado en fibras de músculos de mamífero no es estrictamente una función del tipo de fibra. Esos resultados sugieren que el nivel de tensión de reposo mostrada por una fibra muscular, y por lo tanto de la isoforma de titina que contiene, está relacionada con su localización anatómica dentro del animal. Deberían considerarse en este contexto las variaciones observadas en la tensión de reposo. Por ejemplo, en los artrópodos, se piensa que la tensión de reposo de músculos opuestos proporciona el soporte postural (Yox, el al. 1982). En animales superiores, la producción de tensión de reposo durante el alargamiento pasivo podría limitar el grado de movimiento producido por un músculo opuesto durante el acortamiento activo. Además, la producción de tensión de reposo podría ayudar a proteger los músculos del daño debido a la sobrextensión. Otras investigaciones sobre esas posibilidades podrían conducir al entendimiento de la función de las variaciones anatómicas (Hill y Weber, 1986; Hu, el al. 1986; Wang y Wright, 1988) y del desarrollo (Yoshidomi, e l al. 1985) en las isoformas de titina. Estiramiento de moléculas de titina. La demostración más dramática del desenrollamiento del dominio está en el estudio de Rief el al. (1997), que usaron un microscopio de fuerza atómica para estirar la titina. El panel inferior de la figura 42 ilustra el comportamiento de la molécula de titina en altos esfuerzos, la cual se comporta de la siguiente manera: la molécula de titina con una longitud de ≈100 nm, comprendiendo 25 dominios de inmunoglobulina (se muestran cinco), es estirada entre dos ataduras. Cuando las ataduras están muy cerca una de la otra, la titina estaría enrollada azarosamente. Cuando la molécula empieza a extenderse se comporta como un resorte entrópico; se necesita una pequeña fuerza para extenderla hasta el punto A. Conforme la titina alcanza su extensión completa, la fuerza del resorte entrópico aumenta de forma empinada. En B la fuerza está empezando a sacar el par de hilos (3 más débiles (indicado por la flecha) una conclusión importante que surge de los nuevos resultados ((Tskhovrebova, el al. 1997; Kellermayer, el al. 1997; Rief, el al. 1997) es que el desenrrollamiento de dominios requiere una elevada fuerza sostenida por sólo una corta distancia para iniciar el proceso. Cuando los hilos 0 han sido desplazados ≈ 0.5 nm (Erickson, 1997), el dominio se desestabiliza y rápidamente se desenrolla (punto C en la figura), y la fuerza cae. Conforme el polipéptido se extiende, el proceso se repite y otro dominio se desenrolla (D a F). En este punto, el experimentador retrae las ataduras de regreso al valor de cero. La fuerza del resorte entrópico cae rápidamente cuando los hilos se colapsan para formar una enrollamiento azaroso (G). Sin embargo, aún la débil fuerza en el punto G evita la renaturalización del dominio. Sólo cuando la atadura está casi completamente retraída (H) inicia la renaturalización del dominio (flecha). XIX.- EQUIVALENTE MECANICO DEL MUSCULO. Propiedades mecánicas y contráctiles del músculo entero. Longitud del sarcómero y propiedades contráctiles. Periodo de latencia. Componentes elásticos del músculo esquelético. Tensiones en contracción aislada y tétanos. XIX.- EQUIVALENTE MECANICO DEL MUSCULO. Propiedades mecánicas y contráctiles del músculo entero. Muchas de las propiedades mecánicas del músculo fueron dilucidadas durante la primera mitad del presente siglo, antes de que fuese comprendido el mecanismo de la contracción. Es interesante reexaminar estos descubrimientos clásicos a la luz de nuestros presentes conocimientos de los mecanismos subyacentes. La contracción puede expresarse de dos formas diferentes: en términos de acortamiento o en términos de tensión. Se utilizan dos métodos correspondientes para medir la actividad del sistema contráctil. En uno se miden los cambios en la longitud del músculo durante la contracción mientras se permite a éste acortarse y levantar alguna carga que esté unida a su tendón. Esta es la denominada contracción isotónica, pues la tensión permanece constante. En el otro método, el músculo se mantiene sujeto por sus dos extremos y se le impide acortarse, por lo tanto la longitud es constante mientras se determina la tensión producida durante la contracción. En lugar de realizar trabajo externo el músculo desarrolla tensión en sus puntos de unión; la energía generada en la contracción es liberada como calor, esta es la llamada contracción isométrica. Si bien no hay un acortamiento externo apreciable durante la contracción isométrica, existe un pequeño acortamiento interno (deslizamiento de los filamentos de actina de la banda A), que se produce a costa del estiramiento de los componentes elásticos en serie intracelulares y extracelulares, tales como los brazos de los puentes cruzados y los tejidos conectivos en serie con las fibras musculares. La variación de la contracción con el tiempo difiere enormemente entre los músculos de diferentes animales y entre los distintos músculos de un mismo animal (McComas, 1996; Eckert, 1990), Un punto a ser remarcado es que, independientemente de las circunstancias de la contracción - isotónica, isométrica, o alargamiento- las interacciones entre los puentes cruzados y los filamentos de actina son las mismas, en donde los puentes cruzados se enlazan y se esfuerzan para deslizar a estos últimos en dirección de la región M del sarcómero. En una contracción isotónica (concéntrica) con una carga pequeña, el movimiento deslizante permite a los filamentos de miosina traslaparse completamente por los de actina. En una contracción isométrica, la cantidad de traslape de los filamentos depende de la longitud en la cual, previa a la activación, se haya mantenido al músculo. Durante la activación los puentes cruzados repentinamente hacen y deshacen conexiones con los filamentos de actina, produciendo una tensión igual a la de la carga externa pero no hay movimiento de los filamentos de actina. En una contracción de alargamiento (excéntrica), los puentes cruzados generan menos tensión que la fuerza externa de estiramiento aplicada al músculo, por lo consiguiente, en los sarcómeros los filamentos de actina opuestos son retirados uno del otro (McComas, 1996). Un concepto físico sencillo pero de esencial importancia para comprender los siguientes apartados es que, bajo una carga cualquiera, la tensión de un elemento de una serie lineal (como el eslabón de una cadena) es igual a la tensión desarrollada en cada uno de los otros elementos de la serie. Este concepto es válido tanto para la tensión activa generada por la contracción como para la tensión pasiva producida por un peso externo jalando al músculo (Eckert, 1990). Longitud del sarcómero y propiedades contráctiles. La velocidad con que se aproximan uno a otro dos puntos a lo largo de una fibra muscular (es decir, la velocidad a la que el músculo se acorta) bajo una carga dada es una función lineal del número de sarcómeros presentes en serie entre ambos puntos. Suponiendo que todos los sarcómeros de una fibra muscular se acorten igual distancia por unidad de tiempo, la reducción total de longitud en un tiempo dado será proporcional al número de sarcómeros en serie. En resumen, esto significa que los extremos de un músculo largo se acercan uno al otro a una velocidad mayor que la de un músculo más corto. Indudablemente este es un factor importante en la evolución de la morfología esquelética y en la energética del ejercicio. También significa que de entre dos músculos de una longitud determinada, aquel que contenga los sarcómeros más cortos será el que pueda acortarse más rápidamente, a pesar de que nuevamente la velocidad de deslizamiento de los filamentos sea igual en ambos músculo. Igualmente resulta evidente que la velocidad máxima de acortamiento y la máxima fuerza desarrollada están relacionadas recíprocamente. Para un músculo de una masa y área de su sección transversal dadas, unos sarcómeros largos, (es decir, un mayor traslape de los miofilamentos) comunicarán una tensión más elevada y una velocidad de acortamiento total más lenta, mientras que unos sarcómeros cortos proporcionarán más velocidad con menos fuerza. La tensión contráctil producida por una fibra muscular está limitada por el número de miofibrillas (o más exactamente, de filamentos de actina y miosina) trabajando en paralelo, y un músculo grueso puede realizar más esfuerzo que otro delgado, sin considerar la longitud. El ejercicio físico incrementa el número de miofibrillas por fibra muscular, de modo que se produce un aumento tanto en el tamaño como en la fuerza del músculo. Un ascenso concomitante en el número de mitocondrias permite intensificar la resistencia a la fatiga del músculo. Periodo de latencia. Al aumentar la carga, el músculo precisa de más tiempo para levantar una pesa de su soporte. La razón de este hecho reside en que el músculo necesita tiempo para desarrollar la tensión debida a la actividad de los puentes cruzados. Cuanto mayor sea el peso, más largo es -el periodo de tiempo invertido en estirar los componentes elásticos y generar la tensión necesaria. Incluso con un peso muy ligero existe un periodo de latencia, la suma de todos los retrasos entre la excitación de la membrana, su propagación por los túbulos T al interior de la fibra, la liberación y difusión del Ca++ y el tiempo que transcurre durante la activación de los puentes cruzados. El lapso de tiempo entre el pico del potencial de acción y la primera señal de desarrollo de tensión en el músculo de rana puede ser de tan sólo 2 ms (Eckert, 1990). Resulta también aparente que la velocidad inicial de acortamiento disminuye al incrementar la carga del músculo. La velocidad máxima se alcanza cuando la carga es cero, en cuyo caso, obviamente, la fuerza externa (tensión) desarrollada por el músculo también es cero. La velocidad de acortamiento desciende conforme aumenta la fuerza necesaria para levantar la carga (o sea, el peso de la carga). Si la carga colocada es lo suficientemente pesada, no tendrá lugar acortamiento externo alguno, y la contracción será, por definición, isométrica. Unas cargas externas elevadas pueden causar un estiramiento real del músculo "contraído". La dependencia de la velocidad de acortamiento con respecto a la carga es fácilmente comprensible a la luz de la teoría de los filamentos deslizantes. La tendencia de los filamentos de actina para deslizarse hacia atrás en contra de la producción de fuerza por la actividad de los puentes cruzados aumenta al incrementar la carga y, por lo tanto, el grado de acortamiento también disminuye al aumentar la carga. Esto plantea la cuestión del comportamiento de los puentes cruzados durante las contracciones en que el músculo se mantiene en situación isométrica o incluso resulta alargado en respuesta a una carga externa. Independientemente de que se produzca o no un cambio de longitud, el ciclo de los puentes cruzados produce tensión. La asincronía entre los ciclos individuales de los puentes cruzados es responsable del carácter sostenido y uniforme de la contracción. Componentes esquelético. elásticos del músculo El músculo puede representarse desde un punto de vista funcional (Fig. 44) como un componente contráctil en paralelo con un componente elástico (sarcolema, tejido conectivo, etc.) y en serie con un segundo grupo de componente elástico, el también denominado componente elástico en serie (CES). Incluidos en la categoría de los CES están los tendones, los tejidos conectivos que unen las fibras musculares a los tendones y el material de la línea Z y los filamentos conectores de titina. Un importante componente adicional que contribuye a la elasticidad en serie parece ser el brazo del puente cruzado, que aparentemente sufre cierto estiramiento en respuesta a la tensión. Al acortarse el componente contráctil debe estirar a los CES mientras se desarrolla tensión y ésta se transmite a la carga externa (Fig. 44A y 44B). Cuando la tensión desarrollada en los CES iguala al peso de la carga, el músculo comienza a acortarse externamente y a levantar la carga (Fig. 44C). En el instante representado en la figura 44B la contracción es aún isométrica, mientras que en la figura 44C se ha convertido ya en isotónica y la carga resulta finalmente levantada. Si la carga fuera suficientemente pesada, la contracción hubiese permanecido isométrica de principio a fin. A una tensión máxima durante una contracción isométrica, el CES se estira una cantidad equivalente de alrededor de un 2 % de la longitud del músculo (Eckert, 1990). Los componentes contráctiles deben acortarse, por consiguiente, una distancia equivalente, puesto que la longitud total del músculo, bajo estas condiciones, no cambia. Recuérdese, con respecto a esto, el efecto de la carga sobre el tiempo de latencia. Se precisa cierto tiempo para que los filamentos se deslicen entre sí por la actividad del puente cruzado cuando el CES resulta estirado y se genera tensión. Por tanto, el desarrollo de tensión en un músculo progresa con el tiempo como función del acortamiento interno. El efecto de la elasticidad en serie es reducir el desarrollo de tensión y suavizar los cambios bruscos. Los registros isométricos de las sacudidas musculares dan una pobre indicación de la intensidad y duración del estado activo a causa de los componentes elásticos que se encuentran en serie con los elementos contráctiles. Una vez que los componentes elásticos en serie han sido estirados la tensión puede ser registrada, el estado activo inicia antes del comienzo de la sacudida isométrica y tiene una duración que es menor que el tiempo de contracción (McComas, 1996). El acortamiento o la tensión alcanza un máximo entre 10 y 500 ms, dependiendo del tipo de músculo, la temperatura y la carga. A primera vista puede pensarse que el mecanismo contráctil se activa igualmente con un lento ascenso a lo largo del tiempo. Sin embargo, es importante no confundir la variación temporal en la tensión desarrollada por el músculo con la variación respecto al tiempo de la activación de los puentes cruzados (Eckert, 1990). Debe recordarse que tras la excitación y la liberación del calcio del RS, los puentes cruzados se adhieren primero a los filamentos de actina antes que se inicie el deslizamiento activo. Más aún, el deslizamiento debe compensar la laxitud del CES antes de desarrollar enteramente la tensión (Fig. 44). El estado de actividad del puente cruzado que predomina antes de que el músculo haya tenido oportunidad de desarrollar por completo su tensión puede determinarse por medio de la aplicación de tirones rápidos con un aparato especial, varios instantes después de la estimulación y antes y durante la contracción. El objeto de la aplicación de tales tirones rápidos al músculo es la de provocar la extensión del CES y por consiguiente, eliminar el tiempo que se requiere normalmente para que el mecanismo contráctil los estire. De este modo puede medirse el estado de actividad del puente cruzado con una mejor resolución en el tiempo. La tensión registrada por el dispositivo sensible durante el rápido estiramiento representa la fuerza tensora del mecanismo contráctil en el instante en que se produce dicho tirón rápido. Esta fuerza tensora depende de la fuerza de anclaje de los puentes cruzados en el momento del estiramiento, ya que los puentes cruzados resbalarán y los filamentos simplemente se deslizarán unos respecto de otros, evitando el desarrollo de cualquier tensión mayor. Así, la tensión justamente necesaria para hacer que los filamentos gruesos y delgados se separen deslizándose se aproxima a la capacidad de carga del músculo en el instante del producida por el músculo durante una contracción fásica es mucho más baja que el estado activo, es decir, que la tensión máxima que es capaz de realizar el mecanismo contráctil? Durante una contracción fásica aislada, el estado activo finaliza rápidamente por la actividad secuestrante del calcio por el RS, que retira los iones de calcio tan pronto como son liberados. Por tanto, el estado activo empieza a descender antes de que los filamentos tengan tiempo para deslizarse lo suficiente como para estirar el CES hasta un desarrollo completo de la tensión (Fig. 45). Por esta razón, en una sola contracción fásica aislada no se consigue toda la tensión que el sistema contráctil es capaz de realizar. Antes del pico de tensión, los elementos contráctiles almacenan energía Tensiones en contracción aislada y tétanos. potencial en el CES por un estiramiento progresivo. Si llega un segundo PA detrás del Una pregunta obvia surge al comparar primero, antes del que el RS haya podido el estado activo y la tensión en una contracción fásica aislada representada en la figura 45. ¿Por retirar el calcio previamente qué la máxima tensión estiramiento. Esta tensión será proporcional al número de puentes cruzados activos por sarcómero (Eckert, 1990). En el estado de relajación, el músculo tiene una resistencia al estiramiento muy baja. La técnica de los tirones rápidos han revelado que, tras la estimulación, la resistencia al estiramiento aumenta bruscamente y alcanza un máximo aproximadamente a la vez que el acortamiento externo a la tensión en el músculo no estirado empiezan a iniciarse. Tras una breve meseta, la capacidad de carga disminuye hasta el bajo nivel característico del músculo relajado. liberado, los niveles de concentración de calcio en el sarcoplasma se mantendrán levados y el estado activo podrá continuar. Con un estado activo prolongado, la tensión isométrica continúa incrementándose con el tiempo hasta que la tensión producida por el acortamiento interno de los componentes contráctiles y el estiramiento del CES sea suficiente para causar el resbalamiento de los puentes cruzados y prevenir el posterior acortamiento de los elementos contráctiles (Eckert, 1990). BIBLIOGRAFIA Adrian, R.H., Costantin, L.L., & Peachey, L.D.: Radial spread of contraction in frog muscle fibres. Journal of Physiology 1969; 204: 231-257. Al-Amood, W.S., Buller, A.J., Pope, R.: Long-term stimulacion of cat fast-twitch muscle. Nature 1973; 44: 225-227. Alberts, B., Bray, D., Lewis, J., Raff, M., Roberts, K., Watson, J.D.: Molecular Biology of the Cell. 3th. ed. U.S.A.: Garland Publishing, Inc. New York & London; 1994. Alexander, R. Mcn.: Elastic Mechanisms in Animal Movement. Cambridge.: University Press; 1988. Allbrook, D.: Muscle regeneration. Physiotherapy 1973; 59: 240-247. Allen, D.G., Lee, J.A., & Westerblad, H.: Intracellular calcium and tension during fatigue in isolated single muscle fibres from Xenopus laevis. Journal of Physiology 1989; 415: 433-458. Andersen, P. & Henriksson, J.: Training induced changes in the subgroups of human type II skeletal muscle fibres. Acta Physiologica Sacandinavica 1977; 99: 123-125. Armstrong, R.B.: Muscle fiber recruitment patterns and their metabolic correlates. In: Excercise, Nutrition, and Energy Metabolism. Horton, E.S. & Terjung, R.L. (Eds.) New York: Macmillan; 1988. Armstrong, C. M., Bezanilla, F., & Horowics, P.: Twitches in the presence of ethylene glycol bis((3-aminoethylene)-N, N'-tetraacetic acid. Biochimica et Biophysica Acta 1972; 267: 605-608. Arreola, J., Calvo, J., Garcia, M.C., & Sánchez, J.A.: Modulation of calcium channels of twich skeletal muscle fibres of the frog by adrenaline and cyclic adenosine monophosphate. Journal of Physiology (London) 1987; 393: 307-330. Ashley, C.C. & Ridgway, E.B.: Simultaneous recording of membrane potential, calcium transient and tension in single muscle fibres. Nature 1968; 219: 1168-1169. Ashley, C.C. & Ridgway, E.B.: On the relationships between membrane potential, calcium transient and tension in single barnacle muscle fibres. Journal of Physiology 1970; 209: 105-130. Bagshaw, C.R.: Muscle Contraction. Outline Studies Series. London: Chapman and Hall; 1982. Bailey, A.l, Robins, S.P., & Balian, G.: Biological significance of the intermolecular crosslinks of collagen. Nature 1974; 251: 105-109. Bailey, A.J., Shellswell, G.B. & Duance, V.C.: Identification and change of collagen types in differentiating myoblasts and developing chick muscle. Nature 1979; 278: 67-69. Bastian, J., & Nakajima, S.: Action potential in the transverse tubules and its role in the activation of skeletal muscle. Journal of General Physiology 1974; 63: 257-278. Bennett, M.R.: Development of neuromuscular synapses. Physiological Reviews 1983; 63: 915-1048. Berg, R.A., & Prockop, D.J.: The thermal transition of a non-hydroxylated form of collagen. Evidence for a role for hydroxyproline in stabilizing the triple-helix of collagen. Biochemical and Biophysics Research Commun 1973; 52: 115-120. Billeter, R., & Hoppeler, H.: Muscular basis of strength. In Strength and Power in Sport. Edited by P. Komi. London, Blackwell Scientific Publications; 1992. Bodine, S.C., Roy, R.R., Eldred, E., & Edgerton, V.R.: Maximal force as a function of anatomical features of motor units in the cat tibialis anterior. Journal of Neurophysiology 1987; 6: 1730-1745. Borg, T.K., & Caufield, J.B.: Morphology of conective tissue in skeletal muscle. Tissue & Cell 1980; 12: 197-207. Borg, T.K., Sullivan, T., & Ivy, J.: Functional arragement of connective tissue in striated muscle with emphasis on cardiac muscle. Scann Electron Microscopy 1982; IV: 17751784. Bornstein, P., & Sage, H.: Structurally distinct collagen types. Annual review of Biochemistry 1980; 49: 957-1003. Bouchard, C., Simoneau, J.A., Lorthie, G., Boulay, M.R., Marcotte, M., & Thibault, M.C.: Genetic effect in human skeletal muscle fiber type distribution and enzyme activities. Canadian Journal of Physiology and Pharmacology 1986; 64: 1245-1251. Bowman, W.C., & Nott, M.W.: Actions of sympatomimetic amines and their antagonist on skeletal muscle. Pharmacology Review 1969; 21: 27-73. Brooke, M.H., & Kaiser, K.K.: Muscle fibers types: How many and what kind? Archivies of Neurology; 1970; 23: 369-379. Brooke, M.H., & Kaiser, K.K.: The use and abuse of muscle histochemistry. Annals of the New York Academy of Sciences 1974; 228: 121-144. Buller, A.J., Eccles, J.C., & Eccles, R.M.: Diferentiation of fast and slow muscles in the cat hindlimb. Journal of Physiology 1960a; 150: 399-416. Buller, AJ., Eccles, J.C., & Eccles, R.M.: Interactions between motoneurons and muscles in respect to the characteristic speeds of their responses. Journal of Physiology 1960b; 150: 417-439. Butler, D.L., Grood, E.S., Noyes, F.R., & Zernicke, R.F.: Biomechanics of ligaments and tendons. Excercise and Sports Science Review 1978; 6: 125-182. Cavagna, G.A., & Citterio, G.: Effect of stretching on the elastic characteristics and the contractile component of frog striated muscle. Journal of Physiology 1974; 239: 1-44. Chandler, W.K., Rakowski, R.F., & Schneider, M.F.: Effects of glycerol treatment and maintained depolarization on charge movement in skeletal muscle. Journal of Physiology 1976; 254: 285-316. Close, R.I.: Dynamic properties of mammalian skeletal muscles. Physiological Review 1972; 52: 129-197 Costantin, L.L.: The role of sodio current in the radial spread of contraction in frog muscle fibers. Journal of General Physiology 1970; 55: 703-715. Costill, D.L., Daniels, J., Evans, W., Fink, W., Krahenbuhl, G., & Saltin, B.: Skeletal muscle enzymes and fibre composition in male and female athletes. Journal of Applied Physiology 1976; 40: 149-154. Duance, V.C., Restall, DJ, Beard, H., Bourne, F.J. & Bailey, A.J.: The location of three collagen types in skeletal muscle. FEBS Letters 1977; 79: 248-252. Donozo, P., & Hidalgo, C.: Sodium-calcium exchange in transverse tubules isolated from frog skeletal muscle. Biochim. Biophys. Acta 1989; 978: 8-16. Eckert, R., Randall, D., Augustine, G.: Fisiología Animal. 3a. Ed. España.: Interamericana McGrawHill; 1990. Edman, K.A.P.: The relation between sarcomere length and active tension in isolated semitendinosus fibers of the dog. Journal of Physiology (Load) 1966; 183: 407-4 10. Edman, K.A.P., Reggiani, C., Schiaffino, S., & Tekronnie, G.: Maximun velocity of shortening related to myosin isoform composition in frog skeletal muscle fibres. Journal of Physiology 1988; 395: 679-694. Eisenberg, B. R.: Quantitative ultraestructure of mammalian skeletal muscle. In: Peachey, L.D., Adrian, R.H., & Geiger, S.R. (Eds). Handbook of Physiology. Bethesda, MD: American Physiological Society: 1983; 73-112 Eisenberg, B.R., & Salmons, S.: The reorganization of sucellular structure in muscle undergoing fast-to-slow type transformation. A stereological study. Cell & Tissue Research 1981; 220: 449-471. Erickson, H.P.: Reversible unfolding of fibronectin type III and immunoglobulin domains provides the structural basis for stretch and elasticity of titin and fibronectin. Proceedings of the National Academy of Sciences (USA) 1994; 91: 10114-10118. Erickson, H. P.: Stretching single protein molecules: titin is a weird spring. Science 1997; 276: 10901092. Essen, B., et al.: Metabolic characteristics of fiber types in human skeletal muscles. Acta Physiologica Scandinavica 1975; 95: 153 Eyre, D.R., Paz, M.A., & Gallop, P.M.: Cross-linking in collagen and elastin. Annual Review of Biochemistry 1984; 53: 717-748. Fabiato, A. & Fabiato, F.: Myofilament-generated tension oscillations during partial calcium activation and activation dependence of the sarcomere length-tension relation of skinned cardiac cells. Journal of General Physiology 1978; 72: 667-669. Fambrough, D., Hartzell, H.C., Rash, J.E., y Ritchie, A.K.: Receptor properties of developing muscle. Annals of the New York Academy of Sciencies 1974; 228: 47-61. Faulker, J.A., et al.: Contractile properties of isolated human muscle preparation. Clinical Science 1979; 57: 20 Finer, J.T., Simmons, RM., & Spudich, J.A.: Single myosin molecule mechanics: Piconewton forces and nanometre steps. Nature 1994; 368: 113-119. Fleischmajer, R., Steffen, M.D., Jerome,. M.D., Perlish, J.S., & Cesarini, J.P.: Immunoelectron microscopy of type III collagen in normal and scleroderma skin. Journal Investigation Dermatology 1980; 75: 189-191. Fleischmajer, R., Timpl, R., Tuderman, L., Raisher, L., Wiestner, M., Perlish, J. S., & Graves, P.N.: Ultrastructural identification of extension aminopropeptides of type I and III collagens in human skin. Proceedings of the National Academy of Sciences (USA) 1981; 78: 7360-7364. Foidart, M., Foidart, J.M. & Engel, W.K.: Collagen localization in normal and fibrotic human skeletal muscle. Archives of neurology 1981; 38: 152-157. Fosset, M., Jaimovich, E., Delpont, E. & Lazdunski, M.: Nitrendipine receptors in skeletal muscle. Properties and preferential localization in transverse tubules. Journal of Biological Chemistry 1983; 258: 6086-6092. Frank, G.B.: Inward movement of calcium as a link between electrical and mechanical events in contraction. Nature 1958; 182: 1800-1801. Franzini-Armstrong, C.: Studies of the triad. I. Structure of the junction in frog twich fibers. Journal of Cell Biology 1970; 47: 488-499. Fulton, A.B., Isaacs, W.B.: Titin, a huge, elastic sarcomeric protein with a probable role in morphogenesis. BioEssays 1991; 13: 157-61. Funatsu, T., Higuchi, H., & Ishiwata, S.: Elastic filaments in skeletal muscle revealed by selective removal of thin filaments with plasma gelsolin. Journal of Cell Biology 1990; 110: 53-62. Furst, D.O., Osborn, M., Nave, R., & Weber, K.: The organization of titin filaments in the halfsarcomere revealed by monoclonal antibodies in immunoelectron microscopy : a map of ten nonrepetitive epitopes starting at the Z line extends close to the M line. Journal of Cell Biology 1988; 106: 1563-1572. Gage, P.W., & Eisenberg, R. S.: Action potential, after potentials, and excitacion-contraction coupling in frog sartorius fibers without transverse tubules. Journal of General Physiology 1969; 53: 298-3 10. Gallager, J.T., Lyon, M., & Steward, W.P.: Structure and function of heparan sulphate proteoglycans. Biochemical Journal 1986; 263: 313-325. Gans, C.: Fiber architecture and muscle function. Excercise and Sports Science Review 1982; 10: 160-207. Garcia-Bunuel, L., & Garcia-Bunuel, V.M.: Connective tissue and the pentose phosphate pathway in normal and denervated muscle. Nature 1967; 4: 913-914. Gartner, L.P., Hiatt, J.L: Color Atlas of Histology. 2nd. Ed. U.S.A.: Williams & Wilkins; 1994. Gilbreath, R.L., Di Marco, G.R., & Vandernoot, G.W.: Age and muscle-related differences of acid mucopolysaccharides in bovine muscle tissue. Journal Animal Science 1971; 32: 620-623. Glatz, J.F.C., De Jong, Y.F., Coumans, W.A, Lucas, C.M., Van der Veen, F.H., Van der Vusse, G.F.: Differences in metabolic response of dog and goat latissimus dorsi muscle to chronic stimulation. Journal of Applied Physiology 1992; 73: 806-811. Gollnick, P.D., Armstrong, R.B., Saltin, B., Saubert, C.W. IV, Sembrowich, W.L. & Shephard, R.E.: Effect of training on enzyme activity and fibre composition of human skeletal muscle. Journal of Applied Physiology 1973; 34: 107-111. Gollnick, P.D., Armstrong, R.B., Saubert, C.W.IV, Piehl, K., & Saltin, B.: Enzime activity and fiber composition in skeletal muscle of untrained and trained men. Journal of Applied Physiology 1972; 33: 312-319. Gollnick, P.D., et al.: Fiber number and size in overloaded chicken anterior latissimus dorsi muscle. Journal of Applied Physiology 1983; 54: 1292 González-Serratos, H.: Inward spread of activation in vertebrate muscle fibres. Journal of Physiology 1971; 212: 777-799. González-Serratos, H.: Inward spread of activation in twitch skeletal muscle fibers. In: Peachey, L.D., Adrian, R.H., & Geiger, S.R. (Eds). Handbook of Physiology. Bethesda, MD: American Physiological Society: 1983; 325-353 Gordon, A.M., Huxley, A.F., & Julian, F.J.: Tension development in highly streched vertebrate muscle fibres. Journal of Physiology 1966a; 184: 143-169. Gordon, A.M., Huxley, A.F., & Julian, F.J.: The variation in isometric tension with sarcomere length in vertebrate muscle fibres. Journal of Physiology 1966b; 184: 170-192. Granzier, H., Helmes, M., Trombitás, K.: Nonuniform elasticity of titin in cardiac myocytes: a study using immunoelectron microscopy and cellular mechanics.Biophysical Journal 1996; 70: 430442. Green, H.J., Klug, G.A., Reichmann, H., Seedorf, U., Wiehrer, W., & Pette, D.: Exerciseinduced fibre type transitions with regard to myosin, parvalbumin, and sarcoplasmic reticulum in muscles of the rat. Pflügers Archives 1984; 400: 432-438. Green, H.J., Reichmann, H., & Pette, D.: Fibre type specific transformations in the enzyme activity pattern of rat vastus lateralis muscle by prolonged endurance training. Pflügers Archives 1983; 399: 216-222. Gull, K.: Microtubules: the cell's most dinamic organelles?. Biological Sciences Review 1990; 2 (5): 18-22. Hay, E.D.: Cell Biology of Extracellular Matrix. New York (U.S.A.): Plenum; 1991. Heilbrunn, L.V., & Wiercinski, F.J.: The action of various cations on muscle protoplasm. Journal of Cellular and Comparative Physiology 1947; 29: 15-32. Hill, C., & Weber, K.: Monoclonal antibodies distinguish titins from heart and skeletal muscle. Journal of Cell Biology 1986; 102: 1099-1108. Hochachka, P. W.: Muscles as Molecular and Metabolic Machines. Boca Ratón (FL): CRC Press; 1994. Horowits, R.: Passive force generation and titin isoforms in mammalian skeletal muscle. Biophysical Journal 1992; 61: 392-398. Horowits, R., Dalakas, M.C., & Podolsky, R.J.: Single skinned muscle fibers in Duchenne muscular dystrophy generate normal force. Annals of Neurology 1990; 27: 636-641. Horowits, R., Kemper, E.S., Bisher M.E., & Podolsky, R.J.: A physiological role for titin and nebulin in skeletal muscle. Nature (Lord.) 1986; 323: 160-164. Horowits, R., Maruyama, K., & Podolsky, R.J.: Elastic behavior of connectin filaments during thick filament movement in activated skeletal muscle. Journal of Cell Biology 1989; 109: 2169-2176. Horowits, R., & Podolsky, R.J.: The positional stability of thick filaments in activated skeletal muscle depends on sarcomere length: evidence for the role of titin filaments. Journal of Cell Biology 1987; 105: 2217-2223. Horowits, R., Podolsky, R.J.: Thick filament movement and isometric tension in activated skeletal muscle. Biophysical Journal 1988; 54: 165-171. Howald, H., Hoppeler, H., Claassen, H., Mathieu, O., & Straub, R.: Influences of endurance training on the ultrastuctural composition of the different muscle fiber types in humans. Pflügers Archives 1985; 403: 369-376. Hu, D.H., Kimura, S., & Murayama, K.: Sodium dodecyl sulfate gel electrophoresis studies of connectin-like high molecular weight proteins of various types of vertebrate and invertebrate muscles. Journal of Biochemistry 1986; 99: 1485-1492. Huerta, M., Muñiz, J., Trujillo, X., Lomeli, J.: Adrenergic modulation of the K+ contractures in tonic skeletal muscle fibers of the frog. Japanese Journal of Physiology 1991; 41: 851860. Huerta, M., Muñiz, J. Vásquez, C., Marin, J.L., & Trujillo, X.: Sodium/calcium exchange in tonic skeletal muscle fibers of the frog. Japanese Journal of Physiology 1991; 41: 933944. Huxley, A.F.: Muscular contraction. Journal of Physiology 1974; 243: 1-43. Huxley, A.F., & Niedergerke, R.: Structural changes in muscle during contraction. Interference microscopy of living muscle fibres. Nature 1954; 173: 971-973. Huxley, A.F., & Simmons, R.M.: Mechanical properties of the cross-bridges of frog striated muscle. Journal of Physiology 1971; 218: 74-76. Huxley, A. F., & Taylor, R.E.: Local activation of striated muscle fibres. Journal of Physiology 1958; 144: 426-441. Huxley, H.E.: Sliding filaments and molecular motile sistems. Journal of Biological Chemistry 1990; 265: 8347-8350. Huxley, H.E.: The contraction of muscle. Scientific American 1958; 199: 67-82. Huxley, H.E., & Hanson, J.: Changes in the cross-striations of muscle during contraction and strech and their structural interpretation. Nature 1954; 173: 973-976. Ingjer, F.: Effects of endurance training on muscle fibre ATPase activity, capillary supply anad mitochondrial content in man. Journal of Physiology 1979; 294: 419-432. Itoh, Y., Suzuki, T., Kimura, S., Ohashi, K., Higuchi, H., Sawada, H., Shimuzu, T., Shibata, M., & Maruyama, K.: Extensible and less-extensible domains of connectin filaments in stretched vertebrate skeletal muscle sarcomeres as detected by immunofluorescence and immunoelectron microscopy using monoclonal antibodies. Journal of Biochemistry 1988; 104: 504-508. Jansen, J.K.S. & Fladby, T.: The perinatal reorganization of the innervation of skeletal muscle in mammals. Progress in Neurobiology 1990; 34: 39-90. Jansson, E., & Kaijser, L.: Muscle adaptation to extreme endurance training in man. Acta Physiologica Scandinavica 1977; 100: 315 Jarvis, J.C.: Power production and working capacity of rabbit tibialis anterior muscles after chronic electrical stimulation at 10 Hz. Journal of Physiology 1993; 470: 157-169. Jarvis, J.C., Mokrusch, T., Kwende, M.M.N., Sutherland, H., Salmons, S.: Fast-toslow transformation in stimulated rat muscle. Muscle & Nerve 1996; 19: 1469-1475. Julian, F.J,, Moss, R.L., & Waller, G.S.: Mechanical properties and myosin light chain composition of skinned muscle fibres from adult and new-born rabbits. Journal of Physiology (London) 1981; 311: 201-218. Keene, D.R., Sakai, L.Y., B .chinger, H.P. & Burgeson, R.E.: Type III collagen can be present on banded collagen fibrils regardless of fibril diameter. Journal of Cell Biology 1987; 105: 2393-2402. Keller, T.C.S. III.: Molecular bungees. Nature 1997; 387: 233-235. Kellermayer, M.S.Z., Smith, S.B., Granzier, H.L., & Bustamante, C.: Folding-unfolding transitions in single titin molecules characterized with laser tweezers. Science 1997; 276: 1112-1116. Kirschbaum, B.J., Heilig, A., Hartner, K-T, Pette, D.: Electrostimulation-induced fast-to-slow transitions of myosin light and heavy chains in rabbit fast-twitch muscle at the mRNA level. FEBSLetters 1987; 243: 123-126 Kivirikko, K.J., & Myllyl , R.: Posttranslational enzimes in the biosynthesis of collagen: Intracellular enzymes. In: Colowick, S.P. & Kaplan, C.O. (Eds). Methods in enzymology. Vol 82: 245-304. Structural and contractile proteins. New York: Academic Press 1982. Klug, G.A., & Tibbits, G.F.: The effects of activity on calcium-mediated events in striated muscle. Excercise and Sports Science Review 1988; 16: 1 Komi, P. V., & Karlsson, J.: Skeletal muscle fiber types, enzyme activities and physical performance in young males and females. Acta Physiologica Scandinavica 1978; 103: 210 Komi, P.V., Viitasalo, J.H.T., Havu, M., Thorsttensson, A., Sj6din, B., & Karlsson, J.: Skeletal muscle fibres and muscle enzyme activities in monozigous an dizygous twins of both sexes. Acta Physiologica Sacandinavica 1977; 100: 385-392. Kovanen, V.: Effects of ageing and physical training on rat skeletal muscle. Acta Physiologica Scandinavica 1989; 135 suppl 577: 1-56. Kovanen, V., Suominen, H. & Heikkinen, E.: Collagen in slow twich and fast twich muscle fibres in different types of rat skeletal muscle. European Journal of Applied Physiology 1984a; 52: 235-242. Kovanen, V., Suominen, H. & Heikkinen, E.: Connective tissue of "fast" and "slow" skeletal muscle in rats -effects of endurance training. Acta Physiologica Scandinavica 1980; 108: 173-180. Kovanen, V., Suominen, H. & Heikkinen, E.: Mechanical properties of fast and slow skeletal muscle with special reference to collagen and endurance training. Journal of Biomechanics 1984b; 17: 725735. Kraus, W.E., et al.: Skeletal muscle adaptation to chronic low-frequency motor nerve stimulation. Excercise and Sports Science Review 1994; 22: 313. Kurzban, G.P., & Wang, K.: Giant polypetides of skeletal muscle titin: sedimentation equilibrium in guanidine hydrochloride. Biochemistry and Biophysics Reseach Commun 1988; 150: 1155-1161. Labeit, S., & Kolmerer, B.: Titins: giant proteins in charge of muscle ultraestructure and elasticity. Science 1995; 270: 293-296. Lance-Jones, C., & Landmesser, L.: Effect of spinal cord deletions and reversals on motoneuron projection patterns in the embryonic chick hindlimb. Soc. Neurosci. 1978; 4: 118 (Abstr). Landmesser, L.T.: The generation of neuromuscular specificity. Annual Review of Neuroscience 1980; 3: 279-302. Laughlin, M.H., et al.: Vascular transport capacity of hindlimb muscles of excercise-trained rats. Journal of Applied Physiology 1987; 62: 438 Laurent, G.J., Sparrow, M.P., Bates, P.C. & Millward D.J.: Turnover of muscle protein in the fowl. Collagen content and turnover in cardiac and skeletal muscles of the adult fowl and the changes during strech-induced growth. Biochemistry Journal 1978; 176: 419427. Lawrie, R.A.: Meat Science. Oxford: Pergamon Press; 1979. Lieber, R.L.: Skeletal Muscle Structure and Function. Baltimore (U.S.A): Williams & Wilkins; 1992. Lieber, R.L., Leonard, M.E., Brown, C.G., & Trestik, C.L.: Frog semitendinosus tendon loadstrain and stress-strain properties during passive loading. American Physiological Society 1991; 261: 8692. Light, N., & Champion, A.E.: Characterization of muscle epimysium, perimysium and endomysium collagens. Biochemical Journal 1984; 219: 1017-1026. Linke, W.A., Ivemeyer M., Olivieri, N,, Kolmerer, B., Rüegg, J.C., Labeit, S.: Towards a molecular understanding of the elasticity of titin. Journal of Molecular Biology 1996; 261: 6271. Lowey, S., Waller, G. S., & Trybus, K.M.: Skeletal muscle myosin light chains are essential for physiological speeds of shortening. Nature 1993; 365: 454-456. Lymn, R.W., & Taylor, E.W.: Mechanism of adenosine triphosphate hydrolysis by actomyosin. Biochemistry 1971; 10: 4617-4624. Magid, A. & Law, D.J.: Myofibrils bear most of the resting tension in frog skeletal muscle. Science 1985; 230: 1280-1282. Martin, G.R. & Timpl, R.: Laminin and other basement membrane components. Annual Review of Cell Biology 1987; 3: 57-85. Martin, G.R., Timpl, R., Miller, P.K. & Kiihn, K.: The genetically distinct collagens. TIBS 1985; July: 285-287. Maruyama, K.: Myofibrilar cytoskeletal proteins of vertebrate skeletal muscle. In: Developments in Meat Sience. Vol. 3. Elsevier Applied Science (U.S.A.): R. A. Lawrie; 1985. Maruyama, K., Kimura, S., Yoshidomi, H., Sawada, H., & Kikuchi, M.: Molecular size and shape of (3-connectin, an elastic protein of striated muscle. Journal of Biochemistry 1984; 95: 1423-1433. McArdle, W. D., Katch, F. I., Katch, V. L.: Exercise Physiology. 4th. ed. U.S.A.: Williams & Wilkins; 1996. McComas, A.J.: Skeletal Muscle. U.S.A: Human Kinetics; 1996. Miller, E.J. & Gay, S.: Collagen: An overview. In: Colowick, S.P. & Kaplan, C.O. (Eds.). Methods in enzimology. Vol. 82, Structural and contractile proteins. New York: Academic Press; 1982. Miller, E.J. & Gay, S.: The collagens: An overview and update. In: Cunningham, L.W. (Eds.). Methods in enzimology. Vol 144. Structural and contractile proteins. Extracellular matrix. Orlando: Academic Press, Inc.; 1987. Miller, J.B., & Stockdale, F.E.: Developmental origins of skeletal muscle fibers; clonal annalysis of myogenic cell lineages based on expression of fast and slow myosin heavy chains. Proceedings of the National Academy of Sciences 1986; 83: 3860-3864. Miller, J.B., & Stockdale, F.E.: What muscle cells know that nerves don't tell them. Trends in Neurosciences 1987; 10-12. Mines, G.R.: On functional analysis of the action of electrolytes. Journal of Physiology 1913; 46: 188-235. Moore, R.L., & Stull, J.T.: Myosin light chain phosphorylation in fast and slow skeletal muscles in situ. American Journal of Physiolgy 1984; 247: 462-47 1. Mailer, W.: Temporal progress of muscle adaptation to endurance training in hind limb muscles of young rats. A histochemical and morphometrical study. Cell & Tissue Research 1974; 156: 61-87. Natori, R.: The electrical potential change of internal membrane during propagation of contraction in skinned fiber of toad skeletal muscle. Japanese Journal of Physiology 1975; 25: 51-63. Nave, R., Furst, D.O., & Weber, K.: Visualization of the polarity of isolated titin molecules: a single globular head on a long thin rod as the M band anchoring domain? Journal of Cell Biology 1989; 109: 2177-2187. Nosek, T.M., Guo, N., Ginsburg, J.M., & Kolbeck, R.C.: Inositol (1,4,5)triphosphate (IP3 ) qithin diaphragm muscle increases upon depolarization. Biophysical Journal 1990; 57: 401. Osborn, M. & Weber, K.: Intermediate filaments: cell type specific markers in differentiation and pathology. Cell 1982; 31: 303-6. Peachey, L.D.: The sarcoplasmic reticulum and transverse tubules of the frog's sartorius. Journal of Cell Biology 1965; 25: 209-23 1. Pette, D.: Activity-induced fast to slow transitions in mammalian muscle. Med. Sci. Sports Excerc. 1984; 16: 517-528. Pette, D., & Staron, R.S.: Cellular and molecular diversities of mammalian skeletal muscle fibers. Reviews of Physiology, Biochemistry and Pharmacology 1990; 116: 1 Pette, D. & Vrbova, G.: Invited review: neural control of phenotypic expresion in mamalian muscle fibers. Muscle & Nerve 1985; 8: 676-689. Piez, K.A.: Molecular and aggregate structures of the collagens. In: Piez, K.A. & Reddi, A.H. (Eds) Extracellular matrix Biochemistry. New York: Elsevier; 1984. Pihlajaniemi, T., & Tamminen, M.: Complete cDNA-derived amino acid sequence of human type XIII collagen: this collagen has al least five alternative splicing sites. In: Federation of European Connective Tissue Societies. XIth meeting, Amsterdam, August 22-26, 1988. Abstract 380. Podolsky, R.J.: The maximum sarcomere length for contraction of isolated myofibrils. Journal of Physiology (London) 1964; 170: 110-123. Pollack, G.H.: Muscles & Molecules. Uncovering the principles of biological motion. Washington (USA): Ebner & Sons Publishers; 1990. Poo, M, M.: Rapid lateral diffusion of functional ACh receptors in embryonic muscle cell membrane. Nature 1982; 295: 333-334. Poole, A.R.: Proteoglycans in health and disease: structures and functions. Biochemical Journal 1986; 263: 1-14. Prockop, D.J., Kivirikko, K.I.: Collagens: molecular biology, diseases, and potentials for therapy. Annual Review of Biochemistry 1995; 64: 403-434. Rayment, I., Holden, H.M., Whittaker, M., Yoha, C.B, Lorenz, M., Holmes, K.C. & Milligan, R.A.: Structure of the actin-myosin complex and its implications for muscle contraction. Science 1993; 261: 58-65. Rief, M., Gautel, M., Oesterhelt, F., Fernandez, F.M., & Gaub,H.E.: Reversible unfolding of individual titin immunoglobulin domains by AFM. Science 1997; 276: 1109-1112. 42 Ringer, S.: A further contribution regarding the influence of different constituents of the blood on the contraction of the heart. Journal of Physiology 1883; 4: 29-41. Ríos, E., Ma. J.J., & González, A.: The mechanical hypothesis of excitation-contraction (EC) couplingin skeletal muscle. Journal of Muscle Research and Cell Motility 1991; 12: 127-135. Robins, S.P.: Cross-linking of collagen. Biochemical Journal 1983; 215: 167-173. Robson, R. M., & Huiatt.: Roles of the cytoskeletal proteins desmin, titin and nebulin in muscle. Reciprocal Meat Conference Proceedings 1983; 36: 116-124. Rohde, H., Wick, G. & Timpl, R.: Inmunochemical characterization of the basement membrane glycoprotein laminin. European Journal of Biochemistry 1979; 102: 195-201. Romanul, F.C.A., & Van der Meulen, J.P.: Slow and fast muscles after cross innervation. Enzimatic and physiological changes. Archivies of Neurology 1967; 17: 387-402. Rowe, R.W.D.: Morphology of perymisial and endomysial connective tissue in skeletal muscle. Tissue & Cell 1981; 13: 681-690. Rugg, J.C.: Calcium in Muscle Activation. A Comparative Approach. Berlin: Springer Verlag; 1986. Rüdel, R., & Taylor, S.R.: Aqueorin luminiscence during contraction of amphibian skeletal muscle. Journal of Physiology 1973; 233: 5-6. Sacks, R.D., & Roy, R.R.: Architecture of the hind limb muscles of cats: functional significance. Journal of Morphology 1982; 173:185-195. Salmons, S., & Streter, F.A.: Significance of impulse activity in the transformation of skeletal muscle type. Nature 1976; 263: 30-34. Salmons, S. & Vrbova, G.: The influence of activity on some contractile characteristics of mammalian fast and slow muscles. Journal of Physiology 1969; 201: 535-549. Saltin, B., et al.: Fiber types and metabolic potentials of skeletal muscles in sedentary man and endurance runners. Annals of the New York Academy of Sciences 1977; 301: 3 Saltin, B., Nazar, K., Costill, D.L., Stein, E., Jansson, E., & Golinick, P.D.: The nature of the training response: peripheral and central adaptation to one-legged exercise. Acta Physiologica Sacandinavica 1976; 96: 289-305. Sanes, J.R.: Laminin, ñbronectin, and collagen in synaptic and extrasynaptic portions of muscle fiber basement membrane. Journal of Cell Biology 1982; 93: 442-451. Sargeant, A.J., Dolan, P., & Young, A.: Optimal velocity for maximal short-term anaerobic power output in cycling. International Journal of Sports Medicine 1984; 5: 124-125. Schantz, P. G.: Plasticity of human skeletal muscle. Acta Physiologica Sacandinavica 1986; 128 (Suppl. 558): 1-62. Schantz, P., Billeter, R., Henriksson, J., & Jansson, E.: Training-induced increase in myofibrilar ATPase intermediate fibers in human skeletal muscle. Muscle & Nerve 1982; 5: 628636. Schantz, P.G., & Dhoot, G.K.: Coexistence of slow and fast isoforms of contractile and regulatory proteins in human skeletal muscle fibres induced by endurance training. Acta Physiologica Sacandinavica 1987; 131: 147-154. Sheetz, M.P., & Spudich, J.: Movement of myosin-coated fluorescent beads on actin cables in vitro.Nature 1983; 303: 31-45. Simoneau, J.A., Lortie, G., Boulay, M.R., Marcotte, M., Thibault, M.C. & Bouchard, C.: Human skeletal muscle fiber type alteration with high-intensity intermittent training. European Journal of Applied Physiology 1985; 54: 250-253. Slomic, A., Rosenfalck, A., & Buchthal, F.: Electrical and mechanical responses of normal and myasthenic muscle with particular reference to the staircase phenomenon. Brain Research 1968; 10: 1-78. Smith, C.A., & Wood, E.J.: Biología Celular. Wilmington, Delaware (U.S.A): Addison-Wesley Iberoamericana, S.A.; 1977. Spudich, J.A., Kron, S.J., & Sheetz, M.P.: Movement of myosin-coated beads on oriented filaments reconstituted from purified actin. Nature 1985; 315: 584-586. Squire, J.: The Structural Basis of Muscular Contraction. New York (U.S.A.): Plenum Press; 1981. Steinert, P.M. & Parry, D.A.: Intermediate filaments: conformity and diversity of expresion and structure. Annual Review of Cell Biology 1985; 1: 41-65. Stenman, S. & Vaheri, A.: Distribution of a major connective tissue protein, fibronectin, in normal tissues. Journal of Experimental Medicine 1978; 147: 1054-1064. Street, S.F. & Ramsey, R.W.: Sarcolemma: transmitter of active tension in frog skeletal muscle. Science 1965; 149: 1379-1380. Streter, F.A., Gergely, J., Salmons, S., & Romanul, F.: Synthesis by fast muscle of myosin light chains characteristics of slow muscle in response to long-term stimulation. Nature 1973; 241: 17-19. Strickholm, A.: Intracellular generated potentials during excitacion coupling in muscle. Journal of Neurobiology 1974; 5: 161-187. Taylor, D.L. & Wang, Y.L.: Fluorescently labelled molecules as probes of the estructure and function of living cells. Nature 1980; 284: 405-10. Terjung, R.L., & Engbretson, B.M.: Blood flow to diferent rat skeletal muscle fiber type sections during isometric contractions in situ. Med. Sei. Sports Excerc. 1988; 20: S 124 Thompson, W.J., Sutton. L.A., & Riley, D.A.: Fibre type composition of single motor units during synapse elimination in neonatal rat soleus muscle. Nature 1984; 309: 709-711. Thorstensson, A., Hulten, B., Von D6beln, W., & Karlsson, J.: Effect of strength training on enzyme activities and fibre characteristics in human skeletal muscle. Acta Physiologica Sacandinavica 1976; 96: 392-398. Tidball, J.G., & Daniel, T.L.: Elastic energy storage in rigored skeletal muscle cells under physiological loading conditions. American Journal of Physiology 1986; 19: 56-64. Timpi, R., Rohde, H., Robey, P.G., Rennard, S.J., Foidart, J.M. & Martin, G.R.: Laminin: a glycoprotein from basement membranes. Journal of Biological Chemistry 1979; 25: 9933-9937. Trinick, J.: Elastic filaments and giant proteins in muscle. Current Opinion in Cell Biology 1991; 3: 112-119. Tskhovrebova, L., Trinick, J., Sleep, J. A., & Simmons, R,M.: Elasticity and unfolding of single molecules of the giant muscle protein titin. Nature 1997; 387: 308-312. Vibert, P., & Cohen, C.: Domains, motions and regulation in the myosin head. Journal of Muscle Research and Cell Motility 1988; 9: 269-305. Vuorio, E.: Connective tissue diseases: mutations of collagen genes. Annals of Clinical Research 1986. 18: 234-241. Wagenknecht, T., Grassucci, R., Frank, J., Saito, A., Inui, M., & Fleischer, S.: Threedimensional architecture of the calcium channel/foot structure of sarcoplasmic reticulum.Nature 1989; 338: 167-170. Wagner, P.D.: Formation and characterization of myosin hybridas containing essential light chains and heavy chains from different muscle myosins. Journal of Biological Chemistry 1981; 256: 24932498. Wang, K.: Sarcomere-associated cytoskeletal lattices in striated muscle: review and hipotesis. Cell and Muscle Motility 1985; 6: 315-369. Wang, K., Knipfer, M., Huang, Q., Herden, A., Chi-Li Hsu, L., Gutierrez, G., Quian, X., Stedman, H.: Human skeletal muscle nebulin sequence encodes a blueprint for thin filament architecture. Sequence motifs and affinity profiles of tandem repeats and terminal SH3 *. Journal of Biological Chemistry 1996; 271: 4304-4314. Wang, K., McCarter, R., Wrigth, J., Beverly, J., & Ramirez-Mitchell, R.: Regulation of skeletal muscle stiffness and elasticity by titin isoforms: a test of the segmental extension model of resting tension. Proceedings of the National Academy of Sciences (USA) 1991; 88: 7101-7105. Wang, K., McCarter, R., Wrigth, J., Beverly, J., & Ramirez-Mitchell, R.: Viscoelasticity of the sarcomere matrix of skeletal muscle. The titin-myosin composite filament is a dual-stage molecular spring. Biophysical Journal 1993; 64: 1161-1177. Wang, K., & Wright, J.: Architecture of the sarcomere matrix of skeletal muscle: immunoelectron microscopic evidence that suggests a set of parallel inextensible nebulin filaments anchored at the Z line. Journal of Cell Biology 1988; 107: 2199-2212. Wang, K., Wrigth, J., & Ramirez-Mitchell, R.: Architecture of the titin/nebulin containing cytoskeletal lattice of the striated muscle sarcomere: evidence of elastic and inelastic domains of the bipolar filaments. Biophysical Journal 1985; 47: 349a (Abstr.) Westerblad, H., & Allen, D.G.: Changes of myoplasmic calcium concentration during fatigue in single mouse muscle fibers. Journal of General Physiology 1991; 98: 615-635. Whiting, A., Wardale, J., & Trinick, J.: Does titin regulate the length of muscle thick filaments? Journal of Molecular Biology 1989; 205: 263-268. Yoshidomi, H., Ohashi, K., & Murayama, K.: Changes inthe molecular size of connectin, an elastic protein, in chicken skeletal muscle during embryonic and neonatal development. Biomedical Research 1985; 6: 207-212. Yoshioka, T., Higuchi, H., Kimura, S., Ohashi, K., Umazume, Y., Maruyama, K.: Effects of mild trypsin treatment on the passive tension generation and connectin splitting in stretched skinned fibers from frog skeletal muscle. Biomedical Research 1986; 7: 181186. Yox, D.P., DiCaprio, R.A., & Fourtner, C.R.: Resting tension and posture in arthropods. Journal of Experimental Biology 1982; 96: 421-425. Zaager, S., & Burke, M.: Subunit interactions of skeletal muscle myosin and myosin subfragment. Evidence for heavy chain-alkali light chain association-dissociation equilibrium. Journal of Biological Chemistry 1988; 263: 1513-1517.