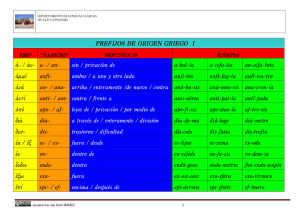
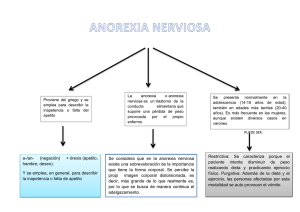
Atlas de la IASLC de Pruebas de ALK en Cáncer de Pulmón
Anuncio

Editado por DR. Ming SOUND Tsao, FRCPC DR. Fred R. Hirsch, PhD DR. Yasushi Yatabe, PhD Atlas de la IASLC ’ ’ de Pruebas de ALK en CAncer de PulmOn international Association for the Study of Lung Cancer Atlas de la IASLC ’ ’ de Pruebas de ALK en CAncer de PulmOn International Association for the Study of Lung Cancer, Aurora, Colorado, EEUU Editores: Dr. Ming Sound Tsao, FRCPC Dr. Fred R. Hirsch, PhD Dr. Yasushi Yatabe, PhD Una publicación de la IASLC publicada por IASLC Press Patricia Vigués, Spanish translation Cubierta original y diseño del libro por Biographics Oficina de Prensa de la IASLC: IASLC, 13100 East Colfax Ave., Unit 10, Aurora, Colorado 80011, EEUU www.iaslc.org Primera publicación por la IASLC Octubre 2013 10 9 8 7 6 5 4 3 2 1 ISBN: 978-1-940488-04-2 Copyright ©2013 International Association for the Study of Lung Cancer Reservados todos los derechos Ninguna parte de esta publicación puede ser reproducida, almacenada, introducida o transmitida en cualquier forma o por cualquier medio sin permiso previo y por escrito del titular del copyright. Aunque la información de este libro se cree que es verdadera y exacta a partir de la fecha de publicación, ni la IASLC ni los editores ni la editorial aceptan ninguna responsabilidad legal por cualquier error u omisión que pueda haber. La editorial no ofrece ninguna garantía, expresa o implícita, en cuanto al material contenido en el mismo. Atlas de la IASLC ’ ’ de Pruebas de ALK en CAncer de PulmOn Editado por Dr. Ming Sound Tsao, FRCPC Dr. Fred R. Hirsch, PhD Dr. Yasushi Yatabe, PhD international Association for the Study of Lung Cancer Agradecimientos La IASLC agradece la generosa aportación y apoyo proporcionado por Pfizer Oncology para este atlas de pruebas de ALK. Los co-editores y todos los colaboradores también agradecen la asistencia editorial de Lori Alexander, MTPW, ELS, el apoyo de Deborah A. Whippen, Editorial Rx, Inc., y Rania Gaspo, PhD, Pfizer Oncology, durante la preparación de esta publicación. ’ Indice Lista de colaboradores. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 6 Abreviaturas . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 7 Fabricantes. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 8 Introducción . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 9 Capítulo 1 Candidatos para las pruebas de ALK . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 11 Capítulo 2 Obtención de muestras, procesamiento y diagnóstico general de procedimientos . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 13 Capítulo 3 Hibridación In Situ Fluorescente (FISH) . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 17 Capítulo 4 La Inmunohistoquímica (IHC). . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 29 Capítulo 5 Retrotranscriptasa-reacción en cadena de la polimerasa (RT-PCR por sus Siglas en Inglés) y varios ensayos genéticos . . . . . . . . . . . . . . . . . . . . . . . . . . 38 Capítulo 6 Comparación de diferentes plataformas de ensayo para pruebas de ALK . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 44 Capítulo 7 Análisis de ALK en citología . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 53 Capítulo 8 Presentación de informes de la prueba ALK . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 58 Capítulo 9 Líneas de actuación y estudios de estandarización . . . . . . . . . . . . . . . . . . . . . . . . . . . 61 Capítulo 10 Resumen y perspectivas futuras . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 67 Referencias . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 69 Anexo 1 Resumen de estudios publicados sobre las pruebas de reordenamiento del gen ALK en cáncer de pulmón . . . . . . . . . . . . . . . . . . . . . . . . . . 74 Anexo 2Guía de pruebas moleculares propuestas por CAP/IASLC/AMP para la selección de pacientes con cáncer de pulmón elegibles para el tratamiento con inhibidores de la tirosina cinasa para EGFR y ALK . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 76 6 Atlas de la IASLC de Pruebas de ALK en Cáncer de Pulmón Lista de colaboradores Editores Dr. Ming Sound Tsao, FRCPC Dr. Fred R. Hirsch, PhD Yasushi Yatabe, MD, PhD Patólogo y Científico Senior, Princess Margaret Cancer Centre, University Health Network Profesor, Departamento de Medicina De Laboratorio y Patobiología, University of Toronto Toronto, Canadá Profesor, Departamento de Medicina Departamento de Patología University of Colorado en Denver Denver, Colorado, EE.UU. Jefe de Departamento de Patología y Diagnóstico Molecular, Aichi Cancer Center Nagoya, Japón Autores colaboradores Dra. Elisabeth Brambilla, PhD Keith M. Kerr, FRCPath Dr. Erik Thunnissen, PhD Profesora, Département d’Anatomie et Cytologie Pathologiques INSERM U823 Institut Albert Bonniot Centre Hospitalier Universitaire de Grenoble, Université Joseph Fourier Grenoble, Francia Profesor, Departamento de Patología Aberdeen University Medical School Aberdeen Royal Infirmary Aberdeen, Escocia, Reino Unido Patólogo, Consultor, VU University Medical Center Amsterdam, Holanda Dra. Sylvie Lantuéjoul, PhD Profesora, Departamento de Medicina/Oncología Médica Departamento de Patología University of Colorado en Denver Denver, Colorado, EE.UU. Dr. Lukas Bubendorf Profesor y Jefe de la División de Citopatología Instituto de Patología, University Hospital Basel Basel, Suiza Dr. Jin-Haeng Chung, PhD Profesor, Departamento de Patología Seoul National University Bundang Hospital Seoul, Corea del Sur Profesor y Presidente del Departement d’Anatomie et Cytologie Pathologiques INSERM U 823 Institut Albert Bonniot Centre Hospitalier Universitair A Michallon, Université Joseph Fourier Grenoble, Francia Dr. Kengo Takeuchi, PhD Objetivos Moleculares en Patología Instituto del Cáncer División de Patología del Cancer Institute Hospital Fundación Japonesa para la Investigación del Cáncer Tokyo, Japón Marileila Varella-Garcia, PhD Dr. Ignacio Wistuba Profesor y Presidente emérito de Jay and Lori Eisenberg Departamento de Patología Molecular Traslacional University of Texas MD Anderson Cancer Center Houston, Texas, EE.UU. Dr. Akihiko Yoshida, PhD Patólogo, Departamento de Patología National Cancer Center Hospital Tokyo, Japón Asistentes al Workshop IASLC ALK Testing, Sorrento, Italia, 2013. Primera fila, de izquierda a derecha–Y. Yatabe, M. Varella-Garcia, E. Brambilla, S. Lanteujoul, R. Gaspo (Pfizer Oncology), J-H Chung. Última fila, de izquierda a derecha–A. Yoshida, I. Wistuba, F. R. Hirsch, M. S. Tsao, E. Thunnissen, L. Bubendorf, K. Kerr. 7 Abreviaturas Abreviaturas Las siguientes abreviaturas se usan en el texto: AEC: 3-amino-9-etilcarbazol ALK: cinasa del linfoma anaplásico AMP: Asociación de Patología Molecular ATS: Sociedad Torácica Americana CAP: Colegio de Patólogos Americanos CISH: hibridación in situ cromogénica CPCP: cáncer de pulmón de células pequeñas CPCNP: cáncer de pulmón de células no pequeñas DAB: 3, 3’ diaminobencidina EBUS: ecografía endobronquial EDTA: ácido etilendiaminotetraacético EGFR: receptor del factor de crecimiento epidérmico EML4: proteína 4 asociada al microtúbulo del equinodermo ERS: Sociedad Respiratoria Europea ETOP: Plataforma Oncológica Torácica Europea FDA: US Food and Drug Administration FFPE: fijado en formol e incluido en parafina FISH: hibridación in situ fluorescente H&E: hematoxilina & eosina HER2: factor de crecimiento epidérmico humano receptor 2 iAEP: polímero intercalado de anticuerpos mejorado IASLC: Asociación Internacional para el Estudio de Cáncer de Pulmón IHC: inmunohistoquímica ISH: hibridación in situ KIF5B: miembro de la familia cinesia 5B NOS: no especificado NGS: secuenciación de nueva generación PAAF: Punción-aspiración con aguja fina RET: proto-oncogen ret ROS1: ros oncogen 1 RT-PCR: retrotranscriptasa-reacción en cadena de la polimerasa TKI: inhibidor de la tirosina cinasa USE: ecografía transesofágica v: variante 8 Atlas de la IASLC de Pruebas de ALK en Cáncer de Pulmón Fabricantes Los siguientes fabricantes y sus productos se destacan en este Atlas. Las localizaciones dadas por cada fabricante no son únicas. La mayoría de los fabricantes tienen oficinas en todo el mundo. Abbott Molecular Abbott Park, Illinois, EE.UU. Vysis LSI ALK Break Apart FISH Probe Kit, Spectrum Orange Probe, and Spectrum Green Probe Leica Biosystems Buffalo Grove, Illinois, EE.UU. Wetzlar, Alemania Bond-Max, Novolink Polymer Detection System Abcam Cambridge, Reino Unido Anticuerpo Anti-ALK (5A4) Nichirei Biosciences, Inc. Tokyo, Japón Anticuerpo 5A4 (Histofine ALK Detection Kit) BD (Becton, Dickinson and Company) Diagnostics Franklin Lakes, New Jersey, EE.UU. SurePath Novocastra Newcastle, Reino Unido Anticuerpo 5A4 Cell Signaling Technology Danvers, Massachusetts, EE.UU. Anticuerpo D5F3 (ALK [D5F3] XP Rabbit mAb) Dako Glostrup, Dinamarca Carpinteria, California, EE.UU. ADVANCE, anticuerpo ALK1, EnVision, EnVision+, EnVision FLEX, y EnVision FLEX+, PT Link, y Target Retrieval Solution Hologic, Inc. Bedford, Massachusetts, EE.UU. ThinPrep Invitrogen, Life Technologies Corporation Carlsbad, California, EE.UU. Anticuerpo Anti-ALK NanoString Technologies Seattle, Washington, EE.UU. NanoString assay Pfizer Oncology New York, New York, EE.UU. XalkoriTM Ventana Medical Systems, Inc. (miembro del grupo Roche) Tucson, Arizona, EE.UU. BenchMark XT, iVIEW DAB Detection Kit, OptiView DAB IHC Detection Kit, OptiView Amplification Kit, y ultraView Universal DAB Kit, y Ensayo de Anticuerpo Primario Monoclonal de Conejo ZytoVision GmbH Bremerhaven, Alemania ZytoDot 2C SPEC ALK break-apart probe INTRODUCCIÓN Por Ming Sound Tsao, Fred R. Hirsch y Yasushi Yatabe En los últimos años, el diagnóstico y el tratamiento de pacientes con cáncer de pulmón avanzado ha sufrido grandes cambios. El modelo actual para la prescripción de nuevas terapias especializadas se basa en la selección de pacientes de acuerdo a la presencia de anormalidades oncogénicas específicas en el tumor. Las primeras anomalías en ser descubiertas en el cáncer de pulmón fueron las mutaciones en el dominio cinasa del receptor del factor de crecimiento epidérmico (EGFR). Se encontró que los tumores con estas mutaciones tenían sensibilidad a los inhibidores de la tirosina cinasa de EGFR (TKIs). Desde entonces, el gen de la cinasa del linfoma anaplásico (ALK) se ha convertido en el segundo oncogén diana en el cáncer de pulmón para el que se han desarrollado nuevas terapias altamente efectivas. El nuevo gen de fusión ALK está formado por un reordenamiento que ocurre en el brazo corto del cromosoma 2 y afecta a los genes que codifican para ALK (2p23.2) y la proteína 4 asociada al microtúbulo del equinodermo (EML4) (2p21) o, raramente, a los genes en otros cromosomas. El producto proteíco de este nuevo gen de fusión tiene una cinasa constitutivamente activa de ALK porque el dominio básico del gen EML4 proporciona un mecanismo para la dimerización de la nueva proteína quimérica. Se han identificado numerosas variantes de reordenamiento del gen de fusión EML4-ALK en los diferentes tipos de cáncer de pulmón. Las fusiones implican la parte del extremo N-terminal del gen EML4 y el dominio de cinasa en la parte C-terminal del gen ALK. Debido a que esta reordenación génica implica una gran inversión y translocación cromosómica, la hibridación in situ fluorescente (FISH) se ha convertido en el método elegido para la detección de todas las formas de reordenamiento del gen ALK, y fue el ensayo utilizado para detectar esta aberración genética en los primeros ensayos clínicos del inhibidor de ALK, crizotinib (Xalkori®, Pfizer Oncology) (Bang 2010, Kwak 2010, Camidge 2012). Por lo tanto, FISH y las sondas break-apart para detectar reordenamiento se han convertido en el método estándar para el diagnóstico de cáncer de pulmón con el reordenamiento ALK, y la Food and Drug Administration (FDA) de los EE.UU. ha aprobado la prueba Vysis LSI ALK Break-Apart FISH Probe Kit (Abbott Molecular) para ello. Este ensayo, junto con criterios bien definidos para los resultados positivos y negativos, se utilizó para identificar a los pacientes con cáncer de pulmón avanzado de células no pequeñas (CPCNP) que eran positivos para el reordenamiento del gen ALK. En un estudio fase I/II, la tasa de respuesta objetiva con crizotinib fue del 61% y una mediana de supervivencia libre de progresión de 9,7 meses (Camidge 2012). En un estudio en fase III aleatorizado (PROFILE 1007), en la que crizotinib se comparó con la quimioterapia en pacientes en los que la enfermedad había progresado durante la quimioterapia convencional, la tasa de respuesta objetiva con el tratamiento con crizotinib fue del 65 % (comparada con el 20% para la quimioterapia) y una mediana de supervivencia libre de progresión de 7,7 meses (en comparación con 3,0 meses para la quimioterapia) (Shaw 2013). 10 Atlas de la IASLC de Pruebas de ALK en Cáncer de Pulmón Se ha desarrollado una nueva generación de inhibidores de ALK, y estos inhibidores se están estudiando en ensayos clínicos continuamente. En cuanto se detectan nuevos reordenamientos del gen, se ponen en marcha ensayos utilizando la reacción en cadena de la polimerasa (PCR): la secuenciación para detectar los genes de fusión. Además, los estudios de varias instituciones han demostrado que la proteína ALK puede ser detectada por inmunohistoquímica (IHC) con amplificación de la señal en casi todos los tumores que son ALK positivo en FISH, y varios informes describen casos en que los tumores CPCNP que albergan patrones atípicos de ALK en FISH (FISH ALK negativo) que son ALK positivo en la IHC pueden responder al tratamiento con inhibidores de ALK (Peled 2012). En este contexto se están desarrollando y validando los kits comerciales de la IHC actualmente. El desarrollo de estas múltiples plataformas de diagnóstico proporciona métodos alternativos para que los laboratorios detecten reordenamientos del gen ALK o proteínas de fusión, dependiendo de la experiencia y el equipo técnico disponible. Es necesario estandarizar estos ensayos dado que las pruebas de diagnóstico clínico requieren ensayos con una sólida reproducibilidad y fiabilidad. Para abordar esta cuestión, el Comité de Patología de la Asociación Internacional para el Estudio del Cáncer de Pulmón (IASLC) convocó a un panel de expertos para publicar esta guía que puede ayudar a los patólogos, científicos de laboratorio y médicos en ejercicio a entender mejor el trasfondo, el protocolo y la interpretación de los resultados de las pruebas de ALK en pacientes con CPCNP avanzado. CAPÍTULO 1 Candidatos para las pruebas de ALK Por Fred R. Hirsch, Elisabeth Brambilla y Ming Sound Tsao Es ampliamente reconocido que la detección de reordenamientos del gen ALK es importante para la selección de la mejor terapia para los pacientes con CPCNP avanzado. Sin embargo, no está claro si las características clínico-patológicas pueden ayudar a determinar qué pacientes deben someterse a las pruebas de ALK. Los reordenamientos del gen ALK se encuentran con mayor frecuencia en los tumores de pulmón de los no fumadores, ex fumadores ocasionales, los pacientes CPCNP-Otros más jóvenes y en los tumores clasificados (n=376) ADSC (n=78) como adenocarcinomas. Pero, ¿es plausible excluir a los pacientes de edad avanzada y CCE fumadores con histología escamosa de las (n=1411) CPCNP (n=4025) pruebas de ALK? En estudios publicados, alrededor del 70 % al 80 % de los pacientes con CPCNP ALK- positivo han sido siempre no ADC fumadores (comparado con el 20 % y el 30 % (n=6775) de los fumadores actuales o ex fumadores), y han sido más jóvenes (40 a 50 años) que las personas con CPCNP en general (60 a 70 años) o personas con CPCNP con mutación 11.1 9 en EGFR (60 a 65 años) (Rodig 2009). Sin 5.7 embargo, en todos los estudios, también se 5.2 4.8 han encontrado tumores que albergaban 1.3 reordenamiento de ALK en pacientes mayores de 70 años o menores de 40. CPCNP ADC ADSC CPCNPADC CCE Otros (no seleccionado) (seleccionado) De acuerdo con estos datos, no está claro que los antecedentes de tabaquismo Figura 1. Resumen de los estudios sobre el reordenamiento del y la edad debieran excluir las pruebas ALK gen ALK en CPCNP. A. Número de casos de CPCNP que han sido en ningún paciente. La histología parece estudiados sobre la aberración ALK y descritos en la literatura hasta mayo de 2013. “CPCNP” se refiere a los casos de los estudios ser el criterio de selección más importante. que no especificaron los tipos de tumores, y los “CPCNP-otros” De entre las más de 12.000 muestras de incluyen carcinoma adenoescamoso (ADSC) y carcinoma de grandes/ sarcomatoide. B. Tasa estimada de casos ALKcáncer de pulmón que se han descrito en células positivo según la histología del tumor. Para adenocarcinoma la literatura, los reordenamientos de ALK se (ADC), la figura 1 muestra la prevalencia en los estudios con o encuentran principalmente en los carcino- sin criterios clínicos de selección (por ejemplo, antecedentes de tabaquismo, negativo en EGFR o mutación en KRAS). Las cifras se mas no neuroendocrino y no escamoso de basan en datos que se presentan en el Anexo 1. CCE=carcinoma pulmón. (Figura 1; Anexo 1). Según estos de células escamosas. A B 12 Atlas de la IASLC de Pruebas de ALK en Cáncer de Pulmón datos, varias guías publicadas, incluyendo la guía de más reciente publicación desarrollada por el Colegio Americano de Patólogos (CAP)/Asociación Internacional para el Estudio del Cáncer de Pulmón (IASLC)/Asociación para la Patología Molecular (AMP), han recomendado que las pruebas de ALK no se realicen de forma rutinaria en el CPCNP avanzado con histología escamosa (Lindeman 2013). (Véase el Anexo 2 y el capítulo 9 para una discusión completa de las líneas de actuación para las pruebas de ALK). Sin embargo, el reordenamiento de ALK se ha detectado en aproximadamente el 1,3 % de más de 1.400 carcinomas de pulmón de células escamosas (Anexo 1) y en varios informes de casos en los que el reordenamiento de ALK se verificó mediante la IHC (Alrifai 2013, An 2013, Ochi 2013). La discordancia entre los estudios de carcinoma de pulmón de células escamosas puede ser causada por las dificultades que todavía existen para diagnosticar los subtipos histológicos de CPCNP. Un diagnóstico de cáncer de pulmón a menudo se hace de acuerdo con el examen de una pequeña muestra de biopsia o muestras citológicas, pero los diagnósticos histopatológicos realizados en pequeñas muestras de biopsia no siempre son representativos de todo el tumor. En la revisión de un diagnóstico de cáncer de células escamosas de especímenes que no mostraban evidencia de mutaciones en EGFR ni mutaciones en KRAS, se demostró la presencia de componentes de adenocarcinoma en 15 de 16 tumores (Rekhtman 2012). Por lo tanto, la guía CAP/IASLC/AMP sugiere que las pruebas de ALK se hagan sólo a los pacientes con adenocarcinoma y cáncer de pulmón mixto con un componente de adenocarcinoma en muestras de cáncer de pulmón completamente extirpadas. La prueba ALK también se recomienda para muestras limitadas, como las muestras de biopsia y de citología, cuando no se puede excluir por completo el componente de adenocarcinoma. La detección de ALK con la IHC podría ser una solución ideal para los problemas de las pruebas de ALK en el carcinoma de pulmón de células escamosas. Teniendo en cuenta su bajo coste y su alta reproducibilidad, sensibilidad y especificidad, las pruebas de IHC se conciben para los pacientes con carcinoma de pulmón de células escamosas en combinación con la prueba FISH, que es más cara, y que se utiliza para confirmar los resultados positivos de la IHC. Las pruebas para el reordenamiento del ALK no se asocian actualmente con resultados terapéuticos inmediatos en los pacientes con CPCNP localizado o loco-regional. Sin embargo, pueden ser beneficiosas ya que muchos de estos pacientes, posteriormente, pueden sufrir una recidiva, y los resultados de las pruebas podrán ahorrar tiempo y esfuerzo en el futuro. CAPÍTULO 2 Obtención de muestras, procesamiento y diagnóstico general de procedimientos Por Keith M. Kerr, Ignacio Wistuba y Yasushi Yatabe Las pruebas para detectar reordenamientos del gen ALK (en muestras de tejido afectadas por cáncer de pulmón) es uno de los varios procedimientos de diagnóstico necesarios. En la mayoría de los pacientes, un único procedimiento de muestreo va a generar una cantidad relativamente pequeña de tejido que luego debe ser utilizado de la manera más eficiente para permitir el diagnóstico más completo posible. Deben tenerse en cuenta dos puntos importantes sobre muestras de tejido: existe la posibilidad de que una muestra no contenga tejido tumoral, y sólo hay una oportunidad de fijar y procesar el tejido. Por lo tanto, la adquisición y el procesamiento son pasos cruciales en el control de calidad con el fin de facilitar todos los procedimientos de diagnóstico que se necesiten hacer sobre una muestra de tejido. La obtención de tejido para el diagnóstico En la mayoría de los casos, las pruebas de ALK se realizan en una pequeña muestra de tejido obtenida por biopsia o en muestras citológicas tomadas de los pacientes con enfermedad avanzada. Con menos frecuencia, se encuentra disponible todo el tumor de un paciente al que se le practicó una resección quirúrgica de la enfermedad en etapa inicial y recurrencia posterior. La toma de muestras de tejido para el diagnóstico debe tener como objetivo la obtención del mayor rendimiento del tumor en la forma más segura y menos invasiva posible (Thunnissen 2012d). El muestreo puede implicar al tumor primario, la enfermedad metastásica intratorácica o metástasis extratorácica. Aunque se han descrito discrepancias en el estado de ALK entre la enfermedad primaria o metastásica (Kim 2013), no hay suficientes datos para recomendar ningún método en concreto para la obtención de tejido. El tumor primario puede ser muestreado con endoscopia (por biopsia endobronquial o transbronquial, criobiopsia o punción aspiración con aguja fina [PAAF]), o con una técnica percutánea transtorácica (por biopsia con aguja o PAAF). Hoy en día la enfermedad metastásica intratorácica es rutinariamente muestreada usando ultrasonido endobronquial (EBUS) o una ecografía transesofágica (USE). Normalmente la enfermedad pleural (ya sea biopsia pleural o citología del líquido) es una buena fuente de material diagnóstico. La enfermedad metastásica distante (extratorácica) se puede muestrear dependiendo de su procedencia; en todos los casos, varias técnicas de imagen son útiles para determinar la selección de las muestras para mejorar el rendimiento del tumor (Rivera 2007). En muchos de los centros, se utilizan procedimientos quirúrgicos para obtener tejido si no se obtiene el material suficiente con los procedimientos guiados por imagen o cuando dichos procedimientos no han tenido éxito. Tejido para la prueba de ALK Para la prueba de ALK se puede utilizar tanto la biopsia de tejido como las muestras procedentes 14 Atlas de la IASLC de Pruebas de ALK en Cáncer de Pulmón de citología; la clave está en que el material debe ser procesado y manipulado de forma adecuada y la muestra debe contener suficientes células tumorales (Thunnissen 2012b). El número de células tumorales necesarias para la determinación inmunohistoquímica (IHC) de la proteína ALK aún no está definido, pero para evaluar la técnica FISH para determinar el reordenamiento del gen ALK, se requiere un mínimo de 50 células tumorales. Existen diferentes enfoques para las muestras de frotis citológico, pero el más adecuado con las muestras de citología es generalmente el bloque celular que permite preparar y tratar las secciones de la misma manera que las secciones de muestras de biopsia de tejido. En general, todo el tejido o material celular recibido en el laboratorio de patología debe ser procesado. Los especímenes de resección quirúrgica son una excepción, aunque, como regla general, los tumores con un diámetro de 3cm o menos deben ser procesados en su totalidad. Los derrames pleurales abundantes también pueden ser procesados en parte. Se recomienda el almacenamiento del fluido hasta que todos los procedimientos de diagnóstico hayan concluido. Procesamiento de tejidos Se recomienda la fijación por inmersión, o cuando corresponda, por insuflación, con formaldehído tamponado al 10%. La pre-fijación con algunos fijadores a base de alcohol puede alterar la antigenicidad del tejido o la integridad del DNA. Las soluciones descalcificadoras ácidas utilizadas en muestras de biopsia ósea pueden interferir con la IHC, con frecuencia comprometer la prueba FISH y a menudo degradar el DNA, y por ende hacer que las pruebas para determinar las mutaciones sean menos fiables. También se deben evitar los agentes de fijación que son ácidos (tales como el fluido de Bouin) o a base de sales de metales pesados. En general, se recomienda un periodo de fijación de más de 6 horas y menos de 48 horas, especialmente cuando se tengan que hacer pruebas de biomarcadores (para las que la integridad del DNA es importante) (Wolff 2007, Hunt 2007). Un defecto o un exceso de fijación pueden tener efectos nocivos en el DNA y sobre los epítopos de una proteína antigénica (Werner 2000, Atkins 2004, Oyama 2007, Bussolati 2008, Eberhard 2008). Una de las partes importantes de dicha fase en la manipulación de tejidos es el periodo de tiempo que comienza inmediatamente después de extirpar la muestra del paciente y colocarla en el fijador. La mayoría de los laboratorios no tienen ni el control, ni los datos sobre la cantidad de tiempo transcurrido entre la extracción de tejidos y la inmersión en un fijador y su llegada al laboratorio. Además, la mayoría de las máquinas de procesamiento de tejidos tienen una etapa de fijación, lo que aumenta el tiempo de fijación. En la práctica, la mayoría de los laboratorios ajustan sus procesos de tinción pertinentes para la IHC y la hibridación in situ (ISH) para determinar su propio tiempo medio de fijación. La determinación de la naturaleza y duración de la fijación es un desafío aún mayor en los laboratorios que reciben muestras de muchas fuentes externas con muy diferentes métodos de fijación. Manejo de tejidos para pruebas de biomarcadores La mayoría de las investigaciones con biomarcadores (IHC, ISH, o estudios de RNA / DNA) se llevan a cabo durante el estudio diagnóstico inicial. En estas circunstancias, se deben utilizar las secciones recién cortadas para las pruebas de biomarcadores. El tejido previamente cortado y almacenado en un portaobjetos se deteriorará en cuestión de días o semanas y, ciertamente, a lo largo de los meses. La degradación depende de las condiciones de almacenamiento y muy probablemente también del biomarcador específico (Atkins 2004). La estabilidad de la proteína ALK en secciones no teñidas aún no se ha estudiado sistemáticamente. Por lo tanto, de forma similar que en la determinación de HER2 en cáncer de mama, los cortes de secciones de tejido almacenadas durante más de 6 semanas no se deben utilizar para las pruebas de IHC para ALK. Si se requiere su almacenamiento, las secciones 15 CAPÍTULO 2: Obtención de muestras, procesamiento y diagnóstico general de procedimientos deben estar revestidas en cera o un medio similar para evitar la oxidación por aire y además deben mantenerse en un lugar fresco, oscuro y seco. El tejido fijado en formol e incluido en parafina (FFPE) es menos propenso al deterioro, y en la mayoría de las circunstancias, resulta útil recortar el bloque de tejido según sea necesario en un momento posterior. Existen diversas estrategias que pueden ayudar a limitar el número de veces que el bloque debe ser cortado para proporcionar material para la evaluación inicial morfológica, la tinción IHC, y posterior análisis molecular. Por ejemplo, las secciones adicionales se pueden cortar en la primera sesión de corte, y aunque esta estrategia puede salvar la inevitable pérdida de material de gran valor en cada nueva sesión de corte, se puede dar el caso de cortar innecesariamente y ello puede plantear cuestiones relacionadas con el almacenamiento de las secciones cortadas (Figura 1). El Procedimiento rutinario actual Tinción con H&E para diagnóstico histológico Repetir cortes para la IHC Repetir cortes para las pruebas moleculares El procedimiento en la era de las terapias molecularmente dirigidas Tinción con H&E para diagnóstico histológico para la IHC para las pruebas moleculares Figura 1. Preparación de las secciones de tejido durante la evaluación diagnóstica. La práctica rutinaria actual consiste en hacer secciones adicionales para el ensayo IHC y/o pruebas moleculares después de los cortes iniciales para la tinción de hematoxilina- eosina (H&E) para el diagnóstico histológico. El corte seriado múltiple puede mermar el volumen del tumor cada vez que se recorte el bloque. En la era de las terapias molecularmente dirigidas, la preparación de las secciones adicionales sin teñir para posibles análisis de IHC y/o pruebas moleculares puede reducir significativamente la cantidad de muestra de tejido perdido y mejorar el tiempo de respuesta. 16 Atlas de la IASLC de Pruebas de ALK en Cáncer de Pulmón primer paso en la evaluación de una muestra es identificar la presencia o ausencia de malignidad. Dependiendo de la selección de pacientes, elección de la técnica de muestreo y la habilidad del cirujano, la tasa de hallazgos tumorales positivos es generalmente alta, pero puede variar desde aproximadamente el 60 % hasta más del 90 % (Schreiber 2003). Es bien sabido que, incluso cuando el tumor está presente en la muestra, puede no estar presente en todos los fragmentos de tejido y por lo general comprende una pequeña proporción de la muestra (Coghlin 2010). Una vez que se confirma la malignidad, el siguiente paso es excluir la posibilidad de tumores malignos no epiteliales (tales como linfoma o sarcoma) y/o la posibilidad de que un cáncer, especialmente el adenocarcinoma, no sea la metástasis de pulmón de otro órgano (Kerr 2013b). Este paso se suele hacer fácilmente basándose en la evaluación de la información clínica y radiográfica adecuada que acompaña a la muestra y la evaluación morfológica básica basada en H&E. La falta de información clínica, sin embargo, puede conllevar a la realización de pruebas auxiliares de IHC innecesarias en la muestra en un intento de excluir posibles fuentes extratorácicas de un adenocarcinoma, lo cual puede conllevar a que se agote el material para posteriores estudios moleculares. Suponiendo que el tumor es un cáncer primario de pulmón, el siguiente paso es distinguir el cáncer de pulmón de células pequeñas (CPCP) de otros tipos, ya que el CPCP avanzado se trata de manera distinta al CPCNP. Por lo general, esta discriminación se puede hacer con gran precisión basándose en las características morfológicas (Burnett 1994), pero aún así, la IHC podría llegar a ser necesaria. La mayoría de los casos que no son CPCP pueden ser diagnosticados con precisión y clasificados morfológicamente como carcinomas escamosos, adenocarcinomas o, en raras ocasiones, otro tipo de CPCNP. Entre 25% y 40% de los casos, sin embargo, dependiendo del tipo de muestra y casuística, las características morfológicas no son adecuadas para la clasificación precisa y consistente del subtipo CPCNP; tales casos deben ser designados inicialmente como CPCNP no especificado (NOS) (Chuang 1984). A continuación, se puede utilizar la IHC en el diagnóstico para predecir la probabilidad del subtipo de CPCNP (Loo 2010, Travis 2011, Travis 2013). Este enfoque, utilizando un panel de IHC limitado, puede reducir la proporción de casos de CPCNP-NOS a menos del 10% y predecir el subtipo de CPCNP en la mayoría de los casos de NOS con una precisión de más del 80% (Loo 2010). Los casos descritos juntamente con este uso de IHC deben ser informados usando la terminología recomendada (por ejemplo, CPCNP, probable adenocarcinoma) en un caso morfológicamente indiferenciado, donde la IHC puede predecir adenocarcinoma (Travis 2011, Kerr 2013a). Conclusión El criterio estándar se basa en la identificación de pacientes con dianas moleculares terapéuticas en sus tumores. La necesidad de más pruebas moleculares, más allá de las requeridas para el diagnóstico morfológico inicial y el perfeccionamiento de la clasificación de tumores por la IHC cuando sea necesario, hace que la adquisición, la manipulación, el procesamiento y el aprovechamiento razonable de tejido tumoral de diagnóstico sea de suma importancia. Se debe hacer todo lo posible para asegurar que una cantidad suficiente de tejido tumoral esté disponible para los pasos diagnósticos posteriores. Sin embargo, la falta de tejido suficiente puede ser inevitable en algunos casos, y conlleva a un gran impacto en las pruebas moleculares que siguen al diagnóstico del tumor. Cuando la cantidad de tejido es insuficiente, es cada vez más frecuente realizar la biopsia de repetición. CAPÍTULO 3 Hibridación In Situ Fluorescente (FISH) Por Akihiko Yoshida y Marileila Varella-Garcia La sonda FISH de rotura (o break-apart) fue originalmente desarrollada para la detección de fusiones de genes creados por translocaciones intracromosomales. FISH break-apart es un método de diagnóstico fiable en la patología quirúrgica, ya que es fácilmente aplicable a especímenes FFPE, incluso cuando no se conocen las parejas exactas de fusión. Las sondas FISH ALK break-apart se han incorporado con éxito en la práctica habitual de diagnóstico de linfomas y de los tumores mesenquimales, y el descubrimiento del reordenamiento de ALK en un subgrupo raro de CPCNP amplió su aplicación (Soda 2007). Sin embargo, en este último escenario, la prueba FISH se ha enfrentado a complicaciones inesperadas, principalmente debido a que las variantes comunes de fusión se producen entre ALK (2p23.2) y el gen situado muy cerca de EML4 (2p21) a través de inversiones intracromosomales. Rara vez el gen ALK se fusiona con otros genes por translocación intracromosomal. Por lo tanto, la técnica FISH break- apart para detectar el reordenamiento del gen ALK, se debe realizar prestando mucha atención a los aspectos técnicos y a la interpretación de los resultados. Diseño de la sonda FISH La sonda de rotura ALK está originalmente diseñada mediante el marcaje de la región 3' (telomérica) del punto de rotura con un fluorocromo y la región 5' (centromérica) con otro fluorocromo distinto. Existen algunas variaciones entre los diferentes reactivos comerciales o hechos a medida para las zonas genómicas específicas cubiertas por las sondas y los distintos fluorocromos utilizados para el marcaje. En el kit desarrollado por Abbott Molecular (Figura 1; Vysis LSI FISH ALK break apart Probe Kit), la región 3' (aproximadamente de 300 kb) se representa por una señal 300 kb 442 kb 3' 5' naranja (espectro naranja, a menudo referido como rojo en la literatura 2p23.2 debido a que la señal es detectada por ALK EML4 el filtro de interferencia en la longitud de onda roja), y la región 5' (aproxima- Normal damente de 442 kb) está representada ~12.5 Mb inversión por una señal verde (espectro verde). Gen de fusión EML4- ALK Este conjunto de sonda fue aprobado ALK:EML4 como un ensayo de diagnóstico comALK:EML4 plementario para un inhibidor de ALK por la FDA de EE.UU. y se utiliza Figura 1. El Vysis LSI FISH ALK Break Apart Probe Kit (Abbott Molecular) comúnmente en todo el mundo. para la prueba para detectar la presencia del gen de fusión EML4-ALK (reordenamiento en ALK) en el cáncer de pulmón. 18 Atlas de la IASLC de Pruebas de ALK en Cáncer de Pulmón Requisitos de manipulación preanalítica Como cualquier ensayo basado en el DNA, la técnica FISH tiene una ventaja importante por su solidez. Sin embargo, el ensayo se ve afectado por muchos factores, especialmente el momento de la fijación, el tiempo de fijación, y el tipo de fijador, todo lo cual puede conducir a la degradación del DNA (Tabla 1) (Hunt 2007, Babic 2010). Por ejemplo, la larga isquemia fría, o que transcurra más de 1 hora desde el momento en que el tejido se extirpa hasta que se fija, puede provocar la degradación del DNA y por consiguiente que las pruebas de FISH no sean valorables (Khoury 2012). Se considera que el momento ideal para la fijación es de entre 6 y 48 horas (Hunt 2007, Babic 2010); tanto los tiempos de fijación más cortos como los más largos pueden influir en el rendimiento de las pruebas de manera significativa. Tabla 1. Recomendaciones preanalíticas para la obtención de unos buenos resutados de las pruebas FISH Parámetro Recomendaciones Tiempo de fijación Lo más corto posible, que no exceda 1 hora Fijador Formaldehído tamponado al 10% Tiempo de fijación 6-48 horas Preparación Muestras parafinadas cortadas a un grosor de 5 ±1 μm Almacenamiento de la muestra Bloques de tejido (ideal) Tiempo de almacenamiento de los bloques No es relevante si las condiciones son adecuadas Condiciones de almacenamiento de los bloques Protegidos de la luz, del calor y la humedad Tiempo de almacenamiento para los cortes histológicos 4-6 semanas (ideal); los cortes menos recientes requieren un protocolo personalizado Descalcificación EDTA, si es necesario El fijador óptimo es el formaldehído tamponado al 10%; el fijador Prefer y el fijador de Bouin impedirán la hibridación. Es casi seguro que los tejidos descalcificados con soluciones de ácido fuerte no puedan hibridar. La descalcificación suave con EDTA o ácido fórmico en general no afecta sustancialmente el rendimiento de la prueba. La descalcificación es particularmente relevante cuando la única muestra disponible para el análisis molecular es una lesión ósea metastásica; en tales casos, el grado de descalcificación ósea puede deducirse a partir del tejido teñido con H&E, lo cual puede ayudar a decidir si se pueden utilizar las muestras para la prueba FISH. Otro factor relevante para la eficacia del ensayo es el tiempo y las condiciones de almacenamiento de las secciones. El tejido seccionado en portaobjetos que se guarda durante un periodo prolongado a temperatura ambiente no suele dar buenos resultados en ensayos FISH estándar, requiriendo protocolos personalizados. Por lo tanto, el bloque de tejido incluido en parafina es el formato ideal de almacenamiento. El tiempo de almacenamiento aceptable para los bloques de parafina varía en función de las condiciones de almacenamiento (por ejemplo, la temperatura, la exposición a la luz, al calor o a la humedad), y los materiales sometidos a condiciones que degradan el DNA pueden fallar para hibridar. Numerosas variables antes y después de la hibridación también pueden afectar a la prueba. El proceso de prehibridación incluye una serie de pasos para facilitar la penetración de la sonda en el núcleo de las células tumorales. La permeabilización del tejido se consigue con la digestión de las 19 CAPÍTULO 3: Hibridación in situ fluorescente grandes estructuras de proteínas, pero no todas las muestras responden de forma idéntica a un determinado protocolo. Los tumores pobremente diferenciados son más sensibles a los procedimientos de prehibridación, mientras que los tumores mucinosos y fibrosos son más resistentes. Los lavados post-hibridación deben permitir la eliminación adecuada de la sonda no hibridada sin disminuir la intensidad de la señal. Muchos protocolos alternativos pueden generar excelentes resultados, por lo que los laboratorios pueden elegir cualquiera de estos protocolos mientras las condiciones se ajusten adecuadamente a las características de la muestra. Evaluación de la calidad de las muestras hibridadas y selección de células valorables Es esencial que la calidad de la morfología del tejido y la intensidad de la señal sean evaluadas rigurosamente antes de aceptar una muestra para el análisis. Las muestras son óptimas para el análisis cuando presentan una morfología excelente y una intensidad de señal con muy baja tinción de fondo (Figuras 2 y 3). Las muestras con una digestión excesiva de la cromatina o escasa penetración de la sonda no son aceptables y deben ser analizadas de nuevo cuando se hayan solucionado los problemas técnicos. Por ejemplo, las muestras no son aceptables cuando el pre-tratamiento de los tejidos es insuficiente o excesivo (Figura 4) o cuando la superposición de núcleos con señales fusiformes, producto del artefacto en los cortes, hace imposible valorar la A C B Figura 2. Campos microscópicos de los tumores de pulmón ALK negativo. D A B C E Figura 3. Campos microscópicos de los tumores de pulmón ALK positivos mostrando principalmente el patrón dividido 3'-5' (3A-3C) y el patrón aislado 3' (3D, 3E). 20 Atlas de la IASLC de Pruebas de ALK en Cáncer de Pulmón separación entre la señal roja y la verde (Figura 5). El reordenamiento de ALK aparece homogéneamente distribuido en el tumor, lo que refleja su papel oncogénico crítico (Camidge 2010). Por lo tanto, no es necesario seleccionar un área del tumor específico basado en la morfología o perfil inmunológico, y en cambio se recomienda clasificar varias áreas tumorales diferentes. La gradación de los B A tumores se debe realizar en Figura 4. Muestras no aceptables para el análisis debido a la digestión excesiva las células tumorales muy bien del tejido (4A) o la escasa digestión del tejido (4B). conservadas que no se solapan y que tienen por lo menos una copia de cada una de las señales de las regiones 5' y 3'. Debido a que el cáncer de pulmón tiende a asumir una amplia gama de patrones de crecimiento, y porque las células tumorales pueden mezclarse estrechamente con los elementos de tejido no tumoral (por ejemplo, macrófagos alveolares y linfocitos), la identificación precisa de A B las células tumorales puede ser difícil en un campo oscuro. Es Figura 5. Muestras no aceptables para el análisis debido a altos niveles de recomendable remitirse siempre tinción de fondo (5A) y señales fusiformes (5B). a una serie de cortes histológicos de tejido teñido con H&E para el ajuste morfológico adecuado. Clasificación celular: patrones de señal Conceptualmente, las zonas genómicas homólogas a las sondas 5' y 3' están molecularmente muy cercanas y estas señales se visualizan como fusionadas, próximas o adyacentes en las células normales. Por el contrario, cuando el gen de fusión EML4-ALK está presente, la señal verde de 5' ALK se aleja bastante de la señal roja de 3' ALK (aproximadamente 12,5 Mb), y las señales se ven como si estuvieran divididas. En realidad, las señales 3' y 5' se pueden visualizar o muy alejadas o muy próximas entre sí en las células huéspedes tumorales anormales debido a diversos grados de condensación y reordenamientos tridimensionales de la cromatina. Del mismo modo, debido a la proximidad de EML4 y ALK, la división puede ser tan estrecha que las señales pueden parecer fusionadas en el reordenamiento ALK (Figura 6). Además, esta región genómica parece ser altamente inestable, y las regiones homólogas a una de las sondas se pueden perder, y por consiguiente, la señal correspondiente también. Como resultado, cada célula tumoral puede mostrar una variedad de combinaciones de señales de co-localización 5'-3' ALK o señales aisladas de 5' o 3' ALK. 21 CAPÍTULO 3: Hibridación in situ fluorescente A pesar de esta diversidad en el perfil de la señal, las células se pueden clasificar dentro de cuatro patrones distintos basados según el número de la señal y su localización. CLASIFICACIÓN DE LA SEÑAL Patrones observados en patrón Patrones observados en ALK nativo dividido 3'-5' ALK Rojo y verde separado por diámetros de señal <2 Clasificado como negativo Rojo y verde separado por diámetros de señal ≥2 Clasificado como positivo Rojo y verde separado por diámetros de señal ≥2 Clasificado como positivo Rojo y verde separado por diámetros de señal <2 Clasificado como negativo Patrón fusionado (normal) (Figura 7A). Se considera que una célula tiene un patrón normal (ALK negativo) cuando CLASIFICACIÓN DE LA MUESTRA las señales 5' y 3' se fusionan tumores con reordenamiento: tumores sin reordenamiento: (Figura 2). Cualquier separatasa de reordenamiento tasa de reordenamiento ción entre las señales 5'y 3' positivo ≥15% de las células positivo <15% de las células por una distancia de menos Figura 6. Patrones de señal en los núcleos de tumores pulmonares hibridados con de dos diámetros de señal la prueba FISH de ALK-break apart. debe ser clasificada como patrón fusionado. El número de señales fusionadas 5'-3' por núcleo tumoral no es relevante para la clasificación según estos patrones. Patrón dividido (positivo) (Figura 7B). Se considera que una célula tiene un patrón dividido (ALK positivo) cuando las señales 5' y 3' están separadas, sin importar el número de señales aisladas reales (Figura 3). La separación entre las señales de 5' y 3' debe ser dos o más veces el diámetro de la señal más grande (Camidge 2010). El número de señales aisladas 5' y 3' no necesita ser el mismo, por ejemplo, una célula con dos copias de la señal aislada 5' y tres copias de la señal aislada 3' se clasifica como patrón dividido. El número de señales fusionadas 5'-3' acompañantes en la célula no es relevante para la clasificación de patrones. Patrón aislado 3' (positivo) (Figura 7C). Se considera que una célula tiene un patrón aislado 3’ cuando sólo están presentes las señales aisladas 3' y no hay ninguna señal 5' aislada. Cuando una célula tiene tanto señales aisladas 3' como 5', con más señales 3' que 5', la clasificación correcta es la de patrón dividido, y no la de patrón aislado 3'. El número de señales fusionadas acompañantes no es relevante para la clasificación de patrones. Patterns Examples A. Fused B. Split C. Isolated 3' ALK D. Isolated 5' ALK Figura 7. Clasificación de células tumorales basada en el patrón de señal ALK en la prueba FISH. 22 Atlas de la IASLC de Pruebas de ALK en Cáncer de Pulmón Patrón aislado 5' (negativo) (Figura 7D). Se considera que una célula tiene un patrón aislado 5' cuando sólo están presentes señales aisladas 5' y no hay señales aisladas 3'. Cuando una célula tiene tanto señales aisladas de 3' como 5', con más señales de 5' que de 3', la clasificación correcta es la de patrón dividido, y no de patrón aislado 5'. El número de señales fusionadas acompañantes no es relevante para la clasificación de patrones. Nota: Los criterios para el patrón dividido se basan principalmente en las pruebas efectuadas de las secciones del tumor FFPE con el Vysis LSI ALK Break Apart FISH Probe Kit, y los criterios deben ser validados cuando se utiliza un reactivo analítico diferente o un espécimen biológico. El tamaño de la sonda puede diferir entre los diseños de sonda, y una sonda más grande da como resultado tanto un tamaño de la señal más grande como una distancia más corta necesaria para la definición de patrón dividido. Célula Gradación de tumores Se necesita un mínimo de 50 células tumorales cuando hay un marcador y un mínimo de 100 células tumorales cuando hay dos marcadores (ver más información en la sección “Valor de Corte”). Las muestras con menos células evalua­bles no son adecuadas para el análisis FISH (Camidge 2010). El patrón de señal de cada célula tumoral se debe anotar en una hoja de registro (Figura 8). Es probable que la gradación de tumores sea más exacta cuando se visualiza el tejido bajo un microscopio con filtros de interferencia individuales (rojo y verde) y dual. La gradación de tumores basada en imágenes capturadas tiene limitaciones y la imagen debe representar toda la profundidad de la sección con el fin de evitar una falsa interpretación de las señales aisladas (Figura 9). El aumento de copias del gen ALK nativo es común en CPCNP (Figura 10) y no existe ningún indicio de que esté asociado con la sobreexpresión de la proteína. Hoy por hoy, no se recomienda que el número de copias de ALK se incluya de forma rutinaria como parte de la gradación. A Nota: El tamaño de la señal en las imágenes capturadas tiende a ser ligeramente más señal señal fusionada 5' señal 3' Pattern Célula 1 2 0 0 Fusionada Célula 2 2 1 1 Dividida Célula 3 2 0 1 Aislada 3' Célula 4 1 1 0 Aislada 5' Célula 5 0 1 2 Dividida Célula 6 1 0 0 Fusionada Célula 50 2 0 0 Fusionada Resumen de gradación de células: Número total de células contadas: 50 Número total de células con patrón fusionado: 19 Número total de células con patrón dividido: 22 Número total de células con patrón aislado 3': 5 Número total de células con patrón aislado 5': 4 Número total de células con patrón de reordenamiento positivo: 22+5=27 Tasa de células de reordenamiento positivo: 27÷50 x100=54% Figura 8. Un ejemplo de una hoja de registro de gradación de células. No z-stacking B 16 planes at 0.4 µm= 6.4 µm z-stacking Figura 9. El análisis basado en imágenes capturadas es difícil si la sobreposición z (consolidación de múltiples niveles de enfoque en un plano) no representa toda la profundidad de la sección. 23 CAPÍTULO 3: Hibridación in situ fluorescente D A B C E Figure 10. El aumento de número de copias de las señales de ALK nativas aumenta comúnmente en muestras de cáncer de pulmón, con niveles que van desde bajo (10A) a muy alto (10C). Un grupo de numerosas copias sugiere la amplificación del gen (10D, 10E). El aumento de número de copias no debe ser interpretado como un resultado positivo. grande que la que se observa en el examen real bajo microscopía de fluorescencia. Cuando la gradación se realiza en las imágenes capturadas, la distancia entre las señales puede subestimarse, lo que puede comprometer los resultados del análisis. Otro riesgo en la utilización de imágenes capturadas para la gradación de tumores es que la captura de imágenes a menudo consolida múltiples niveles de enfoque en un plano, y, como resultado, una señal dividida verticalmente a lo largo del eje z del plano de tejido puede no distinguirse de una señal fusionada. Clasificación de la muestra: tasa de células de reordenamiento positivo La tasa de reordenamiento positivo se define como: Tasa de reordenamiento de células positivas (%) = [(número de células con patrón dividido + número de células con patrón aislado 3’) / Número total de células evaluadas] × 100 Nota: Debido a que el dominio cinasa de la tirosina cinasa del ALK se codifica en la región 3' del gen, la señal 3' no apareada es la que indica el gen de fusión oncológicamente relevante, mientras que la señal no apareada 5' representa probablemente un producto de fusión recíproco no funcional. Por lo tanto, las células con un patrón aislado 3’ se clasifican como células de reordenamiento positivo junto con las que tienen un patrón dividido. Las células con un patrón aislado 5' no deben ser interpretadas como células de reordenamiento positivo. Si no tenemos en cuenta el patrón aislado 3' y nos limitamos a la definición de reordenación para el patrón dividido, se reduce la sensibilidad del ensayo de FISH de ALK en un 60% ó 70% (Yoshida 2011a, Paik 2011). Valor de corte Debido a que el gen de fusión EML4-ALK se crea normalmente por una pequeña inversión intracromosomal que afecta a dos genes localizados en las proximidades, la distancia entre las señales de división que supone un reordenamiento de ALK es normalmente estrecha cuando se utiliza la prueba FISH break-apart. Debido al grado de condensación de la cromatina en las células o su distribución física, las divisiones estrechas son a veces técnicamente no distinguibles de las señales fusionadas (Figura 6), lo cual puede causar que la tasa de células con reordenamiento positivo en ALK en CPCNP sea baja (40 % al 70 %)(Perner 2008, Camidge 2010, Camidge 2012b). Además, CPCNP sin reordenamiento de ALK puede tener patrones de reordenamiento positivo (es decir, patrón dividido o patrón aislado 3') en una fracción de células (Perner 2008, Camidge 2010, Yoshida 2011a), 24 Atlas de la IASLC de Pruebas de ALK en Cáncer de Pulmón probablemente debido a un artefacto de rotura o tal vez a una alteración genómica estocástica que no indica un gen de fusión específico (Figura 6). Como resultado, la distribución de las tasas de células con reordenamiento positivo en CPCNP es continua, y la diferencia entre CPCNP ALK-reordenado y de tipo nativo es una cuestión estadística. Por lo tanto, se debería efectuar obligatoriamente una cuidadosa evaluación cuantitativa para el resultado óptimo de la prueba. Se ha determinado un valor de corte del 15% para separar mejor entre CPCNP ALK reordenado (ALK positivo) y CPCNP ALK de tipo nativo (ALK negativo) (Camidge 2010, Kwak 2010, Yoshida 2011a). Para minimizar el sesgo técnico, se recomienda una estrategia de evaluación en dos etapas con dos marcadores independientes (Figura 11). El primer marcador clasifica 50 células tumorales. Una tasa de células de reordenamiento positivo de menos de 10% (es decir, de reordenamiento en menos de cinco de las 50 células) se considera negativa; una tasa mayor del 50% (es decir, más de 25 de las 50 células) se considera positiva, y una tasa de 10% a 50% (es decir, de 5 a 25 de las Primer marcador–50 células tumorales 50 células) se considera equívoca y por tanto se debe hacer una clasificación <10% positiva >50% positiva 10%-50% positiva adicional. En ese caso, un segundo marcador independiente clasificaría Equívoca 50 células tumorales adicionales, y una Segundo marcador–50 células tumorales tasa final de células de reordenamiento Primer y segundo marcador-50 células tumorales positivo se calcularía sobre la suma de la primera y la segunda. Si la tasa final es <15% positiva ≥15% positiva de 15% o más, la muestra se interpreta como positiva para el reordenamiento Muestra considerada Muestra considerada del gen ALK, y si la tasa es menor que negativa para el positiva para el reordenamiento reordenamiento 15%, la muestra se interpreta como del gen ALK del gen ALK negativa para el reordenamiento del Figura 11. Algoritmo de clasificación recomendado para FISH de ALK. gen ALK. Nota: El punto de corte del 15% se basa principalmente en pruebas con el Vysis LSI ALK Break Apart FISH Probe Kit (Abbott Molecular) y se debe confirmar cuando se utilice un reactivo diferente. Validación del laboratorio La prueba FISH de ALK debe estar debidamente validada en el laboratorio antes de ofrecer la prueba en un entorno clínico (Halling 2012, Saxe 2012). La exactitud de los resultados- es decir, el grado en que el ensayo discrimina entre normal (ALK negativo) y anormal (ALK positivo) - debe compararse cuidadosamente en otro laboratorio donde el ensayo validado se está realizando correctamente y/o en comparación con un método previamente validado en el mismo laboratorio que ofrezca la misma precisión. La precisión o reproducibilidad de los resultados debe ser verificado teniendo en cuenta el grado de acuerdo entre las mediciones realizadas sobre la misma muestra por diferentes técnicos y/o en diferentes momentos, y todo el proceso de análisis debe ser corroborado y repetido periódicamente. Por otra parte, la sensibilidad analítica y especificidad de la prueba deben ser confirmadas en las muestras con genotipo conocido. El CPCNP con ALK de tipo nativo y el tejido benigno deben ser evaluados para determinar la distancia en una señal dividida como verdaderos positivos (una distancia de al menos dos veces el diámetro de la señal). Estas tareas son más sencillas cuando se utilizan reactivos comerciales y requieren un mayor nivel de detalle cuando se utilizan reactivos desarrollados por el laboratorio. 25 CAPÍTULO 3: Hibridación in situ fluorescente Desafíos El procedimiento FISH de ALK break-apart se ha asociado a cuatro retos principales: resultados falsos negativos y falsos positivos, perfiles de señales FISH atípicos, las tasas marginales de células de reordenamiento positivas y la necesidad de repetir la prueba. Los resultados falsos negativos y falsos positivos Aunque la sonda FISH break-apart se ha utilizado como norma general para el diagnóstico de cáncer de pulmón ALK-positivo, sigue siendo difícil evaluar la verdadera sensibilidad y especificidad de la prueba. La mayor discordancia entre FISH y otras modalidades surge debido a razones técnicas. Sin embargo, FISH puede generar verdaderos resultados falsos positivos o falsos negativos, que pueden tener un impacto significativo en el manejo de la enfermedad. Los resultados falsos positivos son especialmente difíciles de demostrar, principalmente debido a la limitada sensibilidad bien conocida de la RT-PCR y la IHC. Sin embargo, hay algunos indicios clínicos de que un diagnóstico basado en resultados de FISH predice la respuesta al tratamiento con un inhibidor de ALK con menos exactitud que una combinación de FISH, IHC y RT-PCR, y los casos clínicamente discordantes raramente incluyen verdaderos falsos positivos con los resultados de FISH (Chihara 2011). Las nuevas tecnologías, como la secuenciación masiva en paralelo en todo el genoma, pueden ayudar a demostrar la existencia de resultados falsos positivos de FISH. Por el contrario, algunos casos de resultados falsos negativos de FISH están bien documentados en la literatura (Yoshida 2011a, Murakami 2012, Peled 2012). En tales casos, los patrones de señales FISH atípicos pueden o no ser vistos. Los mecanismos genómicos subyacentes a los resultados falsos negativos de FISH no han quedado completamente claros, pero cabe la posibilidad de que los complejos reordenamientos genéticos e inserciones crípticas puedan contribuir a ello. Perfil de señal atípico Hay casos aislados aproximadamente el 6% de los casos, (Camidge 2013) en que FISH produce perfiles de señal atípicos que son tanto recurrentes como suficientemente distintos para ser reconocibles. Al menos algunos de dichos patrones son conocidos por estar asociados con resultados falsos negativos. Un ejemplo de ello es cuando la mayoría de las células tumorales albergan un patrón aislado predominantemente de 5', con sólo unas pocas células que tienen un patrón dividido o un patrón aislado 3' (“patrón predominante 5'”, Figura 12). Por regla de enumeración convencional, el patrón aislado 5' debe ser clasificado como ALK negativo y estos casos tienden a ser pasados por alto como negativo para el reordenamiento de ALK. Sin embargo, se han descrito casos con este patrón de señal que conllevan un transcrito de A B fusión EML4-ALK cuando los Figura 12. Un patrón atípico en el cáncer de pulmón con la prueba FISH breakresultados se confirmaron por apart es el patrón aislado predominantemente 5'. Las flechas indican las señales verdes individuales (5' ALK). la RT-PCR (Yoshida 2011a). 26 Atlas de la IASLC de Pruebas de ALK en Cáncer de Pulmón Otra señal de FISH atípica es el denominado patrón de doble señal roja, en el que un par de señales de 3' se fusiona con una señal 5' (Figura 13A) (Peled 2012). El CPCNP ALK-positivo con un patrón de doble señal roja puede ser mal interpretado como negativo para el reordenamiento de ALK porque dicho grupo de señales puede simular una señal fusionada convencional. A veces, tres o más copias de señales 3' pueden agruparse y fusionarse con una señal 5' (que se refiere como un patrón de triple señal roja) y así sucesivamente, según el número de copias (Figura 13B, 13C). En otros casos más raros, la mayoría de las células tumorales en CPCNP de ALK positivo pueden mostrar sólo señales 3' aisladas sin copias normales de ALK (Figura 13D). Las células con dicho patrón son consideradas como no evaluables por las reglas de gradación convencionales debido a la posibilidad de un fallo de la hibridación de la sonda 5', y el cáncer ALKpositivo con un patrón de este tipo puede ser pasado por alto. B Aunque todavía no está completamente claro cómo tales patrones de señales anormales predicen el estado de fusión sistemáticaA C D mente, estos patrones Figura 13. Patrones atípicos observados en los tumores de pulmón con la sonda FISH deberían al menos break-apart. 13 A: 3'-5-3' (patrón de doble señal roja) 13B y 13C: 3'-3'-5'-3' (patrón de triple plantear un alto índice señal roja); 13D: Señales 3’ aisladas, en su mayoría sin señales normales ALK. Las flechas de sospecha e incitar a indican un reordenamiento en ALK. la realización de pruebas con otras modalidades de diagnóstico (por ejemplo, la RT-PCR o la IHC). Serán necesarios futuros estudios para identificar otros perfiles de señal atípicos que están asociados con resultados falsos negativos de la prueba FISH. Tasas borderline de células con reordenamiento positivas En aproximadamente el 8% de los casos de CPCNP, la tasa de células con reordenamiento positivo está en un rango del 10 % al 20 % (Camidge 2013). Aunque el punto de corte aceptado actualmente del 15% clasifica técnicamente tales casos, ya sea como positivo o negativo para el reordenamiento de ALK, nuestra experiencia es limitada en cuanto a si dicha prevalencia borderline de señales de reordenamiento por la prueba FISH representa con precisión la presencia del gen de fusión. Recomendamos que las células sean cuidadosamente contadas otra vez en este tipo de muestras prestando especial atención a la diferenciación morfológica entre células tumorales y no tumorales. El hecho de incluir las células no tumorales en el recuento diluye la tasa de células con reordenamiento positivo. Estos errores técnicos se deberían minimizar mediante el algoritmo de clasificación de dos pasos recomendado. Se debe prestar atención también a las señales divididas verticalmente a lo largo del eje z del plano de tejido, el cual podría ser confundido con una señal fusionada. Este último inconveniente es particularmente relevante en laboratorios en los que la evaluación se realiza en imágenes digitales capturadas que consolidan múltiples niveles de enfoque para producir una imagen (sobreposición z). Estos casos borderline también pueden albergar perfiles de señal atípicos, como se ha descrito anteriormente. En concreto, un patrón de doble señal roja puede destacar inicialmente como una tasa borderline de células con reordenamiento positivo. Usar un filtro de un solo color en el análisis 27 CAPÍTULO 3: Hibridación in situ fluorescente puede facilitar la identificación de señales estrechamente yuxtapuestas que pueden ser pasadas por alto con un filtro de dos colores (rojo y verde) o de tres colores (azul, rojo y verde). Si después de una cuidadosa re-evaluación, la tasa de células con reordenamiento positivas sigue siendo borderline, la interpretación final puede ser tanto positiva como negativa utilizando el punto de corte del 15% y se debería añadir una nota de advertencia recomendando que se tomen en cuenta otras modalidades de diagnóstico, como la IHC o la RT-PCR, para su posterior estudio diagnóstico. Necesidad de repetir la prueba Los resultados de algunas investigaciones sugieren que el estado de ALK, incluyendo el aumento de número de copias de ALK en el curso clínico, puede cambiar, sobre todo después del tratamiento con un inhibidor de ALK (Doebele 2012). Aunque la incidencia exacta y el mecanismo de dicho cambio aún no están claros, se recomienda repetir la prueba cuando el tumor muestra resistencia adquirida tras el tratamiento con un inhibidor de ALK, y seleccionar un nuevo régimen terapéutico. Sin embargo, los datos son todavía preliminares, y se necesitan más investigaciones y validación. Hibridación In Situ Cromogénica (CISH) La prueba FISH no está exenta de limitaciones, entre las que están la necesidad de un equipo altamente especializado, un inevitable desvanecimiento de la señal después de un almacenamiento de tejidos a largo plazo y el examen de campo oscuro que puede dificultar la visualización de la arquitectura del tejido y la citomorfología. Este último factor puede ser especialmente problemático porque el cáncer de pulmón a menudo muestra patrones de crecimiento complejos íntimamente mezclados con células no tumorales y diferenciar las células tumorales de elementos no tumorales puede ser difícil sin información arquitectónica o citomorfológica. La prueba CISH se ha desarrollado para superar estas desventajas de la prueba FISH. Con la prueba CISH, cada sonda de hibridación se visualiza por cromógenos en lugar de fluorocromos (Figura 14). CISH permite la detección de alteraciones genéticas específicas, preservando al mismo tiempo la arquitectura del tumor y citomorfología bajo el microscopio de trabajo de rutina de campo claro. Se ha puesto a prueba la utilidad Substrato Reacción cromogénica Enzima Anticuerpo primario Anticuerpo secundario Sonda DNA diana Figura 14. Principios de la prueba CISH; izquierda. Sondas individuales marcadas con diferentes haptenos que se visualizan por reacciones de anticuerpos similares a los de la IHC. La sonda CISH de ALK break- apart se aplica a los tumores ALK-positivos (derecha). Los puntos negros representan el gen normal ALK, y los genes con reordenamiento en ALK se muestran como señales separadas en color rojo o azul. 28 Atlas de la IASLC de Pruebas de ALK en Cáncer de Pulmón de la técnica CISH de ALK-break-apart para el diagnóstico del cáncer de pulmón y todos los estudios han demostrado una excelente concordancia con los resultados de la prueba FISH y/o la RT -PCR (Kim 2011, Yoshida 2011a, Nitta 2013, Schildhaus 2013). La prueba CISH aún tiene que ser validada para su uso en la detección de reordenamiento de ALK en el cáncer de pulmón, y se han utilizado diferentes puntos de corte (15% y 20%) y criterios de gradación (1 vs 2 diámetros de diferencia) en los pocos estudios realizados. Conclusión La prueba FISH break-apart es una técnica fiable para el diagnóstico de CPCNPs con reordenamiento en ALK y ha sido aceptada como el criterio estándar para seleccionar pacientes para el tratamiento con un inhibidor de ALK. Sin embargo, la prueba FISH depende en gran medida de una cuidadosa preparación e interpretación que siga un estricto cumplimiento de las recomendaciones. Además, la prueba FISH rara vez puede producir resultados equívocos o incluso erróneos. Como cualquier otra prueba clínica, la sonda FISH de ALK-break apart tiene sus puntos fuertes y sus limitaciones y debe ser utilizada dentro de un contexto de diagnóstico adecuado.También es muy recomendable que cada laboratorio realice estudios de validación interna donde se utilicen controles conocidos antes de usar este método como prueba habitual. Además, los laboratorios deben participar en programas periódicos de intercambio de cortes con otros laboratorios clínicos acreditados o en encuestas de ensayos de aptitud proporcionados por los distribuidores autorizados. CAPÍTULO 4 La Inmunohistoquímica (IHC) Por Erik Thunnissen, Sylvie Lantuéjoul, Jin-Haeng Chung, Keith Kerr, Fred R. Hirsch, Ming Sound Tsao y Yasushi Yatabe La IHC de ALK como herramienta de detección La terapia dirigida molecularmente depende fundamentalmente de una prueba validada para detectar la alteración molecular correspondiente, especialmente cuando la alteración molecular está presente en un pequeño subgrupo de pacientes. La IHC de ALK es un método prometedor de cribaje rápido y relativamente económico que utiliza el examen de campo claro, el cual es el preferido por la mayoría de los patólogos, sobre todo porque permite la evaluación de la arquitectura de los tejidos y la histología de las células tumorales. Posiblemente, la IHC se puede interpretar con un menor número de células malignas de las necesarias para la prueba FISH. La IHC da buenos resultados en una variedad de muestras de tumor diferentes. Se pueden analizar los bloques de tejido FFPE, fluidos y citología de bloques celulares por aspiración con aguja fina (PAAF) o frotis, siempre y cuando al menos un par de grupos de células tumorales viables estén presentes en la muestra. Además, en enfermedades de baja prevalencia, tales como CPCNP con reordenamientos en ALK, hay una necesidad creciente de un método de cribado económico (Soda 2007, Koivunen 2008, Perner 2008, Takeuchi 2008, Palmer 2009). El desafío de la IHC de ALK Es importante estandarizar el ensayo de la IHC de ALK como método de cribado y establecer los criterios de evaluación. Las células tumorales en el cáncer de pulmón ALK - positivo normalmente expresan las proteínas de los genes quiméricos del ALK (Figuras 1 y 2). La proteína de fusión del dominio de tirosina cinasa intracelular de ALK con varias (N-terminal) porciones truncadas del gen acompañante es responsable de aumentar constitutivamente la actividad de la cinasa ALK (Morris 1994, Allouche 2007). Sin embargo, la proteína de fusión de ALK en CPCNP puede ser más difícil de detectar con el anticuerpo ALK1, el cual se utiliza A B C D Figura 1. Un adenocarcinoma que es fuertemente ALK positivo. A y B: secciones teñidas con H&E, a pequeño aumento (A) y con un aumento de x10 (B). El recuadro en B es a un aumento de x40. No se observan células en anillo de sello. C y D: La IHC de ALK con el anticuerpo 5A4 muestra intensa tinción citoplasmática de producto del gen ALK (aumento), C: x20, D: x40. 30 Atlas de la IASLC de Pruebas de ALK en Cáncer de Pulmón B A Figura 2. Un adenocarcinoma que es fuertemente ALK positivo. A: sección teñida con H&E. B: La IHC de ALK con el anticuerpo D5F3 y amplificación de tiramida muestra una intensa tinción citoplasmática del producto del gen ALK (aumento, x40). para diagnosticar el linfoma anaplásico de célula grande (LACG), ya que la expresión de la proteína es generalmente menor en el CPCNP (Mino-Kenudson 2010). Para superar este problema, se han introducido varios pasos técnicos incluyendo la recuperación de antígeno, el uso de un anticuerpo primario con mayor afinidad y en una concentración suficientemente alta, medidas para amplificar la fuerza de la señal (por ejemplo, con una cascada tiramida y la intercalación de un anticuerpopolímero mejorado), y el desarrollo de nuevos anticuerpos (Tabla 1). Tabla 1. Anticuerpos disponibles en el mercado para la IHC para detectar la expresión de la proteína ALK. Clon Tipo de Clon Isotipo Immunogeno ALK1 Monoclonal de ratón IgG3, kappa Los aminoácidos 1359–1460 de la proteína ALK humana de longitud completa, correspondientes a los aminoácidos 419–520 de la proteína de NPM-ALK quimérica 5A4 Monoclonal de ratón IgG1 C-terminal del transcrito NPM-ALK (419-520 aminoácidos) D5F3 Monoclonal de conejo No disponible Anti-ALK Monoclonal de conejo IgG Carboxilo terminal (C-terminal) de ALK humano La proteína recombinante que representa los aminoácidos 426 a 528 de ALK humano Otro aspecto importante de las pruebas IHC de ALK en muestras de cáncer de pulmón es la falta de un control positivo interno para la inmunotinción, lo que hace difícil juzgar si un resultado de IHC negativo es realmente negativo para la expresión de la proteína de fusión de ALK. Sin embargo, debido a que el tejido pulmonar normal no expresa ALK, la expresión difusa de la proteína ALK en células de cáncer de pulmón se asocia siempre con la expresión de la proteína aberrante de fusión ALK (Takamochi 2013, Takeuchi 2013). Los bloques celulares obtenidos a partir de líneas celulares con reordenamientos en ALK (H3122-variante 1 y H2228 de la variante 3) se pueden usar como controles para el estado óptimo de tinción, pero se deben tener en cuenta las diferencias entre las secciones de tejido y los bloques celulares obtenidos de líneas celulares, especialmente con una concentración menor de epítopo de la IHC de ALK (Figura 3). Fijación y seccionamiento Los pasos preanalíticos para la IHC de ALK son los mismos que los otros procedimientos de la IHC. 31 CAPÍTULO 4: La inmunohistoquímica Intensidad (U.A.) Independientemente de su origen, 20 las biopsias diagnósticas o piezas quirúrgicas deben fijarse de inmediato en una cantidad adecuada (relación de 10 veces más que el volumen de la muestra) de for10 maldehído tamponado al 10% y embebidos en parafina (FFPE). La fijación debe hacerse tan pronto como sea posible para evitar los 0 1 10 80 efectos de isquemia fría. No se recomiendan tiempos de fijación Concentración de epítopo de menos de 6 horas porque la tinción convencional, así como la IHC, Figura 3. El efecto de un sistema de mejora de la señal en la IHC: baja (círpuede verse afectada negativa- culos azules) y alta (triángulos rojos). Nótese que una baja concentración de epítopo puede llegar a ser positiva con un sistema de alta señal de mejora, mente. La preservación antigénica (flecha delgada), pero negativa con un sistema de mejora de señal baja. para la IHC es epítopo depen­diente, Además, se llegó a una meseta de mayor intensidad; una vez positiva, una concentración de epítopo no dará lugar a manchas oscuras. Con la y algunos epítopos no pueden mayor IHC de ALK, la concentración del epítopo es mayor (flecha gruesa) en los verse obstaculizados por tiempos linfomas que en CPCNP (flecha delgada), y un sistema de mejora de la señal de fijación de hasta 120 horas. Para baja puede ser suficiente. En CPCNP es necesario un anticuerpo de alta afinidad con alta concentración y alta mejora. La concentración de epítofines prácticos, se recomienda un pos tiene una escala logarítmica y una escala lineal de la intensidad (UA = intervalo de fijación de 6 a 48 horas unidades arbitrarias). Adaptado de Prinsen CF, Klaassen CH, Thunnissen FB. para todas las muestras. Después de Microarray como modelo para la química de la visualización cuantitativa. Appl Immunohistochem Mol Morphol. 2003;11:168-173 su inclusión en parafina, el tejido tumoral es estable y se conserva contra daños oxidativos u otros efectos degenerativos. Sin embargo, una vez las secciones de 3 a 4-μm de grosor se cortan a partir del bloque de FFPE, el tiempo de almacenamiento de estas secciones montadas en portaobjetos de vidrio a temperatura ambiente se limita a un máximo de 6 semanas. Si se almacena a temperaturas más frías, las secciones siguen siendo adecuadas durante un período de tiempo más largo. Sin embargo, los cortes de las secciones de tejido que se prepararon con más de 6 semanas de antelación se deben interpretar con mucho cuidado, ya que pueden presentar resultados falsos negativos. La inmunotinción Para el procedimiento analítico, es decir, la prueba de IHC de ALK en sí, se tienen que controlar y optimizar varias cuestiones: la recuperación del epítopo, tipo y concentración del anticuerpo, tiempo de incubación, temperatura de incubación y la amplificación. No se ha evaluado o comparado una sola técnica uniforme en los estudios sobre IHC de ALK en CPCNP. En cambio, el tipo o la fuente de anticuerpos, el proceso de recuperación de antígeno y detección de anticuerpos, y las técnicas de amplificación han variado sustancialmente (Tabla 2). Cuando se compararon directamente los diferentes anticuerpos, D5F3 (Cell Signaling Technology) y 5A4 (Novocastra) con el sistema ADVANCE (Dako) parecían ser ambos más sensibles y más específicos que el anticuerpo ALK1 (Dako) (Figura 4) (Conklin 2013). (Veáse el Capítulo 6 para una discusión de varias plataformas de ensayo). Actualmente se están desarrollando y validando kits comerciales de IHC de ALK. La sensibilidad para detectar la proteína de fusión ALK se ha mejorado mediante el uso de varias etapas de amplificación de la señal (Figura 5) (Rodig 2009, Sakairi 2010, McLeer-Florin 2012). 32 Atlas de la IASLC de Pruebas de ALK en Cáncer de Pulmón Tabla 2. Las Condiciones de la inmunotinción utilizando anticuerpos alk comercialmente disponibles en los estudios publicados seleccionados en los que los kits comercialmente disponibles no se utilizaron Estudio Anticuerpo Recuperación Antigénica Yi et al., 2011 ALK1 Mino-Kenudson et al., 2010 ALK1 D5F3 EDTA, pH 8,0, 30 min en PT Link EDTA, pH 8,0, en olla de presión Dilución Incubación Sistema de detección 1:100 30 min a temperatura ambiente ADVANCE Durante la noche EnVision+ 1:2 1:100 Minca et al., 2013a D5F3 Calor mediante BenchMark XT 1:100 Sin especificar OptiView Martinez et al., 2013 D5F3 Estándar en BenchMark XT 1:50 16 min a 37ºC ultraView Paik et al., 2011 5A4 Solución CC1, 100ºC, 20 min 1:30 2 hr a 42°C iVIEW Hofman et al., 2011 5A4 Objetivo de recuperación de soluciones, pH 9,0, 97°C, 40 min 1:50 30 min a temperatura ambiente EnVision FLEX McLeer-Florin et al., 2012 5A4 Solución CC1 con EDTA, pH 8,4, 1 hr 1:50 2 hr a 37°C Amplification Kit Kim et al., 2011 5A4 Solución CC1, 100°C, 20 min 1:30 2 hr a 42°C iVIEW Sholl et al., 2013 5A4 Tampón citrato, pH 6,0, en olla de presión, 122ºC, 30-45 min 1:50 40 min a temperatura ambiente EnVision FLEX+ Wong et al., 2009 Anti-ALK Tampón citrato, pH 6,0, en microondas, 95ºC, 30 min 1:1000 Durante la noche a 4°C Estreptavidina biotina peroxidasa de rábano picante complejo Chen et al., 2012 Anti-ALK Solución CC1, 95ºC, 30 min 1:500 Durante la noche a temperatura ambiente ultraView Anticuerpos: ALK1 es un producto de Dako; D5F3 es un producto de Cell Signaling Technology; 5A4 es un producto de Novocastra en los estudios de Paik et al, Kim et al, y Sholl et al. y es un producto de Abcam en los estudios de Hofman et al. y McLeer-Florin et al, y anti-ALK es un producto de Invitrogen, Life Technologies Corporation. Recuperación antigénica: PT Link y Target Retrieval Solution son productos de Dako y BenchMark XT es un producto de Ventana Medical Systems, Inc. Sistemas de Detección: ADVANCE, EnVision FLEX + son productos de Dako; OptiView (Kit DAB), ultraView (Kit DAB), iVIEW (Kit DAB), y Amplification Kitson son productos de Ventana Medical Systems, Inc Clone ALK1 Clone D5F3 Figura 4. La IHC de ALK con anticuerpos ALK1 y D5F3 muestran significativamente diferentes intensidades positivas en cortes de tejido idénticos. 33 CAPÍTULO 4: La inmunohistoquímica La estandarización también se Método del polímero regular Método del polímero enlazador puede obtener con la automatización de la IHC usando un kit de IHC disponible comercialmente. La estandarización con tinción automatizada puede llevar a una tinción más consistente, ocasionalmente a expensas de una mayor concentración del anticuerpo primario. Recientemente, ha sido desarrollado un método de detecPolímero con anticuerpo primario anticuerpos secundarios ción altamente sensible que !"#$%"&'%()*+,&' Antígenos combina un novedoso hapteno enlazador (3-hidroxi-2-quinoxalina; HQ) con amplificación de tiramida Figura 5. Esquemas de métodos de polímero regular y de polímero enlazador. (Nitta 2013). Con este sistema de detección de la IHC con HQ-tiramida, todas las células tumorales fueron positivas a pesar de las variaciones de intensidad, lo que sugiere que la tinción heterogénea con algunos métodos es una cuestión de detección del umbral. Además, la hipótesis fue confirmada mediante el ensayo de la proteína del gen que combinaba la IHC altamente sensible con una prueba ISH break apart de campo claro. Evaluación de la tinción La fase postanalítica comienza con la evaluación microscópica de la muestra teñida. En CPCNP, la tinción ALK es citoplasmática; puede tener un carácter granular y, en algunos casos, puede haber un refuerzo de la membrana. La evaluación de la intensidad de la tinción es subjetiva, pero el uso de objetivos de varios aumentos es una ayuda física en el establecimiento del nivel de intensidad, tal y como fue aplicado a pruebas de HER2 (Ruschoff 2012). El uso de este enfoque puede conllevar a una mayor uniformidad en la gradación de la intensidad. La tinción fuerte (3+) es claramente visible con el uso de un microscopio con un objetivo de x2 o x4; la tinción moderada (2+) requiere un objetivo x10 o x20 para ser vista claramente, y la tinción débil (1+) se puede ver solamente con un objetivo x40. La clasificación H clásica se obtiene multiplicando el porcentaje de tumores que se tiñen positivamente por la intensidad (0, 1, 2, ó 3) dentro de un rango de 0 a 300. Este enfoque tiene más en cuenta la heterogeneidad de la tinción. Se han aplicado diferentes criterios para los resultados de ALK-positivos y ALK- negativos en la IHC en diferentes estudios. Algunos autores han clasificado la intensidad de 1+ a 3+ (Figura 6), con un umbral ambiguo alrededor de 1+ o 2+. Este enfoque de clasificación parece estar principalmente relacionado con el sistema de amplificación utilizado y con la tinción de fondo observada con algunos anticuerpos (Mino-Kenudson 2010, Conklin 2013). Otros han aplicado una evaluación sencilla de la positividad, definiendo la expresión de ALK-positiva cuando se observa más del 10 % de células tumorales positivas, independientemente de la intensidad (Rodig 2009, Mino-Kenudson 2010, McLeer-Florin 2012, Martínez 2013, Sholl 2013). Más recientemente, sin embargo, Takeuchi encontró que casi todas las células cancerosas se tiñeron en más de 300 tipos de cáncer de pulmón con reordenamiento en ALK que fueron probados por la IHC con el anticuerpo 5A4 y el método del polímero de anticuerpos mejorado intercalado (iAEP) (Takeuchi 2013). Esta homogeneidad en la tinción sugiere 34 Atlas de la IASLC de Pruebas de ALK en Cáncer de Pulmón que, en el cáncer de pulmón con reordenamiento en ALK, todas las células tumorales albergan el reordenamiento del gen ALK. Hasta que se disponga de más datos acerca de los resultados falsos positivos de la IHC para el 3+ 2+ cribaje de alto rendimiento con IHC de ALK, cosa que se propone en la actualidad en la mayoría de las publicaciones, los patólogos deben confirmar cualquier señal positiva por la técnica de referencia: la prueba FISH fluorescente. 0 Sin embargo, un número cre1+ ciente de pacientes que tienen Figura 6. Un ejemplo de la clasificación de la IHC de ALK que oscila de 0 a 3+. tumores que son positivos con la IHC y negativos con FISH (de acuerdo a criterios estrictamente definidos) han tenido una buena respuesta a la terapia con tocrizotinib (Peled 2012). Otro aspecto a tener en cuenta es la reproducibilidad de los resultados de la IHC de ALK entre diferentes laboratorios y patólogos. Hasta el momento, dos protocolos de IHC parecen haber sido validados. En un estudio, siete patólogos internacionales evaluaron la reproducibilidad utilizando el kit Ventana IHC ALK (Ventana Medical Systems, Inc.). En una clasificación binaria utilizando el procedimiento definido de funcionamiento estándar Ventana, la reproducibilidad entre los observadores fue del 95% y el 97% tanto para los resultados positivos como negativos (Hirsch 2013). El otro estudio es el protocolo de la Plataforma Europea de Oncología Torácica (ETOP) en el que se utilizó el anticuerpo 5A4 (Novocastra) (Thunnissen 2012c), y en el que 12 laboratorios tiñeron, ya sea manualmente o con el uso de un procedimiento automatizado, los mismos tumores de una manera consistente. (Consulte el Capítulo 9 para obtener información más detallada sobre la estandarización). Puesta en práctica de la IHC de ALK Los patólogos deben estar familiarizados con varios artefactos que pueden llevar a la tinción de falsos positivos: el punteado citoplasmático claro en los macrófagos alveolares (Figura 7), células de origen neural (células nerviosas y ganglionares), la tinción del epitelio glandular, la mucina extracelular y las áreas tumorales necróticas. Raramente se observa tinción de fondo en parénquima pulmonar normal, pero se han observado varios problemas de tinción. (Tabla 3). La expresión de la proteína ALK puede estar aumentada en algunas situaciones sin reordenamiento de ALK, y los resultados de la IHC pueden ser positivos con un patrón negativo (o atípico) en la prueba FISH de ALK (Figura 8) (véase también el capítulo 3). Además, se ha descrito en la literatura médica la falta de la expresión de la proteína de ALK a pesar de la amplificación del gen (Pelosi 2012, Salido 2011). Por ejemplo, Pelosi et al. describieron un subconjunto de carcinoma sarcomatoide que presentaba la amplificación del gen ALK, pero la expresión de la proteína ALK no se detectó usando dos anticuerpos diferentes. Las implicaciones clínicas del aumento de número de copias del gen asociada con la expresión de la proteína requiere más investigación (Salido 2011, Kim 2013). Histológicamente, las células que contienen mucina, como las células en anillo de sello, requieren una cuidadosa interpretación de la inmunorreactividad del ALK. El patrón positivo fino de 35 CAPÍTULO 4: La inmunohistoquímica A B C D Figura 7. Tinción inespecífica con la IHC con el anticuerpo D5F3. A: Los macrófagos alveolares en el margen de un tumor ALK negativo. B: Citología de bloque celular por punción aspiración con aguja de un nódulo pulmonar, mostrando CPCNP. El punteado citoplasmático claro en los macrófagos alveolares puede dar lugar a una interpretación falsa positiva. Bloque celular (C) y una biopsia (D) de adenocarcinoma con punteado que fue negativo para el reordenamiento ALK en la prueba FISH. Tabla 3. Posibles errores de interpretación de los resultados de la IHC Células productoras de mucina El citoplasma está enmascarado por la mucina intracelular con ausencia de la proteína ALK, y conlleva a la tinción negativa o tinción tipo marginal membranosa y a una interpretación de falsos negativos. Tinción de membrana Ocasionalmente se vé tinción de membrana no específica, particularmente prominente en la parte apical. Este hallazgo no es específico para células tumorales y también se observa en los neumocitos normales. Células neuroendocrinas Algunos carcinomas escamosos, carcinomas neuroendocrinos de célula grande y células ganglionares normales muestran reacciones positivas. Tinción no específica de la mucina Dependiendo del sistema de amplificación utilizado, se puede observar alguna tinción de fondo de la mucina extracelular y en el citoplasma de los macrófagos alveolares y las células bronquiales. membrana con la IHC de ALK puede estar enmascarado por la vacuola mucinosa intracelular (Figura 9), y el patrón positivo puede entonces ser difícil de detectar en las células en anillo de sello (Rodig 2009, Yoshida 2011b, Popat 2012). Algunos investigadores han observado tinción membraB A nosa, particularmente en la parte apical, en el cáncer FISH-negativo Figura 8. Un ejemplo de expresión de la proteína ALK (izquierda) con patrón (Murakami 2012, Mino-Kenudson atípico de la prueba FISH (señales verdes difusas individuales: derecha) [comunicación personal]). Este hallazgo no es específico para las células cancerígenas y también fue observado en algunas células no tumorales como los neumocitos tipo II reactivos. Además, algunos carcinomas neuroendocrinos también se han relacionado con reacciones positivas (Murakami 2012, Nakamura 2013). La tinción puede parecer heterogénea en algunos tumores, particularmente en muestras quirúrgicas (Figura 10), sin embargo, si se controlan las condiciones preanalíticas, la gran mayoría de las células tumorales se tiñen de igual manera que en la distribución homogénea del reordenamiento 36 Atlas de la IASLC de Pruebas de ALK en Cáncer de Pulmón del gen ALK en el análisis FISH. La heterogeneidad está probablemente relacionada con la heterogeneidad de la fijación y no parece estar relacionada con la presencia de un patrón histológico diferente. La sensibilidad de la proteína ALK con un tiempo de fijación mayor no es un problema para las muestras de biopsia, pero puede ser un problema cuando se utilizan microarrays de tejidos para el cribaje de ALK en muestras archivadas. Puede que se requieran estudios adicionales sobre el patrón de punteado paranuclear descrito como característico en la reordenación KIF5B-ALK (Figura 11) (Takeuchi 2009). A B C D Figura 9. Un tumor con variación en la morfología y la tinción. La tinción H&E muestra (A) un área con muchas células en anillo de sello, y (B) un área con un patrón sólido con pocas células en anillo de sello. La inmunohistoquímica ALK 5A4 muestra (C) un pequeño refuerzo citoplasmático con tinción débil (+1) y (D) intensidades de tinción altas (+2/+3) (ampliación, x40). Figura 10. Un ejemplo de tinción positiva heterogénea en un tumor ALK-positivo. Los cuadros en la tabla de la izquierda corresponden a las imágenes de la derecha. El componente de carcinoma de células en anillo de sello es un problema potencial para la tinción negativa. 37 CAPÍTULO 4: La inmunohistoquímica A B C D Figura 11. Reacciones positivas inusuales en la IHC de un adenocarcinoma KIF5B-ALK-positivo, mostrando un patrón con una fuerte tinción del área del aparato de Golgi (A: tinción H&E, B: tinción ALK) y un patrón de halo perinuclear (C: tinción H&E, D: tinción de ALK). Las barras=100 μm. Fuente: Takeuchi K, et al. KIF5B-ALK, una oncocinasa nueva de fusión identificada por un sistema de diagnóstico basado en la IHC para el cáncer de pulmón ALK-positivo. Clin Cancer Res. 2009; 15:3143-3149. Conclusión Los ensayos de IHC de ALK están siendo validados y estandarizados actualmente y parecen ser una herramienta clínica prometedora para un cribado rentable para detectar la presencia del reordenamiento del gen ALK en el CPCNP. Este procedimiento ya está siendo recomendado por las organizaciones en Europa, Japón y Asia. En los Estados Unidos, donde el tratamiento de CPCNP con un inhibidor de ALK actualmente depende de los resultados positivos en FISH de ALK, los resultados positivos en la IHC de ALK aún requieren verificación por FISH de ALK para poder beneficiarse de la terapia con el inhibidor de ALK. Sin embargo, en un futuro próximo, el test de IHC podría ser aprobado por la FDA de los EE.UU., y los pacientes con resultados positivos en la IHC de ALK también podrían ser candidatos para el tratamiento con un inhibidor de ALK. En Europa, el cáncer de pulmón ALK-positivo no se limita a las pruebas por FISH de ALK. CAPÍTULO 5 Retrotranscriptasa-reacción en Cadena de la Polimerasa (RT-PCR por sus siglas en inglés) y varios ensayos genéticos Por Yasushi Yatabe, Kengo Takeuchi y Ignacio Wistuba La PCR es clínicamente factible, ya que esta técnica se utiliza en la mayoría de ensayos para detectar mutaciones de EGFR en CPCNP. Sin embargo, los ensayos con retrotranscriptasa [(RT)-PCR] se utilizan principalmente para neoplasias malignas hematológicas, ya que requiere RNA de alta calidad, el cual es difícil de obtener en la práctica clínica. De hecho, en la guía CAP/IASLC/AMP, no se recomienda la RT-PCR en las pruebas de selección de los pacientes para la terapia con inhibidor de ALK en el cáncer de pulmón debido al riesgo de resultados falsos negativos y una alta tasa de error para los ensayos basados en RNA en muestras FFPE. Sin embargo, la RT-PCR proporciona información más sólida y detallada acerca de los patrones de fusión de ALK. Además, algunas de las técnicas recientemente desarrolladas se pueden aplicar a muestras clínicas con una elevada tasa de éxito. RT-PCR El EML4-ALK muestra muchas variantes de fusión. El punto de rotura del ALK se encuentra siempre antes del extremo 5' del exón 20 (ENST00000389048) donde comienza el dominio de la cinasa, y esta alteración se observa en otros tipos de cáncer con la translocación de ALK, tales como linfoma y sarcoma. En cambio, el punto de rotura de EML4 puede abarcar varios exones. Tras el descubrimiento de las dos primeras variantes de fusión (Soda 2007), se han encontrado más de 13 variantes y tres parejas de fusión (Figura 1). En las seis variantes EML4-ALK más comunes, los exones del EML4 y ALK se fusionan directamente en marco de lectura sin necesidad de inserción o deleción. Las tres variantes principales (v1: E13; A20, v2: E20; A20, y v3: E6; A20) representan más del 90% del cáncer de pulmón asociados con EML4-ALK. Entre las variantes menores, E2; A20 (v5’) y E18; A20 (v5’) se encuentran entre 1% y 2% del cáncer de pulmón con EML4-ALK (Takeuchi 2008, Wong 2009). El E21; A20 ha sido identificado en el cáncer colorrectal (Lin 2009), pero todavía no en el cáncer de pulmón. La RT-PCR en muestras tumorales frescas o congeladas instantáneamente puede ser más sensible que otros métodos en relación al número de células tumorales requeridas. Sin embargo, la alta sensibilidad se consigue sólo cuando el patrón de fusión está dentro de un rango detectable por los pares de cebadores. Para detectar todas las variantes posibles de reordenamiento EML4-ALK, se deben diseñar de manera correcta los conjuntos de cebadores (Tabla 1), pero incluso un diseño meticuloso de los cebadores puede no detectar algunas variantes con deleciones en el sitio de anilamiento. Además, los sistemas de RT- PCR diseñados para detectar EML4 -ALK no pueden detectar fusiones de ALK con otros conjuntos asociados, como por ejemplo los miembros de la familia cinesia 5B (KIF5B) y cadena ligera cinesia 1 (KLC1) (Takeuchi 2009, Togashi 2012). Para superar esta limitación, se han diseñado cebadores para otras parejas de fusión, lo que permite que se detecte simultáneamente EML4-ALK, KIF5B-ALK (Figura 2), y fusiones con el proto-oncogén ret (RET) en un mismo tubo de RT–PCR (Takeuchi 2012). A pesar de estos esfuerzos, las fusiones con parejas desconocidas han 39 CAPÍTULO 5: Retrotranscriptasa-reacción en cadena de la polimerasa y varios ensayos genéticos ALK e20 e14 EML4-ALK (E14;del49A20), v4 EML4-ALK (E18;A20), v5' KIF5B-ALK (K24;A20) KIF5B-ALK (K15;A20) del49e20 e2 EML4-ALK (E2;A20), v5 EML4-ALK (E15del19;del20A20), v4' e20 e6 EML4-ALK (E6;A20), v3 EML4-ALK (E14;del14A20), v7 e20 e20 EML4-ALK (E20;A20), v2 EML4-ALK (E13;ins69A20), v6 e20 e13 EML4-ALK (E13;A20), v1 e20 e13 ins69e20 e14 e15del19 del14e20 e18 del20e20 e20 e24 e15 e17 e20 e20 KIF5B-ALK (K17;A20) KLC1-ALK (K9;A20) e20 e9 e20 Figura 1. ALK de tipo nativo y varios tipos de fusiones ALK en el cáncer de pulmón: cinco variantes regulares (v1, v2, v3, v5, y v5') y cuatro variantes irregulares (v4, v6, v7, y v4') de EML4-ALK, tres variantes de KIF5B-ALK, y KLC1-ALK. Las regiones más oscuras en los genes asociados de fusión (EML4, KIF5B y KLC1) representan dominios “coiled-coil”, y los de ALK representan el dominio transmembrana (naranja) y el dominio cinasa (rojo). permanecido indetectables. Por lo tanto, la RT-PCR no se recomienda para el cribado de pacientes para el tratamiento con un inhibidor de ALK. Desde otra perspectiva, la eficacia terapéutica con inhibidores de ALK puede variar de acuerdo a las parejas de fusión y/o variantes de fusión, como se ha sugerido en algunos estudios que muestran que el punto de mutación L858R y la deleción del exón 19 de EGFR afecta a la actividad de transformación in vitro y la eficacia clínica del tratamiento con EGFR TKIs. La RT-PCR puede ser beneficiosa si tales diferencias resultan ser clínicamente relevantes en el cáncer de pulmón ALK–positivo. La técnica de RT-PCR permite y es más adecuada para el estudio de muestras que no son aptas para bloques de tejido, como líquido de lavado bronquial, esputo, sangre, efusión en cavidad corporal y otros fluidos corporales (Soda 2012). Para los pacientes con un diagnóstico confirmado de reordenamiento en ALK, la RT-PCR que utiliza RNA aislado o células tumorales circulantes en muestras de líquido es una herramienta poderosa y mínimamente invasiva para controlar la progresión de la enfermedad. Sin embargo, la presencia de células tumorales (o RNA procedente del tumor) en muestras de fluido es a menudo difícil de confirmar, lo que aumenta el riesgo de que los especímenes sin células tumorales se diagnostiquen erróneamente como negativos para el reordenamiento de ALK. En principio, si se utilizan las muestras de fluidos para el cribado primario, sólo las muestras confirmadas como positivas para células malignas deben ser examinadas, pero entonces la alta sensibilidad de la RT-PCR ya no es ventajosa. 40 Atlas de la IASLC de Pruebas de ALK en Cáncer de Pulmón Tabla 1. Configuración de la RT-PCR para el cribaje de EML4-ALK Estudio Utilización de las Variantes Regulares de EML4-ALK Variantes Principales* Tipo de Muestras No. of Cebadores Variantes Menores* E13;A20 E20;A20 E6;A20 E2;A20 E18;A20 E21;A20 Soda et al., 2007 Si Si No No Si Si Congelada 2 Inamura et al., 2008 Si Si No No Si Si Congelada 2 Shinmura et al., 2008 Si Si No No Si Si Congelada 3 Takeuchi et al., 2008 Si Si Si Si Si Si Congelada 3 Martelli et al., 2009 Si Si Si No Si Si Congelada 3 Takeuchi et al., 2009 Si Si Si Si Si Si Congelada (incluyendo 2 cebadores para KIF5B-ALK) Wong et al., 2009 Si Si Si No Si Si Congelada 4 Takahashi et al., 2010 Si Si Si Si Si Si Congelada 3 Sun Y et al., 2010 Si Si Si Si Si Si Congelada 4 Sanders et al., 2011 Si Si Si Si Si Si FFPE 23 Si Si Si Si Si Si Congelada Shaozhang et al., 2012 Si Si Si Si Si Si Congelada 4 Soda et al., 2012 Si Si Si Si Si Si Congelada (incluyendo 4 cebadores para KIF5B-ALK) Takeuchi et al., 2012 5 6 (incluyendo 3 cebadores para fusiones KIF5B-ALK y RET ) 9 *Las variantes principales se encuentran en más del 90% de cáncer de pulmón con EML4-ALK; las variantes menores se encuentran entre 1% y 2% de cáncer de pulmón con EML4-ALK. Comparativa RT-PCR cuantitativa La IHC se puede usar para detectar reordenamientos en ALK porque el gen ALK no se expresa en los tejidos pulmonares normales y, como tal, una reacción positiva de ALK en la IHC siempre sugiere una expresión aberrante del gen ALK que frecuentemente es por reordenamiento en el cáncer de pulmón. Este principio se puede aplicar a la expresión del transcrito de ALK. El punto de rotura en ALK se produce antes del dominio oncogénico de cinasa (exón 20) que el transcrito quimérico mantiene consistentemente. Por lo tanto, cuando el gen ALK se fusiona con el EML4 u otros interactores, las regiones 3’ y 5’ del transcrito de ALK se expresan de manera diferente (Figura 3). Basándose en este principio, el array de exones se ha utilizado para detectar el gen de fusión identificando nuevas variantes de EML4-ALK además de los patrones de fusión común (Lin 2009). También se ha utilizado PCR en tiempo real (Wang R 2012a, Wang R 2012b). El ensayo NanoString (NanoString Technologies) fue introducido recientemente para detectar genes de fusión ALK (Lira 2013), así como ROS1 y RET (Suehara 2012). 41 CAPÍTULO 5: Retrotranscriptasa-reacción en cadena de la polimerasa y varios ensayos genéticos EML4 72F; 5'-GTCAGCTCTTGAGTCACGAGTT-3' (exón 2 EML4, forward) !"#$(2-H,(3 %DBC&DCBCBBD&DBC&CD&DBB%+ ()!"#$(;EF>(-0(KFGLMG:/( Fusion-RT-S; 5'-GTGCAGTGTTTAGCATTCTTGGGG-3' (exón 13 EML4, forward) HI?=F>%AB%J,(3%DBDC&DBDBBB&DC&BBCBBDDDD%+ ()!"#$(;EF>(*+0(KFGLMG:/0(( &#'(+.26AA0(3 %&BCC&DBBCDBCCBDBBC&D&DC%+ ()&#'(;EF>(-.0(G;1;G?;/( ALK 3078RR, 5'-ATCCAGTTCGTCCTGTTCAGAGC-3' (exón 20 EML4, reverse) EML4 72F/ !"#$(2-HN( &#'(+.26AA( ALK 3078RR Fusion RT-S/ HI?=F>(AB%JN( &#'(+.26AA( ALK 3078RR !"#$%&#'()!*+,&-./0(1* EML4-ALK (E13;A20), v1 (1,735bp) ()*02+345/ (($+-45(432bp EML4-ALK (E20;A20), v2 !"#$%&#'()!-.,&-./0(1- (2,488bp) ()-0$6645/ 1,185bp (*0*6345( EML4-ALK (E6;A20), v3 !"#$%&#'()!7,&-./0(1+ 913bp*, 946bp* (8*+4590(8$7459( EML4-ALK (E14;del49A20), v4 !"#$%&#'()!*$,:;<$8&-./0(1$ (1,849bp) ()*06$845/ EML4-ALK (E2;A20), v5 !"#$%&#'()!-,&-./0(13 ($3$45(454bp EML4-ALK (E13;ins69A20), v6 !"#$%&#'()!*+,=>?78&-./0(17 (1,804bp) ()*06.$45/ !"#$%&#'()!*$,:;<*$&-./0(12 EML4-ALK (E14;del14A20), v7 (3$745(546bp (3.*45(501bp ()*062+45/ (1,873bp) (32.45(570bp !"#$%&#'()!*3:;<*8,:;<-.&-./0(1$@( EML4-ALK (E15del19;del20A20), ()+02+-45/ v4' (3,732bp) (32845(579bp !"#$%&#'()!*6,&-./0(13@ EML4-ALK (E18;A20), v5' ()-0+.-45/ (2,302bp) (88845(999bp KIF5B867F 5'-ATTAGGTGGCAACTGTAGAACC-3' (exon 10) 'OH3P672H(3@%&BB&DDBDDC&&CBDB&D&&CC%+@(();EF>(*./( KIF5B2533F'OH3P-3++H((3@%DBDC&C&&&C&DBBDDB&CDBD%+@()!EF>(-+%-$(4FI>:MGQ/( 5'-GTGCACAAACAGTTGGTACGTG-3' (exon 23-24 boundary) KIF5B867F/ 'OH3P672HN( ALK 3078RR &#'(+.26AA( KIF5B2533F/ 'OH3P-3++HN( ALK 3078RR &#'(+.26AA( 'OH3P%&#'()'-$,&-./ KIF5B-ALK (K24;A20) (3$745546bp ()+07.+45/(( (3,603bp) 'OH3P%&#'()'*3,&-./ KIF5B-ALK (K15;A20) ( (*0*2745(( 1,176bp 'OH3P%&#'()'*2,&-./ KIF5B-ALK (K17;A20) ( (*0$6+45( 1,483bp se señala con un asterisco (*) los productos de la variante 3A y B respectivamente Figura 2. Sitios de los cebadores y las longitudes de productos previstos de la RT-PCR múltiple. Debido a que el dominio de la cinasa del gen ALK se fusiona con varios exones del EML4 y otros genes asociados, tales como KIF5B, se necesitan varias series de cebadores para la detección eficaz de fusión de ALK. El mayor beneficio de estos arrays basados en RNAm comparando 3' y 5' es que pueden detectar simultáneamente y de forma independiente varias parejas de fusión de ALK. Aunque FISH break-apart ofrece un beneficio similar, la medición comparativa de las regiones 3' y 5' del transcrito permite un análisis de alto rendimiento, lo que significa que todas las alteraciones de tipo fusión, incluyendo a ALK, ROS1 y RET, se pueden detectar usando los métodos en una sola muestra de RNA. Por otra parte, los recientes avances en las técnicas de extracción de RNA de muestras FFPE permite la aplicación de este método a + cells ALK ALK+ cells células ALK + Normal cells células normales Normal cells ALK DNA DNA ALK DNA ALK mRNA mRNA RNAm Kinase dominio domain cinasa EML4dominio Coiled EML4 coil domain “coiled-coil” domain Comparación de las regiones !"#$%&'(")*+,-.,,)*/0*%)1*20* Comparison between 5' and 3' 5’ y 3’ofdeALK ALKtranscript transcrito regions &,3'")(*"4*567*-&%)(8&'$-* RNAm mRNA mRNA ALK ALK ALK Kinase dominio domain cinasa 5' región 5’ region region5' 10 8>9* 6 =* 4 <* 2 ;* 0 :* 9* región 5' 5' region 5' region 3'región region3' 3' region ALKdominio Kinase ALK domain cinasa 3' 3’ region region3' región 10 8 6 4 2 0 >9* =* <* ;* :* 9* región 5' 5' region 5' region región 3' 3' region 3' region Figura 3. En las células pulmonares normales, el ALK se expresa en un nivel muy bajo o indetectable de RNAm, mientras que las células tumorales de ALK-positivo producen abundante ALK quimérico transcrito. Cuando se analizan por separado las regiones 3' y 5' de ALK, un alto nivel de transcrito de la región 5' de ALK se detecta exclusivamente en células ALK-positivo. Este método no se vé afectado por las células normales mezcladas y es independiente de las parejas de fusión. ALK DNA DNA ALK DNA ALK Kinase dominio domain cinasa EML4dominio Coiled EML4 coil domain “coiled-coil” ALKdominio Kinase ALK domain cinasa 42 mRNA mRNA RNAm domain Atlas de la IASLC de Pruebas de ALK en Cáncer de Pulmón RNAm mRNA mRNA la práctica clínica, ya que la RT-PCR cuantitativa generalmente requiere productos de corta longitud (aproximadamente 150 pb), que se obtienen por lo general, incluso en muestras FFPE (Figura 4). ALK ALK ALK Comparación de las regiones !"#$%&'(")*+,-.,,)*/0*%)1*20* Comparison between 5' and 3' 5’ y 3’ de ALK transcrito regions of ALK transcript &,3'")(*"4*567*-&%)(8&'$-* Kinase dominio domain cinasa 5' región 5’ region region5' 9* 800 región 5' 5' region fluorescencia 10 8>9* 6 =* 4 <* 2 ;* 0 :* 600 400 3'región region3' 200 34.83 B productos 3' >9* =* <* ;* :* 3'0 region -200 exón 20 ALK 10 8 6 4 2 0 9* 50.0 5' region A comparativa de productos 5’-3’ 3' 3’ region region3' región región 5' 5' region productos 5' 5' region 20 10 30 40 50 región 3' 3' region 3' region 60 ciclos exón 13 EML4 C D Figura 4. Un ejemplo de adenocarcinoma de pulmón ALK-positivo (A), usando PCR en tiempo real cualitativo en un RNA en una muestra FFPE. Se extrajo RNA de la FFPE y se analizó el nivel de expresión de las regiones 3' y 5' de ALK (B). En este tumor, la diferencia entre las dos regiones era sustancial, lo que sugiere un reordenamiento de ALK. La fusión fue confirmada con secuenciación directa con la RT-PCR (C) y FISH Break-Apart (D). Ensayos de múltiples genes Existe una creciente necesidad en el cáncer de pulmón de desarrollar ensayos clínicamente aplicables que puedan simultáneamente determinar la mutación, reordenamiento, y el estado de expresión de muchos genes, incluyendo el ALK. Estas metodologías múltiples son importantes para maximizar el uso de pequeñas muestras de tejido tumoral de pulmón y muestras de citología. Aunque varios ensayos múltiples genómicos se pueden utilizar para determinar las fusiones de ALK en los niveles de DNA y RNA, la literatura publicada es limitada (Li T 2013). El rápido desarrollo de las tecnologías para la secuenciación a gran escala (secuenciación de nueva generación [NGS]) ha facilitado el análisis molecular de alto rendimiento que ofrece varias ventajas con respecto a la secuenciación tradicional, incluyendo la capacidad de secuenciar plenamente un gran número de genes en una sola prueba y, simultáneamente, detectar deleciones, inserciones, alteraciones del número de copias, reordenamientos y sustituciones de bases en todo el exoma (incluyendo mutaciones conocidas hotspot) en los genes conocidos relacionados con el cáncer (Ross 2011). Actualmente, las plataformas NGS, que incluyen todo el genoma, todo el exoma, y la secuenciación de genes dirigida, representan metodologías de diagnóstico emergentes para la detección de fusiones y mutaciones de oncogenes 43 CAPÍTULO 5: Retrotranscriptasa-reacción en cadena de la polimerasa y varios ensayos genéticos en muestras de tejido tumoral, incluyendo muestras FFPE (Lipson 2012, Takeuchi 2012). En un estudio con NGS de DNA genómico, donde estaban involucrados puntos de rotura en al menos cinco loci diferentes del genoma, detectaron un complejo reordenamiento de ALK en una muestra que fue ALK-negativo utilizando FISH break-apart (Peled 2012). La experiencia se limita a la determinación de mutaciones de ALK y la variación del número de copias del gen en muestras clínicas de tejidos tumorales. Con el uso de DNA extraído de muestras de FFPE de tejidos tumorales de pulmón, un ensayo de NGS múltiple detectó mutaciones del gen ALK asociadas con la resistencia al tratamiento con crizotinib en tres de 13 pacientes con cáncer de pulmón (Huang 2013). Conclusión La RT-PCR para detectar EML4-ALK debe ser diseñada de la forma más completa posible, con los objetivos restringidos a las tres variantes principales que representan más del 90% del cáncer de pulmón con EML4-ALK. La RT-PCR puede ser una herramienta útil para confirmar los resultados de IHC y análisis FISH, pero es menos apropiada para el cribado primario de reordenamiento de ALK, especialmente cuando la cantidad de muestra de tejido es adecuada. Los ensayos de genómica múltiples nuevos, en especial NGS, representan metodologías prometedoras clínicamente aplicables para la detección de fusiones de ALK, así como otras anomalías de genes, incluyendo mutaciones, ganancias de número de copia y la expresión génica. Sin embargo, los datos publicados sobre estos ensayos son limitados. CAPÍTULO 6 Comparación de diferentes plataformas de ensayo para pruebas ALK Por Sylvie Lantuéjoul, Marileila Varella-Garcia, Erik Thunnissen y Yasushi Yatabe Como se señaló anteriormente, FISH ha sido universalmente aceptado como un estándar de referencia en la evaluación de reordenamiento de ALK, y ha sido clínicamente validado y aprobado para las pruebas de selección de los pacientes para el tratamiento con un inhibidor de ALK (crizotinib). FISH puede detectar reordenamiento en ALK independientemente de la pareja de genes y la variante y se puede realizar en muestras de FFPE archivadas. Sin embargo, FISH requiere un mínimo de 50 células tumorales, y este requisito puede ser la razón por la cual FISH no se puede utilizar en el 20% de las biopsias de cáncer de pulmón (Camidge 2010, McLeer-Florin 2012). La prueba FISH tiene muchas otras limitaciones: requiere mucho tiempo, tiene un alto coste, requiere de un microscopio de fluorescencia y exige una formación especializada para la interpretación de los resultados. Debido a sus limitaciones, FISH no está disponible en todos los laboratorios de rutina de patología, y por tanto, otras plataformas de ensayo han sido evaluadas por su utilidad en la detección de ALK en CPCNP. Los estudios se han centrado en la comparación de la prueba FISH con IHC con el uso de diversos anticuerpos, la RT-PCR cuantitativa y múltiple y CISH. La IHC puede, en teoría, detectar todas las proteínas de fusión de ALK, pero algunas variantes y parejas de fusión pueden generar bajos niveles de proteína que pueden ser difíciles de detectar. Por lo tanto, muchos ensayos de IHC incluyen ahora un proceso de amplificación para mejorar la señal de la proteína. La IHC sigue siendo la plataforma más popular y rentable, ya que: • Se utiliza en los laboratorios de patología en todo el mundo • Se puede usar en muestras FFPE preparadas rutinariamente • Es relativamente barato • Requiere un equipo limitado • Ofrece una rápida formación y optimización • Por lo general, requiere un pequeño número de células tumorales para detectar la presencia de la proteína de fusión Aunque la correlación de los resultados de la IHC para ALK y FISH para ALK es excelente, la IHC no se ha validado en grandes cohortes de pacientes como marcador predictivo de respuesta a la terapia con inhibidores de ALK. La IHC tampoco muestra directamente el reordenamiento de ALK, y se ha descrito en la literatura algunos resultados falsos negativos y falsos positivos (en comparación con los resultados de FISH). En algunas muestras que habían resultado positivas para ALK con IHC y negativas con FISH, se observó una buena respuesta al crizotinib (Peled 2012). Actualmente está en curso la estandarización del ensayo de IHC para las pruebas de ALK. Sin embargo, muchas directrices, como las desarrolladas en Europa y Japón, ya recomiendan la IHC para ALK en las pruebas de cribado y posterior comprobación de los resultados positivos con FISH 45 CAPÍTULO 6: Comparación de diferentes plataformas de ensayo para pruebas ALK para optar a la terapia con crizotinib. Además, las directrices estadounidenses señalan que si la IHC para ALK se valida cuidadosamente puede tenerse en cuenta para la detección de pacientes con adenocarcinoma de pulmón (Lindeman 2013). La RT-PCR es una técnica altamente específica y fiable, ya que permite la identificación precisa de las parejas 5’ y variantes de punto de rotura. Pero las variantes ALK atípicas o parejas de fusión (por ejemplo, una variante irregular con inserción o deleción) pueden pasar inadvertidas. La RT-PCR de EML4-ALK es muy sensible ya que los cebadores no amplificarán un producto en las células normales, pero el RNAm intacto se conserva mal en una muestra guardada de FFPE. Aún se está valorando el coste de la RT-PCR y dependerá del laboratorio y la prueba utilizada. CISH es un nuevo método para la detección de reordenamiento de ALK, con el fin de superar algunas de las desventajas de FISH (Kim 2011). CISH es un ensayo de ISH totalmente automatizado que proporciona una tinción estable y permite la detección del reordenamiento del gen ALK usando microscopía óptica de campo claro convencional. IHC versus FISH Varios estudios han comparado la IHC con FISH. Se han utilizado una variedad de anticuerpos para la IHC, incluyendo dos clones de anticuerpos monoclonales de ratón, ALK1 (Dako) y 5A4 (Novocastra); un clon de anticuerpo monoclonal de conejo D5F3 (Cell Signaling Technology), y un anticuerpo policlonal de conejo (Invitrogen, Life Technologies). En la mayoría de los estudios, la prueba FISH se ha realizado con un kit de sonda de reordenamiento ALK-break-apart (Abbott Molecular), la cual está aprobada por la FDA de EE.UU. como prueba complementaria de diagnóstico para las pruebas de ALK para determinar la selección de los pacientes para el tratamiento con crizotinib. La IHC de ALK1 versus FISH Inicialmente utilizado para el diagnóstico de linfoma de célula grande anaplásico, el anticuerpo ALK1 también se ha evaluado para la detección de reordenamiento de ALK en CPCNP. Se comparó ALK1 con IHC y FISH en tres grandes series de adenocarcinoma de pulmón o CPCNP (Tabla 1) (Rodig 2009, Mino-Kenudson 2010, Yi 2011). En comparación con FISH, ALK1 con IHC parece menos sensible para detectar el reordenamiento de ALK en cáncer de pulmón que para detectarlo en el linfoma de célula grande anaplásico, posiblemente debido a que la proteína de fusión ALK se expresa en niveles bajos en CPCNP. ALK1 ofrece una buena especificidad, pero la sensibilidad oscila entre 67 % y 100 %. Algunas muestras han dado positivo para ALK en FISH pero negativo para ALK en IHC, pero no hay Tabla 1. Características de tinción de la IHC con el anticuerpo ALK1 Estudio No. de Dilución Recuperación Muestras ALK1 Antigénica Sistema de Detección y Amplificación Gradación Umbral IHC Positivo Sensibilidad Especificidad IHC IHC (vs. FISH) (vs. FISH) Rodig et al., 2009 358 1:2 EDTA (pH 8,0) en olla de presión Amplificación de la tiramida y EnVision 0 vs. + >10% células tumorales positivas 80% con amplificación (40% sin) 100% MinoKenudson et al., 2010 153 1:2 EDTA (pH 8,0) en olla de presión EnVision 0, 1+, 2+, ó 3+ y % de células tumorales teñidas >10% células tumorales positivas 67% 97% Yi et al., 2011 101 1:100 EDTA (pH 8,0) en PT Link ADVANCE 0, 1+, 2+, ó 3+ >0 90% 97,8% PT Link, EnVision y ADVANCE son productos de Dako. 46 Atlas de la IASLC de Pruebas de ALK en Cáncer de Pulmón muestras que hayan dado positivo en la IHC y negativo en FISH (Rodig 2009, Mino-Kenudson 2010). En un estudio, resultados de 1+ y 3+ de IHC determinaron ALK negativo y ALK positivo, respectivamente, considerando 2+ como un resultado equívoco (Yi 2011). Esta clasificación es similar a la de las pruebas de HER2 en cáncer de mama. El uso de la amplificación de la tiramida se recomienda para aumentar la sensibilidad de detección, pero se ha descrito una tinción no específica tanto en células tumorales como en células no tumorales con una alta concentración del anticuerpo ALK1 (Mino-Kenudson 2010). La IHC con D5F3 versus FISH Se ha comparado la IHC con el clon D5F3 y FISH en tres estudios (Tabla 2) (Mino-Kenudson 2010, Martínez 2013, Minca 2013). La sensibilidad fue del 83% al 100%, y la especificidad del 99% y del 100%. De entre seis muestras que fueron ALK positivo por FISH en un estudio, una muestra fue ALK negativo por IHC, pero ninguna de las muestras que fueron ALK negativo por FISH, fueron ALK positivos por IHC (Martínez 2013). Además de estos estudios, un panel internacional de patólogos evaluó la IHC con D5F3 en una serie de adenocarcinomas de pulmón con genotipo ALK conocido. En general, la sensibilidad fue del 90% y la especificidad del 95% para IHC comparado con FISH, y la concordancia entre observadores en la puntuación fue alta (Hirsch 2013). Tabla 2. Las características de tinción de la IHC con el anticuerpo D5F3 Estudio No. de Dilución Recuperación Muestras D5F3 Antigénica Sistema de Detección y Amplificación Gradación Umbral IHC Positivo Sensibilidad Especificidad IHC IHC (vs. FISH) (vs. FISH) MinoKenudson et al., 2010 153 1:100 EDTA (pH 8,0) en olla de presión EnVision+ 0, 1+, 2+, ó 3+ y % de células tumorales >10% células tumorales positivas 100% 99% Martinez et al., 2013 79 1:50 Estándar en BenchMark XT ultraView 0 vs. + ≥10% células tumorales positivas 83% 100% Minca et al., 2013a 231 1:100 Calor con BenchMark XT OptiView 0 vs. + Positivo 94%** 100% Hirsch et al., 2013b* 98 Prediluído Estándar en BenchMark XT OptiView y OptiView Amplification 0 vs. + Cualquier tinción citoplásmica fuerte 90% 95% a Dos resultados falsos negativos en las pruebas de IHC de muestras FFPE fueron posteriormente corregidas con un procesador ThinPrep (resultados positivos). b Los casos seleccionados para el estudio incluyeron 43 muestras que fueron ALK positivo por FISH y 55 que fueron ALK negativo por FISH. BenchMark XT, ultraView (Universal DAB Detection Kit), OptiView (DAB IHC Detection Kit),y OptiView Amplification Kit son productos de Ventana Medical Systems, Inc. EnVision+ es un producto de Dako. La IHC con el clon 5A4 versus FISH Al menos seis estudios han comparado la IHC con el clon 5A4 y FISH en una amplia serie (Tabla 3) (Jokoji 2010, Kim 2011, Paik 2011, Lopes 2012, McLeer-Florin 2012, Sholl 2013). En todos los estudios, la sensibilidad y la especificidad varió de 93% a 100% y 96% a 100%, respectivamente. Sin embargo, en un estudio, se describieron resultados falsos positivos o falsos negativos. En un caso, las células malignas se perdieron en FISH, y el resultado fue ALK positivo por IHC, y en otro caso, las señales de división asimétrica con señales de sonda verdes débiles fueron mal interpretados como ALK positivo en FISH (Sholl 2013). En general, en ese estudio, la especificidad de FISH en comparación con IHC fue de 98,5%. 47 CAPÍTULO 6: Comparación de diferentes plataformas de ensayo para pruebas ALK Tabla 3. Características de la tinción de IHC con el anticuerpo 5A4 Estudio Sistema de No. de Dilucióna Recuperación Detección y Muestras 5A4 Antigénica Amplificación 1:100 Target Retrieval EnVision Solution, FLEX+ y iAEP pH alto Umbral IHC Positivo Gradación 0 vs. + Ninguna gradación Sensibilidad Especificidad IHC IHC (vs. FISH) (vs. FISH) 100% 100% Jokoji et al., 2010 254 Paik et al. 2011 640 1:30 Solución CC1 i-VIEW 0, 1+, 2+, ó 3+ 0, ó 1+: negativo 2+: equívoco 3+: positivo 100% 96% Kim et al., 2011 465 1:30 Solución CC1 i-VIEW 0, 1+, 2+, ó 3+ 0, ó 1+: negativo 2+: equívoco 3+: positivo 100% cuando 2+ se considera positivo 98% McLeerFlorin et al., 2012 441 1:50 Solución CC1 ultraView 0, 1+, 2+, ó 3+ y % de células tumorales positivas >10% de células tumorales positivas 95% 100% Lopes et al., 2012 62 1:200 Microondas Novolink Ninguna >10% de células tumorales positivas 100% 100% Sholl et al., 2013 186 1:50 Tampón de citrato, (pH 6) en olla de presión EnVision FLEX+ 0, 1+, ó 2+ 1+, 2+ 93% 100% (FISH sólo en muestras IHC+) a Los anticuerpos 5A4 usados en los estudios de McLeer-Florin et al., Jokoji et al., y Lopes et al. eran de Abcam ; el anticuerpo usado en los otros estudios era de Novocastra. iView (DAB Detection Kit) y OptiView (DAB IHC Detection Kit) son productos de Ventana Medical Systems. Novolink (Polymer Detection System) es un producto de Leica Biosystems. Anticuerpos policlonales de conejo para IHC versus la RT-PCR Al menos dos estudios han incluido el uso de IHC con anticuerpos policlonales de conejo (Tabla 4) (Wong 2009, Chen 2012). En un estudio, los resultados se compararon con los obtenidos por RT-PCR de EML4-ALK y la concordancia fue alta (Chen 2012). En el otro estudio, 11 adenocarcinomas y un carcinoma adenoescamoso que eran ALK positivo en RT-PCR también fueron positivos en IHC (Wong et al 2009). Tabla 4. Características de tinción de IHC con anticuerpo ALK policlonal de conejo Estudio No. de Sistema de muestras Dilución Recuperación Detección y (% de ALK+) ALK1 Antigénica Amplificación Gradación Umbral IHC Positivo Sensibilidad Especificidad IHC IHC (vs. RT-PCR) (vs. RT-PCR) Wong et al., 2009 266 (4,9%) 1:1000 Tampón de citrato (pH 6,0) en microondas HRP complex Ninguna No especificado 100% No especificado Chen et al., 2012 64 (4,7%) 1:500 Solución CC1 ultraView 0, 1+, 2+, ó 3+ ≥2+ 100% 90% CC1 (Tris/borate/ EDTA) es un producto de Roche (Basel, Suiza). UltraView (Universal DAB Detection Kit) es un producto de Ventana Medical Systems, Inc. y el complejo HRP (peroxidasa de rábano picante) es un producto de Dako. Comparación de clones de anticuerpos Algunos autores han abordado directamente la concordancia entre los clones de anticuerpos usando las mismas muestras, y se ha demostrado que la concordancia depende de los anticuerpos (Tabla 5) (Rodig 2009, Takeuchi 2009, Mino-Kenudson 2010, Murakami 2011, Conklin 2013, Selinger 2013). 48 Atlas de la IASLC de Pruebas de ALK en Cáncer de Pulmón Tabla 5. Comparación de los clones de anticuerpos usados con IHC No. de Muestras Estudio Takeuchi et al., 2009 Clon de (% de ALK+) Anticuerpo 21 (52%) 5A4 Recuperación Antigénica Target Retrieval Solution (pH 9,0) (para todos) 239 (4%) 37 (59%) 0 vs. + (para todos) RT-PCR 361a (5%) Selinger et al., 2013 377 (3%) 594 (11%) 100% 27% iAEP 100% 100% ALK1 EnVision+ 9% 100% SP8 iAEP 20% 100% ALK1 EnVision+ EDTA en olla de presión (para ambos) ALK1 100% 18% 40% 100% 80% 100% 67% 97% 100% 99% 81% 100% EnVision FLEX+ 100% 100% EnVision FLEX+ 100% 99,7% 100% 62,5% EnVision+ 0 vs. + (para ambos) FISH Amplificación de la tiramida EDTA en olla de presión (para ambos) ALK1 Target Retrieval Solution (pH 9,0) (para todos) 5A4 Conklin et al., 2013 100% EnVision+ EnVision+ (para ambos) Un marcaje >2,7 en el análisis por imagen es positivo FISH D5F3 Murakami et al., 2011 100% 5A4 ALK1 MinoKenudson et al., 2010 iAEP ALK1 SP8 Rodig et al., 2009 Sistema de Sensibilidad Especificidad Detección y IHC IHC Amplificación Gradación Estándar (vs. estándar) (vs. estándar) 5A4 Según instrucciones del fabricante (para todos) ABC (sin amplificación) iAEP 0 vs. + (para todos) 0, 1+, 2+, ó 3+ (para todos) RT-PCR/ FISH FISH ALK1 EnVision FLEX 66% 100% ALK1 ADVANCE 66% 87,5% 5A4 ADVANCE 100% 87,5% D5F3 ADVANCE 100% 75% 100% 99% ALK1 Buffer (pH 9,0) en olla de presión EnVision FLEX+ 0, 1+, 2+, ó 3+ (para todos) FISH 5A4 Según instrucciones del fabricante ultraView y ultraView Amplification 100% 98% D5F3 Según instrucciones del fabricante OptiView y OptiView Amplification 100% 99% a Se analizaron un total de 356 muestras con el anticuerpo D5F3. SP8 es un producto de Abcam. Target Retrieval Solution, buffer, EnVision, EnVision FLEX+, y ADVANCE son productos de Dako. UltraView (Universal DAB Detection Kit), OptiView (DAB IHC Detection Kit), y ultraView y OptiView Amplification kits son productos de Ventana Medical Systems, Inc. ABC=complejo avidina biotina. 49 CAPÍTULO 6: Comparación de diferentes plataformas de ensayo para pruebas ALK Takeuchi et al. describieron resultados comparables con los anticuerpos ALK1 y 5A4 usando un método de polímero intercalado de anticuerpos mejorado (iAEP) para amplificar señales (Takeuchi 2009). Sin embargo, se han encontrado discordancias con otros estudios. Por ejemplo, Murakami et al. describieron un caso discordante entre las 12 muestras con reordenamiento de ALK cuyo resultado fue negativo con IHC con 5A4 pero positivo con IHC con D5F3 (Murakami 2012). Conklin et al. compararon cinco combinaciones de clones de anticuerpos y los sistemas de detección, y la concordancia fue mayor con 5A4 y D5F3 con el sistema ADVANCE (Dako), pero se detectó una reacción heterogénea positiva en una muestra que era ALK negativo en FISH (Conklin 2013). RT-PCR cuantitativa o múltiple en comparación con FISH (con o sin IHC) Además de encontrarse transcritos de EML4-ALK en las células tumorales de nueve CPCNP, también se encontraron en un único estudio en un pulmón normal (Martelli 2008). Dicha presencia en el tejido pulmonar normal no ha sido confirmada por otros, lo que ha llevado a cuestionarse esos datos (Mano 2010, Sasaki 2010). La RT-PCR es un método altamente sensible asociado con una alta especificidad y sin resultados falsos positivos. Sin embargo, hay un riesgo de resultados falsos negativos debido a la dificultad en la obtención de RNA de alta calidad a partir de muestras FFPE. Aunque la tasa de falsos negativos de la RT-PCR no se ha abordado en detalle, se ha descrito la detección de los transcritos de ALK de forma prospectiva (Soda 2012). En ese estudio, 108 (12 %) de las 916 muestras fueron excluidas porque el RNA era de mala calidad. Se detectaron los transcritos EML4-ALK en 36 muestras, 15 de las cuales estaban disponibles para IHC; y todas las muestras fueron ALK positivas por IHC. En general, la sensibilidad y especificidad de la RT-PCR para la detección de los transcritos de ALK, en comparación con IHC y FISH, son buenas, y van desde 94% al 100% (Tabla 6) (Takeuchi 2008, Inamura 2008, Takeuchi 2009, Soda 2013). Tabla 6. Comparación de los resultados de la RT-PCR con los resultados de otros métodos de pruebas de ALK Sensibilidad de la RT-PCR (vs. FISH y/o la IHC) Especificidad de la RT-PCR (vs. FISH y/o la IHC) Tipo de RT-PCR Anticuerpo IHC FISH Inamura et al., 2008 RT- PCR múltiple ALK1 Ninguno 100% (vs. IHC) 100% (vs. IHC) Takeuchi et al., 2008 RT- PCR múltiple – Ensayo de fusión basado en FISH 100% (vs. FISH) 100% (vs. FISH) Takeuchi et al., 2009 RT-PCR inversa y múltiple 5A4 ALK1 Ensayo de fusión EML4 y KIF5B 100% (vs. IHC) 100% (vs. IHC) RT- PCR múltiple 5A4 ALK break-apart probe kit 100% (vs. IHC) 94% (vs. FISH) 100% (vs. IHC) 100% (vs. FISH) Estudio Soda et al., 2012 En los estudios de Inamura et al. y Takeuchi et al. (2009), el anticuerpo ALK1 es un producto de Dako. El anticuerpo 5A4 en el estudio de Takeuchi et al. (2009) es un producto de Abcam y, en el estudio de Soda et al. es un producto de Nichirei Biosciences, Inc. En el estudio de Soda et al., el kit de sonda break-apart es un producto de Abbott Molecular. CISH versus otros métodos CISH tiene algunas ventajas sobre FISH, y los estudios han demostrado que los resultados de CISH son comparables con los de otros métodos de detección de reordenamiento de ALK (Tabla 7) (Kim 2011, Yoshida 2011a, Schildhaus 2013). En un estudio, los criterios de ALK-positivo para CISH eran los mismos que FISH, pero en otro estudio, los investigadores encontraron que un valor de corte diferente para CISH llevó a una mejor separación de los tumores ALK-positivo y ALK-negativo (Schildhaus 2013, Yoshida 2011a). Se ha desarrollado una nueva tecnología dual en la que el número de copias 50 Atlas de la IASLC de Pruebas de ALK en Cáncer de Pulmón de ALK y la expresión de la proteína ALK se evalúan en las mismas células (Ventana Medical Systems, Inc.) (Nitta 2013), y dicho método ha demostrado una mayor sensibilidad que la IHC convencional, proporcionando una evaluación más precisa del estado de ALK. Sin embargo, el ensayo es técnicamente difícil, por lo que se están realizando controles de validación continuos de esta tecnología. Tabla 7. Comparación de CISH con otros métodos de prueba ALK CISH Kit de Prueba Estudio FISH IHC RT-PCR No. de Muestras Criterio de (% de ALK+) Positividad Sensibilidad Especificidad Sensibilidad Especificidad Sensibilidad Especificidad Kim et al., 2011 ALK dual-color break-apart CISH 431 (4%) No se menciona 94% 100% 66,7% 100% ND ND Yoshida et al., 2011a ALK dual-color break-apart CISH 45 (31%) ≥20% células con señales divididas 100% 100% 93% 100% 93% 100% ZytoDot 2C SPEC ALK break-apart probe 100 (16%) ≥15% de células con señales divididas 100% 100% ND ND ND ND Schildhaus et al., 2013 El kit de prueba usado en los estudios de Kim et al. y Yoshida et al. es un producto de Ventana Medical Systems, Inc. El kit usado en el estudio de Schildhaus et al. es un producto de ZytoVision GmbH. ND = no disponible. Ejemplos de algoritmos diagnósticos para la prueba de ALK Basándose en las ventajas y características de cada método para la detección de ALK, varios grupos de investigadores han propuesto algoritmos de diagnóstico para la realización de las pruebas de ALK (Figuras 1-6) (Sociedad de Cáncer de Pulmón Japonesa 2011, Kim 2011, Paik 2011, Thunnissen 2012b, Conklin 2013, Marchetti 2013). muestras de cáncer de pulmón muestras de citología, congeladas RT-PCR IHC negativo negativo positivo positivo FISH negativo positivo (raro) inhibidor de ALK Figura 1. Algoritmo propuesto por la Sociedad Japonesa de Cáncer de Pulmón, con el cribaje por IHC y confirmación por FISH. La RT-PCR se utiliza para muestras de citología. Las líneas de puntos representan un posible análisis duplicado de acuerdo con las características clínicopatológicas. Modificado con autorización del Comité de biomarcadores, Sociedad Japonesa de cáncer de pulmón. “Guidance for ALK Gene Testing in Lung Cancer Patients” (Orientaciones para las Pruebas Genéticas de ALK en pacientes con cáncer de pulmón). Versión 1.0 (1 agosto, 2011). Disponible en http://www. haigan.gr.jp/ uploads/photos/641.pdf 51 CAPÍTULO 6: Comparación de diferentes plataformas de ensayo para pruebas ALK IHC negativo 0/1+ equívoco 2+ negativo 3+ presentadas como ALK negativo CISH/FISH presentadas como ALK positivo IHC negativo 0/1+ equívoco 2+ negativo 3+ presentadas como ALK negativo FISH presentadas como ALK positivo Figura 3. Algoritmo diagnóstico utilizando IHC de ALK y FISH en CPCNP. Modificado con autorización de Paik J, Choe G, Kim H, et al. “Screening of anaplastic lymphoma kinase rearrangement by immunohistochemistry in non-small cell lung cancer: correlation with fluorescence in situ hybridization” (Cribaje del linfoma anaplásico con reordenamiento de cinasa por inmunohistoquímica en el cáncer de pulmón de células no pequeñas: correlación con hibridación in situ fluorescente). J Thorac Oncol. 2011;6(3):466-472. Figura 4. Algoritmo propuesto para las pruebas de ALK en CPCNP si la IHC para ALK está completamente validada. Modificado con autorización de Thunnissen E, Bubendorf L, Dietel M, et al. “EML4-ALK testing in nonsmall cell carcinomas of the lung: a review with recommendations” (Las pruebas EML4ALK en carcinomas de células de pulmón no pequeñas: revisión y recomendaciones). Virchows Arch. 2012;461(3):245-257. CPCNP pruebas de ALK IHC positivo 1+, 2+, 3+ negativo FISH negativo sin reordenamiento de ALK Figura 2. Algoritmo para predecir el reordenamiento del gen ALK mediante IHC y CISH o FISH. Modificado con autorización de Kim H, Yoo S-B, Choe J-Y, et al. “Detection of ALK gene rearrangement in non-small cell lung cancer”. (La detección de reordenamiento del gen ALK en el cáncer de pulmón de células no pequeñas). J Thorac Oncol. 2011;6(8):1359-1366. positivo con reordenamiento de ALK 52 Atlas de la IASLC de Pruebas de ALK en Cáncer de Pulmón ALK IHC (5A4 por Novocastra o DSF3 por Cell Signaling con detección ADVANCE) negativo positivo (sin expresión ALK) (cualquier expresión ALK) FISH ALK positivo ALK negativo CPCNP (adenocarcinoma, carcinoma de células grandes, diferentes tumores con adenocarcinoma, NOS) ALK IHC 1-2 días laborables negativo positivo prueba FISH 2-3 días laborables negativo sin reordenamiento ALK positivo con reordenamiento ALK Figura 5. Algoritmo para el diagnóstico de detección para la prueba de ALK con IHC y posterior confirmación con FISH. Modificado con autorización de Conklin C, Craddock KJ, Have C, et al. “Immunohistochemistry is a reliable screening tool for identification of ALK rearrangement in non-small-cell lung carcinoma and is antibody dependent”.(La inmunohistoquímica es una herramienta de detección fiable para la identificación de reordenamiento de ALK en el carcinoma de pulmón de células no pequeñas y es dependiente de los anticuerpos) J Thorac Oncol. 2013;8(1):45-51. Figura 6. Posibles algoritmos de pruebas ALK en CPCNP propuestos por la Asociación Italiana de Oncología Médica y la Sociedad Italiana de Patología y Citopatología. Los recuadros y líneas punteadas corresponden a formas hipotéticas de selección de tumores para la prueba FISH después del cribado con IHC. Se describe también la duración del tiempo necesario para las pruebas y la interpretación de los resultados de IHC y FISH. NOS=no especificado. Modificado con autorización de Marchetti A, Ardizzoni A, Papotti M et al. “Recommendations for the analysis of ALK gene rearrangements in non-small-cell lung cancer: a consensus of the Italian Association of Medical Oncology and the Italian Society of Pathology and Cytopathology” (Recomendaciones para el análisis de los reordenamientos del gen ALK en el cáncer de pulmón de células no pequeñas: un consenso de la Asociación Italiana de Oncología Médica y la Sociedad Italiana de Patología y Citopatología) J Thorac Oncol. 2013;8(3):352-358. Conclusión La detección de ALK con IHC es ampliamente recomendada debido a su relación coste-eficacia para el cribaje masivo y posterior verificación de los resultados ALK-positivos por FISH. Sin embargo, la IHC necesita una mayor validación clínica que muestre una fuerte correlación con la respuesta a los inhibidores de tirosina cinasa de ALK. Además, FISH debe continuar siendo evaluado para determinar la importancia clínica de los resultados que se interpretan actualmente como atípicos o borderline. Se han propuesto varios algoritmos de diagnóstico para las pruebas de ALK. CAPÍTULO 7 Análisis de ALK en citología Por Lukas Bubendorf El papel de la citología en CPCNP Las pruebas FISH para la detección del reordenamiento de ALK como marcador predictivo en CPCNP se emplearon en un principio para el análisis de biopsias (Kwak 2010). El material de biopsia se prefiere a menudo para los estudios traslacionales en los ensayos clínicos ya que los bloques de parafina se procesan de forma rutinaria en los laboratorios de patología y estos bloques proporcionan múltiples secciones para distintos análisis. Sin embargo, hasta el 40% de todo el CPCPN avanzado se diagnostica sólo mediante una evaluación citológica, sin correlación con una biopsia. Por lo tanto, depender de la histología como la única fuente para las pruebas de ALK requeriría repetir la biopsia en una gran proporción de los pacientes, haciendo hincapié en la necesidad de ampliar el análisis de ALK a las muestras citológicas. El análisis FISH de muestras citológicas cuenta con una larga tradición. La tecnología FISH se utilizó para evaluar las líneas celulares o núcleos intactos aislados a partir de muestras de tumores histológicos antes de que fuera aplicable a las secciones de tejido. La prueba FISH también es el método establecido en varios campos de diagnóstico de la citología. Desde un punto de vista analítico, no hay ningún argumento en contra de la aplicación de FISH de ALK en muestras citológicas. De hecho, las muestras citológicas tienen varias ventajas; por ejemplo, comparado con las secciones histológicas, los núcleos en frotis de citología están íntegros, lo que permite la detección del número real de las señales de FISH en un núcleo. La citología es un método interesante y mínimamente invasivo para recoger el material tumoral para repetir el análisis de biomarcadores en la enfermedad recurrente o metastásica. El diagnóstico citológico de CPCNP se basa habitualmente en muestras obtenidas por EBUS-PAAF, PAAF transtorácica, secreciones o cepillados bronquiales, lavados broncoalveolares y efusiones pleurales o PAAF de otros sitios metastásicos. El procesamiento de dichas muestras para los bloques celulares en FFPE se ha convertido en el método más utilizado de muchos laboratorios ya que los bloques celulares pueden ser manejados de la misma manera que las muestras histológicas, y se pueden aplicar los mismos protocolos para el análisis de biomarcadores (Figura 1) (Alici 2013, Kalhor 2013). 50 µm 50 µm Aparte de la capacidad de A B generar más material me- Figura 1. Derrame pleural de un adenocarcinoma pulmonar. 1A: Frotis teñido con diante cortes seriados, los Papanicolaou convencional. 1B: sección teñida con H&E de un bloque celular (x 400). 54 Atlas de la IASLC de Pruebas de ALK en Cáncer de Pulmón bloques celulares también tienen la ventaja de la conservación a largo plazo de la proteína o de la calidad del DNA. Además de los productos comerciales, están también disponibles los protocolos publicados para la realización de bloques celulares, y tres de los más comúnmente utilizados son los denominados método del botón celular, el método del alginato sódico y el método de plasmatrombina (Cuadro 1) (Orell 2011, Kalhor 2013, Noda 2010, Jing 2013). Análisis de FISH de ALK en citología pulmonar Cuadro 1. Protocolos para la preparación de bloques celulares citológicos MÉTODO 3 MÉTODO 2 MÉTODO 1 Método del Botón Celular (Orell 2011, Kalhor 2013) FISH es una tecnología sólida que se a. Dejar caer suavemente una gota de material aspirado o puede aplicar a casi todos los tipos y citocentrifugado en un portaobjetos de vidrio sin difundirlo formatos de muestras citológicas. Los o extenderlo. protocolos y criterios para el análisis b. Después de unos pocos segundos para que se adhiera, sumergir cuidadosamente el portaobjetos en etanol para su de FISH de ALK son idénticos a los fijación. usados en histología. Sin embargo, c. Separar con cuidado la gota fijada (como un botón) con una un grupo significativo de bloques hoja de bisturí y procesarla de la misma manera que una pequeña muestra de la biopsia. celulares contienen muy escasas o ninguna célula cancerígena para el Método del Alginato Sódico (Noda 2010) análisis molecular (Knoepp 2013), a. Suspender el material correctamente centrifugado y fijarlo y la diferenciación de las células en formaldehído tamponado al 10% durante 2-3 horas. tumorales de las células reactivas b. Recoger el precipitado con las células fijadas por centrifugación, decantar el formaldehído sobrenadante y adyacentes es más difícil que en la lavar con agua destilada. citología convencional, especialc. Centrifugar y resuspender el precipitado con 0,5ml de mente durante el análisis de FISH. alginato sódico al 1%. d. Añadir sodio-calcio (1M) a la solución y dejar que coagule. Por lo tanto, el análisis de ALK en e. Recoger el material coagulado con forceps y procesar de la muestras citológicas es otra opción misma manera que una pequeña muestra de biopsia. válida usada por algunos laboratorios (Figura 2) (Betz 2013, Savic Método de Plasma-Trombina (protocolo usado en los 2013). Una ventaja importante de Hospitales Universitarios de Basilea y Zurich, Suiza) a. Centrifugar el material citológico durante 10 minutos a la citología convencional es la capa 2500 rpm. cidad de seleccionar la extensión b. Eliminar el sobrenadante. citológica óptima entre todas las c. Pipetear dos gotas del sedimento en un tubo cónico. d. Añadir 200 μl de plasma y agitar brevemente la muestra. extensiones previamente teñidas e. Añadir 50 μl de trombina y agitar brevemente la muestra. para el análisis de FISH, sin necesi f . Incubar la muestra durante 5 minutos. dad de usar extensiones no teñidas g. Poner el cóagulo en un casete de inclusión (entre dos adicionales. Además de la falta de almohadillas de filtro), y cerrar el casete. h. Fijar el material en formaldehído tamponado al 10%. rotura nuclear y artefactos relaciona i . Sacar el material fijado y procesarlo de la misma manera que dos, la calidad del DNA en muestras una pequeña muestra de biopsia. citológicas fijadas en alcohol o secadas al aire es mejor que la que hay después de la fijación en formaldehído, la cual conlleva al cruzamiento y la modificación química de los nucleótidos. Esto explica una tasa de éxito de hasta un 100 % para el análisis de FISH de ALK en la citología convencional y una tasa de fracaso de hasta el 19 % para las muestras histológicas (McLeer-Florin 2011, Savic 2013). La técnica FISH es aplicable a casi todos los tipos de muestras citológicas, incluyendo frotis convencionales, muestras citocentrifugadas, o preparaciones de base líquida (por ejemplo, ThinPrep, Hologic, o SurePath, BD Diagnostics), independientemente del tipo de fijación (secado al aire y 55 CAPÍTULO 7: Análisis de ALK en Citología A B C D Figura 2. Hallazgos representativos sobre ensayos de FISH de ALK en extensiones citológicas convencionales o muestras previamente teñidas con Papanicolaou (imágenes comprimidas superpuestas z que muestran la proyección de todas las señales de FISH en el núcleo intacto de las células). 2A y 2B: Dos tipos de cáncer ALK-negativo con tres señales normales (fusionadas) de ALK (2A), y con un mayor número de señales normales de ALK por núcleo de la célula tumoral (2B). 2C y 2D: Dos tipos de cáncer ALK-positivos con una o dos señales break-apart (una distancia entre las señales verde y roja de al menos dos veces el diámetro de la señal) (2C) o una sola señal roja con ninguna señal verde correspondiente además de varias señales normales por núcleo de célula tumoral (2D). fijadores a base de alcohol). Se recomienda el uso de portaobjetos recubiertos de adhesivo o con carga positiva en la citología de pulmón, ya que estos portaobjetos tratados mejoran la adherencia de las células y les impiden flotar durante la realización de la técnica FISH. La prueba FISH funciona igual de bien en muestras no teñidas, así como las procesadas con Papanicolaou, hematoxilina, o la tinción de Giemsa modificada, y generalmente no se requiere un procedimiento separado, excepto cuando se utiliza la tinción de Giemsa modificada y se recomienda usar una solución de desteñido con un alcohol ácido antes del análisis FISH (Betz 2013). Cabe destacar que FISH también funciona bien con las muestras inmunocitoquímicamente teñidas si se utiliza 3-amino-9-etilcarbazol (AEC) como cromógeno. El uso de 3,3’diaminobencidina (DAB) puede interferir con las señales de FISH debido a la autofluorescencia. Se ha publicado un protocolo para la prueba FISH en muestras citológicas teñidas (Thunnissen 2012b). Es posible que existan reticencias sobre el uso de extensiones citológicas diagnósticas para el análisis FISH ya que legalmente los laboratorios de citología archivan las extensiones de diagnóstico durante varios años y cabe la necesidad de revisar estas 56 Atlas de la IASLC de Pruebas de ALK en Cáncer de Pulmón extensiones relacionadas con casos raros incluso años después del diagnóstico. Una posible solución a este problema pasaría por capturar las imágenes representativas o escanear toda la muestra antes del análisis. También es posible teñir otra vez los cortes después del análisis FISH (Betz 2013). El umbral para un resultado positivo de FISH de ALK se estableció sobre la base del análisis de las muestras histológicas (un patrón de señal típica de reordenamiento de ALK en al menos el 15% de las células cancerosas), pero cada laboratorio debe determinar su propio umbral en muestras citológicas ALK negativo hasta que estén disponibles las recomendaciones consensuadas. (Véase la sección Hibridación in Situ Fluorescente para más información sobre los valores de corte). Se deben seleccionar las células tumorales no superpuestas para la prueba de FISH de ALK, aunque los grupos tridimensionales son susceptibles de análisis de ALK, ya que la detección de señales de reordenamiento no se ve obstaculizada por la tridimensionalidad. El uso de una fase automatizada guiada por un software apropiado para las muestras con baja proporción de células tumorales aumenta la precisión del análisis y facilita la revisión del resultado de la prueba FISH. La IHC de ALK en citología La inmunohistoquímica para detectar la sobreexpresión de la proteína ALK se ha convertido recientemente en un método muy útil para el cribado de CPCNP para el análisis FISH posterior y para la posterior evaluación de los resultados de FISH inciertos (tal y como se describe en detalle en la sección de Inmunohistoquímica ). Al igual que con las muestras histológicas, la prueba de IHC de ALK es igualmente prometedora con muestras citológicas, incluyendo bloques celulares y preparaciones citológicas convencionales o de base líquida (Moreira 2012, Martínez 2013, Savic 2013, Tanaka 2013). La precisión de la prueba de IHC de ALK en extensiones citológicas teñidas con Papanicolaou ha sido alta, con una sensibilidad y especificidad de casi el 100 % comparado con FISH de ALK (Savic 2013, Tanaka 2013). Esta precisión se logró con el anticuerpo 5A4 (Novocastra, véase la sección Diferentes Plataformas de Ensayo para las Pruebas de ALK) y un inmunoteñidor automatizado (Bond-Max; Leica Biosystems) (Figuras 3 y 4). Serán necesarios más estudios para validar este anticuerpo en otras plataformas y para probar el rendimiento de un nuevo ensayo estandarizado de IHC de ALK utilizando el anticuerpo D5F3 (Ventana Medical Systems, Inc.) en citología. A B C D Figura 3. La IHC en extensiones citológicas convencionales a partir de derrames pleurales malignos de adenocarcinoma pulmonar (x 200), mostrando ALK-negativo (3A) y tumores ALK-positivos (3B, 3C), con una línea celular H2228 con reordenamiento de ALK utilizado como control positivo (3D). Se utilizó el anticuerpo 5A4 (Novocastra) y un inmunoteñidor automatizado (Bond-Max; Leica Biosystems) y todos los resultados fueron confirmados por FISH. 57 CAPÍTULO 7: Análisis de ALK en Citología A Debido a que el uso de la IHC está ampliamente generalizado, el número de laboratorios de patología que la utilizan como un primer medio de prueba de ALK puede aumentar y limitar el análisis de FISH sólo a los hallazgos equívocos o positivos en la IHC, siempre y cuando se compruebe que los ensayos estandarizados y programas adecuados de control de calidad externos sean satisfactorios tanto para las muestras histológicas como citológicas. RT-PCR La RT-PCR puede ser utilizada para analizar muestras citológicas (Betz 2013, Mitiushkina 2013). Como se expuso en la sección Diferentes Plataformas de Ensayo para las Pruebas de ALK, la RT-PCR puede ser apropiada para la confirmación de los resultados de la prueba de IHC de ALK o de FISH, pero es menos apropiada para el cribado primario para el reordenamiento de ALK. B Conclusión Las preparaciones citológicas, incluyendo las extensiones convencionales y bloques celulares pueden constituir una solución alternativa a las muestras de biopsia para el análisis predictivo de ALK. C Figura 4. La IHC de ALK de un adenocarcinoma pulmonar ALK-positivo (x 200), con las pruebas realizadas con el anticuerpo 5A4 (Novocastra) en una extensión citológica previamente teñida con Papanicolaou (4A) y las correspondientes secciones del bloque celular teñidas con el anticuerpo 5A4 (4B) y el anticuerpo D5F3 (Ventana Medical Systems, Inc.) (4C) CAPÍTULO 8 Presentación de informes de la prueba ALK Por Elisabeth Brambilla, Erik Thunnissen, Marileila Varella-Garcia y Yasushi Yatabe De acuerdo con el sistema habitual de diagnóstico patológico molecular de los tumores, los informes de ensayo de ALK deben incluir cuatro secciones: preanalítica, analítica, resultados e interpretación/ conclusión, independientemente del método diagnóstico utilizado: FISH, IHC, o RT-PCR. Sección preanalítica Además de la identificación del paciente, esta sección del informe habitual debe incluir un resumen del tipo de muestra y del diagnóstico si el diagnóstico molecular no se ha emitido conjuntamente con el informe anatomopatológico. Se deben añadir los siguientes datos. Características de la muestra • Tamaño de la muestra y tipo: resección quirúrgica (lobectomía, neumonectomía, segmentectomía, cuña), biopsia (bronquial/biopsia transbronquial, biopsia con aguja gruesa), citología PAAF, fluido (pleural, líquido cefalorraquídeo) • Conservación del tejido: congelado instantáneamente (temperatura de almacenamiento) o FFPE • La fijación del tejido: el tiempo de fijación, la duración y el fijador utilizado (se recomienda sólo formaldehído tamponado para FFPE). Si el tejido ha sido procesado con una solución descalcificadora, ésta debe ser documentada, así como el reactivo utilizado. Diagnóstico histológico del tumor Para el adenocarcinoma, el tipo y subtipo deben seguir la clasificación del 2011 de adenocarcinoma de pulmón de la IASLC/American Thoracic Society/European Respiratory Society (Travis 2011). Los tumores que sean de más de un tipo deben ser descritos como tales: carcinoma adenoescamoso, cáncer de pulmón de células pequeñas combinado con adenocarcinoma y carcinoma neuroendocrino de células grandes (puro o combinado con adenocarcinoma). Si en el mismo tumor hay más de un patrón o tipo histológico, se deberá indicar el tipo histológico predominante en la muestra de la prueba, y si no es así, se debe documentar el tipo analizado. Evaluación del tumor • Estimación de la celularidad tumoral (porcentaje de núcleos de células tumorales en comparación con todos los núcleos presentes en el corte) de toda la muestra, para saber si la muestra contiene suficientes células tumorales para las pruebas IHC, FISH y/ o RT-PCR • Porcentaje de células tumorales en el corte/bloque inicial y, opcionalmente, después de la selección de células tumorales por macrodisección para así reflejar la celularidad del tumor de la parte de la muestra utilizada para aislar el DNA/RNA 59 CAPÍTULO 8: Presentación de informes de la prueba ALK • Presencia de necrosis, infiltrados de células inflamatorias, antracosis y artefactos tisulares • Resultados de la prueba de marcadores inmunohistoquímicos de diagnóstico adicionales, tales como factor de transcripción tiroideo 1 (TTF-1), p63/p40, y tinciones de mucina, si existieran (Thunnissen 2012a) Idoneidad general de la muestra • Documentada como “adecuada para las pruebas de” (en relación con los resultados recogidos aquí, así como para las pruebas de ALK) o como “no apta” (anotando la razón o razones) Otra información • Tratamiento farmacológico previo, si existiera (opcional) Sección analítica Esta sección debe incluir la metodología básica para cada ensayo utilizado junto con la sensibilidad del ensayo y el umbral. Debe incluir la suficiente información para que cualquier otro laboratorio pueda entender lo que se hizo, en caso de discrepancia entre los laboratorios, o si se pidiera que repitiese la prueba. • FISH de ALK: set de sondas (fabricante, tipo) y el umbral utilizado para definir resultados positivos • IHC de ALK: tipo de anticuerpo (fuente), la concentración de anticuerpos, el tiempo de incubación y la temperatura, y el sistema de intensificación de la señal secundaria • RT-PCR de ALK: método utilizado, cebadores, sondas y sus referencias, y la sensibilidad del ensayo Sección de resultados En esta sección se debe informar de los resultados de la prueba, incluyendo los hallazgos incidentales y variantes de significado incierto. Los resultados no concluyentes se deben describir claramente como tales. Los resultados se deben especificar como positivos o negativos para el reordenamiento de ALK para que los oncólogos y patólogos no especialistas puedan comprender fácilmente los resultados. Además, se deben añadir los elementos específicos de acuerdo con el método de prueba utilizado. FISH de ALK: el número de células analizadas y el número y porcentaje de células que muestran patrones positivos. En el caso de que hubiera un patrón atípico, éste debe anotarse (por ejemplo, “negativo para reordenamiento de ALK, ver Interpretación”). Si se utilizaran los Sistemas Internacionales de Nomenclatura para la Citogenética Humana (ISCN, por sus siglas en inglés), ésta debe ir acompañada de un resultado específico de fácil comprensión. IHC de ALK: El resultado debe ser descrito como positivo, negativo o indeterminado. Cuando el resultado es indeterminado, se debe proporcionar una explicación (por ejemplo, agotamiento del tejido del tumor o número insuficiente de células tumorales). Entre otros resultados opcionales están la gradación-H modificada (el porcentaje de núcleos teñidos, la intensidad y el patrón de la tinción [citoplásmica y/o de membrana]) y la homogeneidad de la tinción. Para garantizar la validez de la técnica, se requiere un control positivo externo para todas las pruebas. Este control positivo puede ser un bloque celular obtenido de una línea celular con reordenamiento en ALK o una muestra de un tumor ALK-positivo. RT-PCR de ALK: los nombres de todas las mutaciones clínicamente significativas que se han identificado. Se ha utilizado el patrón de fusión como la “variante 1,” pero se recomienda describir 60 Atlas de la IASLC de Pruebas de ALK en Cáncer de Pulmón las variantes (Soda 2012) como “EML4-ALK (E13; A20)” para la variante 1 y “EML4-ALK (E14; A20 E14; ins11del49A20)” para la variante 4. (Para más información ver http://atlasgeneticsoncology. org/Tumors/inv2p21p23NSCCLungID5667.html.) Sección de interpretación/conclusión Esta sección debe incluir lo siguiente: • Tipo de muestra y diagnóstico (primario o después del tratamiento con un inhibidor de ALK) • Interpretación clínica fácilmente comprensible, incluyendo los resultados de la prueba molecular y una apreciación general de la probabilidad de que el cáncer responda o sea resistente a la terapia con inhibidores de ALK (teniendo en cuenta también la evidencia clínica) • Explicación (lo más clara posible) para los resultados no concluyentes o resultados discrepantes con múltiples pruebas, ya sea debido a un fallo del ensayo, una muestra insuficiente, u otra razón (por ejemplo, los patrones atípicos de la prueba FISH) y sugerencias para la obtención de mejores resultados en el ensayo de próximas muestras Conclusión Los informes sobre los resultados de las pruebas de ALK deben incluir detalles suficientes para que tanto los médicos como los profesionales sanitarios de laboratorio puedan entender el origen y las características de la muestra analizada, la naturaleza de la prueba realizada, así como la precisión y la posible utilidad clínica de los resultados. CAPÍTULO 9 Líneas de actuación y estudios de estandarizació Por Yasushi Yatabe, Sylvie Lantuéjoul, Erik Thunnissen, Keith Kerr y Ming Sound Tsao Con el desarrollo de la terapia dirigida contra ALK para CPCNP, varias organizaciones de oncología y patología de todo el mundo han definido recomendaciones para las pruebas de ALK, ya sea como documentos independientes o como parte de unas directrices generales sobre las pruebas moleculares. Además, se han realizado varios estudios multicéntricos locales o internacionales para estandarizar los protocolos de la prueba de ALK en los diferentes laboratorios. Líneas de actuación Las directrices para las pruebas moleculares en muestras de cáncer de pulmón pueden incluir recomendaciones clínicas y metodológicas. En el 2011, la Sociedad Europea de Oncología Médica (ESMO), señaló que, en ese momento, no se podían recomendar las pruebas de rutina de ALK, pero reconoció que los datos emergentes podrían dar lugar a indicaciones clínicas para dicha prueba en un futuro (Felip 2011). Desde entonces, varios grupos de expertos han publicado un criterio general consensuado y recomendaciones para las pruebas moleculares en el cáncer de pulmón, incluyendo la prueba de reordenamiento del gen ALK (Tabla 1). La guía más completa es el resultado de un esfuerzo conjunto de expertos en representación de la CAP, IASLC y AMP que se basó en una revisión sistemática de los estudios publicados hasta febrero del 2012. (Véase el Apéndice 2 para un resumen de las recomendaciones de esta guía). La guía recomienda que todos los pacientes con CPCNP avanzado se hagan las pruebas de reordenamiento del gen ALK si el tumor es de subtipo adenocarcinoma o tiene un componente de adenocarcinoma. También se deben realizar las pruebas para la determinación del reordenamiento del gen ALK si la muestra es pequeña y no se puede excluir el componente de adenocarcinoma (Lindeman 2013). Al igual que para las pruebas para la mutación de EGFR, es necesario que un patólogo seleccione las muestras de tejido para determinar si son adecuadas o no. La metodología elegida actualmente es el ensayo FISH ALK break-apart (Vysis LSI Break Apart FISH Probe Kit, Abbott Molecular), que es, hoy por hoy, la única prueba aprobada por la FDA de EE.UU. para seleccionar los pacientes tributarios al tratamiento con un inhibidor de ALK. Sin embargo, la normativa establece que la prueba de IHC de ALK también se puede utilizar para el cribaje de ALK si se utiliza un ensayo de IHC validado. Estudios de estandarización En los Estados Unidos, el uso de crizotinib, tal y como lo indica en el prospecto, está supeditado a la realización de las pruebas de ALK con un ensayo aprobado por la FDA de los EE.UU. En la actualidad, la prueba de FISH de ALK break-apart (Abbott Molecular) es el único ensayo de FISH de ALK aprobado. En otras partes del mundo, las agencias reguladoras no exigen el uso de un método específico, pero sí requieren el uso de un ensayo validado. En estos países, otros métodos o ensayos 62 Atlas de la IASLC de Pruebas de ALK en Cáncer de Pulmón Tabla 1. Directrices o recomendaciones publicadas por varios grupos de expertos sobre el ensayo de ALK en el cáncer de pulmón Técnica Autor, Año Organización Analizada Algoritmo de Diagnóstico Pruebas en Muestras de Citología Inmunohistoquímica (IHC) Mitsudomi et al., 2011 JLCS FISH, IHC, Cribado con IHC y posterior y RT-PCR confirmación con FISH Adecuadas. Se recomienda hacer un bloque celular para FISH y IHC Recomendaciones para enviar muestras a los laboratorios comerciales validados donde se utilizan clones y sistemas de detección adecuados Garrido et al., 2012 SEOM y SEAP FISH No discutido No discutido Thunnissen Expertos en FISH, IHC, Cribado con IHC y posterior et al., Europa y RT-PCR confirmación con FISH 2012b Las muestras histológicas y citológicas son potencialmente adecuadas Tiene un gran potencial como herramienta de detección Yi et al., 2012 Expertos FISH y IHC Cribado con IHC y posterior confirmación con FISH No discutido Puede ser una herramienta de cribaje práctica y segura Marchetti et al., 2013 AIOM y SIAPEC-IAP FISH es válida, FISH, IHC, FISH para una selección de y RT-PCR pacientes con estadio IIIB y IV incluso en frotis de CPCNP (tejido Lindeman et al., 2013 CAP-IASLCAMP FISH FISH en el momento de diagnóstico en pacientes con adenocarcinoma de pulmón avanzado (o CPCNP con componente de adenocarcinoma). Se recomienda la prueba a los pacientes en estadio I-III CPCNP bajo criterio del equipo multidisciplinario local Adecuadas. Preferentemente en bloques celulares y no en frotis Técnica correctamente validada. Puede ser una herramienta de cribaje para seleccionar muestras para la prueba FISH de ALK. La prueba FISH no es necesaria si los resultados con la IHC optimizada son negativos Ettinger et al., 2013 NCCN FISH FISH es estándar; puede ser detectado con la IHC y confirmados los resultados positivos con FISH. La PCR está siendo evaluada. No discutido Puede ser usada como una herramienta de cribaje. Los ensayos de la IHC para linfomas no son aptos para la detección de muchos CPCNP con reordenamiento en ALK. Pruebas de FISH para pacientes con tumores EGFRnegativos congelado) Puede ser usada para el cribaje, pero no hay datos suficientes para establecer conclusiones ESMO=Sociedad Europea de Oncología Médica, SEOM=Sociedad Española de Oncología Médica, SEAP: Sociedad Española de Patología, AIOM=Asociación Italiana de Oncología Médica, SIAPEC-IAP=Sociedad Italiana de Anatomía Patológica y Diagnóstico CitopatológicoAcademia Internacional de Patología, NCCN=Red Nacional de Centros Oncológicos Integrales, ALCL=Linfoma de Célula Grande Anaplásico. pueden ser utilizados si han sido estandarizados para detectar el reordenamiento del gen ALK. El criterio general de los expertos reflejado en la normativa del CAP/IASLC/AMP es que la validación de las pruebas de ALK debe seguir las mismas directrices y políticas similares de control y garantía de calidad que las otras pruebas de diagnóstico molecular. Se han realizado varios estudios multicéntricos en diferentes países o regiones del mundo con el fin de implementar una política de estandarización entre laboratorios (Tabla 2). Europa El proyecto ETOP Lungscape se diseñó para ocuparse de la investigación de biomarcadores en el cáncer de pulmón. El primer protocolo fue un estudio de cohorte retrospectivo de reordenamiento del gen ALK para tratar la prevalencia de la positividad del ALK en el adenocarcinoma de pulmón 63 CAPÍTULO 9: Líneas de Actuación y estudios de estandarización Tabla 2. Estudios de estandarización multicéntricos para los métodos de prueba de ALK País Métodos Evaluados Participantes No. de Muestras Tipo de Estudio Europa (ETOP) IHC y FISH 15 laboratorios 1099 (69 ALK-positivas) Prueba interlaboratorios; Análisis retrospectivo Canadá IHC y FISH 12 laboratorios de patología canadienses 28 (22 ALK- positivas) Pruebas según protocolo individual de cada laboratorio, seguido de un ajuste de protocolo después de una reunión de consenso y validación adicional al repetir la prueba. Japón IHC, FISH, y RT-PCR cuantitativo Pruebas de detección a nivel nacional durante 3 meses 2884 213 ALK- positivas) Cribaje prospectivo Francia IHC, FISH, y RT-PCR 15 departamentos de patología torácica franceses 459 (85 ALK- positivas) Tratar la concordancia como método de ensayo en los laboratorios centrales Alemania IHC y FISH Expertos de 8 institutos de patología alemanes 10 (5 ALK- positivas) Pruebas interlaboratorios con el estado de ALK conocido previamente Europa (Sociedad Europea de Patología) IHC, FISH, e imágenes digitales de FISH 80 y 150 laboratorios respectivamente para la primera y segunda serie de pruebas 6 muestras extirpadas (2 ALK-positivas), 6 líneas celulares (2 ALK positivas) y 4 imágenes digitales (2 ALK positivas) Pruebas interlaboratorios con el estado de ALK conocido previamente resecado en el estadio I-III en Europa, utilizando IHC con posterior confirmación con FISH (Blackhall 2012). Un protocolo de IHC de ALK fue validado en una prueba interlaboratorios en la que participaron 15 laboratorios. Aunque el clon de anticuerpo utilizado fue 5A4 junto con el sistema de detección Novolink (Leica Biosystems), algunos laboratorios utilizaron la plataforma de tinción automática Bond-Max (Leica Biosystems) y otros realizaron la tinción manualmente. Un análisis preliminar demostró que la IHC de ALK fue positiva en 69 (6,3%) de 1099 muestras de adenocarcinoma. La gradación fue de 3+ en 23 muestras (33,3%), 2+ en ocho muestras (11%) y 1+ en 38 muestras (55%). Para verificar la concordancia, se evaluó una prueba de IHC de ALK positiva/negativa 1:2 de cohorte equiparable (n=207) con la prueba FISH. Los resultados de la prueba FISH fueron concordantes en 22 (37%) de los 60 tumores IHC ALK-positivos y en 137 (99%) de los 138 tumores IHC ALK-negativos (Figura 1). Este estudio demuestra la importancia de una definición clara de positividad de la IHC y qué nivel de positividad IHC puede predecir el reordenamiento del gen ALK. Si se usan estas condiciones aplicadas al anticuerpo 5A4, las muestras con una puntuación de 1+ o 2+ tienen una baja probabilidad de reordenamiento de ALK. Del mismo modo, una prueba IHC negativa conlleva una alta probabilidad de no reordenamiento de ALK. Canadá El estudio canadiense del linfoma anaplásico cinasa (CALK) fue un estudio multicéntrico llevado a cabo en todo el país para optimizar y estandarizar la prueba de IHC de ALK y de FISH, con tumores confirmados por FISH (22 tumores ALK-positivos y seis tumores ALK-negativos) (Tsao 2013). Las muestras de ALK-positivos se obtuvieron a partir de muestras que habían sido seleccionadas tanto con la IHC como con la prueba FISH en microarrays de tejidos construidos a partir de cerca de 2000 adenocarcinomas pulmonares resecados. Se enviaron réplicas anónimas de secciones a los laboratorios participantes para la IHC y la prueba FISH utilizando la prueba FISH ALK break-apart (Abbott 64 Atlas de la IASLC de Pruebas de ALK en Cáncer de Pulmón pacientes de adenocarcinoma con información de la IHC de ALK disponible N=1099 100 ALK IHC– N=1030 Estudio de cohorte pareado de la IHC de ALK 1:2 N=207 factores coincidentes en orden de importancia: estadio, sexo/tabaquismo, centro/año de realización de la intervención quirúrgica/edad ALK IHC+ N=69* 38 FISH– 22 FISH+ *9, prueba FISH no realizada ALK IHC– N=138 1 FISH+ 137 FISH– 99,3% 93,5% 87,5% 9,5% 90,5% 80 porcentaje ALK IHC+ N=69 60 40 20 0 12,5% 6,5% IHC resultado IHC resultado IHC resultado IHC resultado 0+ 1+ 2+ 3+ FISH ALK FISH negativo FISH positivo Figura 1. Los resultados del proyecto ETOP Lungscape. Entre 1099 adenocarcinomas de pulmón, 69 se identificaron como ALK positivo en la IHC. La concordancia entre la IHC y la prueba FISH se analizó en un cohorte emparejado. Molecular) por FISH: los anticuerpos ALK1 (Dako, un centro), clon 5A4 (Novocastra; 12 centros), el clon D5F3 (Cell Signaling Technology, un centro); y el sistema de tinción automática existente localmente disponibles (Dako, Leica Biosystems, o Ventana Medical Systems, Inc.). Se recogieron y analizaron los resultados propios de la IHC de 12 centros que evaluaron el anticuerpo 5A4 y los resultados de FISH en 11. El coeficiente de correlación intraclase (CCI) entre centros para IHC era 0,84. Tras el análisis inicial de los resultados de la IHC y una reunión de los patólogos participantes para revisar los cortes, cada laboratorio implementó los ajustes de protocolo pertinentes. Un segundo estudio se llevó a cabo con el mismo conjunto de muestras, y el CCI mejoró significativamente (0,94). El CCI para FISH fue de 0,68, y la sensibilidad y especificidad de los resultados de FISH entre centros fue del 88 % al 100 % y 100%, respectivamente. Los autores de este estudio concluyeron que se puede lograr la estandarización en los múltiples centros para las pruebas de ALK por la técnica de IHC y de FISH. Se detectaron todos los tumores que eran ALK-positivo por IHC y FISH, a excepción de un caso discrepante con resultados de la prueba FISH atípicos con una mutación desconocida e implicación clínica también desconocida. Sin embargo, los resultados también sugieren la posible aparición de resultados falsos negativos ocasionales en FISH. Japón Crizotinib fue aprobado por la Agencia de Productos Farmacéuticos y Sanitarios en Japón el 30 de marzo del 2012, pero este agente no se pudo utilizar en la práctica clínica hasta que fue incluido en la Lista de Precios de Medicamentos del Seguro de Salud Nacional. Tres meses antes de que se incluyera esta medicación, Pfizer Japón llevó a cabo un programa de pre-reembolso por razones éticas, en el que la compañía farmacéutica proporcionaba crizotinib a un instituto certificado cuando se determinaba que un tumor era ALK positivo. En el programa, se examinaron muestras FFPE simultáneamente con la prueba FISH (Vysis LSI ALK Break Apart FISH Probe Kit, Abbott Molecular) y la IHC (el anticuerpo clon 5A4 junto con el sistema EnVision FLEX + [ Dako ] y un kit de 65 CAPÍTULO 9: Líneas de Actuación y estudios de estandarización detección de iAEP [Nichirei Biosystems]), y la RT-PCR se utilizó en muestras de citología, tales como el derrame pleural. Se realizaron un total de 5514 pruebas: 2630 con FISH, 2631 con IHC y 253 con RT-PCR. El éxito de las pruebas fue del 93%, 96%, y 94%, respectivamente. Aunque la concordancia entre la técnica de FISH y la IHC fue del 98%, la sensibilidad de la IHC de ALK se limitó al 86%. Los resultados fueron positivos tanto en la prueba FISH como en la IHC para 213 muestras; 36 muestras fueron positivas en la prueba FISH, pero negativas en la IHC, y 12 muestras fueron negativas en FISH, pero positivas en la IHC. Los resultados fueron negativos tanto en FISH como en la IHC para 2076 especímenes. Basándose en estos resultados, la Sociedad Japonesa del Cáncer de Pulmón añadió una nota especial en su guía de pruebas de ALK 2011 que indica que, incluso cuando se considera a un paciente un buen candidato para el tratamiento con un inhibidor de ALK basándose en los resultados de ambas pruebas de IHC y FISH, puede haber discrepancia entre los resultados de las dos pruebas, y el tratamiento debe ser cuidadosamente determinado teniendo en cuenta la relación beneficio-riesgo (Mitsudomi 2011). Francia El programa del Instituto Nacional del Cáncer (INCA) francés, que se inició en 2007, se dedica a la detección prospectiva de biomarcadores emergentes en el cáncer de pulmón, cáncer colorrectal y melanoma en 28 plataformas de genética molecular en los hospitales para cáncer. Como parte de este programa, se está realizando un estudio multicéntrico francés de validación del ALK que compara la IHC, utilizando los anticuerpos 5A4 y D5F3 (Novocastra y Cell Signaling Technology, respectivamente), con la técnica FISH y la RT-PCR cuantitativa en una serie de 500 especímenes quirúrgicos FFPE (Lantuéjoul 2013). Entre los 459 especímenes incluidos hasta la fecha, 340 eran ALK negativo tanto en la prueba FISH como en la IHC y 85 fueron ALK positivos también en ambas. Entre los casos discordantes, 15 fueron negativos en la prueba FISH y positivos en la IHC (pero con gradación baja de tinción); 12 fueron positivos en la prueba FISH y negativos en la IHC. Siete especímenes no se pudieron interpretar con la prueba FISH, pero cinco de ellos fueron ALK positivo en la IHC. En general, la sensibilidad de la IHC versus la técnica FISH fue del 87% y la especificidad del 96%. En cuanto a la RT-PCR cuantitativa, casi el 50% de las muestras ALK positivas tenían la variante 1, el 30% tenían variante 3a/b, menos del 5% tenían la variante 2 ó 7, y 20% fueron negativas o no se pudieron interpretar. Los autores concluyeron que la IHC con 5A4 es una técnica fiable y fácil para el diagnóstico de rutina de anormalidades de ALK, mientras que la técnica FISH y la RT-PCR cuantitativa aún dependen de las condiciones preanalíticas y los conocimientos técnicos. Sin embargo, ningún método es absolutamente preciso, y cuando el cuadro clínico sugiere la presencia de la positividad de ALK, a pesar de un resultado negativo, conviene repetir la prueba con otro método. Alemania La Sociedad Alemana de Patología (Deutsche Gesellschaft für Pathologie; DGP) y la Asociación Profesional de Patólogos Alemanes (Berufsverband Deutscher Pathologie; BDP) están llevando a cabo pruebas interlaboratorios para la detección de la fusión del gen ALK para garantizar la técnica en cada uno de los institutos. En la fase preliminar del estudio, expertos de ocho institutos de patología evaluaron las muestras de 10 casos de cáncer de pulmón para confirmar el estado del ALK mediante la técnica FISH y la técnica de IHC (V Laffert 2013). Posteriormente, las muestras de cáncer de pulmón confirmadas se distribuyeron como una sección de microarrays de tejidos. Los institutos participantes utilizaron diferentes sondas FISH (ya sea de Abbott Molecular o ZytoVision GmbH), diferentes clones de anticuerpos (ALK1, 5A4 y D5F3), diferentes diluciones (de 1:20 a 1:200), y varios sistemas de detección (tinción manual o automatizado de Ventana Medical Systems, Leica 66 Atlas de la IASLC de Pruebas de ALK en Cáncer de Pulmón Biosystems o Dako). Los tumores ALK negativos fueron diagnosticados correctamente con cualquiera de los métodos (FISH y la IHC), mientras que se encontraron resultados dispares para los tumores ALK positivos, especialmente con la IHC. El estudio demostró claramente que es crucial establecer protocolos estandarizados para detectar el gen de fusión ALK. Europa Se ha publicado recientemente una guía sobre los requisitos de los programas de evaluación externa de la calidad de la patología molecular (Van Krieken 2013). La Sociedad Europea de Patología lleva a cabo un programa europeo de evaluación externa de la calidad para determinar las mutaciones de los biomarcadores en CPCNP y así asegurar la máxima precisión y perfeccionamiento en las pruebas. El programa cuenta con dos series de evaluación externa de calidad de las pruebas de ALK en las que participaron 80 y 150 laboratorios respectivamente. Se proporcionaron cortes de microarray tisular con núcleos a partir de material FFPE e imágenes digitales de FISH. Los datos de las dos series estarán disponibles a finales de 2013. Estudio internacional de reproducibilidad del kit Ventana IHC de ALK Siete observadores internacionales estudiaron 100 casos evaluables para analizar la correlación entre las pruebas de IHC y de FISH así como la reproducibilidad de la técnica de IHC de ALK Ventana con el anticuerpo D5F3 (Ventana Medical Systems, Inc). Cuando los resultados de la IHC de ALK se correlacionaron con los de la prueba FISH de ALK, la sensibilidad fue del 90% y la especificidad del 95%, con una precisión del 93% respecto a la prueba FISH. Los siete observadores coincidieron en la interpretación de la IHC en el 95% de los casos, y seis de los siete observadores coincidieron en el 97% de los casos (Hirsch 2013). Los autores llegaron a la conclusión de que había una excelente concordacia intraobservador e interobservador con el Kit IHC de Ventana, así como una excelente correlación con las pruebas FISH de ALK. Conclusión Aunque las pruebas para el reordenamiento del gen ALK mediante sondas FISH ALK break-apart es generalmente reconocida como el criterio diagnóstico estándar para la terapia con TKI ALK, el algoritmo de cribado para la detección de cáncer de pulmón con reordenamiento en ALK está aún en fase de investigación. Se están llevando a cabo estudios en varios grupos para desarrollar directrices nacionales o regionales en todas partes del mundo. La mayoría de estos estudios se centran en la estandarización tanto de las pruebas IHC como las pruebas FISH, así como en la evaluación de la sensibilidad y la especificidad de la IHC como herramienta de detección. A medida que se publiquen los resultados de estos estudios, es probable que se pueda llegar a un consenso mundial sobre el algoritmo de detección del gen ALK en los próximos años. CAPÍTULO 10 Resumen y perspectivas futuras Por Fred R. Hirsch, Yasushi Yatabe y Ming Sound Tsao Los resultados del tratamiento para los pacientes con CPCNP en estado avanzado y reordenamiento del gen ALK siguen siendo alentadores, y el diagnóstico de estos reordenamientos sigue siendo un reto. Hoy en día es bien sabido que las pruebas moleculares para el reordenamiento del gen ALK son cruciales para elegir la mejor terapia para los pacientes con CPCNP avanzado, en particular para los tumores de tipo adenocarcinoma o que tienen un componente de adenocarcinoma. Sin embargo, aún quedan algunas cuestiones sin resolver: 1.¿Qué pacientes deben ser examinados para el reordenamiento del gen ALK ? 2.¿Cuál es el método de cribado más efectivo a nivel de coste-beneficio? 3.¿Cuál es el mejor modelo de cribado para seleccionar los pacientes que serán tributarios del tratamiento con inhibidores de ALK con el fin de elegir todos los pacientes que pueden beneficiarse potencialmente de esta terapia? 4.¿Cuál es el modelo de tratamiento más eficaz basado en la evidencia clínica actual? Aunque la última pregunta está más allá del alcance de este Atlas, las tres primeras preguntas han sido abordadas en esta publicación. ¿Qué pacientes deben ser examinados para el reordenamiento del gen ALK? Parece haber consenso en que, como mínimo, la detección de reordenamiento del gen ALK se debe hacer para todos los pacientes con CPCNP avanzado que sea un adenocarcinoma o que tenga un componente de adenocarcinoma. En función de los recursos y el interés académico, se debe considerar la detección de los pacientes con CPCNP avanzado con otras histologías, sobre todo los pacientes con una o más de estas características: pacientes más jóvenes de la media, sin antecedentes de tabaquismo (o fumadores esporádicos), o resultados negativos en las pruebas en el gen EGFR y en el gen KRAS. De vez en cuando, el reordenamiento del gen ALK se encuentra en los tumores con un diagnóstico histológico sin adenocarcinoma, aunque esto no es muy común. Si la muestra de diagnóstico es pequeña y el componente de adenocarcinoma no se puede excluir, se recomienda realizar las pruebas de ALK. A pesar de que el tratamiento con un inhibidor de ALK no se recomienda para los pacientes con CPCNP en estadio temprano (I-IIIA), se recomiendan las pruebas moleculares, incluyendo las pruebas de ALK, en las piezas quirúrgicas con el fin de proporcionar información si se produjese una recaída de la enfermedad o un avance en la misma. ¿Cuál es el método de cribado más efectivo a nivel de coste-beneficio? En los Estados Unidos, el criterio de inclusión para la terapia con crizotinib requiere el diagnóstico del 68 Atlas de la IASLC de Pruebas de ALK en Cáncer de Pulmón reordenamiento del gen ALK mediante un ensayo de ALK que esté aprobado por la FDA de los EE.UU. Actualmente, sólo hay uno que esté aprobado por dicha organización: el ensayo FISH ALK breakapart (Abbott Molecular). Sin embargo, no se ha estipulado ningún requisito para determinar una prueba específica para la detección del ALK. Muchos estudios han confirmado una alta especificidad y sensibilidad diagnóstica para la IHC de ALK comparada con la FISH de ALK, y muchas directrices ya incluyen recomendaciones para el uso de la IHC de ALK para detectar el reordenamiento del gen ALK en grandes poblaciones de personas afectadas de CPCNP y la verificación de los resultados positivos en la IHC con la prueba de FISH de ALK para la selección de tratamiento. Hoy por hoy, la RT-PCR no se recomienda para el cribado de ALK. ¿Cuál es el mejor modelo de cribado para el tratamiento con un inhibidor de ALK? Aunque el cribado con IHC de ALK ha sido adoptado en muchos países, no está claro cuales resultados deben ser verificados con la prueba de FISH de ALK. Algunas guías recomiendan que todos los tumores que son positivos en IHC de ALK deben ser analizados por la técnica de FISH de ALK, mientras que otros sugieren que la prueba de FISH se use para verificar los resultados de la IHC de 1+ y 2+. Se requieren un mayor número de asociaciones clínico-diagnósticas más detalladas en cuanto a la respuesta y los resultados relacionados con la terapia con inhibidores de ALK para determinar el paradigma óptimo de cribado de diagnóstico. Hasta que estos resultados adicionales detallados del análisis correlativo estén disponibles, los autores recomiendan que todos los tumores IHC positivos se verifiquen con FISH de ALK. Sin embargo, hay un número creciente de pacientes con tumores que son FISH ALK negativos pero positivos con la IHC que tienen una buena respuesta a la terapia con crizotinib. En tales casos, estos resultados negativos en la prueba de FISH de ALK pueden ser resultados tanto verdadero-negativo como falso-negativo debido a un patrón FISH borderline o atípico. En este momento se están realizando análisis más exhaustivos de estos casos que ayudará a obtener más información al respecto. ¿Cuáles son los pasos a seguir en el futuro? Desde un punto de vista terapéutico, actualmente se encuentran en desarrollo clínico varios inhibidores de ALK de segunda generación, como los inhibidores duales ALK/EGFR, con resultados muy alentadores. Sólo podremos decidir qué ensayo de diagnóstico dará los mejores resultados clínicos realizando más estudios. La prueba de FISH de ALK es hoy en día el criterio estándar para la inclusión en el tratamiento con crizotinib, y también se está utilizando en los ensayos clínicos con inhibidores de ALK de nueva generación. Sin embargo, la correlación del tratamiento con otros ensayos, tales como la IHC y la PCR, es aún objeto de investigación y el paradigma de diagnóstico de cribado puede cambiar en el futuro. Además, la introducción de nuevos ensayos múltiples, en particular las tecnologías NGS, deben ser validadas tanto para el cribado como para la selección de tratamiento de los pacientes con CPCNP para la terapia ALK dirigida. Conclusión Como se ilustra en este Atlas, el diagnóstico del reordenamiento del gen ALK todavía se está estudiando. En un par de años, el esquema de diagnóstico puede cambiar, y la aparición de nuevos fármacos dirigidos puede facilitar esa transición. Sin embargo, estamos seguros de que ahora podemos tratar adecuadamente a los pocos pacientes que tienen CPCNP con esta alteración genética. Todos los profesionales de este campo deben asegurarse que los pacientes que potencialmente puedan beneficiarse de la terapia de ALK-dirigida reciban un tratamiento óptimo. 69 REFERENCIAS Referencias Alici I, Demirci NY, Yilmaz A, et al. The combination of cytological smears and cell blocks on endobronchial ultrasound-guided transbronchial needle aspirates allows a higher diagnostic yield. Virchows Arch. 2013;462(3):323-327. Allouche M. ALK is a novel dependence receptor: potential implications in development and cancer. Cell Cycle. 2007;6:1533-1538. Alrifai D, Popat S, Ahmed M, et al. A rare case of squamous cell carcinoma of the lung harbouring ALK and BRAF activating mutations. Lung Cancer. 2013;80(3):339-340. An S, Chen ZH, Su J, et al. Identification of enriched driver gene alterations in subgroups of non-small cell lung cancer patients based on histology and smoking status. PLoS One. 2012;7(6):e40109. Atkins D, Reiffen K-A, Tegtmeier CL, et al. Immunohistochemical detection of EGFR in paraffin-embedded tumor tissues: variation in staining intensity due to choice of fixative and storage time of tissue sections. J Histochem Cytochem. 2004;52(7):893-901. Babic A, Loftin IR, Stanislaw S, et al. The impact of preanalytical processing on staining quality for H&E, dual hapten, dual color in situ hybridization and fluorescent in situ hybridization assays. Methods. 2010;52(4):287-300. Bang Y, Kwak EL, Shaw AT, et al. Clinical activity of the oral ALK inhibitor PF-02341066 in ALK-positive patients with non-small cell lung cancer (NSCLC) J Clin Oncol. 2010;28(18s):(suppl; abstr 3). Betz B, Dixon CA, Weigelin HC, et al. The use of stained cytologic direct smears for ALK gene rearrangement analysis of lung adenocarcinoma. Cancer Cytopathol. 2013 Mar 27 [Epub ahead of print]. Biomarker Committee, Japanese Lung Cancer Society. Guidance for ALK Gene Testing in Lung Cancer Patients. Version 1.0 August 1, 2011. Available at http://www.haigan.gr.jp/ uploads/photos/641.pdf. Blackhall F, Peters S, Kerr KM, et al. Prevalence and clinical outcomes for patients with ALK gene rearrangement in Europe: preliminary results from the European Thoracic Oncology Platform Lungscape project. Ann Oncol. 2013;23(Suppl 9):ix73. Boland J, Erdogan S, Vasmatzis G, et al. Anaplastic lymphoma kinase immunoreactivity correlates with ALK gene rearrangement and transcriptional up-regulation in nonsmall cell lung carcinomas. Hum Pathol. 2009;40(8):1152-1158. Burnett R, Swanson Beck J, Howatson SR, et al. Observer variability in histopathological reporting of malignant bronchial biopsy specimens. J Clin Pathol. 1994;47(8):711-713. Bussolati G, Leonardo E. Technical pitfalls potentially affecting diagnoses in immunohistochemistry. J Clin Pathol. 2008;61(11):1184-1192. Camidge D, Bang YJ, Kwak EL, et al. Activity and safety of crizotinib in patients with ALK-positive non-small-cell lung cancer: updated results from a phase 1 study. Lancet Oncol. 2012;13(10):1011-1019. (a) Camidge D, Kono SA, Flacco A, et al. Optimizing the detection of lung cancer patients harboring anaplastic lymphoma kinase (ALK) gene rearrangements potentially suitable for ALK inhibitor treatment. Clin Cancer Res. 2010;16(22):5581-5590. Camidge DR, Skokan M, Kiatsimkul P, et al. Native and rearranged ALK copy number and rearranged cell count in non-small cell lung cancer. Implications for ALK inhibitor therapy. Cancer. 2013 Sept 10 [Epub ahead of print]. Camidge D, Theodoro M, Maxson DA, et al. Correlations between the percentage of tumor cells showing an anaplastic lymphoma kinase (ALK) gene rearrangement, ALK signal copy number, and response to crizotinib therapy in ALK fluorescence in situ hybridization-positive nonsmall cell lung cancer. Cancer. 2012;118(18):4486-4494. (b) Chen T, Chang IC, Liu HP, et al. Correlation of anaplastic lymphoma kinase overexpression and the EML4-ALK fusion gene in non-small cell lung cancer by immunohistochemical study. Chang Gung Med J. 2012;35(4):309-317. Chihara D, Suzuki R. More on crizotinib [letter]. N Engl J Med. 2011;364(8):776-778. Chuang M, Marchevsky A, Teirstein AS, et al. Diagnosis of lung cancer by fibreoptic bronchoscopy: problems in the histological classification of non-small cell carcinomas. Thorax. 1984;39(3):175-178. Coghlin C, Smith LJ, Bakar S, et al. Quantitative analysis of tumour in bronchial biopsy specimens. J Thorac Oncol. 2010;5(4):448-452. Conklin C, Craddock KJ, Have C, et al. Immunohistochemistry is a reliable screening tool for identification of ALK rearrangement in non-small-cell lung carcinoma and is antibody dependent. J Thorac Oncol. 2013;8(1):45-51. Dai Z, Kelly JC, Meloni-Ehrig A, et al. Incidence and patterns of ALK FISH abnormalities seen in a large unselected series of lung carcinomas. Molec Cytogenetics. 2012;5(1):44. DiVito K, Charette LA, Rimm DL, Camp RL. Long-term preservation of antigenicity in tissue microarrays. Lab Invest. 2004;84(8):1071-1078. Doebele R, Pilling AB, Aisner DL, et al. Mechanisms of resistance to crizotinib in patients with ALK gene rearranged non-small cell lung cancer. Clin Cancer Res. 2012;18(5):1472-1482. Eberhard D, Giaccone G, Johnson BE; Non-Small-Cell Lung Cancer Working Group. Biomarkers of response to epidermal growth factor receptor inhibitors in Non-Small-Cell Lung Cancer Working Group: standardization for use in the clinical trial setting. J Clin Oncol. 2008;26(6):983-994. Edwards S, Roberts C, McKean ME, et al. Preoperative histological classification of primary lung cancer: accuracy of diagnosis and use of the non-small cell category. J Clin Pathol. 2000;53(7):537-540. 70 Atlas de la IASLC de Pruebas de ALK en Cáncer de Pulmón Felip E, Gridelli C, Baas P, et al. Metastatic non-small-cell lung cancer: consensus on pathology and molecular tests, first-line, second-line, and third-line therapy: 1st ESMO Consensus Conference in Lung Cancer; Lugano 2010. Ann Oncol. 2011;22:1507-1519. Gainor J, Varghese AM, Ou SH, et al. ALK rearrangements are mutually exclusive with mutations in EGFR or KRAS: an analysis of 1,683 patients with non-small cell lung cancer. Clin Cancer Res. 2013;19(15):4273-4281. Garrido P, de Castro J, Concha Á et al. Guidelines for biomarker testing in advanced non-small-cell lung cancer. A national consensus of the Spanish Society of Medical Oncology (SEOM) and the Spanish Society of Pathology (SEAP). Clin Transl Oncol. 2012;14(5):338-339. Halling K, Schrijver I, Persons DL. Test verification and validation for molecular diagnostic assays. Arch Pathol Lab Med. 2012;136(1):11-13. Hirsch F, Yatabe Y, Dietel M, et al. ALK-immunohistochemistry (IHC) standardization with D5F3 antibody in non-small cell lung carcinoma (NSCLC): an international consensus study. J Clin Oncol. 2013;31(May 20 Supplement):e22042. Huang D KD, Kotsakis A, et al. Multiplexed deep sequencing analysis of ALK kinase domain identifies resistance mutations in relapsed patients following crizotinib treatment. Genomics. 2013 Feb 20 [Epub ahead of print]. Hunt J. Molecular pathology in anatomic pathology practice: a review of basic principles. Arch Pathol Lab Med. 2007; 132(2):248-260. Inamura K, Takeuchi K, Togashi Y, et al. EML4-ALK fusion is linked to histological characteristics in a subset of lung cancers. J Thorac Oncol. 2008;3:13-17. Jin G, Jeon HS, Lee EB, et al. EML4-ALK fusion gene in Korean non-small cell lung cancer. J Korean Med Sci. 2012; 27(2):228-230. Jing X, Li QK, Bedrossian U, Michael CW. Morphologic and immunocytochemical performances of effusion cell blocks prepared using 3 different methods Am J Clin Pathol. 2013; 139(2):177-182. Jokoji R, Yamasaki T, Minami S, et al. Combination of morphological feature analysis and immunohistochemistry is useful for screening of EML4-ALK-positive lung adenocarcinoma. J Clin Pathol. 2010;63(12):1066-1070. Kalhor N, Wistuba, II. Perfecting the fine-needle aspirate cell block. Cancer Cytopathol. 2013;121(3):109-110. Kerr K. Clinical relevance of the new IASLC/ERS/ATS adenocarcinoma classification. J Clin Pathol. 2013 Apr 6 [Epub ahead of print]. (a) Kerr K, Loo PS, Nicolson MC. Pathology and personalized medicine in lung cancer. Lung Cancer Mange. 2013;2(1):35-46. (b) Khoury T. Delay to formalin fixation alters morphology and immunohistochemistry for breast carcinoma. Appl Immunohistochem Mol Morphol. 2012;20(6):531-542. Kim H, Xu X, Yoo SB, et al. Discordance between anaplastic lymphoma kinase status in primary non-small-cell lung cancers and their corresponding metastases. Histopathology. 2013;62(2):305-314. Kim H, Yoo S-B, Choe J-Y, et al. Detection of ALK gene rearrangement in non-small cell lung cancer. J Thorac Oncol. 2011;6(8):1359-1366. Knoepp S, Roh MH. Ancillary techniques on direct-smear aspirate slides: a significant evolution for cytopathology techniques. Cancer Cytopathol. 2013;121(3):120-128. Koivunen J, Mermel C, Zejnullahu K, et al. EML4-ALK fusion gene and efficacy of an ALK kinase inhibitor in lung cancer. Clin Cancer Res. 2008;14(13):4275-4283. Kwak E, Bang YJ, Camidge DR, et al. Anaplastic lymphoma kinase inhibition in non-small-cell lung cancer. N Engl J Med. 2010;363(18):1693-1703. Lantuéjoul S, Rouquette I, Begueret H, et al. A French multicentric and prospective validation study for ALK translocation diagnosis in lung adenocarcinomas J Clin Oncol. 2013;31 (May 20 Supplement):8100. Li T, Kung HJ, Mack PC, Gandara DR. Genotyping and genomic profiling of non-small-cell lung cancer: implications for current and future therapies. J Clin Oncol. 2013;31:1039-1049. Li Y, Li Y, Yang T, et al. Clinical significance of EML4-ALK fusion gene and association with EGFR and KRAS gene mutations in 208 Chinese patients with non-small cell lung cancer. PLoS One. 2013;8(1):e52093. Lin E, Li L, Guan Y, et al. Exon array profiling detects EML4-ALK fusion in breast, colorectal, and non-small cell lung cancers. Mol Cancer Res. 2009;7:1466-1476. Lindeman N, Cagle PT, Beasley MB, et al. Molecular testing guideline for selection of lung cancer patients for EGFR and ALK tyrosine kinase inhibitors: guideline from the College of American Pathologists, International Association for the Study of Lung Cancer, and Association for Molecular Pathology. J Thorac Oncol. 2013;8(7):823-859. Lipson D, Capelletti M, Yelensky R, et al. Identification of new ALK and RET gene fusions from colorectal and lung cancer biopsies. Nature Med. 2012;18:382-384. Lira M, Kim TM, Huang D, et al. Multiplexed gene expression and fusion transcript analysis to detect ALK fusions in lung cancer. J Molec Diag. 2013;15:51-61. Loo P, Thomas SC, Nicolson MC, et al. Subtyping of undifferentiated non-small cell carcinomas in bronchial biopsy specimens. J Thorac Oncol. 2010;5(4):442-447. Lopes L, Bacchi CE. Anaplastic lymphoma kinase gene rearrangement in non-small-cell lung cancer in a Brazilian population. Clinics (Sao Paulo). 2012;67:845-847. Mano H, Takeuchi K. EML4-ALK fusion in lung [letter]. Am J Pathol. 2010;176(3):1552-1553. Marchetti A, Ardizzoni A, Papotti M, et al. Recommendations for the analysis of ALK gene rearrangements in non-smallcell lung cancer: a consensus of the Italian Association of Medical Oncology and the Italian Society of Pathology and Cytopathology. J Thorac Oncol. 2013;8(3):352-358. Martelli M, Sozzi G, Hernandez L, et al. EML4-ALK rearrangement in non-small cell lung cancer and non-tumor lung tissues. Am J Pathol. 2009;174(2):661-670. 71 REFERENCIAS Martinez P, Hernandez-Losa J, Montero MA, et al. Fluorescence in situ hybridization and immunohistochemistry as diagnostic methods for ALK positive non-small cell lung cancer patients. PLoS One. 2013;8(2):e52261. Paik J, Choi CM, Kim H, et al. Clinicopathologic implication of ALK rearrangement in surgically resected lung cancer: a proposal of diagnostic algorithm for ALK-rearranged adenocarcinoma. Lung Cancer. 2012;76:403-409. McLeer-Florin A, Moro-Sibilot D, Melis A, et al. Dual IHC and FISH testing for ALK gene rearrangement in lung adenocarcinomas in a routine practice: a French study. J Thorac Oncol. 2012;7(2):348-354. Palmer R, Vernersson E, Grabbe C, Hallberg B. Anaplastic lymphoma kinase: signalling in development and disease. Biochem J. 2009;420:345-361. Minca E, Portier BP, Wang Z, et al. ALK status testing in nonsmall cell lung carcinoma: correlation between ultrasensitive IHC and FISH. J Mol Diagn. 2013;15(3):341-346. Mino-Kenudson M, Chirieac LR, Law K, et al. A novel, highly sensitive antibody allows for the routine detection of ALK-rearranged lung adenocarcinomas by standard immunohistochemistry. Clin Cancer Res. 2010;16(5):1561-1571. Mitiushkina N, Iyevleva AG, Poltoratskiy AN, et al. Detection of EGFR mutations and EML4-ALK rearrangements in lung adenocarcinomas using archived cytological slides. Cancer Cytopathol. 2013;121(7):370-376. Moreira A, Hasanovic A. Molecular characterization by immunocytochemistry of lung adenocarcinoma on cytology specimens. Acta Cytol. 2012;56(6):603-610. Morris S, Kirstein MN, Valentine MB, et al. Fusion of a kinase gene, ALK, to a nucleolar protein gene, NPM, in non-Hodgkin’s lymphoma. Science. 1994;263:1281-1284. Murakami Y, Mitsudomi T, Yatabe Y. A screening method for the ALK fusion gene in NSCLC. Front Oncol. 2012;2:24. Nakamura H, Tsuta K, Yoshida A, et al. Aberrant anaplastic lymphoma kinase expression in high-grade pulmonary neuroendocrine carcinoma. J Clin Pathol. 2013;66:705-707. National Comprehensive Cancer Network. Non-small cell lung cancer. Version 2.2013. Available at www.nccn.org. Nitta H, Tsuta K, Yoshida A, et al. New methods for ALK status diagnosis in non-small-cell lung cancer: an improved ALK immunohistochemical assay and a new, brightfield, dual ALK IHC-in situ hybridization assay. J Thorac Oncol. 2013; 8(8):1019-1031. Noda Y, Fujita N, Kobayashi G, et al. Diagnostic efficacy of the cell block method in comparison with smear cytology of tissue samples obtained by endoscopic ultrasound-guided fine-needle aspiration. J Gastroenterol. 2010;45(8):868-875. Ochi N, Yamane H, Yamagishi T, et al. Can we eliminate squamous cell carcinoma of the lung from testing of EML4ALK fusion gene? Lung Cancer. 2013;79(1):94-95. Orell S, Sterrett GF (eds). Orell and Sterrett’s Fine Needle Aspiration Cytology, 5th ed. New York: Churchill Livingstone; 2011. Oyama T, Ishikawa Y, Hayashi Y, et al. The effects of fixation, processing and evaluation criteria of immunohistochemical detection of hormone receptors in breast cancer. Breast Cancer. 2007;12(2):182-188. Paik J, Choe G, Kim H, et al. Screening of anaplastic lymphoma kinase rearrangement by immunohistochemistry in nonsmall cell lung cancer: correlation with fluorescence in situ hybridization. J Thorac Oncol. 2011;6(3):466-472. Park H, Lee JK, Kim DW, et al. Immunohistochemical screening for anaplastic lymphoma kinase (ALK) rearrangement in advanced non-small cell lung cancer patients. Lung Cancer. 2012;77:288-292. Peled N, Palmer G, Hirsch FR, et al. Next-generation sequencing identifies and immunohistochemistry confirms a novel crizotinib-sensitive ALK rearrangement in a patient with metastatic non-small-cell lung cancer. J Thorac Oncol. 2012;7(9):e14-16. Pelosi G, Gasparini P, Cavazza A, et al. Multiparametric molecular characterization of pulmonary sarcomatoid carcinoma reveals a nonrandom amplification of anaplastic lymphoma kinase (ALK) gene. Lung Cancer. 2012;77:507-514. Perner S, Wagner PL, Demichelis F, et al. EML4-ALK fusion lung cancer: a rare acquired event. Neoplasia. 2008;10(3):298-302. Popat S, Gonzalez D, Min T, et al. ALK translocation is associated with ALK immunoreactivity and extensive signetring morphology in primary lung adenocarcinoma. Lung Cancer. 2012;75:300-305. Prinsen C, Klaassen CH, Thunnissen FB. Microarray as a model for quantitative visualization chemistry. Appl Immunohistochem Mol Morphol. 2003;11:168-173. Rekhtman N, Paik PK, Arcila ME, et al. Clarifying the spectrum of driver oncogene mutations in biomarker-verified squamous carcinoma of lung: lack of EGFR/KRAS and presence of PIK3CA/AKT1 mutations. Clin Cancer Res. 2012; 18(4):1167-1176. Rikova K, Guo A, Zeng Q, et al. Global survey of phosphotyrosine signaling identifies oncogenic kinases in lung cancer. Cell. 2007;131:1190-1203. Rivera M, Mehta AC, American College of Chest Physicians. Initial diagnosis of lung cancer: ACCP evidence-based clinical practice guidelines (2nd edition). Chest. 2007;132(3 Supple):131S-148S. Rodig S, Mino-Kenudson M, Dacic S, et al. Unique clinicopathologic features characterize ALK-rearranged lung adenocarcinoma in the western population. Clin Cancer Res. 2009;15(16):5216-5223. Ross J, Cronin M. Whole cancer genome sequencing by nextgeneration methods. Am J Clin Pathol. 2011;136:527-539. Rothschild S, Zippelius A, Betticher DC, et al. Neue Therapiekonzepte beim Bronchuskarzinom. Schweiz Med Forum. 2011;11:7. Ruschoff J, Kerr KM, Grote HJ, et al. Reproducibility of immunohistochemical scoring for epidermal growth factor receptor expression in non-small cell lung cancer. Arch Pathol Lab Med. 2012 Dec 27 [Epub ahead of print]. 72 Atlas de la IASLC de Pruebas de ALK en Cáncer de Pulmón Sakairi Y, Nakajima T, Yasufuku K, et al. EML4-ALK fusion gene assessment using metastatic lymph node samples obtained by endobronchial ultrasound-guided transbronchial needle aspiration. Clin Cancer Res. 2010;16(20):4938-4945. Salido M, Pijuan L, Martinez-Aviles L, et al. Increased ALK gene copy number and amplification are frequent in non-small cell lung cancer. J Thorac Oncol. 2011;6(1):21-27. Sanders H, Li HR, Bruey JM, et al. Exon scanning by reverse transcriptase-polymerase chain reaction for detection of known and novel EML4-ALK fusion variants in non-small cell lung cancer. Cancer Genet. 2011;204:45-52. Sasaki T, Rodig SJ, Chirieac LR, et al. The biology and treatment of EML4-ALK non-small cell lung cancer. Eur J Cancer. 2010;46:1773-1780. Savic S, Bode B, Diebold J, et al. Detection of ALK-positive non-small-cell lung cancers on cytological specimens: high accuracy of immunocytochemistry with the 5A4 clone. J Thorac Oncol. 2013;8(8):1004-1011. Saxe D, Persons DL, Wolff DJ, et al. Validation of fluorescence in situ hybridization using an analyte-specific reagent for detection of abnormalities involving the mixed lineage leukemia gene. Arch Pathol Lab Med. 2012;136(1):47-52. Schildhaus H, Deml KF, Schmitz K, et al. Chromogenic in situ hybridization is a reliable assay for detection of ALK rearrangements in adenocarcinomas of the lung. Mod Pathol. 2013 Jun 7 [Epub ahead of print]. Schreiber G, McCrory DC. Performance characteristics of different modalities for diagnosis of suspected lung cancer: summary of published evidence. Chest. 2003;123(1 Suppl):115S-128S. Selinger C, Rogers TM, Russell PA, et al. Testing for ALK rearrangement in lung adenocarcinoma: a multicenter comparison of immunohistochemistry and fluorescent in situ hybridization. Mol Pathol. 2013 Jun 7 [Epub ahead of print]. Shaozhang Z, Xiaomei L, Aiping Z, et al. Detection of EML4ALK fusion genes in non-small cell lung cancer patients with clinical features associated with EGFR mutations. Genes Chromsomes Cancer. 2012;51(10):925-932. Shaw A, Kim DW, Nakagawa K, et al. Crizotinib versus chemotherapy in advanced ALK-positive lung cancer. N Engl J Med. 2013;368(25):2385-2394. Shaw A, Yeap BY, Mino-Kenudson M, et al. Clinical features and outcome of patients with non-small-cell lung cancer who harbor EML4-ALK. J Clin Oncol. 2009;27(26):4247-4253. Shaw A, Yeap BY, Solomon BJ, et al. Effect of crizotinib on overall survival in patients with advanced non-small-cell lung cancer harbouring ALK gene rearrangement: a retrospective analysis. Lancet Oncol. 2011;12(11):1004-1012. Soda M, Choi YL, Enomoto M, et al. Identification of the transforming EML4-ALK fusion gene in non-small-cell lung cancer. Nature. 2007;448(7153):561-566. Soda M, Isobe K, Inoue A, et al. A prospective PCR-based screening for the EML4-ALK oncogene in non-small cell lung cancer. Clin Cancer Res. 2012;18(20):5682-5689. Sun J, Choi YL, Won JK, et al. A dramatic response to crizotinib in a non-small-cell lung cancer patient with IHC-positive and FISH-negative ALK. J Thorac Oncol. 2012;7:e36-e38. Sun Y, Ren Y, Fang Z, et al. Lung adenocarcinoma from East Asian never-smokers is a disease largely defined by targetable oncogenic mutant kinases. J Clin Oncol. 2010;28(30):4616-4620. Takahashi T, Sonobe M, Kobayashi M, et al. Clinicopathologic features of non-small-cell lung cancer with EML4-ALK fusion gene. Ann Surg Oncol. 2010;17(3):889-897. Takamochi K, Takeuchi K, Hayashi T, et al. A rational diagnostic algorithm for the identification of ALK rearrangement in lung cancer: a comprehensive study of surgically treated Japanese patients. PLoS One. 2013;8(8):e69794. Takeuchi K. Interpretation of anti-ALK immunohistochemistry results [letter]. J Thorac Oncol. 2013;8(7):e67-e68. Takeuchi K, Choi YL, Soda M, et al. Multiplex reverse transcription-PCR screening for EML4-ALK fusion transcripts. Clin Cancer Res. 2008;14(20):6618-6624. Takeuchi K, Choi YL, Togashi Y, et al. KIF5B-ALK, a novel fusion oncokinase identified by an immunohistochemistry-based diagnostic system for ALK-positive lung cancer. Clin Cancer Res. 2009;15(9):3143-3149. Takeuchi K, Soda M, Togashi Y, et al. RET, ROS1 and ALK fusions in lung cancer. Nature Med. 2012;18:378-381. Tanaka H, Tone K, Hayashi A, et al. Clinical application of immunocytochemical detection of ALK rearrangement on cytology slides for detection or screening of lung adenocarcinoma. Lung Cancer. 2013;80(3):289-292. Thomas J, Lamb D, Ashcroft T, et al. How reliable is the diagnosis of lung cancer using small biopsy specimens? Report of a UKCCCR Lung Cancer Working Party. Thorax. 1993; 48(11):1135-1139. Thunnissen E, Boers E, Heideman DA, et al. Correlation of immunohistochemical staining p63 and TTF-1 with EGFR and K-ras mutational spectrum and diagnostic reproducibility in non small cell lung carcinoma. Virchows Arch. 2012;461(6):629-638. (a) Thunnissen E, Bubendorf L, Dietel M, et al. EML4-ALK testing in non-small cell carcinomas of the lung: a review with recommendations. Virchows Arch 2012;461(3):245-257. (b) Shinmura K, Kageyama S, Tao H, et al. EML4-ALK fusion transcripts, but no NPM-, TPM3-, CLTC-, ATIC-, or TFG-ALK fusion transcripts, in non-small cell lung carcinomas. Lung Cancer. 2008;61(2):163-169. Thunnissen E, Kerr KM, Bubendorf L, et al. External quality assessment for ALK immunohistochemistry testing in lung adenocarcinoma within the European Thoracic Oncology Platform Lungscape Project. Ann Oncol. 2012;23(suppl 9):2932. (c) Sholl L, Weremowicz S, Gray SW, et al. Combined use of ALK immunohistochemistry and FISH for optimal detection of ALK-rearranged lung adenocarcinomas. J Thorac Oncol. 2013;8(3):322-328. Thunnissen E, Kerr KM, Herth FJ, et al. The challenge of NSCLC diagnosis and predictive analysis on small samples. Practical approach of a working group. Lung Cancer. 2012;76(1):1-18. (d) 73 REFERENCIAS To KF, Tong JH, Yeung KS, et al. Detection of ALK rearrangement by immunohistochemistry in lung adenocarcinoma and the identification of a novel EML4-ALK variant. J Thorac Oncol. 2013;8(7):883-891. Wong D, Leung EL, So KK, et al. The EML4-ALK fusion gene is involved in various histologic types of lung cancers from nonsmokers with wild-type EGFR and KRAS. Cancer. 2009;115(8):1723-1733. Togashi Y, Soda M, Sakata S, et al. KLC1-ALK: a novel fusion in lung cancer identified using a formalin-fixed paraffinembedded tissue only. PLoS One. 2012;7:e31323. Wu S, Kuo YY, Chang YL, et al. EML4-ALK translocation predicts better outcome in lung adenocarcinoma patients with wildtype EGFR. J Thorac Oncol. 2012;7(1):98-104. Travis W, Brambilla E, Noguchi M, et al. International Association for the Study of Lung Cancer/American Thoracic Society/ European Respiratory Society international multidisciplinary classification of lung adenocarcinoma. J Thorac Oncol. 2011; 6(2):244-285. Yang P, Kulig K, Boland JM, et al. Worse disease-free survival in never-smokers with ALK+ lung adenocarcinoma. J Thorac Oncol. 2012;7(1):90-97. Travis W, Brambilla E, Noguchi M, et al. Diagnosis of lung cancer in small biopsies and cytology: implications of the 2011 International Association for the Study of Lung Cancer/ American Thoracic Society/European Respiratory Society classification. Arch Pathol Lab Med. 2013;137(5):668-684. Tsao M, Craddock K, Brandao G, et al. Canadian ALK (CALK): A pan-Canadian multicenter study to optimize and standardize ALK immunohistochemistry (IHC) and fluorescence in situ hybridization (FISH) for ALK gene rearrangements. J Clin Oncol. 2013;31(May 20 Supplement):8096. V Laffert M, Warth A, Penzel R, et al. Anaplastic lymphoma kinase (ALK) gene rearrangement in non-small cell lung cancer (NSCLC): results of a multi-centre ALK-testing. Lung Cancer. 2013;81:200-206. van Krieken J, Normanno N, Blackhall F, et al. Guideline on the requirements of external quality assessment programs in molecular pathology. Virchows Arch. 2013;462:27-37. Wang R, Hu H, Pan Y, et al. RET fusions define a unique molecular and clinicopathologic subtype of non-small-cell lung cancer. J Clin Oncol. 2012;30:4352-4359. (a) Wang R, Pan Y, Li C, et al. The use of quantitative real-time reverse transcriptase PCR for 5’ and 3’ portions of ALK transcripts to detect ALK rearrangements in lung cancers. Clin Cancer Res. 2012;18(4725-4732. (b) Yi E, Boland JM, Maleszewski JJ, et al. Correlation of IHC and FISH for ALK gene rearrangement in non-small cell lung carcinoma: IHC score algorithm for FISH. J Thorac Oncol 2011;6:459-465. Yi E, Chung JH, Kulig K, Kerr KM. Detection of anaplastic lymphoma kinase (ALK) gene rearrangement in non-small cell lung cancer and related issues in ALK inhibitor therapy: a literature review. Mol Diagn Ther. 2012;16:143-150. Yoshida A, Tsuta K, Nitta H, et al. Bright-field dual-color chromogenic in situ hybridization for diagnosing echinoderm microtubule-associated protein-like 4-anaplastic lymphoma kinase-positive lung adenocarcinomas. J Thorac Oncol. 2011;6(10):1677-1686. (a) Yoshida A, Tsuta K, Watanabe S, et al. Frequent ALK rearrangement and TTF-1/p63 co-expression in lung adenocarcinoma with signet-ring cell component. Lung Cancer. 2011;72:309315. (b) Zhang X, Zhang S, Yang X, et al. Fusion of EML4 and ALK is associated with development of lung adenocarcinomas lacking EGFR and KRAS mutations and is correlated with ALK expression. Mol Cancer. 2010;9:188. Zhang Y-G, Jin M-L, Li L, et al. Evaluation of ALK rearrangement in Chinese non-small cell lung cancer using FISH, immunohistochemistry, and real-time quantitative RT-PCR on paraffin-embedded tissues. PLOS One. 2013;8(5):e64821. Wang Z, Zhang X, Bai H, et al. EML4-ALK rearrangement and its clinical significance in Chinese patients with advanced non-small cell lung cancer. Oncology. 2012;83(5):248-256. Zhang Y, Sun Y, Pan Y, et al. Frequency of driver mutations in lung adenocarcinoma from female never-smokers varies with histologic subtypes and age at diagnosis. Clin Cancer Res. 2012;18(7):1947-1953. Werner M, Chott A, Fabiano A, Battifora H. Effect of formalin tissue fixation and processing on immunohistochemistry. Am J Surg Pathol. 2000;24(7):1016-1019. Zhou J, Yang H, Deng Q, et al. Oncogenic driver mutations in patients with non-small-cell lung cancer at various clinical stages. Ann Oncol. 2013;24(5):1319-1325. Wolff A, Hammond ME, Schwartz JN, et al. American Society of Clinical Oncology/College of American Pathologists guideline recommendations for human epidermal growth factor receptor 2 testing in breast cancer. Arch Pathol Lab Med. 2007;131(1):18-43. China (HK) Japón Japón España China Japón Jokoji et al., 2010 Sakairi et al., 2010 Salido et al., 2010 Sun Y et al., 2010 Takahashi et al., 2010 IHC/FISH Corea EEUU Paik et al., 2011 Yi et al., 2011 FISH/IHC RACE/ RT-PCR Zhang X et al., 2010 China RT-PCR/Direct Seq RT-PCR FISH/IHC IHC/FISH & RT-PCR IHC RT-PCR 101 735 103 313 52 107 109 254 266 130 141 Wong et al., 2009 IHC/RT-PCR & FISH FISH IHC/FISH Japón 335 IHC/FISH/RT-PCR Takeuchi et al., 2009 EEUU Boland et al., 2009 340 RT-PCR/FISH/ Gen Seq EEUU Japón Takeuchi et al., 2008 77 603 RT-PCR/Gen Seq FISH/RT-PCR Shaw et al., 2009 Japón Shinmura et al., 2008 305 358 EEUU/Suiza Perner et al., 2008 RT-PCR 75 103 120 EEUU/Corea Koivunen et al., 2008 RT-PCR RT-PCR EEUU Japón Soda et al., 2007 Rodig et al., 2009 China Rikova et al., 2007 No. de CPCNP* Martelli et al., 2009 Italia/España RT-PCR/FISH/IHC País Estudio Plataforma de Pruebas 10 (9,9%) 28 (3,8%) 12 (11,7%) 5 (1,6%) 3 (5,8%) 3 (2,8%) 7 (6,4%) 8 (3,1%) 13 (4,9%) 4 (3,1%) 19 (13,5%) 20 (5,6%) 9 (7,5%) 6 (1,8%) 11 (3,2%) 2 (2,6%) 16 (2,7%) 8 (2,6%) 5 (6,7%) 4 (4%) No. (%) ALK+ - 20 (5,6%) 3 (4,8%) 5 (2,7%) 11 (4,3%) 2 (4,0%) - 8 (3,8%) 2 (10,0%) 101 395 62 211 52 69 82 254 209 130 10 (9,9%) 27 (6,8%) 10 (16,1%) 5 (2,4%) 3 (5,8%) 3 (4,3%) 7 (8,5%) 8 (3,1%) 11 (5,3%) 4 (3,1%) 130 18 (12,8%) 358 63 185 253 50 - 208 20 - 0 292 29 75 0 30 18 0 34 0 2 0 48 150 71 20 - 88 11 - 0 0 2 (6,9%) 0 0 0 0 0 0 0 0 0 4 (8,3%) 1 (0,7%) 0 0 - 0 1 (9,1%) - 0 0 0 0 0 0 0 0 0 0 4 0 2 0 7 3 - 9 2 0 0 0 0 0 0 0 0 0 0 1 (25%) 0 2 (100%) 0 0 0 - 0 0 - No. No. de No. (%) No. de No. (%) ADSC/ No (%) ADC ALK+ CCE ALK+ ASC ALK+ 0 48 12 27 0 8 9 0 23 0 5 0 7 0 9 4 - 0 42 - No. CPCNP, Otros 0 1 (2,1%) 0 0 0 0 0 0 2 (8,7%) 0 0 0 0 0 0 0 - 0 0 - No. (%) ALK+ 0 0 0 0 0 0 0 0 0 0 0 0 0 0 24 0 - 0 0 - 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 - 0 0 - No fumadores con adenocarcinoma No fumadores No fumadores/ fumador ocasional, asiáticos, mujeres NE Ca incluye CPCP + CNECG No. No (%) Selección de NE Ca ALK+ Pacientes Resumen de estudios publicados sobre las pruebas de reordenamiento del gen ALK en cáncer de pulmón Anexo 1 Atlas de la IASLC de Pruebas de ALK en Cáncer de Pulmón 74 China (HK) China China To et al., 2013 Zhang Y-G et al., 2013 Zhou et al., 2013 ARMS RT-PCR RT-PCR/IHC/FISH IHC/FISH/RT-PCR IHC/FISH IHC/FISH FISH/IHC 239 15 (6,3%) 28 (5,7%) 20 (4,2%) 22 (5,9%) 12 (6,5%) 32 (12,8%) 7 (7,1%) 7 (3,4%) 75 (4,4%) 15 (4,3%) 34 (11,3%) 39 (34%) 11 (9,7%) 8(7,8%) 25 (9,7%) 31 (3,8%) 29 (6,6%) 10 (6,0%) 49 (3,7%) 39 (34%) 10 (10,5%) 5 (6,2%) 17 (9,3%) 30 (4,2%) 29 (6,6%) 9 (7,4%) - 10 (7,7%) 349 341 373 186 - 79 95 - 349 25 (7,2%) 19 (2,6%) 22 (5,9%) 12 (6,5%) - 5 (6,3%) 6 (6,3%) - 15 (4,3%) 300 34 (11,3%) 116 95 73 182 713 441 121 - 130 101 112 0 - 7 96 - 0 0 0 18 14 0 52 0 46 - 97 2 (2,0%) 0 0 - 0 0 - 0 0 0 1 (5,6%) 1 (7,1%) 0 1 (1,9%) 0 1 (0,2%) - 4 (4,1%) 12665 662 (5,2%) 6775 444 (6,6%) 1411 18 (1,3%) 488 469 373 186 249 99 208 1683 349 300 116 113 102 258 811 441 167 1387 - 78 18 4 0 - 0 7 - 0 0 0 0 14 0 8 0 0 - - 7 (9,0%) 1 (5,6%) 0 0 - 0 1 (14,3%) - 0 0 0 0 2 (14,3%) 0 0 0 0 - 376 20 12 0 - 13 10 - 0 0 0 0 1 76 38 0 0 - 12 17 (4,5%) 0 1 (8,3%) 0 - 2 (15,4%) 0 - 0 0 0 0 0 8 (10,5%) 0 0 0 - 1 (8,3%) 28 0 0 0 - 0 0 - 0 0 0 0 0 4 0 0 0 - 0 0 0 0 0 - 0 0 - 0 0 0 0 0 0 0 0 0 - 0 Mujeres no fumadoras No fumadores EGFR de tipo nativo, derrame pleural Mujeres,no fumadoras/fumador ocasional, y/o adeno-carcinoma EGFR de tipo nativo o falta de respuesta a TKI para EGFR anterior * Excluye cáncer neuroendocrino (NE Ca); CPCNP= carcinoma de pulmón de células no pequeñas, ADC= adenocarcinoma, CCE=carcinoma de células escamosas, ADS=mezcla adenocarcinoma/ carcinoma de células escamosas, CPCP=carcinoma de pulmón de células pequeñas CNECG=carcinoma neuroendocrino de células grandes, EGFR=receptor del factor de crecimiento epidérmico, TIK= inhibidores de la tirosina cinasa, RT-PCR = reacción en cadena de la polimerasa con transcriptasa inversa, FISH= fluorescencia de hibridación in situ, Gen seq=secuenciación genética, IHC=inmunohistoquímica, RACE= amplificación rápida de los extremos de cDNA, y ARMS= amplificación refractaria de sistemas de mutaciones. Total EEUU EEUU Minca et al., 2013 Sholl et al., 2013 España Martinez et al., 2013 RT-PCR/IHC FISH EEUU China Gainor et al., 2013 RACE-PCR Zhang Y et al., 2012 China Li Y et al., 2013 IHC/FISH EEUU RT-PCR Yang et al., 2012 China Shaozhang et al., 2012 IHC/FISH RT-PCR/FISH Corea Park et al., 2012 RT-PCR/IHC/FISH Taiwan Japón Murakami et al., 2012 IHC/FISH RT-PCR Wu et al., 2012 Francia McLeer-Florin et al., 2012 FISH/IHC Corea Jin et al., 2012 RACE-PCR FISH Wang Z et al., 2012 China China EEUU An et al., 2012 Dai et al., 2012 ANEXO 1 75 76 Atlas de la IASLC de Pruebas de ALK en Cáncer de Pulmón Anexo 2 Guía de pruebas moleculares propuestas por CAP/IASLC/AMP para la selección de pacientes con cáncer de pulmón elegibles para el tratamiento con inhibidores de la yirosina cinasa para EGFR y ALK Resumen de las recomendaciones Sección I. ¿Cuándo se deben realizar las pruebas Mmoleculares de cáncer de pulmón? Pregunta 1. ¿En qué pacientes se deberían realizar las pruebas de mutaciones del EGFR y reordenamiento del Gen ALK? 1.1a: Recomendación: La prueba molecular de EGFR se debe utilizar para seleccionar a los pacientes para la terapia dirigida con inhibidores de la tirosina cinasa del EGFR, y los pacientes con adenocarcinoma de pulmón no deben ser excluidos de la prueba debido a las características clínicas. 1.1b: Recomendación: La prueba molecular de ALK se debe utilizar para seleccionar a los pacientes para la terapia dirigida con inhibidores de la tirosina cinasa del ALK, y los pacientes con adenocarcinoma de pulmón no deben ser excluidos de la prueba debido a las características clínicas. 1.2: Recomendación: En el caso de muestras de cáncer de pulmón resecado, se recomiendan las pruebas EGFR y ALK para los adenocarcinomas y cánceres de pulmón mixtos con un componente de adenocarcinoma, sin importar el grado histológico. En el caso de muestras de cáncer de pulmón totalmente extirpadas, no se recomiendan las pruebas de EGFR y de ALK en cáncer de pulmón que carece de cualquier componente de adenocarcinoma, como por ejemplo el carcinoma “puro” de células escamosas, el carcinoma de células pequeñas “puro”, o carcinoma de células grandes carentes de evidencia inmunohistoquímica (IHC) de diferenciación de adenocarcinoma. 1.3: Recomendación: En el caso de las muestras de cáncer de pulmón más limitadas (biopsias, citologías), donde un componente de adenocarcinoma no puede excluirse totalmente, las pruebas EGFR y ALK se pueden realizar en casos que muestran una histología escamosa o de células pequeñas, pero los criterios clínicos (por ejemplo, edad jóven, ausencia de historial de tabaquismo) pueden ser útiles en la selección de un subgrupo de estas muestras para la prueba. 1.4: Recomendación: Los tumores primarios o lesiones metastásicas son igualmente adecuados para determinar el estado de EGFR y ALK para la selección del tratamiento inicial. 1.5: Opinión consensuada de los expertos: Para los pacientes con múltiples, aparentemente separados, adenocarcinomas de pulmón primarios, cada tumor puede ser examinado pero no es necesario examinar múltiples zonas diferentes dentro de un mismo tumor. Pregunta 2. ¿Cuándo se debe examinar la mutación EGFR o el reordenamiento ALK en una muestra de un paciente? 2.1a: Recomendación: Las pruebas de mutación del EGFR se deben pedir en el momento del diagnóstico en los pacientes que presentan un estadio avanzado de la enfermedad (estadio IV de acuerdo con la séptima edición del sistema de estadificación TNM) y que son aptos para la terapia o en el momento de la recidiva o progresión en los pacientes que originalmente tuvieron la enfermedad en estadios bajos, pero que no fueron examinados previamente. 2.1b: Sugerencia: La prueba de reordenamiento del ALK debe solicitarse en el momento del diagnóstico en los pacientes que presentan enfermedad en estadio avanzado (estadio IV de acuerdo con la séptima edición del sistema de estadificación TNM) y que son aptos para la terapia o en el momento de la recidiva o progresión en los pacientes que originalmente tuvieron la enfermedad en estadios bajos, pero que no fueron examinados previamente. 77 ANEXO 2 2.2a: 2.2b: 2.3: Opinión consensuada de los expertos: se recomienda realizar las pruebas de EGFR en los tumores en el momento del diagnóstico en pacientes con estadio I, II o III, pero la decisión de hacerlo debe tomarse localmente por cada laboratorio, en colaboración con su equipo de oncología. Opinión consensuada de los expertos: se recomienda realizar las pruebas de ALK en los tumores al momento de diagnóstico en pacientes con estadio I, II o III, pero la decisión de hacerlo debe tomarse localmente por cada laboratorio, en colaboración con su equipo de oncología. Recomendación: Debe priorizarse el tejido para las pruebas EGFR y ALK. Pregunta 3. ¿Cuán rápido deberían estar disponibles los resultados de las pruebas? 3.1: Opinión consensuada de los expertos: Los resultados de las pruebas EGFR y ALK deberían estar disponibles en 2 semanas (10 días laborables) desde la recepción de la muestra en el laboratorio de pruebas. 3.2: Opinión consensuada de los expertos: Los laboratorios con tiempos medios de respuesta de más de 2 semanas tienen que poner a disposición una prueba más rápida—ya sea interna o a través de un laboratorio de referencia—en casos de urgencia clínica. 3.3: Opinión consensuada de los expertos: los departamentos de laboratorio deben establecer procesos para asegurarse que los especímenes que tienen un diagnóstico histopatológico definitivo se envíen a laboratorios externos de patología molecular dentro de los 3 días hábiles siguientes a la recepción de solicitudes y a laboratorios de patología molecular internos en 24 horas. Sección II. ¿Cómo se deben realizar las pruebas de EGFR? Pregunta 4. ¿Cómo se deben procesar las muestras para las pruebas de mutación EGFR? 4.1: Opinión consensuada de los expertos: los patólogos deben utilizar, muestras fijadas en formol e incluidas en parafina (FFPE) o especímenes frescos, congelados, o fijados en alcohol para pruebas de mutaciones EGFR basados en la PCR. Se deben evitar otros tratamientos de tejidos (por ejemplo fijadores ácidos o de metales pesados o soluciones descalcificantes) en las muestras destinadas a las pruebas de EGFR. 4.2: Opinión consensuada de los expertos: las muestras citológicas también son adecuados para las pruebas EGFR y ALK. Los bloques celulares son preferibles a las preparaciones de frotis. Pregunta 5. ¿Qué requisitos deben cumplir las muestras para las pruebas de EGFR? 5.1: Opinión consensuada de los expertos: Los patólogos deben determinar la idoneidad de las muestras para las pruebas de EGFR mediante la evaluación del contenido de células cancerígenas y la cantidad y calidad del DNA. 5.2: Opinión consensuada de los expertos: Cada laboratorio debe establecer el porcentaje y el número de células cancerígenas mínimas necesarias para la detección de mutaciones durante la validación. 5.3: Opinión consensuada de los expertos: Un patólogo debe evaluar el contenido del tumor de cada espécimen y, o bien, realizar microdisecciones para enriquecer la muestra en células tumorales (según sea necesario) o supervisar a un técnico capacitado para que las realice. Pregunta 6. ¿Cómo se debe realizar la prueba EGFR? 6.1: Recomendación: Los laboratorios pueden usar cualquier método validado de análisis EGFR con características de rendimiento suficientes. 6.2: Opinión consensuada de los expertos: Los laboratorios deben utilizar métodos de prueba de EGFR capaces de detectar mutaciones en las muestras con al menos un 50% de contenido de células cancerígenas, aunque se recomienda encarecidamente a los laboratorios utilizar (o tener a su disposición en un laboratorio de referencia externa) pruebas más sensibles capaces de detectar mutaciones en muestras con sólo 10% de células cancerígenas. 78 Atlas de la IASLC de Pruebas de ALK en Cáncer de Pulmón 6.3: Opinión consensuada de los expertos: las pruebas clínicas de mutación EGFR deben ser capaces de detectar todas las mutaciones individuales que se han descrito con una frecuencia de al menos el 1% de los adenocarcinomas de pulmón con una mutación en el gen EGFR. 6.4: Recomendación: No se recomienda la inmunohistoquímica del EGFR total para la selección de la terapia con TKI para EGFR. 6.5: Recomendación: No se recomienda el análisis del número de copias del gen EGFR (es decir, FISH o CISH) para la selección de la terapia con TKI para EGFR. Pregunta 7. ¿Cuál es la función del análisis del gen KRAS en la selección de pacientes para la terapia dirigida con TKI para EGFR? 7.1: Recomendación: las pruebas de mutación KRAS no se recomiendan como un único factor determinante de la terapia TKI para EGFR. Pregunta 8. Qué otras consideraciones importantes hay que Ttener en cuenta en caso de encontrar resistencia secundaria o adquirida a los TKI para EGFR? 8.1: Recomendación: Si un laboratorio realiza pruebas en muestras de pacientes con resistencia adquirida a los inhibidores de cinasa del EGFR, dichas pruebas deben ser capaces de detectar la mutación secundaria EGFR T790M en tan sólo 5% de las células. Sección III. ¿Cómo se debe realizar la prueba de ALK? Pregunta 9. ¿Qué métodos deben utilizarse para las pruebas de ALK? 9.1: Recomendación: Los laboratorios deben utilizar el ensayo FISH de ALK utilizando sondas break- apart doblemente marcadas para la selección de pacientes para terapia con TKI para ALK. Si se valida cuidadosamente la inmunohistoquímica del ALK, ésta puede ser considerada como una metodología de cribaje para seleccionar muestras para las pruebas FISH de ALK. 9.2: Recomendación: La RT -PCR no se recomienda como una alternativa a la prueba FISH para la selección de pacientes para la terapia de inhibidores de ALK. 9.3: Opinión consensuada de los expertos: Un patólogo debería participar en la selección de cortes para la prueba FISH de ALK evaluando la arquitectura del tumor, la citología y la calidad de la muestra. 9.4: Opinión consensuada de los expertos: Un patólogo debería participar en la interpretación de las imágenes de la prueba FISH de ALK, ya sea mediante la realización de análisis directamente o mediante la revisión de las interpretaciones de citogenetistas o técnicos con capacitación especializada en el análisis FISH de los tumores sólidos. 9.5: Opinión consensuada de los expertos: Hoy en día no se requieren pruebas para mutaciones secundarias en ALK asociado con resistencia adquirida a los inhibidores de ALK para la gestión clínica. Sección IV. ¿Se deben examinar rutinariamente otros genes en el adenocarcinoma de pulmón? Pregunta 10. ¿Existen otros marcadores moleculares adecuados para el análisis en el cáncer de pulmón? 10.1a: Recomendación: Las pruebas de EGFR deben ser prioritarias sobre otros marcadores moleculares en el adenocarcinoma de pulmón. 10.1b: Sugerencia: Después de las pruebas de EGFR, las pruebas de ALK deben tener prioridad sobre otros marcadores moleculares propuestos en el adenocarcinoma de pulmón, ya que en el momento presente, la evidencia publicada es insuficiente para respaldar el desarrollo de guías para su análisis. 79 ANEXO 2 Sección V. ¿Cómo se deben implementar y poner en marcha los análisis moleculares en el adenocarcinoma de pulmón? Pregunta 11. ¿Se tienen que analizar todos los adenocarcinomas tanto con la prueba del EGFR como con la de ALK? 11.1: Opinión consensuada de los expertos: Los laboratorios pueden implementar algoritmos de pruebas para mejorar la eficacia de las pruebas moleculares de los adenocarcinomas de pulmón, siempre que se cumplan los requisitos generales de tiempo de respuesta. Pregunta 12. ¿Cómo se deben describir los resultados de EGFR y ALK? 12.1: Opinión consensuada de los expertos: los informes de los análisis de mutación del gen EGFR y FISH de ALK deben incluir una sección de resultados y de interpretación que sea de fácil comprensión para los oncólogos y patólogos no especializados. Pregunta 13. ¿Cómo se deben validar los análisis de EGFR y ALK? 13.1: Opinión consensuada de los expertos: La validación de los análisis de EGFR y ALK debe seguir las mismas pautas que los otros diagnósticos moleculares y pruebas de FISH. Pregunta 14. ¿Cómo se mantendrá la garantía de calidad? 14.1: Opinión consensuada de los expertos: Los laboratorios deben seguir un control similar de calidad, así como de garantía de calidad y procedimientos para las pruebas EGFR y ALK en cáncer de pulmón al igual que para otros ensayos de laboratorio clínico. En particular, los laboratorios que realizan pruebas de EGFR y ALK para la terapia con TKI deben contar con pruebas de capacitación, si están disponibles. Abreviaturas: CISH, hibridación in situ cromogénica; EGFR, receptor del factor de crecimiento epidérmico; FISH, hibridación in situ fluorescente; PCR, reacción en cadena de la polimerasa; RT-PCR, retrotranscriptasa- reacción en cadena de la polimerasa; TKI, inhibidor de la tirosina cinasa; TNM, tumor, nódulo y metástasis. . Reproducido, con permiso de, Lindeman NI, Cagle PT, Beasley MB, et al. “Molecular testing guideline for selection of lung cancer patients for EGFR and ALK tyrosine kinase inhibitors” (Guía de pruebas moleculares para la selección de pacientes con cáncer de pulmón para los inhibidores de la tirosina cinasa de EGFR y ALK: Guía del CAP, IASLC y AMP. J Thorac Oncol 2013;8:823-859. IASLC acknowledges the generous funding and support provided by Pfizer Oncology for this ALK Atlas project. www.iaslc.org