HALUROS DE ALQUILO - q
Anuncio
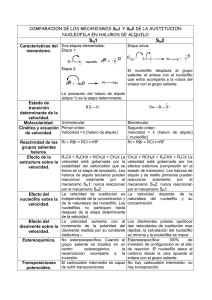
LLUMIQUINGA FAUSTO QUINTANA CRISTIAN SUQUILLO TOMÁS Derivados de los Hidrocarburos(alcanos) Enlace polar(polarizado hacia el halógeno) Halógeno unido a un carbono sp3 Existen 2 tipos de fuerzas intermoleculares las fuerzas de London y la atracción dipolodipolo(del enlace C-X). Puntos de ebullición altos. Insolubles en agua debido a que no son líquidos asociados. Haluros de bromo y yodo son más densos que el agua, y los de fluor y cloro menos densos. Sustitución vía radicales libres (halogenación radicalaria):X2/hʋ Adición, a partir de alquenos y alquinos con tratamiento de: HX (Markovnikov); HX/peróxidos (anti-Markovnikov); X2/Cl4C Sustitución nucleofílica, de: HX/H+; PX3 u otros a partir de alcoholes con tratamiento •Intervención de sustituciones nucleofílicas: Formación de alcoholes Intercambio de haluros Síntesis de éteres de Williamson Síntesis de aminas Síntesis de nitrilos Síntesis de alquinos •β-Eliminaciones •Formación de reactivos organometálicos •Acoplamiento de reactivos organocúpricos •Reducción Mecanismo Sustrato SN1 SN1-E1 E1 SN2 SN2-E2 E2 Grupo Saliente El sustrato debe ser un halogenuro de alquilo terciario y secundario de sustituyentes grandes. El sustrato debe tener un átomo de carbono electrofílico con un buen grupo saliente. El sustrato debe ser metílico, primario y secundario de sustituyentes pequeños. Solvente Debe ser una base débil, muy estable después de desprenderse, llevándose el par de electrones con el que estaba unido al carbono. Aceptor de electrones, para polarizar al átomo de carbono. Polarizable, para estabilizar el estado de transición. Estable una vez que ha salido, es decir bases débiles. Nucleófilo débil. Base débil. Solventes polares apróticos. En algunas ocasiones el mismo nucleófilo actúa como solvente. Nucleófilos fuertes. Solventes muy polares. Nucleófilo o base La polaridad del solvente no es de mucha importancia. La base debe ser necesariam ente fuerte. En el paso 2 el carbocatión puede: •Combinarse con un nucleófilo. •Transponerse a un carbocatión mas estable. •Eliminar un protón para generar un alqueno. SSN2 E2 Si se usa un nucleófilo débilmente básico en un solvente polar aprótico, predomina las sustitución S N 2; con una base fuerte, como los alcóxidos prevalece la eliminación E2. Aquí también existe cambio de configuración, La velocidad de la reacción S N 1 es proporcional solo a la concentración del haluro de alquilo. La E1 la de velocidad de la reacción es proporcional solo a concentración del haluro alquilo. La velocidad de la reacción S N 2 es proporcional tanto a la concentración del haluro de alquilo como del nucleófilo. La velocidad de la reacción E2 es proporcional tanto a la concentración del haluro de alquilo como del nucleófilo. Libros: Wade, L.G Jr, Química Orgánica, Quinta Edición, Cap:6. Morrison, Química Orgánica, Quinta Edición; Pags: 165-212 Mcmurry, John, Química Orgánica, Séptima Edición, Pag:424 Páginas Web’s http://www.bolivar.udo.edu.ve/quimica/quimicaorganica/reaccione s/eliminacion.html http://es.wikipedia.org/wiki/Halogenuros_de_alquilo http://www.rena.edu.ve/cuartaEtapa/quimica/Tema14.html