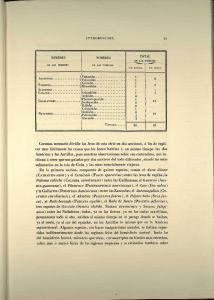
Estudio de las variaciones en las microbandas de calcificación de
Anuncio

Lic. Marcia Nashieli Ramos Salcedo Dr. Carlos Cáceres Martínez, Dr. Jorge Iván Cáceres Puig XX CONGRESO NACIONAL DE CIENCIA Y TECNOLOGIA DEL MAR Introducción Durante los últimos 15 años en Baja California Sur y Sonora el cultivo comercial de Pteria sterna o concha nácar, se realiza, dependiendo de la colecta de semillas del medio natural. Los estudios de crecimiento y supervivencia de estas semillas son fundamentales para asegurar el futuro de esta actividad Periostractum periostractum Las conchas de los Pteridos está recubierta de nácar iridiscente con capacidad de producir perlas en forma natural, están compuestas por dos elementos, en capas alternadas: 1. Matriz orgánica (proteína principalmente conquiolina, y glicoproteínas diversas) 2. Matriz inorgánica (carbonato de calcio, cristalizado como calcita y aragonita). Estos depósitos pueden observarse en forma de microbandas en cortes de conchas de juveniles. Coan y Vallentichs-Scott, 2012 Objetivo General Estudiar las variaciones en las microbandas de crecimiento de juveniles de Pteria sterna colectados en la Bahía de La Paz, Baja California Sur, México. Particular Determinar la edad de los juveniles de Pteria sterna colectados a partir del conteo de microbandas de crecimiento en las conchas. 2. Determinar la variabilidad en el alto de las microbandas 3. Estudiar la relación de las microbandas de crecimiento con la Clorofila “a”, seston, y su composición de proteínas, carbohidratos y lípidos, así como la temperatura. 1. UABCS Perlas del Cortez CIBNOR Materiales y Métodos Los juveniles de P. sterna fueron colectados en dos periodos diciembre del 2008-abril 2009 y abril-julio del 2009, en 10 estaciones en la Bahía de La Paz. Colecta Los juveniles de P. sterna fueron colectados usando bolsas de malla de plástico colocadas a 4, 7, 12 y 20 m de profundidad. T°C Termógrafo in situ (Onset Optic Base Station Termograf), en intervalos de una hora. Clorofila “a” fotografías satelitales (frecuencia de registro de tres días) (Ocean color), usando el protocolo desarrollado por CICESE (Dr. Eduardo González Rdz.) PIM, POM y SESTON por muestreo de 2 l de agua de mar (cuadruplicado) protocolo Luna-González el al. 2000 Análisis químicos sobre filtrado de agua de mar 2/l en filtro de vidrio: • Carbohidratos Dubois et al. (1956), modificado por Malara y Charra (1972). • Lípidos Bligh y Dyer (1958) • Proteínas Lowry et al., (1951) Los Juveniles después de ser secados Fueron Medidos en su longitud y altura Las conchas fueron cortadas en su eje anteroposterior, desde el umbo hasta el margen de la concha usando una cortadora de diamante. Los cortes fueron pulidos y fijados en portaobjetos utilizando cianocrilato. Los cortes fijados fueron observados bajo un microscopio óptico para la identificación de las microbandas de crecimiento. Identificación y medición de microbandas de crecimiento Microbandas de crecimiento 200x 100x Las microbandas de crecimiento fueron identificadas por medio del programa analizador de imágenes (ImagePro©) con una precisión de 0.0001 µm (82 cortes con 110 bandas en promedio medidas en cada organismo) Resultados La temperatura del agua de mar fue registrada con el termógrafo de manera continua desde el mes de enero a abril del 2009, se observa las típicas temperaturas de invierno hasta finales de febrero cuando se aprecia un ligero aumento (1.5 °C) relacionado con el inicio de la primavera. 22.5 Temperatura C° 22 21.5 21 20.5 20 Fecha de muestreo Parámetros ambientales Encontramos que los valores más altos de la concentración de Clorofila “a” se presentan en enero y mayo correspondiente a invierno-primavera y los valores más bajos los encontramos en agosto y en septiembre correspondientes a verano-otoño. 10.0 9.0 6.9 mg/m³ Clorofila “a” mg/m³ 8.0 6.8 mg/m³ 7.0 6.0 5.0 4.0 3.0 0.8 mg/m³ 2.0 1.0 0.0 E F M A M J J A S O N D Meses de muestreo Martínez et al, 2001 Se obtuvieron 82 cortes de ambos periodos de colecta. Se fotografió la concha de 40 juveniles del muestro 4 (M4) en el periodo de diciembre del 2008 hasta abril del 2009 y 42 juveniles del muestreo 5 (M5) en el periodo de abril a julio del 2009. Longitud de microbandas de crecimiento en µm Se contaron y midieron las microbandas de crecimiento de 8 juveniles del M4 y 12 del M5. 150.0 140.0 130.0 120.0 110.0 100.0 90.0 80.0 70.0 60.0 50.0 40.0 1 5 9 13 17 21 25 29 33 37 41 45 49 53 57 61 65 69 73 77 81 85 89 93 97 101 105 109 113 117 121 125 129 133 137 Número de bandas de crecimiento Juvenil de P. sterna en el muestreo 4 (M4) (17/12/2008-08/04/2009 de una longitud de 40.9 y alto de 37.3 mm. Cáceres-Puig et al., (2011) Seston POM PIM 70.0 60.0 62-64 mg/L mg/L 50.0 40.0 30.0 28-30 mg/L 20.0 10.0 2-3 mg/L 0.0 Enero Febrero Mayo Julio Agosto Diciembre 2009 Luna-González et al, 2000 710.3 µg/L 46.6 µg/L 14.6 µg/L 98.8 µg/L 31.1 µg/L 287.3 µg/L La altura de las microbandas para los últimos 30 días de permanencia en el agua de todos los individuos estudiados en los muestreos 4 y 5, fueron comparadas usando un análisis de varianza, encontrando diferencias significativas en la altura promedio de las microbandas por individuo Grados Promedio de de los libertad cuadrados Origen de las Muestreo M4 variaciones Altura promedio 85.7±17.3 Entre grupos 47269.242 8 5908.65 Dentro de los grupos 78605.70 261 301.17 Total= 125874.94 269 Origen de las variaciones Suma de cuadrados Entre grupos 15364.48 11 1396.77 Dentro de los grupos 73538.07 348 211.32 Total= 88902.55 359 Muestreo M5 84.6±15.1 Suma de cuadrados Grados Promedio de de los libertad cuadrados F 19.62 F 6.61 Valor Nivel de Probabilidad crítico para Significancia F 4.40E-23 1.97 Valor Probabilida crítico para d F 4.79E-10 1.82 S Nivel de Significancia S S Al realizar la comparación múltiple (LSD 95%) de las longitudes individuales, constatamos que existe una alta heterogeneidad en la respuesta de altura de microbandas de crecimiento, para las que el valor promedio fue de: 84.4±17.8 µm de altura Lo que significa una variabilidad de Pearson del 22% Para los juveniles de Pteria sterna La edad promedio de los individuos estudiados considerando que cada microbanda corresponde a un día de edad fue de 110 días. n=2,276 microbandas medidas Correlación entre los parámetros ambientales y la altura de las microbandas de crecimiento Al realizar las correlaciones directas día con día no encontramos relación alguna por esa razón realizamos correlaciones en retroceso para cada parámetro estudiado. Buscando el valor máximo del parámetro r2 de correlación para establecer un índice de relación. Análisis de la altura de las microbandas de crecimiento La longitud de las microbandas fue correlacionada linealmente con la disponibilidad de Clorofila “a”, composición química y temperatura en 5,10,15,20,25 y 30 días anteriores a la medición. Carbohidratos Constante a=129.08 Pendiente b=0.2406 r²=0.041r y = -0.0014x + 1.7485 r² = 0.004 3 Clorofila "a" (mg/m³) Concentración de Clorofila “a” en el día 1 y día 25 después de ingerir el alimento. 2.5 2 1.5 1 0.5 0 0.0 50.0 100.0 150.0 200.0 Longitud de microbandas (µm) Clorofila “a” mg/m³ 2.5 y = -0.0088x + 2.237 2 r² = 0.1459 1.5 1 0.5 0 0.0 50.0 100.0 150.0 200.0 Clorofila a mg/m³ Longitud de microbandas (µm) 3 2.5 2 1.5 1 0.5 0 y = -0.0086x + 2.2534 r² = 0.1208 0.0 50.0 100.0 150.0 200.0 Longitud de microbandas (µm) Juvenil 24M4 del muestreo 4 (M4), se colocó en mallas de plástico el 16 de diciembre del 2008 y se sacó el 4 de abril del 2009, teniendo una longitud de 28.9 mm y un alto de 27.7 mm. 400.0 350.0 Proteína µg/l Concentración de Proteína en el día 1 y día 10 después de ingerir el alimento. 300.0 250.0 200.0 150.0 y = 0.439x + 259.12 r² = 0.0427 100.0 50.0 0.0 0.0 20.0 40.0 60.0 80.0 100.0 120.0 140.0 160.0 180.0 Longitud de microbandas (µm) Proteínas µg/l 400.0 350.0 300.0 250.0 200.0 150.0 y = 0.4523x + 266.43 r² = 0.075 100.0 50.0 0.0 0.0 20.0 40.0 60.0 80.0 100.0 120.0 140.0 160.0 180.0 Longitud de microbandas (µm) Juvenil 24M4 del muestreo 4 (M4), se colocó en mallas de plástico el 16 de diciembre del 2008 y se sacó el 4 de abril del 2009, teniendo una longitud de 28.9 mm y un alto de 27.7 mm. Concentración de Carbohidratos en el día 1 y día 10 después de ingerir el alimento. Carbohidratos µg/l 200.0 180.0 160.0 140.0 120.0 100.0 80.0 60.0 y = 0.2406x + 129.08 r² = 0.0412 40.0 20.0 0.0 0.0 Carbohidratos µg/L 200.0 50.0 100.0 150.0 200.0 Longitud de microbandas (µm) 180.0 160.0 140.0 120.0 100.0 80.0 y = 0.263x + 131.72 r² = 0.0803 60.0 40.0 20.0 0.0 0.0 20.0 40.0 60.0 80.0 100.0 120.0 140.0 160.0 180.0 Longitud de microbandas (µm) Juvenil 24M4 del muestreo 4 (M4), se colocó en mallas de plástico el 16 de diciembre del 2008 y se sacó el 4 de abril del 2009, teniendo una longitud de 28.9 mm y un alto de 27.7 mm. 47.0 Concentración de Lípidos en el día 1 y día 25 después de ingerir el alimento. Lípidos µg/L 46.5 46.0 45.5 45.0 44.5 44.0 y = 0.0065x + 44.151 r² = 0.0192 43.5 43.0 42.5 0.0 47.0 20.0 60.0 80.0 100.0 120.0 140.0 160.0 180.0 Longitud de microbandas (µm) 46.5 Lípidos µg/L 40.0 46.0 45.5 45.0 44.5 y = 0.0134x + 43.895 r² = 0.1347 44.0 43.5 0.0 50.0 100.0 150.0 200.0 Longitud de microbandas (µm) Juvenil 24M4 del muestreo 4 (M4), se colocó en mallas de plástico el 16 de diciembre del 2008 y se sacó el 4 de abril del 2009, teniendo una longitud de 28.9 mm y un alto de 27.7 mm. Conclusiones 1. El método de medición de microbandas en la concha de juveniles, es un método preciso para estimar la edad y el crecimiento de la especie Pteria sterna. 2. La edad promedio de los individuos estudiados fue de 110 días por lo que la aplicación del método de medición es precisa. 3. El tamaño promedio de una microbanda de crecimiento diario registrado en la concha de juveniles para la especie de Pteria sterna es de 84.3±17.8 µm de altura correspondiéndole un factor de variación porcentual del 22%. 4. La relación de las microbandas de crecimiento con el alimento disponible no tiene una relación directa día a día, sino que se ve relacionada la concentración de Clorofila “a”, y el contenido de Proteínas, Carbohidratos y Lípidos del POM en suspensión de 10 hasta 30 días después, esta situación la atribuimos al proceso metabólico del alimento disponible para los juveniles de esta especie. 5.Este método es una herramienta fiable para realizar estudios de crecimiento individual en moluscos bivalvos. Agradecemos las facilidades de laboratorios y equipos Agradecemos a la empresa Perlas de Cortes S. de R. L. M.I. Gracias Agradecemos la disposición de datos y muestras del proyecto CIBNOR a cargo del Dr. Leonardo Huato Soberanis 900-801 Agradecemos por la facilidad del programa MatLab Playa El Tecolote, verano 2011