Descarga la hoja 3 de ejercicios en PDF
Anuncio
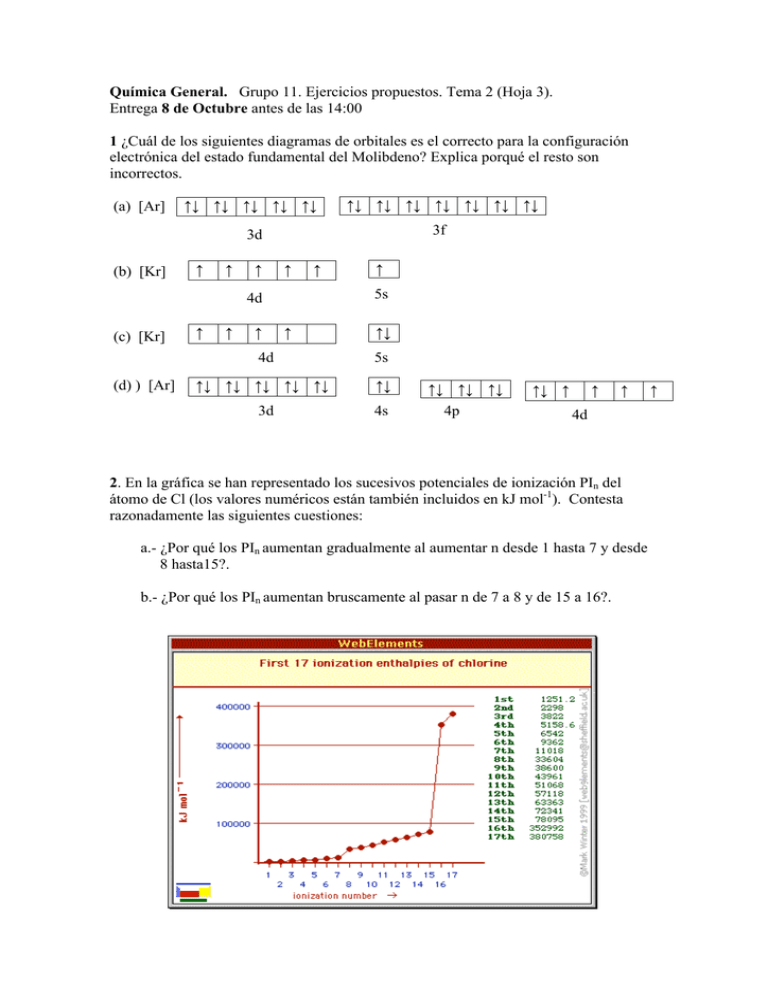
Química General. Grupo 11. Ejercicios propuestos. Tema 2 (Hoja 3). Entrega 8 de Octubre antes de las 14:00 1 ¿Cuál de los siguientes diagramas de orbitales es el correcto para la configuración electrónica del estado fundamental del Molibdeno? Explica porqué el resto son incorrectos. (a) [Ar] (b) [Kr] ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ 3d 3f ↑ ↑ ↑ ↑ ↑ 5s 4d (c) [Kr] (d) ) [Ar] ↑ ↑ ↑ ↑ ↑ ↑↓ 4d 5s ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ 3d 4s ↑↓ ↑↓ ↑↓ 4p ↑↓ ↑ ↑ ↑ 4d 2. En la gráfica se han representado los sucesivos potenciales de ionización PIn del átomo de Cl (los valores numéricos están también incluidos en kJ mol-1). Contesta razonadamente las siguientes cuestiones: a.- ¿Por qué los PIn aumentan gradualmente al aumentar n desde 1 hasta 7 y desde 8 hasta15?. b.- ¿Por qué los PIn aumentan bruscamente al pasar n de 7 a 8 y de 15 a 16?. ↑ 3. ¿Hay algún átomo para el que su segunda energía de ionización sea más pequeña que la primera? Razona tu respuesta. 4. Algunas afinidades electrónicas tienen valores positivos y otras negativos o próximas a cero. ¿Por qué no sucede esto con las energías de ionización? 5. Para los siguientes grupos de elementos, selecciona aquel que tenga la propiedad requerida: a) El átomo mayor: Mg, Mn, Mo, Ba, Bi, Br. b) La primera energía de ionización más pequeña: B, Sr, Al, Br, Mg, Pb. c) La afinidad electrónica más negativa: As, B, Cl, K, Mg, S. d) El mayor número de electrones desapareados: F, N, S2-, Mg2+, Sc3+, Ti3+. 6. El ion Na+ y el átomo de Ne son isoelectrónicos. La facilidad con que pierde un electrón un átomo gaseoso de Ne, tiene un valor de 2081 kJ/mol. La facilidad con que pierde un electrón un ion gaseoso de Na+, es 4562 kJ/mol ¿Por qué son tan distintos estos valores? 7. ¿Cuál de las siguientes configuraciones electrónicas para el P (Z=15) es la correcta? ¿Por qué son erróneas el resto? 3s 3p (a) [Ne] ↑↑ ↑ ↑ ↑ (b) [Ne] ↑↓ ↑ ↑ ↓ (c) [Ne] ↑↓ ↑ ↑ ↑ (d) [Ne] ↑↓ ↑↓ ↑











