P15 Descomposicion
Anuncio

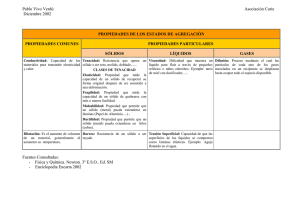
QUIMICA (63.01) TRABAJO PRACTICO N°:2 RELACCIONES DE DOBLE DESCOMPOSICION CON FORMACIÓN DE UNA FASE SOLIDA. INTEGRANTES: REACTIVOS UTILIZADOS FORMULA KCl CoCl2 Na(OH) Fe2(SO4)3 Cu(SO4) KI Na2CO3 AgNO3 NiCl2 KBr BaCl2 NOMECLATURA Cloruro de Potasio Cloruro de cobalto(II) Hidróxido de Sodio Sulfato(VI) de Hierro(III) Sulfato(VI) de Cobre(II) Ioduro de Potasio Carbonato de sodio Nitrato(V) de Plata Cloruro de Níquel(II) Bromuro de Potasio Cloruro de Bario COLOR Transparente Rosado Transparente Marrón, Anaranjado Verde Transparente Transparente Transparente Verde Transparente Transparente DESCRIPCION DE LO OBSERVADO EN EL LABOTATORIO Obtuvimos los materiales y los reactivos. Colocamos las sustancias en los tubos de ensayo (aproximadamente 2 o 3 cm3 de cada uno). Teníamos diez reacciones de doble descomposición las cuales nos tenían que dar una sustancia acuosa y otra sólida. Previamente al introducir los compuestos, observamos sus colores por separado. Las reacciones no fallaron, pero los resultados obtenidos no eran los mismos en todas las reacciones. Obtuvimos colores variados, los sólidos que se obtuvieron se pudieron divisar bien, no obtuvimos ningún gas visible y no se observo aumento de la temperatura. ECUACIONES UTILIZADAS: 1) Ec. Molecular. KCl (aq) + AgNO3 (aq) → AgCl (s) + KNO3 (aq) Ec. Ionica. K+(aq) + Cl−(Aq) + Ag+(aq) + (NO3)−(aq) → AgCl (s) + K+(aq) + (NO3)−(aq) Ec. Ionica Neta. Cl−(Aq) + Ag+(aq) → AgCl (s) 2) Ec. Molecular. Na(OH) (aq) + CoCl2 (aq) → Co(OH)2 (s) + 2NaCl (aq) Ec. Ionica. 2Na+(aq) + 2(OH)− (aq) + Co2+(aq) + 2Cl− (aq) → Co(OH)2 (s) + 2Na+ (aq) + 2Cl− (aq) Ec. Ionica Neta. 2(OH)− (aq) + Co2+ (aq) → Co(OH)2 (s) 3) Ec. Molecular. Cu(SO4)(aq) + 2Na(OH) (aq) → Cu(OH)2 (s) + Na2(SO4) (aq) Ec. Ionica. Cu2+(aq) + (SO4)2−(aq) + 2Na+(aq) + 2(OH)−(aq) → Cu(OH)2(s) + 2Na+(aq) + (SO4)2−(aq) Ec. Ionica Neta. Cu 2+ (aq) + 2(OH)− → Cu(OH)2 (s) 4) Ec. Molecular. Fe2(SO4)3 (aq) + 3Na2CO3 (aq) → Fe2(CO3)3 (s) + 3Na2SO4 (aq) Ec. Ionica. 2Fe3+ (aq) + 3(SO4)2− (aq) + 6Na+ (aq) + 3(CO3)2− (aq) → Fe2(CO3)3 (s) + 6Na+ (aq) + 3(SO4)2− (aq) Ec. Ionica Neta. 2Fe3+ (aq) + 3(CO3)2− (aq) → Fe2(CO3)3 (s) 5) Ec. Molecular. NiCl2 (aq) + 2Na(OH) (aq) → Ni(OH)2 (aq) + 2NaCl (aq) Ec. Ionica. Ni 2− (aq) + 2Cl− (aq) + 2Na− (aq) + 2(OH)− (aq) → Ni(OH)2 (s) + 2Na− (aq) + 2Cl− (aq) Ec. Ionica Neta. Ni 2− (aq) + 2(OH)− (aq) → Ni(OH)2 (s) 6) Ec. Molecular. CoCl2 (aq) + Na2CO3 (aq) → CoCO3 (s) + 2NaCl (aq) Ec. Ionica. Co2+ (aq) + 2Cl− (aq) + 2Na− (aq) + (CO3)2− (aq) → CoCO3 (s) + 2Na− (aq) + 2Cl− (aq) Ec. Ionica. Neta Co 2+ (aq) + (CO3)2− (aq) → CoCO3 (s) 7) Ec. Molecular. KI (aq) + AgNO3 (aq) → AgI (s) + KNO3 (aq) Ec. Ionica. K+ (aq) + I− (aq) + Ag+ (aq) + (NO3)− (aq) → AgI (s) + K− (aq) + (NO3)− (aq) Ec. Ionica Neta. I− (aq) + Ag+ (aq) → AgI (s) 8) Ec. Molecular. CuSO4 (aq) + Na2CO3 (aq) → CuCO3 (s) + Na2SO4 (aq) Ec. Ionica. Cu2+ (aq) + (SO4)2− (aq) + 2Na+ (aq) + (CO3)2− (aq) → CuCO3 (s) + 2Na+ (aq) + (SO4)2− (aq) Ec. Ionica Neta. Cu 2+ (aq) + (CO3)2− (aq) → CuCO3 (s) 9) Ec. Molecular. CoCl2 (aq) + Na2CO3 (aq) → CoCO3 (s) + 2NaCl (aq) Ec. Ionica. Co2− (aq) + 2Cl− (aq) + 2Na+ (aq) + (CO3)2− (aq) → CoCO3 (s) + 2Na+ (aq) + 2Cl− (aq) Ec. Ionica Neta. Co 2− (aq) + (CO3)2− (aq) → CoCO3 (s) 10) Ec. Molecular. Na2CO3 (aq) + 2AgNO3 (aq) → Ag2CO3 (s) + Na2(NO3)2 (aq) Ec. Ionica. 2Na+ (aq) + (CO3)2− (aq) + 2Ag+ (aq) + 2(NO3)− → Ag2CO3 (s) + 2Na+ (aq) + 2(NO3) (aq) Ec. Ionica Neta. (CO3)2− (aq) + 2Ag+ (aq) → Ag2CO3 (s) 11) Ec. Molecular. KBr (aq) + AgNO3 (aq) → AgBr (s) + KNO3 (aq) Ec. Ionica. K+(aq) + Br –(aq) + Ag+(aq) + NO3-(aq) → AgBr (s) + NO3-(aq) + K+(aq) Ec. Ionica Neta. Br –(aq) + Ag+(aq) → AgBr (s) 12) Ec. Molecular. 3BaCl2 (aq) + Fe2(SO4)3 (aq) → 3BaSO4(s) + 2FeCl3 (aq) Ec. Ionica. 3Ba2+(aq) + 6Cl –(aq) + 2Fe3+(aq) + 3SO42-(aq) → 3BaSO4(s) + 2Fe3+ + 6ClEc. Ionica Neta. 3Ba2+(aq) + 3SO42-(aq) → 3BaSO4(s) COMENTARIOS: 1) El Cloruro de Plata es un sólido blanco y el Nitrato (V) de Potasio es un liquido trasparente. En cuanto reaccionaron observamos una solución blancuzca, tuvimos que esperar un rato a que se sedimente bien la reacción para poder divisar bien el sólido. No sentimos olor. 2) El Hidróxido de Cobalto(II) es un sólido marrón y el Cloruro de Sodio es un liquido transparente. En cuanto reaccionaron observamos que el Hidróxido de Cobalto(II) era azul y amarillo, al sedimentarse se torno marrón. No sentimos olor. 3) El Hidróxido de Cobre(II) es un sólido azul y el Sulfato(VI) de Sodio es un liquido transparente. En cuanto reaccionaron observamos que el Hidróxido de Cobre(II) era azul con manchas marrones lo colocamos en la centrifuga y el color del precipitado se unifico siendo el color final azul. No sentimos olor. 4) El Carbonato de Hierro(III) es un sólido marrón anaranjado y el sulfato(VI) de Sodio es un liquido transparente. En cuanto reaccionaron observamos nítidamente el color del precipitado pero al centrifugarlo el precipitado se asentó bien en el fondo del tubo de ensayo. No sentimos olor. 5) El Hidróxido de Níquel es un sólido de color verde claro y el Cloruro de Sodio es un liquido transparente. Como en la mayoría de las reacciones al sedimentarse el sólido, el color de este se torno más nítido. No sentimos olor. 6) El Carbonato de Cobalto(II) es un sólido de color violeta y el Cloruro de sodio es un liquido transparente. En esta reacción sentimos un olor relativamente fuerte. 7) El Ioduro de Plata es un sólido amarillo y el Nitrato(VI) de Potasio es de color transparente. En esta reacción no sentimos olor. Como en la mayoría de las reacciones al sedimentarse el sólido, el color de este se torno más nítido. 8) El Carbonato de Cobre(II) es un sólido de color azulado y el Sulfato(VI) de Sodio es un liquido transparente. Al comenzar la reacción el color del sólido era celeste pero al asentarse el sólido el color de este se torno mas fuerte. No sentimos olor. 9) El Carbonato de Cobalto(II) es un sólido de color violeta y el Cloruro de Sodio es un liquido transparente. Como en la mayoría de las reacciones al sedimentarse el sólido, el color de este se torno más nítido. No sentimos olor. 10) El Carbonato de Plata es un sólido de color blanco y el Nitrato(V) de Sodio el un sólido de color transparente. Al sedimentarse el sólido, el color de este se torno más nítido. No sentimos olor. 11) El Bromuro de Plata es insoluble, es una sustancia blancuzca y densa. El Nitrato de Potasio esta en solución y es transparente. 12) El Cloruro de Hierro es de color transparente, el Sulfato de Bario un sólido de color amarillo.