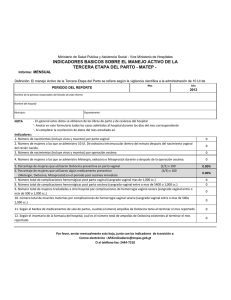
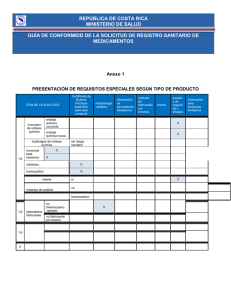
No. de Entrada: 133300202C7598 - Ferring Profesionales de la Salud
Anuncio

No. de Entrada: 133300202C7598 CAPÍTULO I 1.1 Inducción del parto 1.1.1 Indicaciones para la inducción del parto 1.1.2 Inducción del parto versus conducta expectante 1.1.3 Los métodos de inducción del parto 1.1.4 Inducción del parto con oxitocina 1.1.5 Inducción del parto con prostaglandinas 1.2 La importancia de la maduración cervical 1.2.1 Maduración cervical y la inducción del parto 1.2.2 Control hormonal y cambios celulares en la maduración cervical 1.2.3 Competencia Cervical 1.2.4 Los métodos para inducir la maduración cervical 1.3 MISOPROSTOL 1.3.1 Química de Misoprostol 1.3.2 Formulaciones y vías de administración 1.3.3 Características de las formulaciones de Misoprostol 7 7 8 8 10 10 10 10 11 11 11 12 12 13 13 CAPÍTULO II 2.1 Inserto vaginal de Misoprostol: Perfil del Producto 2.1.1 Justificación de desarrollo 2.1.2 Características del Inserto vaginal de Misoprostol 2.1.3 Desempeño de liberación in vivo 2.1.4 El sistema de recuperación 14 14 14 15 16 CAPÍTULO III 3.1 Uso terapéutico del inserto vaginal de Misoprostol 3.1.1 Indicaciones terapéuticas 3.1.2 Dosificación 3.1.3 Administración y la eliminación 3.1.4 Contraindicaciones 3.1.5 Precauciones y advertencias 3.1.6 Información de Almacenamiento y empaquetado 17 17 17 17 18 18 18 CAPÍTULO IV 4.1 Farmacocinética y farmacodinamia del inserto vaginal de Misoprostol 4.1.1 Descripción de los estudios farmacocinéticos 4.1.1.1 Diseño de los estudios 4.1.1.2 Farmacocinética 4.2 Farmacodinamia 19 19 19 20 21 CAPÍTULO V 5.1 Eficacia clínica del inserto vaginal Misoprostol 5.1.1 Descripción de los estudios de registro 5.1.2 Diseño de estudios 22 22 22 INTRODUCCIÓN 5.1.3 Estudio 1 – Eficacia12 5.1.4 Estudio 2 – Eficacia7 5.1.5 Estudio 3 – Eficacia8 5.1.6 Estudio 4 – Eficacia53 5.1.7 Estudio 5 – Eficacia54 23 25 26 26 27 CAPÍTULO VI 6.1 Seguridad clínica del inserto vaginal Misoprostol 6.1.1 Información general 6.1.2 Estudio 1 - Seguridad12 6.1.3 Estudio 2 - Seguridad7 6.1.4 Estudio 3 - Seguridad8 6.1.5 Estudio 4 - Seguridad53 6.1.6 Estudio 5 - Seguridad54 6.1.7 Las cuestiones de seguridad adicionales 28 28 29 29 29 30 30 30 CAPÍTULO VII 7.1 El inserto vaginal de Misoprostol Versus el Inserto vaginal de Dinoprostona 7.1.1 Información general 7.1.2 Wing, et al. 2008 - Eficacia7 7.1.3 Wing, et al. 2008 - Seguridad7 31 31 31 31 CAPÍTULO VIII 8.1 Uso en el mundo real del inserto vaginal de Misoprostol 8.1.1 Potencial para uso ambulatorio 33 33 CONCLUSIONES 33 CAPITULO XI. 34 INFORMACIÓN PARA PREESCRIBIR 34 REFERENCIAS 37 Para la mayoría de las mujeres, el embarazo no presenta complicaciones y progresa a un parto a término y espontáneo, sin la necesidad de intervención. En algunos casos, sin embargo, el parto electivo por medio de la inducción del parto puede ser necesario a causa de complicaciones en la madre o el feto. Lograr una inducción exitosa depende críticamente de la condición del cérvix. Para facilitar el paso del feto hacia la vagina durante el parto, el cérvix debe ser suave y maleable o ‘maduro’ con el fin de que puedan producirse el borramiento y dilatación del cuello uterino. El inicio de trabajo de parto sin cambios cervicales previos se produce en aproximadamente el 5% de los embarazos. Esto puede hacer que el parto sea prolongado y complicado. Cuando se induce el parto, la condición del cérvix es particularmente importante. En presencia de un cuello inmaduro, se presentan altas tasas de fracaso de la inducción debido a problemas asociados con la mala dilatación cervical. Estos incluyen un curso prolongado y difícil de trabajo de parto, que con frecuencia se traduce en sufrimiento fetal, una alta incidencia de cesárea y otras complicaciones maternas y fetales, dependiendo del método de inducción utilizado.1 La importancia de la maduración cervical, la cual es parte del proceso que conduce a la inducción del parto, ha llevado al desarrollo de una variedad de técnicas y tratamientos para preparar el cérvix para la inducción del parto2,3 y así mejorar el pronóstico del parto para la madre y el feto. En particular, el Misoprostol, un análogo de la prostaglandina natural E1 (PGE1), ha sido reconocido como un agente potencial para la maduración cervical durante muchos años.3,4 Como consecuencia, las tabletas orales de Misoprostol se han utilizado fuera de su indicación autorizada para la inducción del parto por médicos desde finales de 1990.4 5 El inserto vaginal de Misoprostol ha sido desarrollado para proporcionar una formulación de liberación controlada, la cual suministra una dosis baja continua de Misoprostol, y está combinado con un sistema de recuperación integral para permitir que el inserto sea fácil y rápidamente eliminado al final del período de dosificación o una vez que se logra el inicio del trabajo de parto activo. Además, en comparación con la prostaglandina E2 (PGE2o dinoprostona), el Misoprostol ha demostrado mejores efectos en la contractilidad uterina,5,6 lo cual ofrece ventajas en términos de tiempos más cortos para el parto.7,8 En consecuencia, los exámenes y las administraciones vaginales se reducen, lo que disminuye el riesgo potencial de infección, la carga de trabajo sobre los profesionales de la salud y mejora el bienestar del paciente. Monografía del producto FERRING Y OBSTETRICIA Ferring Pharmaceuticals es una compañía biofarmacéutica dedicada a impulsar la investigación para la identificación, desarrollo y comercialización de productos innovadores en el campo de la obstetricia y la ginecología. Como empresa, Ferring se ha comprometido con el desarrollo de productos basados en los términos del propio cuerpo. Ferring tiene como objetivo proporcionar la mejor prevención y tratamiento para ayudar en todas las fases del ciclo reproductivo, especialmente durante el embarazo, para garantizar un proceso seguro y exitoso para la madre y su bebé. 6 CAPÍTULO I 1.1 Inducción del Parto 1.1.1 Indicaciones para la inducción del parto La inducción del parto se define como la iniciación artificial del parto.13 Por lo general, está indicada cuando el riesgo para la madre o el feto es mayor que los posibles beneficios de continuar el embarazo. Las diversas indicaciones para la inducción (que puede ser necesaria hacerla prematuramente, al término o post término) son la hipertensión inducida por el embarazo, la ruptura prematura de las membranas, corioamnionitis y embarazo post-término. En 2008, el UK National Institute for Health and Clinical Excellence (NICE) publicó guías actualizadas que han sido adoptadas por el The Royal College of Obstetricians and Gynaecologists (RCOG) para indicaciones maternas y fetales (Tabla 1) y contraindicaciones (Tabla 2) para la inducción del parto.13 Más recientemente, la Organización Mundial de la Salud publicó sus recomendaciones para la inducción del trabajo de parto en 2011, cuyo objetivo era promover las mejores prácticas clínicas en trabajo de parto y el parto, y así mejorar los resultados maternos en todo el mundo (Tablas 1 y 2)14 El embarazo y el parto suponen importantes riesgos para la salud, incluso en el mundo desarrollado, y más aún en países emergentes. Esto se refleja en las iniciativas de la Organización de las Naciones Unidas para mejorar significativamente la salud materna y neonatal para el año 2015 a través de los Objetivos de Desarrollo del Milenio.9 Se ha estimado que el 40% de las mujeres experimentan problemas de salud durante o después del embarazo y el parto, con 15% que sufren complicaciones graves o con secuelas a largo plazo.10 De hecho, los datos de las Naciones Unidas indican que más de 350.000 mujeres mueren cada año por complicaciones durante el embarazo o el parto.9 La gestión de los riesgos maternos y neonatales requiere investigación y desarrollo continuo en obstetricia. 7 Ferring se dedica a la mejora de las terapias de obstetricia, desde el tratamiento del trabajo de parto prematuro, la inducción del trabajo de parto y la prevención de la hemorragia posparto, con el fin de reducir la morbilidad materna y neonatal así como la mortalidad durante el embarazo y el parto. El inserto vaginal de Misoprostol ha sido diseñado para proporcionar una liberación controlada y continua, de Misoprostol en dosis bajas en una forma farmacéutica fácil de usar. Formulado específicamente para la maduración cervical e inducción del trabajo de parto. Es la única forma farmacéutica de Misoprostol que se aprobó para la inducción del trabajo de parto,11 y proporciona un tiempo más corto para el parto vaginal y un riesgo mínimo para la madre y el recién nacido, en comparación con el inserto vaginal de dinoprostona.12 Los detalles sobre el uso del inserto vaginal de Misoprostol se revisan en esta monografía. Sin embargo, estos criterios no deben ser considerados absolutos, y cada embarazo debe ser evaluado individualmente antes de que se tome una decisión de inducir el parto. Las tasas de inducción del trabajo de parto varían de país a país. Por ejemplo, la tasa de inducción del parto se ha duplicado en los EE.UU. durante el período de 1990 a 2010 (9.5 a 23.4%).15,16 Por el contrario, la tasa de inducción del trabajo de parto en el Reino Unido se ha mantenido relativamente constante durante el período comprendido entre 1990 y 2010 (18.3 y 20.8%, respectivamente).17 En toda Europa, hay una amplia variación en la tasa de inducción del parto, que va desde 5 hasta 35% de los embarazos,18 lo cual se observa no sólo entre países sino también entre los distintos hospitales, en función de las diferencias locales en la práctica y las actitudes hacia la intervención clínica. Monografía del producto 1.1.2 Inducción del parto versus conducta expectante En los embarazos que está indicada la inducción del parto, aún hay debate sobre si la evolución de los pacientes mejora con la inducción electiva en lugar de la conducta expectante. Sin embargo, una revisión sistemática Cochrane comparando 22 estudios e informes sobre 9.383 mujeres, mostró que una política de inducción del parto se asoció con menos muertes perinatales (por cualquier causa) en comparación con una política de conducta expectante (Riesgo relativo [RR], 0.31; intervalo de confianza del 95% [CI]: 0.12, 0.81; 17 ensayos, 7407 mujeres).19 Además, hubo menos cesáreas en mujeres sometidas a inducción del parto en comparación con las que esperan el inicio espontáneo del trabajo de parto (RR, 0.89, CI del 95%: 0.81, 0.97; 21 ensayos, 8749 mujeres).19 Por último, menos bebés tenían síndrome de aspiración de meconio en el grupo de inducción del parto en comparación con el grupo de tratamiento expectante (RR, 0.50, CI del 95%: 0.34, 0.73; ocho ensayos, 2371 neonatos).19 La inducción del parto también puede ser más costo-efectiva y se asocia con mejora de los resultados maternos y neonatales en comparación con la conducta expectante. Un modelo de costo-efectividad desarrollado por Kaimal et al (2011) en los EE.UU. comparó la inducción del parto a las 41 semanas con la conducta expectante en mujeres nulíparas, y demostró que la inducción del parto es costo-efectiva, con un costo adicional de $ 10.945 por año de vida ganado ajustado por calidad en comparación con la conducta expectante.20 La inducción electiva a las 41 semanas se asoció con tasas reducidas de eventos obstétricos adversos, incluyendo la muerte neonatal, distocia de hombro, síndrome de aspiración de meconio y laceraciones perineales graves. Además, en un análisis de costo-efectividad de un ensayo controlado aleatorio que compara la inducción del parto con el manejo expectante en mujeres con diabetes gestacional o preeclampsia, el costo promedio por inducción del parto fue de € 7077 frente a € 7908 para el manejo expectante (diferencia media de - € 831; CI del 95%: - € 1561, - € 144).21 Los datos de los resultados clínicos del estudio mostraron que la inducción del parto se asoció significativamente con mejores resultados maternos en comparación con la conducta expectante (RR, 0.71, CI del 95%: 0.59 a 0.86, p < 0.0001).22 8 1.1.3 Los métodos de inducción del parto Cuando el cérvix se encuentra en una condición favorable, el trabajo de parto puede ser inducido por métodos físicos para estimular las contracciones del útero, incluyendo la rotura artificial (amniotomía), separación de las membranas o el uso de catéteres intrauterinos. Enfoques farmacológicos para la inducción del parto incluyen el uso de oxitocina y prostaglandinas.23 El objetivo de estas diversas técnicas es para imitar la secuencia fisiológica de borramiento y la dilatación seguida de una contracción uterina que ocurre durante el trabajo de parto espontáneo.23 Los métodos recomendados para la inducción del trabajo de parto de las directrices actuales se muestran en la Tabla 3.13,14 9 La inducción del trabajo de parto se asocia con un mayor riesgo de cesárea en comparación con el parto espontáneo. 24 Por lo tanto, es importante ser capaz de predecir en que mujer es mas probable que tenga éxito la inducción del parto. La tabla 4 resume los factores que son predictivos de la inducción del parto exitoso. Monografía del producto 1.2.2 Control hormonal y cambios celulares en la maduración cervical Cuando el embarazo progresa naturalmente a trabajo de parto espontáneo a término, la maduración del cuello uterino y el inicio del trabajo de parto se producen como parte de un proceso natural y gradual, preparando al mismo tiempo el útero y el cuello uterino durante la fase activa del trabajo de parto. Las hormonas facilitan los cambios celulares necesarios para la maduración del cuello uterino. Cuando se acerca el plazo, la disminución de los niveles de progesterona limita su efecto inhibitorio sobre la maduración cervical. Al mismo tiempo, se producen aumentos concomitantes en la concentración plasmática de estrógenos. Los estrógenos, y, posiblemente, la relaxina, estimulan la actividad de la fosfolipasa, aumentando así la síntesis local de PGE 2 y PGF2 - prostaglandinas que median los procesos de maduración cervical.31 PGE2 es fundamental en la coordinación de la maduración cervical y la iniciación de la contractilidad del miometrio. La PGE 2 está implicado en la relajación del músculo liso y en el aumento de la síntesis de glicosaminoglicanos por los fibroblastos cervicales, componentes importantes en la maduración cervical. La PGE2 también estimula la producción de PGF2a, que a su vez sensibiliza el miometrio a la actividad uterotónica de oxitocina. 10 1.1.4 Inducción del parto con oxitocina La infusión intravenosa de oxitocina, el agente más comúnmente usado para la inducción del parto,3,27 estimula rápidamente las contracciones uterinas fuertes.3 Sin embargo, la oxitocina no tiene ningún efecto directo sobre la condición del cérvix. Por otra parte, el uso de oxitocina para la inducción del trabajo de parto ha sido cuestionado desde que las revisiones sistemáticas y meta-análisis han demostrado que no es tan eficaz en la consecución de un parto vaginal exitoso dentro de las 24 horas, como otros agentes farmacológicos, como las prostaglandinas vaginales o intracervicales.27,28 Como consecuencia de ello, no se recomienda el uso de la oxitocina sola para la inducción del parto en las directrices RCOG (2008, Tabla 3).13 De hecho, se puede argumentar que el uso más apropiado para la oxitocina es para el aumento del trabajo dede parto en lugar de la inducción del parto. Este punto de vista se refleja en las últimas recomendaciones de la OMS, las cuales indican que la oxitocina sólo se debe utilizar si no se dispone de las prostaglandinas (Tabla 3),14 y en las guías italianas recientemente desarrolladas para la inducción del parto, las cuales recomiendan que la infusión de oxitocina (5-10 IU en 500 ml de solución salina) sólo se debe utilizar para acelerar el trabajo de parto.29 Además, altas dosis de oxitocina se han relacionado con un mayor riesgo de hemorragia post-parto.29 1.1.5 Inducción del parto con prostaglandinas Las prostaglandinas fueron utilizadas inicialmente en la práctica obstétrica para la inducción del trabajo de parto en la década de 1970, cuando PGE2 y la prostaglandina F2 (PGF2) llegaron a estar disponibles en el mercado como la dinoprostona y dinoprost, respectivamente. A altas concentraciones, son fuertes estimuladores de la actividad del miometrio y, en consecuencia, en la presencia de un cuello uterino ya maduro, las prostaglandinas se pueden utilizar para inducir el parto. Sin embargo, para lograr la concentración plasmática necesaria para producir la contractilidad uterina suficiente para la inducción del parto, las prostaglandinas fueron inicialmente administradas por vía intravenosa o por vía oral y se asocian con varios efectos secundarios sistémicos. Esto condujo a la justificación de la aplicación localizada de las prostaglandinas en una dosis más baja y el desarrollo de formulaciones que pueden ser administradas directamente en el cuello uterino o la vagina para la maduración cervical. Un análogo de PGE1 también se puede utilizar como un agente para la maduración cervical, y actúa de una manera similar a PGE2. Sin embargo, se han demostrado diferencias sutiles en las acciones fisiológicas entre PGE2 y el análogo de PGE1, el Misoprostol. En las mujeres sometidas a cesárea que no han iniciado trabajo de parto, solamente PGE1 ha demostrado que aumenta la contractilidad del miometrio, mientras que PGE2 no tuvo ningún efecto.5 PGE1 puede unirse selectivamente a receptores EP2 /EP3 lo que causa una contracción relacionada con la dosis del útero.5 Estas observaciones pueden explicar las mayores tasas de parto vaginal, así como otros efectos, asociados con el uso de un análogo de PGE1 en comparación con PGE2.6 La rigidez del cuello uterino hasta el parto depende predominantemente del alto contenido de colágeno en el tejido conectivo del cuello uterino. El rompimiento y la dispersión de colágeno hacen el cérvix blando, elástico, y por lo tanto menos resistente a la dilatación durante el parto. 1.2.3 Competencia Cervical Debido a que un cuello favorable es un factor clave para la inducción exitosa de parto, los métodos para evaluar objetivamente la madurez se han desarrollado, facilitando la determinación del tiempo óptimo para la inducción. Con el sistema más utilizado, el índice de Bishop,32 la consistencia, borramiento y la dilatación del cérvix se consideran con la posición de la parte de presentación del feto (Tabla 5). Las puntuaciones individuales para cada parámetro se combinan para dar un resultado final que va desde cero (menos favorable) al 13 (más favorable) antes de finalizar el embarazo. Si la puntuación total es de nueve o más, la probabilidad de parto inducido que conduce a un parto vaginal es similar a la observada durante el trabajo de parto espontáneo. Un estudio reciente, llevado a cabo en más de 5.000 mujeres nulíparas sometidas a la inducción del trabajo de parto, observó que un índice de Bishop simplificado que incorpora sólo la dilatación cervical, borramiento y la estación tuvieron capacidad predictiva similar para la inducción del parto exitoso.33 11 Las prostaglandinas vaginales son actualmente los agentes preferidos para la inducción del trabajo de parto recomendadas por el RCOG y las directrices de la OMS, a menos que existan razones clínicas específicas en contra de su uso, tales como el riesgo de hiperestimulación uterina (Tabla 3).13,14 Aunque la PGE2, dinoprostona, actualmente se recomienda en las directrices RCOG para la inducción del parto, las más recientes directrices de la OMS también recomiendan el uso del análogo de PGE1, Misoprostol para la inducción del trabajo de parto. Recientes pruebas in vitro muestran que el Misoprostol es un agente más efectivo que la dinoprostona para la contracción uterina.5,6 Por otra parte, los ensayos controlados aleatorios han demostrado que el Misoprostol es más eficaz que la dinoprostona para la inducción del trabajo de parto, en términos de reducción de tiempo para un parto vaginal seguro.7,8,12 1.2 La importancia de la maduración cervical 1.2.1 Maduración cervical y la inducción del parto La maduración del cérvix es un requisito previo para el pleno borramiento cervical y dilatación, y por lo tanto para el éxito de la inducción del parto. Si se induce el parto cuando el cuello no está maduro, y por lo tanto no puede funcionar en respuesta a las contracciones, altas tasas de fracaso pueden ser experimentadas, incluido el trabajo de parto prolongado y agotador, y una alta incidencia de cesárea.30 Por lo tanto una previa maduración artificial del cérvix, es necesaria para facilitar el éxito de la inducción de parto cuando está indicada y hay presencia de un cuello inmaduro. 1.2.4 Los métodos para inducir la maduración cervical Agentes para la maduración cervical Ambos medios mecánicos y hormonales que causan la dilatación y el ablandamiento del cuello uterino se utilizan para iniciar la maduración cervical antes de la inducción del parto. Métodos mecánicos incluyen dilatadores higroscópicos, dilatadores osmóticos, catéteres Foley, dispositivos de doble balón y la infusión de solución salina extra-amniótica.34 Los dilatadores mecánicos se insertan en el canal cervical para afectar la manipulación física y por lo tanto la estimulación del cérvix. Una desventaja de tales dispositivos es que pueden predisponer a la madre a la infección.35 Monografía del producto Además, estos métodos mecánicos no se recomiendan en las directrices más recientes para la inducción del trabajo de parto desarrolladas por el RCOG (Tabla 2).13 En general, se han descartado en gran medida a favor de los agentes farmacológicos establecidos, tales como la dinoprostona. Además de las prostaglandinas, el estrógeno de hormonas,36 oxitocina27 y relaxina37 se han utilizado para inducir la maduración cervical, pero con éxito limitado. Las prostaglandinas Las prostaglandinas, en dosis bajas, provocan ablandamiento del cuello uterino, incluso en la ausencia de la contractilidad uterina.7,38-41 PGE2 aumenta la actividad de la colagenasa en el cérvix y también aumenta los niveles de elastasa, glicosaminoglicano, sulfato de dermatán y ácido hialurónico. Las prostaglandinas también aumentan los niveles de calcio intracelular, lo que provoca la contracción del músculo del miometrio, facilita la relajación del músculo liso y la dilatación del cuello uterino.2 Muchas investigaciones han confirmado su efecto directo en la maduración cervical,30,42 y la administración de prostaglandina está ahora bien reconocida como especialmente beneficiosa cuando el trabajo de parto será inducido en presencia de un cuello inmaduro. En tales condiciones, la inducción con oxitocina es con frecuencia no exitosa, lo que lleva a una sección de cesárea en el 30-40% de los casos.38 El perfil de seguridad y eficacia de PGE2 se ha establecido 43 y PGE2 es actualmente la preferida sobre PGF2 para la maduración cervical. PGE2 se considera más eficaz que la PGF2 y su uso se piensa para reflejar eventos naturales más estrechamente. Las prostaglandinas se han establecido como el agente de inducción más eficaz cuando el cuello no está maduro. De hecho, en las pautas utilizadas actualmente por el RCOG, PGE2 vaginal es el agente preferido para la inducción del parto, a menos que existan razones clínicas específicas en contra de su uso, tales como el riesgo de hiperestimulación uterina.13 Además, las recientes directrices de la OMS reconocen la utilidad del análogo sintético de PGE1, el Misoprostol en la inducción del trabajo de parto,14 y estudios con Misoprostol, administrado como un inserto vaginal de liberación controlada, han demostrado que es eficaz y seguro para las mujeres en gestación de termino que requieren la maduración cervical y la inducción del parto.7,8,12 12 Factores predictivos de éxito con prostaglandinas En un análisis secundario de los datos de un ensayo controlado aleatorizado comparando PGE2 con inserciones vaginales de Misoprostol, 1274 pacientes tuvieron suficientes datos de trabajo de parto y parto propiamente para ser incluidos en el análisis comparativo.24 Se encontraron varias características maternas para ser predictivas de la inducción del parto con éxito con las prostaglandinas, incluyendo la multiparidad (p < 0.001), IMC < 30 kg/m2 (p < 0.001), una puntuación de Bishop modificada de referencia de por lo menos 4 (p = 0.047) y siendo de 35 años de edad o menos (p = 0.01). Antiprogesterona La mifepristona es una antiprogestina que contrarresta la inhibición de la contracción uterina por la progesterona.2 Mientras que los estudios han demostrado que, en comparación con el placebo, la mifepristona aumenta la probabilidad de que las mujeres tengan un cuello uterino favorable dentro de las 48 horas, una reciente revisión de Cochrane concluyó que no hay actualmente pruebas suficientes para apoyar el uso de este agente para la inducción del parto.44 En efecto, la mifepristona no está recomendada para la inducción del parto en las directrices RCOG actuales, excepto en las mujeres que han sufrido la muerte fetal intrauterina.13 1.3 MISOPROSTOL 1.3.1 Química de Misoprostol Misoprostol ([11α, 13E] - [±] -11,16-dihidroxi-16-metil-9-oxoprost-13-en-1-oico éster metil ácido) es la denominación común internacional para el análogo sintético de PGE1. Tiene un peso molecular de 382.5 Da y una fórmula química de C22H38O5, y existe como una mezcla 1:1 de dos diastereoisómeros, (±) - (S)-Misoprostol y (±) - (R)-Misoprostol. Las estructuras químicas de PGE1 y el Misoprostol se muestran en la Figura 1. El Misoprostol se presenta como un aceite de color amarillento claro viscoso con un olor a humedad, que es higroscópico y altamente soluble en agua y etanol.45 El Misoprostol se absorbe mucho, y se somete a una rápida de-esterificación a su ácido libre, ácido de Misoprostol. El ácido es responsable de la actividad clínica de Misoprostol. El Misoprostol en sí no es detectable en el plasma, con los estudios farmacocinéticos de Misoprostol oral y por vía intravaginal en general la medición de ácido de Misoprostol. En voluntarios sanos, el Misoprostol es rápidamente absorbido después de la administración,46 mientras que la vida media del ácido de Misoprostol en el plasma de mujeres embarazadas es de aproximadamente 30 a 40 minutos después de la eliminación del inserto vaginal.47 Ninguna acumulación de ácido de Misoprostol se ha observado en estudios de dosis múltiples.7,41,46,47 Las concentraciones plasmáticas máximas de ácido de Misoprostol disminuyen cuando la dosis se toma con los alimentos y la disponibilidad total de ácido de Misoprostol se reduce por el uso concomitante de antiácidos.48 1.3.2 Formulaciones y vías de administración Varias formulaciones de Misoprostol están disponibles, sobre todo en combinación con otros agentes y se utilizan para la profilaxis contra el fármaco anti-inflamatorio no esteroideo (NSAID ) - úlceras gástricas inducidas. Sólo hay una formulación que está indicada en la actualidad para la inducción del parto: • La liberación controlada (0.3 µg/hora, 200 µg reservorio) inserto vaginal - indicado para la inducción del trabajo de parto en las mujeres con un cuello uterino desfavorable, de 36 semanas de gestación, en el que se indica clínicamente la inducción (Myspess®, Ferring Pharmaceuticals)11 • Tableta oral con núcleo con recubrimiento entérico que contiene ya sea 50 o 75 mg de diclofenaco sódico y una capa externa que contiene 200 µg de Misoprostol - indicado para pacientes que requieren diclofenaco NSAID junto con el Misoprostol. El componente de Misoprostol está indicado para pacientes con una necesidad especial para la profilaxis de la úlcera gástrica inducida por NSAID y duodenal (Arthrotec®, Pfizer Ltd)49 • Tableta oral que contiene 100 ó 200 µg de Misoprostol - indicado para la curación de la úlcera duodenal y úlcera gástrica incluyendo las inducidas por NSAID en pacientes artríticos en riesgo, al tiempo que continúan su tratamiento con NSAID . Además, se puede utilizar para la profilaxis de las úlceras inducidas por NSAID (Cytotec ®, Pharmacia Ltd)50 • Tableta oral que contiene 200 µg de Misoprostol (proporcionado en paquetes de combinación, que incluyen 500 mg, comprimidos de naproxeno) - indicado para pacientes que requieren naproxeno 500 mg dos veces al día y Cytotec 200 µg dos veces al día. El componente de Misoprostol está indicado para la profilaxis de la úlcera gastroduodenal inducida por NSAID (Napratec®, Pharmacia Ltd)51 13 1.3.3 Características de las formulaciones de Misoprostol Misoprostol en forma de tableta se ha aplicado en la práctica obstétrica para inducción del trabajo de parto off-label, en la que comprimidos no ranurados de 100 o 200 µg se redujeron a la mitad o en cuartos, luego se colocan en la vagina cada 4 a 6 horas.4 Sin embargo, este enfoque de división de comprimidos no proporciona una dosificación precisa de Misoprostol ni permite que el fármaco se libere de manera constante y bien definida. Además, no hay manera exacta o rápida de eliminación del fragmento de la tableta de Misoprostol una vez que se ha insertado. Por el contrario, el inserto vaginal de Misoprostol de 200 µg libera el Misoprostol a una velocidad controlada durante un máximo de 24 horas. La liberación controlada de una dosis baja continua de Misoprostol durante un período prolongado regula la exposición de los tejidos a PGE1, lo que minimiza la probabilidad de hiperestimulación del útero, mientras que todavía mantiene el beneficio de un corto período de tiempo para el parto vaginal seguro. Si se tienen en cuenta factores, tales como la necesidad de monitorización de pacientes, el ahorro de tiempo y la comodidad del paciente, el uso del inserto vaginal de Misoprostol también puede ser más rentable en comparación con el inserto vaginal de dinoprostona. El inserto vaginal de Misoprostol se elimina rápida y fácilmente después de 24 horas, o antes, en el inicio del trabajo de parto activo o por otras razones cuando es aconsejable suspender la dosificación de prostaglandinas exógenas. La eliminación del inserto vaginal de Misoprostol detiene la administración de prostaglandinas exógenas y de más dosis por lo tanto innecesaria. Figura 1. La estructura química de la prostaglandina E1 y Misoprostol45 Monografía del producto CAPÍTULO II 2.1 Inserto vaginal de Misoprostol: Perfil del Producto 2.1.1 Justificación de desarrollo El inserto vaginal de Misoprostol fue desarrollado para proporcionar una liberación continua y controlada de una dosis baja de Misoprostol en un formato fácil de usar. La aplicación y recuperación del inserto vaginal son simples de realizar, lo cual permite el control preciso de la localización y dosis de Misoprostol administrada. Por otra parte, la administración sostenida y controlada de una dosis baja de Misoprostol evita la administración de dosis en exceso de las cantidades requeridas para llevar a cabo la maduración cervical y así elimina el riesgo de dosis innecesarias, lo que puede estar asociado con un aumento de la probabilidad de efectos adversos. Los riesgos se reducen aún más por el hecho de que la baja dosis de Misoprostol liberada desde el dispositivo de liberación se elimina rápidamente por los tejidos.52 La presencia de un sistema de recuperación también significa que el inserto se puede quitar rápida y fácilmente, eliminando inmediatamente la fuente de Misoprostol.52 2.1.2 Características del Inserto vaginal de Misoprostol El Inserto vaginal de Misoprostol es una formulación aplicada localmente de Misoprostol que permite controlar la maduración cervical. El producto comprende un dispositivo de liberación delgado, oblongo, semi-opaco de hidrogel que se contiene dentro de una bolsa de poliéster de una pieza y una cinta de retirada (el sistema de recuperación) (Figura 2). El inserto de hidrogel mide 30 x 10 x 0.8 mm y se compone de una matriz polimérica no biodegradable. Uniformemente dispersado por toda la matriz están 200 µg de Misoprostol. El sistema de recuperación (la bolsa más la cinta retirada) es de 30 cm de longitud y garantiza la eliminación fácil y segura del producto, después del período de dosificación de 24 horas o en el inicio del trabajo de parto activo.12 Largas cadenas de óxido de polietileno son reticuladas para producir un polímero El Misoprostol se sostiene en el hidrogel has que el producto llega a ser humedecido con la administración Aproximadamente 200µg de Misoprostol se libera cada hora durante un período de 24 horas Figura 3. Liberación de Misoprostol del inserto de hidrogel Las características del inserto vaginal de Misoprostol en comparación con la tableta de Misoprostol oral se resumen en la Tabla 6. La liberación predecible y constante de Misoprostol del inserto vaginal a lo largo del período de dosificación de 24 horas significa que una dosis única es suficiente para conseguir la maduración cervical en la mayoría de las mujeres. Una ventaja adicional de la liberación gradual continua del Misoprostol en la ubicación del cérvix es que refleja la situación de la vida real que se produce con el parto espontáneo. El Misoprostol también puede reducir el tiempo para el parto vaginal seguro en comparación con el de inserto vaginal de liberación de dinoprostona.12 14 15 Figura 2. El inserto vaginal de Misoprostol La matriz del sistema de liberación de hidrogel consiste en largas cadenas de óxido de polietileno químicamente reticulado para producir el polímero de hidrogel. Dispersa de forma homogénea a lo largo de esta matriz están las moléculas de Misoprostol. Estas son retenidas dentro del hidrogel hasta la administración del inserto vaginal. Después de la inserción, el polímero de hidrogel absorbe el fluido vaginal, se hincha a aproximadamente dos veces el tamaño original y comienza a liberar el Misoprostol unido a la matriz (Figura 3). Las características del inserto vaginal de Misoprostol en comparación con la tableta de Misoprostol oral se resumen en la Tabla 6. La liberación predecible y constante de Misoprostol del inserto vaginal a lo largo del período de dosificación de 24 horas significa que una dosis única es suficiente para conseguir la maduración cervical en la mayoría de las mujeres. Una ventaja adicional de la liberación gradual continua del Misoprostol en la ubicación del cérvix es que refleja la situación de la vida real que se produce con el parto espontáneo. El Misoprostol también puede reducir el tiempo para el parto vaginal seguro en comparación con el de inserto vaginal de liberación de dinoprostona.12 2.1.3 Desempeño de liberación in vivo El inserto vaginal de Misoprostol fue diseñado para evitar el “dumping de dosis” que se produce como una liberación del fármaco inicial de la mayor parte del depósito seguido por una disminución significativamente de la liberación del fármaco. El Misoprostol se libera de la matriz del sistema de suministro a una velocidad de aproximadamente 0.3 µg / hora.11 Monografía del producto Esta lenta liberación controlada de Misoprostol (100 y 200 µg) del inserto de hidrogel se ve in vivo (Figura 4) y se mantiene durante todo el período de dosificación de 24 horas.46,53 Los datos de insertos recogidos en varios puntos de tiempo de varios estudios también han revelado que no hay ningún pico inicial en la liberación de Misoprostol.46,53,54 Por lo tanto, un total de aproximadamente 7 µg de Misoprostol se libera del inserto vaginal de Misoprostol durante la administración de 24 horas.11 El resto se queda en la matriz de hidrogel del inserto y actúa como un depósito. CAPÍTULO III 3.1 Uso terapéutico del inserto vaginal de Misoprostol 3.1.1 Indicaciones terapéuticas El inserto vaginal de Misoprostol (200 µg de Misoprostol) está indicado para la inducción del trabajo de parto en las mujeres con un cuello uterino desfavorable, de 36 semanas de gestación, en el que se indica clínicamente la inducción. 3.1.2 Dosificación Un solo inserto vaginal de Misoprostol, dejado en su lugar durante un máximo de 24 horas, generalmente se requiere para lograr la pre-inducción adecuada de maduración cervical. El depósito de 200 µg de Misoprostol libera Misoprostol a una velocidad constante de aproximadamente 0.3 µg/hora durante el período de dosificación de 24 horas. Sin embargo, si no ha sido insuficiente la maduración cervical después de 24 horas, el inserto vaginal de Misoprostol debe ser eliminado. 3.1.3 Administración y la eliminación La introducción del inserto vaginal de Misoprostol y la posterior eliminación del inserto son procedimientos simples que no implican el uso de una jeringa, un espéculo vaginal o estribos (figuras 5a-c).11 El inserto debe permanecer sellado en el paquete de papel de aluminio y se almacena en un congelador (-10 a -25 °C) hasta que se necesite. No se requiere descongelación antes de su uso. Después de la apertura, que se lleva a cabo a continuación, entre los dedos índice y medio y se coloca transversalmente, alta en el fórnix posterior, usando sólo pequeñas cantidades de lubricantes solubles en agua para ayudar a la inserción. Una vez correctamente insertado, el final de la cinta debe extenderse 2-3 cm por fuera de la vagina para facilitar la eliminación. Cualquier exceso de la cinta debe ser cortado para evitar la retirada inadvertida del inserto. Los pacientes deben permanecer en cama durante 30 minutos para permitir que el inserto se hidrate y se hinche, pero después de este período pueden ser ambulatorios. Dado que el Misoprostol se libera de forma continua desde el inserto durante un período de 24 horas, la contractilidad uterina y la condición del feto deben controlarse a intervalos frecuentes y de acuerdo con las normas locales de atención. 16 17 2.1.4 El sistema de recuperación El sistema de recuperación es una entidad única y continua que comprende una bolsa (que contiene el inserto de Misoprostol-hidrogel) y una cinta de retirada. La bolsa y la cinta son de poliéster de tejido de grado de injerto vascular que puede estirarse como los hidratos de chips de hidrogel y se hinchan. Este sistema de recuperación no influye en el perfil de liberación de Misoprostol a partir del hidrogel, ni altera la estabilidad del producto. Al final del período de dosificación, o en caso de ser necesario cesar la administración del fármaco, el inserto vaginal de Misoprostol puede ser fácilmente eliminado y es fiable mediante una tracción suave sobre la cinta de retirada. Por otra parte, debido a la vida media corta de Misoprostol (30 a 40 minutos), se espera que los efectos de la droga cesen rápidamente después de la retirada. Figura 5a. Sosteniendo el inserto vaginal de Misoprostol firmemente entre el índice y el dedo medio, el inserto vaginal se introduce en la vagina y se coloca detrás del fondo de saco posterior de la vagina Figura 5b. El inserto se coloca transversalmente para asegurar que permanece in situ Figura 5c. La tira de recuperación debe permanecer visible fuera de la vagina para permitir la retirada. La administración de Misoprostol se termina mediante la eliminación del inserto, efectuada por una suave tracción sobre la cuerda de recuperación Monografía del producto Cuando se requiere la eliminación, esto se puede lograr rápidamente y fácilmente a través de la aplicación de una suave tracción a la cinta de recuperación (Figura 5c). Se requiere un intervalo de al menos 30 minutos antes del uso secuencial de oxitocina para la inducción del trabajo de parto, si es necesario, después de la eliminación del inserto (de acuerdo con el Resumen de las Características del Producto). En la retirada, el inserto vaginal se ha hinchado hasta aproximadamente el doble de su tamaño original y es flexible. El producto entero se dispone a continuación como desecho clínico. 3.1.4 Contraindicaciones El inserto vaginal de Misoprostol no debe ser utilizado o se deja en su lugar bajo las siguientes circunstancias: • Cuando el trabajo ha comenzado • Cuando hay sospecha o evidencia de compromiso fetal antes de la inducción (por ejemplo, fallo en las pruebas de esfuerzo y no esfuerzo, la presencia de meconio, o el diagnóstico o la historia del estado fetal inestable) • Cuando se administran fármacos oxitócicos y/u otros agentes de inducción del parto • Cuando hay sospecha o evidencia de cicatriz uterina resultante de una cirugía uterina o cervical anterior (por ejemplo, el parto por cesárea) • Cuando hay útero anormal (por ejemplo, útero bicorne) • Cuando hay placenta previa o sangrado vaginal sin explicación después de las 24 semanas de gestación • Cuando hay mala presentación fetal • Cuando hay signos o síntomas de la corioamnionitis, a menos que el tratamiento previo adecuado se ha iniciado • En las mujeres que han tenido más de tres partos vaginales previos a las 24 semanas de gestación • Antes de 36 semanas de gestación • Cuando existe hipersensibilidad al principio activo o a alguno de los excipientes (por ejemplo polímero de hidrogel reticulado, butilhidroxianisol y el sistema de recuperación de poliéster [hilo de poliéster]) CAPÍTULO IV 4.1 Farmacocinética y farmacodinamia del inserto vaginal de Misoprostol 4.1.1 Descripción de los estudios farmacocinéticos La farmacocinética del inserto vaginal de Misoprostol para la maduración del cuello uterino a término se ha abordado en dos ensayos clínicos de etiqueta abierta.46,47 El ensayo de Powers et al. fue un estudio cruzado en 12 mujeres no embarazadas pre-menopáusicas sanas, que evaluaron cuatro concentraciones de dosis diferentes de los insertos vaginales de Misoprostol (100, 200 y 400 µg) en orden de dosis ascendente.46 Para comparar los niveles sistémicos de ácido de Misoprostol, las mujeres recibieron también por separado, una dosis oral de 200 µg de Misoprostol. El ensayo MISO-OBS-205 fue un estudio de Fase II que incluyó a 24 mujeres embarazadas (nulíparas o multíparas) a ≥ 36 semanas de gestación, y que requieren la maduración cervical y la inducción del trabajo de parto.47 4.1.1.1 Diseño de los estudios Algunos de los criterios de inclusión / exclusión de los dos estudios farmacocinéticos se muestran en la Tabla 7. Después de la inscripción, cada paciente recibió tratamiento con Misoprostol (inserto oral o vaginal). El inserto vaginal se inserta transversalmente en el fondo del saco posterior de la vagina, y se mantuvo en su lugar hasta por 24 horas. 3.1.5 Precauciones y advertencias El inserto vaginal de Misoprostol sólo debe ser administrado por personal obstétrico capacitado en entornos de hospital donde el monitoreo fetal y uterino continuo está disponible, y después de la evaluación adecuada del paciente y de la condición del cuello uterino. 18 Después de la inserción, la liberación de Misoprostol debe ser interrumpida mediante el retiro del inserto en la aparición de complicaciones maternas o fetales o efectos adversos. El retiro del inserto también es necesario si las contracciones uterinas son prolongadas o excesivas, ya que pueden predisponer a la hipertonía uterina o ruptura. Si las contracciones uterinas excesivas persisten después de eliminación del fármaco, se deben considerar tratamientos tocolíticos. Aunque no hay experiencia con el uso de más de una aplicación de Misoprostol, una sobredosis del agente puede dar lugar a síntomas de exposición excesiva de prostaglandinas, como la hiperestimulación o sufrimiento fetal. En tales circunstancias, el inserto vaginal de Misoprostol debe ser removido inmediatamente y el paciente se manejara de acuerdo con el protocolo estándar del centro de salud. 19 El inserto vaginal de Misoprostol debe utilizarse con precaución en mujeres con: • Ruptura de membranas (duración de > 48 horas antes de la inserción del inserto vaginal) • Un embarazo múltiple También se requiere precaución en mujeres con Streptococcus del Grupo B que requieren antibióticos profilácticos, y la consideración cuidadosa se debe dar a los tiempos de terapia antibiótica para lograr una protección adecuada. 3.1.6 Información de Almacenamiento y empaquetado Los insertos vaginales de Misoprostol se presentan en paquetes de cinco. Dentro de los paquetes, cada inserto está sellado individualmente en un envoltorio de aluminio, que debe permanecer sin abrir hasta inmediatamente antes de su uso. Los Insertos vaginales de Misoprostol se deben almacenar en un congelador (-10 a -25 °C) durante un máximo de 2.5 años. Por favor, consulte el etiquetado del paquete para la vida útil máxima. Además de la evaluación de tres concentraciones de dosis del inserto vaginal de Misoprostol, el estudio de las mujeres no embarazadas también se asigna al azar la duración del inserto in situ para uno de los tres períodos (4, 8 ó 12 horas) en cada día de tratamiento hasta que todas las 12 mujeres habían experimentado las tres duraciones en orden aleatorio. Esto permitió el análisis de la cantidad residual de Misoprostol que queda en el polímero después de diferentes duraciones in situ, Monografía del producto lo cual se utilizó para determinar la capacidad del inserto de polímero para controlar la liberación del fármaco. 46 Por el contrario, sólo el inserto vaginal de Misoprostol de 200 µg se evaluó en el estudio MISO-OBS-205 y el inserto se deja en su lugar durante un máximo de 24 horas a menos que ocurran eventos adversos los cuales requirieron el retiro previo, como la aparición del trabajo de parto activo o eventos adversos durante el parto .47 4.1.1.2 Farmacocinética Los datos farmacocinéticos de las mujeres no embarazadas mostraron que los valores medios de concentración máxima (Cmax) para todas las tres dosis de insertos vaginales de Misoprostol fueron considerablemente más bajos (oscilan aproximadamente 18 a 4 veces) y el tiempo medio para alcanzar la concentración máxima (Tmax) es más tarde que los valores correspondientes vistos con la dosificación oral (Tabla 8). Aunque las mujeres embarazadas tratadas con el inserto vaginal de Misoprostol de 200 µg en el estudio MISO-OBS-205 demostraron una farmacocinética ampliamente comparable con las mujeres no embarazadas (Figura 7), se observaron algunas diferencias leves (Tabla 8).47 20 21 Los datos de las mujeres que no están embarazadas son valores medios, mientras que los datos de las mujeres embarazadas son valores de medianas. IMC = índice de masa corporal; Cmax = concentración máxima: N/A = no aplicable, N/R = no se informa, Tmax = tiempo de concentración máxima, AUC0-inf = área bajo la curva de concentración plasmática frente a la curva de tiempo desde tiempo 0 hasta el infinito; AUC0-t = área bajo la curva de concentración plasmática frente a la curva de tiempo desde el tiempo 0 hasta la última concentración medible; T 1/2 = media vida terminal Sin embargo, la exposición sistémica total (AUC 0-t y AUC0-inf) con las tres dosis del inserto vaginal de Misoprostol fue mayor que la dosis oral (Tabla 8), no demostró ningún pico discernible después de la administración y exhibió proporcionalidad de dosis lineal (Figura 6). De hecho, la exposición sistémica total con el inserto vaginal de Misoprostol de 200 µg fue de aproximadamente 2.8 veces mayor que la de 200 µg de dosis oral única de Misoprostol. El ácido de Misoprostol también se elimina rápidamente, con una vida media terminal (T 1/2) de menos de 1 hora (Tabla 8). Tomados en conjunto, estos datos indican que los insertos vaginales de Misoprostol entregan un máximo inferior de Misoprostol durante un período de tiempo más largo, con una rápida eliminación del agente activo después de la extracción del inserto vaginal.46 El Tmáx se alcanza antes y la exposición sistémica con Misoprostol fue de aproximadamente 3 veces menor en las mujeres embarazadas que en las mujeres no embarazadas. El T-max más rápido se puede explicar por la menor duración in situ del inserto vaginal en mujeres embarazadas (es decir, eliminación debido a la aparición del trabajo de parto), mientras que una alta tasa de aclaramiento en las mujeres embarazadas también puede haber contribuido a la menor exposición sistémica con Misoprostol.47 Estas variaciones menores a un lado, los datos de T 1/2 de ambos estudios sugieren que la eliminación de Misoprostol después de la extracción del inserto vaginal es rápida, con independencia de si la mujer está embarazada o no. 4.2 Farmacodinamia La respuesta farmacodinámica del inserto vaginal de Misoprostol se ha evaluado usando los criterios de valoración clínicos. Por lo tanto, los datos para establecer una relación formal entre las concentraciones plasmáticas de ácido Misoprostol y la actividad farmacológica del inserto vaginal de Misoprostol no están disponibles actualmente.47 Monografía del producto CAPÍTULO V 5.1 Eficacia clínica del inserto vaginal de Misoprostol 5.1.1 Descripción de los estudios de registro El uso del inserto vaginal de Misoprostol en mujeres embarazadas en término o cerca de gestación se ha estudiado en cinco ensayos controlados aleatorios, doble ciego: dos ensayos de fase III (Estudios 1 y 2)7,12 y tres de fase II (Estudios 3-5).46,53,54 En total, 3194 mujeres a término (entre las 36 y 42 semanas de gestación) se inscribieron en los cinco estudios (Tabla 9). Los datos de eficacia En el Estudio 1, el inserto vaginal de Misoprostol 200 µg dio lugar a un tiempo de parto vaginal que fué más de 11 horas más rápido que el inserto vaginal de dinoprostona 10 mg en mujeres de cualquier paridad, y un tiempo para parto por cualquier vía que fue de aproximadamente 9 horas más corto.12 Además, el estudio 3 demostró que, en comparación con la dosis de 100 µg, el inserto vaginal 200 µg de Misoprostol se asoció con una reducción en el tiempo para el parto vaginal seguro.8 Estudios 4 y 5 mostraron que el inserto vaginal Misoprostol reduce el tiempo de parto vaginal seguro y es un agente eficaz para la maduración cervical antes del trabajo de parto, un importante requisito previo para el pleno borramiento cervical y dilatación, y por tanto para la inducción del parto exitosa.53,54 5.1.3 Estudio 1 – Eficacia12 Hasta la fecha, el estudio más amplio que evalúa la eficacia y seguridad del inserto vaginal de Misoprostol es un ensayo controlado aleatorizado de fase III realizado en los EE.UU. En el estudio participaron un total de 1.358 mujeres en gestación o a corto plazo y se comparó el inserto vaginal de Misoprostol 200 µg (n = 678) con inserto vaginal de dinoprostona 10 mg (n = 680). De la población total del estudio, 14 no tuvieron parto durante su primer intento de inducción (cinco mujeres en el grupo de inserto vaginal de Misoprostol 200 µg y nueve en el grupo de inserto vaginal de dinoprostona 10 mg). Los criterios de inclusión y exclusión se enumeran en la Tabla 11. 22 5.1.2 Diseño de estudios Los protocolos para cada uno de los cinco estudios multicéntricos fueron similares con respecto a la metodología, criterios de inclusión y exclusión (Tabla 10) y los parámetros de resultado. Después de la inscripción, cada paciente recibió tratamiento con un inserto vaginal de dinoprostona o un inserto vaginal de Misoprostol. Cada tratamiento se inserta transversalmente en el fondo del saco posterior de la vagina y se deja en su lugar durante un máximo de 24 horas. Los insertos se retiran al final del período de dosificación de 24 horas, en el inicio del trabajo de parto activo o en la ocurrencia de un evento adverso. La monitorización fetal y uterina se realizó antes y durante todo el período de observación de 24 horas. La medida de resultado primario para el éxito de maduración cervical después de un tratamiento era el tiempo de un parto vaginal seguro en cuatro de los cinco estudios;7,12,53,54 la variable de resultado primario para un estudio de fase II fue la proporción de partos vaginales en 24 horas.8 Los parámetros de resultado secundarios para la evaluación de la eficacia incluyen: • Tiempo de cualquier parto (vaginal o cesárea) • Tiempo de inicio de trabajo de parto activo • Uso de oxitocina antes del parto 23 La variable principal de eficacia de este estudio fue: • Tiempo para el parto vaginal Variables secundarias de eficacia incluyeron: • Tiempo de cualquier parto (vaginal o cesárea) • Tiempo de inicio de trabajo de parto activo • Proporción de mujeres que requieren oxitocina pre-parto • Frecuencia de presentación de partos dentro de las 12 y 24 horas Monografía del producto Los grupos fueron comparables en cuanto a sus características de base. La mediana de tiempo para el parto vaginal fue aproximadamente 11 horas más corto con el inserto vaginal de Misoprostol 200 µg frente al inserto vaginal de dinoprostona 10 mg (21.5 vs 32.8 horas, p < 0.001) (Figura 8). La ventaja en el tiempo para el parto vaginal con el inserto vaginal de Misoprostol 200 µg sobre el inserto vaginal de dinoprostona 10 mg se mantuvo en las mujeres tanto nulíparas y multíparas (ambos p < 0.001; Figura 8). 5.1.4 Estudio 2 – Eficacia7 Un estudio anterior de fase III de 1308 mujeres que requieren la maduración cervical y la inducción del trabajo de parto se llevó a cabo en los EE.UU. y Canadá, y comparó dos dosis del inserto vaginal de Misoprostol - 50 µg (n = 428) y 100 µg (n = 444) - con el inserto vaginal de dinoprostona 10 mg (n = 436). Los datos no estaban disponibles para un paciente en el grupo de tratamiento con el inserto vaginal de Misoprostol 100 mg. El tiempo para el parto vaginal fue comparable entre el inserto vaginal de Misoprostol 100 µg y el inserto vaginal de dinoprostona 10 mg (26.4 vs 27.3 horas, p = 0.97) (Figura 9). Por el contrario, las mujeres tratadas con el inserto vaginal de Misoprostol 50 µg requieren aproximadamente 8 horas más desde el tratamiento hasta el parto que aquellas tratadas con el inserto vaginal de dinoprostona 10 mg (35.4 vs 27.3 horas, p = 0.01). Una tendencia similar se observó en las mujeres nulíparas y multíparas. 24 25 Además, los tres tratamientos demostraron tasas similares de parto por cesárea, tanto en la población de estudio general y subgrupos de pacientes categorizados de acuerdo a la paridad (Figura 10). Del mismo modo, el tratamiento con el inserto vaginal de Misoprostol 200 µg fue superior al tratamiento con el inserto vaginal de dinoprostona 10 mg, en términos de los criterios de valoración secundarios (Tabla 12). Monografía del producto Todas las comparaciones entre los insertos vaginales de Misoprostol e inserto vaginal de dinoprostona no fueron significativas, n = número de mujeres sometidas a cesárea; N = número total de mujeres de cualquier paridad, nulíparas o multíparas. 5.1.5 Estudio 3 – Eficacia8 Un estudio de fase II, llevado a cabo en los EE.UU., ha investigado la eficacia y seguridad de tres dosis diferentes del inserto vaginal de Misoprostol (100, 150 y 200 µg) en 374 mujeres en gestación de termino que requieren la maduración cervical y la inducción del trabajo de parto (índice de Bishop modificado ≤ 4 antes de la inducción del trabajo de parto). Utilizando la evidencia del anterior estudio de fase III,7 el inserto vaginal de Misoprostol 100 µg se utilizó como grupo de referencia. Los grupos de tratamiento fueron en general comparables con respecto a los datos demográficos básicos y características. Las únicas excepciones fueron: • Más mujeres se sometieron a inducción electiva en el grupo del inserto vaginal de Misoprostol 200 µg (27 [20.6%]) que en el grupo del inserto vaginal de Misoprostol 100 µg (16 [13,7%]) y 150 µg (19 [15,2%]) • Más mujeres fueron inducidas para la hipertensión en el grupo del inserto vaginal de Misoprostol 100 µg (24 [20,5%]) que en el grupo del inserto vaginal de Misoprostol 150 µg (8 [6,4%]) y 200 µg (17 [13,0%]) En general, 24.0% de las mujeres que recibieron el inserto vaginal de Misoprostol 200 µg no pudo lograr el parto vaginal dentro de las 24 horas en comparación con el 36.3% de las que recibieron el inserto vaginal de Misoprostol 100 µg (RR, 0.66, CI del 95%: 0.42, 1.04, p = 0.057). Sin embargo, las mujeres en el grupo de inserto vaginal de Misoprostol 200 µg presentaron más rápido el parto vaginal y parto por cualquier vía (aproximadamente 9 y 6 horas más rápido, respectivamente), y tuvo un inicio más rápido de la fase activa del trabajo de parto (aproximadamente 6 horas) en comparación con las mujeres del inserto vaginal de Misoprostol 100 µg grupo de referencia (Tabla 13). 26 27 Hubo una proporción significativamente mayor de mujeres tratadas con el inserto vaginal de Misoprostol 200 µg que presentaron parto por cualquier modo dentro de las 24 horas en comparación con las mujeres tratadas con el inserto vaginal de Misoprostol 200 µg (72.5 frente a 52.1%, p <0,001). Este hallazgo se mantuvo en mujeres nulíparas y multíparas (p = 0.012 y p = 0.016, respectivamente). Sin embargo, las tasas de cesárea fueron similares entre los tres grupos: 31.4, 30.4 y 22.9% en los grupos de inserto vaginal de Misoprostol 100, 150 y 200 µg, respectivamente. Por último, menos de la mitad del grupo del inserto vaginal de Misoprostol 200 µg requieren estimulación con oxitocina, en comparación con aproximadamente el 70% en el grupo de inserto vaginal de Misoprostol 100 µg (Figura 11) 5.1.6 Estudio 4 – Eficacia53 Un estudio UK de grupos paralelos con rango de dosis Fase II, incluyó 124 mujeres que tuvieron hijos a término (37-42 semanas de gestación inclusive) y se evaluó la eficacia de cuatro depósitos de dosis del inserto vaginal de Misoprostol (25, 50, 100 y 200 µg). La medida de resultado primario fue el tiempo del parto vaginal. La mediana del tiempo hasta el parto vaginal se redujo con el aumento de dosis de Misoprostol (Figura 12). Por el contrario, hubo un aumento constante de la proporción de mujeres que dieron a luz por vía vaginal a las 12 horas (9, 14, 47 y 53% en los grupos de 25, 50, 100 y 200 µg, respectivamente, p < 0.001 mediante el inserto vaginal de Misoprostol grupo de 25 µg como comparador) y dentro de 24 horas (42, 79, 81 y 70%, p = 0.003). 5.1.7 Estudio 5 – Eficacia54 Este Estudio de fase II de dos partes (estudio abierto, estudio de escalada de dosis en la Parte A y aleatorizado, doble ciego, controlado en la parte B) se llevó a cabo en los EE.UU. y México, e incluyó a mujeres nulíparas a término (37-42 semanas de gestación inclusive). El estudio evaluó la eficacia de cinco depósitos de dosis de inserto vaginal de Misoprostol (25, 50, 100, 200 y 300 µg). El objetivo principal fue determinar la dosis máxima tolerada y para determinar la eficacia de los diferentes embalses de dosis del inserto vaginal de Misoprostol, con un criterio de valoración principal de la eficacia de tiempo para el parto vaginal. El aumento de las dosis del depósito de Misoprostol hasta 100 µg produjo incrementos más rápidos en las puntuaciones de Bishop modificadas (hasta la puntuación máxima), reducción en la necesidad de oxitocina y un tiempo más corto para el parto vaginal. La mediana del tiempo hasta el parto vaginal para las dosis de 25, 50, 100, 200 y 300 µg era de 43.3, 29.0, 14.2, 11.1 y 13.8 horas, respectivamente, lo que indica una meseta en la dosis de 100 µg. Por otra parte, la razón más común para la eliminación del inserto en el grupo de 300 µg fue la hiperestimulación del útero, mientras que la razón más común para la eliminación en el grupo de 100 y 200 µg era el trabajo de parto activo. Juntos, estos datos, en el momento, proporcionaron una evidencia más fuerte para continuar con la dosis de 100 µg en los ensayos clínicos posteriores. Monografía del producto CAPÍTULO VI 6.1 Seguridad clínica del inserto vaginal de Misoprostol 6.1.1 Información general El Misoprostol es eficaz y bien tolerado en el tratamiento de las mujeres indicadas para la inducción del parto y la maduración cervical. Esto es a pesar de la preocupación de que la administración intravaginal de las prostaglandinas, incluyendo el Misoprostol, puede inducir la hiperestimulación uterina (definida como una sola contracción de 2 minutos de duración o más de cinco contracciones en 10 minutos), lo que puede conducir a la angustia fetal y alteraciones del ritmo cardíaco fetal. La evidencia acumulada en los estudios de registro mostró que los eventos adversos registrados relacionados con el tratamiento con mayor frecuencia fueron: frecuencia cardíaca fetal preocupante, meconio en el líquido amniótico y taquisistolia uterina (Tabla 14).7,8,12,53,54 6.1.2 Estudio 1 - Seguridad12 En el estudio de Fase III pivotal, el punto final de seguridad co-primario fue la tasa de parto por cesárea durante la primera hospitalización. Esto ocurrió en el 26.0% de las mujeres en el grupo de inserto vaginal de Misoprostol 200 µg y en el 27.1% de las mujeres en el grupo del inserto vaginal de dinoprostona 10 mg. Los eventos adversos fueron la razón más común para la cesárea (25.1 y 24.7% para el inserto vaginal de Misoprostol 200 µg e inserto vaginal de dinoprostona 10 mg, respectivamente). Las razones más comunes para el parto por cesárea durante la primera hospitalización en cada grupo de tratamiento fueron (inserto vaginal de Misoprostol 200 µg e inserto vaginal de dinoprostona 10 mg, respectivamente): • Categoría II Patrón de la frecuencia cardíaca fetal (9.1 y 6.2%) • Detención de la dilatación / fracaso para dilatar (8,6 y 12,5%) • Detención de descenso / fracaso para descender (3.5 y 4.1%) • Taquisistolia uterina con desaceleraciones tardías, bradicardia o desaceleraciones prolongadas (1,9 y 0%) Aunque las tasas de efectos adversos maternos y neonatales fueron comparables entre los dos grupos de tratamiento, algunos eventos neonatales y los resultados fueron más frecuentes en el grupo del inserto vaginal de Misoprostol 200 µg en comparación con el grupo de inserto vaginal de dinoprostona 10 mg (Tabla 16). 28 29 Los partos por cesárea se asocian con estancias hospitalarias prolongadas y potencialmente pueden causar otros efectos adversos graves para la mayoría de las madres que se someten a una cesárea. Un análisis combinado de tres de los cinco estudios de registro7,8,12 mostró que la tasa de cesáreas fue de aproximadamente 30% con el inserto vaginal de Misoprostol, mientras que el inserto vaginal de Misoprostol 200 µg demostró ser no inferior al inserto vaginal de dinoprostona 10 mg con un margen de no inferioridad relativa 10% (Tabla 15).55 Estos raros, pero graves, eventos fueron revisados a fondo en una forma ciega por expertos externos, lo cuales llegaron a la conclusión de que había “ plausibilidad biológica limitada de que el fármaco del estudio había llevado a estos resultados”.12 6.1.3 Estudio 2 - Seguridad7 La tasa de parto por cesárea durante la primera hospitalización fue también el punto final de seguridad co-primario en el segundo estudio de fase III. De las mujeres que dieron a luz en la primera admisión, los partos por cesárea se produjeron en el 28.3, 28.9 y 27.1% en el inserto vaginal de Misoprostol 100 y 50 µg, e inserto vaginal de dinoprostona 10 mg, respectivamente. Las razones más comunes para el parto por cesárea en cada grupo incluido (inserto vaginal 100 y 50 µg, y el inserto vaginal de dinoprostona 10 mg, respectivamente): • Frecuencia cardíaca fetal no tranquilizada (37,8, 36,3 y 29,6%) • Detencion de descenso (20,2, 13,7 y 27,0%) • Detención de la dilatación (12,6, 21,8 y 16,5%) Eventos adversos relacionados con el tratamiento incluyen (inserto vaginal de Misoprostol 100 y 50 µg, e inserto vaginal de dinoprostona 10 mg, respectivamente): • El síndrome de hiperestimulación (4.0, 1.4 y 4.8%) • Frecuencia cardíaca fetal no tranquilizada (14,7, 12,2 y 15,4%) 6.1.4 Estudio 3 - Seguridad8 En el Estudio 3, partos por cesárea se realizaron en el 28.1% de la población total del estudio, lo que corresponde a 31.4, 30.4 y 22.9% de las mujeres en el grupo del inserto vaginal de Misoprostol 100, 150 y 200 µg, respectivamente. La frecuencia cardíaca fetal preocupante fue la razón más común para el parto por cesárea (11.0% de las mujeres en general) con la detención de dilatación como la segunda razón más común (10.2%). Los partos por cesárea realizados por la frecuencia cardíaca fetal poco confiable relacionada con el fármaco del estudio ocurrieron en el 2.7% de las mujeres (1.7, 2.4 y 3.8% para los grupos del inserto vaginal de Misoprostol 100, 150 y 200 µg, respectivamente). Aunque no se encontraron patrones de frecuencia cardíaca fetal para ser categoría II o III en la mayoría de las mujeres (58.0% del total), la mayoría se consideraron relacionados con el tratamiento del inserto vaginal de Misoprostol. Monografía del producto Hubo un aumento del riesgo de taquisistolia en el grupo del inserto vaginal de Misoprostol 200 µg (41.2%) en comparación con el grupo de 100 mg de dosis (19,5%, (RR, 2,11, IC del 95%: CI 1,39, 3,22, p <0,001) y grupo de 150 mg de dosis (25,6%; RR, 1,31, IC del 95%: 0,82 a 2,11, p = 0,26). 6.1.5 Estudio 4 - Seguridad53 Se observó taquisistolia uterina en el 5.6% de las mujeres en todas las dosis del inserto vaginal de Misoprostol en el Estudio 4. El Síndrome de hiperestimulación uterina se informó sólo en los dos grupos de dosis más altas, y se produjo con una incidencia de 6 y 10% para el inserto vaginal de Misoprostol de 100 y 200 µg, respectivamente. Los partos por cesárea se realizaron en seis mujeres, por diferentes razones, incluyendo una labor de parto obstruida y transversal (grupo 25 µg), un patrón de frecuencia cardiaca fetal no tranquilizador (grupo 50 µg), dos casos de desproporción céfalo-pélvica y un caso de patrón fetal inestable de la frecuencia cardíaca (200 µg). No hubo partos por cesárea en el grupo de 100 µg. 6.1.6 Estudio 5 - Seguridad54 El objetivo primario de seguridad para el Estudio 5 fue determinar la dosis máxima tolerada sobre la base de ocurrencia del síndrome de hiperestimulación. Un total de cinco mujeres se les removio el inserto vaginal de Misoprostol debido a la hiperestimulación uterina - cada uno de los grupos 50 y 200 µg y tres del grupo de 300 µg. 6.1.7 Las cuestiones de seguridad adicionales En general, el feto será sometido a un grado de hipoxia en algún momento durante el parto, que a menudo se tolera bien, aunque el feto puede señalar su malestar a través de cambios en los patrones de frecuencia cardiaca, meconio en el líquido amniótico, y las puntuaciones de Apgar bajas o acidosis sanguínea . Similar a otras prostaglandinas, el Misoprostol exhibe efectos uterotónicos y la taquisistolia es una extensión del efecto farmacológico del Misoprostol que conduce a tiempos acortados de parto vaginal. Posteriormente, se mantiene la preocupación de que la taquisistolia pueda ser perjudicial para el feto mediante la reducción de forma intermitente del flujo de sangre de la placenta y la inducción o exacerbación de hipoxia fetal. 30 En efecto, la taquisistolia se destacó como un resultado y evento adverso emergente del tratamiento de especial interés en el estudio pivotal de Fase III.12 El tratamiento inicial de taquisistolia en las mujeres que están recibiendo tratamiento con el inserto vaginal de Misoprostol es eliminar el fármaco del estudio utilizando el sencillo sistema de recuperación. Si el taquisistolia no disminuye, tocolisis u otros se podrán interponer. Por último, el paso a la cesárea puede ser afectado si la taquisistolia continúa con signos de sufrimiento fetal. En el estudio pivotal de Fase III, 90 mujeres tratadas con inserto vaginal de Misoprostol 200 µg experimentaron taquisistolia, de las cuales 25 (27.8%) requirieron medidas adicionales y 14 (15,6%) hicieron necesario un parto por cesárea.12 Los 14 recién nacidos por cesárea de madres con taquisistolia tuvieron puntuaciones de Apgar a 5 minutos de 7 o más y todos fueron dados de alta en el mismo día en que sus madres.55 De acuerdo a las guías clínicas del Colegio Americano de Obstetras y Ginecólogos,56 hay poca evidencia para apoyar la idea de que los patrones de frecuencia cardiaca fetal adversos o tinción meconial se asocian con malos resultados en el recién nacido. Por lo tanto, los cambios adversos en el patrón de la frecuencia cardíaca fetal y la presencia de meconio deben considerarse sólo como signos de que puede producirse un resultado adverso y que se requiere un cuidadoso monitoreo, y no como una prueba de que los daños en el feto ya se han producido o van a ser evidentes en el recién nacido. CAPÍTULO VII 7.1 El inserto vaginal de Misoprostol Versus el inserto vaginal de Dinoprostona 7.1.1 Información general Aunque la dinoprostona ya ha sido recomendada en las directrices para la inducción al trabajo de parto, menos del 50% de los recién nacidos nacen dentro de las 24 horas de la administración de la dinoprostona. Dada la necesidad de terminar el embarazo rápidamente y que sea predecible en mujeres en las que la inducción del parto está indicado médicamente, es deseable para lograr un menor tiempo de parto lo cual es posible con la dinoprostona. Por otra parte, un estudio realizado por Shetty et. al. ha demostrado que el trabajo de parto inducido artificialmente da como resultado tasas de satisfacción más bajas en comparación con el trabajo de parto espontáneo, lo que puede explicarse y que es potencialmente agravado por los retrasos entre el inicio de la inducción y el parto.57 En efecto, las inducciones del trabajo de parto de larga duración son a menudo percibidas como traumáticas por las mujeres.57 Además, un marco de tiempo más predecible de parto facilita la planificación de los recursos y la menor duración de la estancia en la unidad de suministro de trabajo de parto y también puede reducir los costos médicos. El inserto vaginal de Misoprostol 200 µg ha resultado en un tiempo de parto vaginal que es de aproximadamente 11 horas más corto que con el inserto vaginal de dinoprostona en mujeres tanto nulíparas y multíparas, y un tiempo para parto por cualquier vía que es de aproximadamente 9 horas más corto.12 Además, en comparación con la dosis de 100 mg, el inserto vaginal de Misoprostol 200 µg se ha asociado con una reducción significativa en el tiempo para el parto vaginal seguro.8 El inserto vaginal de Misoprostol, por lo tanto, tiene una alta utilidad en su capacidad de combinar los atributos de la administración de dosis de dinoprostona, incluyendo una única administración vaginal, de liberación controlada, y la eliminación de la droga exógena una vez que ya no es necesaria, con una mejora de los efectos de contractilidad uterina y los tiempos más cortos de parto. Además, la marcada reducción en el uso de la oxitocina que se ha encontrado con el inserto vaginal de Misoprostol 200 µg, en comparación con el inserto vaginal de dinoprostona, puede tener beneficios adicionales. Es decir, el uso de oxitocina para el aumento de trabajo de parto es controvertida, como se refleja en los numerosos regímenes de dosis de oxitocina que se utilizan en la práctica clínica y su inclusión en una lista de medicamentos de alto riesgo por el Instituto de las prácticas médicas seguras.58 7.1.2 Wing, et al. 2008 - Eficacia7 En el estudio de fase III de 1308 mujeres que requieren la maduración cervical y la inducción del trabajo de parto, el tiempo medio para el parto vaginal fue menor para el inserto vaginal de Misoprostol 100 mg que para el inserto vaginal de dinoprostona 10 mg (26.6 y 27.5 horas, respectivamente). De las mujeres que dieron a luz durante su primer ingreso en el hospital, la incidencia de partos por cesárea fue comparable entre el inserto vaginal de Misoprostol 100 mg (119 de 428 [27.8%]), el inserto vaginal de Misoprostol 50 µg (124 de 443 [28.0%]) y el inserto vaginal de dinoprostona 10 mg (115 de 436 [26.4%]). El inserto vaginal de Misoprostol de dosis de 100 µg es aproximadamente equivalente a un fragmento de 25 µg de tableta de Misoprostol insertada cada 6 horas, lo que puede ser considerado como conservador por algunos clínicos.8 Por otra parte, el hallazgo de que el inserto vaginal de Misoprostol 100 µg fue comparable al inserto vaginal de dinoprostona 10 mg, en términos de tiempo para el parto vaginal, ofrece una justificación para la investigación de un mayor depósito de dosificación de Misoprostol. La dosis de 200 µg se investigó en estudios posteriores, y se ha demostrado que es eficaz, segura y bien tolerada.8,12 De hecho, las mujeres en el estudio pivotal de Fase III mostraron tiempos significativamente más cortos para el parto vaginal (21.5 frente a 32.8 horas, p < 0.001), cualquier parto (18.3 frente a 27.3 horas, p < 0.001) y el inicio del trabajo de parto (12.1 frente a 18.6 horas, p < 0.001) con el inserto vaginal de Misoprostol 200 µg que con el inserto vaginal de dinoprostona 10 mg.12 31 7.1.3 Wing, et al. 2008 - Seguridad7 El síndrome de hiperestimulación se reportó en 4.0, 1.4 y 4.8% de las mujeres tratadas con el inserto vaginal de Misoprostol 100 y 50 µg, y el inserto vaginal de dinoprostona 10 mg, respectivamente, mientras que los patrones de frecuencia cardíaca fetal preocupante ocurrieron en el 14.7, 12.2 y 15.4% de las mujeres de estos grupos, respectivamente. Los resultados durante el parto que se produjeron en los tres grupos de tratamiento se muestran en la Tabla 17. Tabla 17 (siguiente página) Monografía del producto CAPÍTULO VIII 8.1 Uso en el mundo real del inserto vaginal de Misoprostol 8.1.1 Potencial para uso ambulatorio Hay un gran interés en los métodos de inducción del parto ambulatoria y ahora hay evidencia que sugiere que los pacientes internos y los métodos de inducción del parto ambulatoria logran resultados maternos y neonatales similares.59 Por otra parte, la inducción del parto ambulatoria se asocia con varios beneficios, incluyendo la reducción de la hospitalización del paciente, la carga de trabajo de las unidades de prestación de trabajo de parto y, costes sanitarios y una mayor satisfacción del paciente. Otro beneficio adicional en los embarazos prolongados es la menor necesidad de pruebas antes del parto.59 Sin embargo, hay consideraciones de seguridad asociadas con la inducción ambulatoria; las mujeres deben ser cuidadosamente seleccionadas para que las mujeres con embarazos de alto riesgo u otras contraindicaciones para la inducción se excluyan de dicho tratamiento.59 Las mujeres que pueden ser consideradas como las mujeres para la inducción ambulatoria son aquellas con embarazos simples sin posteriores complicaciones.59 En un estudio retrospectivo de cohorte de pacientes hospitalizadas y ambulatorias con inducción del trabajo de parto mediante el uso de un inserto vaginal de dinoprostona (datos recogidos de 1998-2006), ninguna de las mujeres en el grupo de pacientes ambulatorios tuvieron complicaciones graves en forma ambulatoria, y no hubo diferencias significativas en los resultados fetales, medido por el ingreso a la unidad de cuidados intensivos neonatales y las puntuaciones Apgar a los 5 minutos.60 Los resultados de este estudio demuestran que el uso de insertos vaginales de prostaglandina en el ámbito ambulatorio pueden, en el futuro, convertirse en una opción segura para las mujeres con un embarazo de bajo riesgo sometidas a la inducción del parto. Sin embargo, se necesitan más estudios y ensayos controlados aleatorios para confirmar el potencial del uso ambulatorio, ya sea para el inserto vaginal de prostaglandina; las directrices de RCOG actuales recomiendan que el uso de la prostaglandina vaginal en el ambulatorio se debe evaluar exhaustivamente antes de cualquier recomendación para su uso que en este contexto pueda ser hecha.13 32 33 CONCLUSIONES La experiencia clínica que se ha acumulado con el inserto vaginal de Misoprostol para la maduración cervical y la inducción del trabajo de parto demuestra un alto grado de eficacia y seguridad tanto para la madre como para el feto e indica un tiempo más rápido para el parto vaginal seguro que con preparados convencionales de prostaglandinas. El inserto vaginal de Misoprostol también reduce la necesidad de oxitocina sin aumentar la incidencia de parto por cesárea. Cumple con las necesidades insatisfechas asociadas con el uso de tabletas de Misoprostol oral por tener: una indicación y desarrollo destinado a la maduración cervical y a la inducción del parto; farmacocinética bien caracterizada en la población objetivo, una dosificación precisa, controlada y sostenida, el tiempo más predecible del parto, una sola administración para todo el período de tratamiento, la capacidad de ser eliminado de forma rápida y segura en caso de ser necesario, y un gran cuerpo de eficacia y seguridad de los datos de ensayos clínicos bien controlados. El Misoprostol encerrado en su sistema de recuperación integrante, tiene claras ventajas sobre las formulaciones de gel u oral de prostaglandinas, en el que se libera una baja concentración del agente activo durante un período prolongado (progresivamente lo cual conduce a la maduración cervical y la aparición gradual de las contracciones del miometrio) en lugar de la dosis completa rápidamente; su inserción es fácil - una sola dosis es suficiente para conseguir la maduración cervical en la mayoría de las mujeres, eliminando la necesidad de aplicaciones repetidas y añadiendo al paciente y al personal la aceptabilidad. En particular, la presencia del sistema de recuperación ofrece el control preciso del médico sobre el grado de maduración cervical, lo que permite la administración del fármaco para ser detenido por la retirada del inserto en cualquier momento. Monografía del producto CAPÍTULO XI INFORMACIÓN PARA PRESCRIBIR 1.- NOMBRE DEL PRODUCTO: Myspess 8.- REACCIONES SECUNDARIAS ADVERSAS Las siguientes han sido reportadas como reacciones adversas al fármaco en mujeres que han recibido el MVI 200 mg en los estudios clínicos efectuados. 2.- DENOMINACIÓN GENÉRICA: Misoprostol 3. FORMA FARMACÉUTICA Y FORMULACIÓN: Óvulo MIV: Sistema de Liberación Prolongada Inserto Vaginal = Óvulo de Misoprostol FÓRMULA: Cada óvulo contiene: Misoprostol………………………..200 mcg Excipiente cbp........................1 óvulo 4.- INDICACIONES TERAPÉUTICAS El MVI (óvulo de Misoprostol) está indicado para la inducción del trabajo de parto en mujeres con o cerca del embarazo a término. 34 5.- CONTRAINDICACIONES El MIV (óvulo de Misoprostol) no debe ser utilizado o dejado en su lugar: 12. Antes de la semana 36 de la gestación 13. Cuando el trabajo de parto ha comenzado 14. Cuando se están administrando oxitocicos u otros agentes inductivos del trabajo de parto. 15. Cuando ha habido cirugía uterina mayor, por ejemplo: Cesárea. 16. Cuando hay desproporción cefalopélvica. 17. Cuando existe una presentación fetal anómala 18. Cuando existe sospecha o evidencia de sufrimiento fetal. 19. Cuando existen antecedentes de una cirugía mayor previa o ruptura del cérvix 20. Cuando existe placenta previa o sangrado vaginal inexplicable después de 24 semanas de gestación en el embarazo actual. 21. Cuando existe hipersensibilidad al misoprostol o a cualquiera de los excipientes. 22. Paridad > 3 ADVERTENCIAS El MIV (óvulo de misoprostol) debe ser administrado solo por personal obstétrico apropiadamente entrenado y en una unidad obstétrica adecuada. 6.- PRECAUCIONES GENERALES El óvulo de misoprostol (MIV) no se ha estudiado en mujeres con gestación múltiple y por lo tanto se debe utilizar con precaución en estas mujeres. El MIV no se ha estudiado en mujeres cuyas membranas se hayan roto por más de 48 horas antes de la inserción del MIV y por lo tanto se debe utilizar con precaución en estas mujeres. Debido a que las prostaglandinas refuerzan el efecto uterotónico de los fármacos oxitócicos, el MIV debe ser retirado antes de que se inicie la administración de la oxitocina. Se recomienda un intervalo de dosificación de por lo menos 30 minutos para el uso secuencial de la oxitocina después del retiro del inserto. El MIV se debe retirar bajo las siguientes circunstancias: al inicio del trabajo de parto; si las contracciones uterinas son prolongadas o excesivas; si existe evidencia de compromiso fetal. Se debe monitorear cuidadosamente la actividad uterina y la condición fetal mientras el MVI esté colocado. Uso Pediátrico: La seguridad y la eficacia del MIV, se ha establecido en mujeres embarazadas mayores de 18 años de edad. El MIV no se ha estudiado sistemáticamente en mujeres menores de 18 años de edad. Uso Geriátrico: El MIV esta indicado para su uso en mujeres en edad reproductiva y quiénes están embarazadas y, por lo tanto, no está indicado para la población geriátrica. 7.- RESTRICCIONES DE USO DURANTE LE EMBARAZO Y LACTANCIA Trabajo de Parto: El MVI está indicado para la inducción del trabajo de parto en mujeres con o cerca del embarazo a término. Madres Lactantes: El misoprostol se ha detectado en la leche materna después de la administración vaginal. Las concentraciones del ácido de misoprostol en la leche materna son muy bajas, los niveles cayeron rápidamente después de la dosificación, de modo que la cantidad total del misoprostol excretado en el calostro o la leche, fue clínicamente insignificante (Vogel, Abdel - Aleem). 9.- INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO Interacciones del fármaco: No se recomienda el uso concomitante de fármacos oxitócicos o de otros agentes que induzcan el trabajo de parto debido al elevado potencial de efectos uterotonicos. 10.- PRECAUCIÓN EN RELACIÓN CON EFECTOS DE CARCINOGENESIS, MUTAGÉNESIS, TERATOGENESIS Y SOBRE LA FERTILIDAD Carcinogénesis, mutagénesis y alteraciones de la fertilidad: No se han realizado estudios a largo plazo de la carcinogenicidad y de la fertilidad con el MIV (óvulo de misoprostol). Los estudios de la carcinogenicidad realizados en ratas y ratones con misoprostol por vía oral fueron negativos. El misoprostol no es mutagénico en una gama de ensayos in vitro; ningún dato in vivo parece estar disponible en la literatura. En estudios de fertilidad en ratas, existe evidencia de posibles efectos adversos del misoprostol en la implantación, pero esta observación y la potencial teratogenicidad del fármaco no es un problema de seguridad para el MIV, pues se contraindica para su uso antes de la semana 36 de gestación (Ver Contraindicaciones). 35 11.- DOSIFICACIÓN Y VIA DE ADMINISTRACIÓN El MIV (óvulo de misoprostol) contiene 200 mcg de misoprostol, diseñado para ser liberado a razón de 8 mcg / hora aproximadamente. Un solo MIV debe insertarse por hasta 24 horas. El MIV se debe retirar bajo las siguientes circunstancias: ante el inicio del trabajo de parto; si las contracciones uterinas son prolongadas o excesivas; si hay evidencia de compromiso fetal; si han transcurrido 24 horas desde la inserción. Para retirar el MIV del empaque primario, primero rasgue la envoltura a lo largo de la parte superior del sobre (a). Utilizar la cinta de retiro para sacar suavemente el inserto del sobre (b). Sostener el inserto entre los dedos índice y medio (c). a b c Monografía del producto Colocar el extremo del inserto en el fondo de saco vaginal (fórnix) posterior (d) (e). Utilizar solamente lubricantes solubles en agua para ayudar a la inserción. Después de la inserción, se puede cortar la cinta de retiro con tijeras de modo que el extremo de la cinta esté apenas dentro del introito. REFERENCIAS 1.- Hofmeyr, G.J. Induction of labour with an unfavourable cervix. Best Pract Res Clin Obstet Gynaecol 17, 777-794 (2003). 2.- Tenore, J.L. Methods for cervical ripening and induction of labor. Am Fam Physician 67, 2123-8 (2003). 3.- Sanchez-Ramos, L. Induction of labor. Obstet Gynecol Clin North Am 32, 181-200, viii (2005). 4.- Wagner, M. Off-label use of Misoprostol in obstetrics: a cautionary tale. BJOG 112, 266-8 (2005). 5.- Chiossi, G. et al. In vitro myometrial contractility profiles of different pharmacological agents used for induction of labor. Am J Perinatol 29, 699-704 (2012). 6.- Chiossi, G. et al. The effects of prostaglandin E1 and prostaglandin E2 on in vitro myometrial contractility and uterine structure. Am J Perinatol 29, 615-22 (2012). 7.- Wing, D.A. Misoprostol vaginal insert compared with dinoprostone vaginal insert: a randomized controlled trial. Obstet Gynecol 112, 801-12 (2008). d e f La paciente debe recostarse de 20 a 30 minutos después de la inserción, pero posteriormente puede deambular. El MVI es retirado por la tracción suave del sistema de recuperación (cinta de retiro) (f). Después de su retiro, asegúrese de que el producto entero (inserto y sistema de recuperación) se haya removido de la vagina. 36 12.- MANIFESTACIONES Y MANEJO DE LA SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL. La sobredosificación es improbable con una formulación de liberación controlada. El MIV (óvulo de misoprostol) se debe retirar inmediatamente ante el inicio del trabajo de parto; dejar colocado el MIV después de que inicie el trabajo de parto, podría dar como resultado una excesiva cantidad de prostaglandina exógena, dando por resultado una hiperestimulación uterina. Si esto ocurre, el MIV debe ser retirado y la paciente debe ser manejada de acuerdo al protocolo local. ABUSO DE FÁRMACOS Y DEPENDENCIA No se ha observado ningún abuso o dependencia del fármaco con el uso del MIV (óvulo de misoprostol). 13.- PRESENTACIÓN. El MIV (óvulo de misoprostol) esta empacado de forma individual, sellado con un sobre laminado de aluminio / polietileno, en un paquete individual: Caja con 1 óvulo de 200 mcg e instructivo anexo. Caja con 2 óvulos de 200 mcg e instructivo anexo. Caja con 5 óvulos de 200 mcg e instructivo anexo. 14.- LEYENDAS DE PROTECCIÓN Su venta requiere receta médica. Para uso exclusivo en hospital. Léase instructivo anexo. No se deje al alcance de los niños. Para uso exclusivo del médico especialista. No ingerir. No utilizar si el empaque ha sido violado. Literatura exclusiva para médicos. Reporte las sospechas de reacción adversa al correo: [email protected] y al correo: [email protected] 15.- NOMBRE Y DOMICILIO DEL LABORATORIO: Hecho en Reino Unido por: Ferring Controlled Therapeutics Limited 1 Redwood Place, Peel Park Campus, East Kilbride Strathclyde, G74 5PB, Reino Unido Acondicionado y Distribuido por: FERRING S.A. DE C.V. Av. Nemesio Diez Riega, Mz 2, Lote 15 No.15, Col. Parque Industrial Cerrillo II C.P. 52000, Lerma, México 8.- Wing, D.A. et al. Misoprostol vaginal insert for successful labor induction: a randomized controlled trial. Obstet Gynecol 117, 533-41 (2011). 9.- United Nations. (2010). 10.- United Nations. (1999). 11.- Ferring Pharmaceuticals. (2013). 12.- Wing, D.A. et al. Misoprostol Vaginal Insert Reduces Time to Vaginal Delivery: The EXPEDITE Randomized Controlled Trial. In press. (2013). 13.- National Collaborating Centre for Women’s and Children’s Health. (2008). 14.- World Health Organization. (2011). 15.- Martin, J.A. et al. Births: final data for 2010. Natl Vital Stat Rep 61, 1-72 (2012). 16.- Martin, J.A. et al. Births: final data for 2005. Natl Vital Stat Rep 56, 1-103 (2007). 37 17.- National Health Service. (2010). 18.- EURO-PERISTAT, SCPE, EUROCAT & EURONEOSTAT. (2008). 19.- Gulmezoglu, A.M., Crowther, C.A., Middleton, P. & Heatley, E. Induction of labour for improving birth outcomes for women at or beyond term. Cochrane Database Syst Rev, CD004945 (2012). 20.- Kaimal, A.J. et al. Cost-effectiveness of elective induction of labor at 41 weeks in nulliparous women. Am J Obstet Gynecol 204, 137 e1-9 (2011). 21.- Vijgen, S.M. et al. An economic analysis of induction of labour and expectant monitoring in women with gestational hypertension or pre-eclampsia at term (HYPITAT trial). BJOG 117, 1577-85 (2010). 22.- Koopmans, C.M. et al. Induction of labour versus expectant monitoring for gestational hypertension or mild pre-eclampsia after 36 weeks’ gestation (HYPITAT): a multicentre, open-label randomised controlled trial. Lancet 374, 979-88 (2009). 23.- Blickstein, I. Induction of labour. J Matern Fetal Neonatal Med 22, 31-7 (2009). 24.- Pevzner, L., Rayburn, W.F., Rumney, P. & Wing, D.A. Factors predicting successful labor induction with dinoprostone and Misoprostol vaginal inserts. Obstet Gynecol 114, 261-7 (2009). 25.- Battista, L. & Wing, D.A. in Obstetrics: Normal and Problem Pregnancies (eds. Gabbe, S.G., Niebyl, J.R. & Simpson, J.L.) 322-343 (Churchill Livingstone, 2007). 26.- Pevzner, L., Powers, B.L., Rayburn, W.F., Rumney, P. & Wing, D.A. Effects of maternal obesity on duration and outcomes of prostaglandin cervical ripening and labor induction. Obstet Gynecol 114, 1315-21 (2009). 27.- Alfirevic, Z., Kelly, A.J. & Dowswell, T. Intravenous oxytocin alone for cervical ripening and induction of labour. Cochrane Database Syst Rev, CD003246 (2009). 28.- Mozurkewich, E.L. et al. Methods of induction of labour: a systematic review. BMC Pregnancy Childbirth 11, 84 (2011). 29.- Cromi, A., Ferrazzi, E., Frusca, T., Locatelli, A. & Zanini, A. (2011). 16.- NÚMERO DE REGISTRO DEL MEDICAMENTO Registro No. 033M2010 SSA IV IPP No. 133300415A0237 30.- Keirse, M.J. Prostaglandins in preinduction cervical ripening. Meta-analysis of worldwide clinical experience. J Reprod Med 38, 89-100 (1993). 31.- Hayashi, R.H. Spontaneous and induced cervical ripening. Natural dilation and effacement process and current cervical ripening techniques. J Reprod Med 38, 66-72 (1993). Monografía del producto 32.- Bishop, E.H. Pelvic scoring for elective induction. Obstet Gynecol 24, 266-8 (1964). 33.- Laughon, S.K., Zhang, J., Troendle, J., Sun, L. & Reddy, U.M. Using a simplified Bishop score to predict vaginal delivery. Obstet Gynecol 117, 805-11 (2011). 34.- Gelber, S. & Sciscione, A. Mechanical methods of cervical ripening and labor induction. Clin Obstet Gynecol 49, 642-57 (2006). 35.- Heinemann, J., Gillen, G., Sanchez-Ramos, L. & Kaunitz, A.M. Do mechanical methods of cervical ripening increase infectious morbidity? A systematic review. Am J Obstet Gynecol 199, 177-87 (2008). 36.- Thomas, J., Kelly, A.J. & Kavanagh, J. Oestrogens alone or with amniotomy for cervical ripening or induction of labour. Cochrane Database Syst Rev, CD003393 (2001). 37.- Weiss, G. et al. A randomized, double-blind, placebo-controlled trial of relaxin for cervical ripening in post-delivery date pregnancies. Ann N Y Acad Sci 1160, 385-6 (2009). 38.- Keirse, M.J.N.C. & van Oppen, A.C.A. in Effective care in pregnancy and childbirth (eds. Chalmers, I., Enkin, M. & Keirse, M.J.N.C.) 988-1056 (Oxford University Press, Oxford, 1989). 39.- Calder, A. & Embrey, M.P. Letter: Prostaglandins and the unfavourable cervix. Lancet 2, 1322-3 (1973). 40.- Liggins, G.C. Ripening of the cervix. Semin Perinatol 2, 261-71 (1978). 41.- Wing, D.A., Ortiz-Omphroy, G. & Paul, R.H. A comparison of intermittent vaginal administration of Misoprostol with continuous dinoprostone for cervical ripening and labor induction. Am J Obstet Gynecol 177, 612-8 (1997). 42.- Trofatter, K.F., Jr. Endocervical prostaglandin E2 gel for preinduction cervical ripening. Clinical trial results. J Reprod Med 38, 78-82 (1993). 43.- Rayburn, W.F. Prostaglandin E2 gel for cervical ripening and induction of labor: a critical analysis. Am J Obstet Gynecol 160, 529-34 (1989). 44.- Hapangama, D. & Neilson, J.P. Mifepristone for induction of labour. Cochrane Database Syst Rev, CD002865 (2009). 45.- Ferring Pharmaceuticals. (2010). 46.- Powers, B.L., Wing, D.A., Carr, D., Ewert, K. & Di Spirito, M. Pharmacokinetic profiles of controlled-release hydrogel polymer vaginal inserts containing Misoprostol. J Clin Pharmacol 48, 26-34 (2008). 38 47.- Ferring Pharmaceuticals. (2011). 39 48.- Karim, A., Rozek, L.F., Smith, M.E. & Kowalski, K.G. Effects of food and antacid on oral absorption of Misoprostol, a synthetic prostaglandin E1 analog. J Clin Pharmacol 29, 439-43 (1989). 49.- Pfizer Limited. (2012). 50.- Pharmacia Limited. (2013). 51.- Pfizer Limited. (2012). 52.- Rayburn, W.F., Powers, B.L., Plasse, T.F., Carr, D. & Di Spirito, M. Pharmacokinetics of a controlled-release Misoprostol vaginal insert at term. J Soc Gynecol Investig 13, 112-7 (2006). 53.- Ewert, K., Powers, B., Robertson, S. & Alfirevic, Z. Controlled-release Misoprostol vaginal insert in parous women for labor induction: a randomized controlled trial. Obstet Gynecol 108, 1130-7 (2006). 54.- Castaneda, C.S. et al. Misoprostol dose selection in a controlled-release vaginal insert for induction of labor in nulliparous women. Am J Obstet Gynecol 193, 1071-5 (2005). 55.- Ferring Pharmaceuticals. (2012). 56.- American College of Obstetricians and Gynecologists. ACOG Practice Bulletin No. 107: Induction of Labor. Obstet Gynecol 114, 386-97 (2009). 57.- Shetty, A., Burt, R., Rice, P. & Templeton, A. Women’s perceptions, expectations and satisfaction with induced labour--a questionnaire-based study. Eur J Obstet Gynecol Reprod Biol 123, 56-61 (2005). 58.- Institute for Safe Medical Practices. (2012). 59.- Rath, W.H. Outpatient induction - how safe. J Perinat Med 37, 461-7 (2009). 60.- Salvador, S.C., Simpson, M.L. & Cundiff, G.W. Dinoprostone vaginal insert for labour induction: a comparison of outpatient and inpatient settings. J Obstet Gynaecol Can 31, 1028-34 (2009). Monografía del producto