Variante conductual de la demencia frontotemporal como forma de
Anuncio
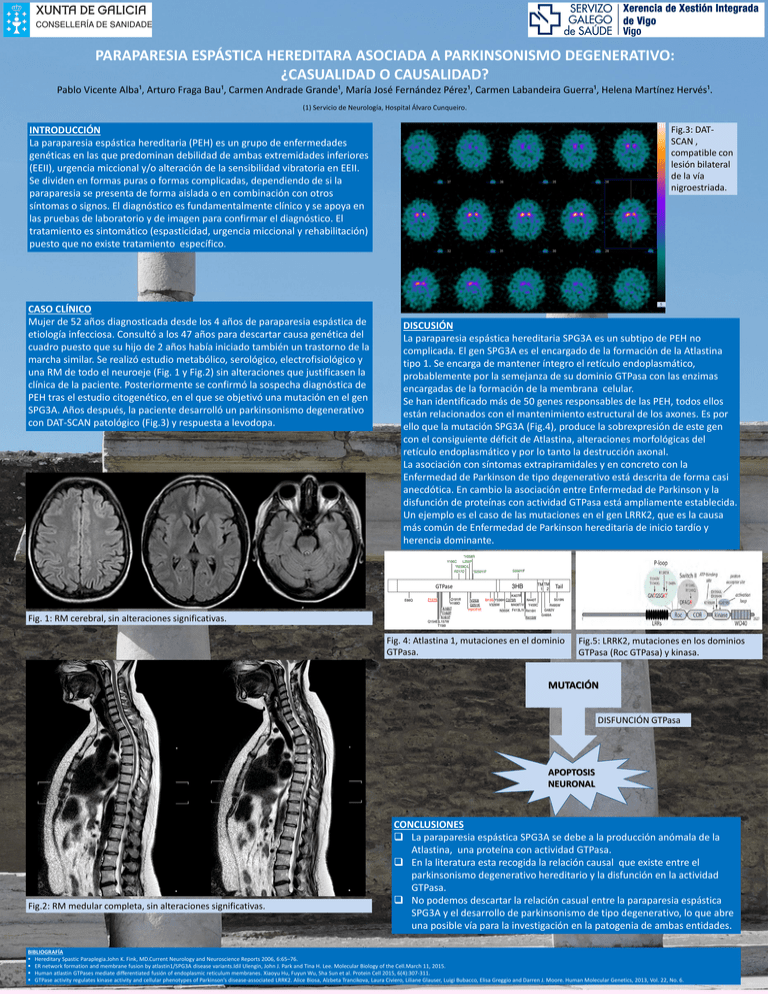
PARAPARESIA ESPÁSTICA HEREDITARA ASOCIADA A PARKINSONISMO DEGENERATIVO: ¿CASUALIDAD O CAUSALIDAD? Pablo Vicente Alba¹, Arturo Fraga Bau¹, Carmen Andrade Grande¹, María José Fernández Pérez¹, Carmen Labandeira Guerra¹, Helena Martínez Hervés¹. (1) Servicio de Neurología, Hospital Álvaro Cunqueiro. INTRODUCCIÓN La paraparesia espástica hereditaria (PEH) es un grupo de enfermedades genéticas en las que predominan debilidad de ambas extremidades inferiores (EEII), urgencia miccional y/o alteración de la sensibilidad vibratoria en EEII. Se dividen en formas puras o formas complicadas, dependiendo de si la paraparesia se presenta de forma aislada o en combinación con otros síntomas o signos. El diagnóstico es fundamentalmente clínico y se apoya en las pruebas de laboratorio y de imagen para confirmar el diagnóstico. El tratamiento es sintomático (espasticidad, urgencia miccional y rehabilitación) puesto que no existe tratamiento específico. CASO CLÍNICO Mujer de 52 años diagnosticada desde los 4 años de paraparesia espástica de etiología infecciosa. Consultó a los 47 años para descartar causa genética del cuadro puesto que su hijo de 2 años había iniciado también un trastorno de la marcha similar. Se realizó estudio metabólico, serológico, electrofisiológico y una RM de todo el neuroeje (Fig. 1 y Fig.2) sin alteraciones que justificasen la clínica de la paciente. Posteriormente se confirmó la sospecha diagnóstica de PEH tras el estudio citogenético, en el que se objetivó una mutación en el gen SPG3A. Años después, la paciente desarrolló un parkinsonismo degenerativo con DAT-SCAN patológico (Fig.3) y respuesta a levodopa. Fig.3: DATSCAN , compatible con lesión bilateral de la vía nigroestriada. DISCUSIÓN La paraparesia espástica hereditaria SPG3A es un subtipo de PEH no complicada. El gen SPG3A es el encargado de la formación de la Atlastina tipo 1. Se encarga de mantener íntegro el retículo endoplasmático, probablemente por la semejanza de su dominio GTPasa con las enzimas encargadas de la formación de la membrana celular. Se han identificado más de 50 genes responsables de las PEH, todos ellos están relacionados con el mantenimiento estructural de los axones. Es por ello que la mutación SPG3A (Fig.4), produce la sobrexpresión de este gen con el consiguiente déficit de Atlastina, alteraciones morfológicas del retículo endoplasmático y por lo tanto la destrucción axonal. La asociación con síntomas extrapiramidales y en concreto con la Enfermedad de Parkinson de tipo degenerativo está descrita de forma casi anecdótica. En cambio la asociación entre Enfermedad de Parkinson y la disfunción de proteínas con actividad GTPasa está ampliamente establecida. Un ejemplo es el caso de las mutaciones en el gen LRRK2, que es la causa más común de Enfermedad de Parkinson hereditaria de inicio tardío y herencia dominante. Fig. 1: RM cerebral, sin alteraciones significativas. Fig. 4: Atlastina 1, mutaciones en el dominio GTPasa. Fig.5: LRRK2, mutaciones en los dominios GTPasa (Roc GTPasa) y kinasa. MUTACIÓN DISFUNCIÓN GTPasa APOPTOSIS NEURONAL Fig.2: RM medular completa, sin alteraciones significativas. CONCLUSIONES La paraparesia espástica SPG3A se debe a la producción anómala de la Atlastina, una proteína con actividad GTPasa. En la literatura esta recogida la relación causal que existe entre el parkinsonismo degenerativo hereditario y la disfunción en la actividad GTPasa. No podemos descartar la relación casual entre la paraparesia espástica SPG3A y el desarrollo de parkinsonismo de tipo degenerativo, lo que abre una posible vía para la investigación en la patogenia de ambas entidades. BIBLIOGRAFÍA Hereditary Spastic Paraplegia.John K. Fink, MD.Current Neurology and Neuroscience Reports 2006, 6:65–76. ER network formation and membrane fusion by atlastin1/SPG3A disease variants.Idil Ulengin, John J. Park and Tina H. Lee. Molecular Biology of the Cell.March 11, 2015. Human atlastin GTPases mediate differentiated fusión of endoplasmic reticulum membranes. Xiaoyu Hu, Fuyun Wu, Sha Sun et al. Protein Cell 2015, 6(4):307-311. GTPase activity regulates kinase activity and cellular phenotypes of Parkinson’s disease-associated LRRK2. Alice Biosa, Alzbeta Trancikova, Laura Civiero, Liliane Glauser, Luigi Bubacco, Elisa Greggio and Darren J. Moore. Human Molecular Genetics, 2013, Vol. 22, No. 6.