Patologías del Pericardio - Enfermeria en Atención al Enfermo Crítico
Anuncio

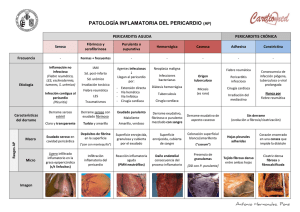
PATOLOGIA DEL PERICARDIO El presente artículo es una actualización al mes de octubre del 2006 del Capítulo de los Dres. Andres Orlandini, Enrique Tuero y Osvaldo Costamagna, del Libro Medicina Intensiva, Dr. Carlos Lovesio, Editorial El Ateneo, Buenos Aires (2001) RECUERDO ANATOMOFUNCIONAL El pericardio es una doble membrana fibrosa que recubre al corazón y al nacimiento de los grandes vasos, que se encuentra unida a la caja torácica por fuertes ligamentos. La capa externa, que constituye el pericardio parietal, es una membrana fibrosa recubierta internamente por una monocapa de células serosas. La capa serosa se repliega sobre la superficie epicárdica del corazón, formando el pericardio visceral. Esta serosa está compuesta por células mesoteliales con microvellosidades y cilias, lo que facilita el transporte de fluidos al aumentar notablemente el área de intercambio. El pericardio parietal tiene contacto directo con las partes planas del pericardio visceral, de modo que en estas regiones sólo existe un espacio virtual. En donde las superficies cardíacas son más curvas existe un espacio real, en particular en los surcos tales como el seno transverso o el seno oblicuo. En la cavidad pericárdica normalmente existen entre 15 y 50 ml de un ultrafiltrado del plasma. La presión intrapericárdica es neutra o negativa, y por lo tanto varios mmHg menor que la de las cavidades cardíacas. La curva de presión/volumen intrapericárdica se caracteriza por una porción plana inicial durante la cual prácticamente no se producen cambios de presión con los cambios de volumen, seguida por una porción final donde mínimos cambios de volumen producen grandes cambios de la presión (Fig. 1). P R E S I O N Taponamiento crítico Límite de distensión pericárdica Derrame rápido Derrame lento Volumen sobre el tiempo Fig. 34/1.- Curva de relación de presión/volumen intrapericárdica. El volumen del pericardio excede en un 10 al 20% al del corazón, por lo que los cambios fisiológicos del volumen cardíaco no producen restricción pericárdica. Las funciones del pericardio son: • Fijar anatómicamente el corazón a la caja torácica, impidiendo los desplazamientos ante los cambios de posición del cuerpo. • Reducir la fricción entre el corazón y los órganos adyacentes durante los movimientos producidos por el ciclo cardíaco. • Actuar como barrera contra la propagación de infecciones o tumores. • Impedir la dilatación excesiva del corazón con los cambios de volumen. • Contribuir al llenado auricular (presión negativa intrapericárdica). • Ayudar en el acoplamiento diastólico entre los dos ventrículos. A pesar de las funciones precitadas, no se han reconocido consecuencias adversas en casos de agenesia o de extirpación quirúrgica del pericardio. PERICARDITIS AGUDA La pericarditis aguda es un síndrome producido por la inflamación del pericardio que se caracteriza por dolor precordial, frote pericárdico y cambios electrocardiográficos evolutivos. Etiología Existen numerosa causas médicas y quirúrgicas que pueden producir pericarditis (Tabla 1), sin embargo las más comunes son las idiopáticas y/o virales, la urémica, la postinfarto y la postcirugía cardíaca. Tabla 1. Causas de pericarditis aguda • Idiopática (≅ 80%) • Infecciosa: viral (Coxsackie A9, B1-4, Echo 8, HIV, CMV, varicela, rubeola, Parvo B19, EBV), tuberculosa, bacteriana (S.aureus, Pneumococcus sp, Mycoplasma, otras), micótica (Histoplasma, Candida, Aspergillus), protozoarios (toxoplasma), otras (rickettsia, anaerobios, parásitos) • Post-infarto agudo de miocardio (síndrome de Dressler) • Metabólicas: uremia, hipotiroidismo • Neoplásicas: secundarias (mama, pulmón, linfoma, leucemia, melanoma), primarias (mesotelioma pericárdico, angiosarcoma) • Colagenopatías: lupus eritematoso sistémico, fiebre reumática, esclerodermia, granulomatosis, artritis reumatoidea, panarteritis nodosa, síndrome de Reiter • Terapia radiante • Producidas por drogas: hidralazina, procainamida, metildopa, isoniazida, etc. • Traumatismo torácico • Cirugía cardiaca (síndrome postpericardiotomía) • Disección aórtica • Otras: colesterínica, asociada a diálisis, quilopericardio, hidropericardio, etc. La pericarditis luego de un infarto agudo de miocardio habitualmente se produce uno a tres días después de la lesión transmural, presumiblemente debido a la interacción del epicardio necrótico con el pericardio adyacente. Una segunda forma de pericarditis asociada con el infarto de miocardio (síndrome de Dressler) se produce en forma característica semanas o meses luego del infarto. Es similar a la pericarditis que puede ocurrir días o meses después de una lesión pericárdica traumática, luego de la manipulación quirúrgica del pericardio, o luego del infarto de pulmón. Este síndrome se presume que es mediado por un mecanismo autoinmune y se asocia con signos de inflamación sistémica, incluyendo fiebre y poliserositis. La frecuencia de pericarditis después del infarto de miocardio se ha reducido con el empleo de la terapéutica de reperfusión. Cuadro clínico El dolor es el síntoma cardinal de la pericarditis aguda. El dolor de la pericarditis es muy variable pudiendo semejar a otras patologías tales como el infarto agudo de miocardio. Las características del dolor que se describen como típicas son la localización retroesternal, la irradiación al trapecio, el aumento de intensidad con los movimientos respiratorios y la atenuación en la posición sentada. La disnea es otro síntoma prominente, aunque no siempre está presente. Otros síntomas incluyen fiebre, tos, nauseas, vómitos, palpitaciones y mareos. Algunos síntomas dependen de la causa de la pericarditis: síndrome gripal (fiebre y mialgias) en la pericarditis viral; forma fulminante y rápida en la pericarditis purulenta bacteriana. La presencia de tos crónica, historia de pérdida de peso, sudoración nocturna y mal estado general puede ser indicativa de una pericarditis tuberculosa. En el examen físico el signo sobresaliente es el frote pericárdico. El mismo se ausculta como un frote entre dos cueros, que aumenta presionando el estetoscopio, en apnea y en posición sentado. En ocasiones el mismo puede ser palpable y ser variable, apareciendo y desapareciendo o cambiando de intensidad. Cuando se desarrolla un derrame pericárdico, el frote puede atenuarse o incluso desaparecer, pero en ocasiones puede persistir aun en presencia de un gran derrame. Es común la presencia de fiebre, pero una temperatura por encima de 38°C es inusual, y debe sugerir la posibilidad de una pericarditis purulenta. En el electrocardiograma se pueden observar cambios progresivos a medida que la enfermedad avanza (Fig. 2). En la primera etapa, se observa una elevación cóncava hacia arriba del segmento ST en las derivaciones precordiales y de los miembros, y una depresión del segmento PR. A medida que la enfermedad progresa, el segmento ST regresa a la línea de base, las ondas T se hacen planas, y el segmento PR puede deprimirse. Posteriormente se observa una inversión de las ondas T que puede persistir por semanas, o incluso indefinidamente. Fig. 2.- Electrocardiograma de pericarditis aguda. La radiografía de tórax puede ser normal, pero la silueta cardiaca puede aparecer aumentada si se acumula líquido (al menos 200-250 ml) en el saco pericárdico. En los análisis de laboratorio se pueden encontrar leucocitosis y velocidad de eritrosedimentación y proteina C reactiva aumentadas. Se pueden reconocer elevaciones escasas de la troponina. En el ecocardiograma se puede detectar en algunas ocasiones derrame pericárdico y ausencia de trastornos segmentarios de la motilidad parietal, dato que puede ser de utilidad para el diagnóstico diferencial de esta entidad con el infarto agudo de miocardio. Tratamiento Las pericarditis secundarias a alguna causa suelen responder al tratamiento de la misma. En los casos virales o idiopáticos se debe administrar un analgésico y se debe indicar reposo en cama. Los antiinflamatorios no esteroides resuelven los síntomas y suprimen la inflamación. Las drogas recomendadas son aspirina 650 mg por boca cuatro veces por día, naproxeno 250 a 500 mg dos veces por día por boca, o indometacina 50 a 75 mg tres veces por día por boca. La colchicina es una droga efectiva en pacientes que no toleran los DAINEs. En el estudio COPE (Imazio y col.) se comprobó que la asociación de aspirina con colchicina (1,0 a 2,0 mg el primer día seguida por 0,5 a 1,0 mg/día por tres meses) era más efectiva que la aspirina sola, reduciendo la sintomatología a las 72 horas y la recurrencia a 18 meses en forma más significativa. Se aconseja mantener la aspirina durante cuatro semanas y la colchicina durante tres meses para minimizar el riesgo de pericarditis recurrente. Aunque la pericarditis aguda habitualmente responde en forma dramática a los corticoides sistémicos, su empleo precoz en el curso de la enfermedad parece estar asociado con un aumento de la incidencia de recaídas. De acuerdo a esto, el empleo de corticoides sólo se debe considerar en pacientes con pericarditis recurrente que no responde a los DAINEs y a la colchicina, o si son necesarios para el tratamiento de una enfermedad de base inflamatoria. La dosis recomendada es de 1,0 a 1,5 mg/kg de prednisona, debiendo continuarse por lo menos un mes antes de iniciar un lento descenso de la dosis. Antes de suspender la prednisona, se aconseja introducir tratamiento antiinflamatorio con colchicina o DAINEs. PERICARDITIS CRÓNICA RECURRENTE En alrededor del 30% de los casos de pericarditis aguda el paciente puede sufrir episodios recurrentes de inflamación pericárdica. Dichos episodios pueden ir asociados con derrame pericárdico y/o derrame pleural. La mayoría de estos pacientes responden a altas dosis de antiinflamatorios no esteroideos. La colchicina ofrece la mejor profilaxis contra los episodios recurrentes y reduce los síntomas durante el ataque agudo. En ocasiones es necesario utilizar dosis decrecientes de corticoides. DERRAME PERICÁRDICO La acumulación de líquido en la cavidad intrapericárdica constituye el derrame pericárdico. Cualquiera de las causas que producen una pericarditis aguda o recurrente (Tabla 1) puede generar un derrame. Este incremento en el líquido intrapericárdico puede producir signos de compromiso hemodinámico o no, de acuerdo a la magnitud, a la velocidad de instalación y a las características elásticas del pericardio. Si el líquido se acumula lentamente, grandes cantidades producen solamente aumentos leves de la presión intrapericárdica. Por el contrario, cantidades relativamente pequeñas de líquido pueden producir importantes cambios en la presión intrapericárdica si éste se acumula abruptamente (Fig. 1 y 3). Además pequeñas cantidades de líquido también producen grandes aumentos de la presión intrapericárdica si el pericardio se encuentra rígido por alguna afección, caso de la pericarditis constrictiva. Cuadro clínico Los derrames pericárdicos que no producen alteraciones hemodinámicas suelen ser asintomáticos y por lo tanto descubrirse en exámenes de rutina. Cuando los derrames son de gran magnitud pueden producir síntomas por compresión de estructuras adyacentes, incluyendo 1. Tos y disnea, por atelectasias pulmonares o compresión traqueobraquial 2. Disfagia, por compresión esofágica 3. Hipo, por compresión del nervio frénico 4. Nauseas y/o vómitos, por compresión de vísceras abdominales El examen físico tampoco presenta signos floridos ni patognomónicos, destacándose solamente el apagamiento de los ruidos cardíacos que se produce en los derrames severos. En la placa de tórax se puede observar en ocasiones un agrandamiento de la silueta cardíaca con imagen en botellón, y menos frecuentemente se pueden visualizar las dos hojas del pericardio separadas. En el electrocardiograma se describen una disminución del voltaje de todos los complejos, depresión del segmento PR, cambios del ST-T, bloqueos de rama y alternancia eléctrica, que es rara en ausencia de taponamiento. Fig. 3.- Derrame pericárdico traumático. Observese la compresión de la aurícula derecha y del ventrículo derecho producida por un derrame leve, como consecuencia de la rápida instalación del cuadro. El método más sensible y más específico para el diagnóstico de derrame pericárdico, y por lo tanto indispensable, es el ecocardiograma. En este estudio se puede observar: • Separación de la hoja visceral y parietal del pericardio con un espacio interpuesto libre de ecos (Fig. 4) • Disminución de la motilidad del pericardio • “Swiming” (movimiento de vaivén) cardíaco La cuantificación de la cantidad exacta de líquido acumulado por medio de la ecocardiografía no es lo suficientemente fidedigna, sin embargo se puede lograr una aproximación a la misma, lo que permite clasificar a los derrames en: • Leve (menos de 100 ml): el líquido se acumula solamente en la región posterior, pegado al anillo mitral (Fig. 5). La separación entre las hojas parietal y visceral sólo se observa durante la sístole. • Moderado (100-500 ml): se observa más líquido en la región posterior, y además se encuentra en las regiones lateral, anterior y apical. La separación entre las hojas epicárdicas se observa en sístole y en diástole. • Severo (más de 500 ml): El líquido se observa en todas las regiones, por lo que el corazón aparece como flotando en el derrame, pudiendo reconocerse el ”swiming” cardíaco (movimientos en sentido anterolateral y en sentido medial) (Fig. 6). Fig 4.- Separación entre las hojas parietal y visceral del pericardio observada por ecocardiograma modo M, en un derrame pericárdico posterior. Fig. 5.- Derrame pericárdico de grado leve. Sólo se observa en la región posterior en eje corto paraesternal. Fig. 6.- Derrame pericárdico anteroposterior de grado moderado a severo, sin compromiso hemodinámico. Diagnóstico etiológico De acuerdo a la etiología, las características del líquido acumulado pueden variar. Así, se pueden encontrar líquidos serosos, hemáticos, serohemáticos, serofibrinosos o purulentos. Si bien en algunas ocasiones el ecocardiograma puede dar una idea de qué tipo de líquido se trata, el diagnóstico de las características del mismo no puede hacerse sin un examen directo. La pericardiocentesis puede estar indicada con fines diagnósticos cuando se sospecha etiología infecciosa o neoplásica. Es de hacer notar que la presencia de líquido hemático no reviste la misma significación que en los líquidos pleural o peritoneal, ya que puede existir en derrames pericárdicos de casi cualquier etiología, incluidas la pericarditis viral o idiopática. El fluido debe ser analizado para el contenido de glucosa, proteínas y LDH, así como recuento celular, microscopía (incluyendo Gram y tinción de Ziehl-Nielsen), cultivo bacteriano, y examen citológico. Las técnicas de PCR pueden identificar virus y M.tuberculosis. Las técnicas de inmunohistoquímica pueden identificar anticuerpos contra el miolema y el sarcolema en la pericarditis autoinmune. Las concentraciones elevadas de adenosina deaminasa (ADA>40 UI/L) son diagnósticas de M. tuberculosis. Ante la sospecha de enfermedad maligna se deben solicitar citología y marcadores específicos: CEA, alfa-feto proteína, CA 125, CA 72-4, CA 15-3, CA 19-9, CD-30, CD-25, etc. La biopsia pericárdica debe ser considerada si se sospecha una causa neoplásica o granulomatosa de la pericarditis. Tratamiento En la pericarditis purulenta es mandatorio realizar un drenaje pericárdico urgente, combinado con la administración intravenosa de antibacterianos: vancomicina 1 g/12 hs., ceftriazona 1-2 g/12 hs., y ciprofloxacina 400 mg/12 hs. La irrigación con uroquinasa o estreptoquinasa, con catéteres gruesos, puede licuar el exudado purulento, pero es preferible el drenaje quirúrgico. El tratamiento inicial de la pericarditis tuberculosa incluye isoniazida 300 mg/día, rifampicina 600 mg/día, pirazinamida 15-30 mg/kg/día, y etambutol 15-25 mg/kg/día. Se debe adicionar prednisona 1-2 mg/kg/día durante 5 a 7 días y reducir progresivamente hasta discontinuar en seis a ocho semanas. La pericardiectomía está reservada para las efusiones recurrentes o la elevación continua de la presión venosa central luego de 4-6 semanas de tratamiento. En presencia de derrames recurrentes en los cuales la pericardiocentesis repetida no resuelve el problema, un procedimiento alternativo es la realización de una ventana pericárdicopleural por pericardioscopia o toracoscopia asistida con video. La instilación de agentes esclerosantes, como la minociclina, puede ser útil en los derrames neoplásicos. TAPONAMIENTO CARDIACO Concepto El taponamiento cardíaco es un cuadro clínico que ocurre cuando la acumulación de líquido intrapericárdico conduce a un incremento de la presión pericárdica en grado tal que se produce la compresión de las cámaras cardíacas. Este cuadro clínico se caracteriza por la elevación de las presiones intracardíacas, la limitación progresiva del llenado ventricular durante la diástole y la disminución del volumen sistólico. Si no se trata, el taponamiento cardiaco puede ser fatal. Fisiopatología En condiciones normales, el espacio entre las láminas visceral y parietal del pericardio puede acomodar sólo una pequeña cantidad de fluido antes de que se produzcan los cambios fisiológicos del taponamiento. No es extraño, por ende, que la perforación cardiaca rápidamente condicione un taponamiento. Con la acumulación gradual de líquido, como ocurre en los pacientes con neoplasias, en cambio, pueden acomodarse grandes efusiones sin producir taponamiento. El concepto clave es que cuando el volumen intrapericárdico produce un aumento de la presión que alcanza la región de “no-compliance“ (Fig. 1), rápidamente se produce el taponamiento. Debido a sus bajas presiones, las cavidades derechas del corazón son más vulnerables a la compresión por el derrame pericárdico, siendo el lleno anormal de las cavidades derechas el primer signo de una efusión pericárdica con repercusión hemodinámica. En estas condiciones, el llenado adecuado del corazón derecho requiere de un aumento compensatorio de la presión venosa sistémica, que resulta de la venoconstricción y de la retención de líquidos. Se debe tener en cuenta que cuando el taponamiento cardiaco es el resultado de una hemorragia en el pericardio, puede aparecer un colapso circulatorio rápido no sólo por el aumento de la presión pericárdica sino por la hipovolemia concomitante, que impide el aumento compensatorio de la presión venosa. El aumento de la presión pericárdica en el taponamiento cardiaco acentúa la interdependencia de las cámaras cardiacas a medida que el volumen cardiaco total se limita por la constricción pericárdica. El volumen de cualquier cámara cardiaca sólo puede aumentar cuando se produce una disminución similar de las otras cámaras. Por otra parte, el retorno venoso y el llenado auricular se producen predominantemente durante la sístole ventricular, a medida que la eyección de sangre del ventrículo derecho e izquierdo disminuye el volumen cardiaco y permite que entre sangre a las aurículas. Además, el efecto normal de la respiración se acentúa, de modo que el retorno venoso y el llenado auricular derecho se producen durante la inspiración a medida que disminuye la presión intratorácica, permitiendo un gradiente de presión entre el sistema venoso y la aurícula derecha. Debido a que el volumen intrapericárdico está fijado por el derrame presurizado, el aumento del llenado ventricular derecho durante la inspiración impide el llenado ventricular izquierdo. Por ello, en el taponamiento, el llenado ventricular izquierdo ocurre preferentemente durante la espiración, cuando existe menos llenado del ventrículo derecho. La pequeña variación en el volumen de eyección ventricular izquierdo y en la presión arterial sistólica que se produce durante la respiración, están marcadamente acentuados en el taponamiento cardiaco, resultando en el hallazgo clínico del pulso paradojal (ver más adelante). En la Fig. 7 se resumen los acontecimientos fisiopatológicos que acompañan a la acumulación de líquido en la cavidad pericárdica y el desarrollo de taponamiento cardiaco. Volumen líquido Presión Pericardio AD y VD Presión de fin de diástole Lleno ventricular diastólico VI Presión de fin de diástole Volumen sistólico Activación de los mecanismos compensatorios (Aumento de la FC y de la FeV) Presión arterial sistémica mantenida Fallo de los mecanismos compensatorios Disminución de la presión arterial sistémica Hipoperfusión tisular Bradicardia, disociación electromecánica Muerte Fig. 7.- Fisiopatología del taponamiento cardiaco. Cuadro clínico El taponamiento cardíaco tiene dos modalidades de presentación, la aguda y la crónica. En el taponamiento agudo que se produce luego de un traumatismo (Fig. 2) con perforación, una ruptura cardíaca o como complicación de un aneurisma disecante de aorta, con relativa pequeña cantidad de líquido acumulado (menos de 200ml) se produce un importante aumento de la presión intrapericárdica. En los casos que no son inmediatamente fatales, el paciente se presenta con un cuadro de shock con marcada elevación de la presión venosa central. La actividad cardíaca es generalmente no palpable y los sonidos cardíacos son hipofonéticos o inaudibles. El pulso paradojal puede ser difícil de detectar debido al cuadro de hipotensión severa presente. En los casos en que el líquido se acumula lentamente el principal síntoma del paciente es la disnea, la cual se produciría por compresión pulmonar. En ocasiones los pacientes refieren dolor precordial opresivo. El signo más comúnmente hallado en la serie de Guberman y colaboradores fue la ingurgitación yugular. Coexistente con esta ingurgitación yugular se observa en el análisis del pulso venoso una profundización del valle x con desaparición del valle y. Otros signos comúnmente hallados fueron taquipnea (80%), taquicardia (77%) y pulso paradójico (77%). La presencia de pulso paradojal es fundamental en el diagnóstico de taponamiento cardíaco. El mismo se define como un descenso de >10 mmHg en la presión arterial sistólica durante la inspiración, sin cambios en la presión arterial diastólica. El pulso paradojal es una exageración de la disminución normal en el volumen de eyección ventricular izquierdo y de la presión arterial que se produce durante la inspiración. El mismo se detecta como una disminución de la amplitud del pulso femoral o carotídeo durante la inspiración, incluso el pulso puede desaparecer. Dicha caída se produce porque el aumento del retorno venoso producido por la inspiración produce una dilatación del ventrículo derecho, con abombamiento del septum hacia el ventrículo izquierdo, con la consiguiente disminución en su volumen y en consecuencia en el volumen sistólico. Otras patologías que pueden producir pulso paradojal son la EPOC, pericarditis constrictiva, miocardiopatias restrictivas, tromboembolismos masivos y cuadros de severa hipovolemia, en este último caso sin distensión yugular. Es importante reconocer que el pulso paradojal puede ser difícil de reconocer en presencia de shock severo y puede estar ausente en el taponamiento cardiaco si coexiste insuficiencia aórtica, defecto septal auricular, o preexiste una elevada presión de fin de diástole ventricular izquierda debido a hipertrofia o dilatación del ventrículo izquierdo. En la radiografía de tórax se puede detectar, si el cuadro clínico es de instalación lenta y se han acumulado más de 250 ml de líquido en la cavidad intrapericárdica, un aumento de la silueta cardíaca con la imagen típica en botellón. Esta imagen es indicativa de derrame pericárdico, pero no de su repercusión hemodinámica. En el electrocardiograma, el signo más indicativo de taponamiento cardíaco es la alternancia eléctrica, que refleja el movimiento pendular del corazón dentro del espacio pericárdico. Dicha alternancia eléctrica puede ocurrir en una relación 2:1 o 3:1, y generalmente está limitada al complejo QRS, pero puede comprender también la onda P y más raramente la onda T. Ecocardiograma El ecocardiograma es el método no invasivo que puede brindar más datos ante la sospecha de taponamiento cardíaco. El ecocardiograma permite documentar la presencia y magnitud del derrame pericárdico, hallazgo crucial para el diagnóstico de taponamiento cardíaco, ya que la ausencia de derrame prácticamente lo excluye, excepto en el post-operatorio de cirugía cardíaca, en el que se puede producir taponamiento por la presencia de un trombo o de acumulación localizada de líquido. El ecocardiograma también permite un rápido diagnóstico diferencial con otros cuadros que pueden semejar un taponamiento, como son la pericarditis constrictiva, la falla cardíaca y el infarto de ventrículo derecho. Los hallazgos ecocardiográficos que indican taponamiento son: • Colapso de la aurícula derecha, que es el signo más precoz (Fig. 8) • Colapso del ventrículo derecho (Fig. 9) • Colapso de la aurícula izquierda • Movimiento paradojal del septum en inspiración • Dilatación de la vena cava con inmovilidad durante la inspiración • Pseudohipertrofia del ventrículo izquierdo • Corazón ondulante (en presencia de volúmenes grandes de líquido) Con el Doppler cardíaco, por su parte, se puede observar: • Incremento anormal (>40%) de la velocidad de flujo tricuspídeo durante la inspiración • Disminución anormal (>25%) de la velocidad del flujo transmitral durante la inspiración (Fig. 10) • Disminución marcada del flujo pulmonar o aórtico durante la inspiración (reflejo del pulso paradójico) • Flujo en las venas pulmonares con onda sistólica normal, pero con desaparición de la onda diastólica • Ocupación por elementos anormales de la cavidad pericárdica (Fig. 11) Estos cambios permiten el diagnóstico de taponamiento en la mayoría de los casos, pero no son 100% específicos ni 100% sensibles, por lo que en muchos casos se requiere la sumatoria de datos clínicos, ecocardiográficos y hemodinámicos para establecer un diagnóstico de certeza. Fig. 8.- Derrame pericárdico severo con compresión de aurícula derecha. Fig. 9.- Derrame pericárdico severo con compresión del ventrículo derecho. Observese que la cavidad del ventrículo es prácticamente virtual. Fig. 10.- Disminución de la velocidad del flujo transmitral durante la inspiración en un paciente con taponamiento cardiaco. Fig. 11.- Paciente con sepsis estafilocóccica que presenta taponamiento cardiaco. En el ecocardiograma se observa el derrame pericárdico y una imagen de pseudocavidad en la cavidad pericárdica. En el acto operatorio se constató la presencia de hemopericardio por arteritis secundaria a absceso (flecha) intracavitario. El cultivo demostró S. aureus meticilino resistente. Evaluación hemodinámica Ante la sospecha de taponamiento cardíaco, y si el estado del paciente lo permite, esta indicado realizar un estudio de presiones en cavidades derechas por medio de un cateter de Swan Ganz. En el mismo se reconoce (Fig. 12): • Ecualización y elevación de las presiones derechas. Esto significa que la presión diastólica de aurícula derecha, la diastólica de ventrículo derecho y la presión de enclavamiento son prácticamente iguales. • Se observa un moderado aumento de la presión sistólica de ventrículo derecho y arteria pulmonar, ya que las mismas son el resultado de la suma de la presión intrapericárdica y la presión desarrollada por el ventrículo derecho. • En el análisis de la curva de presión de aurícula derecha se produce un marcado descenso del valle x con disminución o desaparición del valle y. • Por último, se puede observar una elevación de las resistencias periféricas y una marcada disminución del volumen sistólico, si bien el volumen minuto puede estar mantenido por un aumento de la frecuencia cardíaca. Fig. 12.- Hemodinamia del taponamiento cardiaco. Observese la ecualización y elevación de las presiones diastólicas de aurícula derecha, arteria pulmonar y capilar pulmonar. Evolución y tratamiento Las medidas más importantes para el tratamiento del taponamiento pericárdico incluyen la elevación de los miembros inferiores, la expansión de volumen con una infusión intravenosa de solución salina o coloides, y la realización inmediata de una pericardiocentesis, si es posible guiada por ecocardiografia. Se debe tener en cuenta que la ventilación con presión positiva puede disminuir críticamente el retorno cardiaco y producir una disociación electromecánica en presencia de un taponamiento cardiaco importante. Una vez realizado el diagnóstico de taponamiento se debe extraer el líquido intrapericárdico. Esta evacuación se puede realizar mediante pericardiocentesis percutánea, pericardiotomía por incisión subxifoidea, o pericardiectomía quirúrgica parcial o total. La pericardiocentesis (Fig. 13) permite una rápida desaparición de los síntomas, la comprobación de los cambios hemodinámicos pre y post procedimiento y con el análisis del líquido obtenido realizar en ocasiones el diagnóstico etiológico. Las complicaciones más serias, que se pueden presentar en alrededor del 5% de los casos, son la perforación de las cavidades cardíacas o el pulmón y la ruptura de una arteria coronaria, las que pueden comprometer la vida del paciente. El procedimiento tiene más posibilidades de ser exitoso cuando existe un derrame pericárdico voluminoso, con acumulación anterior del líquido que produzca un separación entre las láminas mayor de 10 mm. Por el contrario, existen más posibilidades de complicaciones cuando no existe derrame anterior, en taponamientos agudos que después de evacuados se reproducen rápidamente, en derrames pequeños (menos de 200 ml), en derrames localizados y cuando existen trombos. El ecocardiograma es útil para guiar la realización de una pericardiocentesis y para disminuir la incidencia de complicaciones, lo que fue demostrado por Callahan y col., en cuya serie de 132 pacientes con pericardiocentesis guiada por ecocardiograma no se produjeron muertes y sólo se produjo un neumotórax y tres complicaciones menores. Inclinación de la aguja de 15° Area apical Fig. 13.- Sitios habituales de realización de la pericardiocentesis. Area paraxifoidea PERICARDITIS CONSTRICTIVA La pericarditis constrictiva se caracteriza por la presencia de un engrosamiento fibroso y adherente del pericardio que produce una restricción al llenado diastólico del corazón. En la mayoría de los casos se produce una fusión entre las hojas parietal y visceral, pero en algunos raros casos la constricción la produce sólo la hoja parietal. En los estadios crónicos se deposita calcio, el que contribuye al engrosamiento y endurecimiento del pericardio. Etiología La mayoría de las pericarditis constrictivas son de causa desconocida y podrían ser secundarias a una pericarditis aguda no diagnosticada, con derrame con depósitos de fibrina. Se produce una progresión lenta a una etapa subaguda, seguida por una etapa crónica con consolidación de la fibrina, engrosamiento pericárdico y obliteración de la cavidad pericárdica. Dentro de las causas conocidas de pericarditis constrictiva, la más frecuente es la de origen tuberculoso. Otras causas incluyen la insuficiencia renal crónica, enfermedades del tejido conectivo, infiltración neoplásica del pericardio, radioterapia y síndrome de Dressler. La cirugía cardiaca se complica con pericarditis constrictiva en menos del 0,5% de los casos, pero teniendo en cuenta el gran número de cirugías que se realizan, en la actualidad se ha convertido en una causa frecuente de pericarditis constrictiva. Fisiopatología En la pericarditis constrictiva clásica, el proceso generalmente es simétrico y compromete por igual a todas las cámaras cardíacas, resultando en un incremento equilibrado de las presiones diastólicas de las cuatro cámaras cardíacas. El llenado ventricular se produce casi exclusivamente en la diástole temprana, momento en que el ventrículo izquierdo tiene un volumen disminuido. El llenado ventricular temprano se produce rápidamente debido a que la presión en la aurícula derecha se encuentra aumentada, y termina bruscamente debido al rápido incremento de la presión al llenarse el ventrículo dentro de un pericardio no complaciente. Este patrón anormal de llenado ventricular es el responsable del característico dip y plateau de las curvas de presión de ventrículo izquierdo y derecho, que se observan en esta entidad (Fig. 14). El dip corresponde al período de llenado rápido, y el plateau a la fase media y tardía de la diástole donde prácticamente no se produce llenado ventricular. Fig. 14.- Hemodinamia ventricular en la pericarditis constrictiva. Izquierda: las curvas de presión en el ventrículo izquierdo y en el ventrículo derecho muestran un dip diastólico precoz con una transición nítida al plateau (el signo de la escuadra). La ondas también muestran una equilibración diastólica. Derecha: curva de presión auricular derecha mostrando la onda en forma de W. Debido a que las presiones en las aurículas están equilibradas con las presiones ventriculares, las curvas auriculares muestran un prominente descenso diastólico que corresponde a la onda y. El descenso sistólico (onda x) está generalmente presente, por lo que las curvas presentan la típica forma de M o W. Como el llenado auricular se produce también en el inicio de la diástole, el flujo de la vena cava o de las venas pulmonares revela un patrón bimodal, sistólico y diastólico, pero con predominio de la onda diastólica, lo que lo diferencia del patrón normal donde la prominente es la onda sistólica, y del patrón observado en el taponamiento donde no existe llenado durante la diástole. En la pericarditis constrictiva, además, no se producen modificaciones de la presión intrapericárdica con los movimientos respiratorios, por lo tanto, durante la inspiración no se produce incremento significativo en los flujos derechos, en contraste con los pacientes normales y los que tienen taponamiento. En algunos pacientes incluso la ingurgitación yugular puede aumentar durante la inspiración (signo de Kussmaul). Cuadro clínico En un comienzo, cuando las presiones no se encuentran muy elevadas, predominan los síntomas de congestión venosa, tales como hepatomegalia, ascitis o edemas, como manifestación de la insuficiencia cardíaca derecha. Cuando la presiones izquierdas y derechas se encuentran muy elevadas aparecen los síntomas de congestión venosa pulmonar: disnea o tos, características de la insuficiencia izquierda retrógrada. Ocasionalmente se puede observar platipnea (disnea en posición supina), sin que se conozca el mecanismo causal de la misma. Posteriormente aparecen los síntomas de bajo volumen minuto: fatiga, pérdida de peso, debilidad (insuficiencia anterógrada); terminando el paciente en estado caquéctico. En el examen físico el hallazgo más frecuente es la ingurgitación yugular donde se puede observar el típico patrón en W previamente descripto. El signo de Kussmaul (aumento de la ingurgitación yugular durante la inspiración) es típico de restricción, sin embargo se puede observar en otros síndromes como ser insuficiencia cardíaca derecha crónica y miocardiopatía restrictiva. Este signo no se produce en el taponamiento cardíaco, por lo que es importante en el diagnóstico diferencial entre estas dos entidades. En la pericarditis constrictiva es posible la presencia de pulso paradójico, pero es muy poco frecuente. En la auscultación se encuentra otro signo característico de esta entidad, el knock pericárdico. Un sonido diastólico agudo que se produce al final del periodo de llenado rápido por la brusca desaceleración del llenado ventricular. Este ruido tiende a ser más agudo y más precoz que el tercer ruido, por lo que es más fácil confundirlo con el chasquido de apertura de la estenosis mitral. También se produce una separación marcada del segundo ruido cardíaco. Es frecuente hallar hepatomegalia, ascitis, angiomas, eritema palmar, edemas maleolares, todos signos de insuficiencia cardíaca derecha. En aproximadamente la mitad de los pacientes se observa en la radiografía de tórax una calcificación extensa del pericardio. Si esta calcificación está presente refuerza el diagnóstico de pericarditis tuberculosa. Cabe destacar que la observación de calcificación en una placa de tórax, no necesariamente indica que el paciente tenga restricción. Otro hallazgo frecuente en la radiografía es la presencia de derrame pleural (60% de los casos), y signos de hipertensión venocapilar pulmonar. Los hallazgos característicos en el electrocardiograma incluyen disminución de voltaje del complejo QRS, inversión generalizada de la onda T y onda P de dilatación auricular. En aproximadamente el 40% de los casos el paciente se presenta fibrilación auricular. Por último se pueden observar patrones de pseudoinfarto cuando la calcificación pericoronaria compromete el miocardio circundante. Ecocardiograma El patrón ecocardiográfico en modo M de la pericarditis constrictiva se caracteriza por la presencia de dos líneas paralelas, engrosadas, que representan la hoja parietal y la visceral del pericardio, separadas por un espacio no menor de 1 mm. Otro signo en el modo M es la observación de un movimiento brusco posterior del septum interventricular, producido por el llenado rápido del ventrículo izquierdo. En el ecocardiograma bidimensional se puede observar un engrosamiento con aumento de la ecodensidad pericárdica y movimiento asincrónico del septum. Otros signos son la dilatación de la vena cava y de las venas hepáticas, sin fluctuación con los movimientos respiratorios. Con ecodoppler se puede observar un patrón del flujo mitral y tricuspídeo de tipo restrictivo (onda E aumentada, con disminución de onda A) (Fig. 15). En los flujos de las venas suprahepáticas o de la vena cava inferior, se puede detectar el típico patrón en W o en M. Los hallazgos ecocardiográficos característicos que diferencian la pericarditis constrictiva de la cardiomiopatía restrictiva son el engrosamiento del pericardio, las variaciones respiratorias significativas en los flujos transmitral, de las venas pulmonares y tricuspideo, y la preservación de los índices de relajación miocárdica. Fig. 15.- Patrón restrictivo en el flujo transmitral en paciente con pericarditis constrictiva. Fig. 16.- Pericarditis constrictiva visualizada con resonancia magnética por imágenes. Obsérvese el casquete pericárdico en ambas vistas, donde se puede evaluar con precisión el engrosamiento y la calcificación del pericardio. Otros métodos complementarios para el diagnóstico de pericarditis constrictiva son la tomografía axial computada y la resonancia magnética nuclear, que son las técnicas más precisas para definir el engrosamiento pericárdico (Fig. 16). Aun con las modernas técnicas de imagen, el diagnóstico de la pericarditis constrictiva puede ser dificultoso, en particular en los casos complejos con hallazgos mixtos de constricción y restricción. Hemodinamia En el estudio de las presiones en cavidades derechas por medio de un cateter de Swan Ganz se puede observar: • Elevación y ecualización de las presiones diastólicas. • Presencia de dip y plateau en la curva de ventrículo derecho. • Curva de presión de aurícula derecha con la típica forma en W. • Aumento de la presión en la aurícula derecha durante la inspiración. • Elevación moderada de las presiones sistólicas de la arteria pulmonar y del ventrículo derecho. • Disminución del volumen sistólico. En ocasiones estos cambios no son observables en condiciones basales, sobre todo en pacientes con tratamiento con diuréticos, por lo tanto para ponerlos de manifiesto es necesario administrar una sobrecarga hídrica rápida (aproximadamente 1.000 ml de solución salina). Diagnóstico diferencial El diagnóstico diferencial incluye la dilatación aguda del corazón, el embolismo pulmonar, el infarto de ventrículo derecho, el derrame pericárdico y la enfermedad pulmonar obstructiva crónica. La diferenciación más dificultosa es entre la constricción pericárdica y la cardiomiopatía restrictiva (Tabla 2). Las manifestaciones clínicas de la cardiomiopatía restrictiva, cuya forma más típica es la amiloidosis cardiaca, pueden ser muy similares a las de la pericarditis constrictiva. El ecodoppler cardiaco es el método más útil para distinguir la constricción de la restricción. Tabla 2.- Diferenciación entre la pericarditis constrictiva y la cardiomiopatía restrictiva. Examen físico Congestión pulmonar Pulso venoso yugular Sonido diastólico precoz Engrosamiento pericárdico Hallazgos del ecodoppler Miocardio ventricular izquierdo Tamaño auricular Flujo mitral Variación respiratoria onda e Velocidad diastólica mitral Marcadores biológicos Péptido natriurético B Hemodinamia Descenso y Presión arterial sistólica pulmonar Variación respiratoria recíproca en PAS pico VD/VI Pericarditis constrictiva Cardiomiopatía restrictiva Habitualmente ausente Descenso y prominente Knock pericárdico >2 mm Habitualmente presente Normal Variable Restrictivo >25% >8 cm/seg Aspecto especial en la amiloidosis Aumentado Restrictivo <20% <8 cm/seg <200 pg/ml >600 pg/ml Prominente <50 mm Hg Presente Variable >60 mm Hg Ausente S3 <2 mm Evolución y tratamiento La pericarditis constrictiva es una enfermedad progresiva sin reversión espontánea. Un porcentaje pequeño de pacientes pueden vivir por largos períodos de tiempo con tratamiento con diuréticos y restricción hídrica, pero la mayoría progresa hacia la caquexia cardíaca. Por lo tanto el tratamiento de esta entidad es la completa resección del pericardio mediante cirugía. Las complicaciones cardíacas han sido reportadas en un rango del 6% al 25%. En los pacientes que sobreviven la operación se produce una mejoría sintomática en alrededor del 90% de los casos y completa desaparición de los síntomas en alrededor del 50%. La sobrevida a cinco años oscila del 74 al 87% según las series analizadas. El riesgo de mortalidad es directamente proporcional a la clase funcional de la New York Heart Association (NYHA), la edad, y la historia previa de radioterapia. Los pacientes con síntomas estables y una clase NYHA I o II deben ser manejados en forma conservadora y la cirugía debe ser diferida. Por otra parte, los pacientes con síntomas progresivos y una clase funcional NYHA II avanzada deben ser sometidos a cirugía tan pronto como sea posible para reducir la mortalidad postoperatoria precoz por un estado de bajo volumen minuto. En los enfermos que se operan en clase funcional IV, la mortalidad alcanza al 30-40%. Si existen adhesiones severas calcificadas entre el pericardio y el epicardio o una afectación general del epicardio, la cirugía se asocia con un alto riesgo de severo daño miocárdico o de resección incompleta. Un tratamiento alternativo en estos casos es el empleo del Excimer laser para realizar una “limpieza laser“. BIBLIOGRAFÍA Aikat S., Ghaffari S.: A review of pericardial diseases: clinical, ECG and hemodynamic features and management. Cleveland Clin J 67:903-2000 Andrews G., Pickering G.: The aetiology of constrictive pericarditis with special reference to tuberculous pericarditis, together with a note on polyserositis. Q J Med 17: 291-1948 Appleton C., Hatle L., Popp R.: Cardiac tamponade and pericardial effusion: Respiratory variation in transvalvular flow velocities studied by Doppler echocardiography. J Am Coll Cardiol 11: 1020-1988 Astrudillo R., Ivert T.: Late results after pericardiectomy for constrictive pericarditis via left thoracotomy. Scand J Thorac Cardiovasc Surg 23: 115-1989 Bashi I., Ravikumar J., Jairaj P.: Early and late results of pericardiectomy in 118 cases of constrictive pericarditis. Thorax 43: 637-1988 Becit N., Unlu Y., Ceviz M.: Subxiphoid pericardiostomy in the management of pericardial effusions: case series analysis of 368 patients. Heart 91:785-2005 Burstow D., Jae K., Baileys K.: Cardiac tamponade: Characteristic Doppler observations. Mayo Clin Proc 64: 312-1989 Callahan J., Seward J., Nishimura R.: Two-dimensional echocardiographically pericardiocentesis: Experience in 117 consecutive patients. Am J Cardiol 55: 476-1985 guided Cameron J., Oesterle S., Baldwin J.: The etiologic spectrum of constrictive pericarditis. Am Heart J. 113: 354-1987 Carsky E., Mauceri R., Azimi F.: The epicardial fat pad sign: Analysis of frontal an lateral chest radiograph in patients with pericardial effusion. Radiology 137:303-1980 Cogswell T., Bernath G., Wann L.: Effects of intravascular volume on the value of pulsus paradoxus and right ventricular diastolic collapse in predicting cardiac tamponade. Circulation 72: 1076-1985 Eisenberg M., Oken K., Guerrero S.: Prognostic value of echocardiography in hospitalised patients with pericardial effusion. Am J Cardiol. 70: 934-1992 Fowler N., Harbin A.: Recurrent pericarditis: Follow up of 31 patients. J Am Coll Cardiol, 7:3001986 Fowler N.: Cardiac tamponade. A clinical or an echocardiographic diagnosis? Circulation 87:17381993 Himelman R., Lee E., Schiller N.: Septal bounce, ven cava plethora, and pericardial adhesion: Informative two-dimensional echocardiographic signs in the diagnosis of pericardial constriction. J. Am Soc Echocar 1: 333-1988 Hoit B.: Pericardial heart disease. Curr Probl Cardiology 22:353-1997 Hoit B.: Management of effusive and constrictive pericardial heart disease. Circulation 105:29392002 Imazio M., Bobbio M., Cecchi E.: Colchicine in addition to conventional therapy for acute pericarditis: results of the COlchicine for acute PEricarditis (COPE) trial. Circulation 112:2012-2005 Kirkland L., Taylor R.: Pericardiocentesis. Crit Care Clin 8:699-1992 Klopfenstein H., Cogswell T., Bernath G.: Alterations in intravascular volume affect the relation between right ventricular diastolic collapse and the hemodynamic severity of cardiac tamponade. J. Am Coll Cardiol 6: 1057-1985 Kostreva D., Castane A., Pedersen D.: Nonvagally mediated bradycardia during tamponade or severe haemorrhage. Cardiology 68:65-1981 Leimgruber P., Klopfenstein H., Wann L.: The hemodynamic derangement associated with right ventricular diastolic collapse in cardiac tamponade: An experimental echocardiographic study. Circulation 68: 612-1983 Levine M., Lorell B., Diver D.: Implications of echocardiographically-assisted diagnosis of pericardial tamponade in contemporary medical patients: Detection prior to hemodynamic embarrassment. J Am Coll Cardiol 17:59-1991 Levy P., Corey R., Berger P.: Etiologic diagnosis of 204 pericardial effusions. Medicine 82:3852003 Little W., Freeman G.: Pericardial disease. Circulation 113:1622-2006 Maisch B., Ristic A.: Practical aspects of the management of pericardial disease. Heart 89:10962003 Martins J., Kerber R.: Can cardiac tamponade be diagnosed by echocardiography?. Circulation 60: 737-1979 Martin R., Bowden R., Filly K.: Intrapericardial abnormalities in patients with pericardial effusion. Findings by two dimensional echocardiography. Circulation 61:568-1980 Matsui T., Finck S., Higgins C.: Constrictive pericarditis and restrictive cardiomyopathy: Evaluation with MR imaging. Radiology 182: 369-1992 Meyer T., Sareli P., Marcus, R.: Mechanism underlying Kussmaul´s sign in chronic constrictive pericarditis. Am J Cardiol 64: 1069-1989 Morgan C., Marshall S., Ross J.: Catheter drainage of the pericardium: Its safety and efficacy. Can J Surg 32: 331-1989 Pankuweit S., Ristic A., Seferovic P.: Bacterial pericarditis: diagnosis and management. Am J Cardiovasc Drugs 5:103-2005 Parameswaram R., Goldberg H.: Echocardiographic quantitation of pericardial effusion. Chest 83:767-1983 Paul O., Castleman B., White P.: Chronic constrictive pericarditis: A study of 53 cases. Am J Med Sci 216: 361-1948 Permanyer Miralda G.: Acute pericardial disease: approach to the etiologic diagnosis. Heart 90:2522004 Reinmuller R., Gurgan M., Erdmann E.: CT and MR evaluation of pericardial constriction: A new diagnostic and therapeutic concept. J Thoracic Imaging 8: 108-1993 Roberts W., Spray T.: Pericardial heart disease: A study of its causes, consequences, and morphological features. In Spodick DH(ed): Pericardial diseases. FA Davis, Philadelphia, 1976 Robertson J., Mulder D.: Pericardiectomy: A changing scene. Am J Surg 148: 86-1984 Singh S., Wann L., Schuchard G.: Right ventricular and right atrial collapse in patients with cardiac tamponade – a combined echocardiographic and hemodynamic study. Circulation 70: 966-1984 Spodick D.: Acute cardiac tamponade. N Engl J Med 349:684-2003 Surawicz B., Lasseter K.: Electrocardiogram in pericarditis. Am J Cardiol 26:671-1970 Sutton F., Whitney N., Applefeld M.: The role of echocardiography and computed tomography in the evaluation of constrictive pericarditis. Am. Heart J. 109: 350-1985 The Task Force on the Diagnosis and Management of Pericardial Diseases of the European Society of Cardiology: Guidelines on the diagnosis and management of pericardial diseases. European Heart J 25:587-2004 Teicholz L.: Echocardiographic evaluation of pericardial diseases. Prog Cardiovasc Dis 21:133-1978 Tirilimis T., Unverdorben S., von der Emde J.: Pericardiectomy for chronic constrictive pericarditis: Risks and outcome. Eur J Cardiothorac. Surg 8: 487-1994 Tomaselli G., Gamsu G., Stolberg M.: Constrictive pericarditis presenting as pleural effusion of unknown origin. Arch. Intern. Med. 149: 201-1989 Troughton R., Asher C., Klein A.: Pericarditis. Lancet 363:717-2004 Tunick P., Nachamie M., Kronzon L.: Reversal of echocardiographic signs of pericardial tamponade by transfusion. Am. Heart J. 119: 199-1990 Usher B., Popp R.: Electrical alternans: Mechanism in pericardial effusion. Am. Heart J. 83: 4591972