Trabajo Practico N 11 - Facultad de Odontología
Anuncio

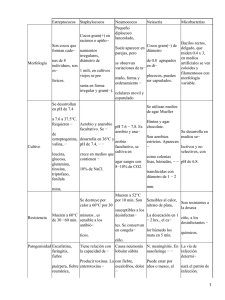
TRABAJO PRÁCTICO Nº 11 DIAGNÓSTICO MICROBIOLÓGICO DIRECTO. En la práctica odontológica las lesiones bucales piógenas se tratan con antibióticos, generalmente administrados en forma empírica, cuando lo ideal es realizar el diagnóstico microbiológico. Siempre que sea posible hacer una correcta toma de material, el posterior aislamiento del agente etiológico y si es necesario un antibiograma para conocer la sensibilidad del patógeno a los antibióticos. De esta forma se solucionarían dos problemas importantes de la práctica clínica que son: la persistencia en forma crónica de las lesiones por no hallar el / los agente / s etiológico/s y el aumento de las resistencias bacterianas adquiridas. Pasos para arribar al diagnóstico etiológico de una lesión purulenta: En el consultorio a) Historia clínica médico-odontológica completa: b) Planilla de pedido de investigación microbiológica con el diagnóstico presuntivo. c) Toma de material: Los pasos a seguir para la toma de material a partir de procesos cerrados (sin fístulas) son: ¾ Realizar buche con agua destilada estéril para disminuir por arrastre la carga microbiana bucal.(Si la toma es de un proceso intraoral) ¾ Realizar antisepsia de la zona del proceso purulento con gasa embebida en povidona yodo. ¾ Dejar actuar el antiséptico durante un minuto y retirar por arrastre con gasa estéril embebida en agua destilada estéril para no distorsionar el resultado. ¾ En la zona más reblandecida del proceso realizar la toma de material por punción aspirativa para la obtención del material purulento. ¾ Colocar la muestra en un tubo conteniendo medio de transporte y realizar al menos dos extendidos en portaobjetos estériles. ¾ Conservar la muestra a temperatura ambiente y remitirla al laboratorio dentro de las 2 hs. Los pasos a seguir para la toma de material a partir de procesos abiertos (con fístula): ¾ Realizar buche con agua destilada estéril para disminuir por arrastre la carga microbiana bucal.(Si la toma es de un proceso intraoral) ¾ Realizar antisepsia del campo operatorio con gasa embebida en povidona yodo. ¾ Dejar actuar el antiséptico durante un minuto y retirar por arrastre con gasa embebida en agua destilada estéril para no distorsionar el resultado. ¾ Con jeringa y aguja aspirar el material purulento introduciéndola en la fístula jeringa. ¾ No tomar nunca muestras de los bordes de la fístula. ¾ Colocar la muestra en un tubo conteniendo medio de transporte y realizar al menos dos extendidos en portaobjetos estériles. ¾ Conservar la muestra a temperatura ambiente y remitirla al laboratorio dentro de las 2 hs. Condiciones y cuidados a tener en cuenta: Momento oportuno: la toma de material se realiza antes de medicar al paciente con antibiótico, si ya está tomando antibiótico conviene suspender la medicación si el caso clínico lo permite. Sitio adecuado: corresponde a la zona más reblandecida del proceso purulento. Instrumental y materiales: se utilizarán siempre elementos estériles: jeringa descartable, agujas gruesas, tubos de ensayo, tapones de goma, portaobjetos, frascos pequeños, gasas, portaobjetos, medios de transporte. Cantidad necesaria: La cantidad mínima de muestra necesaria para el procesamiento en el laboratorio es de 0.5 a 1 ml. Transporte: Enviar al laboratorio el tubo con el material de toma en medio de transporte cerrado con tapón de goma estéril. Remisión: La remisión de la muestra deberá cumplir con las normas de bioseguridad nacionales, que incluyen envase hermético, dentro de otro mayor tamaño rodeado de un material absorbente y un tercer envase rotulado (Triple envoltorio). La muestra debe ser remitida inmediatamente al laboratorio para su procesamiento, de no ser posible se deberá refrigerar por no más de 24 hs. Siempre acompañarla del protocolo de pedido microbiológico, un resumen de la historia clínica y el diagnóstico presuntivo. En el laboratorio: (Cuadro N° 1) Se realizan: • Examen microscópico directo: coloración de Gram. • Cultivos: o Caldo nutritivo, para mantener la cepa o Agar sin sangre, para realizar “reacción de catalasa” o Agar sangre, para diferenciar los distintos tipos de hemólisis (αhemólisis o hemólisis parcial,β hemólisis o hemólisis total, δ hemólisis o anhemolítico) • Reacciones bioquímicas, para tipificación de género y especie (glucosa, coagulasa, manitol, gelatina, etc.) • Antibiograma en caso de ser necesario. Desarrollo del Trabajo Práctico Nº 11: Diagnóstico microbiológico I: Marcha diagnóstica de una lesión purulenta para cocos piógenos y actinomicosis. 1) Simular que un alumno tiene una lesión que tiende a fistulizar al exterior, realizar los pasos para la toma de material para un diagnóstico microbiológico: - Antisepsia de la zona con gasa embebida en povidona yodo al 10%. Lavado con gasa embebida en agua destilada estéril. Simular la punción y recolección de material purulento con jeringa. Pasar el material a un tubo con medio de trasporte estéril. Extendidos Condiciones de envío 2) A partir de una muestra de una colección purulenta desarrollar los pasos de las marchas diagnósticas para Cocos Piógenos (Cuadro Nº 2) o para Actinomicosis (Cuadro Nº 3). MATERIAL PURULENTO EXAMEN MICROSCOPICO DIRECTO GRAM POSITIVO COCOS Streptococcus Staphylococcus NEGATIVO BACILOS NO ESPORULADOS Actinomyces Cuadro N° 1 COCOS Neisserias BACILOS Enterobacterias o Anaerobios Estrictos Cuadro Nº2: Resumen de marcha diagnóstica para Cocos Piógenos Toma de material (pus) Examen macroscópico (en busca de granos) Examen microscópico (Cocos Gram +) Sembrar en distintos medios de cultivo por duplicado Caldo nutritivo Agar sin sangre Agar Sangre (Hemólisis α, β, δ) Incubar a 37º C durante 24 a 48 horas en aerobiosis y anaerobiosis Aislamiento/s en agar sin sangre y prueba de Catalasa de c/u de los mismos (+) Staphycoccus y Micrococcus (-) Streptococcus Prueba fermentación de Glucosa (-) Micrococcus (+) Staphycoccus ( -) Coagulasa (+) (-) Manitol (+) (-) Gelatina (+) (-) St epidermidis (+) St aureus Cuadro Nº 3: Resumen de marcha diagnóstica para Actinomicosis Toma de material (pus) Examen macroscópico (Buscar Granos) Examen microscópico (bacilos o filamentos Gram + y no AAR) Sembrar en distintos medios de cultivo Agar blando glucosado Fluído tioglicolato Caldo BHI Agar BHI con suero Cerrar en condiciones de anaerobiosis Incubar a 37º C durante 24 a 48 horas. Reincubar de 10 a 15 días Examen microscopico (bacilos o filamentos Gram +) Para la tipificación de género y especie se requieren varias pruebas bioquímicas o reacciones de inmunofluorescencia. Pero esto no es necesario para indicar el tratamiento al paciente PREGUNTAS: 1. En qué porcentaje debería utilizar la povidona iodo para realizar la antisepsia de la piel? ………………………………………………………………………………………………………… 2. En caso de que su proceso fuera intraoral en que porcentaje debería usar la povidona iodo? ……………………………………………………………………………………………………… 3. Porque debe realizar extendidos en el momento de efectuar la toma? ………………………………………………………………………………………………………… ………………………………………………………………………………………………………… 4. Que utilidades le brinda la coloración de Gram? ………………………………………………………………………………………………………… ………………………………………………………………………………………………………… ………………………………………………………………………………………………………… ………………………………………………………………………………………………………… …………………………………………………………………………………………………………