trombosis venosa retiniana y trombofilia: un problema compartido
Anuncio

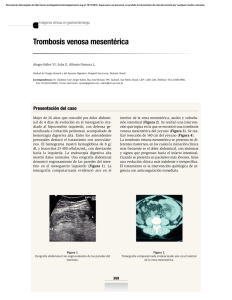
CAPÍTULO 2 TROMBOSIS VENOSA RETINIANA Y TROMBOFILIA: UN PROBLEMA COMPARTIDO Joaquín López Álvarez Eduardo Montero Ruiz Concepción Hernández Ahijado Joaquín López Pérez Las trombosis venosas (TV) constituyen un problema sanitario importante. La incidencia anual entre la población general es de 160 casos por 100.000 habitantes, y en ese mismo periodo se registran 20 casos de embolismo pulmonar fatal secundarios a TV. La embolia de pulmón representa la complicación más importante durante la fase aguda del cuadro, pero en el 50% de los pacientes que sobreviven se desarrolla a largo plazo síndromes postflebíticos. Las TV en otras localizaciones también producen importantes limitaciones funcionales, de calidad de vida y una considerable repercusión en los costes sanitarios (1). Hace más de un siglo, Rudolph Virchow identificó una triada de factores responsables de trombosis vasculares: la alteración de la pared vascular, el éstasis y los cambios en la composición de la sangre (hipercoagulabilidad). Ejemplos de los dos primeros, como factores precipitantes para el desarrollo de enfermedad tromboembólica pueden ser el embarazo, la cirugía, la obesidad o la presencia de neoplasia. El término de hipercoagulabilidad se acuñó para identificar un conjunto de anomalías de la coagulación sanguínea (tercer factor de Virchow). Tradicionalmente el diagnóstico de hipercoagulabilidad sirvió para designar aquellos casos de enfermedad tromboembólica que acontecía en pacientes con edad inferior a 45 años y en los que no se identificaban factores de riesgo anatómicos o causas precipitantes. En los últimos años se han identificado una serie de defectos en la coagulación que explicarían muchos de los casos de hipercoagulabilidad, no obstante debe tenerse en cuenta que en muchos pacientes con alteraciones primarias de la coagulación, coexisten otros factores de riesgo para desarrollar la enfermedad tromboembólica, de forma que la aparición de TV en presencia de neoplasia, embarazo o cirugía, por ejemplo, no excluyen la existencia de una alteración primaria de la coagulación. CAUSAS DE HIPERCOAGULABILIDAD Las causas responsables de síndromes de hipercoagulabilidad pueden estar genéticamente deter- minadas (heredables), o ser adquiridas, como quedan resumidos en la tabla 1. Las formas hereditarias también denominadas trombofilias hereditarias son predisposiciones a fenómenos trombóticos genéticamente determinados, anomalías dominantes o combinaciones de mutaciones de penetrancia variable que potencien defectos menos severos, y que se sospecharán clinicamente ante pacientes con fenómenos trombóticos en edades inferiores a 45 años sin aparentes factores de riesgo adquiridos, recurrencia de fenómenos trombóticos, historia familiar de enfermedad tromboembólica o mujer con historia de abortos de repetición, partos con feto muerto o ambos. Las causas genéticas y adquiridas suelen interactuar, lo que dificulta la decisión de a qué pacientes se efectuarán estudios de trombofilia, qué tests deben realizarse, en qué orden, si los resultados de estos estudios afectarán a la duración del tratamiento anticoaTabla 1. Causas de hipercoagulabilidad Heredables Resistencia a la proteína C activada Déficit de proteína S Déficit de proteína C Déficit de Antitrombina Hiperhomocisteinemia Mutación 20210 A del gen de la protrombina Displasminogenemia Niveles elevados del inhibidor del plasminógeno activado Disfibrinogenemia Niveles elevados de factor VIII Adquiridos Síndrome antifosfolípido Hiperhomocisteinemia Miscelánea Disproteinemias Trombocitemia Trombocitopenia inducida por heparina Estrógenos Anticonceptivos Terapias hormonales Otros Neoplasia Embarazo Inmovilización Cirugía Traumatismos 22 2. Trombosis venosa retiniana y trombofilia: un problema compartido gulante y si se debe estudiar a otros miembros de la familia. En la mayoría de pacientes, no obstante, los eventos trombóticos son episódicos o separados por largos periodos asintomáticos. Esta naturaleza episódica indica que debe existir un gatillo que dispara cada episodio y que el rasgo heredado requiere la interacción con otros factores antes que una alteración clínica se haga evidente (2). TROMBOFILIAS MÁS FRECUENTES La disfibrinogenemia y el déficit de antitrombina fueron las primeras trombofilias heredables descritas en familias en las que varios miembros presentaron trombosis venosas (2,3). Posteriormente se identificaron como causas de trombofilia hereditaria, déficits heterozigóticos de proteína C (4) y proteína S (5). Inicialmente, los estudios en pacientes con TV idiopática fueron desalentadores, puesto que sólo se encontraban datos de trombofilia hereditaria entre el 5-20% de ellos (6). Esta situación cambió radicalmente a partir de 1993, tras el descubrimiento de la resistencia a la proteína C activada. Resistencia a la PCA. Factor V Leiden Es la causa más frecuente de trombofilia. La mutación, consiste en la mayoría de los casos, en la substitución de Adenina por Guanina en el nucleótido 1691 del gen del factor V (G1691A), que provoca que el residuo 505 de Arginina de la proteína factor V, sea reemplazado por Glutamina (Arg506Gln). La nueva proteína resultante fue llamada factor V Leiden (7). El factor V circula en la sangre como un procofactor inactivo que es activado por la trombina produciéndose factor Va, quien a su vez sirve como un cofactor para el factor Xa en la conversión de protrombina a trombina. El factor Va es inactivado mediante proteolisis por la PCA. Cuando la trombina se une al endotelio vascular, activa a la proteína C. La resistencia a esta proteolísis por la PCA conduce a una tendencia trombótica. En el 95% de los casos de resistencia a la PCA, la causa es única, y suele deberse a una mutación en el gen que codifica el factor V (FV R506Q), y que ha sido denominado factor V Leiden (2,7,8). También producen resistencia a la PCA el embarazo, las intervenciones quirúrgicas, la administración de contraceptivos orales, los anticoagulantes lúpicos y niveles altos de factor VIIIa en plasma (2,9). Fig. 1. Obstrucción de vena central de la retina. Mutación 20210 A del gen de la protrombina En 1996 se encontró una nueva causa de trombofilia hereditaria. Una mutación consistente en la substitución de Adenina por Guanina en el nucleótido 20210 del gen de la protrombina (G20210A) (10). La protrombina es convertida en trombina por medio del factor X en la cascada de coagulación. La trombina, subsecuentemente, activa al factor VIII quien estabiliza el coágulo de fibrina y, fragmenta el fibrinógeno para obtener fibrina. En el gen que codifica la protrombina, puede aparecer una transición de guanina a adenina en el nucleótido 20210. Aunque el mecanismo por el que actúa esta mutación es desconocido, el resultado es una elevación de los niveles de protrombina (30% por encima del nivel normal) que incrementa el riesgo de trombosis venosa profunda en heterocigotos (10). En la raza blanca, la prevalencia de la mutación es del 0,7-4%, siendo más frecuente en el sur de Europa, mientras que en la población no blanca es extremadamente rara (11). Cuando se asocia a otros factores de riesgo tales como uso de contraceptivos orales, el riesgo de trombosis venosa cerebral también se eleva (12). Mutación Metilentetrahidrofolato reductasa (MTHFR) La homocistinuria, otra causa de trombofilia, aunque infrecuente, se puede manifiestar clínicamente por episodios trombóticos venosos como arteriales (13). 2. Trombosis venosa retiniana y trombofilia: un problema compartido La homocisteína es un aminoácido intermediario altamente reactivo, cuyos niveles elevados se han asociado recientemente con un incremento en el riesgo trombótico. La hiperhomocisteinemia se refiere a la elevación leve o moderada de niveles de homocisteina que parece predisponer a oclusiones vasculares prematuras. Se puede encontrar hiperhomocisteinemia en el tabaquismo, edad avanzada, alteraciones médicas como la insuficiencia renal, déficit de ácido fólico o vitamina B12, y en los tratamientos con ciertos fármacos como los diuréticos tiazídicos (14). Las causas genéticas incluyen polimorfismos del gen de la cistatino beta sintetasa (15) y del gen de la MTHFR. La mutación del gen que codifica la MTHFR fue identificada por Frosst y Blom como una sustitución de C a T en el nucleótido 677 que convierte un residuo de alanina en uno de valina (16). Los portadores heterocigotos de esta variante termolábil tienen una actividad enzimática del 65% de lo normal, mientras que los homocigotos tienen únicamente un 30% de la actividad normal, habiéndose encontrado la forma homozigota en el 10% de la población (17), y ambas formas, hetero y homozigota elevan los niveles de homocisteína plasmática. Déficits de proteína C y proteína S 23 antitrombina (anteriormente denominada como antitrombina III), se hereda de forma autosómica dominante y debe su nombre a su acción inhibitoria sobre la trombina, aunque también inhibe las proteasas de los factores Ixa, Xa, Xia y XIIa. La acción anticoagulante de la heparina requiere la presencia de antitrombina, de tal manera que ante la presencia de unos niveles de anticoagulación refractarios al tratamiento con heparina debe sospecharse la existencia de un déficit de antitrombina. Otras trombofilias heredables Recientemente se han descrito los niveles elevados de factor VIII como causa de hipercoagulabilidad (20) sugirendo como posible mecanismo etiológico en algunos casos de enfermedad tromboembólica recurrente; la elevación de los niveles de factor VIII, además de causas genéticas pueden presentarse por causas adquiridas. Otras alteraciones como las displaminogenemias y el déficit o incremento de las concentraciones del activador del plasminógeno tisular son muy infrecuentes. Las disfibrinogenemias suelen presentarse con manifestaciones hemorrágicas por la formación de fibrina defectuosa, pero pueden aparecer a la vez fenómenos trombóticos cuando la fibrina defectuosa es resistente al efecto lítico de la plasmina. Las proteína C y S son factores vitamina K dependientes que se sintetizan en el hígado. El gen que codifica la proteína C se localiza en el cromosoma 2 y el de la S en el cromosoma 3. Ambas deficiencias se han considerado como defectos autosómicos dominantes aunque estudios recientes sugieren la posibilidad de la recesividad pero con una alta concomitancia con otras alteraciones de proteínas de la coagulación. Existen dos tipos de defectos proteicos que conducen a estas deficiencias: déficit del contenido proteico o existencia de proteínas disfuncionales. El déficit de proteína S es discretamente más frecuente que el de proteína C y las formas heterozigotas producen cuadros de hipercoagulabilidad, los déficits homocigotos pueden producir coagulopatías en neonatos que amenazan su vida (purpura fulminans) (18,19). El «anticoagulante lúpico» es una anomalía biológica adquirida que se caracteriza por comportamiento como anticoagulante in vitro pero con actividad trombótica in vivo. Esta anomalía debe sospecharse en jóvenes con eventos isquémicos arteriales, tales como infarto de miocardio, accidente cerebrovascular isquémico establecido o transitorio, mujeres con abortos de repetición o presencia de episodios trombóticos venosos de localización inusual tales como trombosis venosas retinianas, venas cerebrales, o trombosis suprahepáticas. Suelen presentar una trombocitopenia moderada y debe sospecharse ante el hallazgo inexplicable de un tiempo de tromboplastina parcial alargado. Antitrombina Otras alteraciones adquiridas En la fase final de la formación del coágulo, la trombina transforma el fibrinógeno en fibrina. La La presencia de neoplasias, embarazo, cirugía, enfermedades del tejido conectivo, síndromes linfo Síndrome antifosfolípido 24 2. Trombosis venosa retiniana y trombofilia: un problema compartido y mieloproliferativos y las disproteinemias, entre otras, son causas reconocidas de hipercoagulabilidad, aunque los mecanismos no son todavía del todo conocidos y varían con cada situación. En los casos de las neoplasias, la hipercoagulabilidad parece estar en relación con efectos «tromboplastinlike» producidos por las células tumorales o sus productos. Así los tumores productores de mucina presentan una alta asociación con fenómenos trombóticos. También pueden contribuir a esta hipercoagulabilidad las infecciones concomitantes, la malnutrición, efectos de la quimioterapia, déficit de folato e inmovilización prolongada. En el embarazo parece existir un exceso de producción de tromboplastina, aunque la hipercoagulabilidad es más frecuente cuando existen embarazos complicados como abruptio placentae, embolización de líquido amniótico o feto muerto retenido. La enfermedad tromboembólica es un ejemplo de enfermedad compleja. Aunque en las últimas décadas se han demostrado una serie de anomalías genéticas que se asocian con una mayor predisposición a la trombosis venosa, éstas no explican por sí solas la mayoría de casos de trombosis (21). Estas incertidumbres aun son mayores cuando hablamos de trombosis aisladas de venas retinianas, cuyo estudio ineludiblemente ha de ser compartido por especialidades médicas y oftalmológicas. TROMBOSIS VASCULARES RETINIANAS (TVR) El Eye Disease Case Control Study Group identifica una serie de factores de riesgo para las oclusiones de ramas venosas periféricas, vena central y venas hemiretinianas que incluyen: Hipertensión arterial (HTA), diabetes, historia de enfermedad cardiovascular, un incremento en el índice de masa corporal y glaucoma de ángulo abierto. Las oclusiones de las ramas venosas retinianas están particularmente relacionadas con la HTA, hecho refrendado por varios estudios (22-24), pero además hay diversas situaciones clínicas que se han asociado con trombosis venosas retinianas como los síndromes de hiperviscosidad, hemoglobinuria paroxística nocturna, púrpura trombótica trombocitopénica, enfermedades sistémicas como la enfermedad de Behçet, enfermedad inflamatoria intestinal o síndrome de HELLP (25-33), además de las anteriormente reseñadas. Numerosas publicaciones han buscado asociaciones entre oclusiones venosas reti- Fig. 2. Trombosis venosa de rama. nianas y defectos hereditarios en las proteínas de las vías de la coagulación. TVR y factor V Leiden Los estudios publicados que demuestran una correlación positiva entre oclusiones vasculares retinianas y resistencia a la PCA, presentan resultados muy variables (34-40). Para interpretar estos estudios conviene tener en cuenta, que más del 15% de la población de raza blanca es portadora de la mutación factor V Leiden, mientras es extremadamente rara en otras razas (41), que estudios de prevalencia de factor V Leiden, han demostrado que para producirse manifestaciones clínicas de trombosis, suele requerirse la presencia de otros factores de riesgo (42), de manera que, la mayoría de los portadores de esta mutación, tanto homozigotos como heterozigotos, suelen tener asociados factores de riesgo tales como embarazo, traumatismos o cirugía, la penetrancia del gen es pues muy variable, siendo muy frecuente la existencia de portadores asintomáticos. En 1998, se publica un caso de asociación de trombosis bilateral de la vena central de la retina con la mutación factor V Leiden (37), y un año después se estudian a 76 pacientes alemanes con obstrucción venosa o arterial retiniana. Este estudio que demostró que la mutación era un factor de riesgo para la oclusión venosa retiniana (43), fue criticado posteriormente (44) porque el grupo de pacientes había sido muy seleccionado. Una situación similar ocurría en otro estudio (28) en el que se describía una correlación positiva en una población 2. Trombosis venosa retiniana y trombofilia: un problema compartido de pacientes con trombosis venosa retiniana en el que un 24% de los incluidos tenían historia previa de accidentes trombóticos. El único estudio aparentemente sin sesgo que encuentra una correlación positiva, fue un estudio caso-control de Albissini y col. (45) donde la prevalencia de la mutación fue muy inferior a la encontrada en los trabajos de Glueck y col. y Greiner y col (29% vs 9%) (43). La mayoría de los estudios no sostienen la existencia de una correlación entre la mutación y la presencia de trombosis venosa retiniana (46-48), incluyendo la serie más amplia de pacientes con trombosis venosa retiniana (n=102), en la que tampoco se encuentran diferencias en la prevalencia de la mutación entre los pacientes y los controles (49). Donde sí se ha demostrado una asociación significativa entre la mutación y trombosis venosa retiniana es en enfermedades oculares inflamatorias, como en la enfermedad de Behçet, enfermedad multisistémica crónica que afecta a adultos jóvenes, que en algunos casos se caracteriza por trombosis venosas recurrentes probablemente debidas a una combinación de vasculits retiniana y formación de trombos. Un estudio de 106 pacientes de Oriente Medio con enfermedad de Behçet, y 120 controles, encontró que la prevalencia de factor V Leiden era significativamente mayor en pacientes con enfermedad inflamatoria ocular (OR 1,67), y más prevalente aún en aquellos enfermos que presentaron enfermedad vascular oclusiva retiniana (50) (OR 2,57). Estos resultados corroboraban otros dos anteriores en pacientes turcos; en el primero, el 69% de los pacientes con enfermedad de Behçet complicados con trombosis, eran homo o heterocigotos para el factor V Leiden comparados con el 17,9% de pacientes con Behçet sin historia de trombosis. En la segunda publicación turca, el 37,5% de pacientes con enfermedad de Behçet eran portadores de la mutación frente al 13% de los pacientes del grupo control (con artritis reumatoide) (51,52). Los fenómenos trombóticos implican en la enfermedad de Behçet un peor pronóstico, ocular y sistémico, por eso la presencia de un factor de riesgo identificable significativamente podría ser un indicador para añadir tratamiento anticoagulante junto al inmunosupresor. Mutación 20210 A de la Protrombina y TVR En trombosis vasculares retinianas se han comunicado casos aislados de la coexistencia con la 25 mutación de la protrombina, por lo que algunos han sugerido que su presencia incremente el riesgo trombótico (53). Algún estudio de prevalencia (51) ha mostrado un 8,3% de la mutación de la protrombina en una serie de 36 pacientes italianos que presentaban trombosis retiniana arterial o venosa, frente a una prevalencia 0 del grupo control. Por el contrario, un estudio más amplio en 102 pacientes israelíes no demostró asociación entre este polimorfismo y la TVR (2,9% frente al 5,7 % del control) (49), de la misma forma, otros estudios (28,54), en 16 y 14 pacientes respectivamente con TVR retiniana tampoco demostró ninguna asociación. MTHFR y TVR Lowenstein y col fueron los primeros en describir un paciente con TVR y la mutación 677C-T (54), posteriormente estudiaron la prevalencia en una serie de 59 pacientes con TVR, y encontraron un número significativo de portadores de la mutación (44% eran heterocigotos y 11% homocigotos), sugiriendo que se debía ampliar el cribaje. Solomon y col, en un estudio de 102 pacientes también describen una correlación positiva entre la presencia de mutación de la MTHFR homozigota y TVR (49). Sin embargo, Glueck y col (28), no pudieron confirmar esta asociación, al igual que otro estudio escandinavo que no encuentra diferencias de prevalencia de la mutación o hiperhomocisteinemia entre controles y pacientes con trombosis de la vena central de la retina (55). Un reciente estudio irlandés retrospectivo caso control de 174 pacientes, demuestra que un genotipo homocigoto MTHFR no aumenta el riesgo de trombosis retiniana arterial o venosa (56). Por consiguiente, la evidencia en curso no soporta una relación entre la mutación de la MTHFR y la trombosis venosa retiniana. El tratamiento de homocisteinemia, sea cual fuere la causa, se basa en pequeñas dosis de folato y vitaminas B6 y B12. Es relativamente simple, barato e inofensivo. En adultos, dosis diarias de ácido fólico de 0,5-5 mg/día es capaz de descender las concentraciones de homocisteina aproximadamente un 25%, y si añadimos vitamina.B12 oral se reduce en un 7% más a una dosis de 0,5 mg/día. Hay estudios que han demostrado que el descenso de los niveles de homocisteína mejora la dilatación endotelial y los marcadores séricos de daño endotelial. Niveles de homocisteína por encima de 11 µmol/l aumenta el riesgo de 26 2. Trombosis venosa retiniana y trombofilia: un problema compartido Tabla 2. Costes de estudios de hipercoagulabilidad Dólares USA Estudio sangre periférica INR, APTT Autoinmunidad Factor V Leiden Actividad de proteína C y S Actividad de Antitrombina III Anticoagulante lúpico Detección de Ac inducidos por heparina Niveles de Homocisteína Metilentetrahidrofolato reductasa Mutación 20210 A de la protrombina Total 18 47,25 87 175 443 120 272 148 122 175 175 1.782,25 $ aterosclerosis, por eso se ha propuesto mantener niveles inferiores a 9-10 µmol/l (57) que se lograría con una ingesta diaria de 400 µg de ácido fólico. ACTITUD ANTE EL PACIENTE AFECTO DE TVR La evidencia en curso, no demuestra una relación entre alteraciones genéticas de la coagulación y las TVR, y en opinión de Souto y col (21), una relación de asociación no implica necesariamente causalidad, siendo este tipo de estudios de asociación o de casos y controles inadecuados para investigar causas genéticas en enfermedades complejas como es el caso de la enfermedad tromboembólica venosa. Los estudios epidemiológicos convencionales son útiles para identificar causas ambientales de enfermedad (p.ej., los anticonceptivos orales y la trombosis venosa o el tabaco y el cáncer de pulmón) pero son muy ineficaces para localizar los genes implicados. No obstante, el desarrollo de las técnicas de reacción en cadena de la polimerasa en los laboratorios clínicos, ha provocado un gran número de estudios de asociación para relacionar variantes genéticas (polimorfismos) en determinados genes con todo tipo de enfermedades, entre ellas la enfermedad tromboembólica venosa, generando una considerable confusión. Al día de hoy el «screening» para detectar alteraciones genéticas asociadas con hipercoagulabillidad es coste-ineficiente debiéndose seleccionar los pacientes. Un estudio completo de trombofilia es excesivamente costoso como mostramos en la tabla 2. Por otra parte, en el seno de la fase aguda de una trombosis, la investigación de la existencia de alteraciones genéticas o adquiridas de la coagulación es de difícil interpretación. La propia trombosis, los fenómenos inflamatorios y los reactantes de fase aguda, alteran los proteínas reguladoras de la coagulación, de la misma forma que pueden alterar los resultados el tratamiento anticoagulante, como reflejamos en la tabla 3. Por todo lo expuesto consideramos que la TVR aislada, es una entidad que debe ser compartida por oftalmólogos, internistas y hematólogos. En nuestra opinión, una vez detectada la TVR, si no tiene una causa pura y claramente oftalmológica, debe solicitarse interconsulta médica en cualquiera de las siguientes situaciones: • Sospecha de factores de riesgo conocidos mal controlados (hipertensión arterial, diabetes, enfermedad cardiovascular, obesidad, tratamiento hormonal substitutorio); • Historia familiar de trombosis venosas; • Edad inferior a 45 años; • Antecedentes personales de cualquier otro episodio tromboembólico en cualquier localización; quienes valorarán a la luz de la historia clínica y exploración, el tipo de estudio, el orden de realización, cuando y la urgencia de los mismos. Tabla 3 Situaciones que potencialmente alteran los resultados de los estudios de coagulación Antitrombina Proteína C Proteína S Embarazo Contraceptivos orales Trombosis venosa Coagulación intravascular diseminada Cirugía Enfermedad hepática Heparina Anticoagulantes orales Descenso Descenso Descenso Descenso Descenso Descenso Descenso Aumento Aumento Aumento Descenso Descenso Descenso Descenso Sin efecto Descenso Descenso Descenso Descenso Descenso Descenso Descenso Sin efecto/Aumento Descenso 2. Trombosis venosa retiniana y trombofilia: un problema compartido BIBLIOGRAFÍA 1. Manejo de la enfermedad tromboembólica venosa. XXIV Reunión de la SEMI. 2001. 2. Seligsohn U, Lubetsky A. Genetic susceptibility to venous trombosis. N Engl J Med 2001; 344: 1222-31. 3. Egeberg Q. Inherited antithrombin III deficiency causing thrombophilia. Thromb Diath Haemorrah 1963; 13: 526-531. 4. Griffin JH, Evatt B, Zimmerman TS, et al. Deficiency of protein C in congenital thrombotic disease. J Clin Invest 198; 68: 1370-3. 5. Comp PC, Esmon CT. Recurrent venous thromboembolism in patient with a partial deficiency of protein S. N Engl J Med 1984; 311: 1525-8. 6. Koeleman BP, Reitsma PH, Bertina RM. Familial thrombophilia: a complex genetic disorder. Semin Hematol 1997; 34: 256-64. 7. Bertina RM, Koeleman BP, Kosler T, et al. Mutation in blood coagulation factor V associated with resistance to activated protein C. Nature 1994; 369: 64-67. 8. Huisman MV, Rosendaal F. Thrombophilia. Curr Opin Haematol 1999; 6: 291-7. 9. Vine AK, Samama MM. Screening for resistance to activated protein C and the mutant gene for factor V: Q506 in patients with central retinal vein occlussion. Am J Ophtalmol 1997; 124: 673-6. 10. Poort SR, Rosendaal FR, Reitsma PH, et al. A common genetic variation in the 3’-untranslated region of the prothrombin gene is associated with elevated plasma prothrombin levels and an increase in venous thrombosis. Blood 1996; 88: 3698-703. 11. Rosendaal FR, Doggen CJM, Zivelin A, et al. Geographic distribution of the 20210 G to A prothrombin variant. Thromb Haemost 1998; 80: 706-8. 12. Stefano VD, Martinelli I, Mannucci PM, et al. The risk of recurrent deep vein thrombosis among heterozigous carriers of both factor V Leiden and the G20210A prothrombin mutation. N Engl J Med 1999; 341: 801-6. 13. Mudd SH, Skovby F, Levy HC, et al. The natural history of homocystinuria due to cystathione beta-synthasa deficiency. Am J Hum Genet 1985; 37: 1-31. 14. Stein JH, McBride PE. Hyperhomocysteinaemia and atherosclerotic disease.Arch Intern Med 1998; 1301-6. 15. Wenzler Em, Redemakers AJ, Boers G. Hyperhomocystinemia in retinal artery and renital vein occlusion. Am J Ophthalmol 1993; 115: 162-7. 16. Frosst P, Blom HJ. A candidate genetic risk factor for vascular disease: a common mutation in methylenetetrahydrofolate reductase. Nat Genet 1995; 10: 111-13. 17. Hayreeh SS, Zimmerman MB, Podhajsky P. Incidence of various types of retinal vein occlusion and their recurrence and demographic characteristics. Am J Ophthalmol 1994; 117: 429-41. 18. Marciniak E, Wilson HD, Marlar RA. Natal purpura fulminans: a genetic disorder related to the absence of protein C in blood. Blood 1985; 65:15-20. 19. Mahasandana C, Suvatte V, Marlar RA et al. Neonatal púrpura fulminans associated with homozigous protein S deficiency. Lancet 1990; 1:61-62. 20. Koster T, Blann AD, Briet E, et al: Role of clotting factor VIII in effect of Von Willebrand factor on occurrence of deep vein thrombosis. Lancet 1995; 345: 152-155. 27 21. Souto JC, Soria JM, Fontcuberta J. Med Clin Mograf (Barc) 2002; 3:(Supl 2): 3-7. 22. Rath EZ, FranK RN,Shin DH, et al. Risk factors for retinal vein occlusions. Ophthalmology 1992; 99: 509-14. 23. Eelman M, Bhatt A, Quinlan P. et al. The risk for sistemic vascular diseases and mortality in patients with central retinal vein occlusion. Ophthalmology 1990; 97: 1543-8. 24. Hayreh SS, Zimmerman B, McCarthy MJ, et al. Systemic diseases associated with various types of retinal vein occlusion. Am J Ophtalmol 2001; 131: 61-77. 25. Fong A, Schatz H. Central retinal vein occlusion in young adults. Surv Ophtalmol 1993; 37: 393-417. 26. Arend O, Remky A, Jung F, et al. Role of rheologic factors in patients with acute central vein occlussions. Ophthalmology 1996; 103: 80-86. 27. Glacet-Bernard A, Chabanel A, Lelong F, et al. Elevated erythrocyte aggregration in patients with central retinal vein occlussion and without conventional risk factors. Ophthalmology 1994; 101: 1483-7. 28. Glueck CJ, Bell H, Vadlamani L, et al. Hereditable thrombophilia and hypofibrinolisis. Arch Ophtalmol 1999; 117: 43-9. 29. Bandello F, V’D’Anvelo S, Parlavecchia M, et al. Hypercoagulability and high lipoprotein (a) levels in patients with central retinal vein occlussion. Thromb Haemost 1994; 72: 39. 30. Costa JR, Krause M, Friedman E, D´Amico DJ. Central retinal vein occlusion in a patient with thrombotic thrombocytopenic purpura. Am J Ophthalmol 2001; 131(5): 669-71. 31. Larsson J, Hansson-Lundblad C. Central retinal vein occlusion in two patients with inflamatory bowel disease. Retina 2000; 20(6): 681-682. 32. Gonzalvo FJ, Abecia E, Pinilla I, Izaguirre LB, Olivan JM, Honrubia FM. Central retinal vein occlusion and HELLP syndrome. Acta Ophtalmol Scand. 2000; 78: 596-8. 33. Bernstein CN, Blanchard JF, Houston DS et al. The incidence of deep venous thrombosis and pulmonary embolism among patients with inflamatory bowel disease: a population based cohort study. Thromb Haemost 2001; 85: 430-4. 34. Dhote R, Bachmeyer C, Horellou MH, et al. Central retinal vein thrombosis associated with resistance to activated protein C. Am J Ophtalmol 1995; 120: 389-9. 35. Hoster T, Rosendaal FR, Briet E, et al. Protein C deficiency in a controlled series of unselected outpatients: an infrequent but clear risk factor for venous thrombosis. (Leiden Thrombofilia Study). Blood 1995; 85: 2756-61. 36. Greven C, Wall AB. Peripheral retinal neovascularisation and retinal occlussion associated with activated protein C resistance. Am J Ophthalmol 1997; 124: 687-691. 37. Spagnolo BV, Nasrallah F. Bilateral retinal vein occlusion associated with factor V Leiden mutation. Retina 1998; 18: 377-8. 38. Williamson T, Rumley A, Lowe G. Blood viscosity, coagulation and activated protein C resistance in central retinal vein occlusion: a population controlled study. Br J Ophthalmol 1996; 80: 203-8. 39. Larsson J, Olafsdottir E, Bauer B. Activated protein C resistance in young adults with central retinal vein occlusion. Br J Ophtalmol. 1996; 80: 200-2 40. Larsson J, Sellman A, Bauer B. Activated protein C resistance in patients with central retinal vein occlusion. Br J Ophthalmol . 1997; 81: 832-4. 28 2. Trombosis venosa retiniana y trombofilia: un problema compartido 41. Bertina RM, Rosendaal FR. Venous thormbosis-the interaction of genes and environment. N Engl J Med 1998; 338: 1840-1. 42. Martinelli I, Sacchi E, Landi G, et al. High risk of cerebral vein thrombosis in carriers of a prothrombin gene mutation and in users of oral contraceptives. N Engl J Med 1998; 338-1793-7. 43. Greiner K, Hafner G, Burkhard D, et al. Retinal vascular occlusions and deficiencies in the protein C pathway. Am J Ophthalmol 1999; 128: 69-74. 44. Vine AK. Retinal vascular occlusions and deficiencies in the protein C pathway. Am J Ophthalmol 2000; 129: 113-114. 45. Albisinni R, Coppola A, Lofredo M, et al. Retinal vein occlusion and inherited conditions predisposing to thrombophilia. Thromb Haemost 1998; 80: 702-3. 46. Gottlieb JL, Blice JP, Mestichelli B, et al. Activated protein C resistance, factor V Leiden, and central retinal vein occlusion in young adults. Arch Ophthalmol 1998; 116: 577-9. 47. Linna T, Ylikorkala A, Kontula K, et al. Prevalence of factor V Leiden in young adults with retal vein occlusion. Thromb Haemost 1997; 77: 212-24. 48. Hodgkins PR, Perry DJ, Sawcer SJ et al. Factor V and antithrobin gene mutations in patients with idiopathic central retinal vein occlusion. Eye 1995; 9: 760-2. Solomon O, Moissiev J, Rosenberg N, et al. Analysis of genetic polymorphisms related to thrombosis and other risk factors in patients with retinal vascular occlusion. Blood Coagul Fibrinolysis 1998; 9: 617-22. 49. Solomon O, Moissiev J, Rosenberg N, et al. Analysis of genetic polymorphisms related to thrombosis and other risk factors in patients with retinal vascular occlusion. Blood Coagul Fibrinolysis 1998; 9: 617-22. 50. Verity DH, Vaughan RW, Madanat W, et al. Factor V Leiden mutation is associated with ocular involvement in Behçcet’s disease. Am J Ophthalmol 199; 128: 352-6. 51. Oner AF, Gurgey A, Gurler A et al. Leiden mutation in patients with Behçet’s disease. J Rheumatol 1998; 25:496-8. 52. Mammo L, Al-Dalaan A, Bahabri SS, et al. Association of factor V Leiden with Behçcet’s disease. J Rheumatol 1997; 24: 2196-8. 53. Incorvata C, Lamberti G, Parmeggiani F. Idiopatic central retinal vein occlusion in a thrombophilic patient with the heterozygous 20210 G/A protrombine genotype. Am J Ophtalmol 1999; 128: 247-248. 54. Lowenstein A, Goldstein M, Winder A, et al. Retinal vein occlusion associated with methylenetetrahydrofolate reductase mutation. Ophthalmology 1999; 106: 1817-20. 55. Larrson J, Hulberg B, Hilarp A. Hyperhomocysteinaemia and the MTHFR 677T mutation. In central retinal vein occlusion. Acta Ophthalmol Scand 1997; 124: 840-1. 56. Cahill M, Karabatzaki M, Donoghue C, et al. Thermolabile MTHFR genotype and retinal vascular occlusive disease. Br J Ophthalmol 2001; 85: 88-90. 57. Omenn GS, Beresford SA, Motlsky AG. Preventing coronary heart disease: B vitamins and homocysteine. Circulation 1998; 97; 421-4.