Prácticas Sangre Miguel Mayo
Anuncio
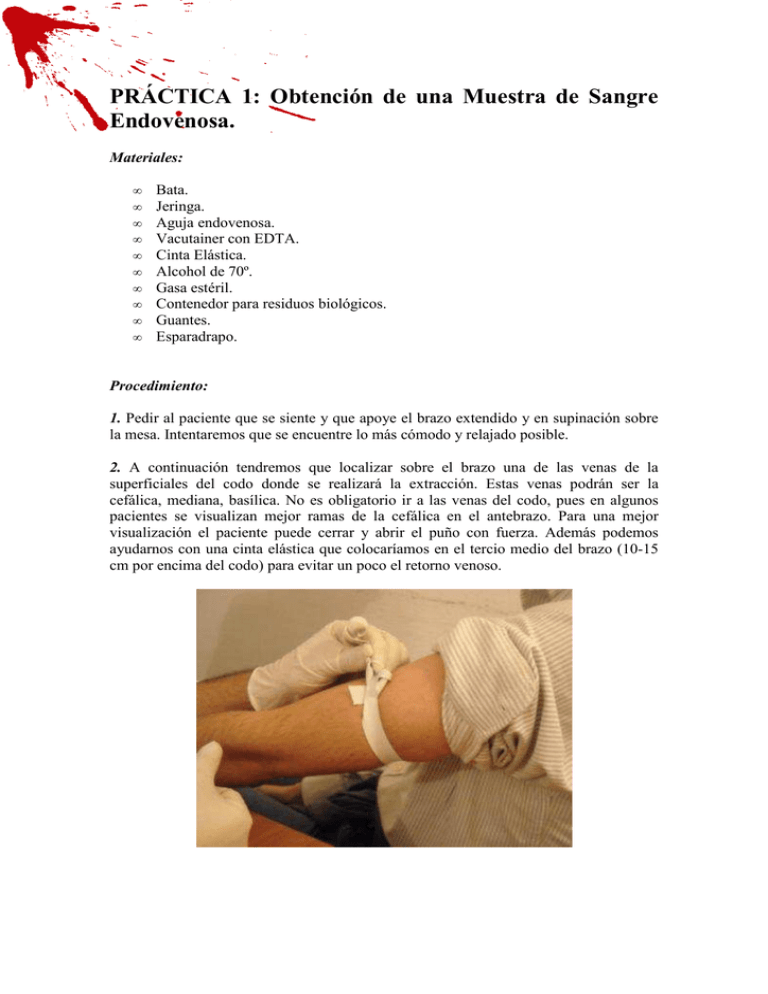
PRÁCTICA 1: Obtención de una Muestra de Sangre Endovenosa. Materiales: • • • • • • • • • • Bata. Jeringa. Aguja endovenosa. Vacutainer con EDTA. Cinta Elástica. Alcohol de 70º. Gasa estéril. Contenedor para residuos biológicos. Guantes. Esparadrapo. Procedimiento: 1. Pedir al paciente que se siente y que apoye el brazo extendido y en supinación sobre la mesa. Intentaremos que se encuentre lo más cómodo y relajado posible. 2. A continuación tendremos que localizar sobre el brazo una de las venas de la superficiales del codo donde se realizará la extracción. Estas venas podrán ser la cefálica, mediana, basílica. No es obligatorio ir a las venas del codo, pues en algunos pacientes se visualizan mejor ramas de la cefálica en el antebrazo. Para una mejor visualización el paciente puede cerrar y abrir el puño con fuerza. Además podemos ayudarnos con una cinta elástica que colocaríamos en el tercio medio del brazo (10-15 cm por encima del codo) para evitar un poco el retorno venoso. 3. Nos ponemos los guantes y limpiamos la zona de extracción con una gasa estéril con alcohol de 70º. 4. Preparamos la jeringa: la quitamos de su envoltorio, retiramos el plástico de la aguja y la colocamos sobre la jeringa. Quitamos el capuchón de la jeringa. Nos aseguramos que el émbolo está abajo del todo. Normalmente las jeringuillas ya vienen preparadas para esto, es decir, vienen haciendo vacío, con el émbolo abajo del todo. 5. Cogemos la jeringa de manera que el orificio de la aguja quede orientado hacia arriba y la introducimos con un ángulo de aproximadamente 45º en la vena previamente palpada y siguiendo su trayectoria. Al meter la aguja hay que hacerlo de una vez, sin dudas, firmes pero sin fuerza bruta. 6. Retiramos la cinta elástica del brazo. 7. Sostenemos bien la jeringa con una mano mientras que con la otra tiramos suavemente hacia atrás del émbolo y con cuidado de que al hacerlo no retiremos la aguja hasta que la jeringa recoja el volumen necesario para nuestro análisis. 8. Una vez finalizada la extracción, retiramos cuidadosamente la aguja del brazo. Esto se hace de forma limpia, de una vez pero con suavidad. 9. Inmediatamente después, tapamos la zona de la zona con una gasa y la fijamos con esparadrapo. Pedimos al paciente que presione, que flexione el codo un poco durante los primero minutos. 10. Pasamos el volumen de sangre recogido en la jeringa a un vacutainer que contiene el anticoagulante EDTA (el empleado en esta práctica y el más habitual). Cuando vertemos sangre en el vacutainer debemos empujarlo suavemente con el émbolo e ir derramando poco a poco sobre la pared del recipiente, ya que si no provocaríamos la lisis celular. Tras esto tapamos el vacutainer y ya tendremos lista la preparación para su análisis. El Ácido Etileno Diamino Tetracético (EDTA) tiene la particularidad de atrapar en su molécula iones de minerales y metales bivalentes que se encuentran en la circulación, en las paredes de las arterias o en las articulaciones, pero no puede afectar el calcio del hueso. Esta sustancia, que es un aminoácido, al captar el calcio depositado, devuelve su elasticidad a las arterias. De esa manera se promueve una mejor nutrición de las células y se vuelven a poner en acción diversos sistemas enzimáticos antes reprimidos. También impide la hemostasia, pues el calcio es un factor clave en ella. 11. Para finalizar depositamos la aguja en el contenedor de residuos biológicos con cuidado de no tocar la punta, así como los guantes y el resto de fómites usados. PRÁCTICA 2: Obtención de un Frotis Sanguíneo. Materiales: • • • • • • • • • • • • • • • • • Bata. Portaobjetos (x2). Lanceta. Cubreobjetos. Bandeja (cubeta). Pipeta Pasteur. Tubo de ensayo. Alcohol de 70º. Gasita estéril. Colorante Giemsa. Tampón PBS. Tampón de Inmersión. Agua Destilada. Guantes. Contenedor de residuos biológicos. Tirita. Microscopio óptico. Procedimiento: 1. Nos colocamos los guantes y desinfectamos la yema del dedo donde se realizará la extracción con una gasa estéril con alcohol de 70º. (Generalmente dedo índice o corazón). 2. Retiramos el envoltorio de la lanceta y, una vez evaporado el alcohol, procedemos a pinchar en un lateral de la yema (menos terminaciones nerviosas) del dedo con un movimiento rápido, pero nunca con demasiada fuerza. 3. A continuación, colocamos bajo el dedo el portaobjetos y presionamos suevamente la yema del dedo para que fluya más sangre hacia el exterior. Dejaremos que unas cuantas gotitas en el extremo del porta. (Generalmente la primera gota suele descartarse). 4. Cubrimos la herida con la tirita y depositamos la lanceta en el contenedor de residuos biológicos. 5. Cogemos el segundo portaobjetos mientras que con la otra mano sujetamos aquel en el que hemos depositado la muestra. Intentaremos poco a poco deslizar el portaobjetos siguiendo un movimiento primero retrógrado hasta tocar el borde donde se encuentra la sangre y posteriormente lo deslizamos hacia adelante para extender la gota. El portaobjetos que utilizamos para extender el frotis debemos colocarlo con una inclinación aproximada de 45 º. Como se indica en el dibujo, obtendremos un frotis en el que distinguiremos 3 partes: la cabeza, donde existe mayor acumulo de la muestra de sangre, y por lo tanto donde veremos gran cantidad de eritrocitos que nos harán difícil visualizar bien los leucocitos; el cuerpo, que es la zona media donde ya no encontraremos tantos eritrocitos acumulados; Cola donde apenas encontramos ya eritrocitos. Cabeza Cuerpo Cola 6. Dejamos secar y procedemos a fijar la muestra haciendo uso de alcohol: colocamos sobre la bandeja el portaobjetos y vertemos sobre él alcohol de 70 º utilizando una pipeta Pasteur. Comenzamos poniendo el alcohol por la cabeza y terminamos por la cola, teniendo siempre cuidado de no hacerlo con demasiada presión. 7. Esperamos 3 minutos. 8. Situamos el portaobjetos inclinado, apoyándolo en el borde de la cubeta para retirar el alcohol. 9. Después, preparamos la disolución Giemsa y PBS. Esta disolución suele prepararse con la proporción 1:9, por lo tanto pondremos en el tubo de ensayo 9 mL de PBS por cada mL de colorante Giemsa. 10. Volvemos a poner el porta sobre la base de la bandeja y vertemos con una pipeta Pasteur el colorante. Poco a poco vamos vertiendo generosamente y cubriendo toda la superficie, pero nunca con presión. Comprobaremos que el colorante aparece con cierto volumen sobre el portaobjetos (esto es gracias al fenómeno de tensión superficial del líquido). 11. Dejamos reposar la preparación unos minutos. 12. Para finalizar de preparar la muestra, apoyamos la cabeza del portaobjetos sobre uno de los bordes de la bandeja y procedemos a lavar el frotis con la pipeta Pasteur cargada de agua destilada. Iremos derramando el agua suavemente sobre la preparación desde la zona superior para quitar el exceso de colorante. 13. Ponemos el portaobjetos sobre el microscopio y observamos cual es la mejor zona de visualización de los diferentes tipos celulares en el frotis. 14. Una vez que elegida la zona cogemos el portaobjetos y añadimos una gotitas de fijador en ella para taparlo con un cubreobjetos. 15. Dejamos secar el portaobjetos y ya tenemos lista la preparación para observar al microscopio. PRÁCTICA 3: Recuento Celular Sanguíneo. Materiales: • • • • • • • • • • • • • Bata. Guantes. Lanceta. Eppendorf (x2). Líquido de Tulkarem. PBS. Cámara de Neubauer (Cámara cuentaglóbulos). Micropipeta. Gasa estéril. Alcohol de 70º. Tirita. Microscopio óptico. Contenedor de residuos biológicos. Procedimiento: 1. Nos ponemos los guantes y desinfectamos la yema del dedo con una gasita estéril empapada en alcohol de 70º. 2. Retiramos el envoltorio que contiene la lanceta y pinchamos en uno de los laterales de la yema del dedo (ver práctica 2). 3. Tiramos la lanceta al contenedor de residuos biológicos e inmediatamente después situamos la punta de la pipeta (con el tope bajado) sobre la sangre de la herida, mientras otra persona nos ayuda presionando el dedo para que salga más. Intentamos absorber poco a poco la sangre soltando lentamente el émbolo de la pipeta. 4. Vamos trasladando la sangre a los 2 Eppendorf. En cada uno de los Eppendorf pondremos un volumen de 0,5 µL. A la hora de ponerlo solo presionaremos hasta el primer tope de la pipeta, a diferencia de cuando recogíamos la sangre del dedo, en donde podíamos apretar hasta el 2º. 5. Ponemos una tirita en el lugar de la punción tras haber recogido la sangre. 6. En cada Eppendorf pondremos una disolución diferente. En uno se hará una para el recuento de glóbulos rojos, mientras que en el otro se hará para el recuento de leucocitos. • 1º Eppendorf: Añadimos con la pipeta un volumen de 1000 µL de PBS. Cogemos el Eppendorf con dos dedos mientras que con otro dedo le damos golpecitos para permitir que se mezclen suavemente sin dañar la preparación. Este Eppendorf será el que utilizaremos para el recuento de eritrocitos. • 2º Eppendorf: Añadimos 100 µL de líquido de Tulkarem. Mezclamos suavemente como con el anterior. Esta disolución será la que emplearemos para el recuento de leucocitos. El líquido de Tull contiene azul de metileno, un compuesto básico que tiñe muy bien todos aquellas moléculas ácidas como son el ADN y el ARN celular. De este modo sólo aparecerán marcados los núcleos. Este líquido también contiene Ácido acético, un compuesto que provoca la lisis de los eritrocitos. Así, cuando visualicemos nuestra preparación solo se apreciarán los núcleos de los leucocitos. 7. Recuento de leucocitos: Con una pipeta cogemos la solución con líquido de Tull y la vamos depositando en la zona central de la cámara de Neubauer. Repetimos esta operación hasta que el portaobjetos quede lleno. 8. Colocamos un cubreobjetos sobre la cámara de Neubauer. Podremos apreciar cómo las gotitas se expanden hacia las rejillas por capilaridad. 9. Situamos la cámara de Neubauer bajo la lente del microscopio. Podremos apreciar la presencia de una cuadrícula. Para el recuento de leucocitos contaremos los núcleos que apreciamos en cada uno de los 16 cuadritos de una de las esquinas del cuadro. Iremos contando de izquierda a derecha, como si estuviéramos leyendo. Cuando hayamos hecho el recuento del número de leucocitos de una de las áreas del cuadro (los leucocitos de los 16 cuadritos) aplicaremos la siguiente fórmula: 10. En nuestro caso realizamos un recuento de 26 leucocitos en una de las áreas (en 16 cuadraditos), de manera a que para hacer una estimación aproximada del número de leucocitos en sangre aplicamos la fórmula. El valor de leucocitos varía según la edad: Adultos / niños > 2 años Niños < 2 años Recién nacidos 5.000 - 10.000/mm3 6.200 - 17.000/mm3 9.000 - 30.000/mm3 El valor fisiológico de leucocitos en sangre está entre 5.000 y 10.000 por mm3. Nuestro recuento ha sido de 5.200, así que puede considerarse que es un estado normal. PRÁCTICA 4: Visualización de Leucocitos. Durante la Práctica de Visualización de Frotis sanguíneo se pudieron observar dos frotis sanguíneos cada uno con una tinción distinta: Visualización de leucocitos sobre un frotis sanguíneo teñido previamente mediante tinción Giemsa. (procedimiento en práctica 2). B. Extracción de sangre capilar, y tras extender el frotis se tiñó mediante la tinción de Wright. A. A) Visualización del frotis sanguíneo con tinción Giemsa, empleando aceite de inmersión y x100 aumentos): La tinción Giemsa nos permitió observar una gran variedad de células de la serie blanca. Las células más abundantes fueron los neutrófilos. La identificación de cada uno de los tipos de leucocitos se facilitó aún más, ya que se utilizó una lente de x100 aumentos con aceite de inmersión. B) Realización de la tinción de Wright: Tinción de Wright: Compuesta por azul de metileno y eosina. Esta técnica, al igual que la de Giemsa, es muy común para la visualización de frotis en el microscopio. Sin embargo, con la tinción de Wright se realiza una tinción más completa, ya que permite visualizar distintas coloraciones citoplasmáticas (pueden quedar reflejadas las granulaciones). Materiales: • • • • • • • • • • • Lanceta. Alcohol. Gasa y Tirita. Cubeta. Tinte de Giemsa. Tinte de Wright. PBS. Pipeta Pasteur. Agua destilada. Microscopio. Bata. Procedimiento: 1. Obtener una muestra de sangre capilar. Para ello, primero nos pondremos los guantes y desinfectaremos con una gasa empapada en alcohol la yema del dedo, que a continuación pincharemos con la lanceta. (Más información en práctica 2) 2. Procedemos a extender la muestra y obtener así un frotis. (Véase práctica 2). 3. Dejar secar el frotis unos minutos. 4. Tinción de Wright: 4.1. Sumergimos el frotis en una solución de Giemsa: dejamos el portaobjetos sobre la cubeta y con la pipeta Pasteur tomaremos un volumen Giemsa repetidas veces y lo iremos añadiendo sobre el frotis hasta dejarlo totalmente cubierto por el tinte. Tras esto, dejamos secar un minuto y después procedemos a quitar el exceso de Giemsa antes de lavarlo, ayudándonos de un papel absorbente. 4.2. Pipeteamos agua destilada y la vamos añadiendo suavemente sin que ésta ejerza presión sobre el frotis. Para facilitar el lavado, apoyaremos uno de los extremos del frotis sobre uno de los bordes de la cubeta. Así, iremos poco a poco lavando la preparación hasta eliminar el exceso de Giemsa. 4.3. Prepararemos la tinción de Wright: Se debe tomar 1 volumen de líquido de Wright por cada 2 volúmenes de PBS. Una vez hayamos obtenido la mezcla, succionamos con una pipeta Pasteur y vamos añadiendo colorante sobre la muestra que reposa sobre la base de la cubeta. Tendremos que asegurarnos que la muestra queda totalmente cubierta por líquido de tinción. 4.4. Dejamos Reposar durante 10 minutos. 4.5. Lavaremos de nuevo el frotis con agua destilada y al igual que antes, no debemos ejercer presión al expulsar el agua desde la pipeta. 4.6. Dejaremos secar la tinción unos minutos. 5. Colocamos el cubreobjetos en la zona más interesante para observar en el microscopio con la ayuda del fijador. 6. Esperamos a que seque y visualizamos el portaobjetos en el microscopio óptico. En este caso, se utilizó aceite inmersión y un objetivo de x100 aumentos. PRÁCTICA 5: Hematocrito. Objetivos: Entender los conceptos de: hematocrito, Volumen Corpuscular Medio y Hemoglobina Corpuscular Media. B. Comprender los cálculos que relacionan el hematocrito y el número de hematíes para obtener el volumen corpuscular y el volumen de hemoglobina corpuscular media. C. Conocer las técnicas para la obtención del hematocrito. D. Realizar el hematocrito con muestras de nuestra propia sangre. A. El índice de hematocrito: Porcentaje de glóbulos rojos que se encuentran en toda la sangre con respecto a la proporción de plasma sanguíneo. Nos da una idea de la cantidad de hematíes que la persona presenta en sangre (se hace en%). Los valores normales del hematocrito varían según el sexo, la edad, la condición física del sujeto o el laboratorio donde se haga la prueba: Varones adultos Mujeres adultas Lactantes - niños Recién nacidos 42 - 52% 37 - 47% 30 - 43% 44 - 64% En situaciones patológicas los valores pueden verse modificados, de ahí que este índice pueda ser de ayuda a la hora de elaborar un diagnóstico: • Hematocrito disminuido: En situaciones patológicas como anemia, hemorragias, cáncer de colon, leucemia, desnutrición o deficiencia vitamínica en la dieta, mieloma múltiple o artritis reumatoide. • Hematocrito elevado: En situaciones de deshidratación, quemaduras, diarrea, eritrocitosis, bajos niveles de O ₂ en sangre (hipoxia), policitemia vera (tipo de leucemia donde la serie eritroide es la que se ve afectada). Se debe obtener una muestra de sangre venosa (ya que el volumen de sangre que se obtendría de una muestra capilar sería insuficiente para realizar la medición). Una vez se tenga la muestra en un capilar se debe centrifugar. Al centrifugar el capilar, se podrán distinguir claramente 2 regiones. La parte superior y más diluida corresponde a la fracción plasmática, mientras que la parte inferior, más densa, corresponde a los elementos formes que componen la sangre. Lo más abundante en esta última son los hematíes y, esto es a lo que le llamamos hematocrito. Cabe recordar que el HC en venas es > HC en arterias, que es > HC en capilares (para más información ver a continuación el procedimiento de obtención de hematocrito con una muestra de sangre propia). A continuación procederemos a calcular el valor del hematocrito. Para la lectura del hematocrito se pueden emplear dos procedimientos distintos: Una regla, midiendo siempre en mm (el método empleado por nosotros), o un lector de hematocrito (utilizado en laboratorios). CAPILAR En nuestro caso no se puedo llevar a cabo la medición del hematocrito, pues la centrifugadora no estaba calibrada y se convirtió en una trituradora, que rompió todos los capilares. Aún así, por ejemplo, si la fracción de elemento formes hubiera sido de 30 mm y nuestra fracción plasmática de 65 mm, tendríamos que hacer lo siguiente: Este valor estaría dentro del rango normal en un varón adulto. Cálculo del número de Hematíes a partir del hematocrito: A partir del índice del hematocrito se puede deducir la cifra de hematíes. Si los hematíes tienen una forma y un tamaño normal y un contenido en hemoglobina normal o poco alterado, la relación ente el número de hematíes (heme) y el índice de hematocrito (Ht) es una constante. Por lo tanto, el porcentaje de hematocrito multiplicado por una constante nos proporcionan el número de hematíes por mm3. Los valores de nº de hematíes varían también con el sexo y la edad: Varones adultos Mujeres adultas Recién nacidos 4,7 - 6,1 millones/mm3 4,2 - 5,4 millones/mm3 4,8 - 7,1 millones/mm3 Volumen Corpuscular Medio: El Volumen Corpuscular Medio nos da idea del tamaño de los hematíes. Este parámetro es útil para el diagnóstico de anemias macrocíticas, producida, por ejemplo, por la falta de vit. B12; o anemias microcíticas producidas, por ejemplo, por deficiencia de hierro. El VCM varía con la edad: Adultos/niños/as Recién nacidos 80 - 95 96 - 108 Concentración de Hemoglobina Corpuscular Media: Concentración de hemoglobina por unidad de volumen de eritrocitos. Este valor varía según la edad y sexo: Varones adultos Mujeres adultas Lactantes - niños Recién nacidos 14 - 18 g/dL 12 - 16 g/dL 11 - 16 g/dL 14 - 24 g/dL Realización de un hematocrito con nuestra propia sangre: Materiales • • • • • • • • • • • • • Bata. Jeringa. Aguja endovenosa. Gasa estéril y tirita. Alcohol. Cinta elástica. Vacutainer con EDTA. Guantes. Contenedor de residuos Biológicos. Tubito Capilar (de 75mm de largo y 2 mm de diámetro interior y heparina de secado). Plastilina. Regla milimetrada. Centrifugadora de alta velocidad (800-1200rpm). Procedimiento 1. Procedemos a obtener una muestra sanguínea endovenosa. Para ello desinfectaremos la zona con una gasa empapada en alcohol y procederemos a la extracción. La sangre deberá incluirse en un vacutainer con el anticoagulante EDTA. (Para más información véase práctica 1). 2. A continuación traspasaremos un volumen de sangre que tenemos en el vacutainer el capilar. Para ello tapamos un extremo del capilar con la yema del dedo e introducimos el otro extremo del capilar en el vacutainer con sangre. Mantenemos el vacutainer con cierta inclinación y tras esto, desplazamos la yema del dedo del orificio del capilar. Así, al haber creado un vacío la sangre tenderá a ascender por el capilar con mayor facilidad. Poco a poco descender y ascender el capilar hasta que quede totalmente lleno. 3. Cuando el capilar esté lleno taparemos ambos extremos del capilar con plastilina para evitar que la sangre pueda perderse. 4. DEPOSITAMOS el capilar en el platillo de la centrifugadora y la Programamos 5 minutos a 12.000 rpm. (Poner siempre un contrapeso). 5. Tras el centrifugado sacamos el capilar y podremos observar como la sangre del capilar aparece dividida en 2 fracciones: La fracción superior más diluida y sin apenas coloración (plasma) y la fracción inferior más densa y rojiza (elementos formes), compuesta principalmente por eritrocitos. 6. Para calcular el hematocrito tan sólo tendremos que medir con una regla milimetrada la longitud del capilar ocupada por cada fracción. Siendo: Y = Longitud de la fracción de células plasmáticas en el capilar. X = Longitud de la fracción de plasma sanguíneo en el capilar. PRÁCTICA 6: Velocidad de Sedimentación Globular (VSG). Velocidad de sedimentación globular (VSG): Prueba de diagnóstico complementaria que mide la velocidad con la que los eritrocitos precipitan en el fondo del tubo de ensayo. Consiste en dejar en reposo durante un período de tiempo determinado (1-2 horas), la sangre total sin coagular (sangre no coagulada con citrato sódico al 3,8% durante una hora), produciéndose la separación de los hematíes de la concentración plasmática, de modo que sedimentan en el fondo del recipiente formando acúmulos en forma de pilas de monedas por la atracción de la superficie de los eritrocitos. La velocidad con la que se da el descenso de estos hematíes sedimentados es lo que define a la prueba de la velocidad de sedimentación globular (VSG). Este parámetro va a estar determinado por: • • • • La concentración y tamaño de los hematíes. La diferencia de densidad del plasma y hematíes. La viscosidad del plasma. La temperatura ambiente. La velocidad de sedimentación globular es muy sensible ante cualquier variación fisiológica o fisiopatológicos que pueda tener lugar. Por esta razón este parámetro no puede emplearse como prueba de diagnóstico, ya que existen múltiples variables con las que se puede ver afectada. Sin embargo, si puede utilizarse como prueba complementaria, como una prueba más que pueda ofrecer información hacia un diagnóstico. Etapas de sedimentación Globular: Etapas de la Sedimentación Globular: 1. Hemaglutinación: tendencia a formar "pilas de monedas". 2. Sedimentación de los hematíes hacia el fondo del recipiente. 3. Acumulación de los hematíes en el fondo del recipiente. De estas 3 etapas la más importante es la primera etapa ya que de ella va a depender la velocidad con la que se dé el resto del proceso. Los eritrocitos van formando agregados, por ello, cuantos más agregados, más rápidamente van descendiendo. Mientras que si existen pocos agregados, la velocidad de sedimentación será mayor. En un individuo normal la VSG se mantiene gracias a un equilibrio entre la albúmina y el resto de las proteínas plasmáticas. A pesar de que sea una prueba tan inespecífica y cuyo uso sea siempre complementario, como ya hemos comentado es muy sensible, y su aumento es siempre signo de enfermedad (proceso inflamatorio, neoplásico o infeccioso). La VSG también se relaciona con la actividad de la enfermedad y puede ser útil para el seguimiento de ciertas afecciones como procesos inflamatorios crónicos (artritis reumatoide, tuberculosis...). Se sabe que el aumento de las globulinas sobre la albumina produce un incremento de la V.S.G., así como el aumento del fibrinógeno plasmático, aunque esto no indica ninguna patología concreta. El método más utilizado es el de Westergren, en el que la velocidad de sedimentación de los hematíes o eritrocitos son medidos en mm/hora. Los valores normales ronda dependiendo de la edad y el sexo los: Hombres Mujeres Niños Neonatos 0-15 mm / h 0-20 mm / h 0-10 mm / h 0-2 mm / h Alteraciones de la VSG: • Aumento de la VSG: Puede ser producido por el envejecimiento, embarazo, menstruación, anemias, infarto agudo de miocardio, insuficiencia renal, neoplasias o tumores, hemorragias, gammapatías monoclonales como mielomas o incluso por un aumento de la fracción de inmunoglobulinas. En condiciones patológicas el aumento de proteínas plasmáticas sobretodo IgM propias de procesos de agudos, enfermedades reumáticas y la presencia de paraproteínas provocan un aumento de la hemaglutinación, ya que estas proteínas se asocian al agua y la densidad plasmática global cambia y por lo tanto, esto termina por aumentar la VSG. • Disminución de la VSG: Puede venir dada por policitemias (aumento de la cantidad de eritrocitos, por ejemplo, por aumento de EPO), alteraciones eritrocitarias (en cuanto a su forma o volumen), disminución de fibrinógeno plasmático (hipofibrinogenenemia), etc. Realización de una lectura de VSG en una muestra de sangre en una hora: Materiales: • • • • • • • • • • • Bata. Jeringa. Aguja endovenosa. Gasa estéril. Alcohol 70º. Tirita. Guantes. Tubo con solución anticoagulante de citrato. Pipeta de Eritrosedimentación o de Westergreen (longitud 300mm y calibre 2,5 mm). Soporte inmovilizador milimetrado de la pipeta en posición vertical. Cronómetro. Procedimiento: 1. Extraer una muestra de sangre venosa, para ello desinfectaremos previamente la zona aplicando una gasa con alcohol, colocamos la cinta elástica y tras ello efectuaremos la extracción (véase práctica 1). La sangre debe quedar contenida en un tubo con citrato sódico en 109 mmol / L. Es importante haber llenar todo el tubo para asegurarnos así de que la proporción de citrato y de sangre es la adecuada: 1 volumen de anticoagulante de citrato: 4 volúmenes de sangre 2. Llenamos la pipeta Westergreen con nuestra muestra de sangre con una propipeta y enrasamos a los 0 mm. 3. Una vez llena ponemos la pipeta de Westergreen el soporte inmovilizador milimetrado, sobre el cual nuestra pipeta quedará en posición vertical. Debemos fijarnos en los mm que nos muestra el soporte nada más ponerlo, ya que se irá produciendo la sedimentación globular, de modo que la altura reflejada en el soporte será distinta al cabo de una hora. 4. Nosotros realizaremos la lectura 1 hora después de su extracción. De esta forma habrá tenido lugar una lenta separación entre los eritrocitos (zona inferior) y el plasma sanguíneo (zona superior). Los eritrocitos habrán ido precipitando y sedimentándose en el fondo de la pipeta quedando apilados unos sobre otros como columnas de monedas. Cuanto más rápido se produzca la sedimentación de los eritrocitos, mayor será la VSG. Nos fijamos en la superficie del menisco de la columna de eritrocitos actual, no del plasma, con respecto a la parte superior de la columna donde se reflejaba 0 mm. La altura correspondiente en mm será el valor de la VSG para nuestra muestra de sangre. PRÁCTICA 7: Tiempo de Protrombina o tiempo de Quick. En esta práctica aprenderemos a calcular el tiempo de protrombina o tiempo de Quick, que es el tiempo necesario para la coagulación de un plasma recalcificado en presencia de un exceso de tromboplastina hística. Materiales: • • • • • • • • • • • • • • • Bata. Jeringa. Aguja endovenosa. Gasa estéril. Alcohol 70º. Cinta elástica. Vacutainer. Plasma pobre en plaquetas gracias a que la sangre se recoge con citrato sódico, 0,1 mol / L en proporción 1 volumen de citrato por cada 9 volúmenes de sangre. Pipeta. Suspensión de tromboplastina hística. Aparato de incubación hoyo 1 A. Imán activador del coágulo. Pocillos especiales para colocar muestra de incubación. Guantes. Contenedor de residuos biológicos. Procedimiento: 1. Obtenemos una muestra de sangre endovenosa (ver práctica 1). La muestra de sangre tendrá que quedar incluida en anticoagulante (citrato sódico). 2. Centrifugamos nuestra muestra de sangre con el anticoagulante durante 10 minutos. Cuando la centrifugación haya finalizado, en nuestra muestra se habrá fraccionado, distinguiéndose así, una región inferior compuesta por hematíes, una región compuesta por leucocitos y plaquetas y una región superior, la cual contiene plasma y es muy pobre en plaquetas. (Esta región pobre en plaquetas es la que buscamos, ya que queremos determinar el tiempo de coagulación sin que interfieran las plaquetas). 3. Pipeteamos 100 landas de plasma (la fracción superior) de la muestra centrifugada y lo introducimos en un pocillo. A continuación depositaremos el pocillo en el aparato de incubación y lo programaremos a 37ºC durante 10 minutos. De esta manera estaremos simulando las condiciones fisiológicas del cuerpo. 4. Una vez transcurridos los 10 minutos, depositamos en el pocillo un imán y a continuación colocamos nuestro pocillo ahora ya sobre el rotor y lo reprogramamos a 0,0. 5. Extraemos un volumen de 200 landas de tromboplastina y lo vertemos en el pocillo. 6. Pondremos en marcha el rotor. 7. A continuación calcularemos el tiempo de coagulación, el cual se corresponderá con el tiempo que se haya necesitado para que el imán deje de rotar. Cuando introducimos la tromboplastina estaremos activando la formación del coágulo, y mientras este se forme el imán girará. Un vez el imán se detenga querrá decir que se ha formado el coágulo y este impide que gire. El valor marcado en ese momento corresponderá al tiempo de coagulación. Si la tromboplasmina es la adecuada, el valor debe encontrarse entre los 12 y los 14 segundos. PRÁCTICA Sanguíneos. 8: Determinación de los Grupos Los grupos sanguíneos AB0 son glucolípidos y proteínas que forman parte de la membrana de los hematíes y se diferencian por su diferente capacidad antigénica. Tales glucoproteínas se encuentran unidas a diferentes azúcares que son los que les proporcionan la especificidad de grupo: • Grupo A: Contiene en la membrana la Galactosaminil-N-acetiltransferasa (sustancia A). Tendrá anticuerpos anti-B. • Grupo B: Contiene en la membrana la Galactosiltransferasa (sustancia B). tendrá anticuerpos anti-A. • • Grupo AB: Contiene tanto los tipos de transferasa del A como de B. No da lugar a ningún anticuerpo. Grupo 0: No contiene ninguna transferasa (sustancia H). Da lugar a lo anticuerpos anti-A y anti-B. Normalmente la población sigue estos porcentajes en lo que se refiere a su grupo sanguíneo: El grupo antigénico no eritrocitario HLA (antígenos leucocitarios humanos) es un grupo antigénico presente en todas las células (incluidos en los glóbulos blancos) y su determinación es de gran importancia para poder evitar así el rechazo de trasplantes de órganos. El Sistema Rh es un sistema complejo basado en distintos antígenos eritrocitarios como Ag: D, C, E, c y e. De todos estos antígenos, el que presenta mayor capacidad antigénica es el D, por ello, en la determinación rutinaria del Rh sólo se investiga el Ag D: • Rh+ si presenta el antígeno D (85% de la raza caucásica). • Rh- si no presenta antígeno anti D (15% de la raza caucásica). Durante esta práctica se pretende: 1. Determinar el grupo sanguíneo y sistema Rh para Ag D de nuestra muestra de sangre. 2. Entender las compatibilidades transfusionales de los grupos AB0 y Rh. Materiales: • • • • • • • • • • • • • • • Bata. Jeringas. Agujas endovenosas. Tubo colector con EDTA. Alcohol. Gasas estériles. Guantes. Cinta elástica. Suero anti-A. Suero anti-B. Suero Anti-D. 3 Pipetas Pasteur. 3 Portaobjetos. 3 Puntas de micropipetas estériles para mezclar y agilizar así la aglutinación si es el caso. Rotulador permanente para marcar los portaobjetos. Procedimiento: 1. Obtenemos una muestra de sangre endovenosa (véase práctica 1) con una tubo colector con EDTA. La muestra puede proceder de punción capilar, pero esto implicaría depositar rápidamente gotas de sangre sobre los portaobjetos y, además se necesita una cantidad de sangre mayor de la que seguramente se obtendría con esta punción. 2. Cogemos los tres portaobjetos y con el rotulador marcamos en cada uno con el nombre del suero que depositaremos posteriormente. De manera que al final tendremos un portaobjetos rotulado como A, otro como B y otro como D. 3. A continuación añadiremos en el centro de cada portaobjetos su suero correspondiente. En el portaobjetos A añadiremos suero Anti-A, en el portaobjetos B añadiremos suero Anti-B y en el portaobjetos D añadiremos suero Anti-D. 4. Una vez tengamos preparados los portaobjetos, destaparemos el tubo colector con EDTA donde está contenida la muestra y con una de las pipetas Pasteur succionaremos un poco de sangre del tubo. A continuación depositaremos una ó dos gotitas de sangre sobre el suero del portaobjetos A. 5. Desechamos la pipeta Pasteur y ayudándonos de una de las puntas estériles procederemos mezclar suavemente pero sin detenerse, el suero con las gotitas de sangre siguiendo un movimiento circular. Lo haremos durante 2 minutos o hasta que vemos que la mezcla se haya aglutinado. En caso de que se produzca aglutinación nos estará indicando que existe unión antígeno-anticuerpo y por ello la muestra de sangre contiene tal antígeno. 6. Repetiremos los pasos 4 y 5 pero esta vez con el portaobjetos B. 7. Para terminar terminaremos repitiendo los pasos 4 y 5, pero esta vez con el portaobjetos D para determinar así si el individuo es Rh+ o Rh-. En este portaobjetos tendremos que continuar el movimiento de la mezcla durante unos 3 minutos o algo más para poder determinar verdaderamente si se produce aglutinación o no, porque tarda más. Tipo O Rh+ No aglutinación en A y B Aglutinación en D Interpretación de los Resultados: Grupo Sanguíneo: • • • • Si la mezcla sólo se aglutina en el portaobjetos A: el grupo sanguíneo es A. Si la mezcla sólo se aglutina en el portaobjetos B: el grupo sanguíneo es B. Si la mezcla se aglutina en el portaobjetos A y también se aglutina en el portaobjetos B: el grupo sanguíneo es AB. Si la mezcla no se aglutina ni en el portaobjetos A ni en el portaobjetos B: el grupo sanguíneo es 0. Sistema Rh para antígeno D: • • Si la mezcla se aglutina en el portaobjetos D: el individuo es Rh+. Si la mezcla no se aglutina en el portaobjetos D: el individuo es Rh-. Compatibilidades transfusionales del grupo AB0: El grupo O puede recibir solo de otro O; pero puede donar a todos, es el dador universal. El grupo A solo puede recibir de otro A o del O. El B solo puede recibir de otro B o del O. Y, por último, el AB puede recibir de todos los grupos sanguíneos (receptor universal), pero solo puede dar a otro AB. Compatibilidades transfusionales del sistema Rh: Un individuo del grupo Rh + no presenta anticuerpos Anti D por ello, es receptor de sangre del grupo Rh+ (sangre con Ag D) y del grupo Rh- (sangre sin Ag D). En cambio, un individuo del grupo Rh- presenta anticuerpos anti-D, por lo tanto sólo podrá recibir transfusiones de sangre que sean del grupo Rh- (aquellas que no contengan Ag D) y nunca podrá ser receptor de sangre de grupo Rh + (las cuales contienen antígeno D). A la hora de realizar la transfusión hay que tener en cuenta ambos sistemas (ABO y Rh), pues de pendiendo de cómo sean ambos la transfusión será posible o no: OR E C E P T O R OO+ AA+ BB+ ABAB+ O+ A- DONANTE A+ B- B+ AB- AB+







