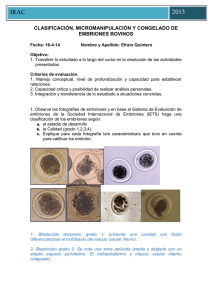
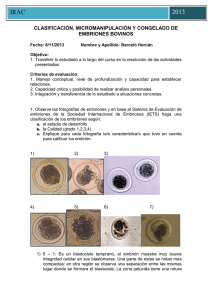
PROTOCOLOS ACTUALES DE CONGELACIÓN: ¿QUÉ Y CÓMO
Anuncio

PROTOCOLOS ACTUALES DE CONGELACIÓN: ¿QUÉ Y CÓMO CONGELAR? María Teresa Cañete Reina E.S.H.R.E. Senior Clinical Embryologist Embryocenter Sevilla CRIOPRESERVACIÓN -CONGELACIÓN DE GAMETOS Y EMBRIONES A MUY BAJA TEMPERATURA:-80ºC A -196ºC -DISMINUCIÓN FUNCIONES VITALES -CONDICIONES DE VIDA SUSPENDIDAS -REACCIONES BIOQUÍMICAS DETENIDAS -CONGELACIÓN Y ALMACENAMIENTO CONGELACIÓN LOS EMBRIONES NO TRANSFERIDOS para uso posterior por: -fallo de embarazo • -segundo hijo TODOS LOS EMBRIONES por: -condiciones maternales adversas. • INDICADA PARA: RETRASO MATERNIDAD por causas laborales ó sociales • PACIENTES ONCOLÓGICAS (quimioterapia ó radioterapia) • PACIENTES NO ONCOLÓGICAS ( tratamientos gonadotóxicos) • CIRUGÍA REPETITIVA EN EL OVARIO COMO ENDOMETRIOSIS -RIESGO DE SHO • BANCO DE ÓVULOS -APARICIÓN PÓLIPOS ENDOMETRIALES -HIDROSÁLPINX • POSPONER TRANSFERENCIA POR: -AUSENCIA DE ESPERMATOZOIDES -DIFICULTAD DE RECOGER LA MUESTRA DÍA DE PUNCIÓN -PACIENTES CON BAJA RESPUESTA PARA ACUMULAR OVOCITOS (DGP) • CONGELACIÓN LENTA DAÑOS: -CONGELACIÓN INTRACELULAR Y FORMACIÓN DE CRISTALES -EFECTOS NOCIVOS DE LA SOLUCIÓN EN MEMBRANA CELULAR Y ORGÁNULOS CELULARES POR CONCENTRACIÓN DE ELECTROLITOS FASES DEL PROCESO DE CONGELACIÓN: -PRECONGELACIÓN -CONGELACIÓN -ALMACENAMIENTO PRECONGELACIÓN: Exposición y equilibrio a un crioprotector. Los crioprotectores modifican las propiedades físicas de una solución por bajar su punto de congelación. TIPOS DE CRIOPROTECTORES • PERMEABLES ó INTRACELULARES: Bajo peso molecular -Glicerol (G) -Dimetilsulfóxido (DMSO) -1,2 propanodiol -Etilenglicol (EG) -Propilenglicol (PG), -Polietilenglicol (PEG) -Etanol y otros alcoholes FUNCIÓN -Entran en la célula -Reemplazan el agua intracelular -Modifican características fisicoquímicas y respuesta frente al descenso de temperatura MECANISMOS DE ACCIÓN: -Disminución punto de congelación de la suspensión. -Impiden formación de hielo CRIOPROTECTORES • IMPERMEABLES O EXTRACELULARES: De alto peso molecular -Polivinilpirrolidona (PVP) -Glucosa -Fructosa -Ficol -Dextrano -Sorbitol -Sucrosa -Lactosa -Trealosa, Rafinosa y otros azúcares FUNCIÓN -Reducen agua intracelular por efecto osmótico USO DE CRIOPROTECTORES EN EMBRIONES • PRONÚCLEOS: Propanodiol y sacarosa • 4-8 CÉLULAS: Dimetilsulfósido • BLASTOCISTO: Glicerol FASES CONGELACIÓN Pasos: • CONGELACIÓN 1EQUILIBRIO DE TEMPERATURAS entre la cámara de enfriamiento y el embrión 2ENFRIAMIENTO LENTO hasta llegar al punto de equilibrio de la congelación por debajo de la cual está la NUCLEACIÓN o formación primer cristal de hielo (-5ºC a -15ºC) 3SUPERENFRIAMIENTO:Diferencia entre el punto de equilibrio y nucleación. -Cristalización espontanea del medio -Aumento de la temperatura debido al desprendimiento de calor latente - Se puede bajar por “SEEDING” físico inducido cerca del punto de equilibrio aprox 2ºC por debajo pto congelación • ALMACENAMIENTO SEEDING :INDUCCIÓN NUCLEACIÓN -CERCA DELPUNTO DE EQUILIBRIO APROX 2ºC POR DEBAJO PTO CONGELACIÓN -TOCAR PARED EXTERIOR TUBO MUESTRA DONDE ESTÁ EMBRIÓN CON PINZAS PREENFRIADAS. -ENFRIAMIENTO DE LA SOLUCIÓN LOCALMENTE A UNA TEMPERATURA POR DEBAJO DE -20ºC NUCLEACIÓN ESPONTANEA -EMBRIÓN COMO OSMÓMETRO Y SE DESHIDRATA. • • PLANER KRYO 10 serie II versión 1.7para aprox 16 embriones UNIDAD DE SEEDING AUTOMÁTICA MODULO PELTIER TERMOELÉCTRICO que actúa como bomba de calor • SUPERENFRIAMIENTO LOCAL • INDUCCIÓN A LA NUCLEACIÓN NICOOL MS21 SEEDING MANUAL VITRIFICACIÓN CARACTERÍSTICAS - - - - ENFRIAMIENTO MUY RÁPIDO SOLUCIÓN ALTAMENTE CONCENTRADA QUE NO CRISTALIZA DURANTE LA CONGELACIÓN SU VISCOSIDAD AUMENTA CON EL DESCENSO DE TEMPERATURA HASTA LA FORMACIÓN DE UN ESTADO SÓLIDO AMORFO VOLUMEN MÍNIMO DE MEDIO (MENOS DE 0,1 MICROLITROS) VITRIFICACIÓN ESPERMATOZOIDES VITRIFICACIÓN:VENTAJAS • • • • No hay cristalización del embrión. Utiliza altas concentraciones de crioprotector que disminuye el período de exposición del embrión a éstos. El uso de pequeños volúmenes provee un incremento significativo en la tasa de enfriamiento. Tasas de enfriamiento entre 15.000 y 30.000ºC/min(0,3ºC/min en la congelación lenta) • Se minimizan el daño por cambios osmóticos. • Se reduce el tiempo del procedimiento (2-10´). • Protocolo muy sencillo. • Se eliminan los costos de adquisición de equipos. • USO DE LAS DOS TÉCNICAS EN EMBRYOCENTER Congelación lenta: Embriones en estadío de desarrollo de día 1. • Vitrificación: desde ovocitos hasta embriones en cualquier estadio de desarrollo (desde día 2 hasta blastocisto). MI EXPERIENCIA EN CONGELACIÓN LENTA/ VITRIFICACIÓN PUBLICACIÓN EN AÑO 1990 EN REVISTA para pacientes PUBLICACIÓN EN BOLETÍN INFORMATIVO VITRIFICACIÓN EN TRIPLOIDES. M.T. Cañete, M. Esbert, E. Moreno, C. Martinez.C.I.V.T.E. (Centro de Inseminación in Vitro y Transferencia Embrionaria) Sevilla INTRODUCCIÓN: La vitrificación en triploides es un método de congelación en el que, debido a la alta concentración de crioprotectores y ultrarrápida velocidad de enfriamiento, cuando se congela el sistema embrión-medio, las moléculas se disponen de manera similar a las del vidrio (tiene igual disposición molecular e iónica que el líquido), solidificando sin formación de cristales de hielo;ésta tiene ventajas frente a la congelación tradicional, pero el principal problema para la aplicación a gran escala ha sido el control estricto del tiempo de exposición de los embriones al crioprotector, ya que debido a la alta concentración requerida del mismo, existen problemas de disminución de la viabilidad embrionaria. Un buen crioprotector debe tener alta solubilidad y baja toxicidad a altas concentraciones y, si es penetrante, bajo peso molecular para entrar fácil y rápidamente a la célula y obtener el máximo efecto protector.Para que los crioprotectores no penetrantes expresen al máximo sus carcterísticas deben ser mezclados con crioprotectores penetrantes. CRIOPROTECTORES ALTO PESO MOLECULAR PENETRANTES - NO PENETRANTES Ficoll, Polivinilpirrolidona, etc... BAJO PESO MOLECULAR Glicerol, Etilenglicol, etc.. Sacarosa, trehalosa, etc... OBJETIVO: Probar el método de vitrificación en triploides para ver la viabilidad de éstos y poderlos aplicar en la práctica clínica. MATERIAL Y MÉTODOS: Se emplearon 15 embriones en día +2 procedentes de zigotos triploides.Estos se expusieron secuencialmente a las soluciones de vitrificación que llevaban etilenglicol como crioprotector intracelular o penetrante, trehalosa como crioprotector extracelular o no penetrante de bajo peso molecular, para la deshidratación de las células, y hialuronato, crioprotector macromolecular para incrementar la viscosidad. Se usaron pajuelas de congelación convencionales de 0.3 ml rellenadas con 30-50 microlitros de la gota de solución de vitrificación con los embriones. Los embriones se almacenaron en nitrógeno líquido durante 30-60 minutos, y se descongelaron rápidamente en un baño a 37 grados centígrados.El contenido de las pajuelas se llevó a un medio tamponado con Hepes suplementado con 0.3 M de sacarosa. RESULTADOS: 13 (86%) de los 15 embriones triploides preservaron una morfología normal en todas las blastómeras y no mostraron signos de daño tras la descongelación; 1 embrión (7%) tuvo una sola blastómera dañada combinada con 3-5 blastómeras supervivientes; 1 embrión (7%) tuvo viabilidad en menos de la mitad de sus células.12 embriones (80%) incluyendo el embrión con una sola blastómera dañada continuaron con la división celular. 7% 7% 86% EM BRIONES NO DAÑADOS EMBRIONES DAÑADOS EM BRIONES MUY DAÑADOS CONCLUSIÓN: El método de vitrificación con hialuronato podría ser un eficiente y simple método de criopreservación en embriones humanos. VITRIFICACIÓN EN TRIPLOIDES HIALURONATO MEDIOS DE VITRIFICACIÓN/DESVITRIFICACIÓN VITRI -Basic Solution (BS): 1 X 1.5ml vial (only for Oocyte Vitrification) -Equilibration Solution (ES): 1 X 1.5ml vial -Vitrification Solution (VS): 2 X 1.5ml vials 1 Cryotop stores up to 5 Oocytes or 4 Embryos as a recommendation. Composition ・ HEPES within Basic Culture Medium ・ Ethylene Glycol ・ DimethylSulfoxide ・ Trehalose ・ Hydroxypropyl Cellulose DESVITRI - Thawing Solution (TS): 2 x 4.0ml -Diluent Solution (DS) - Washing-Solution (WS) Composition ・ HEPES within Basic Culture Medium ・ Trehalose ・ Hydroxypropyl Cellulose PROTOCOLO VITRIFICACIÓN ES VS PROTOCOLO DESVITRIFICACION VITRIFICACION OVOCITOS PROTOCOLO VITRIFICACIÓN PARA EMBRIONES CONCLUSIONES SOBRE VITRIFICACIÓN • • • • • MEJOR CONSERVACIÓN DE LA ULTRAESTRUCTURA Y MENOR LESIÓN DE LA FISIOLOGÍA OVOCITARIA Y EMBRIONARIA. PROPORCIÓN DE EMBARAZO ES SIMILAR A LA COMUNICADA PARA CICLOS EN FRESCO NACIDOS PARA LA VITRIFICACIÓN DE OVOCITOS PARECE TENER UNA INCIDENCIA DE ANOMALÍAS CONGÉNITAS (2.5%) NO MAYOR A LA COMUNICADA PARA LOS NACIDOS DE EMBARAZOS ESPONTÁNEOS EN MUJERES FECUNDAS O DE CICLOS FRESCOS DE FECUNDACIÓN IN VITRO. PROPORCIONA ELEVADA SUPERVIVENCIA OVOCITARIA, FECUNDACIÓN, DESARROLLO EMBRIONARIO Y EMBARAZO. ES UNA TÉCNICA SENCILLA Y ALTAMENTE REPRODUCIBLE GRACIAS POR SU ATENCIÓN