Fisiopatología y regulación respiratoria
Anuncio
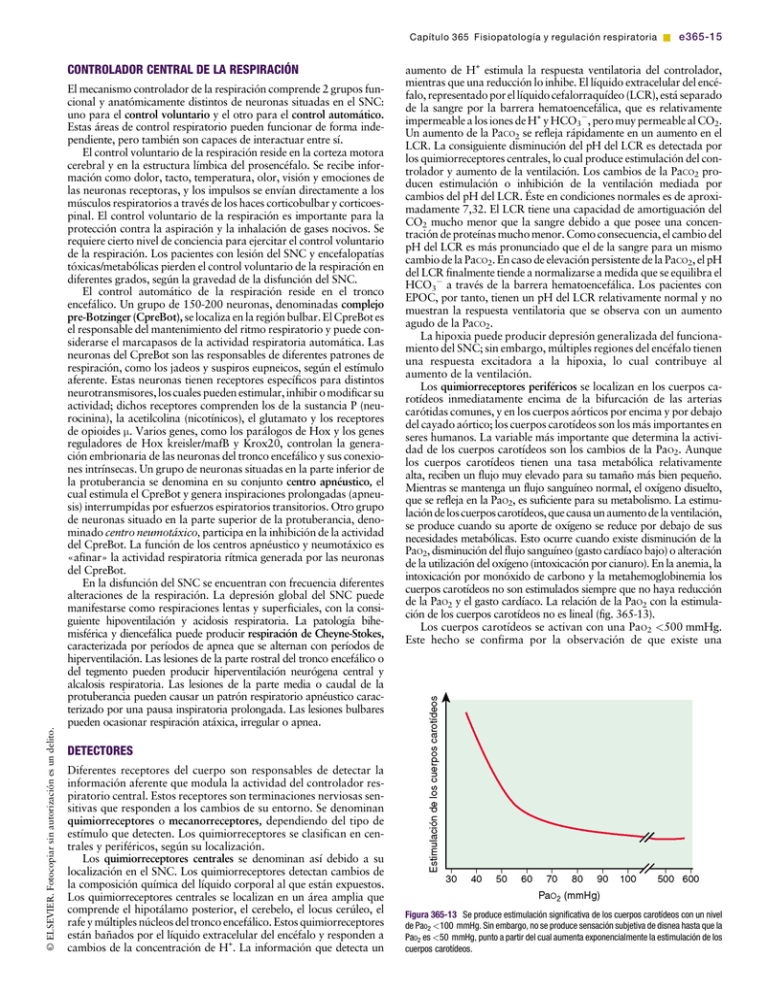
Capítulo 365 Fisiopatología y regulación respiratoria & e365-15 © ELSEVIER. Fotocopiar sin autorización es un delito. CONTROLADOR CENTRAL DE LA RESPIRACIÓN El mecanismo controlador de la respiración comprende 2 grupos funcional y anatómicamente distintos de neuronas situadas en el SNC: uno para el control voluntario y el otro para el control automático. Estas áreas de control respiratorio pueden funcionar de forma independiente, pero también son capaces de interactuar entre sí. El control voluntario de la respiración reside en la corteza motora cerebral y en la estructura límbica del prosencéfalo. Se recibe información como dolor, tacto, temperatura, olor, visión y emociones de las neuronas receptoras, y los impulsos se envían directamente a los músculos respiratorios a través de los haces corticobulbar y corticoespinal. El control voluntario de la respiración es importante para la protección contra la aspiración y la inhalación de gases nocivos. Se requiere cierto nivel de conciencia para ejercitar el control voluntario de la respiración. Los pacientes con lesión del SNC y encefalopatías tóxicas/metabólicas pierden el control voluntario de la respiración en diferentes grados, según la gravedad de la disfunción del SNC. El control automático de la respiración reside en el tronco encefálico. Un grupo de 150-200 neuronas, denominadas complejo pre-Botzinger (CpreBot), se localiza en la región bulbar. El CpreBot es el responsable del mantenimiento del ritmo respiratorio y puede considerarse el marcapasos de la actividad respiratoria automática. Las neuronas del CpreBot son las responsables de diferentes patrones de respiración, como los jadeos y suspiros eupneicos, según el estímulo aferente. Estas neuronas tienen receptores específicos para distintos neurotransmisores, los cuales pueden estimular, inhibir o modificar su actividad; dichos receptores comprenden los de la sustancia P (neurocinina), la acetilcolina (nicotínicos), el glutamato y los receptores de opioides m. Varios genes, como los parálogos de Hox y los genes reguladores de Hox kreisler/mafB y Krox20, controlan la generación embrionaria de las neuronas del tronco encefálico y sus conexiones intrínsecas. Un grupo de neuronas situadas en la parte inferior de la protuberancia se denomina en su conjunto centro apnéustico, el cual estimula el CpreBot y genera inspiraciones prolongadas (apneusis) interrumpidas por esfuerzos espiratorios transitorios. Otro grupo de neuronas situado en la parte superior de la protuberancia, denominado centro neumotáxico, participa en la inhibición de la actividad del CpreBot. La función de los centros apnéustico y neumotáxico es «afinar» la actividad respiratoria rítmica generada por las neuronas del CpreBot. En la disfunción del SNC se encuentran con frecuencia diferentes alteraciones de la respiración. La depresión global del SNC puede manifestarse como respiraciones lentas y superficiales, con la consiguiente hipoventilación y acidosis respiratoria. La patología bihemisférica y diencefálica puede producir respiración de Cheyne-Stokes, caracterizada por períodos de apnea que se alternan con períodos de hiperventilación. Las lesiones de la parte rostral del tronco encefálico o del tegmento pueden producir hiperventilación neurógena central y alcalosis respiratoria. Las lesiones de la parte media o caudal de la protuberancia pueden causar un patrón respiratorio apnéustico caracterizado por una pausa inspiratoria prolongada. Las lesiones bulbares pueden ocasionar respiración atáxica, irregular o apnea. aumento de H+ estimula la respuesta ventilatoria del controlador, mientras que una reducción lo inhibe. El líquido extracelular del encéfalo, representado por el líquido cefalorraquídeo (LCR), está separado de la sangre por la barrera hematoencefálica, que es relativamente impermeable a los iones de H+ y HCO3, pero muy permeable al CO2. Un aumento de la PaCO2 se refleja rápidamente en un aumento en el LCR. La consiguiente disminución del pH del LCR es detectada por los quimiorreceptores centrales, lo cual produce estimulación del controlador y aumento de la ventilación. Los cambios de la PaCO2 producen estimulación o inhibición de la ventilación mediada por cambios del pH del LCR. Éste en condiciones normales es de aproximadamente 7,32. El LCR tiene una capacidad de amortiguación del CO2 mucho menor que la sangre debido a que posee una concentración de proteínas mucho menor. Como consecuencia, el cambio del pH del LCR es más pronunciado que el de la sangre para un mismo cambio de la PaCO2. En caso de elevación persistente de la PaCO2, el pH del LCR finalmente tiende a normalizarse a medida que se equilibra el HCO3 a través de la barrera hematoencefálica. Los pacientes con EPOC, por tanto, tienen un pH del LCR relativamente normal y no muestran la respuesta ventilatoria que se observa con un aumento agudo de la PaCO2. La hipoxia puede producir depresión generalizada del funcionamiento del SNC; sin embargo, múltiples regiones del encéfalo tienen una respuesta excitadora a la hipoxia, lo cual contribuye al aumento de la ventilación. Los quimiorreceptores periféricos se localizan en los cuerpos carotídeos inmediatamente encima de la bifurcación de las arterias carótidas comunes, y en los cuerpos aórticos por encima y por debajo del cayado aórtico; los cuerpos carotídeos son los más importantes en seres humanos. La variable más importante que determina la actividad de los cuerpos carotídeos son los cambios de la PaO2. Aunque los cuerpos carotídeos tienen una tasa metabólica relativamente alta, reciben un flujo muy elevado para su tamaño más bien pequeño. Mientras se mantenga un flujo sanguíneo normal, el oxígeno disuelto, que se refleja en la PaO2, es suficiente para su metabolismo. La estimulación de los cuerpos carotídeos, que causa un aumento de la ventilación, se produce cuando su aporte de oxígeno se reduce por debajo de sus necesidades metabólicas. Esto ocurre cuando existe disminución de la PaO2, disminución del flujo sanguíneo (gasto cardíaco bajo) o alteración de la utilización del oxígeno (intoxicación por cianuro). En la anemia, la intoxicación por monóxido de carbono y la metahemoglobinemia los cuerpos carotídeos no son estimulados siempre que no haya reducción de la PaO2 y el gasto cardíaco. La relación de la PaO2 con la estimulación de los cuerpos carotídeos no es lineal (fig. 365-13). Los cuerpos carotídeos se activan con una PaO2 <500 mmHg. Este hecho se confirma por la observación de que existe una [(Figura_3)TD$IG] DETECTORES Diferentes receptores del cuerpo son responsables de detectar la información aferente que modula la actividad del controlador respiratorio central. Estos receptores son terminaciones nerviosas sensitivas que responden a los cambios de su entorno. Se denominan quimiorreceptores o mecanorreceptores, dependiendo del tipo de estímulo que detecten. Los quimiorreceptores se clasifican en centrales y periféricos, según su localización. Los quimiorreceptores centrales se denominan así debido a su localización en el SNC. Los quimiorreceptores detectan cambios de la composición química del líquido corporal al que están expuestos. Los quimiorreceptores centrales se localizan en un área amplia que comprende el hipotálamo posterior, el cerebelo, el locus cerúleo, el rafe y múltiples núcleos del tronco encefálico. Estos quimiorreceptores están bañados por el líquido extracelular del encéfalo y responden a cambios de la concentración de H+. La información que detecta un Figura 365-13 Se produce estimulación significativa de los cuerpos carotídeos con un nivel de PaO2 <100 mmHg. Sin embargo, no se produce sensación subjetiva de disnea hasta que la PaO2 es <50 mmHg, punto a partir del cual aumenta exponencialmente la estimulación de los cuerpos carotídeos. e365-16 & Parte XIX El aparato respiratorio reducción pequeña pero evidente de la ventilación cuando respiran oxígeno al 100% individuos normales cuando la PaO2 supera los 500 mmHg. Hasta que la PaO2 alcanza los 100 mmHg se produce un aumento relativamente pequeño de la ventilación. Cuando la PaO2 es <100 mmHg la estimulación del cuerpo carotídeo aumenta de forma significativa. La velocidad de respuesta del receptor del cuerpo carotídeo es lo suficientemente rápida como para alterar su frecuencia de descarga durante el ciclo respiratorio como consecuencia de pequeños cambios cíclicos en la PaO2 durante la inspiración y la espiración. A niveles de PaO2 <50 mmHg la estimulación del cuerpo carotídeo aumenta de forma exponencial. El efecto más importante de la estimulación del cuerpo carotídeo es un aumento de la frecuencia respiratoria y del Vc. Los efectos adicionales comprenden vasoconstricción, bradicardia, hipertensión sistémica, liberación de hormona antidiurética y estimulación de la médula y la corteza suprarrenales. El efecto bradicárdico de la estimulación del cuerpo carotídeo es eclipsado por el reflejo pulmonar, que es inducido por la insuflación pulmonar y produce taquicardia. Los pacientes en los que se evita la insuflación pulmonar tienen más probabilidad de tener bradicardia tras la estimulación hipóxica de los cuerpos carotídeos. Ejemplos de estas situaciones son la hipoxia fetal, la depresión del SNC, el bloqueo neuromuscular, la miopatía, la neuropatía y la ventilación controlada. Los quimiorreceptores periféricos son responsables de casi todo el incremento de la ventilación que se produce en respuesta a la hipoxemia. Los quimiorreceptores periféricos también son estimulados por un aumento de la PaCO2; esta respuesta requiere un cambio relativamente importante de la PaCO2 y produce un aumento más pequeño de la ventilación minuto que el efecto de la CO2 sobre los quimiorreceptores centrales. Sin embargo, los quimiorreceptores periféricos responden mucho más rápidamente (en 1 s), mientras que los quimiorreceptores centrales pueden tardar minutos en responder. Por tanto, los quimiorreceptores periféricos son importantes en el aumento inmediato en la ventilación en respuesta a un incremento importante y brusco de la PaCO2. La disminución del pH también estimula los quimiorreceptores periféricos. El efecto del pH es independiente de que la acidosis se deba a causas respiratorias o metabólicas. La disminución de la PaO2, el aumento de la PaCO2 y la reducción del pH actúan de forma sinérgica sobre los cuerpos carotídeos. El efecto combinado es superior a la suma de sus acciones individuales. A diferencia de los quimiorreceptores centrales, los quimiorreceptores periféricos no se deprimen fácilmente, como por la anestesia o los opiáceos. Tampoco se adaptan fácilmente a un estímulo persistente como la hipoxia, como los quimiorreceptores centrales con la hipercapnia. Los quimiorreceptores centrales en los pacientes hipóxicos son relativamente menos sensibles al CO2 en un momento en el que las respiraciones están estimuladas de forma predominante por los efectos de la hipoxia sobre los quimiorreceptores periféricos. RECEPTORES PULMONARES Los receptores de estiramiento se sitúan en el músculo liso de las vías respiratorias. Son estimulados por la hiperinsuflación, y el impulso es conducido por el nervio vago. El principal efecto de estos receptores es disminuir la frecuencia respiratoria debido a una inhibición de la actividad de los músculos inspiratorios y un aumento del tiempo espiratorio. Este reflejo se denomina reflejo de inflado de HeringBreuer. El reflejo de desinflado de Hering-Breuer estimula la actividad de los músculos inspiratorios en respuesta al desinflado del pulmón. Estos reflejos no actúan durante la respiración normal en los adultos, pero pueden ser importantes en recién nacidos. Los receptores de estiramiento desempeñan una función importante en la minimización de la energía requerida para el TR en las enfermedades respiratorias. En las enfermedades en las que aumenta la resistencia de las vías respiratorias (asma) se requiere más energía para superar esa resistencia. La respiración lenta y profunda es más rentable en esta situación debido a la tasa de flujo relativamente menor, y es posible una mayor insuflación alveolar sin estiramiento del músculo liso de la vía respiratoria en fases más tempranas de la inspiración. Cuando hay una alteración de la distensibilidad (edema pulmonar) la respiración rápida y superficial es más rentable para mantener el Telást al mínimo. Debido a que en dichas situaciones los alveolos son más rígidos, la presión transpulmonar se transmite al músculo liso de las vías respiratorias en fases más tempranas de la inspiración, lo cual estimula los receptores de estiramiento para interrumpir la inspiración. Los receptores de irritación están entre las células epiteliales de la membrana mucosa de la vía respiratoria. Son estimulados por sustancias en forma de partículas, gases nocivos y humos químicos en el gas inspirado, y también por el aire frío. El nervio vago es el responsable de conducir el impulso. La estimulación de los receptores de irritación produce broncoconstricción e hiperpnea. Los receptores J deben su nombre a su localización yuxtacapilar (en inglés, juxta-capillary). Se sitúan en las paredes alveolares cerca de los capilares pulmonares. La ingurgitación de los capilares pulmonares y el edema intersticial y de la pared alveolar proporcionan estímulos para la activación de los receptores J, lo cual produce respiraciones superficiales y rápidas y disnea. Esto se observa en la insuficiencia cardíaca izquierda, el SDRA y las enfermedades intersticiales. Los receptores musculares importantes para la regulación de la respiración son aquéllos situados en el diafragma y los músculos intercostales. El estiramiento del músculo detectado por el huso muscular se utiliza para controlar la fuerza de la contracción. Una distorsión excesiva del diafragma y los músculos intercostales inhibe la actividad inspiratoria cuando se requiere una presión intratorácica negativa importante para desplazar el aire, como en la obstrucción de la vía respiratoria. La pared torácica blanda de los recién nacidos y los lactantes pequeños es más susceptible a la distorsión; dichos niños pueden responder a la obstrucción de la vía respiratoria superior con detención prematura de la inspiración y apnea, más que con prolongación de la inspiración requerida para desplazar el aire suficiente a través de la obstrucción. Los barorreceptores arteriales situados en el cayado aórtico y en los senos carotídeos pueden influir sobre la respiración en función de la presión arterial. Una disminución de la presión arterial produce hiperventilación, y un aumento de la presión arterial hipoventilación. Los receptores de dolor y temperatura también influyen sobre la respiración, y su efecto es especialmente pronunciado en recién nacidos y lactantes pequeños. Un estímulo doloroso produce interrupción de la respiración seguida de hiperventilación. El aumento de la temperatura corporal causa hiperventilación, y la hipotermia produce hipoventilación. Cuando hay un estímulo frío el área facial es la que causa apnea de forma más importante. EFECTORES Los efectores más importantes de la respiración son el diafragma, los músculos intercostales y los músculos abdominales. Reciben impulsos del controlador y efectúan la ventilación. Los efectores accesorios, como los músculos esternocleidomastoideos y paravertebrales, pueden ser reclutados para una contribución adicional a los esfuerzos respiratorios en caso de necesidad. Los efectores pueden verse seriamente alterados en la malnutrición, la lesión medular y las enfermedades neuromusculares. ESTADOS DE SUEÑO La regulación respiratoria está considerablemente influida por el sueño. Éste, en general, disminuye la quimiosensibilidad central al CO2. La PaCO2 está aumentada en unos pocos mmHg en comparación con la del estado de vigilia. Existen dos categorías fundamentales de estados de sueño: el sueño sin movimientos oculares rápidos (no REM) y el que presenta los movimientos oculares rápidos (REM) (cap. 17). El sueño no REM se caracteriza por las ondas lentas de alto voltaje en el electroencefalograma (EEG) y se asocia a actividad mental fragmentada. El tono muscular y los movimientos están relativamente poco afectados. El sueño no Capítulo 365 Fisiopatología y regulación respiratoria & e365-17 REM sería similar a «un cerebro relativamente inactivo en un cuerpo móvil». El sueño REM se denomina así por la presencia de ráfagas episódicas de movimientos oculares rápidos. El aspecto clínicamente más significativo del sueño REM es la importante supresión del tono muscular postural y la ausencia de movimientos espontáneos. El sueño REM sería similar a «un cerebro muy activado en un cuerpo paralizado». Los axones que descienden de la región tegmentaria de la parte dorsal de la protuberancia son los responsables de la atonía y la parálisis específicas del sueño REM. El patrón predominante del sueño de los lactantes prematuros es el sueño REM. Un recién nacido a término presenta un 50% de sueño REM. La mayoría de la maduración del sueño se produce en los primeros 6 meses de vida. Los niños mayores y los adultos pasan alrededor del 20% de su sueño en sueño REM. Las alteraciones respiratorias relacionadas con el sueño se producen predominantemente en el sueño REM. La depresión del tono muscular durante el sueño REM tiene dos efectos fundamentales. La pared torácica relajada y, por tanto, cada vez más distensible, se retrae mucho más hacia el interior durante la inspiración que una pared torácica menos distensible, lo cual produce un impedimento a la entrada de aire y un patrón de respiración paradójica (en balancín), en la que el abdomen y la pared torácica se mueven de forma asincrónica. El segundo efecto es la relajación de los músculos geniogloso, palatinos y otros de la vía respiratoria superior, lo cual produce obstrucción de la vía respiratoria. Las alteraciones relacionadas con el sueño REM se encuentran frecuentemente en lactantes prematuros y en niños con obstrucción anatómica de las vías respiratorias, obesidad y disfunción neuromuscular coexistentes. REGULACIÓN DE LA RESPIRACIÓN EN SITUACIONES ESPECIALES © ELSEVIER. Fotocopiar sin autorización es un delito. Fetos, recién nacidos y lactantes pequeños En las distintas fases del desarrollo la respuesta a la estimulación de los quimiorreceptores y los mecanorreceptores es muy diferente. A diferencia de los adultos, que muestran una respuesta inmediata y mantenida a la hipoxemia caracterizada por hiperventilación, el recién nacido muestra una respuesta bifásica. Tras un breve período inicial (1-2 minutos) de hiperventilación, el recién nacido y el lactante pequeño presentan hipoventilación y apnea si se mantiene la hipoxia. Esto explica por qué dichos lactantes tienen mayor tendencia a presentar una parada respiratoria en estados de hipoxia que los niños mayores y los adultos. Una menor edad gestacional del lactante se asocia a una respuesta apneica más precoz y pronunciada a la hipoxemia. Por ejemplo, la actividad respiratoria fetal se desconecta cuando hay privación de oxígeno. La maduración de los quimiorreceptores carotídeos puede ser una explicación de las diferencias de la respuesta hipóxica en varias fases del desarrollo. La sensibilidad de los detectores de CO2 también experimenta un proceso de maduración. Los recién nacidos y los lactantes pequeños tienen menor capacidad de respuesta al CO2 que los adultos y los niños mayores, según se mide por un aumento en la ventilación alveolar minuto para un determinado aumento de la PaCO2. La teofilina y la cafeína aumentan la respuesta ventilatoria de los quimiorreceptores centrales al CO2 y disminuyen el número de episodios apneicos en lactantes prematuros. Los músculos respiratorios neonatales están poco equipados para mantener cargas de trabajo elevadas; se fatigan más fácilmente que en los niños mayores, y esto limita su capacidad para mantener una ventilación adecuada en la enfermedad pulmonar. Además, la retracción interna excesiva de la pared torácica del lactante, que es relativamente blanda, estimula los receptores de estiramiento de los músculos intercostales, los cuales envían impulsos inhibidores al centro respiratorio. Los lactantes pequeños tienen, por tanto, mayor riesgo de presentar apnea cuando los músculos respiratorios están sometidos a grandes cargas elásticas, como en la obstrucción de la vía respiratoria superior. Muchos neurotransmisores que participan en la regulación de la respiración también experimentan cambios madurativos durante el desarrollo. Las neuronas serotoninérgicas situadas en los núcleos del rafe poseen propiedades quimiosensibles y responden a una disminución del pH. Un aumento de la población de estas neuronas se asocia a incremento de la quimiosensibilidad en el animal en desarrollo. En la autopsia de niños que mueren por síndrome de muerte súbita del lactante (SMSL; cap. 367) se observan alteraciones del núcleo arqueado, el equivalente humano del rafe bulbar de la rata y el gato. Estudios de cohortes de víctimas japonesas, afroamericanas y de raza blanca del SMSL han implicado a un gen homocigoto que codifica el alelo largo del promotor del transportador de la serotonina. En comparación con los testigos, las víctimas del SMSL tienen más probabilidad de expresar el alelo largo del promotor del transportador de la serotonina y de perder el alelo corto. El retraso en el desarrollo de las neuronas serotoninérgicas o la expresión excesiva del alelo largo del promotor del transportador de la serotonina pueden explicar la respuesta respiratoria anómala en situaciones adversas, lo cual causa SMSL. La quimiorrecepción central también está muy alterada en el síndrome de hipoventilación central congénito (SHCC), también conocido como maldición de Ondina, que produce paradas respiratorias asociadas al sueño. Se ha demostrado que mutaciones del gen PHOX2B localizado en el cromosoma 4 producen SHCC. Hipoxia e hipercapnia crónicas El mecanismo del control respiratorio se altera cuando se expone a enfermedades crónicas. En los pacientes con insuficiencia pulmonar crónica con PaCO2 elevada, el pH del LCR se ha normalizado y los quimiorreceptores centrales dejan de responder al CO2. La compensación renal produce retención de bicarbonato y normalización relativa del pH sanguíneo. La hipoxemia arterial sigue siendo el estímulo clave para la ventilación, la cual depende predominantemente de la estimulación de los quimiorreceptores periféricos por una PaO2 baja. La administración de una cantidad de oxígeno elevada en estos pacientes conlleva un riesgo de eliminación brusca del estímulo hipóxico, interrupción de la respiración, empeoramiento de la hipercapnia y narcosis por CO2, y coma. Los pacientes con EPOC y enfermedades neuromusculares son especialmente sensibles a esta complicación. Los niños con displasia broncopulmonar o distrofia muscular que han tenido PaCO2 elevada, con o sin oxígeno suplementario, pueden presentar hipoventilación y acidosis respiratoria cuando su PaO2 está aumentada en mayor medida que su valor basal por la administración de una cantidad elevada de oxígeno. Los pacientes con hipoxia crónica, como aquellos que viven a grandes altitudes y los que tienen una cardiopatía congénita cianótica o una neumopatía intersticial, tienen amortiguación del funcionamiento de los quimiorreceptores y una escasa respuesta a la hipoxemia adicional. Es interesante para el pediatra que los niños con asma mal controlada también tienen una respuesta hipóxica amortiguada y puede parecer que respiran relativamente cómodos a pesar de tener una PaO2 peligrosamente baja. Dichos niños y sus cuidadores tienen riesgo de no apreciar la gravedad de su enfermedad, lo cual puede causar un retraso en el tratamiento adecuado. BIBLIOGRAFÍA Abu-Shaweesh JM: Maturation of respiratory responses in the fetus and neonate, Semin Neonatol 9:169-180, 2004. Bush A: Update in pediatric lung disease 2006, Am J Respir Crit Care Med 175(6):532-540, 2007. Carskadon MA, Dement WC: Normal human sleep: an overview. In Kryger MH, Roth T, Dement WC, editors: Principles and practice of sleep medicine, ed 3, Philadelphia, 2000, WB Saunders, pp 15-25. Chokroverty S: Physiology of sleep. In Chokroverty S, Daroff RB, editors: Sleep disorders medicine: basic science, technical considerations, and clinical aspects, ed 2, Boston, 1999, Butterworth-Heinemann, pp 95-126. Feldman JL, Mitchell GS, Nattie EE: Breathing: rhythmicity, plasticity, chemosensitivity, Annu Rev Neurosci 26:239-266, 2003. Gozal D: New concepts in abnormalities of respiratory control in children, Curr Opin Pediatr 19:305-308, 2004. e365-18 & Parte XIX El aparato respiratorio Polgar G, Weng T: The functional development of the respiratory system from the period of gestation to adulthood, Am Rev Respir Dis 120:625-695, 1979. Polla B, D’Antona G, Bottinelli R, et al: Respiratory muscle fibres: specialisation and plasticity, Thorax 59:808-817, 2004. Smith JC, Ellenberger HH, Ballanyi K, et al: Pre-Botzinger complex: a brain stem region that may generate respiratory rhythm in mammals, Science 254:726-729, 1991. Weese-Mayer DE, Berry-Kravis EM, Ceccherine I, et al: Congenital central hypoventilation syndrome (CCHS) and sudden infant death syndrome (SIDS): kindred disorders of autonomic regulation, Respir Physiol Neurobiol 164(1-2):38-48, 2008. West JB: Respiratory physiology: the essentials, ed 7, Baltimore, 2005, Lippincott Williams and Wilkins.