UNIDAD I. INTRODUCCIÓN A LA QUÍMICA
Anuncio

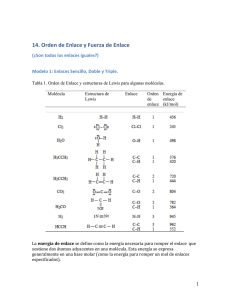
Química Orgánica UNIDAD I. INTRODUCCIÓN A LA QUÍMICA ORGÁNICA. Tema 3. Formulas estructurales y condensadas. I.1 Objetivo de aprendizaje: SABER: Definir el concepto de fórmula estructural y condensada en base al modelo de Lewis. SABER HACER: Modelar la estructura tridimensional de un compuesto orgánico a partir de su fórmula condensada. Formulas. En química orgánica se utilizan tres tipos de fórmulas para representar las moléculas: las condensadas, semidesarrolladas y las desarrolladas; cada una puede representar el mismo compuesto pero con diferente nivel de especificidad. Formulas condensadas. Indican el total de átomos presentes en una molécula, solo se muestran los subíndices de los elementos principales y como subíndices la cantidad total de átomos; para el caso del etano la fórmula C2H6. Fórmulas desarrolladas. Indican en el plano la estructura de la molécula indicando todos sus enlaces; en el mismo caso del etano la formula desarrollada queda de la siguiente forma: Cada carbono debe tener 4 enlaces (es tetravalente), si su hibridación es sp3 tiene 4 enlaces simples, si tiene una hibridación sp2 dos enlaces simples y uno doble; si su hibridación es sp tendrá un enlace simple y uno triple. Las posibilidades son las siguientes: Los hidrógenos y los halógenos siempre se unen con un enlace simple (H, F, Cl, Br y I). Su representación queda: Si existe oxígeno en una molécula se forman dos enlaces (el oxígeno es divalente) ya sean dos enlaces dobles o uno simple. El nitrógeno es capaz de formar tres enlaces (es trivalente) ya sea uno triple, uno doble y uno simple o tres simples. Cuando se escriben fórmulas condensadas (donde no se especifican los enlaces) y se intenta escribir la fórmula desarrollada, donde se deben describir los enlaces; pueden existir diferentes combinaciones de enlaces; por lo cual una misma fórmula condensada puede representar más de una sustancia, en especial para moléculas de muchos átomos. Por ejemplo; para la ecuación C3H8 la forma desarrollada queda: Formulas semidesarrolladas. Muestra únicamente los enlaces entre los átomos distintos del hidrógeno; para el caso del etileno queda: Elaboró: Ing. Marcel Ruiz Martínez 1 Química Orgánica Pero no es el mismo caso de la sustancia C3H6 como podrá notarse la diferencia con respecto a la sustancia anterior es que tiene dos hidrógenos menos, los cuales pueden liberarse de distintas posiciones de la molécula: En caso de la molécula C3H4 pueden existir las siguientes opciones, por lo cual ahora tenemos dos moléculas desarrolladas que cumplen con la misma fórmula condensada. Estructuras de Lewis. Son representaciones bidimensionales sencillas del esqueleto o conectividad de los átomos en una molécula, muestra la posición de los electrones enlazantes y no enlazantes. Tienen como finalidad explicar el enlace covalente mediante la compartición de uno o más pares de electrones entre dos átomos con el objeto de cerrar capa y conseguir así la máxima estabilidad. Las reglas para crear una estructura de Lewis son: 1. Elegir el átomo central. En los compuestos orgánicos siempre es el C (excepto en los éteres). En las fórmulas semidesarrolladas no es necesario escribir los enlaces de cada carbono con los hidrógenos; por lo cual las formulas anteriores pueden escribirse como: 2. Alrededor del átomo central se sitúan los demás (ligandos) de la forma más simétrica posible. A continuación se muestran algunos ejemplos: Ejercicio en clase: convertir la formula C5H12 en desarrollada y semidesarrollada. Elaboró: Ing. Marcel Ruiz Martínez 2 Química Orgánica 3. Ahora los elementos se pueden representar de la siguiente forma según al grupo que pertenecen en la tabla periódica: Actividad 1.3. Estructura de Lewis. Escriba la estructura de Lewis para los siguientes compuestos: 1. 2. 3. 4. 5. 6. 7. 8. NH3 CH3CH3 CH3NH2 CH3CCl3 CO2 H2CO2 CH3CH3Cl N2 Realiza una PRÁCTICA DE EJERCICIOS, las rubricas de dicho producto se puede consultar en la siguiente liga: http://marcelrzm.comxa.com/Rubricas/Rubricas.htm Ejercicio en clase: Usando una tabla periódica escriba la estructura de Lewis de: 1.- CCl4 2.- COCl2 3.- ONF 4.- NF3 5.- SCl2 6.- AsH3 7.- SnCl2 8.-CH4 Elaboró: Ing. Marcel Ruiz Martínez Enviar el trabajo a los siguientes correos: [email protected]; [email protected]; [email protected]; [email protected] También enviar copia del correo a sus compañeros de equipo y a usted mismo. Colocar en ASUNTO: “1.3 Estructura de Lewis” 3