14. Orden de Enlace y Fuerza de Enlace
Anuncio
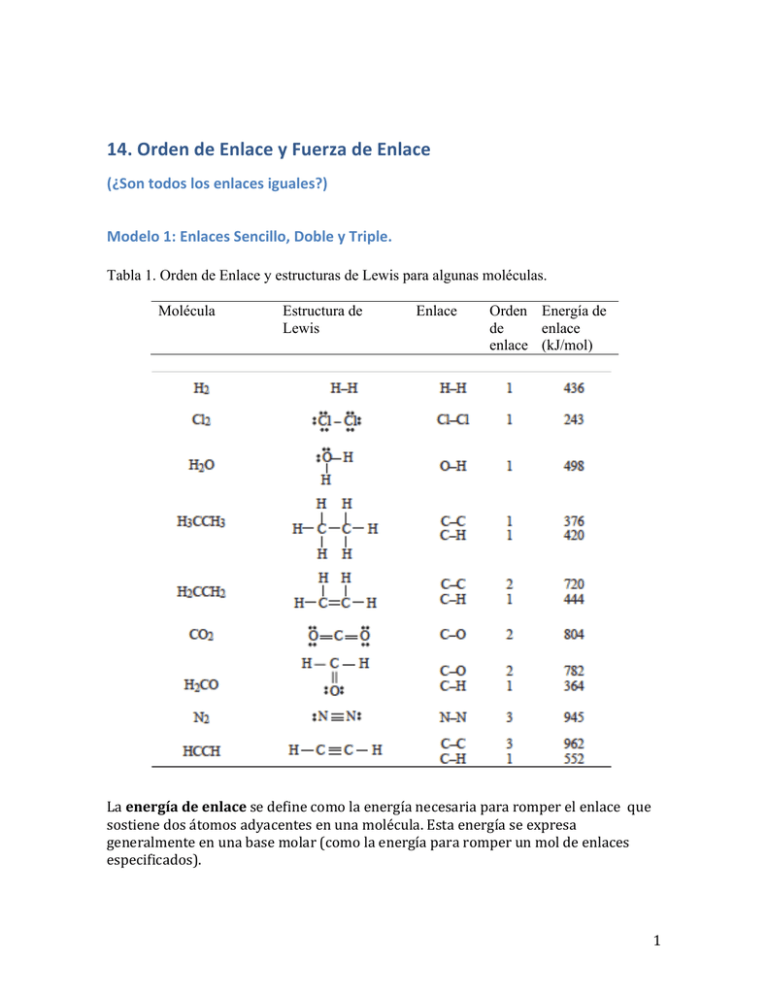
14. Orden de Enlace y Fuerza de Enlace (¿Son todos los enlaces iguales?) Modelo 1: Enlaces Sencillo, Doble y Triple. Tabla 1. Orden de Enlace y estructuras de Lewis para algunas moléculas. Molécula Estructura de Lewis Enlace Orden Energía de de enlace enlace (kJ/mol) La energía de enlace se define como la energía necesaria para romper el enlace que sostiene dos átomos adyacentes en una molécula. Esta energía se expresa generalmente en una base molar (como la energía para romper un mol de enlaces especificados). 1 Preguntas de Pensamiento Crítico 1. Verifica (usando tu lista de comprobación) que la estructura de Lewis para H2CCH2 en la Tabla 1 es correcta. 2. El título de Modelo 1 identifica tres tipos de enlaces. Da dos ejemplos de cada tipo de enlace en las moléculas en la Tabla 1. 3. ¿Cuál es la relación entre el orden de enlace en un enlace y la designación de enlaces simples, dobles y triples? 4. ¿Cuál es la relación entre el orden de enlace y el número de electrones compartido por dos átomos adyacentes? 5. Clasifica los tres tipos de enlaces del Modelo 1 en orden de incremento de energía. 2 Modelo 2: Orden de Enlace y Energías de Enlace para algunas Moléculas. Molécula Estructura de Lewis Enlace Orden Energía de de enlace enlace (kJ/mol) 3 Preguntas de Pensamiento Crítico 6. Considera la serie HF, HCl, HBr, HI. a. ¿Cuál es el orden de enlace para cada enlace H−X? b. ¿Qué tendencia se observa en la energía de enlace? c. Teniendo en cuenta el tamaño relativo de F, Cl, Br, e I, ¿qué tendencia puedes predecir para la longitud de enlace H−X? La longitud de enlace se define como la distancia entre los núcleos de dos átomos unidos. 7. Considera la serie Cl2, Br2, I2. a. ¿Cuál es el orden de enlace para cada enlace X−X? b. ¿Qué tendencia se observa en la energía de enlace? c. Teniendo en cuenta el tamaño relativo del Cl, Br, y del I, ¿qué tendencia predecirías para la longitud de enlace X−X? 8. ¿Cuál de las siguientes afirmaciones parece ser cierta considerando las PPCs 6 y 7? Explica. a. Entre mayor sea la longitud del enlace, más fuerte es el enlace. b. Entre menor sea la longitud del enlace, más fuerte es el enlace. 4 9. En el Modelo 2, a. ¿Cuál es el rango de energías de enlace para todos los enlaces sencillos? b. ¿Cuál es el rango de energías de enlace para todos los enlaces dobles? c. ¿Cuál es el rango de energías de enlace para todos los enlaces triples? 10. Con base en tus respuestas a las PPCs 6-­‐9 y los datos del Modelo 2, explica cómo se puede llegar a la siguiente conclusión: El factor más importante para determinar la energía de enlace es orden de enlace. Si los ordenes de enlace son iguales, mientras más corto sea el enlace más fuerte es el enlace. Ejercicios 1. ¿Cuál enlace C−C es más difícil de romper? 2 ¿Cuál enlace C−C es más difícil de romper? 3 ¿Cuál enlace C−N es más fuerte? 4 Utilizando oraciones gramaticalmente correctas en español, describe las relaciones entre orden de enlace, energía de enlace, y el número de electrones compartidos en un enlace. 5 5 El esqueleto de las estructuras (estructuras que indican la disposición de los átomos) para el formaldehido y el metanol se muestran a continuación: La siguiente aseveración es ¿verdadera o falsa? (explica tu respuesta) Se requiere de más energía para romper el enlace entre C y O en el formaldehido que romper el enlace entre C y O en el metanol. [sugerencia: dibuja la estructura de Lewis de cada molécula.] 6 Una regla empírica establece que se requieren alrededor de 300 kJ para romper un mol de enlaces sencillos. Predice energía de enlace en los enlaces dobles (en kJ/mol) basado en esta regla. Predice la energía de un triple enlace (en kJ/mol) basado en esta regla empírica. Compara tus predicciones con los valores en la Tabla 1 7 Considera moléculas del tipo donde X = F, Cl, Br, I. a) Sobre la base de radios atómicos, ¿cuál esperan que tenga el enlace más largo, C−F, C−Cl, C−Br, C−I? ¿Cuál espera tener la menor longitud de enlace? Explique tu razonamiento. b) ¿Cuál esperas que tenga el enlace más fuerte, C−F, C−Cl, C−Br, C−I? ¿Cuál esperas que tenga el enlace más débil? Explique tu razonamiento. 8 Para cada uno de los siguientes, que tiene el enlace más fuerte entre los dos átomos involucrados? Da una breve explicación. (Sugerencia: escribe la estructura de Lewis para cada molécula.) a) b) c) d) e) f) g) H3CH N2 H2PH HSH HSH H2PH F2 y y y y y y y H3SiH O2 HOH HOH HSeH H2NH O2 6 9 Ordena las moléculas N2, P2, As2, en orden del enlace más débil al más fuerte. 10 Indica si cada una de las siguientes afirmaciones es verdadera o falsa y explica tu razonamiento. a) Los enlaces en NH3 son más cortos que los enlaces en el NF3. b) Los enlaces en el CCl4 son más fuertes que los enlaces en el CBr4. c) El enlace carbono-­‐nitrógeno en H3CNH2 es más fácil de romper que el enlace carbono−nitrógeno en HCN. 11. Problemas de JN Spencer, GM Bodner, y LH Rickard, Química: Estructura y Dinámica, Cuarta Edición, John Wiley & Sons, 2008. Capítulo 4: Problemas: 47, 49, 120, 126. 47. Las longitudes de enlace nitrógeno-­‐nitrógeno en los siguientes compuestos son: N2, 0.110 nm, HNNH, 0.125 nm, H2NNH2 0.146 nm. En qué compuesto es el enlace nitrógeno-­‐nitrógeno más probablemente un enlace ¿sencillo? ¿doble? o ¿triple? 49. Si la longitud de enlace azufre–a-­‐oxígeno son similares en el SO2 y el SO3 ¿qué se puede decir del enlace entre el azufre y en oxígeno en estas moléculas? 120. ¿Qué elementos forman un compuesto con la siguiente estructura de Lewis? a) Be b) B c) C d) N e) O f) F 126. Escribe la estructura de Lewis para el ácido oxálico (H2C2O4),. Asume que la estructura del esqueleto de la molécula se puede escribir como HO2CCO2H. Problema 1. ¿Qué molécula o ion tiene el vínculo más fuerte entre los dos átomos: OH−; HS−; HF; HCl; HI? Explica. 7



