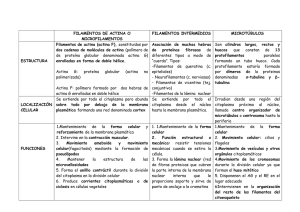
Microfilamentos Introducción En eucariontes, existen filamentos proteicos organizados que se extienden por todo el citoplasma : es el llamado citoesqueleto (cito, célula; esqueleto, soporte). Este organelo proporciona un soporte a los demás organelos y permite mantener la forma de la célula. Además de este papel estructural, el citoesqueleto es responsable no solo del movimiento de toda la célula sino del transporte interno de los organelos y de otras estructuras tales como los cromosomas. Es evidente que se requiere de moléculas energéticas para lograr estos movimientos, en algunos casos es el ATP en otros el GTP. Aunque su nombre pudiera sugerir una rigidez, realmente es una estructura muy dinámica que está en permanente modificación estructural. A excepción de los filamentos intermedios, esta característica se traduce en formación y desaparición de las estructuras. Se habla entonces de ensamble y desensamble para referirse a esta dinámica del citoesqueleto. El ejemplo más evidente es el ensamble de microtúbulos al comenzar la mitosis y su desensamble al finalizar. Y durante la mitosis, los microtúbulos se elongan y se acortan, otro ejemplo de su dinamismo. Prof. Iván Rebolledo El citoesqueleto está integrado por tres tipos de filamentos proteicos : microfilamentos, filamentos intermedios y microtúbulos. Este orden no es caprichoso, está determinado por sus dimensiones. Es así como : Microfilamentos ≈ 7 nm ∅ Filamentos intermedios ≈ 10 nm ∅ Microtúbulos ≈ 24 nm ∅ Es claro de los valores mostrados, la denominación de intermedios a un tipo de estas proteínas filamentosas. En términos generales los microfilamentos son estructuras proteicas, sólidas y alargadas. Los filamentos intermedios son fibras integradas por varias proteínas de estructura similar. Los microtúbulos son estructuras cilíndricas huecas cuya pared está conformada por la proteína llamada tubulina. Las funciones generales del citoesqueleto pueden resumirse en : ­mantener la forma de la célula ­posicionar los organelos en citosol ­movimiento intracelular de materia les y organelos ­movimiento de la célula ­transmisión de señales extracelulares al interior de la célula. Citoesqueleto MICROFILAMENTOS La principal proteína citoesquelética de muchas células es la actina, que se polimeriza para formar filamentos delgados, flexibles de ≈7 nm de Ø y hasta varios µm de largo. Ellos forman manojos o redes tridimensionales con propiedades del gel semisólido. Existe una variedad de proteínas unidas a la actina que permiten regular los procesos de ensamble y desensamble, sus enlaces en los manojos y sus asociaciones con otras estructuras (vesículas, por ejemplo). Ahora bien, vamos a explicar eso de los extremos + y –. Seguro que alguno quiso interpretar como extremos cargados positiva y negativamente. Nada más lejos. Se trata que el extremo más se alarga 5 a 10 veces más rápido que el extremo menos. Además, los monómeros de actina que se polimerizan poseen ATP y luego de ensamblarse en el filamento el ATP se hidroliza en ADP. Entonces las actinas que poseen ATP se polimerizan más fácilmente que los que poseen ADP. Extremo + Molécula de actina Actina G La molécula de actina es globular compuesta de 375 aminoácidos. Cada monómero de actina se llama actina globular (actina G). Posee 2 extremos opuestos que le permite interactuar con otros monómeros : un extremo + y otro –. Los monómeros llegan a unirse para formar filamentos (actina F). Cada monómero en el filamento está rotado 166º dando así una apariencia de hélice a todo el filamento. Considerando que todos los monómeros están orientados en la misma dirección, los filamentos también tienen una polaridad : un extremo + y otro –. (ver Figura ⇒⇒) Dímeros de Actina Trímeros de Actina Extremo – Actina F Citoesqueleto Considerando que la polimerización es reversible, los filamentos pueden despolimerizarse por disociación de subunidades de actina con ADP. Así, existe un aparente equilibrio entre los monómeros y los filamentos, que es dependiente de la concentración de monómeros libres. Este fenómeno se conoce como el molino, el cual ilustra el comportamiento dinámico de los filamentos de actina. Extremo – ADP ADP ADP ADP PO4 PO4 ATP ATP ATP ATP Extremo + Este proceso de molino pudiera reflejar el ensamble y desensamble dinámico de los filamentos de actina necesarios para que la célula pueda moverse o cambiar de forma. Es necesario mencionar algunas drogas que interfieren con la polimerización de los filamentos. Una de ellas es la citocalasina (1) que se une al extremo + e impide su elongación. Esto incide en cambios en la forma celular así como inhibición de algunos movimientos celulares. Otra droga es la faloidina (2) que se une fuertemente al extremo – e impide su disociación en monómeros de actina. Los casos mencionados son drogas exógenas que influyen sobre los microfilamentos de actina. Pero dentro de la célula existen proteínas que normalmente regulan el dinamismo de los filamentos de actina. La más abundante de ellas es la timosina, una molécula pequeña de ≈5 kd que impide el ensamble de filamentos secuestrando los monómeros. Otra proteína es la profilina que también se une a los monómeros de actina impidiendo la formación de filamentos. Ya que la profilina también se relaciona con fosfolípidos de membrana que tienen que ver con señales extracelulares, entonces puede hacer que el ADP de las actinas se intercambie por ATP y así se puedan unir al extremo + del filamento. (1) Citocalasina : alcaloide derivado de hongos de la especie aspergillus. (2) Faloidina : alcaloide derivado de la Amanita phalloides Citoesqueleto Filamentos de actina Los filamentos de actina se organizan en dos tipos generales de estructuras : manojos y redes. En los manojos, filamentos paralelos se encuentran empaquetados. En redes los filamentos forman una trama tridimensional. Estas disposiciones son logradas por participación de proteínas que unen los filamentos. a) Manojos : Los filamentos de actina se organizan paralelamente formando un grupo apretado de longitud variable. El caso mejor estudiado es el manojo de filamentos de actina existente en el interior de las microvellosidades, presentes en la superficie luminal de las células absortivas en el epitelio del intestino delgado. Micrografía electrónica que muestra cortes longitudinales de microvellosidades de una célula absortiva intestinal. Micrografía electrónica que muestra cortes transversales de las microvellosidades observadas en la micrografía anterior. Observe el manojo de filamentos de actina en el centro de cada microvellosidad. Ahora bien, vamos a explicar cómo es que se mantienen unidos estos filamentos. Existen unas proteínas denominadas proteínas atadoras de actina (ABP, por sus siglas en inglés de Actine-bundling proteins), son pequeñas y rígidas forzando a los filamentos de actina a disponerse en manojos o atados. Se destacan dos de ellas : la fimbrina y la vilina. La fimbrina es una proteína de 68 kd que contiene dos dominios de unión fuerte para dos filamentos de actina separados por 14 nm. La vilina es una proteína de 95 kd que hace la misma función que la anterior; es la más abundante en las células intestinales y renales. (Ver dibujo siguiente página). Citoesqueleto Extremo + Membrana plasmática Filamentos de actina Miosina I Fimbrina y villina Filamentos De actina ABD ABD Fimbrina Dibujos esquemáticos que muestran la disposición de los filamentos de actina dentro de las microvellosidades, con las moléculas que unen los filamentos. ABD, dominio atadura de actina. (b) Redes : Aquí los filamentos de actina se encuentran unidos por la proteína llamada filamina (ABP280) conformada por dos subunidades de 280 kd. Como se aprecia en la figura de la derecha, los dominios de dimerización y los de unión con actinas se encuentran en polos opuestos. Así esta proteína llega a ser flexible, permitiendo que los filamentos de actina lleguen a conformar una trama laxa tridimensional. Dominio lámina β Dominio de dimerización Dominio de unión actina Filamentos de actina Citoesqueleto Molécula ABD Filamentos de actina en la membrana plasmática Los glóbulos rojos (eritrocitos o hematíes) son estructuras muy útiles cuando se necesita examinar la membrana sin contaminantes de otras membranas, pues carecen de núcleo u otros organelos membranosos; además, carecen de otros componentes del citoesqueleto lo que deja al citoesqueleto cortical como único componente determinante de su forma bicóncava. Cadena alfa (α) Cadena beta (β) Cadena beta (β) Cadena alfa (α) Micrografía electrónica de barrido que muestra eritrocitos con su forma bicóncava. La principal proteína que proporciona la base estructural del citoesqueleto cortical es la espectrina. Esta proteína se presenta como un tetrámero conformado por dos cadenas polipeptídicas llamadas α (240 kd) y β (220 kd). La cadena β posee en su amino terminal una molécula de ABD. Esta disposición dimérica se asocia con otra igual pero al revés (Ver la figura anexa) Molécula ABD Los extremos de este tetrámero se asocian con filamentos de actina resultando en una trama espectrinaactina que constituye el citoesqueleto del eritrocito. Pero esta trama está unida a proteínas de la membrana plasmática, ¿cómo lo hace? Siga leyendo. Citoesqueleto Cabe destacar aquí que a semejanza de las proteínas banda 3 y ancrina, existen otras proteínas que unen filamentos de actina a la membrana. Así el caso de la distrofina (427 kd), que une filamentos de actina a una proteína de la membrana de células musculares. Los filamentos de actina contienen en toda su longitud una proteína fibrosa llamada tropomiosina. En uno de sus extremos se ubica otra proteína llamada banda 4.1, que le permite tomar contacto con una proteína de la membrana llamada glucoforina. Además, la banda 4.1 sirve de proteína enlace a un extremo de la espectrina y a la aducina, con el filamento de actina. La ausencia o anormalidad de esta proteína conduce a un cuadro clínico denominado distrofia muscular de Duchenne. Esta enfermedad se caracteriza por pérdida progresiva de la musculatura estriada que conduce a la muerte en etapas tempranas de la vida. El gen de la proteína se encuentra en el cromosoma X, lo que hace a los varones más susceptibles de adquirir esta enfermedad. Además, en el centro de la molécula de espectrina se ubica una proteína denominada ancrina que sirve de unión con otra proteína de membrana llamada banda 3. De esta forma, la espectrina llega a unirse a dos proteínas de membrana y constituye así una trama bien conectada que actúa como un citoesqueleto (ver Dibujos abajo) Actina glucoforina Banda 3 Tropomiosina Ancrina Aducina espectrina Citoesqueleto Miosina Los filamentos de actina se asocian con la miosina para realizar muchos tipos de movimientos. La miosina es una proteína muy especial: denominada el motor molecular, debido a que es capaz de convertir la energía química (ATP) en energía mecánica (movimiento). La asociación más notable ocurre en las fibras musculares por su disposición altamente ordenada, en la unidad muscular denominada sarcómera. Las células musculares están especializadas para la contracción. En los vertebrados hay tres tipos de fibras musculares : músculo esquelético, responsable de los movimientos voluntarios; músculo cardíaco, que bombea sangre; músculo liso, para los movimientos involuntarios. Utilizando análisis genómico, se han identificado 13 miembros de la familia de la miosina. Las más abundantes son la miosina I y II, que se encuentran presentes en casi todas las células eucarióticas. La miosina II interviene en la contracción muscular y la citocinesis, mientras que la miosina I y la V intervienen en las interacciones del citoesqueleto de la membrana. “cabeza” región globular Cadena liviana Cadena pesada “cola” α hélice Dibujo de una molécula de Miosina II, con sus cadenas pesadas y livianas. La miosina II es una molécula grande (≈ 500 kd) compuesta de dos cadenas pesadas (≈ 200 kd c/u) y cuatro cadenas livianas (≈20 kd c/u). Cada cadena pesada posee una región globular (“cabeza”) y una región alargada α-hélice (“cola”). Un par de cadenas livianas por cada región globular completan la molécula de miosina II. Ahora que ya tenemos caracterizados a los dos protagonistas de la contracción muscular, la actina y la miosina, explicaremos algo de la sarcómera. Primero, debemos mencionar que los músculos están conformados por manojos de células largas llamadas fibras musculares. Luego, que cada una de ellas posee varios núcleos periféricos y muchas miofibrillas centrales. Por último, las miofibrillas son manojos de filamentos de actina y miosina organizados en cadenas de unidades repetidas. (ver microfotografía en siguiente página) Citoesqueleto Núcleo Micrografía electrónica de transmisión mostrando la extensión de una sarcómera, de la banda A y de la banda I. Las líneas negras verticales que cursan por el centro de la banda I es la línea Z. Micrografía electrónica de barrido mostrando los microfilamentos relacionados con la línea Z. Las tres flechas negras muestran las relaciones estructurales de la actina con la miosina La sarcómera mide ≈2,3 µm de largo y se extienden de una línea Z a la siguiente. Observando la primera micrografía, se deduce que una sarcómera está integrada por una banda A (anisotrópica) y dos ½ bandas I (isotrópica). Observando ahora la micrografía de abajo, nos damos cuenta que los puentes entre los filamentos se encuentran sólo en la banda A. Deducimos que en esta banda A están presente los dos tipos de filamentos: actina y miosina; mientras que en la banda I sólo se encuentra un tipo de filamentos: actina. Citoesqueleto Línea Z actina nebulina miosina titina Línea M Dibujo esquemático de una sarcómera.Las moléculas de titina se extienden desde la línea Z hasta la lInea M sosteniendo los filamentos de miosina. Las molécula de nebulina se extienden desde la línea Z reteniendo los filamentos de actina. Los filamentos de actina y de miosina se encuentra sujetos a la proteína de la línea Z. La nebulina es la proteína que une los filamentos de actina a la línea Z y la titina hace lo mismo con los filamentos de miosina. La línea Z está compuesta por una proteína llamada α-actinina. Línea Z Ya desde 1954, cuando dos investigadores de apellido Huxley, quienes propusieron el modelo de deslizamiento de los filamentos, se postula que durante la contracción muscular las sarcómeras se acortan, haciendo que las líneas Z se acerquen hacia la línea M. actina miosina Línea M Deslizamiento del filamento contracción Citoesqueleto Línea Z Extremo + actina “Cabezas” de miosina Extremo – Filamento grueso de miosina Línea M Extremo – Extremo + Dibujo esquemático de una sarcómera, mostrando las relaciones entre las “cabezas” de la miosina y las actinas. Observe la disposición de las moléculas de miosina a partir de la línea M. El extremo + de los filamentos de actina se encuentra junto a la línea Z. En la contracción muscular, las “cabezas” de la miosina se mueven en dirección de los extremos + de los filamentos de actina. Estos movimientos hacen que los filamentos de actina se deslicen hacia la línea M, es decir, ocurre un acortamiento de la longitud de la sarcómera. Ahora veremos qué ocurre a nivel molecular. El ciclo de la contracción muscular comienza con la miosina, que en ausencia de ATP está fuertemente unida a una actina. El aporte de ATP a la “cabeza” de la miosina la separa de la actina. La hidrólisis del ATP provoca cambios de conformación en la “cabeza” de la miosina que parece desplazarse en una dimensión de 10 nm, quedando frente a la siguiente actina. La eliminación del PO4 hace que la cabeza se una a dicha actina. La eliminación del ADP hace que la “cabeza” adquiera su posición normal y con esto el filamento de actina se ve obligado a desplazarse. Usaremos unos esquemas para mostrar este ciclo de la contracción. Filamento de actina A “cabeza” miosina ATP B ATP Filamento de miosina En la parte A, se muestra a la “cabeza” de la miosina unida a una actina. Al adquirir un ATP, se separa de dicha actina, como se muestra en la parte B. Citoesqueleto C P La hidrólisis del ATP en la “cabeza” de la miosina provoca un cambio conformacional que resulta en un cambio de posición: ahora queda frente a la siguiente actina. Este cambio hace que el PO4 se libere, quedando en la “cabeza” el ADP (ver figura C). D ADP Deslizamiento del filamento ADP E La “cabeza” de la miosina retorna a su posición original En la figura D, se muestra que la “cabeza” de la miosina al poseer ADP se une a la nueva actina y en la figura E, se observa que al liberarse el ADP, la “cabeza” vuelve a su posición inicial, con lo cual desliza el filamento de actina en unos 10 nm. Pero queda una pregunta importante, ¿cuál molécula inicia la contracción a nivel muscular? Para responder esta pregunta debemos mencionar que la célula muscular posee un retículo endoplásmico especial llamado sarcoplásmico. Este retículo es capaz de almacenar grandes cantidades de iones Ca+2. La liberación de iones Ca+2 desde el retículo hacia el citosol provoca la contracción muscular mediante la acción de dos proteínas unidas al filamento de actina: la tropomiosina y la troponina. La tropomiosina es una proteína fibrosa que se une a lo largo de un surco del filamento de actina. Su longitud es equivalente a siete actinas. Ellas se unen cabeza con cola, en tal manera que forman una larga proteína de longitud igual al filamento de actina. La troponina es una proteína compleja formada por tres cadenas polipeptídicas: TnC, troponina que une calcio; TnI, troponina inhibitoria y TnT, troponina que se une a la tropomiosina. Citoesqueleto Como podrá ver en los dibujos de abajo, de un corte transversal de un filamento de actina, la tropomiosina está cubriendo el dominio de la actina que permite unir a la “cabeza” de la miosina. Además, podrá ver que la adición del ión Ca+2 a la troponina C, provoca el desplazamiento de las restantes moléculas dejando al descubierto, en la actina, el sitio de unión para la miosina. Con esto, se produce el ciclo de la contracción explicado anteriormente. tropomiosina actina Pero, queda otra pregunta: ¿cómo se libera el ión Ca+2 del retículo sarcoplásmico? y ¿cuál es el estímulo que provoca dicha liberación?. Debemos recordar que el impulso nervioso es una despolarización de la membrana de las células nerviosas. También debemos recordar que las terminaciones nerviosas pueden llegar a músculos y glándulas. Estas terminaciones nerviosas se llaman botones sinápticos. De ellos se liberan los neurotransmisores que llegan a tomar contacto con la membrana de las células musculares, provocando una despolarización. Este fenómeno se transmite por toda la membrana de la célula muscular, introduciéndose por los tubos T hacia el interior de las microfibrillas. En la página siguiente se mostrará un dibujo en el que se destacan las moléculas que intervienen en la liberación de iones Ca+2. “cabeza” miosina Sitio unión con miosina tropomiosina Citoesqueleto A B LUMEN DEL TUBO T Molécula sensible al voltaje Membrana del tubo T CITOSOL Membrana del retículo LUMEN DEL RETICULO En la parte A de la figura superior podrá observar un ovalo en la membrana del tubo T, que representa a la molécula sensible al voltaje. Por debajo, su ubica la molécula canal de Ca+2. Las esferas pequeñas representan los iones Ca+2. En la figura B, se puede observar que al ocurrir la despolarización de la membrana del tubo T, cambia la conformación de la proteína sensible al voltaje, que a su vez hace cambiar la conformación del canal de Ca+2, con esto salen los iones Ca+2 desde el lumen del retículo sarcoplásmico hacia el citosol. Estos iones Ca+2 irán a unirse a la TnC y así se inicia la contracción. Una vez que ha pasado la desporalización, las moléculas recuperan su forma normal y cesa la salida de los iones. Aunque no se muestra en la figura, existe otra molécula en la membrana del retículo sarcoplásmico que bombea los iones Ca+2 desde el citosol hacia el retículo. Todos estos fenómenos ocurren dentro de milisegundos en cada sarcómera de todas las miofibrillas de la célula muscular. De aquí que todo el músculo se contrae al mismo tiempo. Bueno, aunque el estudio de los microfilamentos salió un poco largo, trataremos ahora los filamentos intermedios.
Anuncio
Documentos relacionados
Descargar
Anuncio
Añadir este documento a la recogida (s)
Puede agregar este documento a su colección de estudio (s)
Iniciar sesión Disponible sólo para usuarios autorizadosAñadir a este documento guardado
Puede agregar este documento a su lista guardada
Iniciar sesión Disponible sólo para usuarios autorizados