SÍNDROME DE RETIRADA CON ANTIDEPRESIVOS INHIBIDORES
Anuncio

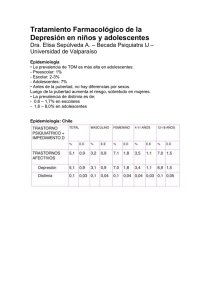
SÍNDROME DE RETIRADA CON ANTIDEPRESIVOS INHIBIDORES SELECTIVOS DE LA RECAPTACIÓN DE SEROTONINA El grupo de antidepresivos que actúan por inhibición selectiva de la recaptación de serotonina (ISRS), tales como fluoxetina, sertralina, venlafaxina y otros, pueden ocasionar síntomas y signos cuando se interrumpe su administración de forma súbita. Se recomienda que los tratamientos se interrumpan de forma gradual. El Comité de Especialidades Farmacéuticas (Committee for Propietary Medicinal Products, CPMP) de la Agencia Europea para la Evaluación de Medicamentos (EMEA) fue requerido por parte de la Comisión Europea en octubre de 1998 para realizar una revisión sobre dependencia, reacciones por retirada y uso prolongado inadecuado con los inhibidores selectivos de la recaptación de serotonina (ISRS), un tema que saltó a la opinión pública a finales de 1998. El CPMP, en colaboración con los Grupos de Trabajo de Seguridad y el de Farmacovigilancia (con representantes de los 15 Estados miembros europeos), revisó los datos disponibles a nivel clínico y preclínico de este grupo de antidepresivos, los ISRS, frente a los antidepresivos clásicos, en cuanto a los aspectos de dependencia y efectos de la retirada de los tratamientos. En la tabla 3 se citan los fármacos evaluados. Tabla 3: Tipos de antidepresivos y sus características Clase de fármacos Antidepresivos clásicos Nombre genérico clomipramina (Anafranil®) maprotilina (Ludiomil®) Inhibidores selectivos de la recaptación de serotonina (ISRS) Últimos antidepresivos fluvoxamina (Dumirox®) fluoxetina (Prozac®, etc) paroxetina (Frosinor®, Seroxat®, etc) sertralina (Besitran®, etc) citalopram (Prisdal®, Seropram®) venlafaxina (Dobupal®, Vandral®) nefazodona (Dutonin®, Menfazona®, Rulivan®) Características principales Comparador como inhibidor relativamente específico de la recaptación de serotonina. Comparador como inhibidor selectivo de la recaptación de noradrenalina. Inhibidor de la recaptación de serotonina y noradrenalina. Inhibidor de la recaptación de serotonina y noradrenalina, y antagonista de receptores 5-HT2 El Grupo de Trabajo de Seguridad (SWP) revisó la información preclínica. Como existían pocos datos preclínicos de acceso público, el CPMP solicitó información, en marzo de 1999, a los ocho laboratorios titulares de los fármacos concernidos. El SWP revisó los datos aportados y se discutieron en las reuniones del CPMP de septiembre y octubre de 1999. En el PhVWP se evaluaron los datos clínicos con relación a la posible dependencia con los diferentes fármacos del grupo de ISRS. El CPMP elaboró una propuesta de declaración basada en las recomendaciones del SWP y del PhVWP. Se remitió a los ocho laboratorios titulares de las especialidades farmacéuticas con ISRS, entre diciembre de 1999 y marzo de 2000. Con los comentarios recibidos de la industria farmacéutica, se elaboró una decisión final en la pasada reunión del CPMP de abril de 2000. El informe de abril está disponible en la página web de la EMEA de Londres (http://www.eudra.org/) como documento EMEA/CPMP/2775/99. En la evaluación de toda la documentación clínica de la que se dispuso, se definieron las siguientes conclusiones: § La revisión no constató evidencias de que los ISRS fueran fármacos con dependencia. § La información del producto para todos los ISRS debe contener las advertencias adecuadas sobre las reacciones identificadas en los casos de retirada o de síndrome de retirada. § No se han realizado ensayos clínicos formales con todos los ISRS para evaluar la naturaleza y la frecuencia de las reacciones en los síndromes de retirada. 1 Finalmente, se realizaron las siguientes recomendaciones: 1. La evidencia clínica disponible no sugiere que los ISRS causen dependencia. Sin embargo, la falta de evidencia no prueba la ausencia de un problema, y debe ser evaluada cualquier evidencia o dato que se produzca. 2. Para la mayoría de los fármacos es insuficiente la evidencia que existe a partir de ensayos clínicos bien definidos, en tanto a la posible dependencia o síntomas de retirada. Por lo tanto, la evaluación global de los resultados de seguridad de los ensayos clínicos para estos fármacos debe tenerse en cuenta a la hora del seguimiento de la seguridad clínica de los ISRS. 3. Los elementos básicos de la información sobre los síndromes de retirada en las fichas técnicas deben armonizarse en toda la Unión Europea, sobre la base de una información mínima, que se adjunta en la tabla 4. 4. Es necesaria la realización de nuevos ensayos clínicos para poder definir la frecuencia y la intensidad de las reacciones al interrumpir el tratamiento con estos antidepresivos, y en particular con relación a las mejores condiciones para la interrupción de los tratamientos. Los cambios que se realizarán en la información de las especialidades farmacéuticas con este grupo de antidepresivos, se resumen en la tabla 4. Tabla 4: Información que se incluirá en los preparados con fármacos ISRS. En la sección 4.8 Efectos indeseables: 1. Un texto indicando que aunque los síntomas de síndrome de retirada pueden aparecer al interrumpir un tratamiento, la evidencia clínica y preclínica no sugiere que los ISRS causen dependencia en los pacientes. 2. Una lista de los síntomas notificados asociados con el síndrome de retirada para cada producto (p.ej., vahídos, parestesia, cefaleas, náuseas y ansiedad). 3. Un texto definiendo que la mayoría de las reacciones por la retirada súbita son leves y autolimitados. 4. Debe incluirse una advertencia a los médicos prescriptores de que debe realizarse una reducción gradual de la dosis cuando se termina el tratamiento, para todos los ISRS excepto para la fluoxetina. La razón es que la fluoxetina y su metabolito tienen una vida media de excreción muy larga (esta información también figurará en el apartado 4.2. Posología). ----------------------------------------------------------------------------------------------------------------------Aspectos generales: 1. Debe usarse el término “síndrome de retirada” en lugar de “reacciones por discontinuación” como ha sido propuesto por algún laboratorio titular de estos fármacos. Debe aclararse que las reacciones del síndrome de retirada son insuficientes por ellas mismas para ocasionar dependencia. 2. No existe suficiente evidencia que nos permita establecer la frecuencia de los síndromes de retirada con los diferentes ISRS. Cualquiera de esas informaciones no deben basarse en la frecuencia de las notificaciones espontáneas, ya que los síndromes de retirada de algunos ISRS están probablemente sujetos a una infranotificación significativa. Cualquier dato relativo a la frecuencia de los síndromes de retirada deben basarse en los resultados de ensayos clínicos, donde se encuentren disponibles. Esta información se incorporará en los prospectos y en las fichas técnicas de los antidepresivos del grupo de los ISRS: fluvoxamina (Dumirox®), fluoxetina (Prozac®, etc), paroxetina (Frosinor®, Seroxat®, etc), sertralina (Besitran®, etc), citalopram (Prisdal®, Seropram®), venlafaxina (Dobupal®, Vandral®) y nefazodona (Dutonin®, Menfazona®, Rulivan®). Todo profesional sanitario debe conocer esta circunstancia para conseguir un uso adecuado de estos fármacos antidepresivos. 2