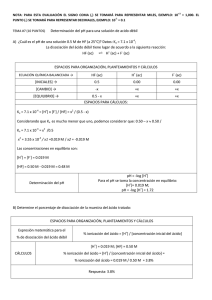
Sistemas tampon
Anuncio

PH y SISTEMAS TAMPÓN DISOCIACIÓN DEL AGUA.El agua se disocia de la manera siguiente: HOH <================> H+ OH- El valor de Kéq. a 25ºC es muy pequeña, siendo del orden de 1´8 x 10(-16). Esto significa que el grado de disociación del agua es insignificante. [H+] [OH-] Kéq. = 1´8 x 10(-16) = ──────────── [H2O] La concentración del agua [H2O] = 55´5 M (Moles por litro). Por lo tanto la ecuación se puede escribir de la siguiente manera: Kéq. x [H2O] = 1´8 x 10(-16) x 55´5 [H+] x [OH-] = 0´99 x 10(-14) = 1 x 10(-14) = [H+] x [OH-] Esto se puede interpretar como que en el agua pura, a 25ºC, la concentración de H+ es igual a la de OH- y sustituyendo en la ecuación anterior resulta que [H+] es 1 x 10(-7) M. De modo semejante, la [OH-] también es 1 x 10(-7) Moles (0´0000001 M). Cuando se valora en las disoluciones la [H+], ésta es tan insignificante que se ha considerado más conveniente expresarla en términos de pH, con lo cual el valor se transforma en otro más fácil de manejar. La forma de obtener el valor de pH a partir de un determinado valor para [H+] es: 1 pH = log ──────── = - log [H+] [H+] El valor, en términos de pH para la [H+] en el agua pura a 25ºC es de: pH = - log 1 x 10(-7) M = 7´0 Así, una concentración de H+ del orden de 10(-7) M es equivalente a un valor de 7 en la escala de pH. Puede compararse la [H+] de cualquier disolución, con respecto a la del agua pura. Si ambas concentraciones coinciden, como el agua se considera neutra se dice que tal sustancia también lo es, y se establece que su nivel en la escala de pH es de 7. Si posee una mayor concentración de protones (por ejemplo: 0´000001 Moles), se dice que es una disolución ácida; esta característica puede expresarse en términos de pH diciendo para el caso del ejemplo que el pH = 6. Se actua del mismo modo cuando la solución es básica. EQUILIBRIOS IÓNICOS El agua es el disolvente en qué están disueltas o suspendidas estas sustancias. Se dice que constituyen DISPERSIONES, es decir, el agua actúa como molécula dispersante o "disolvente" de las otras, que son conocidas como moléculas dispersas o "solutos". El agua actúa como disolvente gracias a su naturaleza dipolar: el agua colmata a las moléculas y anula algunos de los enlaces que mantienen unidos a sus átomos. El resultado es la disociación de las sustancias en iones. NaCl + H2O ----------------> Na+ ClSO4Ca + H2O ----------------> SO4= Ca++ CO3H2 + H2O ----------------> CO3H- H+ Las sustancias (por ejemplo, las sales minerales), que se disocian en el agua dando un catión (ión cargado positivamente) y un anión (ión cargado negativamente), se conocen como electrolitos. Como estas sustancias son de bajo peso molecular, las dispersiones que forman con el agua son completamente transparentes y se conocen como disoluciones. Las sustancias que no son sales minerales (p.e. las moléculas orgánicas), también pueden ser solubles en agua si presentan cierta polaridad. Si estas sustancias presentan un elevado peso molecular, las dispersiones que forman con el agua se conocen como coloidales o, simplemente coloides y se caracterizan porque presentan cierta opalescencia cuando son vistas al trasluz. EQUILIBRIOS IÓNICOS EN DISOLUCIONES ACUOSAS. Las sales minerales, en disoluciones a baja concentración, se disocian totalmente y, en este caso, solo hay iones individuales en la solución y nada de sal sin disociar. Sin embargo, otras sustancias como los ácidos, aunque estén a baja concentración, no se disocian totalmente en el agua; solamente una fracción de sus moléculas está disociada y el resto del compuesto permanece sin disociar. En realidad, lo que ocurre cuando un compuesto se disocia parcialmente es que se llega a un equilibrio dinámico entre el compuesto sin disociar y los iones producidos por la disociación. Un ejemplo lo constituye el ácido láctico, que se disocia parcialmente en anión lactato y un H+ en la forma siguiente: CH3-CHOH-COOH <==============> CH3-CHOH-COOAH A- H+ H+ Cuando un compuesto se disocia parcialmente, tal como lo hace el ácido láctico, es interesante saber en qué grado está disociado cuando se llega al equilibrio. Si representamos el ácido láctico sin disociar como AH y los diferentes iones que se obtienen como A- (anión disociado) y H+ (el catión), podemos tener una medida del grado de disociación en la relación siguiente: [H+] [A-] ┌────────┐ ─────────── = │ │ [AH] └────────┘ El valor resultante se conoce como constante de disociación o de equilibrio y se representa como Keq. Esta constante tiene un valor determinado para cada sustancia, pero varia en relación con la temperatura del medio: aumentando cuando esta aumenta y a la inversa. Para evitar este inconveniente se realiza un cálculo teórico de esta constante de equilibrio en condiciones standard. La constante obtenida en estas condiciones se representa como K´eq. El grado de disociación de un electrolito dependerá de la afinidad del anión por un protón. Si las débiles fuerzas dipolo del agua que interaccionan con el anión y el catión son más fuertes que las fuerzas electrostáticas entre el H+ y el anión, existirá un mayor grado de disociación. De la ecuación de disociación se deduce que si el grado de disociación de una sustancia es pequeña, K´eq. será un número pequeño y viceversa. Evidentemente, para los compuestos que se disocian totalmente no se puede determinar K ´eq. , debido a que en el equilibrio no queda soluto sin disociar. CONCEPTO DE SISTEMA TAMPÓN. En los fluidos biológicos, la presencia de ácidos es algo normal. Un ácido es una sustancia que, en disolución cede protones. Los ácidos fuertes, en disolución se disocian totalmente. Sin embargo, un ácido orgánico como el láctico si se disuelve en agua, se disocia parcialmente, estableciendose un equilibrio entre el ácido, un anión y el protón. Ácido láctico <===========> lactato- H+ Este ácido se considera como un ácido débil. Todo cambio que afecte a la concentración de cualquier componente de la reacción de equilibrio produce un reajuste en la misma. Así, un incremento en la [H+] hará disminuir la concentración de lactato y producirá un incremento equivalente del ácido. Del mismo modo, si se añade una base (sustancia que en solución acepta protones), ésta hará descender la [H+] y el reajuste provocará una adicional disociación de ácido débil. La cantidad de ácido débil disociado será prácticamente igual a la cantidad de H+ capturados por la base. Si se añade NaOH a una disolución de un ácido débil las relaciones de equilibrio también cambian. El NaOH se disocia y los iones OH- formados se combinan con los H+, formando H 2O. Al disminuir la [H+], se producirá una disociación adicional de ácido débil, en igual cantidad al H 2O formada. A medida que se forma ión OH- se produce un inicial descenso de [H+] (incremento brusco del pH), sin embargo la disociación posterior de ácido débil genera más H+ y compensa el pH volviendo a su valor inicial. A este efecto se denomina amortiguación y se define como la capacidad de resistencia de una disolución a variar su pH cuando se le añade un ácido o una base. Quienes en realidad evitan que el pH varíe son el ácido débil y el anión que surge de su disociación, los cuales actúan como dador y aceptor de protones respectivamente. El ácido débil no disociado puede ser considerado como un "almacen de hidrogeniones (protones)", capaz de aportarlos al medio en cualquier momento. Por otra parte, la base disociada puede combinarse con los iones hidrógeno libres que se añadan a la solución, y de esta manera se transformará en ácido débil y se evitará el cambio del pH. A estas dos especies químicas se las conoce como par ácido-base conjugada. Ambas constituyen un SISTEMA TAMPÓN o "buffer". IMPORTANCIA DE LA REGULACIÓN DEL PH FISIOLÓGICO. Diariamente se incorporan al organismo una gran cantidad de hidrogeniones (protones) procedentes de la dieta y del metabolismo, sin embargo su concentración en los fluidos corporales (plasma, fluido intersticial y fluido intracelular) se mantiene muy baja, gracias a los sistemas tampón. Por ejemplo, al añadir 1 ml. de ClH 1 molar a 40 ml. de agua, el pH cambia 5´4 unidades. Sin embargo, si se le añade la misma cantidad de ácido a un tampón formado por volumenes molares iguales de ácido carbónico y de una de sus sales, el pH sólo cambiará 0´071 unidades. Por lo tanto, el tampón ha reducido el cambio de pH unas 500 veces. Esto es necesario, ya que los protones son tan activos que pequeños cambios en la concentración de los mismos puede alterar la conformación de las proteínas y con ello la actividad enzimática, afectando esto a las reacciones enzimáticas y a los procesos fisiológicos. Por ejemplo, la [H+] influye sobre la capacidad de fijación de oxígeno por la hemoglobina. HbH + O2 [H+] <===============> HbO2 + H+ pH El organismo se defiende de estos cambios con los sistemas tampón, los cuales captan o liberan protones de forma inmediata en respuesta a cambios en la acidez. EJEMPLOS BIOLÓGICOS DE TAMPONES INORGÁNICOS. El amortiguador principal del fluido extracelular y del plasma sanguíneo es el sistema tampón dióxido de carbono-bicarbonato. El componente que consideramos como ácido en este sistema amortiguador es el CO2, el cual no es realmente un ácido, sinó un anhídrido de ácido. Reacciona con el agua formando ácido carbónico el cual es, por supuesto, un ácido débil típico. CO2 + H2O <============> H2CO3 El ácido carbónico se ioniza rápidamente dando H+ y HCO3- (hidrógeno carbonato). H2CO3 <================> HCO3- + H+ Si se suman miembro a miembro estas 2 reacciones y se simplifica el H2CO3, el resultado es: CO2 + H2O <=============> HCO3ácido conjugado base conjugada + H+ Consideramos este tampón como una mezcla de ácido débil y su base conjugada. Cuando se añade un ácido fuerte, la mayor parte del H+ adicionado se combina con la base conjugada. Como consecuencia de ello, aumenta el ácido débil y la base conjugada disminuye simultáneamente. El resultado es que el pH cambia mucho menos de lo que lo haría si no estuviera presente el tampón. Como el ácido débil que se forma es CO2, el exceso del mismo se exhala por los pulmones. Los efectos de la alcalosis también pueden ser amortiguados por este sistema tampón, si bien funciona en dirección opuesta. En la alcalosis metabólica el efecto primario es un aumento de la [HCO 3-]. La respuesta fisiológica inmediata es la hipoventilación que aumenta la concentración de CO 2, seguida por un aumento en la excreción renal de [HCO3-]. El sistema amortiguador del bicarbonato en el cuerpo es, por tanto, un sistema abierto en el que la concentración de CO2 se ajusta según las necesidades corporales. Este sistema tampón está regulado en última instancia por los pulmones y los riñones. Otro amortiguador de pH importante lo constituye el TAMPÓN FOSFATO. Actúa de forma casi idéntica a como lo hace el sistema del bicarbonato, pero está compuesto de los siguientes elementos: H2PO4- <================> HPO4= + H+ La concentración de este tampón en el líquido extracelular es sólo la duodécima parte (1/12) de la que tiene el bicarbonato, por ello, el poder amortiguador en este ámbito es menor que el del bicarbonato. En cambio, en el líquido intracelular la concentración de fosfato es mayor y aquí constituye el sistema amortiguador más importante.