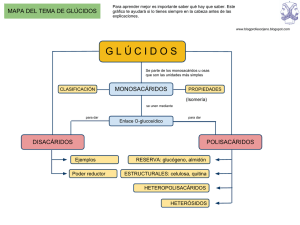
LOS GLÚCIDOS, AULA VIRTUAL DE BIOLOGÍA GUÍA DEL ALUMNO
Anuncio

Miguel Ángel García García LOS GLÚCIDOS, AULA VIRTUAL DE BIOLOGÍA Aplicación interactiva para el aprendizaje de las Ciencias de la Naturaleza. GUÍA DEL ALUMNO Miguel Ángel García García NRP: 0797363446A0590 Cuerpo de Profesores de Enseñanza Secundaria Tlfno. de Contacto: 660 224 658 e-mail: [email protected] 1 Miguel Ángel García García ÍNDICE APARTADO 00 – INTRODUCCIÓN: SALUDOS Y BIENVENIDOS JUSTIFICACIÓN OBJETIVOS FUNCIONAMIENTO DE LA APLICACIÓN RESUMEN APARTADO 00 – INTRODUCIÓN APARTADO 01 – ESQUEMA DE LA UNIDAD ESQUEMA GENERAL EMPEZAMOS POR… LOS ELEMENTOS DE LA VIDA RESUMEN APARTADO 01 – ESQUEMA DE LA UNIDAD APARTADO 02 – INTRODUCCIÓN LA QUÍMICA DE LA VIDA LA MATERIA VIVA LOS BIOELEMENTOS CLASIFICACIÓN DE LOS BIOELEMENTOS OTRA CLASIFICACIÓN (SEGÚN SU FUNCIÓN) 2 Miguel Ángel García García FUNCIÓN E IMPORTANCIA BIOLÓGICA EL AGUA LAS FUNCIONES DEL AGUA EN LOS SERES VIVOS EL TANTO POR CIENTO DE AGUA DE ALGUNOS ORGANISMOS OTRAS CARACTERÍSTICAS DEL AGUA LAS SALES MINERALES CARACTERÍSTICAS DEL ÁTOMO DE CARBONO RESUMEN APARTADO 02 – INTRODUCCIÓN APARTADO 03 – DEFINICIÓN, FUNCIÓN Y CLASIFICACIÓN DE LOS GLÚCIDOS DEFINICIÓN DEL GLICEROL A LA ALDOTRIOSA Y A LA CETOTRIOSA LAS FUNCIONES CLASIFICACIÓN DE LOS GLÚCIDOS LOS MONOSACÁRIDOS LOS ÓSIDOS RESUMEN APARTADO 03 – DEFINICIÓN, FUNCIÓN Y CLASIFICACIÓN DE LOS GLÚCIDOS APARTADO 04 – LOS MONOSACÁRIDOS LOS MONOSACÁRIDOS CARÁCTER REDUCTOR CLASIFICACIÓN DE LOS MONOSACÁRIDOS EJEMPLOS DE MONOSACÁRIDOS LA ESTEREOISOMERÍA EL CARBONO ASIMÉTRICO LOS ENANTIÓMEROS LA ACTIVIDAD ÓPTICA ANIMACIÓN: “ACTIVIDAD ÓPTICA DE LOS MONOSACÁRIDOS” ANIMACIÓN: “QUIRALIDAD” 3 Miguel Ángel García García APARTADO 05 – LA REPRESENTACIÓN DE HAWORTH OTROS EJEMPLOS ALDOPENTOSAS ALDOHEXOSAS CETOHEXOSAS RESUMEN ANIMACIÓN: “CONFIGURACIÓN ESPACIAL DE LA –D-GLUCOPIRANOSA”. ANIMACIÓN – “CICLACIÓN DE HAWORTH EN NUESTRA PIZARRA” APARTADO 06 – DERIVADOS DE LOS MONOSACÁRIDOS DESOXIAZÚCARES POLIALCOHOLES ÁCIDOS URÓNICOS AMINOAZÚCARES O AMINOSANAS APARTADO 07 – LOS DISACÁRIDOS CONCEPTO DE DISACÁRIDO PODER REDUCTOR SACAROSA LACTOSA MALTOSA APARTADO 08 – LOS POLISACÁRIDOS 4 Miguel Ángel García García CONCEPTO DE POLISACÁRIDO FUNCIONES OTRAS CARACTERÍSTICAS LOS HOMOPOLISACÁRIDOS EL ALMIDÓN EL GLUCÓGENO LA CELULOSA LA QUITINA LOS HETEROPOLISACÁRIDOS LA PECTINA EL AGAR-AGAR LAS HEMICELULOSAS LAS GOMAS LOS MUCOPOLISACÁRIDOS APARTADO 09 – LOS HETERÓSIDOS CONCEPTO DE HETERÓSIDO ALGUNOS EJEMPLOS RESUMEN 5 Miguel Ángel García García APARTADO 00 – INTRODUCCIÓN: SALUDOS Y BIENVENIDOS Nos proponemos comenzar el estudio de la unidad didáctica “Los glúcidos” que se ofrece en el currículo de 2º de Bachillerato en la asignatura de Biología. Se trata de un conjunto de conceptos bioquímicos y biológicos de especial importancia para el estudiante de biología, no sólo de 2º de Bachillerato, sino también de otros niveles educativos. Hemos tratado de desarrollar unos contenidos que están más próximos al currículo de 2º de Bachillerato porque de esta manera pensamos que cualquier estudiante podría acercarse a esta aplicación desde sus propios conocimientos básicos, para encontrarse con aprendizajes cada vez más complejos aquí. De modo que consideramos que los contenidos que se incorporan en la presente aplicación son abordables desde otros niveles educativos y no sólo desde la perspectiva del alumno de 2º de Bachillerato. Se trata de una aplicación o programa informático pensado para su libre distribución por la RED, es decir, INTERNET, desde donde abordaremos una parte del estudio de las Ciencias Naturales. Con ella pretendemos incorporar este tipo de aprendizaje al banco de herramientas cotidianas del profesor de Biología. En la actualidad se habla mucho de las TIC, Tecnologías de la Información y la Comunicación. Esta es nuestra pequeña aportación a las mismas, no sin antes advertir que para que la información sea verdaderamente útil es necesario un esfuerzo posterior que la transforme en verdadero proceso de enseñanza-aprendizaje. 6 Miguel Ángel García García A través de los videotutoriales nos introducimos en el campo del autoaprendizaje. ¿Qué son los videotutoriales? Son pequeñas secuencias de video, como el que estamos presenciando en estos momentos, que guían al estudiante a través de su proceso de aprendizaje. Nos atrevemos a decir que son pequeñas clases virtuales donde el esfuerzo fundamental recae en el estudiante, y que más tarde comprobará la eficacia de los mismos a través de pruebas interactivas y sus resultados. JUSTIFICACIÓN Nos justificamos desde tres puntos de vista: En primer lugar deseamos ofrecer contenidos que puedan enmarcarse en las TIC, Tecnologías de la Información y la Comunicación. Estos contenidos son necesarios en el entorno educativo en el que nos encontramos, pero deben ser, en todo caso, complementarios y, de ningún modo, sustitutivos de otro tipo de contenidos más tradicionales y que desde un punto de vista pedagógico se han manifestado más eficaces. En segundo lugar pretendemos presentar contenidos dinámicos, motivadores e interactivos, que a veces se desarrollan de manera tímida en los planes de estudio actuales. Es una aportación más a este banco de recursos de aula. En tercer y último lugar justificamos la presente aplicación desde una perspectiva tecnológica, es decir, utilizaremos las tecnologías 3D (en tres dimensiones), para otorgar a las moléculas de la vida su justa representación, y emplearemos sencillas técnicas de animación para visualizar conceptos que de otra manera podrían resultar más complejos. También queremos incidir en que muchas veces es difícil encontrar este tipo de contenidos dinámicos e interactivos de forma gratuita. Internet es la plataforma más adecuada para democratizar la educación, pero ésta aspiración no se desarrollaría sin el compromiso de todos. 7 Miguel Ángel García García OBJETIVOS Los principales objetivos que pretendemos perseguir son los siguientes: Utilizar herramientas contemporáneas basadas en las TIC. De éstas ya hemos hablado en apartados anteriores. - Establecer contenidos motivadores para el estudio de las Ciencias Naturales. Iniciar un nuevo banco de información y recursos, ampliable por todo aquel que lo desee, a través de las nuevas tecnologías de Internet. - Difundir a través de la RED contenidos interactivos. Todos estos objetivos tienen una única motivación: incorporar los efectos pedagógicos que los videotutoriales presentan sobre un grupo de alumnos interesados, por distintos motivos, en el estudio de las Ciencias Naturales. 8 Miguel Ángel García García FUNCIONAMIENTO DE LA APLICACIÓN La aplicación está organizada en apartados y subapartados, y desde éstos los lectores se pueden redirigir a otros apartados o al menú principal. Además se ha previsto un sistema de ayuda “on line” consultable desde cualquier apartado que se esté visualizando. Podemos resumir, en la siguiente lista, los elementos previstos y su funcionamiento: - Menú general de apartados y sistema de navegación sencillo. - Ayuda "on line" en formato pdf. - Banco de videotutoriales. - Batería de actividades interactivas y prácticas virtuales de laboratorio. Terminamos recordando que pulsando en el botón ¡¡AYUDA!! del menú principal, se encontrarán con toda la información necesaria para un correcto funcionamiento de la aplicación. Nos vemos… 9 Miguel Ángel García García APARTADO 01 – ESQUEMA DE LA UNIDAD ESQUEMA GENERAL Comenzamos la unidad haciendo un esquema general con los apartados que consideramos que no podían faltar. 01 – Esquema de la unidad: es el apartado donde nos encontramos. Delante contamos con el Apartado – 00, pero al tratarse del bloque de contenidos de “objetivos”, “justificación”, etc., no lo incluimos aquí. 02 – Introducción: antes de empezar a hablar de los glúcidos pensamos que podía ser interesante una breve introducción sobre las moléculas de la vida, su estructura y función. Daremos detalles sobre las características de la molécula de agua, las sales minerales y la química del carbono. Haremos una clasificación de los elementos y las moléculas que se pueden encontrar en los organismos vivos. 03 – Definición, función y clasificación de los glúcidos: en este apartado iniciamos el estudio de los glúcidos propiamente dichos. Además de la definición de glúcido, trataremos de exponer sus funciones y haremos una clasificación. Completaremos con ejemplos la clasificación anterior. 04 – Los monosacáridos: además de ser moléculas fundamentales para la vida, son muy importantes para comprender el resto de glúcidos. Los definiremos y acudiremos a su estructura molecular para entender su importancia. Se ofrecerán conceptos tan importantes como “quiralidad”, “enantiomería”, o “actividad óptica”. 05 – Representación de Haworth: mediante distintos ejemplos diferenciaremos la proyección de Fischer de la representación de Haworth. Aprenderemos a “ciclar” un monosacárido. 10 Miguel Ángel García García 06 – Derivados de los monosacáridos: profundizaremos en el estudio de los monosacáridos estudiando sus derivados. Veremos su clasificación y nos detendremos en sus estructuras y su función. 07 – Disacáridos: se trata de moléculas fundamentales para los organismos vivos. Además de su estructura nos detendremos también en su clasificación y su función biológica. 08 – Polisacáridos: son moléculas con una complejidad muy grande y de gran importancia biológica. Veremos, con distintos ejemplos, su clasificación, estructura molecular y función en la naturaleza. 09 – Los heterósidos: grupo muy heterogéneo que ha empezado a conocerse con extraordinaria exactitud en los últimos años. Como veremos, su función biológica es muy importante. EMPEZAMOS POR… Podemos considerar dos grandes apartados: - La química del carbono y los elementos de la vida - Los glúcidos Consideramos que es importante que nos detengamos en el estudio de los componentes fundamentales de las estructuras orgánicas. Aunque lo trataremos de manera superficial, el apartado nos introduce en el concepto de biomolécula. De esta manera podremos comenzar a tratar los glúcidos propiamente dichos. LOS ELEMENTOS DE LA VIDA 11 Miguel Ángel García García Antes de terminar este apartado queremos desglosar la parte dedicada a los elementos de la vida. En primer lugar veremos la materia viva y su composición. A continuación pondremos nuestra atención en los bioelementos y su clasificación. Por último detallaremos la importancia biológica de los mismos. Queremos concluir el Apartado 01 animando a los alumnos a continuar visualizando estos videotutoriales. El esfuerzo merecerá la pena. 12 Miguel Ángel García García APARTADO 02 – INTRODUCCIÓN LA QUÍMICA DE LA VIDA Todos los seres vivos presentan en su composición un conjunto de elementos que se agrupan en moléculas comunes. Los elementos que componen los seres vivos se denominan bioelementos, y éstos se agrupan, a su vez, en las denominadas biomoléculas. En este apartado estudiaremos las características más importantes que definen tanto a los bioelementos, como a las biomoléculas, y haremos un resumen de su clasificación su importancia biológica. LA MATERIA VIVA Como ya se ha comentado anteriormente todos los seres vivos se componen de elementos comunes que no son exclusivos de éstos, sino que también se encuentran presentes en la materia inerte. Cuando estos elementos se agrupan forman las denominadas biomoléculas, sólo presentes en la materia viva. Las diferencias en cuanto a su composición, entre materia viva y materia inerte, las encontramos en las distintas proporciones de los diferentes elementos químicos. Además la materia viva cuenta con una composición mayoritaria de un grupo pequeño de elementos, con unas características especiales que confieren a sus estructuras plasticidad y versatilidad. Para conseguir que exista estabilidad química entre estos componentes se recurre al enlace covalente de manera mayoritaria, aunque también encontramos puentes de hidrógeno, enlaces de Van der Waals, agrupaciones hidrófobas, etc. 13 Miguel Ángel García García Vamos a comenzar con el estudio de los elementos biogénicos o bioelementos y continuaremos con las principales biomoléculas: agua y sales minerales. Por último centraremos nuestra atención sobre un tipo de biomoléculas orgánicas, los glúcidos – aclaramos que además de glúcidos, también son biomoléculas orgánicas lípidos, prótidos y ácidos nucleicos. LOS BIOELEMENTOS Como ya sabemos son los elementos que se encuentran en las estructuras orgánicas. Algunas veces se encuentran de forma aislada y otras veces se enlazan entre sí para formar las biomoléculas. Los seres vivos cuentan con, aproximadamente, unos veinticinco elementos químicos, que no difieren en nada de los clasificados en la tabla periódica de los elementos. De éstos unos dieciséis son comunes a todos los seres vivos. Podemos establecer, como regla fundamental, que la materia inerte presenta una variedad y heterogeneidad mucho mayor en cuanto al número de elementos, pero que su organización es mucho más simple que la que presenta la materia viva. Atendiendo a las proporciones y a la abundancia de éstos, podemos hacer una clasificación en bioelementos primarios y bioelementos secundarios. CLASIFICACIÓN DE LOS BIOELEMENTOS MATERIA VIVA BIOELEMENTOS PRIMARIOS BIOELEMENTOS SECUNDARIOS O C H N P S Ca Na K Cl M g Si Fe +60 20 10 2,5 1,1 0,1 2,4 0,1 0,1 0,4 0,01 1 0,01 14 0,15 0,11 0,15 0,06 3,6 2,7 2,5 2,1 Hidrosfera 46,5 78 Atmósfera MATERIA INERTE PROPORCIÓN (%) Miguel Ángel García García 2,1 27,7 5 En la tabla vemos las proporciones que encontramos de los distintos elementos, y se hace una comparación de sus proporciones relativas entre materia inerte y materia viva.. La clasificación que se establece es la siguiente: 1. Bioelementos primarios: En orden de abundancia serían oxígeno, carbono, hidrógeno, nitrógeno, fósforo, y azufre. Sólo los cuatro primeros constituyen el 95% aproximadamente de la materia viva. Las concentraciones de O, C, P y S son mucho mayores en la materia viva que en la materia inerte tal y como queda reflejado en la tabla. Sin embargo con el N los valores se invierten a favor de su presencia en la atmósfera, que llega a valores próximos al 78%. 2. Bioelementos secundarios: Son el resto de bioelementos. Su abundancia es mucho menor en la materia viva. En algunos casos las concentraciones se consideran prácticamente despreciables. Además existen elementos que no se encuentran en todos los organismos, y aparecen en ciertas especies animales o vegetales por la función tan específica que desempeñan. Podemos clasificar los bioelementos secundarios en: o Indispensables: son aquellos que deben encontrarse en todos los organismos vivos para un correcto funcionamiento de sus estructuras. Algunos sólo se encuentran en forma de trazas, es decir en concentraciones tan bajas que sólo pueden ser detectados mediante técnicas de laboratorio específicas. Destacamos los siguientes elementos en orden de abundancia en los seres vivos: Ca, Cl, K, Na, Mg, Mn, Fe, Co, Cu y Zn. También podemos hablar de OLIGOELEMENTOS refiriéndonos a los elementos que se encuentran en cantidades muy pequeñas pero cuya función sigue siendo indispensable para la vida. o Variables: son los bioelementos secundarios que no se encuentran en todos los organismos, como por ejemplo B, Al, F, etc. 15 Miguel Ángel García García OTRA CLASIFICACIÓN (SEGÚN SU FUNCIÓN) También podemos establecer un tipo de clasificación atendiendo a la función que desempeñan en el organismo. Bioelementos estructurales: son los responsables de los esqueletos moleculares, es decir, aquellos que forman mayoritariamente las estructuras de los organismos. O, C, H, N. Bioelementos que dan rigidez a los organismos – función esquelética: forman las estructuras esqueléticas de los organismos en forma de agregados minerales. En muchos casos puede hablarse de una verdadera cristalización: estructuras dentarias, exoesqueletos y conchas de moluscos, esqueletos de los vertebrados, etc. Destacan el Ca, el Mg, el P, el F o el Si. Bioelementos energéticos: constituyen las moléculas que ofrecen energía a los sistemas biológicos. En algunos casos se trata de moléculas intermediarias como el ATP, el NADH, etc., y en otros casos se trata de moléculas que generan energía después de su hidrólisis u oxidación, como la glucosa.. Los elementos implicados en este tipo de procesos son el C, el O, el H o el P. Bioelementos catalíticos: ayudan a acelerar las reacciones bioquímicas del metabolismo formando parte de las enzimas. Podemos citar al Fe, al Co, al Cu, etc. Bioelementos osmóticos o que realizan funciones electrolíticas: son muy importantes para regular los procesos osmóticos y de intercambio de iones en las células y fluidos corporales. Siempre se comportan en forma de iones: Na+, K+, Cl-, etc. FUNCIÓN E IMPORTANCIA BIOLÓGICA En numerosas ocasiones se ha tratado de establecer la relación que existe entre la importancia y función biológica de los elementos que forman parte de los organismos vivos, y 16 Miguel Ángel García García su abundancia relativa. Se puede concluir que no existe una relación directa entre estos parámetros, es decir, muchas veces los elementos con menores proporciones son los que establecen condiciones de mínimos para que la vida pueda ser posible, aunque también es cierto que los bioelementos mayoritarios para la vida como el C o el O son indispensables para la totalidad de las especies vivas. Por tanto no podemos establecer una relación directa entre abundancia e importancia. Como ejemplo podríamos citar el caso del Silicio, que se encuentra en proporciones traza en la mayoría de los casos, pero que sin embargo constituye el exoesqueleto de las algas diatomeas, y sin cuya participación su supervivencia sería imposible. ¿Por qué han triunfado unos elementos y no otros? Es decir, ¿por qué los bioelementos primarios son los que son y no otros? En el caso del C, el O, el H, etc., se han tratado de encontrar explicaciones termodinámicas. Podríamos decir que la clave se encuentra en su relativa ligereza y la facilidad con la que se unen entre sí para formar enlaces de tipo covalente. En la naturaleza es imprescindible un tipo de enlace lo suficientemente fuerte que soporte las tensiones estructurales de los tejidos firmes, pero además, por razones energéticas, se necesita que puedan ser hidrolizados con facilidad, es decir que puedan romperse si es necesario. De esta hidrólisis molecular es de donde aparecerá la necesaria energía para el funcionamiento de los sistemas vivos. Siempre se pone como ejemplo las diferencias entre el carbono y el Silicio, ambos con valencia cuatro y estructura tetraédrica como veremos más adelante. Sin embargo el carbono presenta numerosas ventajas sobre el Silicio. En primer lugar el carbono admite gran cantidad de enlaces debido a que presenta una menor masa molecular que el silicio. Además puede producir moléculas del tipo CO2 que son solubles en agua, mientras que el dióxido de silicio es completamente insoluble cristalizando en forma de mineral. Las cadenas …-C-C-… pueden ser mucho más variadas que las cadenas …-Si-Si-… (que forma silicatos insolubles) y esto es debido a la menor masa atómica del carbono. Por tanto, el carbono es la molécula adecuada para formar estructuras largas o cicladas con un grado de hidrogenación muy importante, facilitándose así los procesos de óxido-reducción. Estos últimos, también llamados procesos RedOx, son los responsables del intercambio de energía de unos niveles a otros. ¿Cómo consiguen esto? 17 Miguel Ángel García García Las moléculas carbonadas están tremendamente hidrogenadas, es decir, reducidas. Esto facilita que puedan ser oxidadas en presencia de oxígeno. ¿Qué ocurre después? La respuesta es sencilla: liberación de energía, que puede ser empleada en la reducción o hidrogenación de otras moléculas. Los dos procesos RedOx más importantes son la fotosíntesis y la respiración, antagónicos entre sí. En la fotosíntesis es posible formar moléculas reducidas a partir de la energía del sol, mientras que en la respiración estas moléculas se oxidan para conseguir energía utilizable en otros procesos de síntesis bioquímica. Sin pretender extendernos demasiado ofreceremos a continuación las funciones principales de los bioelementos más importantes: Hierro: intermediario de óxido-reducción. Se encuentra presente en la Hemoglobina y es el responsable del transporte de oxígeno a través del torrente circulatorio. También se encuentra en otros pigmentos respiratorios como los citocromos de la cadena de transporte electrónico de las mitocondrias. Magnesio: está presente en la clorofila, interviniendo en el proceso de transporte electrónico de la fotosíntesis, y también en algunas enzimas. Yodo: forma parte de la hormona tiroxina, implicada en los procesos de aceleración o desaceleración metabólica. - Cobalto: es un componente de la vitamina B12. - Fluor: presente en los huesos y en el esmalte de los dientes. - Etc… 18 Miguel Ángel García García EL AGUA El agua es quizás la molécula más importante para los seres vivos, no sólo por su implicación en las funciones metabólicas de los organismos sino también porque gran parte de los ecosistemas se desarrollan en medios acuáticos que no existirían, tal como los conocemos en nuestro planeta Tierra, sin la participación del agua. Al encontrarse abundantemente en nuestro planeta, es el medio en el que la vida asienta sus funciones y de donde los seres vivos tomamos el impulso necesario para construir nuestras estructuras biológicas. Por ello no es de extrañar que se convierta en la sustancia más importante para los tejidos vivos, encontrándose presente en la casi totalidad de los mismos. Se sabe que representa entre un 65% y un 75% del peso de los organismos, incrementándose hasta un 90% en algunos casos. Una pérdida de un 10% de agua puede poner al organismo en una situación muy crítica, situándose éste al borde de la muerte por deshidratación. De esta manera se concluye que la molécula de agua es extraordinariamente importante para la vida debido al conjunto de propiedades metabólicas que manifiesta. Se han desarrollado mecanismos específicos para que los seres vivos mantengan su volumen de agua en márgenes adecuados. Estos mecanismos han sido un logro evolutivo sin cuyos efectos se producirían pérdidas o ganancias irreversibles. Son los denominados procesos de ósmosis, casi siempre funcionales por razones hormonales. En otros casos, especialmente en el reino vegetal, se observan adaptaciones específicas para prevenir la pérdida de agua. No obstante, en ocasiones podemos encontrar proporciones del 10% de agua o incluso menos, pero estos datos siempre corresponden a tejidos especiales como esqueletos, conchas, caparazones o dientes, o incluso a estados latentes del ciclo biológico de algunos seres vivos, como es el caso de las semillas o las esporas. 19 Miguel Ángel García García LAS FUNCIONES DEL AGUA EN LOS SERES VIVOS Llegamos al apartado en el que se definen las funciones del agua. Todas ellas tienen aspectos comunes, compartiendo en algunos casos la explicación teórica que la Física o la Química dan a las mismas. Comenzamos. Función disolvente: las reacciones bioquímicas necesitan un medio acuoso para que puedan producirse. Las moléculas de la vida se encuentran formando dispersiones coloidales en un medio acuoso, siendo el agua, la responsable de la disolución de gran parte de ellas. Función transportadora: al ser una sustancia disolvente puede participar en el transporte de sustancias. Éstas viajan disueltas en el agua a otras partes del organismo. Por tanto puede participar también en los procesos de entrada y salida de sustancias de las células por transporte osmótico, es decir, sin gasto de energía. Otra forma de transporte es el movimiento por el torrente circulatorio de sustancias de unas partes a otras del organismo. La sangre, linfa, savia de los vegetales, etc., que presentan cerca de un 90% de agua se desplazan transportando sustancias en forma de nutrientes, o de deshechos. Función bioquímica: la capacidad de disociación del agua consiste en romper su molécula en forma de los iones H+ (hidrogenión) y OH- (hidroxilón). Esto hace posible que participe en numerosas reacciones bioquímicas de hidrólisis, rompiendo moléculas orgánicas y transfor-mándolas en otras más pequeñas. Esto se consigue con la participación de hidrolasas, es decir, enzimas específicas que aceleran inician o aceleran los procesos. La molécula de agua además participa en numerosas reacciones bioquímicas de la respiración aerobia o la fotosíntesis. Función mecánica y estructural: gracias al agua numerosas estructuras pueden sostenerse. Actúa en distintos niveles todos ellos relacionados entre sí. En primer lugar puede hidratar macromoléculas uniéndose a ellas por puentes de hidrógeno, otorgando estabilidad estructural a las mismas o el medio más apropiado para impedir las repulsiones electroestáticas de distintas partes de la macromolécula. En segundo lugar, debido a su gran fuerza de cohesión el agua no se comprime fácilmente, ofreciendo turgencia y resistencia mecánica a muchas estructuras: algas, medusas, partes blandas de organismos superiores, 20 Miguel Ángel García García etc. Por último, gracias a su fuerza de adhesión es posible el fenómeno de capilaridad y ascenso de agua desde el suelo hasta las partes más elevadas de los vegetales. Función termorreguladora: el agua presenta un elevado calor específico y una elevada conductividad térmica. Esto capacita a su molécula para comportarse como un acumulador o reservorio de calor, haciendo más difícil la pérdida o ganancia de energía calorífica de los objetos o cuerpos que la rodean. Además es la forma ideal para perder calor, simplemente eliminando agua, como por ejemplo sucede en el caso de la sudoración. En este último ejemplo también se debe tener en cuenta que el agua presenta un elevado calor de vaporización, es decir para vaporizar el agua se obtiene la energía de la piel, dando un efecto de enfriamiento de la misma. 21 Miguel Ángel García García EL TANTO POR CIENTO DE AGUA DE ALGUNOS ORGANISMOS En la tabla se puede apreciar el porcentaje de agua de distintos organismos. Son datos que también tienen en cuenta las estructuras esqueléticas, generalmente menos hidratadas. Como se puede apreciar en el extremo superior encontramos a organismos invertebrados como la medusa y otros organismos ligados al medio acuático como por ejemplo las algas. Los organismos vertebrados como por ejemplo nuestra propia especie presentamos cerca de un 70% de agua. Otras estructuras como semillas o esporas y algunas fases de latencia de algunos ciclos biológicos no llegan al 15% de concentración de agua. ORGANISM O Algas Medusa Caracol Conejo Lombriz Hombre % DE AGUA 98 96 80 67 87 65 OTRAS CARACTERÍSTICAS DEL AGUA Además de las funciones que ya hemos comentado el agua presenta las siguientes características que hacen posible la vida en nuestro planeta: Elevada tensión superficial: favorece que algunos organismos puedan deslizarse sobre la superficie de ecosistemas acuáticos sin hundirse. - Elevado calor específico: ya se ha comentado en apartados anteriores. 22 Miguel Ángel García García Densidad anómala: La mayor densidad del agua se alcanza a los 4ºC. Cuando alcanza el punto de solidificación a los 0º ésta es menos densa que la que se encuentra debajo unos grados de temperatura por encima. Esto posibilita que el agua en estado de hielo flote en la superficie de masas de agua. Transparencia: favorece que la luz pueda penetrar en los ecosistemas acuáticos hasta una profundidad máxima aproximada de unos 100 m. Esto permite el desarrollo de los seres fotosintéticos y en consecuencia del resto del ecosistema. LAS SALES MINERALES Podemos definirlas como la combinación de una parte ácida con otra parte básica, es decir, un catión con un anión. Pueden encontrarse en forma precipitada, es decir, combinaciones de cationes con aniones, o en forma disociada, es decir, iones sin combinar. En este último caso se encontrarían en forma de disolución. Los principales iones que podemos encontrarnos son Na+, K+, Ca++ y Mg++ en forma de cationes y Cloruro(Cl-), Nitrato (NO3-), Carbonato CO32-), Sulfato (SO42-), etc., en forma de aniones. Sin pretender extendernos demasiado en las funciones, destacamos que en forma precipitada forman esqueletos y estructuras de sostén, como por ejemplo las conchas de moluscos o los esqueletos de los vertebrados. En forma disociada se encuentran en las disoluciones y participan en funciones tan importantes como la regulación del equilibrio osmótico o el equilibrio ácido base. Para ello se desarrollan sistemas de regulación tampón como por ejemplo el tampón bicarbonato. 23 Miguel Ángel García García CARACTERÍSTICAS DEL ÁTOMO DE CARBONO Se trata de uno de los bioelementos primarios, y constituye aproximadamente el 20% de la materia orgánica. En la tabla periódica se dispone en el grupo de los elementos carbonoideos, es decir, la 14ª columna, con una configuración electrónica de tipo ns2 np2. Su número atómico es 6, es decir, presenta seis protones en el núcleo. El número de neutrones es 6, por lo que su número másico es 12. Su masa atómica es 12,011u. En estado neutro, por tanto, debe tener seis electrones en la corteza que se distribuyen 2+4. Es un elemento electronegativo, es decir, tendería a ganar electrones si no fuera porque su carácter covalente le permite compartir los cuatro electrones de su “última capa”. Es decir, tiene valencia 4. Esto último le confiere una estructura tetraédrica, es decir, sus valencias se disponen en el espacio apuntando a los vértices de un tetraedro. En esta representación hemos tratado de dibujar los electrones de la corteza. Se debe tener en cuenta que los modelos actuales sitúan a estos, no en capas, sino en orbitales. El orbital central, esférico, es de tipo s, y los orbitales exteriores, lobulados, son de tipo p. Cuando se sitúan orbitales s y p juntos se generan orbitales híbridos de de tipo sp3, que es la animación que hemos tratado de conseguir. La disposición final, como puede apreciarse es la de una estructura en la que los orbitales apuntan hacia los cuatro vértices de un tetraedro. Además, en estos vértices hemos representado los orbitales s de cuatro hidrógenos, también esférico. Por tanto la molécula resultante sería CH4, el metano. 24 Miguel Ángel García García Terminamos el Apartado – 02 recordando que era preciso realizar esta introducción sobre los componentes más pequeños de la vida. APARTADO 03 – DEFINICIÓN, FUNCIÓN Y CLASIFICACIÓN DE LOS GLÚCIDOS DEFINICIÓN Los glúcidos son biomoléculas orgánicas que presentan casi siempre C, O e H, aunque sus derivados pueden presentar N, P y S. Son polialcoholes, es decir, tienen el grupo –OH repetido varias veces en función del número de Carbonos que presenten. Si tienen un grupo aldehído en uno de sus carbonos finales se denominan polihidroxialdehídos. Si presentan un grupo cetona en uno de sus carbonos centrales se denominan polihidroxicetonas. La fórmula general es CnH2nOn, que también puede expresarse como Cn(H2O)n. Se observa que el grupo de C y de O coincide, y que presentan el doble número de H que de C o de O. La segunda fórmula, sin embargo puede resultar engañosa puesto que da la sensación de que se constituye del mismo número de moléculas de agua (H 2O)n, que de Carbonos Cn, relación que no es correcta en ningún caso. Por esta razón es más correcto indicar la fórmula de los glúcidos de la primera forma expresada (CnH2nOn). DEL GLICEROL A LA ALDOTRIOSA Y A LA CETOTRIOSA 25 Miguel Ángel García García Tradicionalmente se ha comenzado el estudio de los glúcidos partiendo de una hipotética molécula de glicerol. A partir de ahí podemos explicar cómo se van añadiendo nuevas características a esta molécula, por ejemplo cambio de grupos –OH (grupos hidroxilos o alcoholes) por grupos =OH con doble enlace (es decir, grupos aldehído y ceto); o también procesos de alargamiento de la molécula o ciclación de las mismas como veremos más adelante. El glicerol es una molécula formada por tres átomos de carbono de los que aparecen tres grupos –OH. Por tanto se trata de un polialcohol de tres átomos de carbono. Los carbonos, en este caso, se numeran desde el que se encuentra más a la izquierda o desde el que se encuentra más arriba dependiendo de cómo hayamos dibujado la molécula. Es frecuente dibujar este tipo de moléculas alargadas de arriba a abajo, por lo que el primer Carbono sería el que se encuentra más arriba. En la animación observamos, en primer lugar el paso de glicerol a aldotriosa. Un grupo –OH terminal se transforma en un grupo =OH de doble enlace terminal, es decir, un grupo aldehído. Uno de los enlaces del carbono 1 con uno de los hidrógenos “pivota” transformándose en un enlace doble. A mismo tiempo los dos hidrógenos sobrantes desaparecen de la molécula. El resultado es la aldotriosa, es decir, un gliceraldehído, llamado así porque se considera derivado del glicerol. Cuando pasamos de glicerol a cetotriosa es el carbono 2 el que está implicado en la formación de un grupo =OH de doble enlace central, es decir, un grupo cetona o ceto. En es te caso es el enlace del hidrógeno central el que “pivota” alrededor del Carbono 2 para formar un enlace doble central con el oxígeno, formándose así la molécula de cetotriosa al tiempo que los dos hidrógenos sobrantes desaparecen. Esta molécula también se denomina dihidroxicetona ya que presenta dos grupos hidroxilo y un grupo ceto. A partir de ahora ya tenemos configuradas las moléculas de las que obtendremos el resto de monosacáridos, pero esto lo veremos más adelante. LAS FUNCIONES Las funciones de los glúcidos, hablando en general, podemos resumirlas en las siguientes: 26 Miguel Ángel García García Función energética: esta es la función más importante en cuanto al número de moléculas glucídicas que la realizan. Es frecuente encontrar rutas bioquímicas en las que se hidrolizan estas moléculas para obtener energía, por ejemplo la glucólisis. En este ejemplo la molécula de glucosa se hidroliza y se obtiene energía en forma de ATP. Es una de las primeras reacciones del metabolismo celular y de la que se obtiene energía inmediata a partir de la glucosa. Función estructural: numerosos glúcidos forman parte de estructuras orgánicas como por ejemplo la celulosa o la pectina de las paredes vegetales; o la quitina de los exoesqueletos de los invertebrados y de las paredes celulares de los hongos y líquenes. También forman parte de la pared bacteriana moléculas como peptidoglucanos o mureínas, y otros como los glucosaminoglucanos o el ácido hialurónico mantienen la estructura de los tejidos en colaboración con las proteínas. - Función vitamínica: la vitamina C es un derivado de un monosacárido. - Función inmunológica: forman parte de los anticuerpos o inmunoglobulinas. Marcadores de superficie: algunos oligosacáridos se unen se unen a lípidos y a proteínas de la membrana plasmática y actúan como señas de identidad del individuo. Por ejemplo el complejo mayor de histocompatibilidad. CLASIFICACIÓN DE LOS GLÚCIDOS Normalmente se establece una clasificación en función de la complejidad de las moléculas o el número de carbonos que presenten éstas. Seguiremos esta clasificación por ser la más conocida y la de más amplio espectro pedagógico. MONOSACÁRIDOS: u OSAS HOLÓSIDOS ÓSIDOS HETERÓSIDOS 27 OLIGOSACÁRIDOS POLISACÁRIDOS Miguel Ángel García García Como se ve en la tabla hay dos grupos importantes: por un lado los Monosacáridos, también llamados osas y por otro lado los ósidos: Monosacáridos u osas: son los glúcidos que no pueden descomponerse en otros más simples. Pueden experimentar oxidaciones, reducciones, etc., PERO NO PUEDEN DESCOMPONERSE POR HIDRÓLISIS. Como ejemplo pondremos la glucosa, la fructosa, la galactosa, etc., de las que hablaremos más adelante. Ósidos: éstos sí pueden descomponerse en otros glúcidos más simples. Podemos dividir a este grupo en holósidos y heterósidos: o HOLÓSIDOS: están formados exclusivamente por monosacáridos unidos entre sí. Dependiendo del número de monosacáridos que formen parte de la molécula hablamos de oligosacáridos o polisacáridos. Oligosacáridos: como máximo pueden tener diez monosacáridos. Dependiendo del número de Carbonos se denominan MONOSACÁRIDOS, DISACÁRI-DOS, TRIOSAS, TETROSAS, PENTOSAS, HEXOSAS, HEPTOSAS, etc. Polisacáridos: se componen de más de diez moléculas de carbono. Si todas son iguales se habla de HOMOPOLISACÁRIDOS, y si son distintas de HETEROPOLISACÁRIDOS. o HETERÓSIDOS: además de monosacáridos también forman parte de la molécula otras partes de naturaleza no glucídica. LOS MONOSACÁRIDOS Ya hemos comentado las características más importantes de los monosacáridos. Se trata de polihidroxialdehídos o polihidroxicetonas con fórmula general CnH2nOn, donde el 28 Miguel Ángel García García número de carbonos puede oscilar entre 3 y 8. En la naturaleza no se encuentran glúcidos con un número de carbonos superior a 8. También de denominan osas como ya se ha visto en anteriores apartados, y no se pueden descomponer en otros glúcidos más simples. Un ejemplo lo vemos dibujado aquí, la glucosa. Sus propiedades pueden resumirse en: - Son sólidos cristalinos. Incluso pueden llegar a formar verdaderos cristales. Tienen sabor dulce, de ahí que también se relacione a los monosacáridos con el azúcar de mesa, aunque en realidad éste último sea un disacárido. - Tienen color blanco. Son solubles en agua. Esto implica que son disoluciones verdaderas y no simples mezclas o coloides. Por razones que veremos en más adelante conservan el poder reductor en disolución. Esto quiere decir que otras sustancias pueden ser reducidas por los monosacáridos en disolución, mientras que estos terminarían oxidándose. El concepto de oxidación y reducción es muy importante en bioquímica, y debe ser estudiado con el suficiente rigor, pero para lo que nos interesa en estos momentos, podemos aclarar que reducir una molécula implica que gane un átomo de Hidrógeno, mientras que oxidarla implica que lo pierda. LOS ÓSIDOS Según la clasificación que estamos siguiendo un ósido es, resumiendo: - Un glúcido compuesto por al menos dos monoscáridos. Los holósidos están formados sólo por monosacáridos, ya sean oligosacáridos o polisacáridos, - Los heterosacáridos tienen una parte no glucídica en su molécula. 29 Miguel Ángel García García Así terminamos el Apartado – 03 titulado DEFINICIÓN, FUNCIÓN y CLASIFICACIÓN DE LOS GLÚCIDOS. En el siguiente apartado nos centraremos exclusivamente en el estudio de los monosacáridos. Veremos sus propiedades, funciones y estableceremos una clasificación pormenorizada. También aprenderemos a nombrarlos según las recomendaciones de la IUPAC. 30 Miguel Ángel García García APARTADO 04 – LOS MONOSACÁRIDOS LOS MONOSACÁRIDOS Los monosacáridos son polihidroxialdehídos o polihidroxicetonas con un número de carbonos que oscila entre 3 y 8. Sus propiedades ya han sido mencionadas en al apartado anterior, y las resumimos de nuevo en: - Son sólidos cristalinos. - Tienen sabor dulce. - Tienen color blanco. - Son solubles en agua. Además, recordamos que su fórmula general es CnH2nOn . CARÁCTER REDUCTOR Ya se ha visto en el Apartado 03 que en disolución pueden reducir moléculas de su entorno al tiempo que estos se oxidan. ¿En qué consiste este carácter reductor? El proceso de oxidación es antagónico al de reducción. Si una sustancia es oxidante ésta tiende a reducirse, y viceversa. En el caso de los glúcidos éstos tienden a oxidarse porque reducen sustancias que encuentran en el medio. 31 Miguel Ángel García García Reducirse es sinónimo de “ganar” electrones, es decir perder cargas positivas. Por ejemplo, el ión cúprico Cu2+ se reduce a ión cuproso Cu + en contacto con un azúcar reductor. Como perder protones es imposible para el Cu, lo que ha sucedido es que gana un electrón, perdiendo una carga positiva. ¿De dónde procede ese electrón? DEL CARBONO CARBONÍLO DEL AZÚCAR. En este tipo de azúcares reductores existe un carbono llamado carbonilo que presenta un grupo aldehído –CHO. Éste pasa a –COOH, es decir grupo carboxilo tras la aparición de un grupo oxidante O=. En el caso del reactivo de Fehling se produce la siguiente reacción: 2 Cu(OH)2 + R-CHO Cu2O + R-COOH + 2H2O Es decir, el azúcar se oxida y el reactivo se reduce, cambiando de color azul a un color más rojizo. CLASIFICACIÓN DE LOS MONOSACÁRIDOS En la tabla vemos la clasificación de los monosacáridos. Teniendo en cuenta que se ha visto en el apartado anterior, no hacemos más comentarios. Ejemplos de monosacáridos Aunque más adelante pretendemos mostrar las series completas de aldosas y cetosas más frecuentes de la naturaleza aquí vemos tres ejemplos de monosacáridos: eritrosa, fructosa y xilulosa. 32 Miguel Ángel García García En este tipo de representación los carbonos se encuentran formando una estructura lineal que conforma el esqueleto de la molécula. De los carbonos van surgiendo los grupos – OH y también los grupos –H. No debemos olvidar, no obstante, que los carbonos se presentan en el centro de un tetraedro, y que en cada vértice de esos tetraedros van situándose los diferentes sustituyentes. ERITROSA: como se puede observar la Eritrosa se compone de cuatro átomos de carbonos. El carbono que se encuentra en primera posición tiene el grupo aldehído, por lo que se trata de una tetroaldosa. Además, como vamos a estudiar posteriormente, se trata de la D-eritrosa porque químicamente proviene del D-gliceraldehído. XILULOSA: es una cetopentosa, y pertenece, concretamente, a la serie D porque procede de la D-tetrulosa. El grupo ceto se encuentra sustituido en el carbono número 2. FRUCTOSA: este monosacárido tiene una importancia enorme en la naturaleza, ya que es el azúcar intermediario de muchas reacciones metabólicas de los vegetales relacionadas con la obtención de energía. Como se puede apreciar es una cetohexosa, es decir, tiene seis átomos de carbono y un grupo ceto en el carbono 2. 33 Miguel Ángel García García LA ESTEREOISOMERÍA Debemos aclarar algunos términos antes de continuar. Ya se ha introducido el concepto de “serie” aunque aún no hemos podido explicar su significado. Desde un punto de vista químico la isomería se define como la presencia de moléculas que tienen la misma fórmula empírica pero distinta fórmula desarrollada. Es decir, tienen el mismo número de átomos de cada elemento que las componen, pero su estructura puede variar. En el caso de los glúcidos se puede manifestar un tipo de isomería que sólo tiene que ver con su estructura tridimensional, hablándose entonces de estereoisomería. Recordamos que la palabra estéreo quiere decir espacio. Otro concepto que debemos entender bien es de asimetría. En química se dice que un elemento es asimétrico en una determinada molécula cuando todos sus sustituyentes son distintos. Aclaramos esto con el ejemplo del carbono. Como sabemos el carbono se comporta con valencia 4, por lo que podría presentar cuatro sustituyentes distintos, uno de cada valencia. Esto le confiere características asimétricas, ya que los cuatro radicales o sustituyentes podrían presentarse en distintas posiciones, es decir, en distintos vértices del tetraedro. La fórmula química de dos moléculas que presentaran carbonos asimétricos seguiría siendo la misma pero tendrían distinta estructura tridimensional. A partir de ahí surge el concepto de serie y de enantiomería, y avanzamos que existen enantiómeros D y L. 34 Miguel Ángel García García EL CARBONO ASIMÉTRICO En este tipo de moléculas, donde el esqueleto principal está compuesto por una sucesión de carbonos enlazados entre sí, es frecuente la existencia de alguno de ellos con características asimétricas. ¿Qué es un carbono asimétrico? Mejor que definirlo es verlo en el esquema que hemos representado. El carbono 5 de la D-fructosa que hemos representado tiene distintos todos sus sustituyentes: -R, -OH, -H y CH2OH. Esto le confiere unas características espaciales muy singulares. Si los enlaces que unen este carbono con los carbonos 4 y 6 rotaran, aparecerían compuestos estereoisómeros. LOS ENANTIÓMEROS Como consecuencia de lo que hemos estudiado sobre la asimetría, pueden aparecer moléculas con carbonos asimétricos, que únicamente difieren en la posición del grupo –OH. Esto se puede ver más claramente con las moléculas simples, por ejemplo el gliceraldehído. Las dos moléculas que hemos representado tienen la misma fórmula empírica (C3H6O3), e incluso su estructura lineal se desarrolla de forma casi idéntica. La única diferencia la encontramos en el carbono 2, que como ya hemos apuntado es asimétrico, y cuyos -OH (grupos hidroxilo) difieren el la posición. Uno se encuentra a la derecha y el otro se encuentra a la izquierda. Cuando se estudia su estructura tridimensional en realidad no podemos hablar de derecha e izquierda, sino más bien de distinto vértice del tetraedro que conforma el carbono 2. Esto hace imposible que las dos fórmulas puedan superponerse en el espacio. No obstante, como convenio internacional, las moléculas las dibujamos “planas”, y otorgamos “derecha” o “izquierda” a la posición relativa en la que se encuentra el grupo –OH. 35 Miguel Ángel García García Surgen así las formas “D” y “L”, de derecha e izquierda respectiva-mente. Por tanto, y concluyendo con este apartado, diremos que las formas “D” son aquellas que presentan el grupo –OH a la derecha y las formas “L” las que lo presentan a la izquierda. Únicamente se precisa una última nota aclaratoria. Si la molécula presenta más de tres átomos de carbono, el –OH responsable de su clasificación en D o L es el que está sustituido en el carbono más alejado del carbono carbonilo (en el caso de las aldosas suele ser el Carbono 1, en el caso de las cetosas suele ser el carbono 2). LA ACTIVIDAD ÓPTICA Existe un tipo de isomería a la que denominamos isomería óptica. En este caso la posición de los radicales o sustituyentes no influye para la clasificación de los isómeros ópticos como vamos a ver ahora. ¿Qué es la actividad óptica? Ciertos compuestos, de entre los que destacan todos los glúcidos con la excepción de la dihidroxicetona tienen la capacidad de desviar el plano de luz polarizada. En primer lugar el azúcar debe encontrarse en disolución. A continuación, con un cristal polarizador, filtramos un haz de luz. El resultado de esta filtración es otro haz de luz que contiene un único plano de vibración. Eso es a lo que llamamos luz polarizada. ¿Cómo se manifiesta esta actividad óptica? El siguiente paso es hacer pasar esa luz polarizada a través de la disolución que hemos preparado anteriormente. El resultado se puede medir con un aparato denominado polarímetro, que nos da el grado de desviación de ese plano de luz polarizada. En general, esta es una propiedad observada en todos los glúcidos con excepción de la dihidroxicetona, y es una consecuencia de las propiedades que tienen los carbonos asimétricos. Si el plano de luz polarizada es desviado hacia la derecha se dice que el compuesto es dextro o (+), y si es desviado hacia la izquierda se dice que es levo o (-). 36 Miguel Ángel García García Es muy importante que no se confunda esta propiedad con las series D y L ya que, por lo que acabamos de ver, son dos aspectos completamente independientes. UNA MOLÉCULA DE LA SERIE “D” PUEDE DESVIAR EL PLANO DE LUZ POLARIZADA HACIA LA IZQUIERDA Y POR TANTO SER “LEVO”. El caso contrario también se da con bastante frecuencia. Algunas veces las dos propiedades pueden coincidir en el nombre y la inicial, es decir, pueden ser “D” y “DEXTRO”, o “L” y “LEVO”, PERO SON DOS ASPECTOS QUE NO DEBEN SER CONFUNDIDOS, PORQUE COMO YA SE HA COMENTADO SON COMPLETAMENTE INDEPENDIENTES. ANIMACIÓN: “ACTIVIDAD ÓPTICA DE LOS MONOSACÁRIDOS” En nuestra pizarra vamos a tratar de representar lo que sucede dentro de un polarímetro. Lo primero que vemos es lo siguiente: Un haz de luz con varios planos de vibración de sus fotones. En este caso, y a fin de simplificar el dibujo hemos representado únicamente dos planos de vibración. - Un cristal polarizador que servirá de filtro para el haz de luz anterior. Una disolución de un monosacárido cualquiera. Hemos de aclarar que esto no saldría con la dihidroxiacetona, ya que ésta no presenta Carbonos asimétricos. - Una pantalla donde se proyectará la desviación que experimentará el haz de luz. 37 Miguel Ángel García García Los pasos que se van produciendo son los siguientes: En primer lugar hacemos pasar el haz de luz por el cristal polarizador. Enseguida observamos que se ha producido un único plano de vibración de ese haz. Es a lo que denominamos luz polarizada. A continuación hacemos pasar esa luz polarizada a través del monosacárido en disolución. La respuesta será que el plano polarizado se desviará o bien hacia la derecha o bien hacia la izquierda. ha producido. El polarímetro es capaz de informarnos sobre el ángulo de desviación que se Si la desviación sucede hacia la derecha se habla de glúcido DEXTRO, y si es hacia la izquierda de glúcido LEVO. Por último recordamos que esta propiedad es totalmente independiente de su enantiomería, es decir, ser de la serie D no implica necesariamente desviar la luz polarizada hacia la derecha, AUNQUE PODRÍA COINCIDIR. ANIMACIÓN: “QUIRALIDAD” En muchas ocasiones se habla de quiralidad para referirnos a compuestos que tienen carbonos asimétricos y que, por tanto, son enantiómeros. 38 Miguel Ángel García García Etimológicamente Quirios proviene del Griego y equivale a “mano”, queriendo significar que dos compuestos tienen estructuras especulares, es decir, una es el “reflejo” de la otra, igual que la mano derecha lo es de la mano izquierda. Teniendo en cuenta esto en nuestra pizarra hemos representado una figura geométrica de la que aparecerá su correspondiente “reflejo”. Las moléculas representadas en la superficie de cada forma son “simétricas” entre sí, es decir, formas especulares o quirales. Si tratáramos de superponer en el espacio una forma a la otra veríamos que no es posible. 39 Miguel Ángel García García APARTADO 05 – LA REPRESENTACIÓN DE HAWORTH Por razones históricas y también didácticas nos encontramos en uno de los apartados más importantes de toda la unidad. Todo estudiante que desee comprender con absoluta claridad cómo es un glúcido desde un punto de vista molecular debe aprender a ciclar las moléculas que hasta ahora hemos mostrado en su representación “estirada”. Las formas “estiradas” que hemos visto hasta ahora corresponden a un tipo de representación que en la naturaleza se combinan con otras en forma de anillo. Debido a las características químicas que tienen los carbonos que forman parte de las moléculas, éstas tienden a formar “anillos” o ciclos. Las formas estiradas se denominan proyecciones de Fischer, y las formas cicladas se denominan formas de Haworth. Las primeras tienden a ciclarse cuando se encuentran en disolución, aunque debemos puntualizar que el proceso contrario también es posible, es decir, son formar reversibles pudiéndose dar el paso desde forma ciclada hasta forma estirada. En la representación vemos a la D-fructosa en su forma o proyección de Fischer y en su forma de Haworth. Para pasar de una forma a otra vemos cómo el Carbono 2 se enlaza con el carbono 5 mediante un oxígeno intermediario. El resultado es la forma ciclada de la derecha que tiene aspecto de pentágono. Los dos carbonos, el 2 y el 5, se unen mediante el denominado enlace hemiacetálico. ¡Vamos por partes! Al carbono 2 se le denomina carbono hemiacetálico, porque es el que presenta el grupo ceto. En una aldosa, el carbono hemiacetálico sería el carbono 1, que es el que presenta el grupo aldehído. Por tanto, llamamos carbono hemiacetálico a aquel que lleva el grupo ceto o grupo aldehído. 40 Miguel Ángel García García ¿Y el carbono anomérico? Corresponde al mismo carbono hemiacetálico después de haberse producido el enlace. ¡Esto es muy importante y no debe olvidarse! La ciclación suele producirse entre el carbono hemiacetálico, o si se prefiere, carbono anomérico, y el carbono asimétrico más alejado de éste. En el caso de la D-fructosa sería el carbono 5. OTROS EJEMPLOS Este otro caso representa la ciclación de la xilulosa, también una cetosa. El carbono 2 es el carbono anomérico pero la ciclación se produce entre éste y el carbono 5 por ser ésta una cetopentosa. Esta es una excepción debido a que los ciclos son más estables cuando se trata de formas pentagonales o hexagonales. Las formas tetragonales no existen en la naturaleza. La representación es una forma pentagonal en la que el carbono 5 se une a dos hidrógenos y es el único que no presenta grupo –OH. Pero vayamos a casos más sencillos: La D- galactosa. La D-galactosa es una aldohexosa, el carbono anomérico o hemiacetálico es el carbono 1 y el carbono 5 es asimétrico. Como se trata de la forma “D” el –OH del carbono 5 se encuentra a la derecha. La forma hemiacetálica produce un grupo –OH en el carbono 1 o anomérico y hace desaparecer el –OH del carbono 5. Dentro del ciclo que queda dibujado entre carbono 1 y carbono 5 se sitúan los –OH y los –H restantes. Como norma aplicable a todas las ciclaciones de tipo Haworth, diremos que los sustituyentes que quedan dentro del anillo se representarán hacia abajo del plano de la estructura final. 41 Miguel Ángel García García En este caso el carbono anomérico tendría la posibilidad de representar su grupo –OH resultante dentro del anillo o fuera, pero el resto mantienen sus posiciones de forma invariable: El carbono 2 presenta su –OH dentro del anillo, por lo que en la forma de Haworth se representará hacia abajo. El carbono 3 presenta su –OH fuera del anillo, por lo que en la forma de Haworth se representará hacia arriba. El carbono 4 presenta su –OH fuera del anillo, por lo que en la forma de Haworth se representará hacia arriba. El carbono 5 tiene el último sustituyente en forma de CH2OH que se representa hacia arriba porque en la estructura real suele quedar siempre por encima del plano del ciclo. ALDOPENTOSAS Con intención de reforzar todos estos conceptos estudiaremos a continuación la ciclación de las aldopentosas, y pondremos como ejemplo a la D-Ribosa. Podemos resumir todo el proceso: - El carbono anomérico es el carbono 1. - La forma de Haworth se establece entre carbono 1 y carbono 4. Por último, situamos los dos –OH que quedan dentro del ciclo por debajo del plano que forma el pentágono. 42 Miguel Ángel García García Seguramente ya se habrá observado que el nombre de la forma de Haworth resultante difiere del de la forma estirada inicial. A efectos de nomenclatura diremos que los ciclos pentagonales se denominan furanósidos, y los ciclos hexagonales de denominan piranósidos. Y, aunque esto lo detallaremos después, a partir de ahora nombraremos a las moléculas pentagonales con el sufijo –furanosa, y a los ciclos hexagonales con el sufijo –piranosa. La explicación química es sencillamente que derivan del furano y pirano respectivamente. Nos queda un último detalle que no puede pasarse por alto: las formas α y β . Ya hemos apuntado en otra ocasión que el carbono anomérico genera un radical nuevo, un grupo –OH que antes no tenía. ¿Dónde situamos este grupo hidroxilo, “dentro o fuera del ciclo”? La respuesta es que puede situarse en los dos lados, lo que significa que en la forma de Haworth puede encontrarse hacia arriba del plano o hacia abajo. Como norma general que puede ser aplicada a todos los monosacáridos, diremos que si el –OH del carbono anomérico queda hacia arriba del plano de Haworth, la forma resultante será de tipo β . Por el contrario, si este grupo –OH quedara hacia abajo del plano de Haworth, la forma resultante será de tipo α . En este caso obtenemos una β –D-Ribofuranosa puesto que: - Proviene de la D-ribosa, es decir, forma “D”. El carbono anomérico, es decir, el carbono 1, deja al –OH fuera del anillo de Fischer, por lo que en la representación de Haworth se dibujará hacia arriba del plano que forma el pentágono. - La forma resultante, por tanto, será de tipo β. 43 Miguel Ángel García García Es muy importante que recordemos que: LAS FORMAS α Y β DE LOS MONOSACÁRIDOS SON ANÓMEROS, MIENTRAS QUE LAS FORMAS “D” Y “L” SON ENANTIÓMEROS (O ENANTIOMORFOS). ALDOHEXOSAS La D-glucosa es una aldohexosa, y su ciclación siempre se pone como ejemplo en todos los libros de texto. Por tanto, hemos decidido que en este apartado tampoco podía faltar. En la forma estirada vemos que únicamente el –OH del carbono 3 se encuentra hacia la izquierda. El resto de grupos –OH aparecen hacia la derecha. Cuando trazamos el enlace desde el carbono anomérico, carbono 1, hasta el carbono 5 todos los grupos –OH, excepto el del carbono 3, quedan dentro del “anillo”, por lo que tienen que representarse por debajo del plano de Haworth. Como se forma un ciclo hexagonal la molécula resultante es una glucopiranosa y, como el –OH del carbono anomérico o carbono 1 queda en este caso por debajo del plano de Haworth, la forma resultante es α –D-glucopiranosa. CETOHEXOSAS 44 Miguel Ángel García García Esta ciclación es similar a que pusimos como ejemplo para el caso de la D-xilulosa, sólo que en aquella ocasión se trataba de una Cetopentosa. No obstante, en esta ocasión el resultado es también un furanósido, es decir, una molécula de tipo pentagonal. La D-fructosa es una cetohexosa, y presenta su carbono anomérico en posición 2. La ciclación se produce entre éste y el carbono 5. El resultado es la β –D-fructofuranosa, tal como se ha representado en su forma final Haworth. ANIMACIÓN: “CONFIGURACIÓN ESPACIAL DE LA α –D-GLUCOPIRANOSA”. Hemos representado la α –D-glucopiranosa y la hemos situado en un plano horizontal. La representación de Haworth es una forma simplificada de la verdadera molécula, pero nos da una idea bastante aproximada de su estructura real. Si queremos comprender bien cómo es la estructura molecular real en primer lugar debemos situar los radicales por encima o por debajo del plano que hemos dibujado. Podemos ver que tres grupos –OH se encuentran por debajo del plano y el resto por encima. También podemos contabilizar los –H que se encuentran por encima o por debajo. Además hemos añadido dos flechas que apuntan hacia los carbonos 1 y 5. ¿Qué ocurriría si pudiéramos “plegar” la molécula aplicando dos fuerzas en dichos puntos? En la animación la estructura hexagonal plana se ha transformado en una configuración en forma de “barca” o “nave”, con los carbonos 1 y 4 por encima del plano ecuatorial. 45 Miguel Ángel García García La otra posibilidad es la que vemos en pantalla. En este caso aparece una configuración “plegada” en forma de “silla”. El carbono 1, en esta ocasión, se sitúa por debajo del plano ecuatorial, mientras que el carbono 4 continúa estando por debajo del plano. En este tipo de representaciones, mucho más cercanas a la realidad, es imposible hablar de grupos –OH o grupos –H por encima o por debajo del plano. En este caso se suele expresar que hay radicales ecuatoriales si éstos apuntan hacia el plano ecuatorial. Es el caso del –H del Carbono 1, o del –OH del Carbono 4. Estos últimos son radicales ecuatoriales. Para diferenciar a los radicales ecuatoriales de los demás se habla de radicales polares, que son aquellos que no apuntan hacia el plano ecuatorial, como por ejemplo el –OH del carbono 1. Podemos completar estas aclaraciones con la siguiente animación, donde se aprecia el proceso de “plegado” en configuración “silla”. Los radicales o sustituyentes no se comportan como ecuatoriales o polares aleatoriamente, sino que responden a cuestiones de estabilidad molecular. En este sentido añadimos que es mucho más frecuente la configuración en “silla” que la configuración en “nave”, aunque ambas pueden convivir a un tiempo. ANIMACIÓN – “CICLACIÓN DE HAWORTH EN NUESTRA PIZARRA” Vamos a ver paso a paso como se produce una forma de Haworth partiendo de una glucosa que se encuentra en su proyección de Fischer. Conviene dibujar la molécula horizontalmente. No perdamos de vista el plano horizontal que contendrá a la forma piranósica resultante. 46 Miguel Ángel García García Los pasos bioquímicos que se van dando en la estructura interna de la molécula son los siguientes: - La estructura se pliega para acercar el carbono 1 al carbono 6 No debemos olvidar que nos encontramos en un medio acuoso. En la parte superior derecha hemos dibujado una molécula de agua (H2O). - A continuación el carbono 1 prepara sus orbitales para que reaccionen con el agua. Al mismo tiempo, en el carbono 6, se ha producido una rotación que acerca aún más a su grupo –OH al carbono 1. La molécula de agua hidrata a su resto oxigenado obteniéndose dos grupos – OH. Esta situación es poco estable. En presencia del Grupo –OH del carbono 6 se produce una pérdida de una molécula de agua favoreciendo la aparición del enlace hemiacetálico final. 47 Miguel Ángel García García APARTADO 06 – DERIVADOS DE LOS MONOSACÁRIDOS Existe un gran número de moléculas que derivan de los monosacáridos y que presentan un gran interés biológico. DESOXIAZÚCARES Tal como indica su nombre un desoxiazúcar es un derivado desoxigenado de un monosacárido. Los ejemplos más clásicos son la desoxirribosa y la fucosa. Desoxirribosa: la fórmula general corresponde con la α–D-desoxirribofuranosa, siendo una parte fundamental de la estructura del ADN. El –OH del Carbono 3 de la ribosa pierde su oxígeno como puede verse en la imagen. El resultado es una estructura desoxigenada. Fucosa: el carbono 6 de la galactosa reemplaza su grupo –OH por otro oxígeno, convirtiéndose en CH3. Esta molécula está presente en las glucoproteínas y en los glucolípidos de las membranas plasmáticas de las células. POLIALCOHOLES Los grupos aldehídos o cetonas se reducen y pasan a grupos alcohol. Los ejemplos que hemos encontrado son los siguientes: 48 Miguel Ángel García García GLICEROL: el grupo aldehído del Carbono 1 del gliceraldehído se reduce y pasa a grupo –OH. Es decir, el grupo CHO se transforma en grupo –CH 2OH. El glicerol también se denomina glicerina, y es un componente de las grasas y de los fosfolípidos. SORBITOL: en este caso el Carbono 1 de la glucosa también se reduce, transformándose en el sorbitol. Éste abunda en los frutos de las rosáceas como por ejemplo las manzanas, las peras, las ciruelas, etc. MANITOL: Es un derivado de la manosa de la misma forma que se obtiene el sorbitol. El manitol se encuentra en ciertos frutos como el níspero, la piña o en el exudado del arbusto del maná, de donde recibe su nombre. XILITOL: Es el derivado alcohol de la xilosa, y junto con el Sorbitol y el Manitol es utilizado industrialmente como edulcorante de zumos, alimentos dietéticos o chicles, ya que son moléculas que no se metabolizan como la glucosa, pero siguen teniendo sabor dulce. ÁCIDOS URÓNICOS Si oxidamos el carbono 6 de una hexosa (carbono primario), transformamos el CH2OH en –COOH. Hemos conseguido así un ácido urónico. Por su importancia biológica destacan: ÁCIDO GLUCURÓNICO: deriva de la glucosa. Es el que hemos representado en la imagen. Junto con el ácido galacturónico se encuentra presente en gomas, mucílagos o pectinas que pueden ser encontrados en las algas. 49 Miguel Ángel García García ÁCIDO HIALURÓNICO: lo podemos encontrar en el líquido intersticial, tejido conjuntivo y algunas secreciones glandulares. Es un componente muy importante porque ayuda a conformar la consistencia de algunos tejidos. AMINOAZÚCARES O AMINOSANAS Son moléculas que se forman por la sustitución del –OH del carbono 2 de los monosacáridos por un grupo amino (–NH2). Hemos representado la α–D-glucosamina y su derivado el N-acetil-glucosamina. Ésta forma parte de la quitina, que es el componente fundamental del exoesqueleto de los artrópodos y de la pared celular de los hongos. También podemos destacar la galactosamina, constituyente de la condroitina del cartílago de los vertebrados; el ácido N-acetil-neuramínico (ácido siálico), que forma parte de glucoproteínas y glucolípidos; o el ácido N-acetil murámico, presente este último en las paredes bacterianas. 50 Miguel Ángel García García APARTADO 07 – LOS DISACÁRIDOS CONCEPTO DE DISACÁRIDO Si conseguimos enlazar dos monosacáridos obtenemos un disacárido. Por tanto ya tenemos la primera aproximación a su naturaleza química: “Son oligosacáridos formados por dos monosacáridos enlazados entre sí”. De hecho son los oligoscáridos con mayor representación en la naturaleza y los que realizan las funciones biológicas más importantes. ¿Cómo se enlazan dos monosacáridos? El enlace entre dos monosacáridos denomina O-glucosídico, y en él participan los siguientes grupos: se Primer monosacárido: participa del –OH del carbono anomérico, es decir, el grupo hidroxilo hemiacetálico. A efectos de nomenclatura se añade al nombre del monosacárido el sufijo –osil. Segundo monosacárido: puede participar con un grupo alcohol cualquiera (OH), o con el grupo –OH hemiacetálico, igual que el primer monosacárido. Para entender después los nombres que se aplican a los disacáridos añadimos que si participa un grupo -OH cualquiera la terminación que se le da a esa parte de la molécula es el nombre del segundo monosacárido añadiéndole el sufijo –osa. En caso de que intervenga el –OH hemiacetálico se la añade la terminación –ósido. Todo esto lo volveremos a repetir cuando tengamos un ejemplo delante. Además, en la reacción que se produce se pierde una molécula de agua. 51 Miguel Ángel García García El enlace O-glucosídico es reversible, y tanto para su formación como para su hidrólisis requiere enzimas específicas. Las enzimas implicadas en la destrucción del enlace son de tipo hidrolítico. Debemos añadir que las propiedades de los disacáridos son similares a las de los monosacáridos, es decir, presentan color blanco, sabor dulce y son sólidos cristalinos a temperatura ambiente. Además son solubles en agua igual que los monosacáridos. PODER REDUCTOR Debemos referirnos al Apartado 03 donde se introducía el concepto de poder reductor. Como ya sabemos, el poder reductor depende del carbono anomérico, es decir, el carbono que en la fórmula estirada presentaba el grupo aldehído o el grupo ceto. En la proyección de Fischer aprendimos que la formación del enlace hemiacetálico pasa por la aparición de un nuevo –OH en este carbono (aún así recordamos que en las cetopentosas este grupo no se producía). Ese grupo es el responsable de la reducción de sustancias susceptibles a ello, y al carbono hemiacetálico se le denomina carbono anomérico en la forma de Haworth. En este caso añadimos que si el enlace ocupa los dos –OH de los dos carbonos anoméricos la molécula resultante pierde el poder reductor, y no podría reducir el reactivo de Fehling. La solución que nosotros tendríamos no cambiaría de color. 52 Miguel Ángel García García SACAROSA La α–Dglucopiranosa es susceptible de enlazarse con la β–D-fructofuranosa. Aquí observamos las formas de Haworth de ambas, en las que hemos señalado los Carbonos anoméricos que en este caso son el carbono 1 de la glucosa y el carbono 2 de la fructosa. Al producirse en enlace se pierde una molécula de agua, pero lo más importante es que también se pierde el poder reductor. Esto es consecuencia de que los dos carbonos anoméricos se encuentran ocupados por el enlace. Nombraríamos de la siguiente forma a la molécula resultante: α− D-glucopiranosil (1 2)β -D-fructofuranósido. Lo explicamos por partes: En primer lugar la glucosa es el primer monosacárido, por lo que debe emplear necesariamente su carbono anomérico. Sufijo –OSIL. - El en enlace se produce entre el carbono 1 de la glucosa y el 2 de la fructosa (1 2). La fructosa también ocupa el carbono anomérico, carbono 2, por lo que SE PIERDE EL PODER REDUCTOR. La terminación en este caso es –ÓSIDO. La molécula final, α -D-glucopiranosil (1 2)β -D-Fructofuranósido, es la sacarosa o azúcar de mesa, y es extraída de la caña de azúcar y de la remolacha blanca o azucarera. 53 Miguel Ángel García García LACTOSA Cuando se enlazan una α–D-galactopiranosa con una β–D-Glucopiranosa en enlace (14), aparece la lactosa. La molécula resultante conserva el poder reductor porque el carbono anomérico de la glucosa (carbono 1) se mantiene libre. La lactosa es el azúcar de la leche, y se encuentra en la de los mamíferos en estado libre. Se utiliza frecuentemente en ciertos preparados farmacéuticos. Algunas personas pueden tener dificultades para metabolizarla, produciéndose una intolerancia a la misma. MALTOSA La maltosa es un monosacárido que se obtiene de la hidrólisis del almidón. Al tratarse de un disacárido formado por dos moléculas de glucosa, tiene especial importancia en los procesos de nutrición de los seres heterótrofos, ya que puede convertirse en una fuente de obtención de energía o una forma de tránsito desde el almidón hasta la glucosa. Su fórmula es α-D-glucopiranosil (14)α-D-glucopiranosa, tal como podemos apreciar en la imagen. Por la misma razón que la lactosa también conserva el poder reductor. Queremos concluir el Apartado 07 citando otras moléculas con relevancia biológica que se incluyen en disacáridos u oligosacáridos: ISOMALTOSA: es un disacárido formado por dos glucosas exactamente igual que la maltosa. La única diferencia es que el enlace es de tipo α(1 6). Conserva el poder reductor y se obtiene de la hidrólisis del almidón y del glucógeno. Procede de los puntos de ramificación de éstos. La molécula seria α -D-glucopiranosil (1 6) α -D-glucopiranosa. 54 Miguel Ángel García García CELOBIOSA: se obtiene cuando se hidroliza la celulosa. Es una molécula en la que intervienen dos glucosas en enlace β(14). Para que este enlace sea posible es necesario que una de las glucosas se invierta en espacio. La fórmula entera sería β -Dglucopiranosil (1 4)β -D-glucopiranosa. Es una molécula que únicamente puede ser hidrolizada por algunas bacterias ya que se necesitan enzimas específicas. - RAFINOSA: es un trisacárido presente en ciertas plantas. OTROS OLIGOSACÁRIDOS estreptomicina, neomicina, kanamicina, etc. 55 CON ACTIVIDAD ANTIBIÓTICA: Miguel Ángel García García APARTADO 08 – LOS POLISACÁRIDOS CONCEPTO DE POLISACÁRIDO Podemos definir a los polisacáridos como macromoléculas formados por cientos de monosacáridos unidos entre sí por enlaces de tipo O-glucosídicos. Pueden ser pentosas o hexosas, pero predomina la glucosa como monosacárido principal en muchos de ellos. Los polisacáridos formados por pentosas se denominan pentosanas, y los que están formados por hexosas se denominan hexosanas. Éstos últimos son los que tienen especial importancia desde un punto de vista biológico. Las propiedades más importantes de los polisacáridos son las siguientes: - Todos ellos tienen un gran peso molecular Son insolubles en agua como consecuencia de ese gran peso molecular, por lo que suelen encontrarse en forma de dispersiones coloidales. - No tienen sabor dulce como cabría esperar. - Pero sí mantienen el color blanco, - Además son sólidos a temperatura ambiente Por último hemos de destacar que han perdido el poder reductor debido a que sus Carbonos anoméricos se encuentran todos ocupados por los enlaces O-glucosídicos. Recordamos que los polisacáridos pueden ser de dos tipos: Homopolisacáridos: es el caso de aquellos que están formados por cadenas de monosacáridos idénticos. Heteropolisacáridos: están formados por cadenas de más de un tipo de monosacáridos. 56 Miguel Ángel García García FUNCIONES Destacamos las siguientes funciones generales: Funciones de nutrición: el almidón o el glucógeno son sustancias de reserva energética. Se pueden hidrolizar en caso de existir demanda energética por parte de los organismos. Funciones estructurales: como la celulosa o la quitina de las que ya se ha hablado en otros apartados. Industria alimentaria y farmacéutica: las pectinas, los alginatos, etc., son utilizados por su capacidad espesante y gelificante. - Dieta alimentaria: son muy importantes porque constituyen la fibra alimentaria. OTRAS CARACTERÍSTICAS La adsorción de agua es una de las características de algunos polisacáridos como por ejemplo el almidón. Esta característica favorece la formación de dispersiones coloidales. 57 Miguel Ángel García García Además no presentan carácter reductor como ya se ha visto. En general los polisacáridos difieren unos de otros en el número de unidades de monosacáridos y en el grado de ramificación de sus cadenas. El número de unidades de monosacáridos puede oscilar desde algunos cientos a varios miles. LOS HOMOPOLISACÁRIDOS Vamos a tratar de hacer un repaso de los principales homopolisacári-dos, estableciendo su estructura y su función biológica. EL ALMIDÓN El almidón o “fécula” es el polisacárido de reserva más importante de los vegetales. Se acumula en el interior de las células en unos orgánulos denominados amiloplastos y forma en ellos unos gránulos muy característicos. Estos gránulos se forman a partir de un punto central, o hilio, del que van apareciendo capas concéntricas a su alrededor. Las estructuras que se forman dependen en gran medida de la especie vegetal. El almidón se encuentra en abundancia en la patata o en el trigo y en otros cereales y legumbres, y en frutas como el plátano. Para hidrolizar el almidón se necesitan enzimas específicas que van produciendo, en primer lugar, moléculas de maltosa, y después moléculas de glucosa, de ahí que se considere una fuente de energía muy importante para muchas especies. Vamos a tratar de explicar en qué consiste la molécula de almidón. En primer lugar hay que diferenciar dos partes aunque todo el complejo está formado por α–D-glucosa: 58 Miguel Ángel García García AMILOSA: se trata de la parte NO RAMIFICADA del almidón. Se compone de moléculas de α–D-glucosa unidas por enlaces α(14). Forma una estructura helicoidal ya que las uniones entre las α–D-glucosas presentan un ángulo característico en lugar de encontrarse en la misma dirección. Cada seis moléculas de α–D-glucosa se produciría una vuelta completa de la hélice que se forma. En sus huecos cabe perfectamente una molécula de yodo, de ahí que sea éste el reactivo utilizado para su determinación, tiñéndose de un color azul oscuro. AMILOPECTINA: es la parte RAMIFICADA del almidón. También está formado por α–D-glucosas con enlaces α(14), pero en las ramificaciones el tipo de enlace es α(16). Esta es la razón que explica que cuando hidrolizamos esta parte del almidón se produzcan, no sólo maltosas, sino también isomaltosas. Recordamos que la isomaltosa es una α -D-glucopiranosil (1 6) α -D-Glucopiranosa. Estas ramificaciones se producen cada 15 o 30 restos de glucosa dependiendo de las especies. La amilopectina tiene un mayor peso molecular que la amilosa, y también es insoluble en agua. En contacto con el yodo se tiñe de color rojo violáceo. Los extremos ramificados del almidón están constituidos por los extremos NO REDUCTORES. La presencia de estas ramificaciones hace más fácil la hidrólisis, porque hay más puntos por donde empezar a hidrolizar. Esto favorece la movilización rápida de glucosa en caso de que fuera necesario. Las enzimas implicadas en la hidrólisis del almidón se denominan β-amilasa y αamilasa: La β-amilasa, presente en las semillas, rompe los enlaces α(14), alternativamente, produciéndose moléculas de maltosa. La α-amilasa, presente en la saliva y en el jugo pancreático, rompe los enlaces α(14) de forma aleatoria, por lo que los productos que surgen son siempre impredecibles. Estas enzimas no pueden hidrolizar el enlace α(16), presente en las ramificaciones, por lo que al final queda el núcleo central no metabolizado. Este residuo que queda tras la acción de las amilasas se denomina dextrina que sólo puede ser hidrolizado por una enzima desramificante denominada α(16)glugosidasa. 59 Miguel Ángel García García EL GLUCÓGENO Su estructura es muy parecida a la de la amilopectina, es decir, α–D-glucosas con enlaces α(14), y en las ramificaciones enlaces α(16). No obstante las ramificaciones se repiten mucho más, en este caso cada 8 o 10 restos de glucosa. Es el polisacárido de reserva más importante de los animales, puesto que la movilización de la glucosa en algunos momentos tiene que ser rápida y abundante. Se almacena fundamentalmente en el músculo estriado y en el hígado. Su hidrólisis es muy parecida a la hidrólisis del almidón. LA CELULOSA Se trata de un polímero de β-D-glucosa en enlaces β(14), por lo que también puede ser considerada como una sucesión de moléculas de celobiosa. Las glucosas forman una cadena helicoidal sin ramificar, y las fibras se van uniendo entre ellas por puentes de Hidrógeno. Estas fibras van formando estructuras cada vez mayores llegando a constituir fibras visibles a simple vista (como por ejemplo el algodón). Se encarga de la función estructural de los vegetales. Podríamos decir que sin la celulosa no sería posible que los vegetales se mantuvieran erguidos y sus células no podrían mantener la consistencia necesaria. Es abundante en los tejidos vegetales que presentan células muertas como por ejemplo el leño del interior de los árboles. También abunda en algunas plantas como el esparto o el cáñamo. 60 Miguel Ángel García García Además debemos añadir que su interés económico es enorme puesto que es la materia prima de la que se extrae el papel e incluso algunos plásticos. El enlace β(14) sólo puede ser hidrolizado por las denominadas celulasas, que únicamente son sintetizadas por ciertos insectos y algunos microorganismos. Los animales no podemos digerir la celulosa, por lo que en el caso de los herbívoros son ayudados por la flora bacteriana de su tracto gastrointestinal. LA QUITINA Sin querer ser demasiado repetitivos simplemente esbozaremos las características de la quitina, homopolisacárido de especial importancia para algunas especies. Se trata de un Polímero de N-acetil-glucosamina en enlace β(14). Forma cadenas similares a las de la celulosa, que se unen lateralmente. Esto confiere a la molécula una resistencia extraordinaria ante agentes químicos. Se hidroliza por quitinasas, sólo presentes en los caracoles y en algunos insectos tropicales. Se puede afirmar que en general no es digerible. Por último añadimos que cumple una función estructural, es decir, forma el exoesqueleto de artrópodos y la pared celular de hongos y líquenes. 61 Miguel Ángel García García LOS HETEROPOLISACÁRIDOS Comenzamos el estudio de los heteropolisacáridos. Nuestro objetivo es, simplemente, citar los más conocidos ciñéndonos a sus características más importantes. LA PECTINA Se trata de un polímero complejo formado por ácido galacturónico en enlaces α(14) asociado a radicales metilados y otras cadenas de galactosas con enlaces β(14); también presenta pentosas y otros azúcares en menores proporciones. Está implicada en la función estructural de los vegetales: forma parte, por ejemplo de la lámina media de las uniones celulares de éstos. Por último queremos destacar sus propiedades gelificantes, especial-mente importantes en la industria alimentaria para la producción de mermeladas y productos derivados. Abunda en frutos como manzanas, peras o cítricos. EL AGAR-AGAR Dentro de los heteropolisacáridos encontramos a este polímero complejo de D y Lgalactosas con enlaces (13) y (14), al que se añaden restos sulfatados. 62 Miguel Ángel García García Tiene función estructural ya que forma parte del talo de las algas rojas. Sus propiedades gelificantes hacen de este polímero un producto muy importante en la industria alimentaria, ya que se emplea en la fabricación de flanes, helados, etc. LAS HEMICELULOSAS Este es un grupo heterogéneo de polímeros de pentosas y hexosas con fórmulas complejas. Están asociadas a la celulosa en las paredes vegetales presentando la misma función que la celulosa. LAS GOMAS Son ácidos urónicos a los que se unen pentosas y hexosas. Su composición es compleja. Se suelen segregar por los vegetales cuando éstos sufren una herida externa, taponando a modo de sutura la misma. Por tanto, tienen una función de protección en los vegetales. Un ejemplo es la goma arábiga que es secretada por algunas especies de acacias cuando se practica un corte en su tronco. 63 Miguel Ángel García García LOS MUCOPOLISACÁRIDOS Podemos definirlos como polímeros de aminoazúcares y ácidos urónicos. Constituyen un grupo muy extenso y complejo. También se conocen por glucosaminoglucanos. Realizan una función estructural en los animales; por ejemplo el ácido hialurónico se encuentra en el tejido conjuntivo y la heparina es un anticoagulante natural de la sangre. APARTADO 09 – LOS HETERÓSIDOS Este es el último de los apartados y será el más breve. Únicamente nos proponemos definir qué es un heterósido para, a continuación, establecer sus funciones más importantes. CONCEPTO DE HETERÓSIDO Es un grupo muy heterogéneo de moléculas con una gran diversidad de formas y estructuras. Resulta complicado establecer criterios de clasificación de estas moléculas que únicamente tiene en común presentar una parte glucídica. No obstante tienen un gran interés biológico, aunque su estudio con detalle no suele realizarse en una unidad didáctica dedicada a los glúcidos. Como ya hemos adelantado los heterósidos se definen por presentar una PARTE GLUCÍDICA + PARTE NO GLUCÍDICA. Aunque existen heteropolisacáridos que pueden estar asociados a partes no glucídicas no deben confundirse con los heterósidos ya que en este tipo de moléculas las uniones no suelen ser covalentes. ALGUNOS EJEMPLOS 64 Miguel Ángel García García Sólo vamos a mencionar algunos ejemplos característicos. Destacan los siguientes: - Nucleótidos: ribosa o desoxirribosa + bases nitrogenadas. Forman los ácidos nucleicos, por lo que suelen estudiarse cuando se aborda ese tema. - Antocianos: pigmentos de algunas flores. Se estudian sobre todo por la fisiología vegetal. - Peptidoglucanos o mureínas: forman parte de la pared bacteriana. - Glucoproteínas: en este grupo hay un conjunto de sustancias muy heterogéneo y que realizan distintas funciones fisiológicas. Vamos a mencionar algunas como la mucina, hormonas gonadotropinas, aglutinógenos A y B de las membranas de los eritrocitos, glucoproteínas de membrana, proteoglucanos, etc. No podemos extendernos más puesto que sería interminable la lista de sustancias y sus funciones. - Glucolípidos: derivados lipídicos presentes también en la membrana plasmática. 65 Miguel Ángel García García RESUMEN RESUMEN APARTADO 01 – ESQUEMA DE LA UNIDAD Los puntos que se tratan en este apartado son: ESQUEMA GENERAL: 1- Esquema de la unidad. 2- Introducción. 3- Definición, función y clasificación de los glúcidos. 4- Los monosacáridos. 5- Representación de Haworth. 6- Derivados de los monosacáridos. 7- Disacáridos. 8- Polisacáridos. 9- Los Heterósidos. 66 Miguel Ángel García García EMPEZAMOS POR… La química del carbono y los Elementos de la vida. Los glúcidos. LOS ELEMENTOS DE LA VIDA La materia viva y su composición. Los bioelementos y su clasificación. Importancia biológica de los mismos. Se explica que es necesario tener algún conocimiento sobre la química del carbono y los elementos de la vida para introducirnos posteriormente en el aprendizaje de los glúcidos. Este es un apartado que únicamente estructura el esquema que se seguirá durante todo el estudio posterior. RESUMEN APARTADO 02 – INTRODUCCIÓN Debido a que los glúcidos son moléculas orgánicas es necesario que se tenga algún conocimiento de los elementos y las moléculas que forman parte de la materia viva. Este es un apartado largo que se desglosa en los siguientes puntos: LA QUÍMICA DE LA VIDA: ¿Qué son los BIOELEMENTOS y las BIOMOLÉCULAS? 67 Miguel Ángel García García LA MATERIA VIVA: Diferenciamos a la materia viva de la materia inerte. LOS BIOELEMENTOS: ¿Qué son los Bioelementos? CLASIFICACIÓN DE LOS BIOELEMENTOS Establecemos una clasificación según su abundancia. OTRA CLASIFICACIÓN (SEGÚN SU FUNCIÓN): Establecemos otra clasificación según su función. FUNCIÓN E IMPORTANCIA BIOLÓGICA: Se establecen las funciones más importantes de los bioelementos más comunes. EL AGUA: Debido a la importancia de la molécula de agua hacemos una revisión general de sus características. LAS FUNCIONES DEL AGUA EN LOS SERES VIVOS: Se hace una revisión general de las funciones del agua: Función disolvente, función transportadora, función bioquímica, función mecánica y estructural y función termorreguladora. EL % DE AGUA DE ALGUNOS ORGANISMOS: Comparamos el % en agua de algunos organismos. OTRAS CARACTERÍSTICAS DEL AGUA: Se detallan algunas características importantes del agua: Elevada tensión superficial, elevado calor específico, densidad anómala y transparencia. 68 Miguel Ángel García García LAS SALES MINERALES: Se definen y se pone ejemplos de las mismas. También se hace una breve referencia a los sistemas de regulación tampón. CARACTERÍSTICAS DEL ÁTOMO DE CARBONO: Mediante una exposición de la estructura del átomo de carbono ofrecemos sus características. Una sencilla animación nos muestra cómo es el átomo de carbono y cómo se enlazaría con otros elementos. RESUMEN APARTADO 03 – DEFINICIÓN, FUNCIÓN Y CLASIFICACIÓN DE LOS GLÚCIDOS Comenzamos con la definición de glúcido haciendo una diferenciación entre POLIALCOHOL, POLIHIDROXIALDEHÍDO y POLIHIDROXICETONA. En una animación se ilustra el paso de GLICEROL a la ALDOTRIOSA y a la CETOTRIOSA. Nos detenemos en las funciones de los glúcidos, enunciando loas más importantes: función energética, función estructural, función vitamínica, función inmunológica y marcadores de superficie. La clasificación que se ofrece se representa en forma de tabla y se explica que ésta ha sido elaborada en función de la complejidad de las moléculas o el número de átomos de Carbono que éstas presentan. A continuación se ofrece una definición general de monosacárido y se repasa el concepto de poder reductor. 69 Miguel Ángel García García Así mismo se explican las funciones de los monosacáridos y se da un repaso general a la definición de ósido. RESUMEN APARTADO 04 – LOS MONOSACÁRIDOS Comenzamos el apartado 04 dando una definición de monosacárido y haciendo un recorrido general por sus propiedades. El concepto de poder reductor es muy importante, por lo que se incide en él y se ponen ejemplos: en este caso la reacción que se produce al poner en contacto el licor de Fehling con los glúcidos. El siguiente punto que se trata es la clasificación de los monosacáridos; no obstante en esta último caso sólo se ponen algunos ejemplos: eritrosa, fructosa, eritrosa, etc. Se presta especial atención a los conceptos de estereoisomería, carbono asimétrico, enantiomería, actividad óptica, y quiralidad. Con la animación “actividad óptica de los monosacáridos” se pretende mostrar cómo funciona un polarímetro, al tiempo que se explica el concepto de actividad óptica. También se han propuesto animaciones que pretenden aclarar el concepto de quiralidad. RESUMEN APARTADO 05 – LA REPRESENTACIÓN DE HAWORTH La representación de Haworth es una aproximación a la realidad de las moléculas de monosacáridos. En este apartado se muestra cómo se cicla una molécula a partir de una proyección de Fischer y se explica el concepto de carbono hemiacetálico. A través de animaciones nos aproximamos al concepto de carbono anomérico. 70 Miguel Ángel García García Por último ofrecemos ciclaciones como la de la D-galactosa, la D-ribosa, aldohexosas y cetohexosas. Ofrecemos una animación que conforma a la glucosa en nave y en silla. También se esquematiza paso a paso, mediante una animación, qué ocurre en la molécula de glucosa en una ciclación. RESUMEN APARTADO 06 – DERIVADOS DE LOS MONOSACÁRIDOS Se hace un repaso general, mostrando sus estructuras moleculares, a desoxiazúcares, polialcoholes, ácidos urónicos y aminoazúcares. DESOXIAZÚCARES: se ponen como ejemplos a la desoxirribosa y a la fucosa. POLIALCOHOLES: se hace una descripción de las moléculas de glicerol, sorbitol, manitol y xilitol. ÁCIDOS URÓNICOS: destacamos al ácido glucurónico y al ácido hialurónico. AMINOAZÚCARES: se ponen diversos ejemplos como la galactosamina, el ácido N-acetil-neuramínico, o el ácido N-acetil-murámico. RESUMEN APARTADO 07 - LOS DISACARIDOS 71 Miguel Ángel García García Nos introducimos en el concepto de disacárido haciendo especial hincapié en su formación gracias al enlace O-glucosídico. Aprendemos cual es la nomenclatura apropiada para estas moléculas y cómo utilizarla; de nuevo incidimos en su poder reductor. Hacemos un repaso de los principales disacáridos presentes en la naturaleza y recordaremos sus propiedades, monosacáridos que los forman y lugares o productos donde podemos encontrarlos de forma natural. Además vemos en nuestra pizarra virtual la configuración propia de disacáridos tan importantes como la sacarosa o la maltosa. RESUMEN APARTADO 08 - LOS POLISACÁRIDOS Definimos qué es un polisacárido y como el enlace O-glucosídico interviene en su formación. Recordamos las propiedades principales de estas moléculas y la importancia de las funciones biológicas que realizan: - Función de nutrición. - Función estructural. Los polisacáridos se clasifican atendiendo a la igualdad o no, de los monosacáridos que forman sus respectivas cadenas en: - Homopolisacáridos 72 Miguel Ángel García García - Heteropolisacáridos Mostramos la estructura molecular de los que no pueden pasar inadvertidos: - Almidón - Glucógeno - Celulosa - Pectina Por último conoceremos también que se entiende por mucopolisacáridos. RESUMEN APARTADO 09 - LOS HETERÓSIDOS Un breve apartado donde se aclara que todo heterósido se define por presentar una parte glucídica mas una parte no glucídica y se muestran cuales son los ejemplos mas caracteristicos presentes en la naturaleza: -Glucoproteínas -Glucolípidos -Nucleótidos -Etc… 73