6.0 Átomos polielectrónicos Átomo de helio
Anuncio
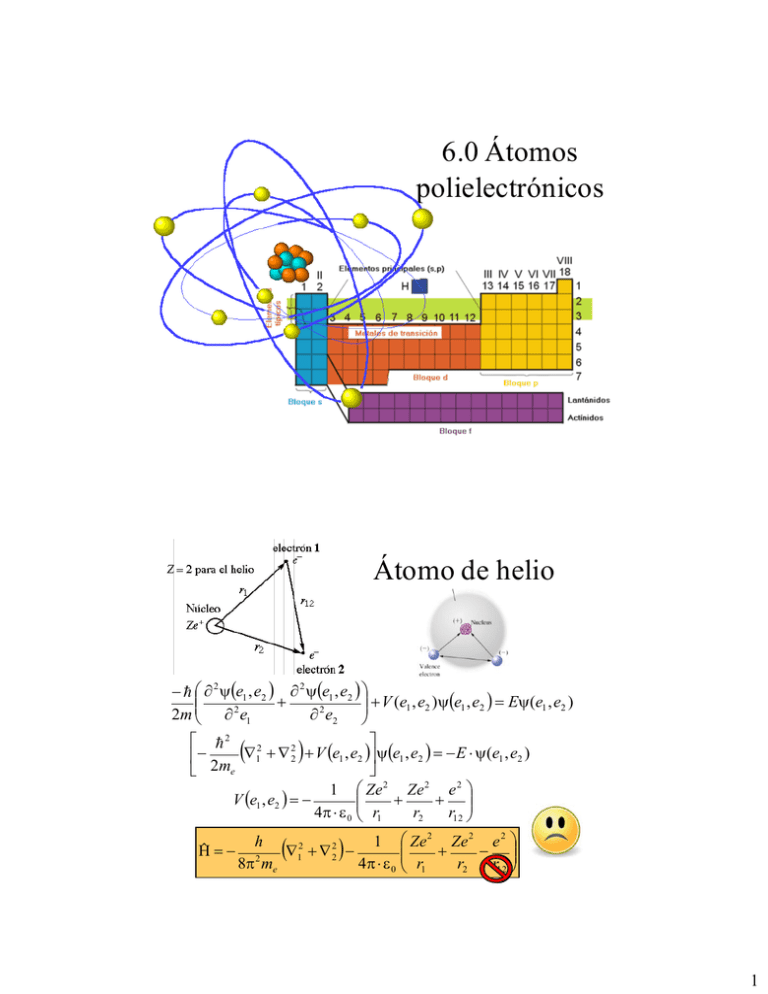
6.0 Átomos polielectrónicos Átomo de helio 2 e1 , e2 2 e1 , e2 V (e1 , e2 )e1 , e2 E(e1 , e2 ) 2m 2 e1 2 e2 2 12 22 V e1 , e2 e1 , e2 E (e1 , e2 ) 2me 1 Ze 2 Ze 2 e 2 V e1 , e2 4 0 r1 r2 r12 Ĥ h 1 Ze 2 Ze 2 e 2 2 2 1 2 4 0 r1 r2 r12 8 2 me 1 Aproximación de electrones independientes Plantea a los electrones independientes en la cual que se suele suponer que cada electrón se mueve como si estuviera solo en el átomo bajo el influjo solo de la carga nuclear. • No se considera la interacción electrón – electrón al ser considerada débil (los electrones deben estar lo mas separado posible uno del otro) • Ambos electrones dentro del orbital presenten un espín opuesto (principio de exclusión de Pauli) Aproximación de electrones independientes Plantea a los electrones independientes en la cual que se suele suponer que cada electrón se mueve como si estuviera solo en el átomo bajo el influjo solo de la carga nuclear. ĤΨ1,2 EΨ1,2 Ψ1,2 1 2 2 12 ψe1 , e 2 22 ψe1 , e 2 Ve1 , e 2 ψe1 , e 2 E total ψ(e1 , e 2 ) 2 me 2 2 12 Ve1 ψe1 ψe1 22 Ve 2 ψe 2 E total ψ(e1 ) ψ(e2 ) ψe 2 2 me 2 me E total E1 E 2 2 Aprox 2: Modelo de carga nuclear efectiva Si se considera que un electrón tapa o apantalla la carga del núcleo, el otro electrón sentirá menos carga (aparente) J. C. Slater (1930) propuso representar la repulsión electrónica con un potencial de apantallamiento. n n ˆ 1 i2 Z * H 2 i1 ri i1 Z* Z i Z* corresponde a la carga nuclear efectiva de cada electron Propiedades periodicas Efecto de Penetración Funciones de probabilidad radial orbitales 2s y 2p 3 Átomo polielectrónicos - Energía E n,l Z 2m e e 4 1 40 2 2 2 n2 Se rompe parcialmente la degeneración Diagrama de niveles para átomos poli-electrónicos, Z > 2 Energías de orbitales atómicos polielectrónicos 4 Atomos polielectrónicos La ecuacion de Schrödinger es irresoluble de forma exacta para átomos polielectrónicos. Una aproximación es: a) la de electrones independientes en la cual que se suele suponer que cada electrón se mueve como si estuviera solo en el átomo y b) bajo el influjo de una carga llamada carga nuclear aparente o efectiva (Z*) Es decir, un electrón no ve al otro electrón en el orbital sino que solo siente una nube en la cual él es el único electrón de un átomo de carga Z* e- Z+ apantallamiento P.e el litio Átomos con mas de dos electrones (3-110) 1,2,3 1s 1 1 1s 2 2 1s 3 3 1 1s 1 1 1s 2 2 1s 3 3 6 1s 1 1 1s 2 2 1s 3 3 1,2,3 1s 1s 1s 0 La densidad de probabilidad para la posicion de los electrones es nula • No pueden construirse funciones anti-simétricas cuando un par de electrones están descritos por el mismo conjunto de cuatro números cuánticos El átomo tiene que utilizar otro orbital para colocar al 3er electrón 5 Principio de exclusión de Pauli Cada electrón en un átomo puede etiquetarse con cuatro (4) números cuánticos: tres para indicar la orbita en la que se encuentran y el cuarto (ms) para indicar su rotación, así: •Si dos electrones tienen n, l y m iguales es forzoso que el espín de cada uno de ellos fuera diferente. •Dos electrones con igual espín y en la misma subcapa ( n y l iguales) deberán girar en orbitas diferentes con diferentes orientaciones espaciales (diferente m) Criterios para el llenado de los niveles energéticos Principio de construcción de Bohr Principio de exclusión de Pauli Principio de máxima multiplicidad o Regla de Hund 6 Principio de construcción o regla de Auf bau • Los niveles energéticos se van ocupando de menor a mayor energia Principio de exclusión de Pauli Es un principio cuántico enunciado por Wolfgang Ernst Pauli en 1925 que establece que no puede haber dos fermiones* con todos sus números cuánticos idénticos (esto es, en el mismo estado cuántico de partícula individual). “dos o mas electrones no pueden existir con los mismos números cuánticos". Pauli, previamente descubrió otro, «el principio de antisimetría», el cual señala: La función de onda total de un conjunto de electrones (fermiones), debe ser antisimétrica con respecto al intercambio de cualquier par de electrones. 0 *partículas que forman estados cuánticos antisimétricos y que tienen espín semientero 7 Principió de exclusión • Dos electrones en un átomo no pueden tener números cuánticos idénticos. Este es un ejemplo de un principio general el cual se aplica no solo a electrones sino también a otras partículas de espín fraccionario (Fermi- Dirac, Fermiones). No se aplica a partículas de espín entero (Bose- Einstein, Bosones). Wolfgang Pauli (1900-1958) nació en Viena 1945, Pauli obtiene el premio Nóbel por el descubrimiento del principio de exclusión. Ahora, acomodar electrones • Acomodar los electrones para un átomo conteniendo 6 electrones Principio de construcción E ¿dónde se coloca el 6to. electrón? 2p 2s 1s Principio de exclusión de Pauli 8 Principio de máxima multiplicidad o regla de Hund Friedrich Hund, nació en 1896 Ms = 1 (Edo. singulete) Ms = 1 (Edo. singulete) El termino de máxima multiplicidad (Ms) de espín es el de menor energía. Ms = 2ST + 1 ST (espín total) = si 1s 2s 3s 4s 5s 6s 7s Ms = 3 (Edo. triplete) Acomodo de los electrones (Regla de las diagonales) 2p 3p 4p 5p 6p 7p 3d 4d 5d 6d 7d 4f 5f 5g 6f 6g 6h 7f . . . . . . . 9 Configuración electrónica • Orden de los electrones dentro del átomo, para ello se siguen tres criterios: Principio de construcción Principio de exclusión Regla de Hund • Debe tenerse claro el numero de electrones en el átomo; – Átomo neutro; #protones = # electrones – Átomo c/carga positiva (cationes) = # electrones – carga – Átomo c/carga negativa (cationes) = # electrones + carga 10 Ejercicio: ¿Cuál es la configuración electrónica de las siguientes especies químicas? a) Li b) Fe2+ c) Ne d) S-2 e) Pt4+ La tabla periódica y las propiedades periodicas 11 Contenido 1.- Clasif icación de los elementos. 1.1. ¿Qué es la tabla periódica? 1.2. ¿Cómo esta ordenada la tabla periódica? 2.- Propiedades periódicas Carga nuclear ef ectiva. 2.1. Carga Nuclear ef ectiva (Z*) y reactividad 2.2. Tamaño de los átomos. Radios atómicos, iónicos y metálicos 2.3. Energía de ionización. 2.4. Af inidad electrónica. 2.5. Electronegatividad 2.6. Carácter metálico. Estructura Atómica y la Tabla Periódica Átomos y Elementos Estructura Atómica y Tabla Periódica Átomo Núcleo Tabla Periódica Electrones Protones Neutrones Número atómico Número de masa Grupos Períodos Arreglo de electrones Ley Periódica Isótopos 24 12 ¿Qué es la tabla periódica? ¿Cómo esta ordenada la tabla periódica? 13 Notación de los grupos Los números de los grupos o familias (1-18) fueron adoptados en 1984 por la IUPAC (International Union of Pure and Applied Chemistry). Los nombres de los elementos 110-118 son los equivalentes en latín de estos números. Los americanos los separan en grupos (A y B) Clasificación de los elementos Los elementos de la tabla periódica pueden clasificarse en: •Elementos representativos y elementos de transición •Grupos o Familias •Metales, semimetales o metaloides y no-metales 14 RENGLÓN = PERÍODO COLUMNA = GRUPO BLOQUES • GRUPOS TIENEN NÚMEROS Y LETRAS. • GRUPOS A SON ELEMENTOS REPRESENTATIVOS • GRUPO B SON ELEMENTOS DE TRANSICIÓN La tabla periódica actual • Hay una relación directa entre el último orbital ocupado por un e– de un átomo y su posición en la tabla periódica y, por tanto, en su reactividad química, fórmula estequiométrica de compuestos que forma... • Se clasifica en cuatro bloques: – – – – Bloque “s”: (A la izquierda de la tabla) Bloque “p”: (A la derecha de la tabla) Bloque “d”: (En el centro de la tabla) Bloque “f”: (En la parte inferior de la tabla) 15 Tipos de orbitales en la tabla periódica 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 He H s1 s2 p1 p2 p3 p4 p5 p6 Bloque “s” Bloque “d” d1 d2 d3 d4 d5 d6 d7 d8 d9 d 10 Bloque “p” Bloque “f” f 1 f 2 f 3 f 4 f 5 f 6 f 7 f 8 f 9 f 10 f 11 f 12 f13 f 14 Grupos Bloque Grupo 1 s 2 13 14 15 p 16 17 18 d 3-12 f Nombres Alcalinos Alcalino-térreos Térreos Carbonoideos Nitrogenoideos Anfígenos Halógenos Gases nobles Elementos de transición Elem. de transición Interna (lantánidos y actínidos) Config. Electrónica n s1 n s2 n s2 p1 n s2 p2 n s2 p3 n s2 p4 n s2 p5 n s2 p6 n s2 (n–1)d 1-10 n s2 (n–1)d 1 (n–2)f 1-14 16 Ejemplo: Determinar la posición que ocupará un átomo cuya configuración electrónica termine en 4f14, 5d4 y 6 s2 Propiedades periódicas de los elementos 17 Propiedades físicas – Características que pueden ser observada o medidas sin afectar la identidad de un elemento. – Las propiedades físicas de una sustancia pueden incluir: forma, color, olor, sabor, densidad, dureza, punto de fusión y punto de ebullición. Propiedades de los elementos • • • • • • • • • • • • Peso Atómico Densidad (gravedad especifica) - g /mL Temperatura de fusión (Tf) - K Temperatura de ebullición (Teb ) - K Energía de ionización (E.I.) – eV (energía) Afinidad electrónica (A.E.) - kJ (energía) Radio Atómico - pm Electronegatividad / valores Pauling o Allred-Rochow Conductividad Térmica - W cm-1 K-1 Conductividad eléctrica Estado de oxidación Común Estructura Cristalina 18 Propiedades periódicas • Tamaño del átomo – Radio atómico: • Radio covalente • Radio iónico. • Radio metálico • • • • Energía de ionización. Afinidad electrónica. Electronegatividad Carácter metálico. Efecto Pantalla El escudamiento ocurre cuando un electrón , o electrones pasan entre un electrón dado y el núcleo. En este proceso, los electrones responsables del “eclipsamiento” ocultaran parte de la carga del núcleo por lo que los electrones externos no experimentaran la carga nuclear completa.. Cuando la interferencia es máxima, se eliminara el efecto de la carga de un protón. 19 Carga nuclear efectiva (Z*) Como resultado del fenómeno de escudamiento, o apantallamiento, la carga nuclear que experimenta un electrón ubicado en las afuera de un átomo, se reduce. La carga nuclear que no se logran ocultar por este efecto es conocida como Carga nuclear efectiva (Z*). Z*=Z - Efecto pantalla Numero atómico La carga nuclear efectiva, Z*, es la cantidad de carga positiva en el núcleo percibida por un electrón. Carga nuclear efectiva (Z*) • Es la carga real que mantiene unido a un e– al núcleo. • Depende de: – Carga nuclear (Z) – Efecto pantalla (apantallamiento) () de e– interiores o repulsión electrónica. • Ambos efectos son contrapuestos: Z* Z a – A mayor Z mayor Z* . – A mayor apantallamiento menor Z* . • Así consideraremos que: 20 Reglas de Slater Calculo de la constante de pantalla () del i-esimo electrón • • • • Escriba la configuración electrónica de la especie que se trate. Una vez escrita la configuración, rescríbala en orden creciente de n y agrúpelos: – (1s)(2s2p)(3s3p)(3d)(4s4p)(4d)(4f)(5s5p)... Identifique el grupo del i-esimo electrón en estudio Obtenga como la suma de las siguientes contribuciones: – 0.0 para cada electrón a la derecha del electron en estudio. – 0.35 para cada electrón adicional en el mismo grupo que se encuentre con el iesimo electrón – Si i es un electrón s o p: • 0.85 por cada electrón en los grupos con (n-1) • 1.0 si esta en grupos (n-2) – Si i es un electrón d o f: • 1.0 por cada electrón a la izquierda del grupo al que pertenece el i-esimo electrón. Ejercicio • Calcula Z* para: – El electrón de valencia de Ni – El electrón 4s del átomo de Ni – El electrón de valencia de Al Z = 28 (Ni) 13 (Al) • Para el caso de Ni, ¿cuál electrón sale mas fácilmente, los s o los d? 21 Variación de Z* vs Z 14 12 10 Z* 8 6 4 electrón de valencia 2 0 0 5 10 15 20 25 30 35 40 Z Variación de Z* en la tabla. • Varía poco al aumentar Z en los e– de valencia de un mismo grupo – Aunque hay una mayor carga nuclear también hay un mayor apantallamiento. – Consideraremos que en la práctica cada e– de capa interior es capaz de contrarrestar el efecto de un protón. 22 Variación de Z* en la tabla. • Crece hacia la derecha en los elementos de un mismo periodo. – Debido al menor efecto pantalla de los e– de la última capa y al mayor Z. Variación de Z+ en la Tabla periódica aumenta Ejemplo: Compara el efecto pantalla de: a) Li y Na; b) Li y Be. 23 Carga nuclear efectiva y reactividad. • Z* junto con la distancia del e– al núcleo (ley de Coulomb) son las responsables de la atracción que sufre el e– y, por tanto, de la reactividad de los átomos. Aumento en la Reactividad METALES Gases nobles NO METALES Variación de la reactividad en la tabla periódica. • Los metales serán tanto más reactivos cuando pierdan los e– con mayor facilidad – Cuanto menor Z* y mayor distancia al núcleo. – El e– 4s del K es más reactivo que el 3s del Na. • Los no-metales serán más reactivos cuando los e– que entran sean más atraídos – A mayor Z* y menor distancia al núcleo. – El e– que capture el F será más atraído que el que capture el O o el Cl. 24 Radio atómico Se define como: “la mitad de la distancia de dos átomos iguales que están enlazados entre sí”. Clasificación según sea el tipo de enlace: • Radio covalente • Radio iónico • Radio metálico el radio de un mismo átomo depende del tipo de enlace que forme, e incluso del tipo de red cristalina que formen los metales. Radio atómico De manera general, el radio atómico varia de forma regular en los elementos de un mismo grupo y de un mismo periodo: 25 Radio atómico Dentro de un mismo periodo, el radio atómico disminuye conforme el numero atómico aumenta. Los radios atómicos de los elementos del segundo periodo siguen la siguiente tendencia: Li > Be > B > C > N > O > F Variación del radio atómico en un periodo • En un mismo periodo disminuye al aumentar Z (hacia la derecha) debido a que los electrones de la última capa estarán más fuertemente atraídos por el poco apantallamiento, mayor carga nuclear efectiva, de los demás electrones que lo acompañan. Periodo 2 26 Radio atómico Para los elementos de un mismo grupo, el radio atómico se incrementa como el numero atómico aumenta. Así, el radio atómico de los gases nobles muestra la siguiente tendencia: He < Ne < Ar < Kr < Rn Variación del radio atómico en un grupo. • En un grupo, el radio aumenta al aumentar el periodo, pues existen más capas internas de electrones. Grupo 1 27 ¿Cuál es la tendencia observada en los radios atómicos? Radios atómicos (pm) Variación del radio atómico vs Z 28 Propiedades Periódicas Radio Atómico R a0 n2 Z s Radio atómico: otras definiciones Radio Covalente; la mitad de la distancia en moléculas diatómicas homonucleares con enlace sencillo. Radio Van der Walls; la mitad de la distancia entre átomos no enlazados de moléculas vecinas, interacción débil (gases nobles) Radio Metálico; la mitad de la distancia entre átomos vecinos en el estado sólido metálico. Radio Iónico; 29 Radio iónico Es el radio que tiene un átomo que ha perdido o ganado electrones, adquiriendo la estructura electrónica del gas noble más cercano. •Los cationes son menores que los átomos neutros por la mayor carga nuclear efectiva (menor apantallamiento o repulsión de e). •Los aniones son mayores que los átomos neutros por la disminución de la carga nuclear efectiva (mayor apantallamiento o repulsión electrónica). Comparación de radios ionicos. 30 Radio iónico El radio de un ión positivo es menor que el del átomo neutro, el cual a su vez es mas chico que el de la especie con carga negativa (anión). Así, el tamaño de los átomos tienen el siguiente orden : S2- > Cl- > Ar > K + > Ca2+ Radio iónico En especies iso-electrónicas, tienen el mismo numero de electrones pero diferente numero de protones, los electrones son atraídos con distinta fuerza por el núcleo haciendo al ión de diferentes tamaños. 3P radios iónicos 2.0 Cl 2 Radio (A) 1.6 1.2 2 6 2 - 6 1s 2s 2p 3s 3p + Na 0.8 2 2 6 1s 2s 2p Cl 0.4 11 12 13 14 15 16 7+ 17 Z 31 Radio iónico Radio Iónico depende del numero de oxidación del ion, con tamaños grandes para iones negativos y tamaños pequeños para iones positivos. EX: radios S+6 = 0.6 Å S = 1.04 Å S-2 = 1.7 Å Comparación de radios atómicos e iónicos Iones isolectrónicos 32 Ejemplo: a) De las siguientes secuencias de iones, razone cual se corresponde con la ordenación en función de los radios iónicos: (I) Be2+ < Li+ < F- < N3-, (II) Li+ <Be2+ < N3- < F-; b) Ordene de mayor a menor los radios de los elementos de que proceden. Energía de ionización (EI) (potencial de ionización). • “Es la energía necesaria para extraer un e– de un átomo gaseoso y formar un catión”. • Es siempre positiva (proceso endotérmico). • Se habla de 1ª EI (EI 1 ), 2ª EI (EI 2 ), ... según se trate del primer, segundo, ... e– extraído. • La EI aumenta hacia arriba en los grupos y hacia la derecha en los periodos por aumentar Z * y disminuir el radio. • La EI de los gases nobles, al igual que la 2ª EI en los metales alcalinos, es enorme. 33 Esquema de variación de la Energía de ionización (EI). 1er periodo 2.5 He2do periodo 4to periodo 1er E.I. -1 E.I. (MJ mol ) 3er Ne periodo 2.0 5to periodo F Ar N 1.5 H Be 1.0 C S Mg Li Al Na 0 Se Ge Sc Si B 0.5 Kr Metales de Br transición Zn As Cl P O K 10 Ca Ga 20 30 40 Número atómico (Z) Esquema de variación de la Energía de ionización (EI). Mg Energía de ionización (V) 80 1er E.I. 2do E.I. 3er E.I. Li 70 60 Ca 50 Na Sr Zn 40 Cd K 30 Rb He Ne Cs Ag 20 Ar Kr Xe 10 Li 0 0 5 10 15 20 25 30 35 40 45 50 55 60 número atómico (Z) 34 Energía de ionización (EI) (potencial de ionización). De forma general, la EI es mayor para los elementos mas ligeros. Para los elementos del primer grupo es: Li > Na > K > Rb > Cs Así, es mas difícil removerle un electrón a Li que para Na. Energía de ionización (EI). X(g) X+(g) + e2.5 DH = EI Aumento en la Energía de ionización He 1er E.I. -1 E.I. (MJ mol ) Ne 2.0 F Ar N 1.5 H 1.0 Be C 0 Na 10 Se Ge Sc Si B Li Br Zn As S Mg 0.5 Kr Cl P O Al K Ca 20 Ga 30 40 Número atómico (Z) 35 Afinidad electrónica (AE) X(g) + e- X-(g) DH =AE • “Es la energía intercambiada cuando un átomo gaseoso captura un e– y forma un anión”. • Se suele medir por métodos indirectos. • Puede ser positiva o negativa aunque suele ser exotérmica. La 2ª AE suele ser positiva. También la 1ª de los gases nobles y metales alcalinotérreos. • Es mayor en los halógenos (crece en valor absoluto hacia la derecha del S.P. y en un mismo grupo hacia arriba por aumentar Z* y disminuir el radio). Afinidad electrónica (AE) X(g) + e- X-(g) DH =AE 1er A.E. 400 -1 A.E. (Kj mol ) 300 200 100 0 0 10 20 30 40 50 60 Z 36 Afinidad electrónica (AE) X(g) + e- X-(g) DH =AE Dado que es el inverso de la afinidad electrónica puede pensarse que es la energía de ionización, si tenemos la reacción inversa, es decir la ionización de un ión negativo, este proceso se define como el energía cero de ionización (0th EI) del átomo neutro, Cl in este caso. Cl-(g) + e- Cl-(g); (0th EI) Afinidad electrónica AFINIDADES ELECTRONICAS DE LOS ELEMENTOS REPRESENTATIVOS 300 Be Mg 200 Ca Sr A.E. (kJ/mol) 100 Ba 0 0 10 20 30 40 50 60 70 80 90 -100 -200 -300 -400 Número Atómico (Z) 37 Electronegatividad ( ) • Son conceptos opuestos (a mayor menor carácter metálico y viceversa). • mide la tendencia de un átomo a a atraer los e– hacía sí. • es un compendio entre EI y AE. • Pauling estableció una escala de electronegatividades entre 0.7 (Fr) y 4 (F). • aumenta hacia arriba en los grupos y hacia la derecha en los periodos. Electronegatividad (escala de Pauling ) 38 Aumento de en la tabla periódica F Carácter metálico Primeramente, ¿Qué es un metal? ¿Cuales son las propiedades físicas y químicas para definir que un elemento químico sea nombrado como un metal? 39 Carácter metálico • ¿Metal? • • • • • • Brillo “metálico” Conductor eléctrico Conductor térmico Dúctil (hilos o alambres) Maleable (laminas) Alta densidad Reactividad; Con el oxígeno forman óxidos básicos que al combinarse con el agua forman soluciones básicas (pH > 7) Con el hidrogeno forman hidruros (H-) Son electropositivos (Ceden e- fácilmente) Agentes reductores Carácter metálico Metálico / Reductor No Metálico / Oxidante 40 Variacion en la temperatura de fusión Tfus 82 Ejemplo: Dados los elementos A y B de números atómicos 19 y 35 respectivamente: a) Establezca la configuración electrónica de cada uno de ellos. b) Indique su situación en el sist. periódico. c)Compare tres propiedades periódicas de ambos elementos. d)Justifique el tipo de enlace que producen al unirse. 41 Ejercicio: Supuesto que se conocen los números cuánticos "n", "1" y "m", que definen el estado del último electrón que forma parte de la corteza de un elemento E. Razone si puede saberse: a) Si será oxidante o reductor; b) Si es un metal o no metal; c) Si será muy electronegativo; d) Si su volumen atómico será elevado. En conclusión • La Periódica Tabla es un resumen de las propiedades químicas de los elementos. La tabla periódica es la estrella orientadora para la exploración en el campo de la química, la física, la mineralogía y la tecnología. Niels Bohr (Tomado de Cruz, et al , ref. 4, pag.675.) 42 Bibliografía • L O S A L A M O S N A T I O N A L L A B O R A T O R Y, Operated by the University of California for the US Department of Energy, http://pearl1.lanl.gov/periodic/default.htm • • environmentalchemistry.com; información http://environmentalchemistry.com/yogi/periodic/ 43






