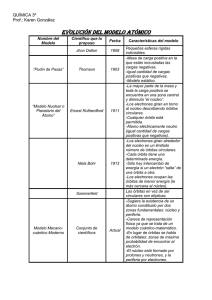
MODELO ATÓMICO DE BOHR El físico danés Niels Bohr (Premio
Anuncio

MODELO ATÓMICO DE BOHR El físico danés Niels Bohr (Premio Nóbel de Física 1922), postuló que los electrones giran a grandes velocidades alrededor del núcleo atómico. En ese caso, los electrones se disponen en diversas órbitas circulares, las cuales determinan diferentes niveles de energía. Para realizar su modelo atómico utilizó el átomo de hidrógeno. Describió el átomo de hidrógeno con un protón en el núcleo, y girando a su alrededor un electrón. En éste modelo los electrones giran en órbitas circulares alrededor del núcleo; ocupando la órbita de menor energía posible, o sea la órbita más cercana posible al núcleo. Cada órbita se corresponde con un nivel energético que recibe el nombre de número cuántico principal, se representa con la letra "n" y toma valores desde 1 hasta 7. De acuerdo al número cuántico principal calculó las distancias a las cuales se hallaba cada una de las órbitas permitidas en el átomo de hidrógeno, respecto del núcleo. Representación de las órbitas n distancia 1 0,53 Å 2 2,12 Å 3 4,76 Å 4 8,46 Å 5 13,22 Å 6 19,05 Å 7 25,93 Å Nota: Con Å se designa la unidad de longitud Ángstrom (en el sistema SI) y equivale a 1.0x10-10 metros. El electrón puede acceder a un nivel de energía superior pero para ello necesita "absorber" energía. Cuando vuelve a su nivel de energía original, el electrón necesita emitir la energía absorbida (por ejemplo en forma de radiación). Este modelo, si bien se ha perfeccionado con el tiempo, ha servido de base a la moderna física nuclear.