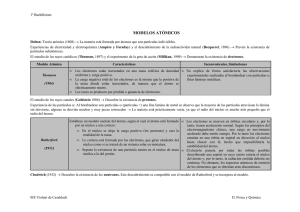
EVOLUCIÓN DEL MODELO ATÓMICO
Anuncio
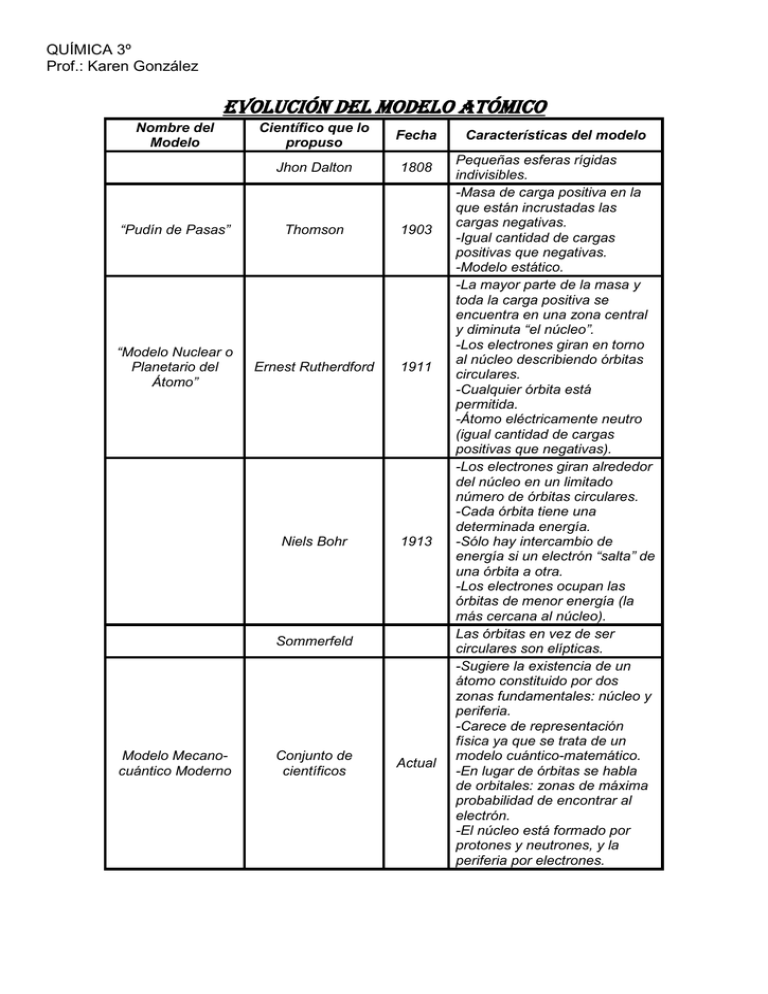
QUÍMICA 3º Prof.: Karen González EVOLUCIÓN DEL MODELO ATÓMICO Nombre del Modelo Científico que lo propuso Fecha Jhon Dalton 1808 “Pudín de Pasas” Thomson 1903 “Modelo Nuclear o Planetario del Átomo” Ernest Rutherdford 1911 Niels Bohr 1913 Sommerfeld Modelo Mecanocuántico Moderno Conjunto de científicos Actual Características del modelo Pequeñas esferas rígidas indivisibles. -Masa de carga positiva en la que están incrustadas las cargas negativas. -Igual cantidad de cargas positivas que negativas. -Modelo estático. -La mayor parte de la masa y toda la carga positiva se encuentra en una zona central y diminuta “el núcleo”. -Los electrones giran en torno al núcleo describiendo órbitas circulares. -Cualquier órbita está permitida. -Átomo eléctricamente neutro (igual cantidad de cargas positivas que negativas). -Los electrones giran alrededor del núcleo en un limitado número de órbitas circulares. -Cada órbita tiene una determinada energía. -Sólo hay intercambio de energía si un electrón “salta” de una órbita a otra. -Los electrones ocupan las órbitas de menor energía (la más cercana al núcleo). Las órbitas en vez de ser circulares son elípticas. -Sugiere la existencia de un átomo constituido por dos zonas fundamentales: núcleo y periferia. -Carece de representación física ya que se trata de un modelo cuántico-matemático. -En lugar de órbitas se habla de orbitales: zonas de máxima probabilidad de encontrar al electrón. -El núcleo está formado por protones y neutrones, y la periferia por electrones.